-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endoskopická ablatívna liečba rektosigmoideálnych prekanceróz – pilotná štúdia
Endoscopic ablative therapy of the proctosigmoideal neoplastic lesions – a pilot study
Purpose and objectives:
Endoscopic possibilities of ablative treatment with curative intention of rectosigmoid precancerous lesions characterized as flat or broad-based adenomas, multifocal lesions and lateral spreading lesions after incomplete endoscopic resection.Methods:
Out-patient based ablative treatment using argon plasma coagulation (APC), photodynamic therapy with delta aminolevulinic acid as a photosensitizer (PDT-ALA) or as a combination of both of them in patients with rectosigmoid lesions within a period of 7 years of regular post-therapeutic follow-up controls.Results:
34 patients with average age 59 years with rectosigmoid lesions (30 adenomas with various degrees of dysplasia, 4 early cancers), after fulfilling “low risk criteria” for endoscopic treatment, were treated using APC (on average 3 sessions), one-off treatment with PDT-ALA or a combination of both of them. Treatment was successful in 31 patients (92%), 3 patients (8%) underwent surgery because of persistent histological positivity in the base (2 high grade dysplasia, 1 carcinoma). We observed minor bleeding in 5 patients (8.5%) and abdominal discomfort caused by gas insufflation in 13 APC patients (48%). No serious complications were observed. Patients were followed up every 6 months for the first 2 years and later at yearly intervals.Conclusion:
Ablative treatment of these lesions using APC, PDT-ALA or a combination of both of them is an effective and safe therapeutic modality. Out-patient based treatment and the reasonable costs are additional advantages.Key words:
photochemotherapy – colorectal neoplasms – ablation techniques
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
26. 9. 2012Accepted:
7. 10. 2012
Autoři: P. Mlkvý 1; I. Čavarga 1; A. Mateášik 2
Působiště autorů: Oddelenie laserovej medicíny, Onkologický ústav sv. Alžběty, Bratislava 1; Medzinárodné laserové centrum, Bratislava 2
Vyšlo v časopise: Gastroent Hepatol 2012; 66(5): 357-363
Kategorie: Gastrointestinální onkologie: původní práce
Souhrn
Účel a ciele:
Endoskopické možnosti kuratívnej ablatívnej liečby rektosigmoideálnych prekanceróz typu plochých alebo širokobázických adenómov, multifokálnych lézií a laterálne sa šíriacich lézií po inkompletnej endoskopickej resekcii.Metódy:
Ambulantná ablatívna liečba s použitím argón plazma koagulácie (APC), fotodynamickej liečby s využitím fotosenzitizátora delta aminolevulovej kyseliny (PDT-ALA), resp. s ich kombináciou u pacientov s rektosigmoideálnymi léziami v priebehu sedem rokov s následnými pravidelnými postterapeutickými kontrolami.Výsledky:
34 pacientov s priemerným vekom 59 rokov s rektosigmoideálnymi léziami (30 adenómov s rôznymi stupňami dysplázie, 4 včasných karcinómov), spľňajúcimi tzv. nízkorizikové kritériá pre endoskopickú liečbu, bolo liečených APC (s priemerne tromi sedeniami) jednorazovou PDT-ALA, resp. s ich kombináciou. Liečba bola úspešná u 31 pacientov (92 %), 3 pacienti (8 %) boli operovaní pre histologickú pozitivitu bázy lézie (2× dysplázia ťažkého stupňa, 1× karcinóm). Drobné krvácanie po liečbe bolo pozorované u 5 pacientov (8,5 %) a abdominálny dyskomfort z nadmernej insuflácie plynu u 13 pacientov (48 %) liečených s APC. Žiadne závažné komplikácie neboli pozorované. Pacienti boli sledovaní prvé dva roky v polročných a následne jednoročných intervaloch.Záver:
Ablatívna liečba uvedených rektosigmoideálnych lézií s použitím APC, PDT s ALA, resp. ich kombinácie je efektívnou a bezpečnou metódou. Ďalšie výhody predstavujú ekonomická nenáročnosť a realizovateľnosť v ambulantných podmienkach.Kľúčové slová:
fotodynamická terápia – kolorektálna neoplázia – endoskopická abláci
Kolorektálny karcinóm s incidenciou 58/100 000 obyvateľov predstavuje najčastejšie nádorové ochorenie tráviaceho traktu a celkovo druhé (u mužov), resp. tretie (u žien), a je najčastejším nádorovým ochorením v Slovenskej republike [1]. Z celkového počtu pacientov s kolorektálnym karcinómom len cca 10–15 % predstavujú nádory v I. štádiu. Screeningové metódy či už s FOBT, pankoloskopické, irrigografické, rektosigmoideoskopické, resp. virtuálne CT koloskopické pomáhajú v odhaľovaní včasných kolorektálnych neoplázií, resp. ich prekanceróz. Vyše 90 % benígnych tumorov kolorekta predstavujú sporadické polypy, či už širokobázické alebo stopkaté. Histologicky ich delíme na polypy s neoplastickým potenciálom (adenomatózne), z ktorých približne 50 % tvoria tubulózne, 35 % tubulovilózne a 15 % vilózne [2]. Tieto nesú v sebe klasický neoplastický potenciál v zmysle známej „Adenoma Cancer Sequence“. Ďalšie polypózne lézie predstavujú hamartómy majúce len minimálny neoplastický potenciál, zatiaľ čo riziko malígneho zvrhnutia hyperplastických polypov prakticky neexistuje. Pri endoskopickej liečbe včasných kolorektálnych neoplázií rozoznávame tzv. nízko rizikové a vyššie rizikové indikačné kritériá. Tzv. nízko rizikové kritériá predstavujú lézie limitované na mukózu, so žiadnou inváziou do lymfatických uzlín, s histologickým gradingom G1, resp. G2 s makroskopicky elevovaným (I) plochoelevovaným (IIa), resp. plochým (IIb) typom, pričom veľkosť lézie by nemala presiahnuť 20 mm [5].
Naproti tomu vyššie rizikovú skupinu predstavujú lézie s inváziou do submukózy, histologickým nízko diferencovaným, resp. nediferencovaným gradingom G3, resp. G4, s makroskopicky preliačeným (IIc), resp. ulceroidným (III) typom a s veľkosťou lézie nad 30 mm [5] (tab. 1).
Tab. 1. Nízko a vysokoriziková situácia pre endoskopickú liečbu. Tab. 1. Low risk and high risk situation for endoscopic therapy. 
Pre efekt endoskopickej liečby sa za kľúčovú považuje invázia do submukózy. To znamená, že bezpečné z hľadiska endoskopickej liečby sú dysplastické lézie, tumory TiS, resp. mukózne karcinómy a tumory T1a neprerastajúce muscularis mucosae. Pri prerastaní do submukózy u tumorov T1b sa invazivita proximálnej tretiny submukózy z hľadiska endoskopickej liečby považuje ešte za bezpečnú, avšak pri invázii strednej tretiny submukózy je lymfaticko-cievna infiltrácia prítomná vo viac ako 30 % a pri invázii v distálnej tretine submukózy dokonca až v 50 %. Bez submukóznej (Sm) subklasifikácie sa za bezpečnú považuje hľbka invazivity tumoru bez rizika postihnutia lymfatickej drenáže do 1 250 µm [6]. Tumory T2 s postihnutím muscularis propria sú jednoznačne indikované pre chirurgický zákrok. V súčasnosti máme k dispozícii pomerne široké spektrum endoskopických terapeutických techník na liečbu včasných kolorektálnych neoplázií, resp ich prekanceróz. V zásade rozlišujeme endoskopické metódy na termálne, nontermálne chemické a kombinované ablačné technicky [3] (tab. 2).
Tab. 2. Možnosti endoskopickej liečby včasných kolorektálnych tumorov. Tab. 2. Possibilities of endoscopic therapy of early colorectal tumours. 
Z uvedenej širokej ponuky techník sme vzhľadom na možnosť ambulantnej liečby a pomernú technickú jednoduchosť rozhodli u pacientov s indikovanými rektosigmoideálnymi léziami (tab. 3) pre ablatívne terapeutické metódy: argón plazma koaguláciu a fotodynamickú liečbu.
Tab. 3. Indikácie ablatívnej liečby prekanceróznych lézií tráviacej trubice. Tab. 3. Indications for ablative treatment of precancerous gastrointestinal lesions. 
Ciele
Cieľom našej práce bolo preskúmať ablatívnu liečebnú efektivitu s léziami rektosigmy:
1. U pacientov s plochými, širokobázickými a multifokálnymi prekanceróznymi léziami, ako aj u pacientov s reziduálnymi (postresekčnými) léziami rektosigmy.
2. Porovnanie efektivity metodík APC, ako aj PDT-ALA, prípadne ich kombinácie, ako aj ich komplikácií a nežiaducich účinkov.
3. Zistiť nutnosť krátkodobej hospitalizácie, resp. možnosť ambulantnej liečby.
4. Sledovanie efektivity v dlhodobejšom horizonte (> 2 roky).
Pacienti a metódy
V priebehu siedmych rokov (2005–2012) bolo v Onkologickom ústave sv. Alžbety ablatívnymi metódami liečených celkovo 57 pacientov s diagnózou prekanceróz a včasných karcinómov tráviacej trubice. Lézie boli najčastejšie lokalizované v oblasti rektosigmy (34 pacientov), pričom ďalšie lokality predstavovali lézie v pažeráku (11 pacientov), v žalúdku (7) a v dvanástorníku (5) s priemerným vekom 59 rokov (29–82 rokov). Lézie predstavovali ploché, širokobázické, ako aj multifokálne adenómy, ako aj reziduálne lézie po inkompletnej endoskopickej resekcii charakteru laterálne sa šíriacich lézií. Lokalizované boli prevažne v rekte (24 pacientov), menej často v sigme (12 pacientov). Histologicky sa jednalo o 30 adenómov (15 tubulárnych, 4 tubulovilóznych, 11 vilóznych), s prítomnými dysplastickými zmenami (18 pacientov s dyspláziami ľahkého a 12 s dyspláziami ťažkého stupňa). Štyria pacienti mali diagnostikovaný karcinóm hodnotený ako včasný bez známok invazivity, čo potvrdil aj staging s MRI vyšetrením malej panvy (obr. 1). Všetci pacienti spľňali nízko rizikové kritériá (limitácia lézie na mukózu, elevované a ploché typy lézií s dobrou histologickou diferenciáciou, pričom ich veľkosť nepresahovala 25 mm).
Obr. 1. MRI – Endorektálny predterapeutický staging. Fig. 1. MRI – endorectal pretherapeutic staging. 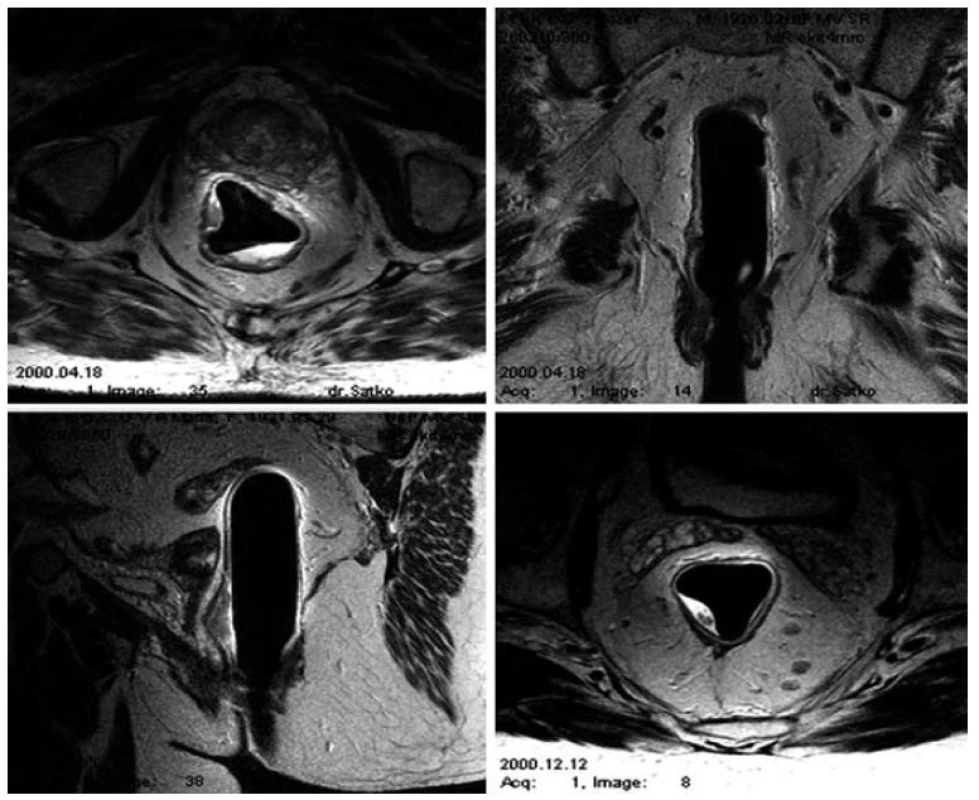
Argón plazma koagulácia (APC) je bezkontaktnou endoskopickou metódou, pri ktorej sa pomocou monopolárnej wolfrámovej elektródy ionizuje argónový plyn, ktorý s cieľovým biologickým tkanivom vytvára argón plazmový oblúk (tzv. argón jet), pričom na cieľovom tkanive pozorujeme okamžitú koaguláciu, exsikáciu, resp. deštrukciu. Pre svoju menšiu hľbku penetrácie (do 3 mm) je bezpečnejší na liečbu menších lézií ako termický laser, na druhej strane treba počítať s 2–4 sedeniami. Argón plazma koagulačnou metódou (s použitím energie 50–70 W, chladením 2 L/min) sme liečili (v 1–6 sedeniach, t. j. priemerne 3 sedenia na pacienta) 23 pacientov. Fotodynamická liečba (PDT) je založená na princípe cytotoxickej reakcie v neoplastických bunkách pôsobením atomárneho kyslíka, ktorý vzniká ožiarením svetlom príslušnej vlnovej dľžky po prechádzajúcom podaní (i. v., resp. perorálnom) fotosenzitizujúcej látky. Laserové červené svetlo, ktorým sa tumor ožiari, sa prenáša špeciálnym aplikátorom cez biologický kanál koloskopu, pričom sa používajú rôzne koncové aplikátory (bodové, difúzne, balónikové...). Fotodynamickú liečbu (s použitím prístroja LPht 630/675-01-Biospec//JSP Biospec) predchádzala fotosenzitizácia pacienta s použitím perorálneho fotosenzitizátora deltaaminolevulovej kyseliny (ALA) vo forme prášku, ktorý sme rozpustili v pomarančovej šťave v dávke 60 mg/kg váhy. U 4 pacientov sme tesne pred začatím terapie vykonali fluorescenčné štúdie na potvrdenie prítomnosti koncentrácie fotosenzitizátora (obr. 2). Následná PDT bola realizovaná 6 hod od fotosenzitizácie s použitím dávky 300–400 mW á 2 min na jednotlivé lokality pri celkovej dávke 3 000–4 000 J pri vlnovej dľžke 632 nm s kontaktnou metódou použitím nekrytého vlákna. Lézie sme liečili vo viacerých (spravidla v 3–4) lokalitách PDT s ALA sme liečili 7 pacientov. Kombináciu obidvoch modalít pacientov (APC predstavovalo prvú modalitu) sme aplikovali u 5 pacientov.
Obr. 2. Fluorescenčná štúdia s použitím fotosenzitizátora ALA – tubulárny adenóm rekta s LGD. Fig. 2. Fluorescence study with photosensitizer ALA – tubular rectal adenoma with LGD. 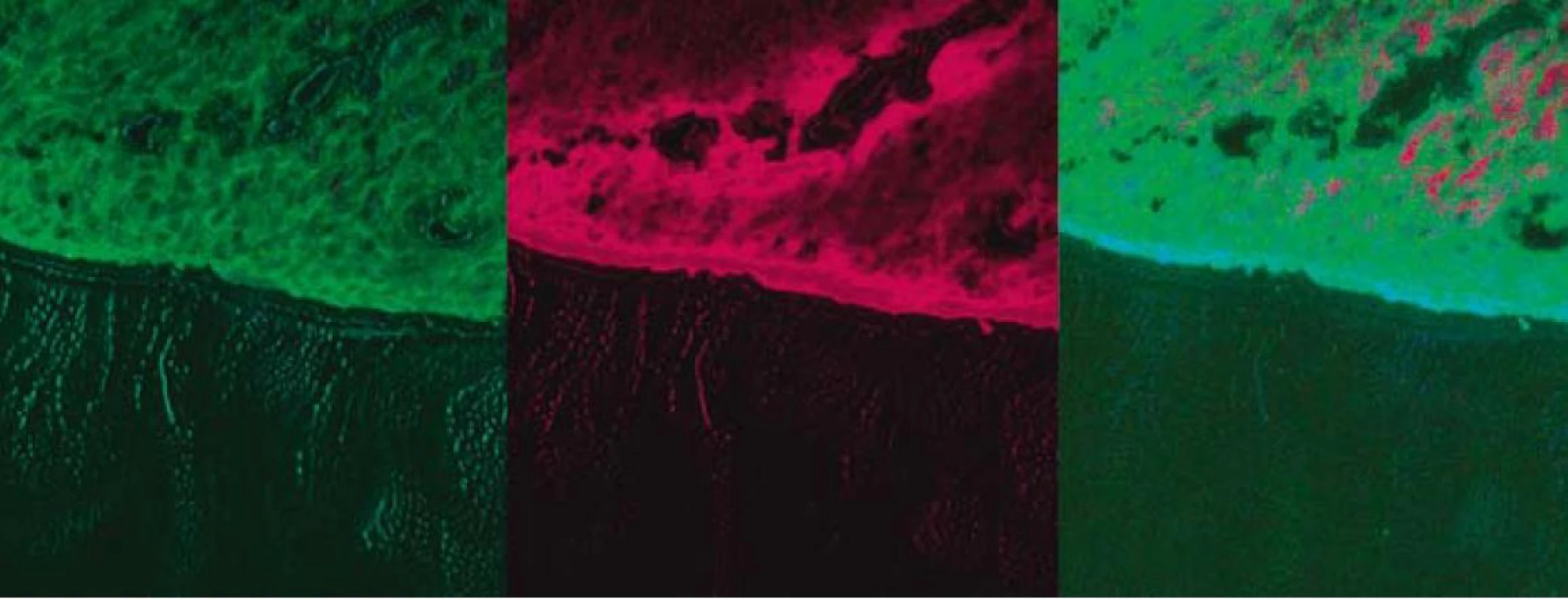
Výsledky
Pred začatím liečby splnili tzv. nízko rizikové kritériá (plošný, resp. plochopolypoidný typ lézie, dobrá, resp. stredná diferenciácia, hraničná veľkosť do 35 mm, histológia bez zn. invazivity). Vzhľadom na hľbku penetrácie APC a PDT-ALA sme pacientov rozdelili do dvoch skupín podľa typu liečby a pri histologických multifokálnych léziách charakteru laterálne sa šíriacej lézie sme použili kombináciu liečby, kedy PDT-ALA nasledovala po APC liečbe (tab. 5).
Tab. 4. Lokalizácia, charakter a histológia pacientov s rektosigmoideálnymi léziami. Tab. 4. Localisation, characteristics and histology of patients with rectosigmoid lesions. 
Tab. 5. Rektosigmoideálne lézie: APC, PDT-ALA, resp. ich kombinácia. Tab. 5. Rectosigmoid lesions: APC, PDT-ALA, or a combination of both. 
Kompletná ablácia sa pozorovala u 29 z 34 pacientov, čo predstavuje 92 % (obr. 3–5). U pacientov liečených s PDT-ALA sme pozorovali kompletnú odpoveď po jednom sedení, zatiaľ čo z 23 pacientov liečených s APC bola opakovaná liečba potrebná u 17 pacientov s maximálne 6 sedeniami. Opakovaná liečba, a to v kombinácii s PDT-ALA, sa vykonala u 4 pacientov s dôvodu mikroskopickej histologickej pozitivity (v zmysle dysplázie) okraja lézie, ktorá mala charakter laterálne sa šíriacej lézie. U troch pacientov pri kontrolnej rektosigmoideoskopii v báze sa histologicky v báze pôvodnej (po terapii už preliačenej) lézie potvrdila perzistencia dysplázie ťažkého stupňa (2 pacienti), resp. karcinóm. Všetci pacienti sa podrobili elektívnemu chirurgickému zákroku. Závažné komplikácie ani perforácie sme v uvedenom súbore pacientov nepozorovali. Drobné krvácanie, ktoré netrvalo dlhšie ako 3 min, so spontánnym zastavením sa pozorovalo u dvoch pacientov (5 %) po APC liečbe (tab. 6).
Obr. 3. APC liečba širokobázického adenómu rekta s ťažkou dyspláziou 2 sedenia, kontrola po 2 mesiacoch. Fig. 3. APC therapy of broad-based rectal adenoma with high grade dysplasia 2 sessions, check-up after 2 months. 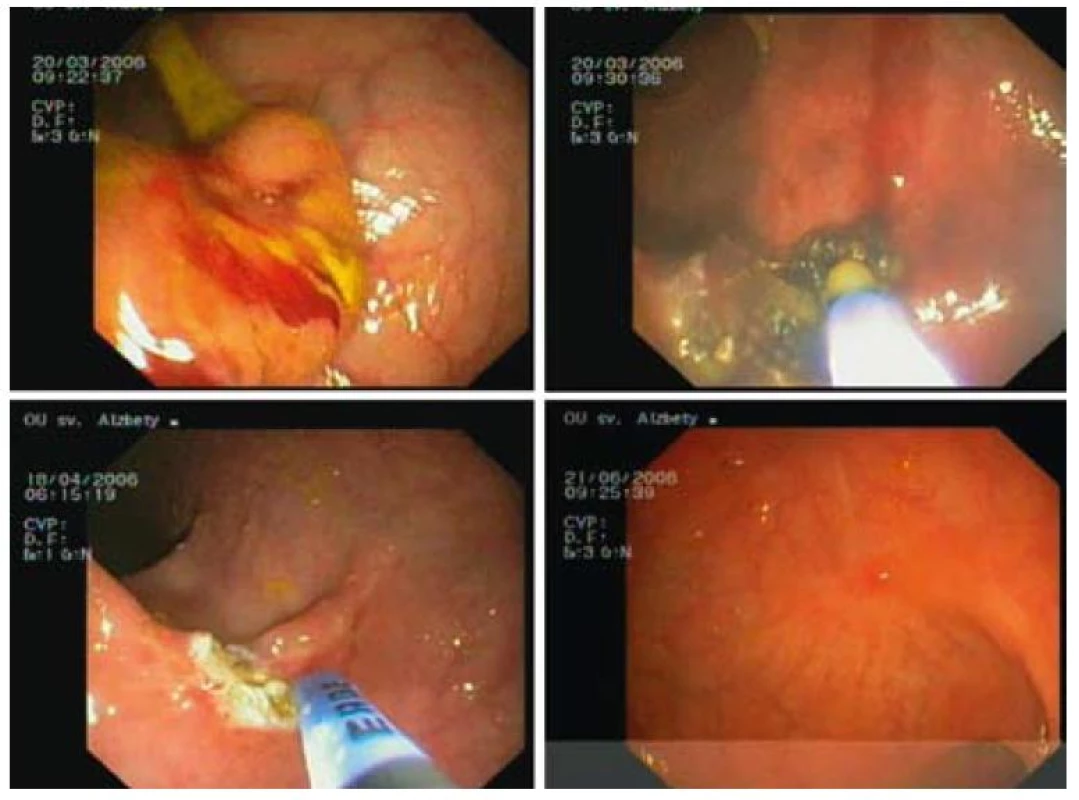
Obr. 4. Stav po inkompletnej polypektómii vilózneho adenómu rekta s ťažkou dyspláziou PDT-ALA, kontrola po 1 týždni, kontrola po 1 roku. Fig. 4. Status after incomplete polypectomy of villous rectal adenoma with high grade dysplasia, PDT-ALA, check-up after 1 week, check-up after 1 year. 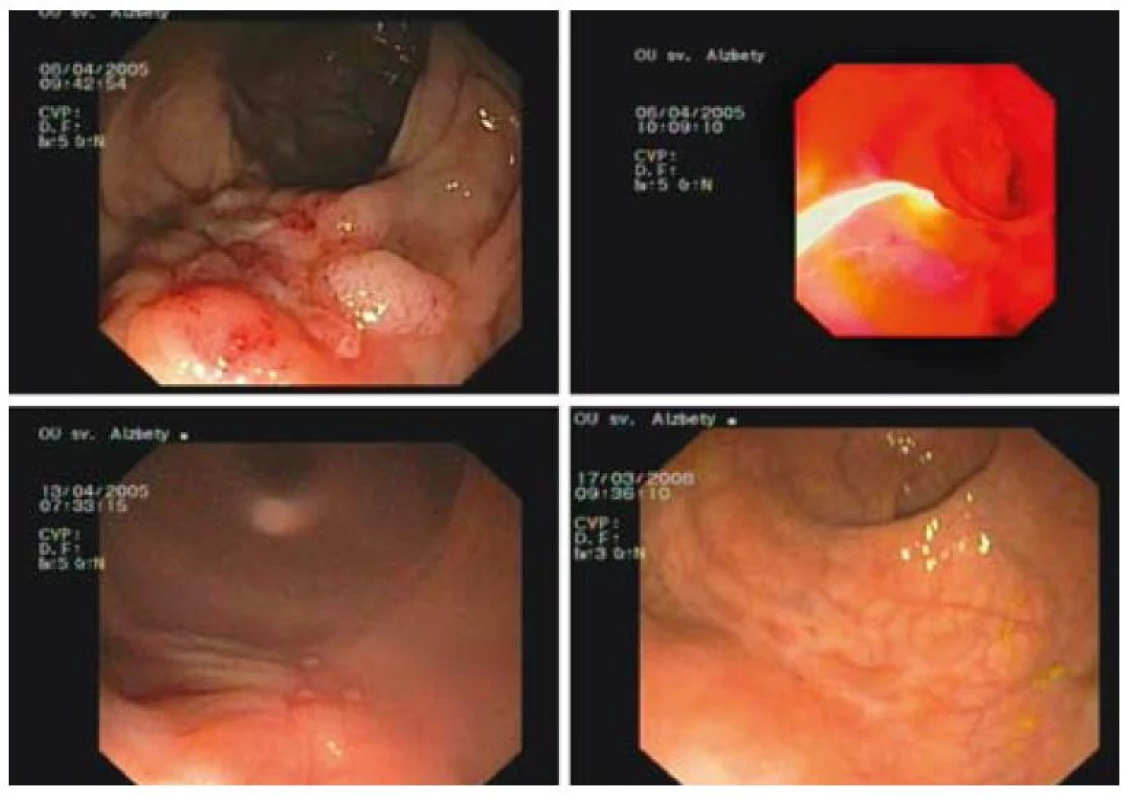
Obr. 5. Širokobázický tubulovilózny adenóm rekta s ťažkou dyspláziou. Kombinácia APC a PDT-ALA, kontrola po 1 mesiaci. Fig. 5. Broad-based tubulovillous rectal adenoma with high grade dysplasia. Combination of APC, PDT-ALA, check-up after 1 month. 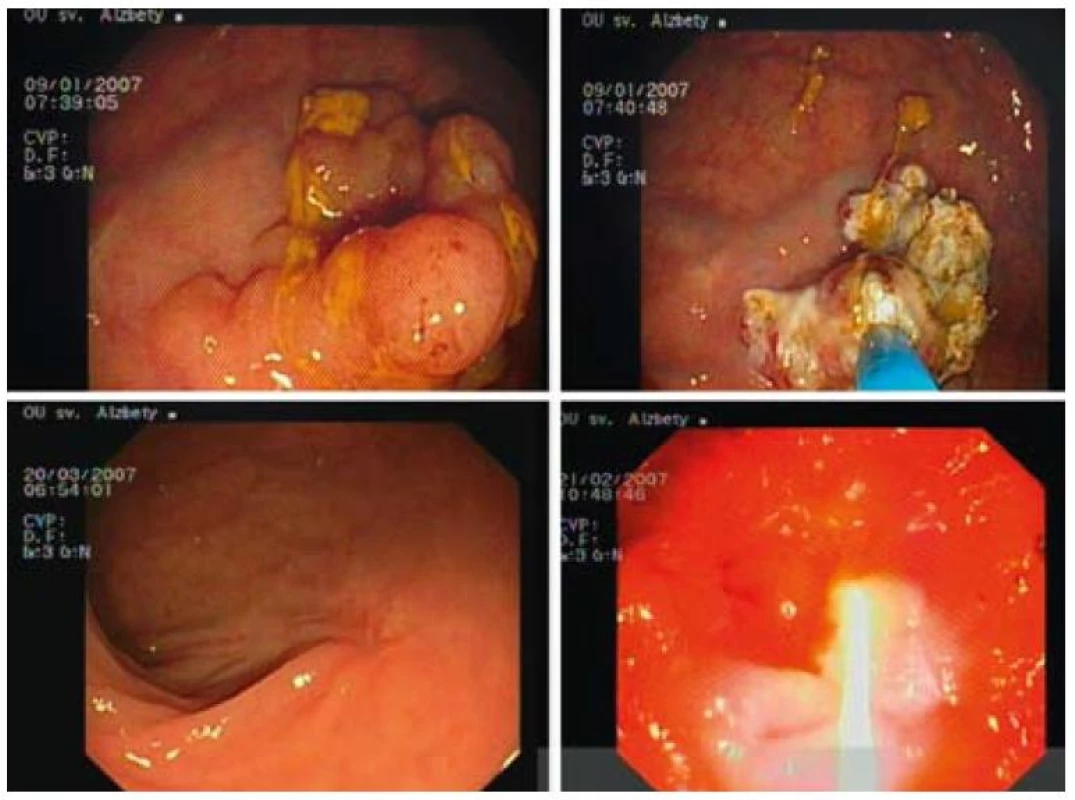
Tab. 6. Výsledky ablatívnej liečby súboru pacientov s rektosigmoideálnymi adenómami. Tab. 6. Results of ablative treatment of patients with rectosigmoid adenomas. 
Z vedľajších účinkov u pacientov s ALA-PDT liečbou sa pozorovala kožná hypersenzitivita na tvári pretrvávajúca dva dni po fotosenzitizácii, u troch pacientov nastala bezprostredne po fotosenzitizácii nauzea, u jedného pacienta opakované hnačkovité stolice. U pacientov liečených s APC sa v priebehu liečby u 12 (48 %) vyskytli bolesti abdomenu spôsobené nadmernou insufláciou plynu, ktoré sa ešte v priebehu liečby podarilo zvládnuť opakovaným prechodným prerušením liečby a koloskopickým odsávaním plynu. Všetky vedľajšie nežiaduce účinky sa podarilo zvládnuť ambulantne bez potreby aj krátkodobej hospitalizácie.
Diskusia
Z množstva retrospektívnych štúdií kolorektálnych adenómov štúdia v Leeds analyzujúca adenómy podľa tvaru zistila najväčší malígny potenciál (od nízkeho stupňa dysplázie až po karcinóm) v polypóznych léziách – v 63 %, nižší v plochých léziách – v 34 % a najnižší v ulceroidných léziách – v 3 %. Najvyššie percento včasných karcinómov u týchto polypov sa našlo v polypoch nad 10 mm veľkosti, a to v plochých – 24 % a v polypoidných v 16 %. Výrazné riziko malignizácie predstavovali ulceroidné lézie, v ktorých sa, hoci pri nízkom výskyte (celkovo 7 pacientov), včasný karcinóm diagnostikoval u piatich, čo predstavuje 71 % [3]. Ďalšie polypózne lézie predstavujú hamartómy majúce len minimálny neoplastický potenciál, zatiaľ čo riziko malígneho zvrhnutia hyperplastických polypov prakticky neexistuje. Naproti tomu riziko zvrhnutia mnohopočetných polypóz pri autozomálne dedičných ochoreniach je vysoké – pri familiárnej adenomatóznej polypóze (FAP) – až 100 %, pri hereditárnom nonpolypóznym kolorektálnom karcinomatóznom syndróme 80 %, juvenilnej polyposis coli 20–60 % a pri Peutz-Jeghersovom syndróme 40 %. Ďalšiu skupinu prekanceróz predstavujú chronické viac rokov trvajúce zápalové ochorenia ako ulcerózna kolitída, resp. Crohnova choroba s tvorbou pseudopolypov, ktoré z pôvodne zápalového charakteru môžu vykazovať aj ťažké dysplastické zmeny, ktoré jednoznačne predstavujú zvýšené riziko vzniku karcinómu [4].
Fotodynamická liečba lézií tráviacej trubice má t. č. skúsenosti s tromi fotosenzitizujúcimi látkami predstavujúcimi analógy porfyrínov (predovšetkým hematoporpyrin – Fotofrin), intermediárne produkty metabolizmu hemu (deltaaminolevulová kyselina – ALA), ako aj vysoko intenzívne účinkujúce chloríny (predovšetkým metatetrahydroxyphenylchlorín – mTHPc – Foscan), ktoré majú svoj najvyšší „peak“ v červenom spektre (vlnové dľžky 630, resp. 650 nm). Po i. v. podaní (Fotofrin a Foscan) dochádza k maximálnej koncentrácii senzitizujúcej látky po 2, resp. 4 dňoch, zatiaľ čo ALA sa podáva perorálne (60 mg/kg váhy rozpustenej vo vode, resp. džúse), maximálna koncentrácia je prítomná už po 5 hod [14]. Laserové červené svetlo, ktorým sa tumor ožiari, sa prenáša špeciálnym aplikátorom cez biologický kanál koloskopu, pričom sa používajú rôzne koncové aplikátory (bodové, difúzne, balónikové...). PDT je non-termálna metóda, pričom sa používa výkon od 100–200 mW, pričom celková dávka sa pohybuje v rozmedzí 450–500 J. Fotofrin má hlbšiu penetráciu (až do 5 mm), avšak jeho nevýhodou je riziko kožnej fotosenzitivity (do 1 mesiaca), vysoká cena (do 1 000 eur na jedného pacienta), ako aj nemožnosť opakovania liečby. Na druhej strane ALA – Levulan – má síce len povrchový efekt (do 2 mm), avšak jej výhody predstavuje relatívne nízka cena (cca 150 eur na pacienta) krátkodobá kožná fotosenzitivita (do dvoch dní) a možnosť opakovania liečby. Vysoko účinný mTHPc – Foscan pre svoje vedľajšie silné účinky predbežne stratil schválenie FDA a v súčasnosti sa používa s pomerne vysokou úspešnosťou v paliatívnej indikácii nádorov hlavy a krku [15].
Možnosti klasickej endoskopickej polypektómie teda predstavuje endoskopická polypektómia, či už vykonaná en bloc, resp. piece meal technikou (t. j. odstraňovaním polypu po častiach pri väčších, resp. širokobázických léziách) [7].
Endoskopická mukozálna resekcia (EMR) typu, tzv. lift and cut s predchádzajúcou submukóznou injektážou (najčastejšie fyziologický roztok, prípadne v kombinácii s ďalšou látkou), je najčastejšie používanou metódou ER. Technika výkonu spočíva v injekčnom podaní roztoku do submukózneho tkaniva, čo umožní separáciu lézie od muscularis propria [8]. Pri EMR technike sa preferujú lézie s veľkosťou do 20 mm ohraničené na sliznicu a nepresahujúce 1/3 obvodu lumenu rektosigmy. Samozrejme k tomu treba prirátať všetky tzv. low risk kritériá.
Medzi termálne metódy patria bipolárna elektrokoagulácia a tzv. heat probe koagulácia, zatiaľ čo k monopolárnym termálnym metódam patrí tzv. hot forceps biopsia a nonkontaktná argón plazma koagulácia. Najčastejšie používané termálne metódy sú argón plazma koagulácia (APC) a bipolárna koagulácia [7].
Nd YAG laserová liečba sa v súčasnosti využíva už len zriedkavo. Pomocou špeciálneho svetlovodu sa na malígnu léziu aplikuje laserové svetlo (vo zvyčajných dávkach od 50–80 W), ktoré v závislosti od výkonu spôsobuje jeho koaguláciu, zuhoľnatenie až odparenie. Pri správnej indikácii je laserová liečba účinná (74–87 %). Komplikácie predstavuje krvácanie, zvyčajne menšieho rozsahu, (3,5–4,5 %) a zriedkavo perforácia (0,6–1,2 %). Nevýhodou laserovej liečby je vysoká cena prístroja a technicky náročná prevádzka [11].
Endoskopická liečba prináša so sebou aj riziká, pričom hlavným rizikom endoskopickej liečby je hlavne postterapeutické krvácanie prítomné od 0,6–14,8 %, riešené zvyčajne endoskopicky buď argón plazma koaguláciou (APC), resp. naložením endoklipov. Ďalšia komplikácia – perforácia popisovaná od 0,4–4,6 % sa môže riešiť takisto endoskopickým naložením klipov, resp. chirurgicky [2].
Analogické výsledky s APC boli pozorované v prospektívnych pilotných štúdiách (Zlatanič 1999, Brooker 2002, Regula 2003 a Boix 2007). Ich súbory liečených širokobázických kolorektálnych adenómov sa pohybovali od 22–71 pacientov, s veľkosťou lézií od 1,5–4,0 cm. Úspešnosť liečby popisovali od 54–91 % pri dľžke sledovania od 6–37 mesiacov. Komplikácie v zmysle krvácania popisovali od 3,8–13,5 % a perforácie od 1,2–3,5 % [17].
Endoskopická mukozálna resekcia, resp. piece meal polypektómia, je metódou voľby pri vizualizovanej unifokálnej elevovanej lézii. Termálne ablačné techniky sú indikované pri plošných léziách a v adjunkcii k EMR. Fotodynamická liečba s ALA senzitizáciou je účinná pri multifokálnych léziách a tiež v kombináciách s EMR, resp. s termálnymi ablačnými technikami. Následné endobioptické kontroly sa odporúčajú prvé dva roky po liečbe v šesťmesačných a následné tri roky v jednoročných intervaloch. Súčasne sa odporúča vyšetrenie endorektálnou sonografiou, resp. MRI na oblasť malej panvy a samozrejme aj vyšetrenie onkomarkerov, ktoré by sa mali vykonávať prvé tri roky 1× ročne. V našom súbore sa v uvedenej dľžke sledovania (od 6 mesiacov do 7 rokov) v skupine 29 úspešne liečených pacientov nepozorovala zbytková reziduálna lézia. V súčasnosti sa kombinácia viacerých hore uvedených endoskopických metodík zvolených podľa charakteru lézie považuje za najefektívnejšiu v liečbe prekanceróz, resp. včasných kolorektálnych neoplázií. Na základe výsledkov našej pilotnej štúdie môžeme konštatovať, že liečba uvedených rektosigmoideálnych lézií je možná či už s APC alebo s ALA-PDT, ktoré sú efektívnymi a bezpečnými terapeutickými modalitami, sú pomerne finančne nenáročné a môžu sa vykonávať ambulantne [16].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 9. 2012
Přijato: 7. 10. 2012
prof. MUDr. Peter Mľkvý, CSc
Oddelenie laserovej medicíny
Onkologický ústav sv.Alžbety
Heydukova 10, 812 50 Bratislava
pmlkvy@ousa.sk
Zdroje
1. Pleško I, Obšitníková A. Incidencia zhubných nádorov v Slovenskej republike v r. 1999. Národný onkologický register 2002; 37.
2. Piedbois P, Buyse M. Recent meta-analysis in colorectal cancer. Curr Opin Oncol 2000; 12(4): 362–367.
3. Skibber JM, Minsky PM et al. Cancer of the Colon . In Cancer: Principle and Practice in Oncology. London: Lippincot, Williams, N.Z 2000 : 1216–1270.
4. Tamura I. Digestive Endoscopy 2003; 15: 39–43.
5. Deinlein P, Reulbach U, Stolte M et al. Risk factors for lymphatic metastasis from pT1 colorectal adenocarcinoma. Pathologe 2003; 24(5): 397–399.
6. Dancygier H, Lightdale C. Endosonography in gastroenterology. Stuttgart: Thieme 1998 : 248–251.
7. Díťe P, Špičák J et al. Nové trendy v digestívní endoskopické diagnostice a léčbe. Praha: Grada Publishing 2000 : 283–287.
8. Rembacken BJ, Gotoda T, Fuji T et al. Endoscopic mucosal resection. Endoscopy 2003; 33 : 709–718.
9. Sakai P, Maluf Filho F, Iryia K et al. An endoscopic technique for resection of small gastrointestinal carcinomas. Gastrointest Endosc 1996; 44(1): 65–68.
10. Feltoza AB, Gostout CJ, Burgart LJ et al. Hydroxypropylmethylcellulose: A better submucosal cushion for endoscopic mucosal resection. Gastrointest Endosc 2003; 57(1): 41–47.
11. Mľkvý P, Makovník P, Májek J et al. Laserová a fotodynamická liečba kolorektálneho karcinómu. Abstrakt III, VDOG 2002.
12. Farrin G, Grund KE. Technology of argon plasma coagulation with particular regard to endoscopic applications. Endoscop Surg Allied Technol 1994; 2(1): 71–77.
13. Ginsberg GG, Barkun AN, Bosco JJ et al. The argon plasma coagulation: technology status evaluation report. Gastrointest Endosc 2002; 55(7): 807–810.
14. Bown SG, Lovat JB. The biology of photodynamic therapy in the gastrointestinal tract. Gastrointest Endosc Clin N Am 2000; 10(3): 533–550.
15. Mľkvý P, Messmann H, Regula J et al. Photodynamic therapy for gastrointestinal tumours using three sensitisers: ALA induced PPI, Photofrin and mTHPc – A Pilot Study. Neoplasma 1998; 45(3): 157–161.
16. Schollmerich JW, Schmiegel H. Leitfaden kolorektales Karzinoms. Bremen-London-Boston: Uni med 2000; 147–167.
17. Switzer Taylor V, Schlup M, Lubcke R et al. Barrett's esophagus: a retrospective analysis of 13 years surveillance. J Gastroent Hepatol 2008; 23(9): 1362–1367.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie – realita blízké budoucnosti?
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Zamyšlení nad finančními aspekty péče o nemocné s kolorektálním karcinomem
- Národní program screeningu kolorektálního karcinomu v České republice – minulost, přítomnost a budoucnost
- Karcinom pankreatu
- Endoskopická ablatívna liečba rektosigmoideálnych prekanceróz – pilotná štúdia
- Karcinom jícnu a rizikové faktory podle histologických typů
- Diagnostika a liečba celiakie: dnes a zajtra
- Nealkoholická steatohepatitida (NASH) – týká se nás všech
- Nález v podkoží v periumbilikální krajině by neměl být přehlédnut
- Endoskopie u nemocných s antikoagulační a antiagregační terapií
- Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty
- Diskuzní fórum
- Komentář ke třídění funkčních dyspepsií podle kritérií „ROME I, II, III“
- Diagnóza nízkého stupně dysplazie u pacientů s Barrettovým jícen – pravděpodobně „overdiagnosed“
- Komentář k domácím publikacím o neoplaziích v Barrettově jícnu
- Odpověď na komentář prof. Špičáka
- Jak zlepšit screening kolorektálního karcinomu?
- Správná odpověď na kvíz
- XXI. jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Prague Hepatology Meeting 2012
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Budenofalk 2 mg rektální pěna představuje významné rozšíření našich terapeutických možností u nemocných s ulcerózní kolitidou
- Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce
- Karcinom pankreatu
- Prof. MUDr. Aleš Hep, CSc., šedesátiletý
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



