-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Karcinom ledviny v éře nastupujících robotických technologií
Renal cell carcinoma in the coming era of robotic technology
Renal cell carcinoma is the most malignant urological tumour and the incidence in the Czech Republic is currently highest in the world. Kidney cancer is associated with seven different genes and is characterized nowadays as metabolic disease. Authors present some current facts about advances in diagnosis and new treatmen methods. Different findings required individual approach. Diagnosis improved with more sophisticated ultrasonography, computed tomography, magnetic resonance imaging and positron emission tomography etc. Apart from standard surgery new alternative methods of minimally invasive procedures also assert (laparoscopy, robotic surgery, radiofrequency ablation, kryoablation) and are incorporated in current complex treatment strategies. Systemic therapy with new targeted antiangiogenics drugs is a new standard of treatment for metastatic kidney cancer. Complex care with integration of local treatment (surgery, radiotherapy, selective embolization, radiosurgery, cementoplasty, vetrebroplasty etc.) and systemic medication with best supportive care is optimal for a metastatic kidney cancer. More accurate diagnostic methods and complex interdisciplinary approach with integration of systemic therapy with new targeted drugs and new minimally invasive procedures represent new possibilities for patients with kidney cancer.
Key words:
kidney cancer, laparoscopy, robotic surgery, vertebroplasty, cementoplasty, selective embolization, metastasectomy, radiofrequency ablation, targeted therapy.
Autoři: Ivan Kolombo 1; Jiří Poněšický 1; Michal Toběrný 1; Radko Kříž 2; Iva Zemanová 3; Jiří Weichet 2; Josef Vymazal 2; Stanislav Černohorský 1; Milan Bartůněk 1
Působiště autorů: Centrum robotické chirurgie a urologie Nemocnice Na Homolce, Praha 1; Radiodiagnostické oddělení Nemocnice Na Homolce, Praha 2; Patologicko-anatomické oddělení Nemocnice Na Homolce, Praha 3
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 215-222
Kategorie: Přehledový článek
Souhrn
Karcinom ledviny je nejmalignějším tumorem v uroonkologii a Česká republika má nejvyšší výskyt na světě. Nově jej vnímáme jako metabolické onemocnění spojené se sedmi odlišnými geny. Zlepšení diagnostiky a nové léčebné metody umožňují větší individualizaci péče. Článek seznamuje s novými možnostmi a trendy. Značná heterogenita nálezů vyžaduje individuální přístup. Diagnostika je umožněna ultrasonografií a výpočetní tomografií, ale také magnetickou rezonancí či novými hybridními metodami využívajícími pozitronovou emisní tomografii. Kromě konvenční chirurgie se stále více uplatňují miniinvazivní postupy typu laparoskopie, robotické chirurgie, radiofrekveční ablace, kryoablace a další. Při generalizaci je novým standardem cílená biologická léčba, kterou dle potřeby kombinujeme s lokální léčbou (resekce metastáz, radioterapie, selektivní embolizace, radiochirurgie, cementoplastika, vertebroplastika). Přesnější metody diagnostiky spolu s komplexně vedenou léčbou, integrující konveční postupy a nové miniinvazivní postupy s cílenou biologickou léčbou umožňují individualizovat a zkvalitnit léčbu karcinomu ledviny.
Klíčová slova:
karcinom ledviny, laparoskopie, robotická chirurgie, vertebroplastika, cementoplastika, selektivní embolizace, radiofrekvenční ablace, biologická léčba.ÚVOD
Karcinom ledviny (renal cell carcinoma – RCC) je nejmalignějším urologickým nádorem a Česká republika má největší výskyt RCC na světě (1, 2). Incidence v České republice trvale narůstá. Celosvětově je diagnostikováno více než 200 000 nových případů RCC a přibližně 100 000 nemocných každý rok na toto onemocnění zemře. Největší incidence je hlášena z vyspělých zemí (Severní Amerika, Evropa a Austrálie) (3–5). V zemích Evropské unie je ročně diagnostikováno více než 40 000 nových případů RCC. Maximum jeho výskytu je okolo 60 a 70 let věku, postihuje však bohužel i mladé (6, 7), jinak zdravé pacienty.
Generalizace se v době diagnózy vyskytuje až u jedné třetiny pacientů a u více než u poloviny nemocných s původně lokalizovaným onemocněním dojde v dalším průběhu k progresi. RCC má letalitu přes 40 % (8, 9).
V současnosti je na RCC pohlíženo jako na onemocnění, kde genetické faktory sehrávají klíčovou roli při jeho vzniku a rozvoji (10). Bylo již popsáno několik forem hereditárně vázaného RCC a v současnosti je již známo přinejmenším sedm odlišných genů, které mají spojitost s RCC (11). Jedná se o následující geny: tumor supresorový von Hippel-Lindauův gen (VHL gen), MET gen – protoonkogen, tumor supresorový BHD gen (Birtův-Hoggův-Dubeho syndrom) označovaný také jako FLCN (jedná se o gen kódující protein folliculin), tumor supresorový FH (fumaráthydratázy) gen, tumor supresorový SDH (sukcinátdehydrogenázy) gen a tumor supresorové TSC1 a TSC2 geny komplexu tuberózní sklerózy (TSC – Tuberous Sclerosis Complex známé také jako morbus Bourneville). Každý z těchto genů je spojen s jistými odlišnostmi u RCC, které se projevují v rozdílné histologii, jiném klinickém průběhu a také rozdílné odpovědi na léčbu. Nicméně patofyziologické uplatnění těchto genů má obdobný společný vliv ve smyslu ovlivnění základních metabolických procesů v buňkách a tkáních a nově je na RCC pohlíženo jako na metabolické onemocnění (11). Většina případů je řazena mezi sporadické RCC. Při delším sledování však lze až u 85 % pacientů nalézt příbuzné, u kterých byl také diagnostikován RCC (10). Proto je diskutována také problematika familiárního RCC (12), kdy však tento není dosud přesně stanovenou jednotku.
VYŠETŘOVACÍ METODY A MOŽNOSTI LÉČBY
Přesná příčina vzniku RCC není úplně známa. V současnosti jsou velké naděje vkládány do nových poznatků a lepšího pochopení molekulární patofyziologie rozvoje RCC, čehož se využívá pro následnou cílenou biologickou léčbu pokročilých případů. Mutace a následná abnormální funkce tumor-supresorového von Hippelova-Lindauova genu (VHL) má za následek absenci VHL genového produktu (pVHL) v buňkách, což vede ke zvýšení tvorby HIF faktoru (hypoxic-inducible factor – hypoxií indukovaný faktor). Další molekulární konsekvencí těchto změn je především nadměrná produkce VEGF faktoru (vascular endothelial growth factor – vaskulární endotelový růstový faktor), což je významný mediátor angiogeneze a k aktivaci řady dalších signálních cest (13). VEGF je zřejmě nejdůležitějším růstovým faktorem nádorové angiogeneze u RCC, což ovlivňují preparáty působící na subcelulární úrovni. Jako nejslibnější v tomto ohledu se jeví využití TKI – tyrozinkinázových inhibitorů (sorafenib, sunitinib, pazopanib). Další možností je neutralizace cirkulujícího VEGF prostřednictvím monoklonálních protilátek (bevacizumab), nebo inhibice signální cesty zprostředkované pomocí mTOR proteinu – (mammalian target of rapamycin – savčí rapamycinový cílový receptor) ovlivnitelného preparáty (temsirolimus, everolimus) (14). Tato léčba vede k inhibici angiogeneze a nádorové proliferace.
Mezi uznávané rizikové faktory RCC patří především kouření cigaret, hypertenze nebo její medikamentózní léčba (antihypertenziva, diuretika) a také obezita (9, 15, 16), kdy definitivní roli obezity a dlouhodobého užívání antihypertenziv jako rizikového faktoru RCC je třeba definitivně prokázat.
RCC má několik odlišných variant (17). Nejčastější variantou je světlobuněčný RCC, který vychází z epiteliálních buněk proximálního tubulu. Druhou nejčastější variantou je papilární RCC, který vychází z epiteliálních buněk distálního tubulu a který představuje asi 10–15 % případů. Chromofobní RCC představuje jen 5 % RCC a jedná se o další histologický subtyp RCC, který vyrůstá z kortikální části společných vývodů. Ostatní varianty RCC, mezi které patří karcinom ze sběrných kanálků (Belini), jsou ještě vzácnější. Světlobuněčný RCC je typicky mikroskopicky tvořen velkými vodojasnými buňkami (vysoký obsah glykogenu a tuků), případně buňkami s granulární cytoplazmou. Vzácněji mohou být přimíšeny buňky vřetenovité nebo sarkomatoidní. Právě sarkomatoidní transformace nádoru, která může postihnout všechny histologické subtypy RCC, je spojena obvykle se špatnou prognózou v důsledku značné agresivity takto sarkomatoidně dediferencovaného RCC. Tento nález tedy jednoznačně upozorňuje na horší prognózu. Struktura nádoru nebývá vždy jednotná a může se lišit místo od místa. Na řezu má typickou žlutavou až okrovou barvu s ložisky hemoragií, případně dutin s koaguly nebo nekrotickými ložisky. Žlutá barva u RCC je způsobena přítomností tukových látek v nádorových buňkách. Pokud je nádor makroskopicky na řezu tuhý a bělavý, může tento nález svědčit pro již zmíněnou sarkomatoidní transformaci nádoru.
Anatomicko-patologické faktory zahrnují velikost nádoru, přítomnost žilní invaze, infiltrace renální kapsuly a nadledviny. Postižení uzlin či přítomnost metastáz představují významné prognostické faktory u RCC, které mohou být klasifikovány pro klinické a vědecké účely. V tomto ohledu je obecně doporučováno využití TNM (tumor; uzlina = node; metastáza) klasifikace RCC, která je průběžně upravována a zpřesňována tak, aby vyhovovala stávajícím poznatkům. U RCC došlo k zavedení nové TNM klasifikace v roce 2009 (18).
Pro RCC je běžné metastazování krevní cestou. Nejčastější jsou plicní metastázy, ale časté je metastazování také do jater, skeletu a mozku. Ojediněle byla zjištěna spontánní regrese metastáz (zejména plicních) po provedení nefrektomie (19, 20) pro primární RCC (< 1 %).
V počátečních stadiích bývá nádor asymptomatický a klíčové se tak staly zobrazovací metody (21, 22), které umožní diagnostiku RCC ještě v době, kdy nemocní nemají žádné obtíže (23). U 30 % pacientů s RCC nacházíme paraneoplastické projevy. V minulosti před érou moderních zobrazovacích metod (ultrasonografie – USG, výpočetní tomografie – CT vyšetření) byl RCC poměrně často diagnostikován právě na základě paraneoplastických projevů lékaři interních oborů – tzv. „nádor internistů“. Později s nástupem moderních technik (USG, CT, magnetická rezonance – MRI atd.) se primárně tyto nádory zjišťovaly v rámci těchto vyšetření na radiodiagnostických odděleních, tzv. „nádor radiologů“. I dnes se můžeme setkat s paraneoplastickými projevy RCC. Patří mezi ně: hypertenze, polycytémie, anémie, hyperkalcémie, amyloidóza nebo hepatopatie (známá také jako Staufferův syndrom). Aby se jednalo o Staufferův paraneoplastický syndrom, což je reverzibilní paraneoplastická hepatická dysfunkce, která je obvykle charakterizována abnormálními jaterními testy, hepatomegalií, horečkami, leukopenií a nekrotickými zónami v játrech, je nutné vyloučit metastatické postižení jater. Po provedení nefrektomie se jaterní funkce normalizují asi u 60–70 % nemocných. Perzistující nebo recidivující hepatopatie obvykle svědčí pro špatnou prognózu onemocnění. Bohužel se stále setkáváme s případy mladých nemocných okolo 40 let věku, kteří přijdou pro jiné potíže a jako vedlejší nález je zjištěn RCC, jenž má již vytvořeny vzdálené metastázy (24). RCC může být podobně jako expanze v oblasti nadledvin zcela náhodným nálezem při USG prováděném z jiné indikace (incidentalomy). CT s podáním kontrastní látky, kromě potřebné diferenciální diagnostiky, vede k upřesnění nálezu RCC a umožňuje navíc posouzení stavu a funkce kontralaterální ledviny. CT dále zpřesňuje údaje o stavu regionálních lymfatických uzlin a nadledvin. Dvoufázová CT angiografie dovoluje zobrazit přesněji vztah k velkým cévním strukturám retroperitonea, upřesní topografii hilových cév před operační revizí.
Fyzikální vyšetření bývá často u pacientů s lokalizovaným RCC zcela negativní. U štíhlých pacientů s velkým RCC můžeme pozorovat vyklenutí břišní stěny a vyhmatat rezistenci. Lokálně pokročilý nádor může vést ke vzniku varikokély u mužů nebo k tvorbě otoků dolních končetin při nádorové trombóze v dolní duté žíle.
U pacientů se zvýšenou hladinou kreatininu nebo alergických na kontrastní látku můžeme indikovat MRI. Také při podezření na nádorový trombus v dolní duté žíle nebo při současném postižení páteře se považuje doplnění MRI za přínosné k přesnějšímu posouzení nálezu. Lze rovněž provést celotělové vyšetření pomocí moderních hybridních přístrojů PET/CT (PET – pozitronová emisní tomografie). Stran přesnějšího posouzení mozkových metastáz RCC má zatím nedostižný význam MRI. Pro PET/CT v této indikaci se jeví jako velmi slibný marker mitotické aktivity fludeoxythymidin (FLT) značený fluorem 18F (25).
Operační léčba RCC je dosud nezastupitelná (9, 16, 26, 27). U RCC je úplné vyléčení obvykle možné pouze v časných stadiích nemoci. V současnosti je otevřená radikální nefrektomie indikována především pro velké nádory kategorie T2 nebo pro pokročilejší tumory T3 a T4.
Operace pro RCC v sobě zahrnuje několik důležitých zásad (tab. 1) vyplývajících z běžně uznávaných onkologických pravidel chirurgické léčby.
Tab. 1. Základní onkologická pravidla otevřené radikální nefrektomie pro RCC 
* Manipulace s nádorem ještě před podvazem renálních cév může indukovat metastatické šíření nádoru. Při nefrektomii, kdy je současně řešen také radikálně nádorový trombus, je základem výkonu předchozí pečlivá preparace dolní duté žíly, kdy je také obvykle provedena ligace a přerušení gonadální žíly. U nádorového trombu stupně I, případně také u menšího trombu stupně II je možné si při operaci vystačit s naložením Satinského cévní svorky na dolní dutou žílu v místě odstupu příslušné renální žíly. U většího nádorového trombu stupně II bývá již nutné naložení turniketů na dolní dutou žílu pod a nad trombem a na kontralaterální renální žílu. Při větším rozsahu nádorového trombu, kdy se jeho horní okraj šíří již do retrohepatické části dolní duté žíly musí být ještě rozsáhleji uvolněna dolní dutá žíla. Multioborová spolupráce a provedení výkonu ve spolupráci s cévními chirurgy je velmi výhodné (28, 29). Nejnáročnějším je operační výkon u nádorového trombu stupně IV. Za standardní metodu je v tomto případě považováno odstranění nádorového trombu při použití mimotělního oběhu (30, 31). Kardiochirurg odstraňuje trombus z pravé síně v kardiopulmonálním bypassu (CPB) za současné atriotomie a kavotomie, kdy během CPB může být využita také hypotermie.
Chirurgická léčba neztratila svůj význam ani v době, kdy byla do klinické praxe zavedena imunoterapie a později biologické léčba RCC. Klinický benefit cytoredukční nefrektomie (CNE, tedy nefrektomie u nemocného s pokročilým či metastatickým – mRCC) je zřejmý při řešení lokálních projevů onemocnění (31), mezi které patří krvácení, bolesti, případně paraneoplastické projevy či mechanické obtíže a dyskomfort působený objemným tumorem. CNE je spojena s rizikem nezanedbatelné morbidity (13–16 %) a dokonce mortality (0 až 4 %) a s rizikem, že některé symptomy mohou perzistovat. Vzhledem k těmto okolnostem je kromě otevřeného výkonu (32) vhodné také zvážit ve vybraných případech další modality a invazivní metody s menší invazivitou. Jedná se o možnost laparoskopického či robotického výkonu, angioembolizace nebo také perkutánní radiofrekveční ablace tumoru či kryoablace atd. (33, 34). Nicméně CNE může vést ke zlepšení kvality života a je důležitým momentem pro psychiku nemocných. Přínosem je také znalost přesné histologie, která bude zřejmě ovlivňovat výběr léčebné strategie i při užití cílené biologické léčby (31, 35, 36). Role CNE se upevnila v době, kdy základem systémové léčby mRCC byla imunoterapie (37–39). V případě, že nebyla provedena CNE a nemocní byli léčeni pouze cytokiny, byla odpověď pouze u 6 % případů, což upozornilo na negativní imunosupresivní efekt ponechaného primárního tumoru. Následně byly provedeny dvě velmi kvalitní randomizované studie hodnotící CNE + interferon (IFN) versus samotnou aplikaci IFN (37, 38). Průměrná doba přežití v první skupině (CNE + IFN) byla 13,6 měsíců, ve druhé skupině pouze s INF byla 7,8 měsíce. Význam chirurgické léčby je zřejmý také ze studie hodnotící 91 nemocných s limitovaným rozsahem metastatického postižení. U 61 nemocných kromě CNE byla také provedena kompletní resekce zjevných metastáz a průměrná doba přežití byla u této skupiny pacientů 30 měsíců oproti druhé skupině 30 nemocných, kdy byla provedena pouze CNE se jednalo pouze o 12 měsíců (39). Přínos CNE je zřejmý i při použití biologické léčby, jak je patrné ze studie III. fáze srovnávající sunitinib versus IFN-α podávaných v 1. linii léčby u mRCC z roku 2007 (40). Do studie bylo zařazeno celkem 750 nemocných s mRCC a ve větvi se sunitinibem se jednalo o 375 pacientů. CNE byla provedena u 339 (90 %) nemocných, zatímco 36 (10 %) pacientů bylo léčeno sunitinibem bez předchozího provedení CNE. Při porovnání období bez progrese choroby (PFS – progression-free survival) u těchto dvou podskupin nemocných léčených biologickou léčbou bylo zjištěno, že PFS byl delší u nemocných po CNE – 11měsíců (rozmezí 11–13 měsíců) versus 6 měsíců (rozmezí 4–11 měsíců) u nemocných léčených pouze sunitinibem (p = 0,0889) (41). Tyto údaje podporující provedení CNE před zahájením cílené biologické léčby jako 1. linie pro mRCC. Biologická léčba může být podána před CNE, kdy by mohlo dojít ke zlepšení resekability tumoru (35, 42).
Radikální nefrektomie otevřeným přístupem představuje poměrně rozsáhlý výkon s nezanedbatelným rizikem vzniku kýly v jizvě či s rizikem parézy přilehlé části lumbální oblasti a břišní stěny a také celou řadou dalších peroperačních i pooperačních úskalí (32). Nyní se RCC diagnostikuje mnohem častěji ještě ve fázi s menším rozsahem samotného nádoru a onemocnění. Hledaly se proto podobně jako pro další chirurgické postupy alternativní způsoby řešení, které by byly méně invazivní. Vhodným miniinvazivním postupem pro provedení radikální nefrektomie se ukázala být laparoskopie. V rukou zkušených operatérů (9, 33, 43–45) je laparoskopická nefrektomie považována za zlatý standard v péči o pacienty s lokalizovaným RCC a je jednou z možností v léčbě lokálně pokročilého RCC T3a (45). Ve složitějších situacích je pro operatéra velmi cenné použít místo rigidních laparoskopických nástrojů, novou generaci flexibilních instrumentů, kterými disponuje robotická daVinci® technologie (Intuitive Surgical®, USA). Endoskopické laparoskopické či retroperitoneoskopické techniky operačních výkonů v oblasti horních močových cest se stávají oblíbenou miniinvazivní metodou využívanou v řadě indikací k náročným komplexním výkonům, kdy urychlují rekonvalescenci nemocných. Jako příklad lze, kromě výkonů pro nádory ledvin, zmínit také operace pro tumory nadledvin, pyeloplastiky či odběr štěpu pro transplantaci ledviny od živého dárce apod. (33, 43, 44, 46, 47). Laparoskopie s rigidními instrumenty má své limity pro některé složitější situace. Řadu limitů standardní laparoskopie umožňují překonat technické přednosti robotického systému daVinci® (48–52). Robotický daVinci® systém využívá vysoce flexibilní endowrist nástroje, což umožňuje zkrátit délku ischémie při resekčních výkonech a velmi precizní preparaci jednotlivých cév v oblasti renálního hilu, což je důležité zvláště v případě anatomických cévních (obr. 1a,b) abnormalit (16) atd.
Obr. 1. Využití daVinci<sup>®</sup> robotické nefrektomie pro komplikovaný případ RCC s vícečetným anomálním cévním zásobením postižené ledviny Technika laparoskopické daVinci<sup>®</sup> roboticky asistované pravostranné nefrektomie pro karcinom pravé ledviny se dvěma renálními tepnami a žílami se zachováním tradičního operačního principu radikálního uroonkologického postupu. V první fázi jsou preparovány a mezi bezpečnostními zamykatelnými Hemolock<sup>®</sup> klipy (a) nejprve přerušeny obě renální tepny. Následuje obdobné ošetření a ostré přerušení obou renálních žil při jejich odstupu z vena cava interiér (b), kdy centrální pahýl všech magistrálních cév bezpečně zajištěn dvěma naloženými Hemolock<sup>®</sup> klipy. Dokončení výkonu, kdy mezi Hemolock klipy jsou již ostře přerušeny obě renální tepny a žíly. Před ukončením výkonu zůstává laterálně od vena cava inferior ve spodině patrný pouze musculus psoas (foto z operačního videa). 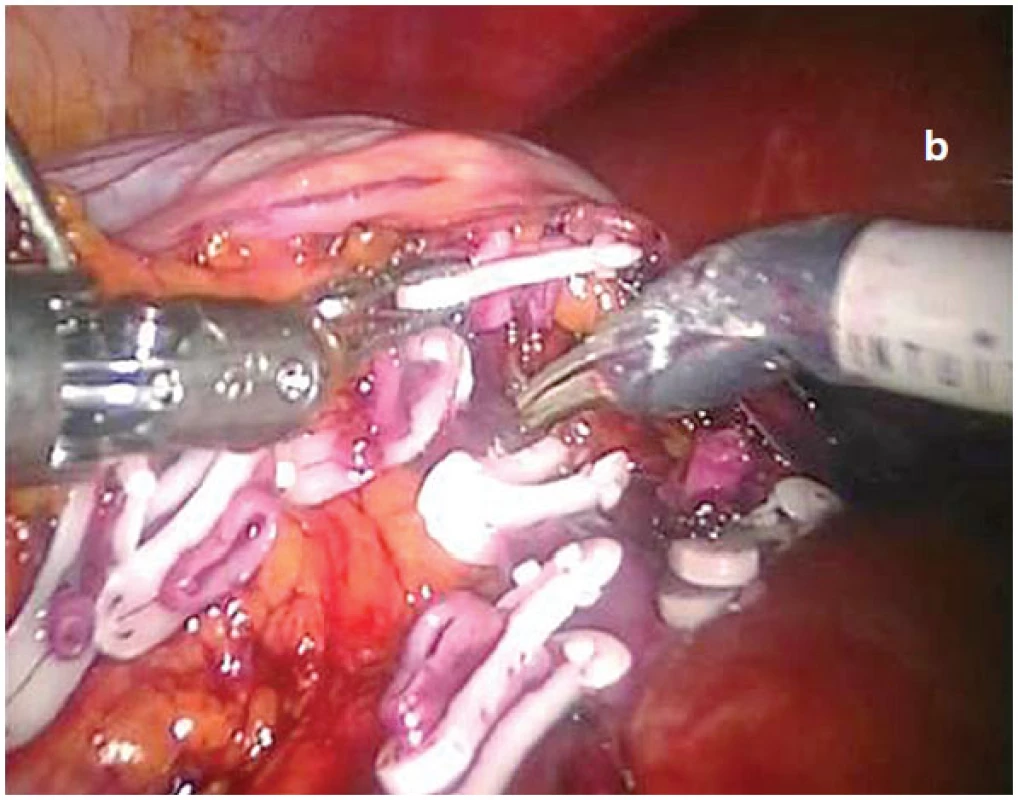
Robotická chirurgie představuje nové odvětví chirurgie vycházející z miniinvazivních operačních přístupů. Využívá velmi přesných počítačem kontrolovaných nástrojů, které přenášejí pohyb operatérovy ruky do dutiny břišní a umožňují provést operaci bezpečněji. Při robotické operaci má operatér trojrozměrný pohled, obraz je velmi dobře osvětlený a zvětšený (až desetinásobně). To nám umožňuje lépe šetřit všechny důležité struktury. Hlavní rozdíl oproti laparoskopii spočívá v tom, že při laparoskopii máme obraz pouze dvou rozměrný a rigidní nástroje, kdy vzhledem k velké náročnosti je třeba se tyto operace dlouho učit (dlouhá learning curve). Robotický daVinci® systém nabízí trojrozměrný obraz, nástroje typu endowrist mají velkou flexibilitu pohybu i v omezeném prostoru a počítač navíc eliminuje třes operatérovy ruky, operace je bezpečnější a není tak těžké se s ním naučit pracovat. Limitem je absence taktilního vjemu pro operatéra, se kterým se musí operatér naučit pracovat (mluvíme někdy o nové chirurgické dovednosti v tomto ohledu). Cenovou náročnost robotiky se daří postupně překonávat, podobně jako tomu bylo v minulosti u klasické laparoskopie. Porovnání základních parametrů konvenční laparoskopie a daVinci® robotického operačního systému (Intuitive Surgical®, USA) poskytuje tabulka 2.
Resekce RCC šetřící tkáň ledviny (nephron sparing surgery) je výkon, který byl úspěšně využíván chirurgy již několik desítek let. Pro větší technickou náročnost jej někteří chirurgové dlouho odmítali. Nejprve byla potvrzena bezpečnost těchto resekcí pro RCC do velikosti 4 cm v průměru, kdy výsledky z onkologického hlediska (četnost recidiv, generalizace atd.) byly plně srovnatelné s provedením radikální nefrektomie (9, 53). Navíc bylo u těchto malých tumorů ledvin hlášeno poměrně významné procento (až kolem 20 %) benigních tumorů. Resekční výkony šetřící tkáň ledviny se staly součástí oficiálních urologických guidelines. Standardní indikace pro nephron sparing surgery jsou dle European Association of Urology (EAU Guidelines) rozdělená do následujících kategorií (9):
- absolutní (anatomicky nebo funkčně solitární ledvina),
- relativní (fungující protější ledvina, jež by mohla v budoucnosti zmenšit svoji funkci),
- elektivní (lokalizovaný jednostranný renální karcinom se zdravou protilehlou ledvinou).
Resekce ledviny je zavedený léčebný postup vhodný pro pacienty se solitárním RCC, do velikosti 4 cm v maximálním průměru. Výsledky dlouhodobého přežití jsou obdobné jako po radikální nefrektomii. Dále mnohé studie prokazují, že pacienti, u kterých byla provedena radikální nefrektomie, mají ve srovnání s nemocnými po provedené resekci ledviny zvýšené riziko zhoršení renálních funkcí, které může vyústit až v chronické selhání ledvin a řadu dalších především kardiovaskulárních komorbidit se zvýšeným rizikem úmrtí na tyto příhody, právě v důsledku zhoršených renálních funkcí (53–56).
Standardní technikou pro resekční výkony je otevřený výkon. Rovněž při resekcích pro RCC se řadě pracovišť a také nám z nových technologií jeví jako slibná a velmi užitečná právě metoda daVinci® robotické techniky (43, 47, 49), která zkracuje learning curve, a tím se výkon stává také bezpečnějším. V posledním období se nám osvědčilo pro nephron sparing surgery také využití radiofrekvenčního ablačního – Habibova® nože, který ve vhodných případech umožňuje resekce bez vaskulární okluze renálních cév, a tím bez negativního vlivu ischémie (29, 43, 57, 58). Nadále pokračuje vývoj miniinvazivních technik a nástrojů a mezi nové alternativy patří operační výkony provedené také na ledvinách metodou tzv. klíčové dírky (single keyhole surgery) nebo operační přístupy využívající přirozené tělní vstupy (Natural orifice translumenal endoscopic surgery – NOTES), které zatím patří mezi zkoumané techniky, ale při sofistikovanějších nástrojích a ve zkušených rukou jsou první hlášené výsledky pro vybrané případy povzbudivé (59–61).
Alternativní miniinvazivní postupy lokální léčby RCC se stále více uplatňují v rutinní praxi.
Standardní operační techniky vyžadující celkovou anestezii mohou být v individuálních případech pro nemocného neúměrně zatěžující a rizikové. Pro tyto případy se stále více používají alternativní méně invazivní techniky, které mohou být proveditelné v lokální anestezii či v kombinaci s analgosedací. Příkladem může být provedení selektivní embolizace pro krvácení z centrálně uloženého tumoru v solitární ledvině, které by při akutním operačním výkonu vedlo k nefrektomii s nutností trvalé další dialýzy. Mezi miniinvazivní techniky patří radiofrekvenční ablace (RFA) či kryoablace (31, 34, 62). Metody se dají vhodně kombinovat, takže například u objemnějšího tumoru je nejprve provedena selektivní embolizace a následně pak dokončeno ošetření metodou RFA, prováděnou perkutánně pod CT navigací (obr. 2a,b,c). RFA působí lokální destrukci a nekrózu tkání vlivem expozice zvýšené teploty. Dle našich zkušeností je metoda obvykle velmi dobře tolerována i staršími nemocnými. RFA má u nás zatím dominantní využití především pro nižší ekonomickou náročnost oproti kryoablaci.
Obr. 2. Příklad radiofrekvenční ablace karcinomu ledviny, kdy pro přidružená komplikující interní onemocnění by konveční chirurgické léčba představovala pro nemocného neúměrně vysokou zátěž a riziko a – nález vaskularizovaného karcinomu vycházejícího z dorzální části pravé ledviny při CT vyšetření, b – miniinvazivně vedená léčba pomocí perkutánní RFA navigovanou pod CT kontrolou, c – výsledný nález avaskulární nekrózy tumoru, který se nesytí po aplikací RTG kontrastní látky; dobrý výsledek léčby bez známek viabilního reziduálního karcinomu pravé ledviny s odstupem 10 měsíců po RFA 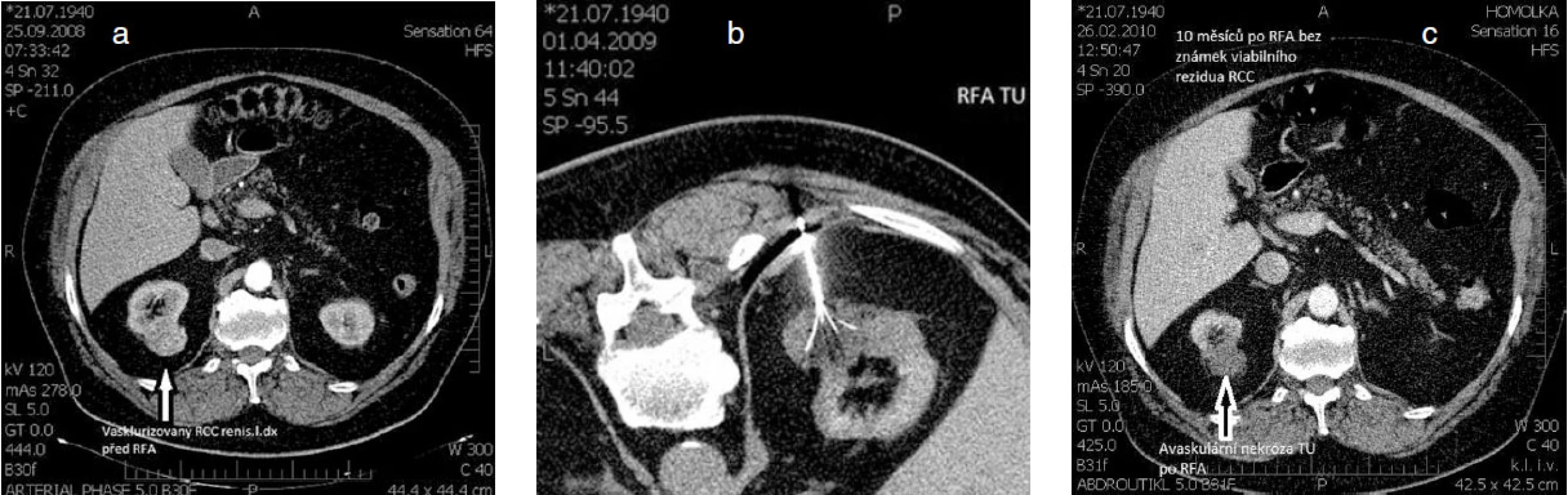
Resekce metastáz, které se u RCC mohou vyskytnout prakticky v jakémkoliv orgánu, patří ke standardním postupům. Nejčastějším místem metastatického postižení jsou plíce. Skelet, mozek, nadledviny a játra patří mezi další častá místa možných metastáz. Odstraňování vzdálených solitárních metastáz je považováno za optimální postup, pokud je výkon technicky možný (31, 36). Provádí se metastazektomie v retroperitoneu, játrech a dalších vnitřních orgánech či ve skeletu (63). Příznivé výsledky je možné dosáhnout i při dalších resekcích v rámci druhé či třetí recidivy metastáz. Výsledky již nejsou tak dobré jako po primární metastazektomii, ale i tak je možné dosáhnout 5letého přežití v 29 %. Závažným nálezem jsou metastázy RCC v nosném skeletu. U RCC se jedná především o osteolytická, vysoce vaskularizovaná a destruktivně se chovající metastatická ložiska (16). Z jejich podstaty pak vyplývá příslušná symptomatologie s algickými syndromy, patologickými frakturami, kdy nejsou vzácností radikulopatie či myelopatie při infiltraci nervových struktur s rizikem paréz či plegií při infiltraci páteřního kanálu. Při konvečním chirurgickém ošetření je například při provádění somatektomie obratlového těla nutné počítat se značnými krevními ztrátami a se stabilizací páteře pomocí osteosyntetického materiálu mnohdy z obou přístupů (předního i zadního), a tedy se značnou zátěží pro nemocného.
Obdobně jako při ošetření primárního RCC patří do komplexní péče miniinvazivní techniky pro ošetření metastatických ložisek. Jedná se opět především o selektivní embolizaci a RFA. V případě, že se jedná o metastázu ve skeletu, pak je miniinvazivní výkon označován jako vertebroplastika či cementoplastika v závislosti na lokalizaci metastázy (31). Po úvodní embolizaci se používá RFA doplněná o následnou cementoplastiku, která stabilizuje místo ve skeletu po předchozí destrukci nádorového ložiska. Jedná se o modality minimální invaze s aplikací nízce viskózního kostního cementu pod CT navigací perkutánně zavedenou jehlou přímo do destruovaného skeletu postiženého nádorem. Kromě stabilizačního efektu přímo aplikovaného cementu se na protinádorovém efektu podílí chemické složení a fyzikální tepelný efekt vznikající při tuhnutí cementového akrylátového polymeru Metody jsou vhodné zejména u strukturálních osteolytických změn skeletu s proběhlou nebo hrozící patologickou frakturou (obratle, skelet pánve atd.). Kromě lokální léčby kostních metastáz se v komplexním přístupu k této problematice uplatňuje snaha o časné vytipování nemocných ohrožených kostními komplikacemi (24, 66) a jejich systémová léčba (67, 68) novými efektivními bisfosfonáty (zoledronát).
Zcela novou a principiálně odlišnou ablační metodou se slibnými klinickými výsledky je technika vyvinutá pod označením Nanoknife®. Z aktivní části zavedených jehel do oblasti tumoru se šíří vysokonapěťové pulzy do celého ložiska, které vedou k destrukci buněčných membrán s následnou apoptózou buněk v nádorovém ložisku. Jde o tzv. ireverzibilní elektroporaci (64), tedy „studenou ablaci“, kdy nedochází k tvorbě tepla a nedochází k poškození nervů a velkých cév (> 2 mm) ani dalších tubulárních struktur (např. močovod) v blízkosti intervenovaného ložiska. Po provedené intervenci není narušena struktura pojivové tkáně, kterou obsahují všechny tyto důležité struktury (močová trubice, ureter atd.).
Tab. 2. Porovnání laparoskopie a robotiky 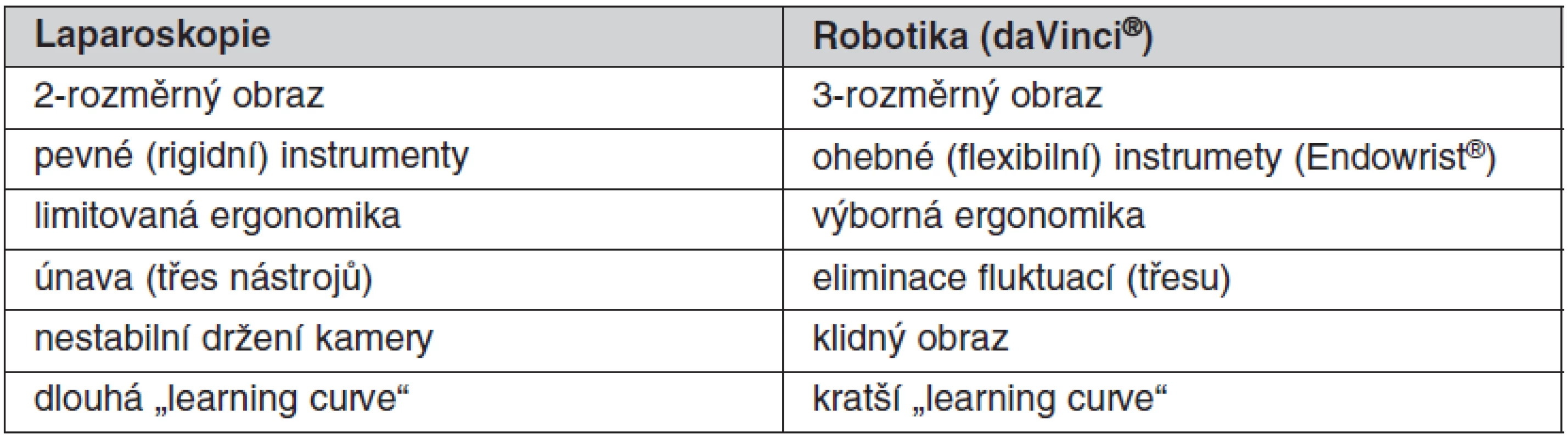
Nový daVinci® robotický operační systém disponuje celou řadou zřejmých technických výhod, díky kterým se daVinci® roboticky asistovaná chirurgie stává pro vhodně vybrané typy výkonů pro nemocného i operatéra bezpečnějším a šetrnějším. Robotika v urologii postupně nahrazuje předchozí operační techniky. Například v Belgii, která má přibližně stejný počet obyvatel jako Česká rebublika, se používá více než 20 daVinci® robotů. V poslední době řada specializovaných pracovišť preferuje v praxi právě daVinci® roboticky asistované resekce ledvin (48, 49, 52). Biologická léčba představuje nový zlatý standard systémové léčby mRCC a překonává výsledky (9, 37, 65) v minulosti zaznamenané při režimech používajících imunoterapii. Mezníkem ve vývoji systémové léčby mRCC se stala studie publikovaná v roce 2007 (40), porovnávající efektivitu do té doby standardně používaného interferonu alfa (IFN-α) s novým preparátem – sunitinib (Sutent®). Sunitinib je selektivní oxindol tyrozin kinázový inhibitor (TKI), který řadíme k preparátům tzv. biologické léčby. Principem biologické léčby blokující angiogenezi je inhibice určitých proteinů tyrozin kinázy a jejich receptorů, mezi které patří především vaskulární endoteliální růstový faktor (VEGFR) a také receptor pro růstový faktor z destiček (PDGFR). Následkem a hlavním mechanismem účinku antiVEGF terapie je silná inhibice angiogeneze a následná inhibice proliferace nádorových buněk. Jednalo se o studii III. fáze srovnávající sunitinib (50 mg/den podávaném v cyklu 4 týdnů a následovaném 2 týdny bez léčby) versus IFN-α podávaných v 1. linii léčby mRCC, kdy byla zaznamenána objektivní odpověď (RR – response rate) na léčbu ve 31 % (sunitinib) versus 6 % (IFN-α). Při podání sunitinibu došlo ke statisticky významnému prodloužení PFS, který byl ve větvi se sunitinibem více než dvakrát delší (11 měsíců versus 5 měsíců, p < 0,000001). Jednalo se o první jasný důkaz, že sunitinib je účinnější v 1. linii systémové léčby u mRCC než konvenční imunoterapie (40). Tento zřejmý pokrok v systémové léčbě mRCC, který přináší pro nemocné biologická léčba, se odrazil do nových standardních postupů a biologická léčba se stala doporučenou v 1. i ve 2. linií léčby mRCC již v roce 2007 v platných doporučeních EAU Guidelines pro léčbu mRCC. Další analýzou dat, kdy pokud byli zhodnoceni pacienti léčení pouze samotným sunitibem či INF, bylo potvrzeno statisticky významně delší přežívání nemocných léčených sunitinibem (69). Kromě sunitinibu (Sutent®) (40), byly do klinické praxe pro léčbu mRCC zavedeny další preparáty, které se staly součástí léčebných algoritmů (70–75), mezi ně patří: sorafenib (Nexavar®), bevacizumab (Avastin®), temsirolimus (Torisel®), everolimus (Afinitor®) a pazopanib (Votrient®). Rovněž u těchto dalších preparátů byl zjištěn klinický benefit léčby oproti předchozím režimům systémové léčby. Cílená biologická léčba (tab. 3) je v současnosti standardem v 1. a ve 2. linii léčby mRCC. Molekulární diagnostika a léčba podobně jako u dalších malignit představuje v současnosti velmi slibný a intenzivně zkoumaný přístup také u RCC (76).
Tab. 3. Faktory a kritéria pro výběr systémové léčby RCC 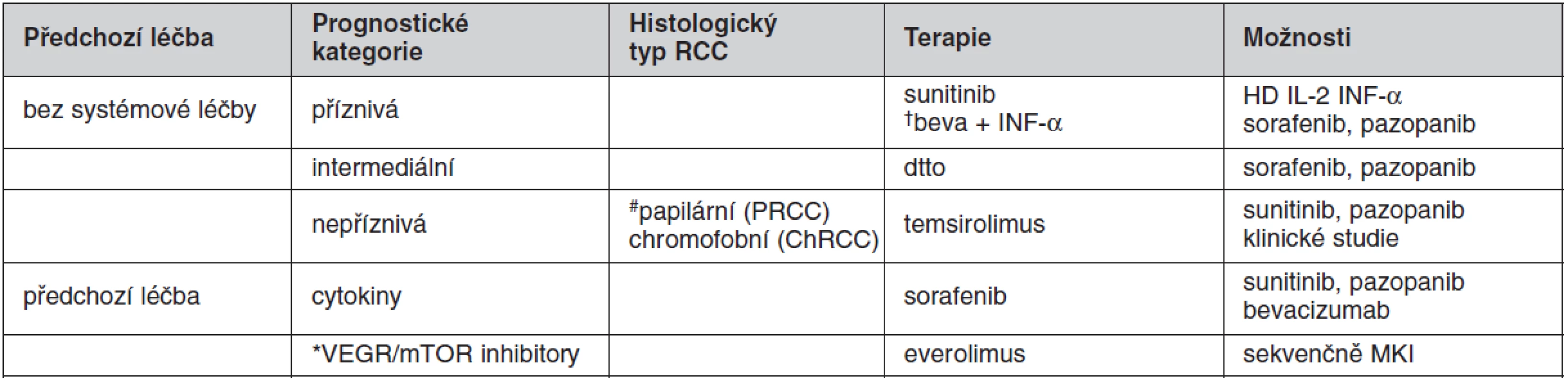
†bevacizumab + IFN-α – redukce dávky interferonu (IFN-α) vede ke snížení toxicity této kombinace při zachovaném přínosu této kombinace #papilární (PRCC) a chromofobní (ChRCC) – asi menší efektivita léčby sorafenibem a sunitinibem; naopak užití temsirolimusu u PRCC se jeví se sklonem k většímu benefitu než u světlobuněčného RCC *rezistence na VEGF automaticky neznamená rezistenci na inhibitory mTOR, jakým je everolimus Závěr
Pro dosažení optimálních výsledků léčby RCC (kontrola nádoru při zajištění dobré kvality života) je třeba uplatňovat komplexní multioborový přístup. Jedná se o integraci chirurgické léčby včetně miniinvazivních technik (laparoskopie a robotika) s režimy efektivnější cílené biologické léčby. Ve vhodných případech použití radioterapie, radiochirurgie, radiofrekvenční ablace, selektivní embolizace, použití bisfosfonátů či radionuklidů při prevenci a terapii skeletálních komplikací v kombinaci s ortopedickými intervencemi a stabilizacemi včetně miniinvazivních cementoplastik a vertebroplastik atd. Je zřejmé, že jednotlivé histologické typy RCC s jejich genetickými a molekulárními odlišnostmi budou mít jinou odpověď na nové preparáty biologické léčby. Všechny současné trendy spějí ke komplexnímu, ale přitom individuálnímu přístupu k nemocným. Pro kvalitní diagnostiku a léčbu RCC je nezbytná úzká spolupráce řady specialistů. Je nutné využít celé spektrum nových možností v rutinní péči o nemocné s RCC.
Zkratky
CNE – cytoredukční nefrektomie
CPB – kardiopulmonální bypass
CT – výpočetní tomografie (computed tomography)
EAU – Evropská urologická společnost (European Association of Urology)
FLT – fludeoxythymidin
HIF faktor – hypoxií indukovaný faktor (hypoxic-inducible factor)
ChRCC – chromofobní karcinom ledviny
IL – interleukin
INF – interferon
mRCC – metastatický karcinom ledviny (metastatic renal cell carcinoma)
MRI – magnetická rezonance (magnetic resonance imaging)
mTOR – savčí rapamycinový cílový receptor (mammalian target of rapamycin)
NOTES – operace využívající přirozených tělních vstupů (natural orifice translumenal endoscopic surgery)
OS – doba přežití (overall survival)
PDGF faktor – růstový faktor z destiček (platelet-derived growth factor)
PET – pozitronová emisní tomografie
PFS – období bez progrese choroby (progression-free survival)
PRCC – papilární karcinom ledviny
pVHL – von Hippel-Lindauův protein
RCC – karcinom ledviny (renal cell carcinoma)
RFA – radiofrekvenční ablace (radiofrequency ablation)
RR – objektivní odpověď (response rate)
TKI – tyrozinkinázový inhibitor (tyrosine kinase inhibitor)
TNM – nádorová klasifikace (tumor; uzlina = node; metastáza)
TSC – komplex tuberózní sklerózy (tuberous sclerosis complex)
USG – ultrasonografie
VEGF faktor – vaskulární endoteliální růstový faktor (vascular endothelial growth factor)
VHL – von Hippel-Lindauova choroba
Adresa pro korespondenci:
MUDr. Ivan Kolombo, FEBU
Centrum robotické chirurgie a urologie Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
e-mail: kolomboi@seznam.cz
Zdroje
1. Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita [2005] (cit. 18. 2. 2011). Dostupný z www: http: //www.svod.cz. Verze 7.0 [2007].
2. Novotvary v České republice. Ústav zdravotnických informací a statistiky ČR 2009 (cit. 18. 2. 2011) Dostupné z: ÚZIS ČR (Institute of health information and statistics of the Czech republic – IHIS CR) http://www.svod.cz.
3. GLOBOCAN 2002, Cancer incidence, Mortality and revalence Worldwide. IARC Cancer Base, Lyon IARC 2002.
4. Jemal A, Siegel R, Ward E, et al. Cancer statistics 2006. CA Cancer J Clin 2006; 56 : 106–130.
5. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics 2002. CA Cancer J Clin 2005; 55 : 74–108.
6. Abou El Fettouh HI, Cherullo EE, El-Jack M, et al. Sporadic renal cel carcinoma in young adults: presentation, treatment, and outcome. Urology 2002; 60 : 806–810.
7. Kolombo I, Poněšický J, Poršová M, et al. Pokročilý karcinom ledviny – současné trendy terapie (1. část). Urologie pro Praxi 2009; 10 : 182–189.
8. Kawaciuk I. Epidemiologie karcinomu ledviny, Urologie pro praxi 2005; 6 : 248–252.
9. Ljunberg B, Hanbury DC, Kuczyk MA, Mersenburger AS, Mulders PFA, Patard J-J, Sinescu IC. EAU Guidelines on Renal Cell Carcinoma, EAU, Update 2009, www.uroweb.org.
10. Gudbjartsson T, Jonasdottir TJ, Thoroddsen A, et al. A population-based familial aggregation analysis indicates genetic contribution in a majority of renal cell carcinomas. Int J Cancer 2002; 100 : 476–479.
11. Linehan WM, Srinivasan R, Schmidt LS. The genetic basis of kidney cancer: a metabolic disease. Nat Rev Uro 2010; 7 : 277–285.
12. Zbar B, Klausner R, Linehan WM. Studying cancer families to identify kidney cancer genes. Annu Rev Med. 2003; 54 : 217–233.
13. Brugarolas J. Renal-cell carcinoma – molecular pathways and therapies. NEJM 2007; 356 : 185–187.
14. Thomas GV, Tran C, Mellinghoff IK, et al. Hypoxia-inducible factor determines sensitivity to inhibitors of mTOR in kidney cancer. Nat Med 2006; 12 : 122–127.
15. Babjuk M, Matoušková M, Fínek J, et al. Zhoubné nádory ledvinového parenchymu dospělého věku; 37–43. In: Konsenzuální doporučené postupy u uroloonkologii. Praha: Galén 2009.
16. Kolombo I, Hanuš T, Odrážka K, et al. Karcinom ledviny. Praha: Mladá Fronta – Aeskulap 2010; 1–279.
17. Michal M, Hes O, Mukenšnabl P. Nádory ledvin dospělého věku. 1. vyd. Plzeň: Euroverlag 2000.
18. Sobin LH, Gospodariwicz M, Wittekind C (eds). TNM classification of malignant tumors. UICC International Union Against Cancer. 7th edn. London: Wiley-Blackwell 2009 : 255–257.
19. Kavoussi LR, Levine SR, Kadmon D, Fair WR. Regression of metastatic renal cell carcinoma: A case report and literature review. J Urol 1986; 135 : 1005–1007.
20. Thoroddsen A, Gudbjartsson T, Geirsson G, et al. Spontaneous regression of pleural metastases after nephrectomy for renal cell carcinoma. Scand J Urol Nephrol 2002; 36 : 396–398.
21. Adam Z, Vorlíček J, Vaníček J, et al. Diagnostické a léčebné postupy u maligních chorob. Praha: Grada Publishing 2003
22. Weichet J, Vymazal J. Zobrazovací metody (sono, CT, MRI) In: Kolombo I, Hanuš T, Odrážka K, et al. Karcinom ledviny. Praha: Mladá Fronta – Aeskulap 2010; 83–93.
23. Klener P, Abrahámová J. Nádory ledvin. In: Klener P. Klinická onkologie. Praha: Galén a Karolinum 2002; 435–442.
24. Kolombo I, Kolombová J, Dvořáček J, Hanuš T, et al. Skeletální postižení v uroonkologii. Praha: Galén 2005.
24. Bělohlávek O. Nukleárně medicínské zobrazovací metody. In: Kolombo I, Hanuš T, Odrážka K et al. Karcinom ledviny. Mladá Fronta – Aeskulap Praha 2010; 94–103.
26. Hora M. Nádory ledvin. Urologie pro Praxi 2005; 1 : 28–30.
27. Rovný A, Filipenský P, Šabacký I, et al. Nádory ledvin. In: Adam Z, Vorlíček J. Speciální onkologie. Brno: Masarykova Univerzita 2002; 139–149.
28. Hanuš T. Surgical management of renal tumours with vena cava involvement: is it a job of urologists? Ces Urol 2009; 13 : 25–28.
29. Kolombo I, Kolombová J, Beňo P, Toběrný M, et al. Mezioborová spolupráce v urologii. Urologie pro Praxi 2007; 8 : 262–267.
30. Morávek P. Nádory ledvin a horních močových cest. Chirurgická terapie. In: Dvořáček J, Babjuk M, et al. Onkourologie. Praha: Galén a Karolinum 2005; 44–56.
31. Kolombo I, Poněšický J, Poršová M, et al. Pokročilý karcinom ledviny – současné trendy terapie (2. část). Urologie pro Praxi 2009; 10 : 218–230.
32. Mejean A, Vogt B, Quazza JE, Chretien Y, Dufour B. Mortality and morbidity after nephrectomy for renal cell carcinoma using a transperitoneal anterior subcostal incision. Eur Urol 1999; 36 : 298–302.
33. Eret V, Hora M, Ferda J, Chudáček Z, Hes O, Ürge T, Klečka J. Nejnovější metodiky v chirurgické léčbě nádorů ledvin. Ces Urol 2009; 13 : 24–25.
34. Kolombo I, Kříž R, Janoušková L, et al. Selective embolization and radiofrequency ablation of renal mass in polymorbid and elderly patients – our experience. Eur Urol Meetings 2007; Abstracts of the EAU 7th Central European Meeting 26–27 October 2007, Zagreb, Croatia, Vol 2, Issue 7, Abstract 26.
35. Barocas DA, Chang SS. The role of cytoreductive nephrectomy in the era of targeted therapy. AUA News 2008; 13 : 1–6.
36. Rini BI, Campbell SC. The evolving role of surgery for advanced renal cell carcinoma in the era of molecular targeted therapy. J Urol 2007; 177 : 1978–1984.
37. Flanigan RC, Salmon SE, Blumenstein BA, et al. Nephrectomy followed by interferon α-2b compared with interferon α-2b alone for metastatic renal cell cancer. N Engl J Med 2001; 345 : 1655–1659.
38. Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon α-based immunotherapy compared with interferon α alone for metastatic renal cell carcinoma: a randomized trial. Lancet 2001; 358 : 966–970.
39. Russo P, Synder M, Vickers A, et al. Cytoreductive nephrectomy and nephrectomy/complete metastasectomy for metastatic renal cancer. Scientific World Journal 2007; 7 : 768.
40. Motzer RJ, Hutson TE, Tomczak P, et al. Sunitinib versus interferon alfa in metastatic renal cell carcinoma. N Engl J Med 2007; 356 : 115–124.
41. Motzer RJ, Figlin RA, Hutson TE, et al. Sunitinib versus interferon alfa (IFN-α) as first-line treatment of metastatic renal cell carcinoma (mRCC): updated results and analysis of prognostic factors. J Clin Oncol 2007; 25(Suppl): abstract 5024.
42. Margulis V, Martin SF, Tannir N, et al. Surgical morbidity associated with administration of targeted molecular therapies before cytoreductive nephrectomy or resection of locally recurent renal cell carcinoma. J Urol 2008; 180 : 94–98.
43. Gronka L, Poršová M, Kolombo I, et al. Karcinom ledviny současné trendy. Urologie pro Praxi 2008; 9 : 120–127.
44. Hartmann I, Študent V, Grepl M, et al. Laparoskopická nefrektomie – zlatý standard? Ces Urol 2008; 12 : 116 – abstract 58.
45. Hemal AK, Kumar A, Kumar R, et al. Laparoscopic versus open radical nephrectomy for large renal tumors: a long-term prospective comparison. J Urol 2007; 177 : 862–866.
46. Kaplan O, Köhler O, Kočárek J, et al. Roboticky asistované resekce tumoru ledvin – první zkušenosti. Ces Urol 2008; 12 : 118 – abstract 62.
47. Kolombo I, Toběrný M, Černohorský S, et al. Laparoskopické roboticky asistované operace ledvin. Endoskopie 2008; 17 : 35–42.
48. Rogers C, Patard J. Robotic partial nephrectomy is better than open partial nephrectomy. Eur Urol 2009; 56 : 568–570.
49. Benway BM, Bhayani SB. Robot-assisted partial nephrectomy: evolution and recent advances. Curr Opin Urol 2010; 20 : 119–124.
50. Benway BM, Bhayani SB, Rogers CG, et al. Robot-assisted partial nephrectomy versus laparoscopic partial nephrectomy for renal tumors: A multi-institutional analysis of perioperative outcomes. J Urol 2009; 182 : 866–872.
51. Guillonneau B, Jayet C, Tewari A, Vallancien G. Robot assisted laparoscopic nephrectomy. J Urol 2001; 166 : 200–201.
52. Kolombo I, Toběrný M, Černohorský S, et al. Robotická chirurgie v urologii. NEUMM 2008; 2 : 84–93
53. Huang WC, Elkin EB, Levey AS, et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors – is there a difference in mortality and cardiovascular outcomes? J Urol 2009; 181 : 55–61, discussion 61–62.
54. McKiernan J, Simmons R, Katz J, et al. Natural history of chronic renal insufficiency after partial and radical nephrectomy. Urology 2002; 59 : 816.
55. Miller DC, Schonlau M, Litwin MS, et al. Urologic Diseases in America Project. Renal and cardiovascular morbidity after partial or radical nephrectomy. Cancer 2008; 112 : 511–520.
56. Thompson RH, Boorjian SA, Lohse CM, et al. Radical nephrectomy for pT1a renal masses may be associated with decreased overall survival compared with partial nephrectomy. J Urol 2008; 179 : 468–471, discussion 472–473.
57. Andonian S, Adebayo A, Okeke Z, Lee BR. Habib laparoscopic bipolar radiofrequency device: a novel way of creating an avascular resection margin in laparoscopic partial nephrectomy. J Laparoendo Adv Surg Tech 2008; 18 : 853–856.
58. Navrátil P, Pacovský J, Všetička J, Podhola M, Matějková M, Zachoval R. Resekce ledvin radiofrekvenčním nožem – radikalita a destrukce funkčního parenchymu. Ces Urol 2008; 12 : 120 – abstract 64.
59. Gill IS, Canes D, Aron M, et al. Single port transumbilical (E‑NOTES) donor nephrectomy. J Urol 2008; 180 : 637–641.
60. Kaouk JH, Goel RK. Single-port laparoscopic and robotic partial nephrectomy. Eur Urol 2009; 55 : 1163–1170
61. Raman JD, Bensalah K, Bagrodia A, et al. Laboratory and clinical development of single keyhole umbilical nephrectomy. Urology 2007; 70 : 1039–1042.
62. Mahnken AH, Rohde D, Brkovic D, et al. Percutaneous radiofrequency ablation of renal cell carcinoma: preliminary results. Acta Radiol 2005; 46 : 208–214.
63. Kolombo I, Chrobok J, Poněšický J, et al. Our first experience with replacement for vertebral body by Synex® device for spine metastatic disease of urooncological patients. Eur Urol Meetings 2007; Abstracts of the EAU 7th Central European Meeting 26–27 October 2007, Zagreb, Croatia, Vol 2, Issue 7, Abstract 98.
64. Rubinsky B. Irreversible Electroporation: A New Ablation Modality – Clinical Implications. Technology in Cancer Research and Treatment 2007; 6 : 37–47.
65. Zachoval R, Urban M, Heráček J, et al. Současný pohled na metastazující karcinom ledviny z hlediska přežití v závislosti na druhu terapie. Urologie pro Praxi 2003; 5 : 190–192.
66. Kolombo I, Hanuš T, Kolombová J. Možnosti laboratorní diagnostiky metabolických změn skeletu. Čas Lék čes 2005; 144 : 162–167.
67. Jarolím J, Abrahámová, J, Buncová M, et al. Kostní metastázy. Program urologie a onkologie Elektronické Univerzity. 2007 www.euni.cz.
68. Kolombo I, Kolombová J, Vlásek T. Místo bisfosfonátů při skeletálním postižení v uroonkologii, Urologie pro Praxi, 2006; 5 : 228–242.
69. Thompson Coon JS, Liu Z, Hoye M, et al. Sunitinib and bevacuzimab for first-line treatment of metastatic renal cell carcinoma: a systematic review and indirect comparison of clinical effectiveness. Br J Cancer 2009; 101 : 238–243.
70. Hudes G, Carducci M, Tomczak P, et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356 : 2271–2281.
71. Melichar B, Koralewski P, Ravaud A, et al. First-line bevacizumab combined with reduced dose interferon-alpha 2a is active in patients with metastatic renal cell carcinoma. Ann Oncol 2008; 19 : 1470–1476.
72. Motzer RJ, Escudier B, Oudard S, et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomized, placebo-controlled phase III trial. Lancet 2008; 372 : 449–456.
73. Odrážka K, Kolombo I, Hanuš T. Algorytmus léčby. In: Kolombo I, Hanuš T, Odrážka K et al: Karcinom ledviny. Praha: Mladá Fronta – Aeskulap 2010, 242–247.
74. Petruželka L. Nové možnosti systémové léčby karcinomu ledviny. Remedia 2008; 18 : 35–45.
75. Sternberg CN, Davis ID, Mardiak J, et al. Pazopanib in Locally Advanced or Metastatic Renal Cell Carcinoma: Results of a Randomized Phase III Trial. J Clin Oncol 2010; 28 : 1061–1068.
76. Linehan WM, Bratslavsky G, Pinto PA, et al. Molecular diagnosis and therapy of kidney cancer. Ann Rev Med 2010; 61 : 329–343.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek ÚvodníkČlánek ZprávyČlánek KnihyČlánek Diagnostika sepseČlánek ZprávyČlánek ZprávyČlánek ZprávyČlánek Pokroky v lékových formáchČlánek Zprávy JCLČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Metamizol v kostce a v praxi – účinné neopioidní analgetikum pro celé věkové spektrum
-
Všetky články tohto čísla
- Úvodník
- Nemocnice Na Homolce – dvacet let špičkové medicíny
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Zprávy
- Karcinom ledviny v éře nastupujících robotických technologií
- Zprávy
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Zprávy
- Nekonvulzivní status epilepticus
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Knihy
- Diagnostika sepse
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Zprávy
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- 24. český a slovenský neurologický sjezd
- X. a XI. česko-slovenská konference laboratorní hematologie
- 19. lipovské dermatovenerologické fórum
- Mezioborový seminář Třeboň ‘11
- Pokroky v lékových formách
- Doc. MUDr. Milan Jaroš, CSc. – osmdesátiletý
- Docent Radim Kočvara šedesátníkem
- Zprávy JCL
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




