-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
Benefit of paracorporeal pulsatile assist device in multiorgan failing patients in terminal stage of heart failure
Background:
Prevalence of terminal forms of heart failure is steadily increasing and thus waiting time for heart transplantation, too. Increasing mortality on waiting list has urged implementation of mechanical circulatory support as an adjunct to the programme of heart transplantation. The objective of the study is to review 7-years experience with paracorporeal assist device in bridging to transplantation.Material and methods:
Retrospective review of 53 transplant candidates treated since April 2003. 50 patients received paracorporeal assist devices in biventricular configuration. Most frequent diagnosis was dilated cardiomyopathy in 51%.Results.
Despite a high risk profile of the patients, 37 of them were successfully transplanted (69.8%). Cumulative support has reached 3513 days. Local exit sites infection was identified as a most frequent complication, sepsis as a most frequent cause of death on support (18.8%). 30‑days post – transplant mortality remained low at 5.7%.Conclusions:
Paracorporeal mechanical circulatory assist devices remain effective alternative for terminal stage heart transplant candidates, especially for those in multiorgan failure who require biventricular support. Success rate of bridging to transplantation is acceptable, as well as complications rate and quality of life while on support. Long-term post-transplant survival is not inferior to the results of procedures performed without necessity of previous implantation of the assist device.Key words:
heart transplantation, ventricular assist device, biventricular configuration, paracorporeal, multiorgan failure.
Autoři: Ivan Netuka 1,4; Jiří Malý 1,4; Hynek Říha 3; Ondrej Szárszoi 1,4; Zora Dorazilová 2; Ivo Skalsky 1; Daniel Turek 1; Marián Urban 1; Jiří Kettner 2; Jan Pirk 1,4
Působiště autorů: Institut klinické a experimentální medicíny Praha, Klinika kardiovaskulární chirurgie 1; Institut klinické a experimentální medicíny Praha, Klinika kardiologie 2; Institut klinické a experimentální medicíny Praha, Klinika anesteziologie a resuscitace 3; Institut klinické a experimentální medicíny Praha, Centrum výzkumu chorob srdce a cév 4
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 44-48
Kategorie: Původní práce
Souhrn
Východisko:
Výskyt terminálních forem srdečního selhání v současnosti narůstá. Po vyčerpání konvenčních možností léčby je jedinou všeobecně akceptovanou metodou, která zásadně ovlivňuje prognózu pacienta, transplantace srdce (TxS). Čekací doba na ni se v posledních letech dramaticky prodloužila. Nezanedbatelná část pacientů se proto přestala dožívat doby jejího uskutečnění. To si vynutilo zavedení programu mechanických srdečních podpor (MSP), které díky obnovení dostatečného srdečního výdeje umožňují přemostění kriticky selhávajících pacientů do doby transplantace. Práce si klade za cíl analýzu přínosu parakorporální mechanické srdeční podpory v IKEM.Metody a výsledky:
Od 3. dubna 2003 byl systém implantován jako „most k transplantaci“ u 53 pacientů v akutním ohrožení života, u nichž byly vyčerpány možnosti konvenční léčby. Dominantně byla MSP implantována v biventrikulární konfiguraci (50 pacientů). Nejčastější základní etiologií byla dilatační kardiomyopatie (51 %). Navzdory vysoké rizikovosti byla implantace úspěšně provedena s nulovou perioperační mortalitou. Kumulativní doba MSP dosáhla 3513 dnů. Třicet sedm pacientů bylo úspěšně přemostěno k transplantaci srdce. Nejčastější komplikací byla lokální infekce v oblasti kanyl systému, nejčastější příčinou úmrtí pak sepse (18,8 %). Třicetidenní mortalita po TxS dosáhla příznivých 5,7 %.Závěry:
Parakorporální MSP je vysoce efektivní terapií, která zásadně ovlivňuje jinak fatální životní prognózu kriticky kardiálně selhávajících pacientů. Kvalita života pacientů i výskyt komplikací jsou plně přijatelné. Přežívání po transplantaci je zcela srovnatelné s pacienty, kteří ji podstoupili bez nutnosti zavedení MSP. Dosažené výsledky potvrzují pozici této léčebné metody jako integrální součásti transplantačního programu srdce.Klíčová slova:
mechanická srdeční podpora, transplantace srdce, srdeční selhání, multiorgánové selhání.ÚVOD
Transplantace srdce je až do současnosti jediným jednoznačně prokázaným a uznávaným chirurgickým řešením terminální fáze srdečního selhání s dlouhodobým pozitivním efektem. V posledních dekádě se však ani České republice nevyhnul celosvětový trend úbytku počtu dárců pro transplantaci srdce, který se projevuje prodlužující se čekací dobou na transplantační listině. Bohužel, značná část těchto nemocných se transplantace srdce přestala dožívat vzhledem k závažné progresi základního onemocnění nebo jeho komplikacím.
Tyto faktory si vynutily i na našem pracovišti potřebu zavedení programu mechanické srdeční podpory (MSP) do klinické praxe. Metoda poskytuje možnost přemostění kriticky selhávajících pacientů, u kterých již byly vyčerpány možnosti maximální konzervativní terapie, až do doby dostupnosti vhodného dárcovského orgánu. Před zahájením programu jsme posoudili publikované výsledky i technickou dosažitelnost jednotlivých typů srdečních podpor. Abychom byli v našich podmínkách schopni pokrýt maximální indikační šíři u pacientů v kritickém kardiálním stavu, zvolili jsme versatilní typ MSP Thoratec VAD, a to zejména vzhledem k jeho flexibilitě použití u jednostranné i oboustranné manifestace srdečního selhání.
Soubor nemocných a použité metody
Od zahájení programu (1) 3. dubna 2003 byla do 28. května 2008 dlouhodobá pulzatilní MSP implantována u 53 konsekutivních kandidátů transplantace srdce s akutní progresí srdečního selhání a projevy počínajícího nebo již plně rozvinutého multiorgánového selhání. Soubor nezahrnoval ty pacienty, kteří byli po rozvoji kritické kardiální dekompenzace napojeni na systém krátkodobé MSP nebo extrakorporální membránové oxygenace (ECMO).
Použité typy srdeční podpory
Mechanická srdeční podpora byla zajištěna parakorporálním či implantabilním pneumatickým systémem Thoratec VAD (Thoratec Laboratories Corporation Inc., Pleasanton, USA) v kombinaci s jeho stacionární nebo mobilní řídící jednotkou (obr. 1).
Obr. 1. Schéma biventrikulárního zapojení systému Thoratec VAD 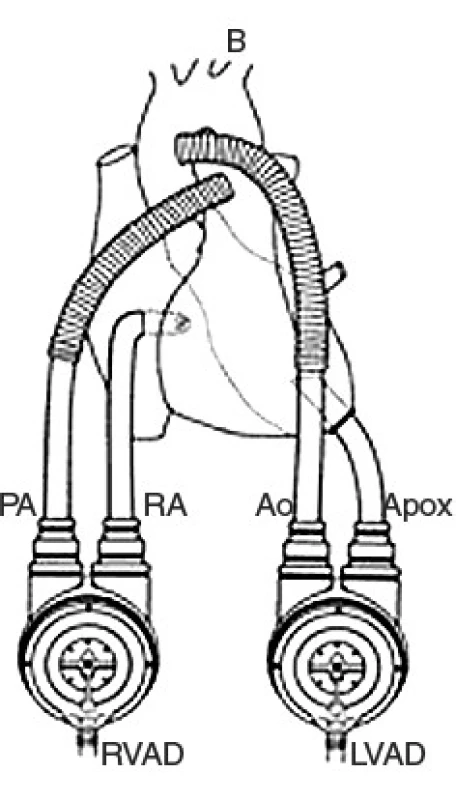
PA – plicnice, RA – pravá síň, Ao – aorta, Apox – hrot levé komory Systémy mohou být použity pro podporu činnosti levé komory (LVAD – left ventricular assist device), pravé komory (RVAD – right ventricular assist device) nebo pro podporu oboustranných srdečních oddílů (BIVAD – biventricular assist device) (2). V těchto případech je systém umístěn paralelně se srdečními oddíly, s nimiž je spojen pomocí vtokových a výtokových kanyl. Ty jsou při LVAD nejčastěji zavedeny do hrotu levé komory (alternativně levé síně) a do vzestupné aorty, při použití jako RVAD pak do pravé síně a plicnice.
U parakorporální varianty jsou komůrky umístěny před břišní stěnou pacienta a se srdečními oddíly jsou spojeny transkutánně zavedenými kanylami. U implantabilního systému jsou komůrky již umístěny v preperitoneálních kapsách a přes kůži pacienta je pak vyveden pouze pneumatický kabel pro pohon, který je generován externí hnací a řídící jednotkou. Obě varianty poskytují úplnou mechanickou srdeční podporu s generovaným výdejem krve až 7,5 l/min. Oběhový systém je implantován ze sternotomického přístupu s použitím mimotělního oběhu na bijícím srdci, pouze u izolované implantace pravostranné MSP (RVAD) přichází do úvahy tzv. off-pump zavedení.
Antikoagulační protokol
Antikoagulační terapie byla zahájena po stabilizaci ztrát z mediastinálních drénů kontinuálním podáváním heparinu k dosažení cílových hodnot dvojnásobku standardního času aPTT, dále pak po obnovení perorálního příjmu postupným přechodem na antikoagulační profylaxi warfarinem v terapeutickém rozmezí INR 2,5–3,0.
Antimikrobiální profylaxe
Protokol antimikrobiální profylaxe zahrnoval perioperačně zahájené intravenózní podávání kombinace vankomycinu a ciprofloxacinu, ve kterém se pokračovalo až do doby odstranění hrudních a mediastinálních drenů. Další antibiotická nebo antimykotická terapie byla nasazována cíleně v případě pozitivních kultivačních nálezů.
Péče o pacienty na mechanických srdečních podporách
Pacienti po napojení na MSP byli opětovně zařazeni na čekací listinu v urgentním pořadí bezprostředně po úplné anebo alespoň signifikantní úpravě orgánových funkcí. Nedílnou součástí péče během trvání srdeční podpory byla včasná intenzivní rehabilitace, u většiny pacientů umožňující i rehabilitaci chůzí s mobilní řídící jednotkou.
V případě následné úspěšné transplantace srdce byly imunosupresivní schéma i celkový terapeutický přístup shodné s běžným protokolem léčby.
Ke klasifikaci neurologických komplikací byly použity standardní definice transitorní ischemické ataky (TIA) a cévní mozkové příhody (CMP).
VÝSLEDKY
Charakteristika souboru
Soubor zahrnuje 53 pacientů, z toho 11 žen. Průměrný věk pacientů byl 48 (18–66) let. Implantabilní varianta MSP byla zavedena u dvou pacientů, u ostatních byl použit systém parakorporální. Vzhledem k pokročilosti oboustranného srdečního a multiorgánového selhání byla multioborovým indikačním týmem preferována biventrikulární varianta podpory (50 pacientů).
S výjimkou tří pacientů, u nichž byla MSP implantována pro fixovanou plicní vaskulární rezistenci kontraindikující transplantaci srdce, byly u všech ostatních pacientů vyčerpány možnosti maximální kombinované inotropní podpory, v 16 případech doplněné intraaortální balonkovou kontrapulzací (IABK). Kardiopulmocerebrální resuscitace (KPCR) u deseti pacientů v posledních 24 hodinách před implantací podtrhuje vysokou rizikovost kohorty.
Nejčastější etiologií základního onemocnění byla dilatační kardiomyopatie následovaná ischemickou kardiomyopatií. Dalšími příčinami srdečního selhání byly dysfunkce na podkladě dekompenzované chlopenní vady (dva pacienti) a refrakterní komorové arytmie. Sporadickou indikací pak byly shodně v jednom případě myokarditida a vrozená vývojová vada srdce v dospělosti.
Umělá plicní ventilace předcházela implantaci u 20 pacientů. Manifestní renální selhání si vyžádalo již před výkonem eliminační metodu – kontinuální veno-venózní hemofiltraci (CVVH) – u jedenácti nemocných.
Přehled vstupních kardiálních, hemodynamických a laboratorních parametrů shrnují tabulky 1 a 2. Tyto údaje jasně svědčí pro značnou pokročilost oboustranného srdečního selhání, stejnou výpovědní hodnotu mají i pro dokumentaci rozvinutosti multiorgánového selhávání.
Tab. 1. Předimplantační parametry souboru 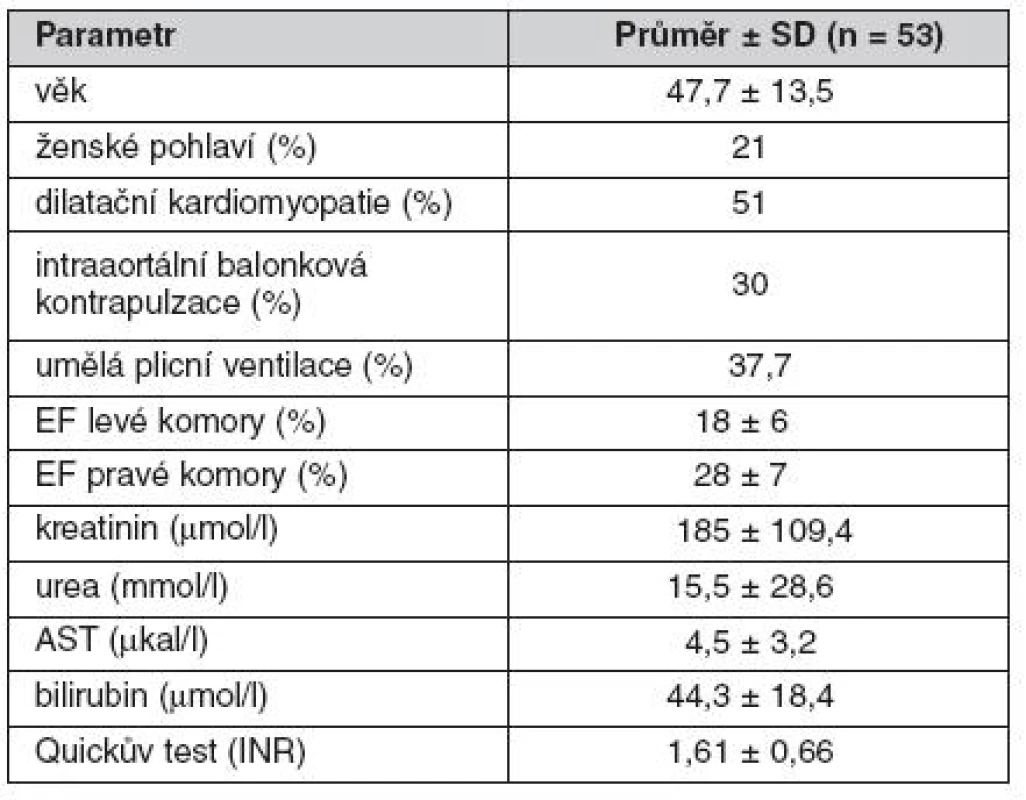
EF – ejekční frakce, AST – aspartátaminotransferáza, INR – mezinárodní normalizovaný čas Tab. 2. Hemodynamické předimplantační charakteristiky souboru 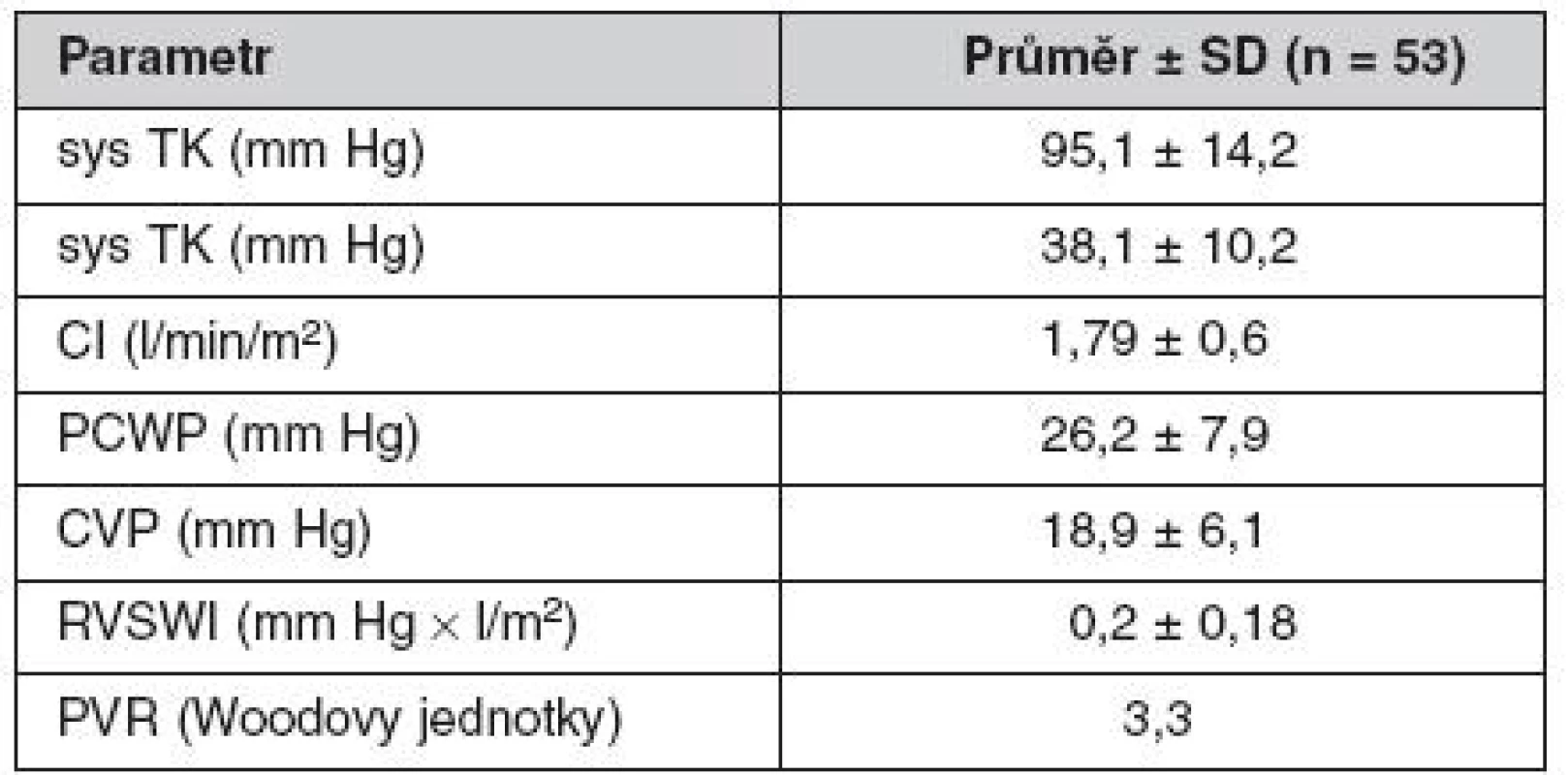
sys TK – systolický tlak krve, CI – srdeční index, PCWP – tlak v zaklínění, CVP – centrální žilní tlak, RVSWI – tepový index pravé komory, PVR – plicní vaskulární rezistence Úspěšnost terapie
Navzdory vysokému riziku nemocných byla srdeční podpora implantována u všech 53 pacientů bez perioperačního úmrtí. Při vždy dosaženém průtoku nad 5 l/min došlo u většiny nemocných k signifikantnímu zlepšení orgánových funkcí i celkového stavu, což následně umožnilo jejich opětovné zařazení na čekací listinu. Celková kumulativní zkušenost s použitím srdeční podpory v naší skupině je 3513 dnů, průměrná čekací doba na transplantaci dosáhla 74 (6–229) dnů.
U 37 pacientů se podařilo úspěšně překlenout kritické období do transplantace srdce. U ostatních kriticky nemocných došlo během napojení na MSP k úmrtím, mezi jejichž příčinami dominovala jednoznačně sepse (tab. 3). Pravděpodobnost přežívání během mechanické srdeční podpory dokumentuje Kaplanova-Meierova křivka v grafu 1.
Graf 1. Kaplan-Meierova křivka přežívání na mechanické srdeční podpoře 
V časném potransplantačním období zemřeli do 30. dne tři pacienti, dlouhodobé přežívání pacientů pak shrnuje Kaplanova-Meierova křivka v grafu 2.
Graf 2. Kaplan-Meierova křivka přežívání transplantovaných pacientů ze souboru 
Komplikace
Jednou z nejobávanějších komplikací u pacientů na MSP jsou tromboembolické příhody a dále pak hemoragické CMP v souvislosti s nutností antikoagulační léčby. Během napojení MSP jsme zaznamenali dvě ischemické CMP, z nichž jedna rezultovala v trvalý neurologický deficit. Stejně tak byly zaznamenány dvě hemoragické CMP, z nichž jedna byla příčinou úmrtí, druhá byla úspěšně řešena neurochirurgickým zákrokem.
Nutnost pooperačního zavedení eliminační metody (CVVH) z důvodu další progrese již předoperačně přítomné renální insuficience byla zaznamenána u deseti pacientů. Umělou plicní ventilaci déle než 72 hodin po výkonu vyžadovalo 16 pacientů.
S chirurgickou revizí pro krvácení v mediastinu jsme se setkali u 14 pacientů, po přechodu na taktiku sekundární odložené definitivní sutury se však výskyt téměř eliminoval. V jednom případě byla nezbytná revize pro korekci malpozice pravosíňové kanyly.
Klinicky významnou hemolýzu jsme nezaznamenali u žádného pacienta. Během celkové doby použití umělé srdeční podpory (3513 dnů) nedošlo k technickému selhání systému.
DISKUZE
Úspěšnost přemostění kritického období do transplantace srdce v našem souboru pacientů, která byla 69,8 %, a dosáhla tak horní hranice úspěšnosti ostatních literárně dokumentovaných výsledků pohybujících se mezi 38–72 % (3–5). Tyto výsledky je třeba vnímat v kontextu průměrné čekací doby (74 dnů) do získání vhodného dárcovského štěpu, kdy lze předpokládat, že naprostá většina těchto nemocných by se transplantace srdce bez použití této metody vůbec nedožila. Pravděpodobnost přežívání v čase demonstruje graf 1.
V případě úspěšného přemostění k transplantaci jsme zaznamenali velmi nízkou perioperační mortalitu. Navzdory tomu, že se vždy jednalo o rozsáhlou reoperaci, která kladla vysoké nároky na chirurgickou techniku i anesteziologickou a intenzivní péči, dosáhla mortalita během prvních 30 dnů příznivých 5,7 %. Tato úspěšnost dokonce překonává dříve mezinárodně publikovaná data (6, 7).
Přesná indikace potřeby zavedení biventrikulární namísto pouze levostranné MSP zůstává i přes celou řadu skórovacích systémů a pomocných kritérií velmi obtížná (8). Hemodynamické prediktory pravostranného srdečního selhání po implantaci levostranné MSP nejsou zcela přesvědčivé (9). Jiní autoři pak kladou důraz na přítomnost klinických proměnných, jako jsou nutnost předimplantační umělé plicní ventilace či výrazný vzestup hodnot bilirubinu a kreatininu, které jsou spojeny s rizikem pravostranného selhání po implantaci pouze levostranné srdeční podpory (2, 10).
Je evidentně prokázáno, že morbidita a mortalita pacientů na biventrikulární MSP oproti pacientům s levostrannou MSP jsou výrazně vyšší. Na druhé straně je mnoho důkazů, že nutnost dodatečné implantace pravostranné srdeční podpory pro přetrvávající pravostranné srdeční selhávání je spojena se signifikantně horším přežitím oproti skupině pacientů, u kterých byla primárně zavedena biventrikulární srdeční podpora (11, 12). Eliminace pokračujícího pravostranného srdečního selhávání umožňuje časné ukončení inotropní podpory, efektivně snižuje centrální žilní tlak a přispívá k obnově mikrocirkulace orgánů u pacientů s multiorgánovým selháním.
Dominantní zastoupení bivetrikulární MSP je v souladu s výše uvedenými úvahami, kdy dokumentované parametry funkce pravé komory, hemodynamiky i další klinická kritéria svědčila pro pokročilost pravostranného i multiorgánového selhání. Je však třeba dodat, že i na našem pracovišti se v současnosti prosazuje trend ve prospěch implantace pouze levostranných srdečních podpor, který je jistě ovlivněn stoupajícími zkušenostmi s terapií pravostranného srdečního selhání, nicméně zásadní podíl na tomto trendu má posun ve strategii referujících kardiologů, který vede k časnější indikaci implantace.
Z hlediska dlouhodobého přežívání je naopak povzbuzující, že po transplantaci nebyl demonstrován rozdíl mezi přežíváním pacientů s předchozí levostrannou nebo biventrikulární MSP (6) a že pravostranná srdeční podpora není potransplantačním rizikovým faktorem z hlediska morbidity ani mortality (13). Přežívání našich pacientů je prakticky totožné s výsledky obdobných souborů (7).
Nejčastější komplikací u pacientů na MSP jsou infekční komplikace, jejichž výskyt se udává v rozmezí 28–49 % (14). I v našem souboru pak byla sepse nejčastější příčinou úmrtí. Faktorů, které se na tom spolupodílejí, je celá řada. Zvlášť obávanou komplikací je zejména u parakorporálních systémů fokální infekce v oblasti prostupu kanyl přes kožní kryt. Pro její omezení je zásadní pečlivé ošetřování oblasti a v případě časných známek infekce včasné zahájení chirurgické a antibiotické terapie.
Dalším významným rizikem je vlastní povrch systému vystavený trvalému kontaktu s krevním řečištěm, na kterém může docházet k vytváření bakteriálního filmu při přítomné bakteriémii. Je proto třeba klást důraz na dodržování perioperační antibakteriální profylaxe i včasnou detekci patogenů v rámci pravidelného infekčního screeningu. Neméně důležitou roli pak sehrává aktivní mobilizace a rehabilitace pacientů.
Časné a pozdní krvácení s nutností operační revize, v našem souboru další častá komplikace, je do značné míry obecným rysem tohoto kardiochirurgického výkonu vzhledem k výchozímu hemokoagulačnímu stavu nemocných, rozsahu vlastního výkonu i nezbytnosti poměrně agresivní antikoagulační léčby po implantaci. I na pracovištích s dlouholetou zkušeností s touto problematikou je uváděn výskyt těchto komplikací až 60 % (15). Ve strategii našeho programu jsme se postupně přiklonili k sekundární odložené sutuře pacientů po 24 hodinách, která snížila výskyt dalších revizí pro krvácení. Minimalizace krevních ztrát a s tím spojené nutnosti transfuzí derivátů má jistě zásadní význam, a to mimo jiné i z hlediska imunosenzitizace před následující transplantací srdce. Jednoznačnější zhodnocení možného přínosu této strategie však bude vyžadovat další analýzy.
Otázka potenciální výhody námi použité pulzatilní mechanické srdeční podpory u pacientů v kritickém hemodynamickém stavu není stále jednoznačně zodpovězena. Experimentální práce prokázaly (16), že nepulzatilní krevní průtok může zásadně alterovat perfuzi na úrovni mikrocirkulace a že pulzatilní průtok urychluje na zvířecím modelu kardiogenního šoku reparaci orgánových a metabolických funkcí. Vzhledem k tomu se námi zvolený přístup s pulzatilním podpůrným systém může jevit jako racionálnější varianta s ohledem na pokročilost multiorgánového selhávání s alterací mikrocirkulace (17). Nicméně je třeba konstatovat, že tato potenciální výhoda je v poslední době relativizována stále širším používáním nepulzatilních systémů, a to i u skupin pacientů s profilem obdobným naší. K definitivnímu zodpovězení této otázky tak bude potřeba dalších srovnávacích studií.
V zahraničí běžné převedení vhodných pacientů na srdeční podpoře do ambulantního režimu nebylo i přes zjevnou únosnost některých našich nemocných prozatím praktikováno, zejména vzhledem k obavám pacientů i jejich blízkých pro případ řešení potenciálních komplikací; další limitací byl v té době nedostatečně propracovaný systém domácí péče. Je však třeba doplnit, že po zavedení modernějších systémů na našem pracovišti byla tato bariéra překonána.
ZÁVĚR
Výsledky v našem souboru pacientů jsou zcela srovnatelné s již dříve publikovanými zahraničními studiemi a opravňují další rozvoj této léčebné metody v rámci klinické praxe našeho transplantačního centra. I přes nezanedbatelnou morbiditu i mortalitu v naší skupině můžeme tyto výsledky interpretovat jako velmi uspokojivé vzhledem k evidentní vysoké rizikovosti nemocných. Možnost dalšího zlepšení výsledků se otevírá v oblasti upřesňování indikací a kontraindikací výkonu a dále pak v medikamentózním i chirurgickém zdokonalování hemostázy. Hlavní důraz je však nutné klást na včasnost zavedení mechanické srdeční podpory v indikovaných případech, pro kterou je nezbytné uvedení tohoto programu do povědomí široké kardiologické veřejnosti.
Přestože modernější typy nepulzatilních mechanických srdečních podpor postupně odsouvají pulzatilní MSP do pozadí, je třeba konstatovat, že v časovém a technologickém kontextu sehrály zásadní roli v rozvoji péče o kriticky selhávající čekatele na transplantaci srdce.
Zkratky
- aPTT – aktivovaný tromboplastinový čas plazmy
- AST – aspartátaminotransferáza
- BIVAD – podpora oboustranných srdečních oddílů (biventricular assist device)
- CI – srdeční index
- CMP – cévní mozková příhoda
- CVP – centrální žilní tlak
- CVVH – kontinuální veno-venózní hemofiltraci
- ECMO – extrakorporální membránové oxygenace
- EF – ejekční frakce
- IABK – intraaortální balonková kontrapulzace
- INR – mezinárodní normalizovaný čas
- KPCR – kardiopulmocerebrální resuscitace
- LVAD – podpora činnosti levé komory (left ventricular assist device)
- MSP – mechanická srdeční podpora
- PCWP – tlak v zaklínění
- PVR – plicní vaskulární rezistence
- RVAD – podpora činnosti pravé komory (right ventricular assist device)
- RVSWI – tepový index pravé komory
- sys TK – systolický tlak krve
- TIA – transitorní ischemická ataka
- TxS – transplantace srdce
Adresa pro korespondenci:
MUDr. Ivan Netuka, Ph.D.
Klinika kardiovaskulární chirurgie IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: ivan.netuka@ikem.cz
Zdroje
1. Kettner J, et al. Mechanická podpora krevního oběhu – první zkušenosti v ČR. Čas Lék čes 2005; 144 : 38–42.
2. Farrar DJ, et al. Preoperative and postoperative comparison of patients with univentricular and biventricular support with the thoratec ventricular assist device as a bridge to cardiac transplantation. J Thorac Cardiovasc Surg 1997; 113 : 202–209.
3. McBride LA, et al. Clinical experience with 111 thoratec ventricular assist devices. Ann Thorac Surg 1999; 67 : 1233–1238.
4. Haddad M, et al. Ventricular assist devices as a bridge to cardiac transplantation: the Ottawa experience. Artif Organs 2004; 28 : 136–141.
5. El-Banayosy A, et al. Predictors of survival in patients bridged to transplantation with the thoratec VAD device: a single-center retrospective study on more than 100 patients. J Heart Lung Transplant 2000; 19 : 964–948.
6. Magliato KE, et al. Biventricular support in patiens with profound cardiogenic shock: a single centre experience. ASAIO J 2003; 49 : 475–479.
7. Kirsch M, et al. Single-centre experience with Thoratec paracorporeal assist device for patiens with primary cardiac failure. Arch Cardiovasc Dis 2009; 102 : 509–518.
8. Rao V, et al. Revised screening scale to predict survival after insertion of a left ventricular assist device. J Thorac Cardiovasc Surg 2003; 125 : 855–862.
9. Ochiai Y, et al. Predictors of severe right ventricular failure after implantable left ventricular assist device insertion: analysis of 245 patients. Circulation 2002; 106: I198–I202.
10. Kormos RL, et al. Transplant candidate‘s clinical status rather than right ventricular function defines need for univentricular versus biventricular support. J Thorac Cardiovasc Surg 1996; 111 : 773–782.
11. Schenk S, et al. Duration of inotropic support after left ventricular assist device implantation: risk factors and impact on outcome. J Thorac Cardiovasc Surg 2006; 131 : 447–454.
12. Fitzpatrick JR, et al. Early planned institution of biventricular mechanical circulatory support results in improved outcomes compared with delayed conversion of a left ventricular assist device to a biventricular assist device. J Thorac Cardiovasc Surg 2009; 137 : 971–977.
13. Morgan JA, et al. Is severe right ventricular failure in left ventricular assist device recipients a risk factor for unsuccessful bridging to transplant and post-transplant mortality. Ann Thorac Surg 2004; 77 : 859–863.
14. Holman WL, et al. Infection in ventricular assist devices: prevention and treatment. Ann Thorac Surg 2003; 75: S48–S57.
15. Goldstein DJ, et al. Left ventricular assist devices and bleeding: adding insult to injury. Ann Thorac Surg. 2003; 75: S42–S47.
16. Bába A, et al. Microcirculation of the bulbar conjunctiva in the goat implanted with a total artificial heart: effects of pulsatile and nonpulsatile flow. ASAIO J 2004; 50 : 321–327.
17. Sezai A, et al. Major organ function under mechanical support: comparative studies of pulsatile and nonpulsatile circulation. Artif Organs 1999; 23 : 280–285.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Metamizol v kostce a v praxi – účinné neopioidní analgetikum pro celé věkové spektrum
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- IKEM – Institut klinické a experimentální medicíny – na prahu páté dekády úspěšné existence
- Plánované akce odborných složek ČLS JEP
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
-
Molecular Diagnostic Europe
Hannover, 4. až 7. října 2010 -
Konference Tabák a zdraví po jedenácté v Lékařském domě
Praha, 5. listopadu 2010 - Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Spolek lékařů českých v Praze
-
Strouhal E, Vachala B, Vymazalová H.
Lékařství starých Egypťanů
I. staroegyptská chirurgie, Péče o ženu a dítě - CHARLES BRENTON HUGGINS
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Prof. MUDr. Václav Čepelák, DrSc. osmdesátníkem
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




