-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nedostatečný screening a malá informovanost o rizikových faktorech u příbuzných I. stupně nemocných s kolorektálním karcinomem
Inadequate screening and low awareness about risk factors among first-degree relatives of colorectal cancer patients
Introduction:
First-degree relatives of colorectal cancer patients have higher risk of disease, thus colonoscopic screening should be started at the age of 40 in this group. Goal of the study was to assess their awareness of the colorectal cancer risk factors and their compliance with colorectal cancer screening programme.Methods:
62 patients after colorectal cancer resection and their 67 first-degree relatives (42% out of 160 addressed) answered structured questionnaire and counselling focused on colorectal cancer risk factors, and screening participation.Results:
Before diagnosis of colorectal cancer only 18% of colorectal cancer patients (11/62) were aware of its risk factors, after diagnosis their awareness increased to 65% (40/62, p < 0.001). Before questionnaire 46% of first-degree relatives (31/67) were aware of colorectal cancer risk factors, after counselling awareness increased to 66% (44/67, p = 0.024). 79% (53/67) of first-degree relatives were aware of their increased familial risk. 28% (19/67) of first-degree relatives enrolled for colorectal cancer screening. Most frequent screening method was fecal occult blood test (FOBT) in 21% (14/67) of first-degree relatives, colonoscopy was performed only in 7% (8/67) of first-degree relatives. Average age of screening participation was 53 years. 22% (15/67) of first-degree relatives refused any screening in the future.Conclusions:
We have found low awareness of colorectal cancer risk factors in colorectal cancer patients and their relatives before their diagnosis of disease respectively before their counselling. First-degree relatives are aware of their increased risk, however their screening participation is unsatisfactory. Screening is performed only in minority of first-degree relatives, often late and with inappropriate modality (FOBT). 22% of first-degree relatives refused any screening in spite of their increased colorectal cancer risk.Key words:
colorectal neoplasms – screening – risk factors – family history
Autoři: P. Vítek 1, 2; I. M. Kajzrlíková 2; J. Bureš 3; J. Chalupa 2
Působiště autorů: Lékařská fakulta Ostravské Univerzity v Ostravě, děkan doc. MUDr. Arnošt Martínek, CSc. 1; Beskydské Gastrocentrum, Interní oddělení, Nemocnice Frýdek-Místek, p. o., primář MUDr. Petr Vítek 2; II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 3
Vyšlo v časopise: Vnitř Lék 2011; 57(12): 1057-1061
Kategorie: 70. narozeniny prof. MUDr. Petra Dítě, DrSc.
Souhrn
Úvod:
Příbuzní I. stupně nemocných s kolorektálním karcinomem (KRK) mají vyšší riziko tohoto onemocnění, a proto je u nich indikováno kolonoskopické vyšetření v 40 letech. Cílem práce bylo posoudit jejich informovanost o riziku onemocnění, přítomnost dalších rizikových faktorů a jejich zapojení do screeningového programu.Soubor nemocných a metodika:
Soubor tvoří 62 nemocných po resekci KRK a 67 jejich příbuzných prvního stupně (42 % ze 160 oslovených). Ti vyplnili strukturovaný dotazník zaměřený na rizikové faktory KRK a zapojení do screeningu. Data byla statisticky zhodnocena.Výsledky:
O rizikových faktorech KRK a prevenci jeho vzniku bylo před diagnózou KRK dostatečně informováno pouze 18 % nemocných (11/62) a před dotazníkem 46 % příbuzných (31/67). Po diagnóze, respektive oslovení dotazníkem informovanost stoupla na 65 % nemocných (40/62, p < 0,001) a 66 % příbuzných (44/67, p = 0,024). Celkem 79 % příbuzných I. stupně (53/67) vědělo, že jejich příbuzenský vztah k nemocnému je spojen s vyšším rizikem KRK. Do screeningu KRK se v době obdržení dotazníku zapojilo 28 % příbuzných I. stupně (19/67). Nejčastější screeningovou metodou byl test na okultní krvacení ve stolici (TOKS) v 21 % případů (14/67), kolonoskopie byla provedena pouze u 7 % příbuzných (5/67). Průměrný věk zapojení do screeningového programu byl 53 let. 22 % příbuzných I. stupně (15/67) se do screeningového programu nehodlá zapojit ani v budoucnu.Závěry:
Informovanost nemocných po resekci KRK a jejich příbuzných I. stupně o rizikových faktorech vzniku KRK je poměrně nízká a významně stoupá až po diagnóze onemocnění (nemocní s KRK) nebo při aktivním oslovení formou dotazníku. Příbuzní I. stupně si jsou vědomi svého vyššího rizika onemocnění KRK, vyplývajícího z onemocnění jejich příbuzného, jejich sledování je však nedostatečné. Screening je prováděn pouze u malé části příbuzných, ve většině případů pak nevhodnými nástroji (TOKS) a rovněž v pozdějším věku, než je doporučeno. Téměř 1/4 příbuzných nemá ani v budoucnu zájem o žádnou formu screeningu KRK bez ohledu na své osobní riziko.Klíčová slova:
kolorektální karcinom – screening – rizikové faktory – rodinná anamnézaÚvod
Kolorektální karcinom (KRK) je nejčastějším dědičně se vyskytujícím nádorovým onemocněním. Nemocní s rodinnou anamnézou příbuzného s diagnózou KRK nebo pokročilého adenomu před 60. rokem věku mají 2krát vyšší riziko onemocnění než běžná populace [1]. Výše rizika přímo souvisí s počtem členů rodiny s KRK a jejich věkem v době diagnózy. Dle metaanalýzy Johnse je riziko více než 2krát vyšší pro příbuzného I. stupně s KRK, více než 4krát vyšší pro více příbuzných a asi 4krát vyšší pro příbuzného s věkem pod 45 let v době diagnózy KRK. Nemocní s příbuzným s pokročilým adenomem pak mají rovněž dvojnásobné riziko KRK oproti průměrné populaci [2]. Na rozdíl od definovaných syndromů se zvýšeným rizikem kolorektálního karcinomu (familiární adenomatózní polypóza, Lynchův syndrom) není v současném celopopulačním screeningu KRK v ČR pro příbuzné I. stupně (PPS) vyhrazen zvláštní screeningový protokol [3,4].
Máme již dostatek důkazů pro tvrzení, že preventivní kolonoskopické vyšetření přímých rodinných příslušníků je součástí správné klinické praxe. Právě mezi příbuznými nemocných s kolorektálním karcinomem bychom měli o implementaci screeningových metod co nejvíce usilovat. Přestože se jedná o zdánlivě jednoduché opatření, klinická realita je velmi často odlišná.
Vznik kolorektálního karcinomu je ovšem také vždy výsledkem interakce genomu pacienta a rizikových faktorů jeho životního stylu. Pozitivní změny životního stylu občanů jsou celospolečensky žádoucí a jejich ovlivnění je do značné míry mimo možnosti zdravotnických pracovníků. Je však pravděpodobné, že u pacientů se zvýšeným rizikem je jejich klinický význam větší než u zbytku populace, a pokus o jejich ovlivnění by proto měl být součástí preventivně léčebné intervence.
Cílem naší práce bylo posoudit a srovnat výskyt rizikových faktorů KRK a jejich znalost u nemocných po resekci KRK a jejich příbuzných I. stupně. Současně jsme se zaměřili na zhodnocení současného stavu screeningu KRK u příbuzných I. stupně nemocných s KRK a jejich ochoty zapojit se do tohoto screeningu v budoucnu.
Soubor nemocných a metodika
Zkoumaný soubor sestává z 2 samostatných částí: nemocní po resekci KRK a jejich příbuzní I. stupně (PPS).
Nemocní po resekci KRK: soubor tvoří celkem 62 nemocných po resekci KRK, kteří byli v rámci dispenzárního sledování odesláni v období od října roku 2005 do července roku 2007 ke kolonoskopickému vyšetření na endoskopické pracoviště Beskydského gastrocentra Nemocnice ve Frýdku-Místku. Se všemi nemocnými byl vypracován rodokmen a vyplněn dotazník se zaměřením na diagnózu KRK, rizika KRK a jejich znalost. Všem nemocným byly vydány dotazníky pro všechny jejich příbuzné I. stupně (PPS) k předání uvnitř rodiny. Celkem tak bylo vydáno 160 dotazníků (53 pro sourozence, 107 pro děti). Všichni nemocní po resekci KRK souhlasili s doručením dotazníků svým PPS, nejvíce bylo vydáno celkem 6 dotazníků u 2 nemocných po resekci KRK. Dotazníky byly kromě rizik KRK zaměřeny i na dosavadní screening KRK u PPS. Dotazníky pro PPS byly vydávány s průvodním vysvětlujícím dopisem a názorným návodem k vyplnění. K dotazníkům byla přiložena obálka s předepsanou zpětnou adresou pracoviště a nalepenou platnou známkou.
Příbuzní I. stupně (PPS): soubor tvoří celkem 67 PPS (26 sourozenců, 41 potomků) nemocných po resekci KRK, kteří vyplnili příslušný dotazník a odeslali jej poštou k vyhodnocení.
Oba soubory byly posouzeny metodami deskriptivní statistiky a k posouzení významnosti rozdílů mezi skupinami byly použity χ2 test a oboustranný Fischerův exaktní test. Analýzy byly provedeny s pomocí programů SPSS verze 19 a Statistica verze 9.
Výsledky
Z oslovených pacientů po resekci KRK dotazník vyplnilo všech 62 nemocných. U příbuzných I. stupně dotazník vyplnilo celkem 42 % oslovených (67/160). Compliance s vyplněním dotazníku byla u sourozenců (49 %, 26 z 53 oslovených) mírně vyšší než u potomků (38 %, 41 ze 107 oslovených). Základní charakteristika obou souborů je uvedena v tab. 1.
Tab. 1. Základní charakteristika souboru nemocných po resekci KRK a jejich PPS. 
O rizikových faktorech KRK a prevenci jeho vzniku bylo před diagnózou KRK dostatečně informováno pouze 18 % nemocných (11/62). V pooperačním období ještě před zařazením do studie informovanost nemocných stoupla na 65 % (40/62), což je statisticky významné (χ2 p < 0,001). Celkem 12 pacientů (19,4 %) mělo v rodině pokrevního příbuzného s KRK (11 jed-noho, 1 dva). Dle provedeného rodokmenu nesplňoval žádný nemocný diagnostická kritéria Lynchova syndromu (Amsterdam II). Z nehereditárních rizikových faktorů byl u nemocných po resekci KRK přítomen diabetes mellitus u 19 nemocných (31 %), idiopatický střevní zánět u 3 (5 %, 1krát Crohnova choroba, 2krát ulcerózní kolitida). 50 % aktivních kuřáků přestalo kouřit po operaci, 26 % nemocných provedlo pozitivní změny diety (zvýšení množství ovoce a zeleniny, vlákniny, redukce červeného masa). Pohybová aktivita po operaci byla zvýšená proti období před diagnózou u 10 (16 %) nemocných, ke snížení po operaci naopak došlo u 29 (47 %) nemocných. 23 (37 %) nemocných pak udalo pohybovou aktivitu před operací i po ní stejnou. Nemocní užívali kyselinu acetylsalicylovou v 23 případech (37 %) a nesteroidní antirevmatika v 20 případech (32 %).
Výsledky srovnání vybraných parametrů životního stylu nemocných po resekci KRK a jejich příbuzných I. stupně jsou uvedeny v tab. 2. V tab. 3 a 4 je pak uvedeno samostatné srovnání s příbuznými I. stupně – sourozenci a příbuznými I. stupně – potomky.
Tab. 2. Srovnání skupiny nemocných po resekci KRK a skupiny PPS. 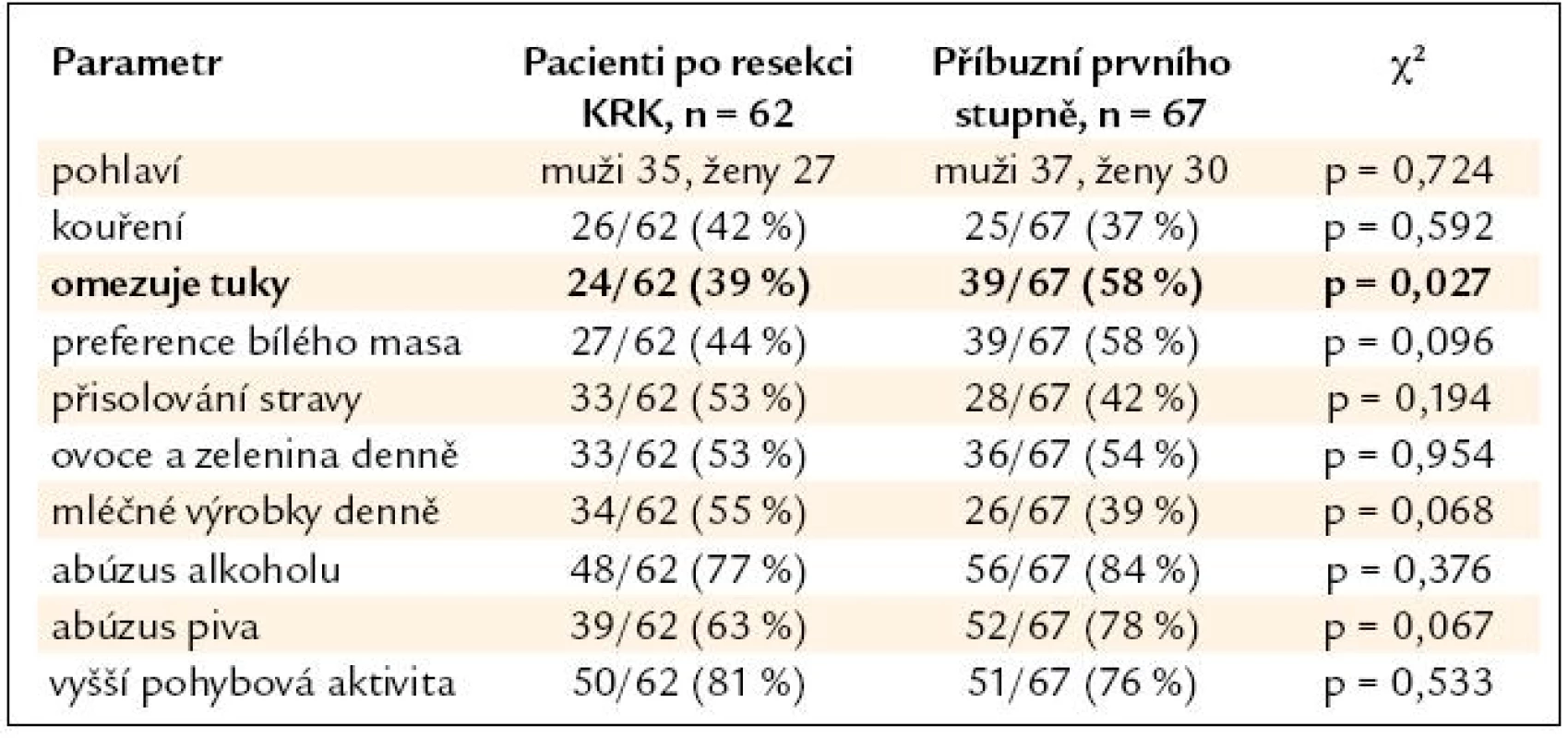
Tab. 3. Srovnání skupiny nemocných po resekci KRK a podskupiny PPS – sourozenců. 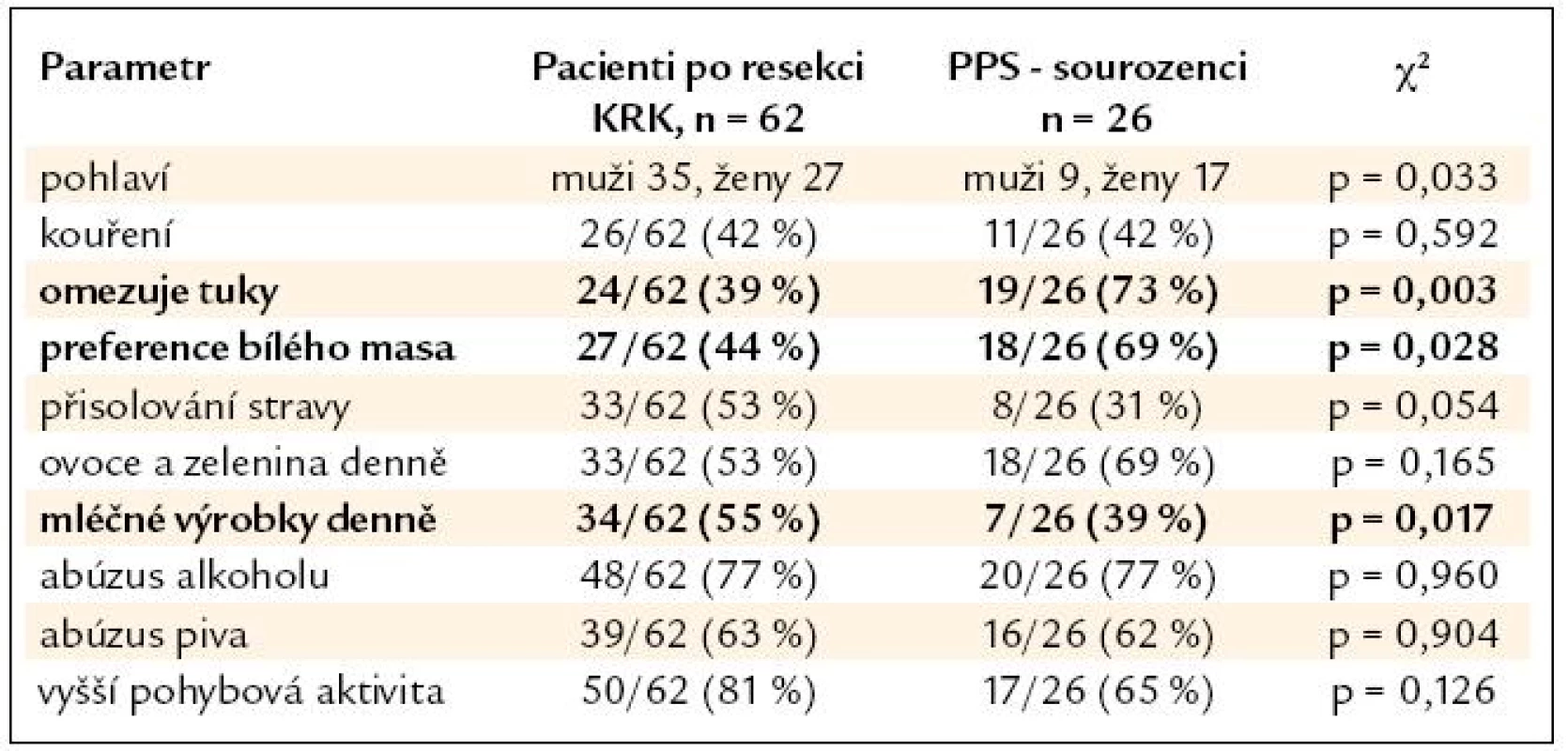
Tab. 4. Srovnání skupiny nemocných po resekci KRK a podskupiny PPS – potomků. 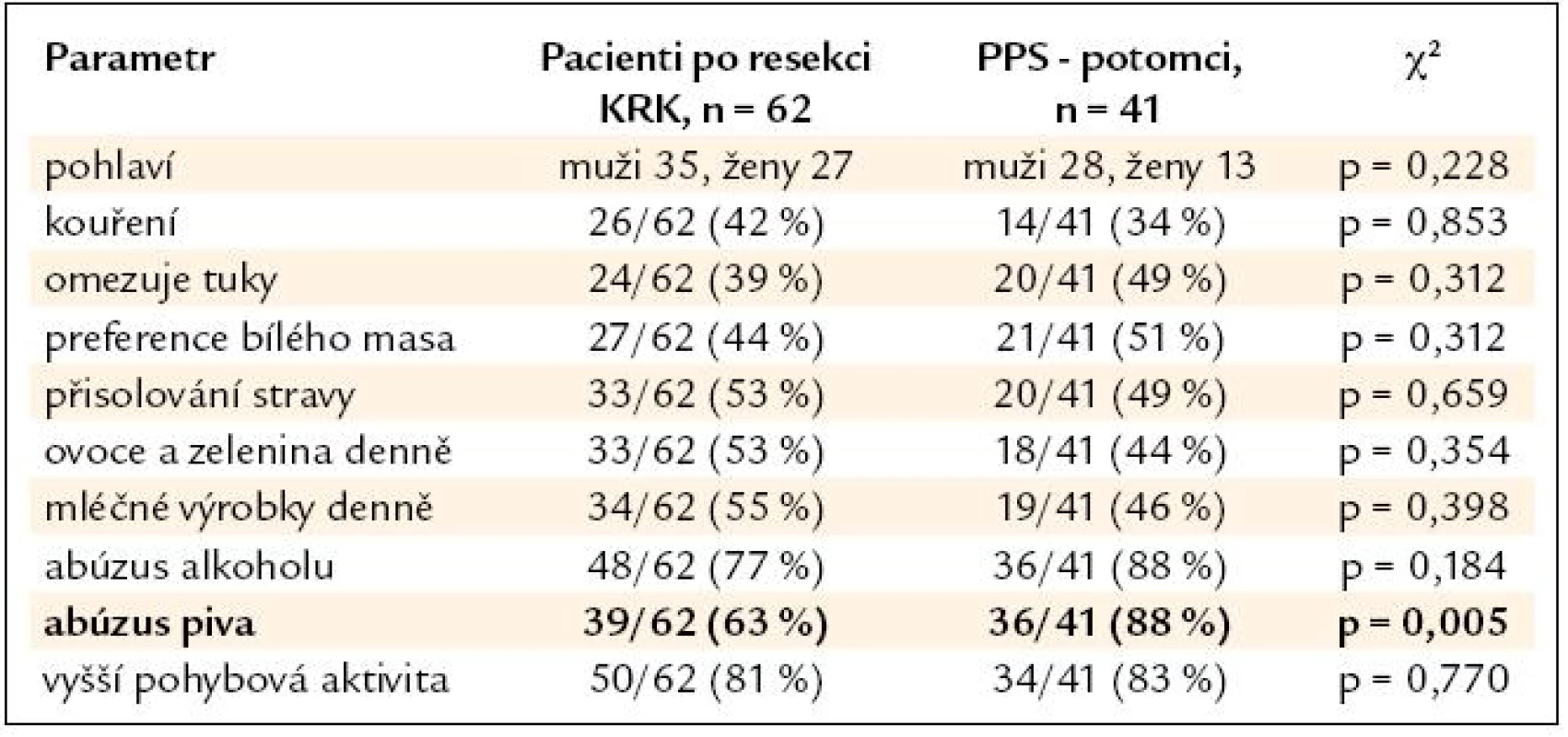
Celkem 79 % PPS (53/67) vědělo, že jejich příbuzenský vztah k nemocnému je spojen s vyšším rizikem kolorektálního karcinomu. O rizikových faktorech KRK a prevenci jeho vzniku bylo před obdržením dotazníku dostatečně informováno 46 % PPS (31/67). Po přečtení průvodního dopisu a vyplnění dotazníku informovanost stoupla na 66 % (44/67), což je statisticky významné (χ2 p = 0,024). Do screeningu KRK se v době obdržení dotazníku již zapojilo 19 PPS (28 %). Průměrný věk zapojení do screeningového programu byl 53 let (minimální 18, maximální 73, SD ± 13,05). Metody použité ve screeningu a posouzení podskupiny ve věku nad 40 let jsou uvedeny v tab. 5.
Tab. 5. Použité metody screeningu u PPS. 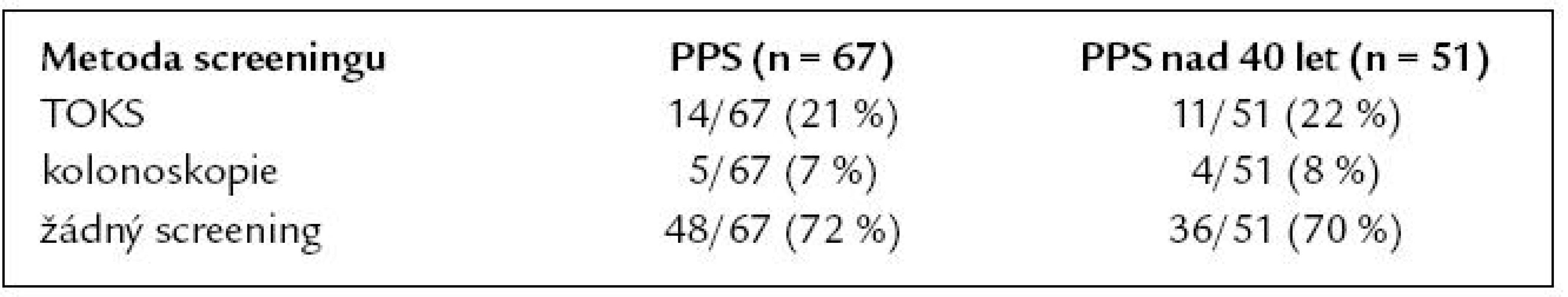
Na základě informací z dotazníku a průvodního dopisu uvedlo dalších 33 (49 %) PPS, že se aktivně zapojí do screeningového programu. Zbývajících 15 PPS (23 %) se do screeningového programu nehodlá zapojit ani v budoucnu. Postoje ke screeningu u všech PPS a u PPS nad 40 let jsou uvedeny v tab. 6. Při porovnání podskupin PPS dle věkové hranice 40 a 50 let nebyl prokázán statisticky významný rozdíl v compliance se screeningem mezi mladšími a staršími PPS (pro věkovou hranici 40 let p = 0,743 – oboustranný Fisherův exaktní test, pro věkovou hranici 50 let p = 0,664 – χ2).
Tab. 6. Compliance PPS se screeningem KRK. 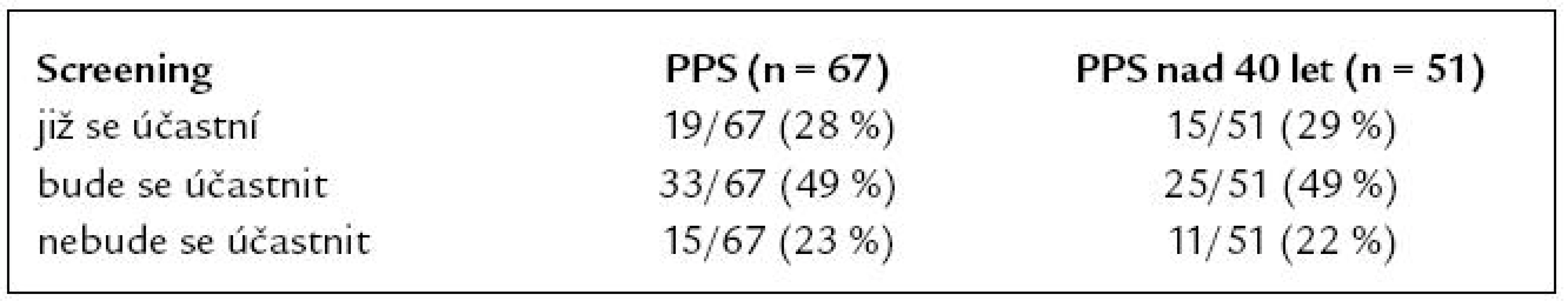
Diskuze
Rodinná anamnéza je kromě věku nejvýznamnějším a současně jedním z nejběžnějších rizikových faktorů KRK. Odhaduje se, že asi 10 % populace má v rodině přímého příbuzného s KRK, a tedy nejméně 2–3násobně vyšší riziko KRK [2,5]. Je prokázáno, že u příbuzných nemocných s KRK je vnímání rizika KRK zvýšeno, tato skutečnost platí především pro ženy [6]. V naší studii tuto skutečnost potvrzujeme. Zvýšeného rizika vyplývajícího z rodinné anamnézy si bylo vědomo 79 % PPS, což představuje téměř dvojnásobek respondentů při srovnání s všeobecnou populací v ČR (44 % zná familiární riziko) [7]. Odlišná je ovšem situace v případě ostatních nehereditárních rizikových faktorů KRK. Nemocní s KRK v dotazníku udávali poznání nehereditárních rizik KRK až v souvislosti s diagnózou onemocnění, PPS pak potvrdili významné zlepšení informovanosti až v souvislosti s oslovením prostřednictvím studie.
V nehereditárních rizikových faktorech se skupiny nemocných po resekci KRK a jejich příbuzných I. stupně významně lišily pouze u sourozenců, jejichž odpovědi naznačují významný posun k zdravějšímu životnímu stylu (nižší příjem tuků, preference bílého masa), u potomků byl naopak zjištěn významně vyšší abúzus piva. Nemocní po resekci KRK a jejich PPS se významně nelišili v BMI (průměr v pásmu nadváhy v obou skupinách) ani v zastoupení kuřáků (více než 1/3 v obou skupinách). Je tedy pravděpodobné, že kromě sdílení familiárního rizika se na celkovém riziku onemocnění KRK u PPS významně podílí i sdílení rizikových faktorů životního stylu uvnitř jednotlivých rodin. Přínos intervence životního stylu je pravděpodobný u zdravých PPS, kdy můžeme předpokládat minimalizaci nehereditárního rizika. Intervence životního stylu je ovšem doporučena American Cancer Society i u nemocných po resekci KRK během léčby a v následujícím období dispenzarizace. Vyšší fyzická aktivita a nepřítomnost obezity jsou u nemocných s KRK spojeny s delším přežitím [8]. Dle Meyehardtovy studie z roku 2007 bylo přežití nemocných po resekci KRK ve stadiu III významně negativně asociováno s přetrvávajícím dodržováním tzv. „západní“ diety [9]. V našem souboru nemocných po resekci KRK provedlo pozitivní změny diety po operaci 26 % pacientů, u 47 % nemocných však po operaci došlo ke snížení pohybové aktivity. Užívání kyseliny acetylsalicylové ani nesteroidních antirevmatik není u nemocných po resekci KRK ani jejich PPS z indikace prevence KRK doporučeno. Potenciální přínos převyšují rizika dlouhodobé terapie [10]. V našem souboru užívala tyto léky 1/3 nemocných, vždy z jiné (kardiovaskulární) indikace.
U PPS je doporučeno zahájit kolonoskopický screening již ve 40 letech nebo 10 let před věkem diagnostikovaného nemocného v rodině [11]. Mladší věk je doporučen proto, že riziko KRK u PPS ve 40 letech je zhruba stejné jako riziko KRK u populace s průměrným rizikem v 50 letech věku [5]. V případě negativního nálezu při kolonoskopickém vyšetření je u asymptomatického nemocného doporučena další kolonoskopie v 5letém intervalu. Studie prokázaly až dvojnásobnou prevalenci adenomů u PPS ve věku 50 let proti populaci s průměrným rizikem (27–39 % vs 13–26 %) [12,13]. Menges ve své studii v roce 2006 prokázal významně vyšší prevalenci adenomů u PPS již ve věku 40–50 let při porovnání s běžnou populací (18,9 % vs 8,2 %, p = 0,001). Byla rovněž prokázána tendence k proximální lokalizaci neoplazií u PPS, kdy 52 % neoplastických lézí bylo lokalizováno proximálně od sigmoidea [14]. U PPS proto nelze použít sigmoideoskopii jako akceptovatelnou metodu screeningu. U PPS je dále prokázán až 4krát rychlejší růst adenomů [15], což ospravedlňuje kratší screeningové intervaly.
Některou z forem screeningu absolvovalo v naší studii pouze 30 % PPS, kterým bylo v době vyplnění dotazníku 40 a více let (15/51). Převažoval screening formou testu na okultní krvácení do stolice (TOKS) u 11 PPS, pouze u 4 PPS byla použita kolonoskopie jako správná screeningová metoda. Jako adekvátní můžeme tedy hodnotit sledování PPS pouze v 8 % případů (4/51). Jako nevhodné se rovněž jeví pozdní načasování screeningu, průměrný věk nemocných v době vstupu do screeningového programu byl 53 let, tedy o 13 let vyšší, než je doporučeno. U PPS nemocných s KRK je prokázána téměř dvojnásobná compliance se screeningem KRK proti běžné populaci [16]. V našem souboru rozhodnutí zúčastnit se screeningu projevilo 78 % PPS (52/67). Zajímavou skutečností je, že zbývajících 22 % PPS se nehodlá screeningu v budoucnu účastnit, bez ohledu na znalost svého zvýšeného rizika. V tomto negativním stanovisku nebyl významný rozdíl mezi mladšími a staršími PPS.
Zjevným limitem validity získaných epidemiologických informací od PPS je nízká návratnost dotazníků. Zatímco nemocní po resekci KRK souhlasili s poskytnutím odpovědí při osobní intervenci ve 100 % případů, jejich PPS odeslali vyplněný dotazník pouze v 42 % (67/160). Hlavatý et al ve své práci s PPS z roku 2006 dosáhli návratnosti pouze 17,3 % [17]. Určitou bariérou intervence uvnitř rodiny může být předávání dotazníků a informací prostřednictvím nemocného s KRK, který se obvykle spíše zaměřuje na řešení vlastního zdravotního stavu. V naší studii předání dotazníků všem PPS deklarovalo 100 % nemocných po resekci KRK. Pokud jsme zpětně analyzovali návratnost dotazníků pouze z rodin, kde jsme obdrželi odpověď alespoň jednoho PPS, tak byla významně vyšší (66 %). Je tedy možné, že někteří nemocní s KRK dotazníky svým příbuzným vůbec nepředali. Na základě těchto výsledků se přikláníme k přímému oslovení PPS, např. prostřednictvím telefonického rozhovoru [18]. Na základě výsledků této studie byl v Beskydském Gastrocentru, Interním oddělení Nemocnice ve Frýdku-Místku v 2. pololetí roku 2008 zahájen prospektivní projekt JAKO JEDNA RODINA, zaměřený na aktivní přímé telefonické oslovení všech PPS nemocných s KRK a nemocných s pokročilým adenomem [18]. Cílem projektu je kromě adekvátního screeningu a komplexní intervence životního stylu nemocných i jejich příbuzných také identifikace části PPS, kteří mohou mít z dispenzárního programu největší benefit.
Závěry
- Informovanost nemocných po resekci KRK a jejich příbuzných I. stupně o rizikových faktorech vzniku KRK je poměrně nízká a významně stoupá až po diagnóze onemocnění (nemocní s KRK) nebo při aktivním oslovení formou dotazníku (příbuzní I. stupně).
- Sourozenci nemocných s KRK ve své stravě významně více omezují tuky, preferují bílé maso a přijímají méně mléčných výrobků při srovnání se stravovacími zvyky nemocných s KRK. U potomků nemocných s KRK je pak významně více zastoupen abúzus piva. V ostatních sledovaných parametrech se skupiny nemocných a jejich příbuzných I. stupně významně nelišily, u obou skupin je vysoká prevalence nadváhy a kouření. Zjištěná data podtrhují nutnost komplexní intervence životního stylu v rámci celé rodiny nemocného s KRK, tedy včetně jeho příbuzných I. stupně.
- Příbuzní I. stupně si jsou vědomi svého vyššího rizika onemocnění KRK, vyplývajícího z onemocnění jejich příbuzného. Jejich sledování je však nedostatečné. Screening je prováděn pouze u malé části příbuzných, ve většině případů pak nevhodnými nástroji (test na okultní krvácení do stolice – TOKS) a rovněž v pozdějším věku, než je doporučeno. Téměř 1/4 příbuzných nemá ani v budoucnu zájem o žádnou formu screeningu KRK bez ohledu na své osobní riziko.
MUDr. Petr Vítek
www.kolonoskopie.cz
e-mail: vitek@kolonoskopie.cz
Doručeno do redakce: 29. 9. 2011
Zdroje
1. Routine aspirin or nonsteroidal anti-inflammatory drugs for the primary prevention of colorectal cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2007; 146 : 361–364.
2. Almendingen K, Hofstad B, Vatn MH. Does a family history of cancer increase the risk of occurrence, growth, and recurrence of colorectal adenomas? Gut 2003; 52 : 747–751.
3. Burt RW. Impact of family history on screening and surveillance. Gastrointest Endosc 1999; 49: S41–S44.
4. Doyle C, Kushi LH, Byers T et al. 2006 Nutrition, Physical Activity and Cancer Survivorship Advisory Committee; American Cancer Society. Nutrition and physical activity during and after cancer treatment: an American Cancer Society guide for informed choices. CA Cancer J Clin 2006; 56 : 323–353.
5. Guillem JG, Forde KA, Treat MR et al. Colonoscopic screening for neoplasms in asymptomatic first-degree relatives of colon cancer patients. A controlled, prospective study. Dis Colon Rectu 1992; 35 : 523–529.
6. Hlavatý T, Lukáč L, Huorka M et al. Rodinný výskyt kolorektálnych karcinómov a ich skríning medzi prvostupňovými príbuznými pacientov s rakovinou hrubého čreva a konečníka. Čes a Slov Gastroent a Hepatol 2005; 59 : 285–292.
7. Johns LE, Houlston RS. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 2001; 96 : 2992–3003.
8. Kajzrlikova I, Vitek P, Chalupa J et al. Direct counselling program for first-degree relatives of colorectal cancer and advanced adenoma patients is effective. Gut 2009; 58 (Suppl II): A144.
9. Menges M, Fischinger J, Gärtner B et al. Screening colonoscopy in 40 - to 50-year-old first-degree relatives of patients with colorectal cancer is efficient: a controlled multicentre study. Int J Colorectal Dis 2006; 21 : 301–307.
10. Meyerhardt JA, Niedzwiecki D, Hollis D et al. Association of dietary patterns with cancer recurrence and survival in patients with stage III colon cancer. JAMA 2007; 298 : 754–764.
11. Montgomery GH, Erblich J, DiLorenzo T et al. Family and friends with disease: their impact on perceived risk. Prev Med 2003; 37 : 242–249.
12. Pariente A, Milan C, Lafon J et al. Colonoscopic screening in first-degree relatives of patients with „sporadic“ colorectal cancer: a case-control study. The Association Nationale des Gastroenterologues des Hôpitaux and Registre Bourguignon des Cancers Digestifs (INSERM CRI 9505). Gastroenterology 1998; 115 : 7–12.
13. Rex DK, Johnson DA, Anderson JC et al. American College of Gastroenterology. American College of Gastroenterology guidelines for colorectal cancer screening 2009. Am J Gastroenterol 2009; 104 : 739–750.
14. Thrasher JF, Cummings KM, Michalek AM et al. Colorectal cancer screening among individuals with and without a family history. J Public Health Manag Pract 2002; 8 : 1–9.
15. UEGF Public Awareness of Colorectal Cancer in Europe. A Summary Report Prepared for the UEGF Public Affairs Committee by IPSOS Research 2003.
16. Winawer SJ, Zauber AG, Gerdes H et al. Risk of colorectal cancer in the families of patients with adenomatous polyps. National Polyp Study Workgroup. N Engl J Med 1996; 334 : 82–87.
17. Zavoral M. The screening of sporadic colorectal cancer. Vnitř Lék 2004; 50 (Suppl 1): S103–S106.
18. Zavoral M, Suchanek S, Majek O et al. Population screening of colorectal carcinoma in the Czech Republic. Rozhl Chir 2009; 88 : 292–294.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 12- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Hydroresponzivní krytí v epitelizační fázi hojení rány
- Význam hydratace při hojení ran
- Statinová intolerance
-
Všetky články tohto čísla
- Screening celiakie u pacientů s osteoporózou a osteopenií
- Očekávaná zátěž nádory jícnu, žaludku a kolorekta ve světě
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Keratinové fragmenty jako sérologický ukazatel u nemocných s jaterní chorobou
- Existuje racionální terapie Crohnovy nemoci a ulcerózní kolitidy?
- Ablatívna liečba rektosigmoideálnych prekanceróz a včasných karcinómov
- Přežívání nemocných po TIPS ve Fakultní nemocnici Hradec Králové
- Souběžný výskyt alkoholické jaterní cirhózy a chronické pankreatitidy
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Nedostatečný screening a malá informovanost o rizikových faktorech u příbuzných I. stupně nemocných s kolorektálním karcinomem
- K jubileu prof. MUDr. Petra Dítě, DrSc.
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
- Epidemiologie Helicobacter pylori
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy


