-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
Screening of Malnutrition Risk Versus Indicators of Nutritional Status and Systemic Inflammatory Response in Newly Diagnosed Lung Cancer Patients
Background:
Most lung cancers are already advanced at the time of diagnosis. In these patients, a frequent symptom is protein‑energy malnutrition, often diagnosed prior to oncological treatment. Malnutrition results in poor tolerance of treatment and increased morbidity and mortality.Methods:
Nutritional Risk Screening (NRS) 2002 adapted for oncological patients was used to assess the risk of undernutrition in a group of 188 lung cancer patients. The risk was evaluated on a 6 - point scale according to common signs of nutritional status and tumor and its treatment risk factors. A score of 3 and more (called „nutritional risk“) means a significant risk of malnutrition. Furthermore, pretreatment nutritional characteristics were evaluated in patients (including the value of BMI) and laboratory values indicating malnutrition/ acute phase response (albumin/ C ‑ reactive protein – CRP).Results:
Acceptable NRS score was found in 50.6%, while in 45.3% was suggested into risk of malnutrition („nutritional risk“). Only 6.6% of our patients had a BMI less than 20 kg/ m2. Significant differences in albumin and CRP values in various categories of NRS were confirmed.Conclusion:
Initial signs of cancer malnutrition may be overlooked in patients who fall within or above the range of BMI for adequate weight, although these patients may be at significant risk of malnutrition. The indicators of nutritional status and systemic inflammatory responses were significantly associated with resulting values NRS score.Key words:
nutritional status – nutritional risk – lung cancer – acute phase response
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
12. 1. 2014Accepted:
16. 2. 2014
Autoři: P. Illa; M. Tomíšková; J. Skřičková
Působiště autorů: Klinika nemocí plicních a TBC LF MU a FN Brno
Vyšlo v časopise: Klin Onkol 2014; 27(4): 261-268
Kategorie: Původní práce
Souhrn
Východisko:
U pacientů s nádorovým onemocněním plic je častým symptomem proteino ‑ energetická malnutrice, která je zjišťována ještě před zahájením onkologické léčby. Systémová zánětlivá odezva je jedním z nejdůležitějších faktorů vedoucích k metabolickým změnám a prohlubujících nutriční alteraci se všemi svými negativními následky na průběh léčby.Metody:
V souboru 188 nově diagnostikových pacientů s karcinomem plic byla k ohodnocení rizika malnutrice použita validovaná metoda Nutričního rizikového screeningu (NRS) 2002 upraveného pro onkologickou praxi. Dále byly u pacientů hodnoceny předléčebné nutriční charakteristiky a laboratorní hodnoty ukazující na malnutrici/ reakci akutní fáze (albumin/ C ‑ reaktivní protein – CRP). Výsledné hodnoty byly korelovány s hodnotou skóre NRS.Výsledky:
„Akceptovatelné“ skóre nutričního screeningu bylo zjištěno u 50,6 % pacientů, zatímco 45,3 % pacientů bylo kategorizováno do „nutričního rizika“. Ačkoliv skoro polovina pacientů byla kategorizována NRS do „nutričního rizika“, pouze 6,6 % všech našich pacientů mělo hodnotu BMI nižší než 20 kg/ m2. Byl také prokázán statisticky významný rozdíl v hodnotách albuminu i CRP v různých kategoriích NRS. Pacienti spadající do kategorie „nutričního rizika“ mají statisticky významně nižší hodnoty albuminu (p = 0,001, rS = – 0,373) a vyšší hodnoty CRP (p = 0,001, rS = 0,290) než pacienti s „akceptovatelným“ skóre NRS.Závěr:
Počáteční známky nádorové malnutrice mohou být velmi často přehlédnuty u pacientů, kteří spadají do nebo i nad škálu BMI pro přiměřenou hmotnost, ačkoliv jsou tito pacienti ve významném riziku malnutrice. Jednotliví ukazatelé výživového stavu a systémové zánětlivé odpovědi, kteří se v mnoha studiích uplatňují v předpovědi výsledku léčby a celkového přežití, byli signifikantně asociováni s výslednými hodnotami skóre NRS.Klíčová slova:
výživový stav – nutriční riziko – karcinom plic – systémová zánětlivá odezvaÚvod
Častým symptomem u pacientů s nádorovým onemocněním plic je proteino ‑ energetická malnutrice se ztrátou hmotnosti, která se vyskytuje ještě před stanovením diagnózy [1 – 3]. Ztráta hmotnosti má vliv na zpoždění anebo dokončení protinádorové terapie a je obecně považována za důležitý a nezávislý ukazatel horší prognózy [3 – 6].
Jak se ztrátou tělesné hmotnosti pacienta, tak i s progresí nádoru a kratším přežitím bývá asociována také systémová zánětlivá odezva [7 – 9]. Je jedním z nejdůležitějších faktorů vedoucích k metabolickým změnám a je často významným rysem téměř všech druhů solidních nádorů [10]. Asi 80 % pacientů s nově diagnostikovaným inoperabilním nemalobuněčným karcinomem plic (non small cell lung cancer – NSCLC) vykazuje známky reakce akutní fáze [11]. Mnoho onkologických pacientů s malnutricí má zvýšené sérové hladiny zánětlivých markerů (např. C ‑ reaktivní protein), přičemž plazmatické hladiny jiných jaterních proteinů klesají, příkladem je albumin. Tento vztah je u různých nádorů podobný [12]. Malnutrice spojená s hypoalbuminemií a přítomností systémové zánětlivé odezvy tak může ovlivňovat farmakokinetiku a farmakodynamiku různých protinádorových léčiv [13,14].
Protože malnutrice nepříznivě ovlivňuje prognózu onkologických pacientů, měla by být zabezpečena její včasná identifikace. Jako jednoduchý nástroj schopný spolehlivě identifikovat pacienty v malnutričním riziku se nabízí Nutriční rizikový screening 2002 (Nutritional Risk Screening 2002 – NRS 2002) [15,16]. Pracovní skupina nutriční péče v onkologii při České onkologické společnosti (ČOS) vzala za základ NRS a jeho upravená verze byla v září 2007 ČOS schválena a doporučena pro klinickou onkologickou praxi v ČR [17].
Cílem naší studie bylo definovat v souboru pacientů s nově diagnostikovaným bronchogenním karcinomem míru rizika podvýživy. Dále byla zhodnocena korelace v praxi používaných ukazatelů nutričního stavu (vstupní procentuální ztráta hmotnosti, BMI, sérové hladiny albuminu) a systémové zánětlivé odpovědi (C ‑ reaktivního proteinu – CRP) s výslednou hodnotou skóre nutričního rizikového screeningu. Výše zmínění ukazatelé (či jejich kombinace) se v hojně publikovaných studiích uplatňují při predikci výsledků léčby a přežití [3 – 5,9 – 13].
Pacienti a metody
Analyzovaný soubor zahrnoval 188 nemocných s histologicky a/ nebo cytologicky nově diagnostikovaným bronchogenním karcinomem. Pacienti, kteří již měli v anamnéze předchozí léčbu nádorového onemocnění, radioterapii a/ nebo adjuvantní nebo paliativní chemoterapii, endokrinologické onemocnění nebo měli závažné zhoršení funkce životně důležitých orgánů, nebyli do analyzovaného souboru zahrnuti. Pacienti s chronickým onemocněním, souběžně přítomnou infekcí (zvýšení hladin CRP spolu se zvýšenými hladinami leukocytů), byli vyloučeni z analýzy také. Pacienti, kteří již podstupovali léčbu, která by mohla interferovat s naměřenými laboratorními parametry albuminu a CRP (např. nesteroidní antiflogistika), byli sice do souboru zařazeni, ale byli vyloučeni z analýz těchto laboratorních parametrů.
U pacientů jsme hodnotili základní demografické charakteristiky (pohlaví, věk), nutriční charakteristiky (skóre NRS, včetně indexu tělesné hmotnosti – BMI – a hodnoty zhubnutí za posledních šest měsíců), klinické charakteristiky (histologický typ nádoru a klinické stadium onemocnění) a laboratorní hodnoty poukazující na malnutrici/ reakci akutní fáze (albumin/ CRP). Pacientova výška byla hodnocena pomocí kalibrované stupnice a hmotnost zjišťována pomocí kalibrované váhy. Pacient byl zvážen nalačno v lehkém oděvu bez obuvi s přesností na 0,5 kg.
K ohodnocení rizika malnutrice byla použita metoda NRS upraveného pro onkologickou praxi [17]. Jednotlivá bodová ohodnocení vycházela z metodiky pro vyhodnocení NRS [15 – 17]. Výsledná hodnota skóre NRS ≥ 3 označuje „nutriční riziko“. Pacienti s hodnotou skóre NRS < 3 byli kategorizováni do „akceptovatelného“ skóre NRS.
Ohodnocení výživového stavu a výše uvedených laboratorních hodnot proběhlo krátce před začátkem terapie kvůli omezení vlivu léčby na tyto hodnocené parametry.
Metody statistické analýzy
Pro srovnání spojitých proměnných v kategoriích NRS byla použita neparametrická Kruskal ‑ Wallis analýza rozdílů (analysis of variance – ANOVA). Pro srovnání kategorizovaných proměnných v kategoriích NRS byl použit M ‑ L Chi ‑ kvadrát test. Pro odhad korelačního koeficientu v různých kategoriích NRS byl použit Spearmanův korelační koeficient. Za statisticky významné byly považovány p < 0,05. Všechny statistické testy byly oboustranné. Statistická analýza byla provedena pomocí softwaru STATISTICA.
Výsledky
Základní charakteristika souboru
V analyzovaném souboru nemocných s potvrzenou diagnózou bronchogenního karcinomu bylo 133 mužů (70,7 %) a 55 žen (29,3 %), s mediánem věku 64,9 roku (rozmezí 29 – 83 let). NSCLC byl diagnostikován u 66,0 % pacientů a malobuněčný karcinom plic (small cell lung cancer – SCLC) u 27,7 % pacientů. Klinickým stadiem I bylo klasifikováno 10,6 % pacientů, klinickým stadiem II 4,3 % pacientů, klinickým stadiem IIIA 9,6 % a IIIB 25,0 % pacientů. Nejčastěji zastoupeným klinickým stadiem bylo stadium IV (48,6 %). U 2,1 % případu nebylo klinické stadium stanoveno.
Nutriční charakteristika souboru
V období před zahájením léčby byl v analyzovaném souboru nemocných medián aktuální hmotnosti (kg) 74,0 (39,5 – 117,0), medián výšky (cm) pacientů 172,0 (148,0 – 193,0), medián BMI (kg/ m2) byl 25,4 (15,4 – 48,0) a medián ztráty hmotnosti (%) byl – 5,3 ( – 26,7 – 6,7). Nutno poukázat, že pouze 6,6 % pacientů mělo BMI nižší než 20 kg/ m2, ačkoliv asi polovina nemocných (47,3 %) vykazovala před léčbou ztrátu hmotnosti > 5 % ze své obvyklé stabilní hmotnosti (tab. 1). Ztrátu hmotnosti do 5 % své obvyklé hmotnosti vykazovalo 46,3 % pacientů a u 6,4 % pacientů zhubnutí stanoveno nebylo.
Tab. 1. Vstupní hodnoty procentuální ztráty hmotnosti před zahájením léčby. 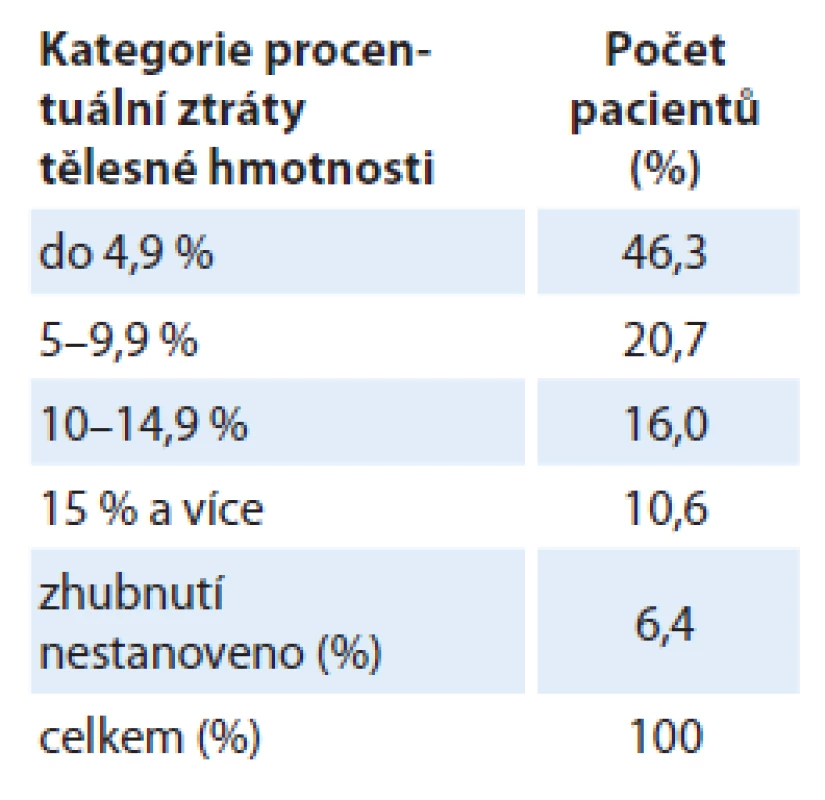
Hodnotou skóre NRS bylo v souboru kategorizováno do „nutričního rizika“ celkem 45,3 % pacientů (NRS ≥ 3). Do „akceptovatelného“ skóre (NRS < 3) bylo kategorizováno 50,6 % pacientů. U osmi pacientů (4,3 %) nebylo NRS stanoveno.
Korelace hodnoty zhubnutí (%)a indexu tělesné hmotnosti s hodnotou skóre NRS
V našem analyzovaném souboru byl prokázán statisticky významný rozdíl v hodnotě % zhubnutí v různých kategoriích NRS (p < 0,001). Lze tedy říci, že s rostoucí hodnotou skóre NRS rostl i hmotnostní úbytek našich pacientů (graf 1). Pacienti v „nutričním riziku“ měli statisticky významně vyšší hmotnostní úbytek než pacienti s „akceptovatelným“ skóre NRS (graf 2). Byl také prokázán statisticky významný rozdíl v hodnotě BMI v různých kategoriích NRS (p < 0,001). S rostoucím NRS tedy klesala i hodnota BMI (graf 3). Také pacienti v „nutričním riziku“ měli statisticky významně nižší BMI než pacienti s „akceptovatelným“ skóre NRS (p < 0,001) (graf 4). Analýza je shrnuta v tab. 2.
Graf 1. Korelace % zhubnutí s různými hodnotami NRS (p < 0,001). 
Graf 2. Korelace % zhubnutí dle zařazení pacienta do kategorie NRS (p < 0,001). 
Graf 3. Korelace hodnoty BMI s různými hodnotami NRS (p < 0,001). 
Graf 4. Korelace hodnoty BMI dle zařazení pacienta do kategorie NRS (p < 0,001). 
Tab. 2. Závislost hodnoty procentuální ztráty hmotnosti/indexu tělesné hmotnosti na hodnotě skóre NRS. 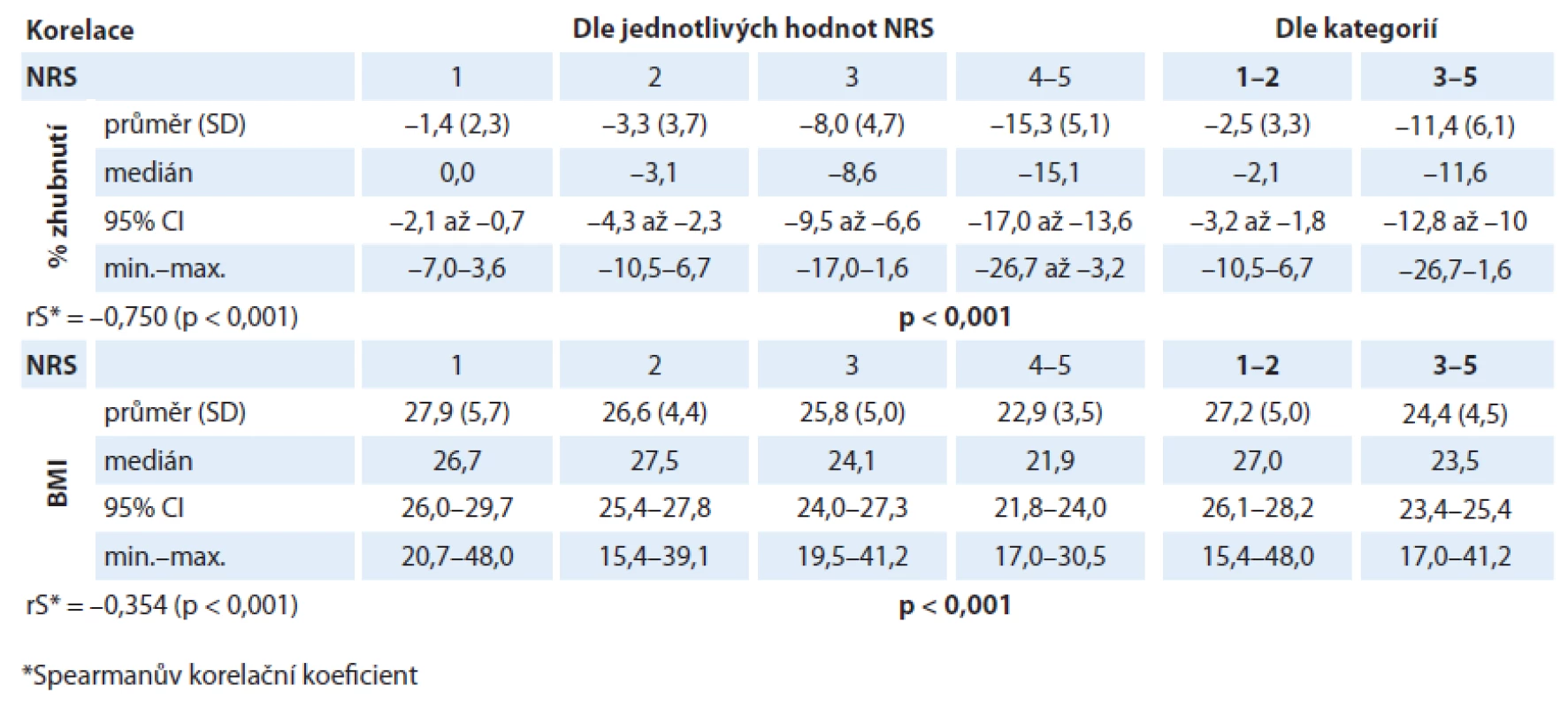
Korelace sérové hladiny albuminu a C ‑ reaktivního proteinu s hodnotou skóre NRS
Při analýze byl prokázán statisticky významný rozdíl v hodnotách albuminu (p = 0,001) i CRP (p = 0,001) v různých kategoriích NRS. V případě albuminu dochází u pacientů s rostoucí hodnotou NRS k poklesu jeho sérové hladiny (rS = – 0,373; p < 0,001; graf 5). Také pacienti v „nutričním riziku“ mají statisticky významně nižší hodnoty albuminu než pacienti s „akceptovatelným“ skóre NRS (p < 0,001; graf 6). V případě CRP dochází u pacientů s rostoucí hodnotou NRS k nárůstu jeho sérové hladiny (rS = 0,290; p < 0,001; graf 7). Také pacienti v „nutričním riziku“ mají statisticky významně vyšší hodnoty CRP než pacienti s „akceptovatelným“ skóre NRS (p = 0,001; graf 8). Analýza je shrnuta v tab. 3.
Graf 5. Korelace hodnoty albuminu s hodnotami NRS (p < 0,001). 
Graf 6. Korelace hodnoty albuminu dle zařazení pacienta do kategorie NRS (p < 0,001). 
Graf 7. Korelace hodnoty CRP s hodnotami NRS (p = 0,001). 
Graf 8. Korelace hodnoty CRP dle zařazení pacienta do kategorie NRS (p = 0,001). 
Tab. 3. Závislost hodnoty albuminu a CRP na hodnotě skóre NRS. 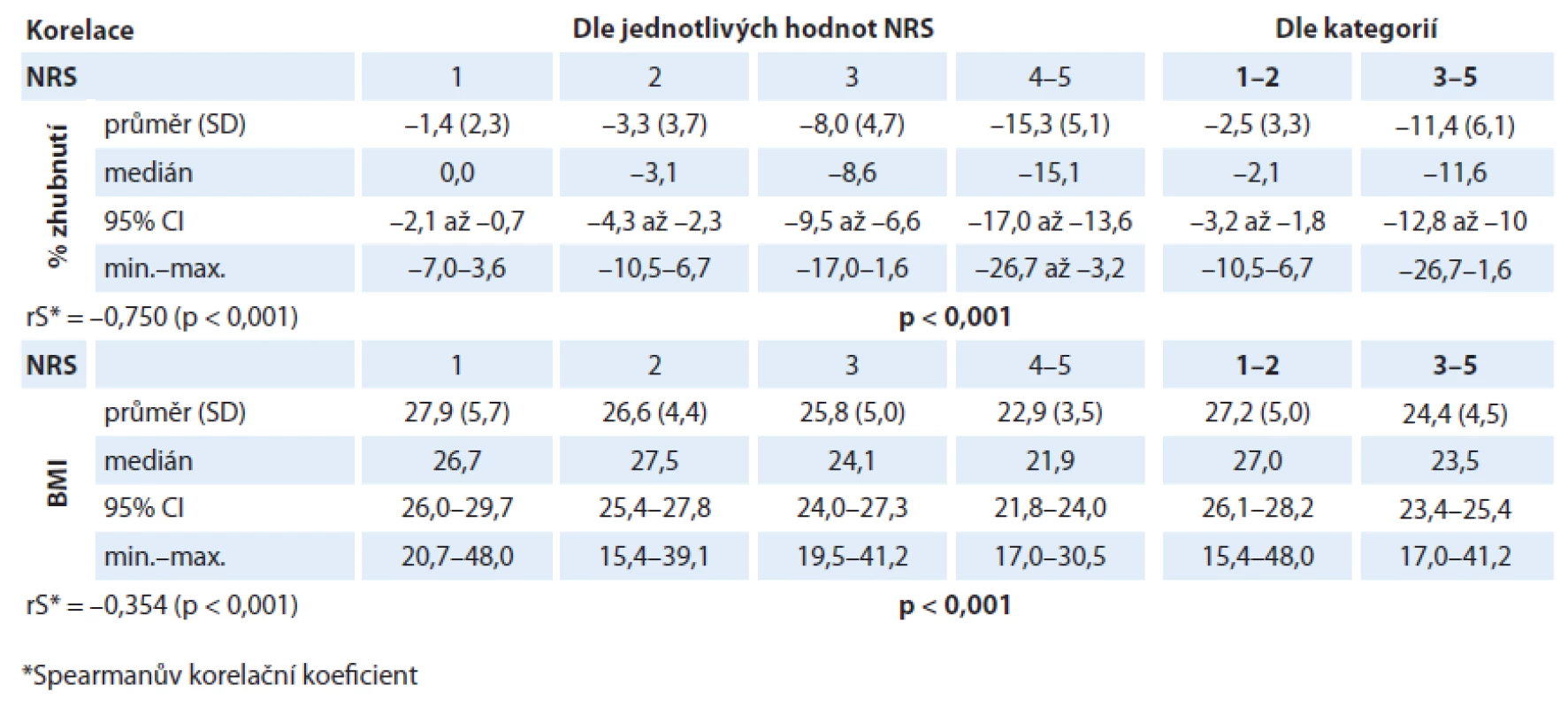
Diskuze
V našem souboru pacientů s nově diagnostikovaným bronchogenním karcinomem (n = 188) byl před zahájením léčby 45,3% výskyt „nutričního rizika“, tj. skóre NRS ≥ 3. Ve srovnání s ostatními nástroji screeningu malnutrice je zjištěná hodnota vcelku srovnatelná. Například Arietta et al ve své studii pacientů s pokročilým stadiem karcinomu plic ohlásili, že 51 % pacientů (n = 100) ohodnocených prostřednictvím SGA bylo v mírném a závažném stupni malnutrice již před zahájením léčby [18]. Také Gioulbasanis et al ve studii u pacientů s metastatickým karcinomem plic (n = 171), jejichž výživový stav před léčbou byl ohodnocený metodou Mini Nutritional Assessment (MNA), poukázali, že 46,2 % pacientů bylo ohroženo rizikem malnutrice [19]. V rozsáhlé studii hodnotící nutriční stav ambulantních pacientů (n = 1 453) napříč spektrem onkologických diagnóz bylo podle skóre NRS celkově 32 % pacientů v „nutričním riziku“ [20]. Tato hodnota je sice odrazem široké variability výskytu malnutrice v populaci ambulantních pacientů, avšak nadále zůstává velmi významná. Orreval et al dokonce poukazují na to, že u onkologických pacientů v paliativní péči (n = 621) může výskyt skóre „nutričního rizika“ ohodnoceného metodou NRS vzrůst až na hodnotu kolem 70 % [21]. Prezentované rozsahy výskytu malnutrice (nebo jejího rizika) ať již u ambulantních, nebo hospitalizovaných pacientů si již zaslouží zabývat se nutriční problematikou nejen v pneumoonkologii, ale u onkologických pacientů obecně.
Z některých studií vyplývá, že ztráta hmotnosti jen 5 % mění u pacientů znatelně imunologickou odpověď, autonomní regulaci, plicní a srdeční funkční testy a má u chemoterapeuticky léčených pacientů signifikantně nepříznivý efekt na přežití [1,3,22]. Tato procentuální hodnota zhubnutí tedy koresponduje s mediánem předléčebné procentuální ztráty hmotnosti v souboru našich pacientů ( – 5,3; rozptyl – 26,7 – 6,7 %). Hmotnostní ztrátu > 5 % vykazovala před léčbou asi polovina (47,3 %) našich nemocných.
Co se týká závislosti procentuální ztráty hmotnosti na hodnotě skóre NRS, byl prokázán statisticky významný rozdíl v procentech zhubnutí v různých kategoriích NRS. Pacienti v „nutričním riziku“ měli statisticky významně vyšší medián hmotnostního úbytku (%) před zahájením léčby ( – 11,6 vs – 2,1; p < 0,001) než pacienti s „akceptovatelným“ skóre (graf 2).Můžeme tak říci, že s rostoucím NRS rostl i hmotnostní úbytek (rS = – 0,750; p < 0,001). Hodnota zhubnutí před léčbou se tedy nabízí jako alternativa k hodnotě skóre NRS. Na druhou stranu je nutné poznamenat, že přesné procentuální vyčíslení hmotnostní ztráty před léčbou bývá v praxi často poněkud subjektivní hodnotou, a proto přispívá jen k jednomu parametru v multidimenzionálním nutričním ohodnocení. Je tedy potřeba také připustit, že i při vyhodnocování NRS jde o částečně subjektivní zařazení pacienta do příslušné bodové kategorie. Vyhodnocení je tedy limitováno spolehlivým zhodnocením zdravotnickým personálem. Nicméně u NRS bylo studiemi prokázáno, že má nízkou observační variabilitu mezi zdravotníky a navíc také vysokou schopnost predikce klinických výsledků [15,20]. Také v naší předchozí studii u pacientů s karcinomem plic se podařilo potvrdit, že hodnota NRS predikuje odpověď nádoru na léčbu [23].
Ačkoliv tedy skoro polovina (45,3 %) našich pacientů s nově diagnostikovaným bronchogenním karcinomem byla kategorizována NRS do „nutričního rizika“, většina měla přiměřenou tělesnou hmotnost. Nasvědčuje tomu medián BMI 25,4 (rozmezí 15,4 – 48,0) při mediánu věku 64,9 roku (rozmezí 29 – 83 roků). I když hodnota BMI korelovala s hodnotou NRS (rS = – 0,354, p < 0,001), u pacientů v kategorii NRS ≥ 3 byl medián BMI 23,5 (rozmezí 17,0 – 41,2). Za normální hodnotu BMI, bez ohledu na pohlaví a věk, se považuje rozmezí 18,5 – 24,9 kg/ m2. V pokročilejším věku však bývá hodnota BMI zřetelně vyšší než u mladších jedinců. Proto se považuje u pacientů starších než 65 roků za normální rozmezí BMI 22 – 29 kg/ m2, takže pro malnutrici může svědčit již hodnota nižší než 22 kg/ m2 [16,24]. Vidíme tedy, že medián hodnoty BMI byl i u pacientů v „nutričním riziku“ stále v rozmezí normálu pro BMI. Počáteční známky nádorové malnutrice tedy bývají velmi často přehlédnuty u pacientů, kteří spadají do nebo nad škálu indexu tělesné hmotnosti pro přiměřenou hmotnost i navzdory významné ztrátě předchozí hmotnosti před zahájením léčby. Segura et al ve své studii ukázali, že ačkoliv 70 % pacientů (n = 781) v pokročilém klinickém stadiu nádorového onemocnění (různé diagnózy) před zahájením léčby signifikantně zhublo (medián zhubnutí 5,6 %), jen 6,5 % pacientů mělo BMI nižší než 18,5 kg/ m2 [25]. Také naší studií u pacientů s bronchogenním karcinomem lze potvrdit, že pouhá hodnota BMI tedy často není schopna identifikovat pacienty v riziku malnutrice. Pouze 6,6 % všech našich pacientů mělo hodnotu BMI nižší než 20 kg/ m2 (věk 64,9 roku, rozmezí 29 – 83 roků), což je mezní hodnota rizikové hodnoty BMI při kategorizaci starších pacientů (nad 65 let) dle NRS [16,17].
Protože hodnoty sérových hladin albuminu a CRP hrají svoji roli v predikci nežádoucích účinků a prognóze přežití onkologických pacientů, a to nezávislé na klinickém stadiu nádoru [11,12,26], úkolem této práce bylo ohodnotit korelaci předléčebné sérové koncentrace albuminu a CRP s hodnotou skóre NRS. V úvahu byla brána vylučující kritéria zmíněná v metodice.
Pacienti v „nutričním riziku“ měli statisticky významně nižší hodnoty sérové koncentrace albuminu než pacienti s „akceptovatelným“ skóre NRS (p = 0,001). Jednotlivé hodnoty sérových hladin albuminu různých kategorií NRS jsou uvedeny v tab. 3 a grafech 5, 6. Lze pozorovat, že s rostoucí hodnotou skóre NRS klesá hodnota koncentrace albuminu (rS = – 0,373; p < 0,001). Ačkoliv medián hodnoty albuminu u pacientů v „nutričním riziku“ (38,0; rozmezí 23,8 – 48,5) ještě není na stanovené hranici hypoalbuminemie (fyziologická koncentrace sérového albuminu je 35 – 53 g/ l), této hranici se blíží. Gioulbasanis et al ve své studii u pacientů s metastatickým karcinomem plic, jejichž nutriční stav byl hodnocen screeningovou metodou MNA, ukázali, že medián sérové hladiny albuminu klesal spolu se závažnějším skóre nutričního stavu [19]. Také Forrest et al ve své studii pozorovali menší dysbalance v sérových hladinách albuminu od fyziologické hodnoty, kdy pouze 10 % pacientů (n = 109) s inoperabilním karcinomem plic mělo před léčbou sérovou hypoalbuminemii (≤ 35 g/ l) [27].
Je nutné ovšem podotknout, že při interpretaci výsledků vyhodnocování sérové hladiny albuminu je potřeba vždy přihlédnout k tomu, že snížení sérového albuminu může také odrážet funkční stav jater nebo stav hydratace pacienta. Sérová hladina albuminu tedy vždy neukazuje jen na stav výživy [28]. Někteří autoři navíc poukazují, že snížené hladiny albuminu mohou být následkem jeho zvýšeného transkapilárního průniku kvůli zvýšené mikrovaskulární propustnosti [29].
Podobná situace nastává při hodnocení sérových hladin CRP. Také byl (stejně tak jako u albuminu) prokázán statisticky významný rozdíl v hladinách CRP v různých kategoriích NRS, kdy se zvyšující se hodnotou skóre NRS rostla i plazmatická hodnota CRP (rS = 0,290; p = 0,001). Medián hodnoty CRP u pacientů v „nutričním riziku“ ve srovnání s pacienty s „akceptovatelným skóre“ NRS byl výrazně zvýšený (22,3 vs 7,8; p < 0,001). Jednotlivé hodnoty sérových hladin CRP různých kategorií NRS jsou uvedeny v tab. 3 a grafech 7, 8. Není vyloučeno, že u našich pacientů by mohla zvýšená plazmatická hodnota CRP odrážet nepodchycenou přidruženou infekci u některého pacienta. Akutní infekce jsou obvykle spojené s výrazným zvýšením sérové koncentrace CRP společně s navýšením počtu leukocytů během relativně krátké doby. Pokud je tomu tak, byl by tento jev spojen také se zvýšením hladiny leukocytů a takový pacient by pak unikl našim vylučujícím kritériím. Nicméně také ve studii autorů Forresta et al byly sérové koncentrace CRP před zahájením léčby zvýšeny (CRP > 10 mg/ l) až u 75 % pacientů s karcinomem plic (n = 109). Ačkoli bílé krvinky korelovaly s koncentrací CRP, bylo v této studii také uvedeno, že velikost tohoto vztahu byla malá [27]. To naznačuje, že zde infekce nemusela být hlavním podnětem k zvýšené koncentraci CRP. Slabý stupeň tkáňového stresu kvůli přítomnosti nádorových buněk má za následek zánětlivou odpověď a stává se podnětem pro produkci CRP. Taktéž ve výše zmíněné studii u pacientů s metastatickým karcinomem plic, jejichž nutriční stav byl hodnocen metodou MNA, se ukázalo, že při vyšším skóre nutričního rizika byl rovněž medián sérové hladiny CRP signifikantně zvýšen [19]. Tento výsledek tedy koresponduje s výsledkem naší studie. Scott et al ve své studii u pacientů s pokročilým karcinomem plic (n = 106) ukázali, že s rostoucí koncentrací CRP roste i podíl zhoršeného nutričního stavu a horší prognózy [30]. Zvýšené koncentrace CRP vlivem aktivního neoplastického procesu u onkologicky nemocných tak poukazují na vývoj syndromu nádorové kachektizace [10,29]. Mnoho studií ukazuje, že tyto markery systémové zánětlivé odpovědi korelují s tolerancí a klinickými výsledky léčby (včetně přežití) u různých solidních nádorů nezávisle na klinickém stadiu. Můžeme tedy říci, že výše uvedenými signifikantními korelacemi hodnoty skóre NRS s těmito laboratorními markery se potvrzuje použitelnost NRS také při předpovědi výsledků léčby.
Závěr
Ačkoliv se pacienti před zahájením onkologické léčby zdáli být na první pohled v relativně dobrém výživovém stavu, téměř polovina našich pacientů spadala do rizikové kategorie NRS. Při absenci provedení screeningu rizika malnutrice tak mohou být tito pacienti přehlédnuti a v průběhu léčby se u nich může nutriční alterace dále prohlubovat se všemi negativními důsledky. NRS tak nabízí doplňkovou informaci, která může přispět k plánování onkologické léčby u nutričně rizikových pacientů ve smyslu vhodně zvolené podpůrné terapie (včetně zahájení časné nutriční intervence).
Signifikantní korelace hodnoty skóre NRS s často v praxi používanými ukazateli nutričního stavu a systémové zánětlivé odpovědi, které v mnoha studiích korelují s prognózou přežívání u různých onkologických diagnóz, poukazuje také na možnou použitelnost NRS při předpovědi výsledků léčby. NRS tak nabízí standardizovaný, jednoduchý a ověřený přístup screeningu rizika malnutrice v onkologické praxi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Petr Illa
Klinika nemocí plicních a TBC LF MU a FN Brno
Jihlavská 20
635 00 Brno
e-mail: petr.illa@seznam.cz
Obdrženo: 12. 1. 2014
Přijato: 16. 2. 2014
Zdroje
1. Dewys WD, Begg C, Lavin PT et al. Prognostic effect of weight loss prior to chemotherapy in cancer patients. Am J Med 1980; 69(4): 491 – 497.
2. Chute CG, Greenberg ER, Baron J et al. Presenting conditions of 1539 population‑based lung cancer patients by cell type and stage in New Hampshire and Vermont. Cancer 1985; 56(8): 2107 – 2111.
3. Ross PJ, Ashley S, Norton A et al. Do patients with weight loss have a worse outcome when undergoing chemotherapy for lung cancers? Br J Cancer 2004; 90(10): 1905 – 1911.
4. Buccheri G, Ferrigno D. Importance of weight loss definition in the prognostic evaluation of non‑small‑cell lung cancer. Lung Cancer 2001; 34(3): 433 – 440.
5. Jeremic B, Milicic B, Dagovic A et al. Pretreatment clinical prognostic factors in patients with stage IV non‑small cell lung cancer (NSCLC) treated with chemotherapy. J Cancer Res Clin Oncol 2003; 129(2): 114 – 122.
6. van Eys J. Effect of nutritional status on response to therapy. Cancer Res 1982; 42 (Suppl): 747 – 753.
7. Simons JP, Schols AM, Buurman WA et al. Weight loss and low body cell mass in males with lung cancer: relationship with systemic inflammation, acute phase response, resting energy expenditure and catabolic and anabolic hormones. Clin Sci 1999; 97(2): 215 – 223.
8. Martín F, Santolaria F, Batista N et al. Cytokine levels (IL‑6 and IFN ‑ gamma), acute phase response and nutritional status as prognostic factors in lung cancer. Cytokine 1999; 11(1): 80 – 86.
9. O‘Gorman P, McMillan DC, McArdle CS. Prognostic factors in advanced gastrointestinal cancer patients with weight loss. Nutr Cancer 2000; 37(1): 36 – 40.
10. Tisdale MJ. Cachexia in cancer patients. Nat Rev Cancer 2002; 2(11): 862 – 871.
11. Forrest LM, McMillan DC, McArdle CS et al. Comparison of an inflammation‑based prognostic score (GPS) with performance status (ECOG) in patients receiving platinum‑based chemotherapy for inoperable non‑small‑cell lung cancer. Br J Cancer 2004; 90(9): 1704 – 1705.
12. McMillan DC. An inflammation‑based prognostic score and its role in the nutrition‑based management of patients with cancer. Proc Nutr Soc 2008; 67(3): 257 – 262. doi: 10.1017/ S0029665108007131.
13. Murry D, Riva L, Poplack DG. Impact of nutrition on pharmacokinetics of antineoplastic agents. Int J Cancer 1998; 11 : 48 – 51.
14. Watanabe H, Yamamoto N, Tamura T et al. Study of paclitaxel and dose escalation of cisplatin in patients with advanced non‑small cell lung cancer. Jpn J Clin Oncol 2003; 33(12): 626 – 630.
15. Kondrup J, Rasmussen HH, Hamberg O et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003; 22(3): 321 – 336.
16. Kondrup J, Allison SP, Elia M et al. ESPEN guidelines for nutrition screening 2002. Clin Nutr 2003; 22(4): 415 – 421.
17. Tomíška M. Nutriční rizikový screening v onkologické ambulanci. Medical Tribune 2008; 1 : 15.
18. Arrieta O, Michel Ortega RM, Villanueva ‑ Rodríguez Get al. Association of nutritional status and serum albumin levels with development of toxicity in patients with advanced non‑small cell lung cancer treated with paclitaxel‑cisplatin chemotherapy: a prospective study. BMC Cancer 2010; 50(10). doi: 10.1186/ 1471 ‑ 2407 ‑ 10 ‑ 50.
19. Gioulbasanis I., Baracos VE, Giannousi Z et al. Baseline nutritional evaluation in metastatic lung cancerpatients: Mini Nutritional Assessment versus weightloss history. Ann Oncol 2011; 22(4): 835 – 841. doi: 10.1093/ annonc/ mdq440.
20. Bozzetti F, Mariani L, Lo Vullo S et al. The nutritional risk in oncology: a study of 1453 cancer outpatients. Support Care Cancer 2012; 20(8): 1919 – 1928. doi: 10.1007/ s00520 ‑ 012 ‑ 1387 ‑ x.
21. Orreval Y, Tishelman C, Permert J et al. Nutritional support and risk status among cancer patients in palliative home care service. Support Care Cancer 2009; 17(2): 153 – 161. doi: 10.1007/ s00520 ‑ 008 ‑ 0467 ‑ 4.
22. Deng H, Seidel K, Bruemmer B et al. Impact of patient weight on non‑relapse mortality after marrow transplantation. Bone Marrow Trasnplant 1995; 15(3): 461 – 468.
23. Tomíšková M, Tomíška M, Illa P et al. Nutritional risk screening predicts tumor response in lung cancer patients. J Thor Oncol 2009; 4(9): 435 – 436.
24. Lochs H, Allison SP, Meier R et al. Introductory to the ESPEN Guidelines on Enteral Nutrition:terminology, definitions and general topics. Clin Nutr 2006; 25(2): 180–186.
25. Segura A, Pardo J, Jara C et al. An epidemiological evaluation of the prevalence of malnutrition in Spanish patients with locally advance or metastatic cancer. Clin Nutr 2005; 24(5): 801 – 814.
26. Forrest LM, McMillan DC, McArdle CS et al. Evaluation of cumulative prognostic scores based on the systemic inflammatory response in patients with inoperable non‑small‑cell lung cancer. Br J Cancer 2003; 89(6): 1028 – 1030.
27. Forrest LM, McMillan DC, McArdle CS et al. Comparison of an inflammation‑based prognostic score (GPS) with performance status (ECOG) in patients receiving platinum‑based chemotherapy for inoperable non‑small‑cell lung cancer. Br J Cancer 2004; 90(9): 1704 – 1706.
28. Doweiko JP, Nompleggi DJ. The role of albumin in human physiology and pathophysiology, Part III: albumin and disease states. J Parent Enteral Nutr 1991; 15(4): 476 – 482.
29. Tomíška M. Syndrom nádorové anorexie a kachexie. Onkologie 2008; 2(3): 174–178.
30. Scott HR, McMillan DC, Forrest LM et al. The systemic inflammatory response, weight loss, performance status and survival in patients with inoperable non‑small cell lung cancer. Br J Cancer 2002; 87(3): 264 – 267.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuality z odborného tiskuČlánek Soutěž o nejlepší práciČlánek Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorůČlánek Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativaČlánek Aktuality z odborného tiskuČlánek Liga proti rakovině
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Aktuality z odborného tisku
- Soutěž o nejlepší práci
- Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů
- Brazilský příběh mutace p53 R337H
- Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem – data z reálné klinické praxe v České republice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
- Vzťah medzi sérovou hladinou karboanhydrázy IX, hypoxiou a rádiorezistenciou nádorov hlavy a krku
- Soutěž na podporu autorských týmů publikujících v zahraničních odborných titulech
- Vliv anakinry na cytokinové profily a profily lymfocytů/ monocytů u pacienta s Erdheim-Chesterovou nemocí
- Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorů
- Informace z České onkologické společnosti
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativa
- Aktuality z odborného tisku
- Liga proti rakovině
- Pacient s Cowdenovým syndromem způsobeným mutací v genu PTEN (archiv 2. LF UK a FN v Motole)
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Brazilský příběh mutace p53 R337H
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



