-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů
Anticipated Efficacy of HPV Vaccination in Prophylaxis Against Nongenital Cancers
Background:
There is a considerable number of studies on the efficacy HPV (human papillomavirus) vaccination against different cancers but relevant information is scattered in diverse journals. This paper is a review summarizing current knowledge of the potential of HPV vaccination against all HPV related cancers.Aim:
HPV infection is probably the most frequent sexually transmitted disease. At least 13 HPV genotypes are classified as carcinogenic or probably carcinogenic in respect to cervical cancer. Almost 100% of cervical cancers are linked to HPV infection. HPV 16 and HPV 18 are the most frequently involved genotypes and account together for approximately 70% of cervical cancer in the world. Persistent high‑risk HPV infection is responsible for a significant proportion of vulvar, vaginal, anal and penile carcinomas. The virus has also been implicated in oncogenesis of head and neck cancers, including oropharyngeal cancers. HPV infection can play an important role in cancerogenesis of lung, esophagus, breast, and colon and rectum. On the contrary, published results indicate that HPV infection is not associated with prostate oncogenesis. Strong predominance of HPV 16 has been reported for all HPV‑associated cancer sites. Generally, it is estimated that approximately 5.2% of all cancers are associated with oncogenic HPV infection. Currently, there are two vaccines on the market; quadrivalent Silgard® (Gardasil®) and bivalent CervarixTM. Large trials for both vaccines have shown efficacy against HPV‑related infection and disease. Efficacy has been very high in HPV naive subjects to vaccine related types. While HPV vaccination is currently approved for the prevention of cervical cancer, it also has the potential in the prevention of all HPV‑associated malignancies. The Czech republic belongs to countries that cover HPV vaccination of girls at the age of 13 – 14 years by general health insurance. Overall impact of this vaccination remains to be evaluated. The new issues of the role of HPV in oncogenesis, as well as the potential effect of HPV vaccination against HPV‑related nongenital cancers are discussed.Conclusion:
Approximately 5.2% of all human cancers are associated with oncogenic human papillomavirus infection. HPV vaccination against the most risky HPV oncotypes may cause a significant reduction of these cancers mainly in the HPV naive population.Key words:
human papillomavirus – anal cancer – penile cancer – head and neck cancer – esophageal cancer – lung cancer – colorectal cancer – recurrent respiratory papillomatosis
This study was supported by grant of Integral Agency of the Czech Ministry of Health No. NT14079-3/2013 and by project PRVOUK-P27/LF1/1.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
2. 2. 2014Accepted:
21. 5. 2014
Autoři: B. Sehnal 1; N. Vojáčková 2; Daniel Driák 1
; E. Kmoníčková 3; D. Vaňousová 2; K. Maxová 1; H. Neumannová 1; J. Sláma 4
Působiště autorů: Onkogynekologické centrum, Gynekologicko‑porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 1; Dermatovenerologická klinika 2. LF UK a Nemocnice Na Bulovce, Praha 2; Ústav radiační onkologie, Komplexní onkologické centrum, 1. LF UK a Nemocnice Na Bulovce, Praha 3; Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze 4
Vyšlo v časopise: Klin Onkol 2014; 27(4): 239-246
Kategorie: Přehled
Souhrn
Východiska:
Existuje mnoho studií o účinnosti HPV (human papillomavirus) vakcinace proti rozličným karcinomům, ale podstatné informace jsou publikovány v různých periodikách. Tento článek je přehledem shrnujícím současné znalosti o potenciální účinnosti HPV vakcinace proti všem HPV asociovaným karcinomům.Cíl:
HPV infekce je pravděpodobně nejčastějším sexuálně přenosným onemocněním. Minimálně 13 HPV genotypů je řazeno mezi kancerogenní nebo pravděpodobně kancerogenní ve vztahu k rakovině děložního hrdla. Prakticky 100 % cervikálních karcinomů je spojeno s HPV infekcí. HPV 16 a HPV 18 jsou nejvíce zastoupenými genotypy a celosvětově způsobují celkem přibližně 70 % cervikálních karcinomů. Perzistující vysoce riziková HPV infekce je zodpovědná za významnou část karcinomů vulvy, vaginy, penisu a anu. Vir je také obviňován z onkogeneze karcinomů hlavy a krku, včetně orofaryngeálních karcinomů. HPV infekce může hrát důležitou roli v karcinogenezi nádorů plic, jícnu, prsu a kolorektálního karcinomu. Na druhou stranu, výsledky dosud publikovaných studií naznačují, že karcinogeneze nádorů prostaty nemá souvislost s HPV infekcí. Vysoká dominance genotypu HPV 16 je uváděna pro všechny HPV asociované malignity. Předpokládá se, že přibližně 5,2 % všech zhoubných nádorů je spojeno s infekcí onkogenními lidskými papilomaviry. V současnosti jsou na trhu dvě vakcíny, kvadrivalentní Silgard® (Gardasil®) a bivalentní CervarixTM. Rozsáhlé studie ukázaly u obou vakcín významnou účinnost proti HPV infekcím a s nimi asociovaným onemocněním. Účinnost byla velmi vysoká převážně proti vakcinovaným genotypům u HPV naivních jedinců. HPV vakcinace je určena pro prevenci cervikálního karcinomu, nicméně její potenciál je v prevenci všech HPV asociovaných karcinomů. ČR patří mezi státy, kde je očkování proti HPV hrazeno pro dívky ve věku 13 – 14 let ze zdravotního pojištění. Celkový dopad tohoto očkování zatím není stanoven. Diskutovány jsou novinky o roli HPV v onkogenezi a potenciální efekt HPV vakcinace proti nongenitálním karcinomům ve vztahu s HPV infekcí.Závěr:
Přibližně 5,2 % všech lidských karcinomů je spjato s onkogenní infekcí lidským papilomavirem. HPV vakcinace proti nejrizikovějším HPV genotypům může způsobit významnou redukci těchto malignit převážně u HPV naivní populace.Klíčová slova:
lidský papilomavirus – rakovina anu – rakovina penisu – karcinomy hlavy a krku – rakovina jícnu – rakovina plic – kolorektální karcinom – rekurentní respiratorní papilomatózaÚvod
Infekce lidským papilomavirem (human papillomavirus – HPV) se přenáší nejčastěji během pohlavního styku a postihne alespoň jednou za život 75 – 80 % sexuálně aktivních osob [1,2].
První zmínka o vztahu mezi stylem pohlavního života a rozvojem rakoviny čípku se objevila již v roce 1847 v práci italského lékaře Rigoni ‑ Sterna, který zpozoroval, že onemocněním jsou často postiženy vdané ženy a vdovy, zatímco u panen a řádových sester se téměř neobjevuje. V roce 1907 Ciuffo vyslovil podezření, že výskyt genitálních bradavic způsobují miniaturní mikroby [3]. Ale teprve Della Torre v roce 1978 v Itálii a Laverty v Austrálii našli HPV partikule v kondylomatech vyskytujících se na děložním hrdle [4,5].
Práce německých virologů Dürsta a zur Hausena z počátku 80. let minulého století prokazovaly přítomnost DNA v biopsiích z karcinomů děložního hrdla. Během 90. let proběhly další molekulárně biologické, imunologické a epidemiologické studie, jejichž výsledky umožnily určit perzistující HPV infekci jako kauzální a nezbytnou podmínku pro kancerogenezi děložního hrdla. V roce 1995 International Agency for Research on Cancer (IARC) uzavřela, že je dostatek důkazů, aby byly genotypy HPV 16 a 18 klasifikovány jako lidské kancerogeny [6]. Tyto objevy vedly k určení infekce HPV jako příčiny rakoviny děložního hrdla a následně i jiných orgánů [7 – 9]. Profesor Harald zur Hausen obdržel v roce 2008 za své objevy Nobelovu cenu.
Na výzkumu etiopatogeneze karcinomu děložního hrdla se významně podílela i československá věda. Vonka a jeho spolupracovníci naopak vyloučili jakýkoliv podíl vlivu herpetické infekce (herpes simplex virus 2 – HSV ‑ 2) na rozvoji cervikální neoplazie a cervikálních karcinomů [10].
Lidské papilomaviry napadají epitel kůže (viry rodu α) nebo sliznice (viry rodu β) orofaryngeální a anogenitální oblasti přes malé defekty v epitelu [11,12]. Životní cyklus viru probíhá v epitelu infikovaného orgánu a není provázen viremií. Většina infekcí je přechodná a nezanechá žádné nebo jen nízké hladiny protilátek, které nechrání proti opakované infekci [13,14]. Reinfekce dokonce i stejným genotypem HPV probíhá za velmi podobných podmínek, jaké jsou u HPV naivních žen [15].
Dosud bylo identifikováno více než 130 HPV genotypů, které se dělí na nízce rizikové (low ‑ risk – LR) a vysoce rizikové (high‑risk – HR) podle potenciálu iniciovat kancerogenezi děložního hrdla [7]. Světová zdravotnická organizace (World Health Organisation – WHO) řadí mezi HR genotypy HPV zařazené do skupiny 1(HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) a skupiny 2A (HPV 68). Naopak viry ve skupině 2B (HPV 26, 53, 66, 67, 70, 73, 82), u kterých nejsou přímé důkazy pro kancerogenní potenciál na děložním hrdle, a viry ve skupině 3 (HPV 6, 11) se označují jako LR. Do skupiny 2B patří také genotypy HPV 5 a HPV 8, pro které jsou nepřesvědčivé důkazy, že se uplatňují v etiopatogenezi karcinomů kůže [16]. Podle rozsáhlé epidemiologické studie publikované Muñozovou jsou genotypy HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82 považované za kancerogenní a genotypy 26, 53, 66 za pravděpodobně kancerogenní [6]. Do skupiny HR HPV je tedy v současnosti řazeno 13 – 18 genotypů, ale za nejdůležitější pro vznik lidských malignit jsou považovány genotypy HPV 16, 18, 31, 33 a 45.
Předpokládá se, že přibližně 5,2 % ze všech humánních karcinomů je způsobeno infekcí onkogenními papilomaviry [17]. HPV infekce je v USA příčinou asi 90 % análních karcinonů, 65 % karcinomů pochvy, 50 % karcinomů vulvy, 35 % karcinomů penisu a 45–90 % orofaryngeálních karcinomů [18,19] a je jí přičítán vznik přibližně 25 000 karcinomů ročně (tab. 1) [20].
Tab. 1. Karcinomy asociované s HPV infekcí v USA v letech 2004–2007 [20]. ![Karcinomy asociované s HPV infekcí v USA v letech 2004–2007 [20].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/92b3cff29b798f5bbd13cc7e26e4426d.png)
Primární prevence malignit asociovaných s HPV infekcí
Principem primární prevence zhoubných nádorů asociovaných s HPV infekcí je zábrana rozvoje infekce vyvolávajícím činitelem – papilomavirem. Hlavní cestou přenosu je sexuální styk. Vzhledem k možnému přenosu HPV i pouhým kožním nebo slizničním kontaktem spočívá jediná reálná možnost primární prevence v profylaktické vakcinaci. Aby bylo dosaženo maximální ochrany, je třeba zahájit očkování alespoň 4 – 6 měsíců před začátkem pohlavního života. Koitarché je však událost zcela individuální. Podle provedených průzkumů v ČR má ve věku 15 let sexuální zkušenost 8,2 % dívek [21]. Aby byly zachyceny i rizikové skupiny dívek s časným zahájením pohlavního života, komise ACIP (Advisory Committee on Immunization Practices) při CDC (Centers for Disease Control and Prevention) v USA doporučuje rutinní očkování dívek ve věku 11 – 12 let. ESGO (European Society of Gynaecological Oncology) je pro širší věkové rozmezí 9 – 13 let. Nedoporučuje se očkovat osoby před dosažením 9. roku života. Imunogenita vakcín v tomto věku nebyla prokázána a není ani dostatek informací o jejich bezpečnosti. Lze však očkovat i jedince starší. Podle studií se dostatečně vysoké hladiny neutralizačních protilátek produkují u všech osob minimálně až do věku 55 let, v Austrálii je CervarixTM registrovaný pro ženy do věku 45 let. Výhodná je aplikace očkovací látky do stejné oblasti (deltový sval téže paže) pro lepší stimulaci imunologické odpovědi cestou stejných regionálních uzlin.
Vakcíny proti HPV infekci
Identifikace HR HPV jako primární příčiny cervikálního karcinomu a kompletní popis struktury genomu HPV se staly podmínkou pro přípravu rekombinantní vakcíny složené z vysoce purifikovaných, viru podobných částic (virus‑like particles – VLPs) tvořených hlavním papilomavirovým kapsidovým proteinem L1 [22]. Bylo objeveno, že je‑li v rekombinantních systémech dostatečné množství molekul hlavního kapsidového proteinu L1, tak jejich samovolným shlukováním vznikají viru podobné partikule, které jsou od virionů v elektronovém mikroskopu morfologicky nerozeznatelné. VLPs neobsahují žádnou virovou DNA a nemohou tak infikovat buňky ani se nemohou množit. Cílem vakcinace je navození tvorby vysokých hladin neutralizačních protilátek. Vývoj vakcín první generace byl zaměřen proti dvěma nejvíce rozšířeným onkogenním genotypům HPV 16 a HPV 18. V současnosti jsou k dispozici na trhu dvě komerčně vyráběné profylaktické vakcíny, kvadrivalentní vakcína Silgard® (HPV 6, 11, 16, 18) a bivalentní vakcína CervarixTM (HPV 16, 18). Vakcíny nelze v jednom očkovacím schématu kombinovat, neboť spektrum typů VLPs není stejné a ani použité VLPs nejsou zcela identické. Odlišné jsou rovněž adjuvantní systémy. Jediná potenciální tolerovatelná situace pro záměnu je nežádoucí reakce na první podanou vakcínu. V takovém případě by teoreticky bylo možné očkování dokončit vakcínou druhou [23]. Obě vakcíny jsou bezpečné. Nejčastější nežádoucí účinek je několikadenní lokální reakce v místě vpichu. Ze systémových vedlejších účinků uvádí SPC Silgardu® horečku, SPC CervarixuTM cefaleu, únavu a myalgie. V ČR je HPV vakcinace pro dívky ve věku mezi 13 a 14 lety hrazena z prostředků zdravotního pojištění. Základní charakteristiky obou vakcín shrnuje tab. 2.
Tab. 2. Základní charakteristiky obou registrovaných vakcín. 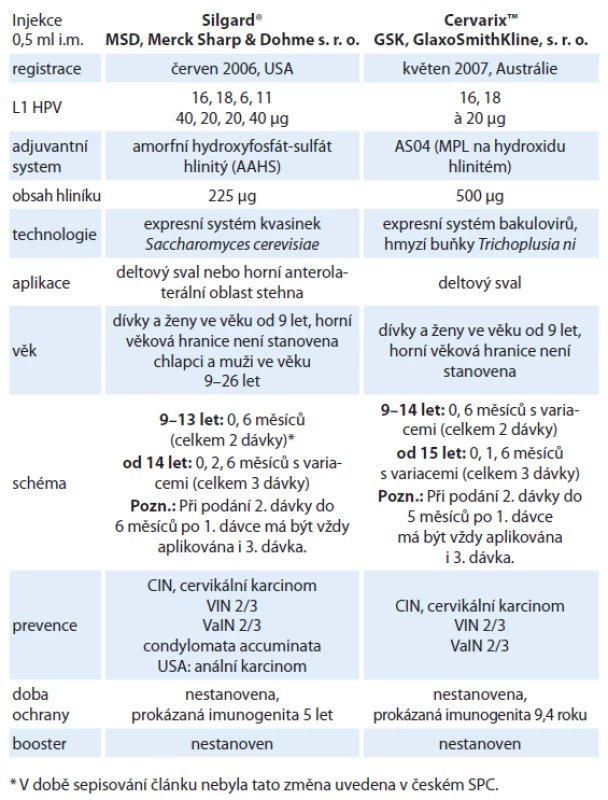
V poslední době je vývoj očkovacích látek proti HPV zaměřen nejen na vakcíny profylaktické, ale i na vakcíny terapeutické a kombinované. Ve stadiu klinických zkoušek je monovalentní profylaktická vakcína, která by měla vytvářet typově specifické neutralizační protilátky proti dvěma neonkogenním a sedmi onkogenním genotypům HPV. Také se testují alternativní a méně invazivní způsoby aplikace VLPs, a to ve formě nazální (sprej, aerosol) a perorální, pozornost se také věnuje vývoji levnějších rostlinných vakcín [24].
Karcinom děložního hrdla
Incidence karcinomu děložního hrdla v ČR se pohybuje kolem 20 nových onemocnění na 100 000 žen za rok [25]. Dlouhodobě neměnná vysoká incidence je způsobena především nízkou účastí žen na pravidelných gynekologických kontrolách [26]. Aplikace obou vakcín v kohortě HPV naivních dívek zajišťuje prakticky absolutní ochranu proti cervikálním karcinomům asociovaným s HPV 16 a HPV 18 [27,28]. V Evropě byla u dlaždicobuněčných karcinomů děložního hrdla prokázána infekce genotypem HPV 16 u 66,2 % případů a HPV 18u 10,8 % případů [29]. U obtížně diagnostikovatelných adenokarcinomů děložního hrdla byly detekovány genotypy HPV 16 u 54,2 % případů a HPV 18 dokonce u 40,4 % pacientek [29]. Kromě vysoké ochrany proti vakcinálním genotypům poskytuje vakcinace bivalentní vakcínou širší ochranu díky zkřížené reaktivitě protilátek proti příbuzným HPV genotypům. Nejvýznamněji se uplatňuje zkřížená ochrana proti HPV 31, 33 a 45. U HPV naivní populace tak CervarixTM dosahuje účinnosti až 93,2 % [29] proti těžké cervikální intraepiteliální neoplazii adenokarcinomu in situ nebo invazivnímu karcinomu děložního hrdla bez ohledu na vyvolávající genotyp HPV.
Karcinom vulvy a vaginy
V ČR jsou diagnostikovány 3 – 4 nové karcinomy vulvy na 100 000 žen ročně, karcinomy vaginy jsou ještě vzácnější, s incidencí jednoho případu na 100 000 žen ročně [25]. V metaanalýze 93 prací ze čtyř světadílů byla HPV infekce diagnostikována u 85,3 % těžkých prekanceróz vulvy, u 40,4 % vulválních karcinomů, u 90,1 % těžkých prekanceróz pochvy a u 69,9 % vaginálních karcinomů [18]. Ve všech lézích dominoval genotyp HPV 16. U karcinomu vulvy byl genotyp HPV 16 zjištěn u 32,2 % ze všech vulválních karcinomů včetně neinfikovaných, genotyp HPV 18 byl identifikován mnohem vzácněji (4,4 %). U vaginálního karcinomu byl zjištěn HPV 16 u 53,7 % případů a HPV 18 u 7,6 % pacientek. Autoři metaanalýzy vyvozují, že očkováním účinným pouze proti genotypům HPV 16 a 18 by bylo možno zabránit přibližně 40 % vulválních a 60 % vaginálních karcinomů [18]. Prokázaná účinnost HPV vakcinace proti malignitám těchto lokalit se projevila i rozšířením indikačního spektra v SPC obou přípravků [27,28].
Karcinom anu
Anální karcinom není časté onemocnění, jeho incidence se pohybuje okolo jednoho případu na 100 000 obyvatel a rok, ale jeho incidence celosvětově stoupá přibližně o 2 % každým rokem [30,31]. Podle velké metaanalýzy byla HPV infekce zjištěna u 93,9 % těžkých análních prekanceróz (AIN 2/ 3) a u 84,3 % análních karcinomů [18]. U análního karcinomu převažoval HPV 16 (73,4 %) následovaný v daleko menším zastoupení genotypem HPV 18 (5,2 %). V české populaci na vzorku 22 pacientů s análním karcinomem zjistili Tachezy et al HPV infekci u 81,8 % pacientů, ve všech případech byl přítomen genotyp HPV 16 [32].
Etiopatogeneze karcinomu anu a děložního hrdla vykazuje určité paralely, což je pravděpodobná příčina 2krát vyšší incidence karcinomu anu u žen než u mužů. V roce 2010 bylo v ČR hlášeno celkem 129 případů, z toho 44 u mužů a 85 u žen [25]. Tento rozdíl v incidenci u obou pohlaví není zcela přesně vysvětlen, nicméně histologická stavba anu a děložního hrdla je podobná včetně přítomnosti transformační zóny přechodu dlaždicového a cylindrického epitelu, kde se na podkladě HPV infekce karcinom přes stadia prekanceróz nejčastěji iniciuje [33]. Ženy s prekancerózou dolního genitálního traktu (cervix, vulva, vagina) mají z těchto důvodů vyšší riziko análního karcinomu [34 – 36]. V case ‑ control studii zahrnující téměř 30 000 žen v dánském registru bylo riziko análního karcinomu zvýšené 5,2krát u pacientek s předchozí diagnózou cervikální prekancerózy [37]. Nejsilněji definované rizikové faktory karcinomu anu – homosexuální praktiky u mužů a přítomnost jiných pohlavně přenosných infekcí – predikují přímou souvislost rizika análního karcinomu se způsobem pohlavního života [38,39]. Na základě prokázané ochrany proti análním prekancerózám schválil Úřad pro kontrolu potravin a léčiv v USA (Food and Drug Administration – FDA) vakcínu Silgard® také k ochraně před karcinomem anu u obou pohlaví [40].
Karcinom penisu
Karcinom penisu je stejně jako karcinom anu vzácný. Incidence se v ČR pohybuje okolo 1,5 nových případů na 100 000 mužů za rok. V roce 2010 bylo hlášeno 85 nových onemocnění [25]. Parkin et al uvádějí, že 40 % penilních karcinomů je asociováno s HPV infekcí [41]. Mezi známé rizikové faktory patří homosexualita, špatná intimní hygiena, kouření, promiskuita, fimóza a jako protektivní faktor se uvádí obřízka [39].
Ve studii zahrnující 2 798 mužů ve věku 16 – 26 let byla sledována účinnost proti karcinomu penisu po očkování Silgardem®. Celkem 83 % probandů (86 % heterosexuálů a 61 % homosexuálů) bylo při vstupu do studie PCR DNA negativních a séronegativních pro HPV 6, 11, 16 a 18. Ve studované skupině nebyl zaznamenán ani jeden případ prekancerózy penisu (penilní intraepiteliální neoplazie – PIN) způsobený očkovanými genotypy, na rozdíl od čtyř případů v kontrolní skupině (účinnost 100%, 95% CI – 52,1 – 100,0) [27]. Výsledky ale nebyly statisticky signifikantní. Plošná HPV vakcinace mužů by tak pravděpodobně snížila incidenci karcinomu penisu, ale pro jeho řídký výskyt a nedostatek jednoznačně přímých důkazů o asociaci s HPV infekcí není zatím možné doporučit HPV vakcinaci jako efektivní primární prevenci karcinomu penisu [42].
Karcinomy hlavy a krku
Do termínu dlaždicobuněčné karcinomy hlavy a krku (head and neck squamous cell carcinoma – HNSCC) se zahrnují malignity dutiny ústní, jazyka, dutiny nosní, paranazálních sinů, epifaryngu, orofaryngu, hypofaryngu, laryngu a slinných žláz. Zatímco HNSCC tvoří asi 4 % všech karcinomů v Evropě, celosvětově se jedná o šestou nejčastější skupinu malignit se stoupající tendencí o 0,6 – 6,7 % ročně [43,44]. K nejvýznamnějším rizikovým faktorům patří kouření a žvýkání tabáku, za kofaktor kancerogeneze se považují HPV, herpes simplex virus typ 1, virus Epstein‑Baarové a abúzus alkoholu.
Poprvé ukázali na možnou souvislost mezi HNSCC a HPV infekcí Syrjänen et al v roce 1983 [45]. Jednotlivé práce z posledních let potvrzují zastoupení HPV infekce u nádorů dutiny ústní a orofaryngu až v 85 %, dříve se udávala asociace výrazně nižší [46 – 49]. Metaanalýza z roku 2005 uvádí přítomnost HPV u 23 – 35 % biopsií HNSCC s maximem v oblasti orofaryngu a dutiny ústní (45 – 90 %) a s dominancí genotypu HPV 16(68 – 87 %) [19].
Zatímco incidence HNSCC se u kuřáků snižuje, incidence HPV pozitivních HNSCC se neustále zvyšuje [50]. Tento nárůst je přičítán zvyšující se prevalenci orální HPV infekce v souvislosti se změnami sexuálního chování [51,52]. Například ve Francii se počet žen udávajících aktivní praktikování orálního sexu zvýšil z 51 % v roce 1970 na 91 % v roce 2006. Podobně i u mužů byl zaznamenán nárůst praktikování orálního sexu za stejné období z 55 % na 94 % [53]. Lidé se séropozitivitou HPV 16 mají 2krát vyšší riziko orofaryngeálního karcinomu [54] a HPV infekce je častěji nacházena i u jeho prekanceróz [55]. Pacienti s HPV pozitivními HNSCC jsou v průměru o 10 let mladší, častěji se jedná o nekuřáky a abstinenty [48,50,56,57]. HPV pozitivní nádory bývají méně diferencovány a jsou diagnostikovány v pozdějších stadiích [43,58]. Pacienti s orofaryngeálním karcinomem asociovaným s HPV infekcí umírají 2 – 5krát častěji než pacienti s tímto karcinomem bez prokázané HPV infekce [43]. Podle jiných studií ale pacienti s HPV asociovanými orofaryngeálním karcinomem žijí déle (OS 82,4 vs 57,1 %; p < 0,001) a vykazují i delší bezpříznakové období (73,7 vs 43,5 %; p < 0,001) [59]. Přestože stále není zcela jasné, jakou přesně roli hraje HPV infekce v etiologii karcinomů hlavy a krku, existují již první práce, které dokládají snížení prevalence orální HPV infekce po vakcinaci [60].
Karcinom jícnu
Incidence karcinomu jícnu se v různých částech světa velmi liší, nejvyšší je ve střední Asii a v severní Číně [61]. V ČR je v posledních letech hlášeno 5,5 nových onemocnění na 100 000 lidí za rok [25]. Celosvětově je diagnostikováno asi 500 000 nových případů ezofageálního karcinomu ročně, čtyři nemocní z pěti zemřou [45]. Jako nejvýznamnější rizikové faktory byly definovány gastroezofageální reflux vedoucí k Barrettovu jícnu, silné kouření, těžký alkoholizmus, expozice některým chemikáliím, jako jsou nitrosaminy, mykotoxiny, opium, obviňována byla i karence vitamínů A, B, C a dráždění epitelu jícnu horkými nápoji a jídly [62,63]. První zprávy o spojení HPV infekce s benigními i maligními tumory jícnu byly publikovány v roce 1982 [64]. V některých případech byla zaznamenána i infekce herpes simplex virem, cytomegalovirem a Epstein‑Baarové virem [62].
Přestože vliv HPV infekce v etiopatogenezi karcinomu ezofagu neni zcela objasněn, podle některých hypotéz může HPV infekce navozovat antiapoptické a proliferativní aktivity, které v kombinaci s jinými rizikovými faktory vedou k malignímu zvrhnutí buněk [20]. V metaanalýze zahrnující celkem 1 485 případů byla zjištěna HPV pozitivita u 22,9 % ezofageálních karcinomů s mnohem větší asociací v regionech s jeho vysokou incidencí [20]. Zajímavé je, že genotypy HPV 6, 11, 16 a 18 ale tvořily méně než 40 % infekcí a nejrizikovější genotypy HPV 16 a 18 byly přítomny pouze u 27 % nemocných [65,66]. HPV infekce nebyla prokázána ani u pacientů s Barrettovým jícnem [67]. V této souvislosti se spekuluje, že etiologie karcinomu jícnu může být odlišná v oblastech s jeho vysokou a nízkou prevalencí. Je jisté, že karcinom jícnu se vyvíjí na podkladě vícečetných událostí na úrovni genomu [20]. Infekce některými mikroorganizmy včetně HPV způsobí akutní nebo chronický zánět, a tím urychlí buněčnou proliferaci s produkcí kancerogenů nebo promotorů s přímým vlivem na buňky dlaždicovitého epitelu [68]. Podporou pro toto tvrzení je častý nález chronické nerefluxní ezofagitidy v oblastech s nejvyšší incidencí karcinomu jícnu [20,62]. K ověření významu HPV infekce u karcinomu jícnu je však potřeba dalších studií. Teprve vývoj incidence v budoucnosti ukáže, zda plošná HPV vakcinace ovlivní výskyt tohoto zhoubného onemocnění.
Karcinom plic
Karcinom plic je celosvětově jedním z nejčastějších příčin úmrtí na malignitu [69], v ČR je každoročně diagnostikováno více než 60 nových případů na 100 000 obyvatel za rok [25].
Již na konci 80. let minulého století byl zvažován možný vliv HPV infekce na etiologii části plicních karcinomů [70] a stále se polemizuje o významu HPV infekce v etiopatogenezi, zvláště u nekuřáků [20]. Některé studie tuto hypotézu podporují [71 – 74], jiné tuto souvislost neprokázaly [75 – 79]. Jasný důkaz pro přímou souvislost HPV infekce s etiologií plicního karcinomu dosud neexistuje. Velká metaanalýza potvrdila široké rozpětí HPV infekce u plicního karcinomu (průměr 22,4 %), které se výrazně lišilo podle regionu, histologického subtypu a podle metody detekce [70]. Prevalence HPV infekce byla signifikantně vyšší v Číně, Taiwanu a dalších zemích Asie a Jižní Ameriky na rozdíl od zemí Evropy, Austrálie a Severní Ameriky [75,80,81]. Největší rozdíly v prevalenci HPV infekce různých oblastí byly pozorovány u adenokarcinomů, dlaždicobuněčných a adenoskvamózních karcinomů, nejmenší u velkobuněčných a malobuněčných karcinomů. Cheng et al zjistili u 55 % nemocných s karcinomem plic pozitivitu HPV 16 nebo HPV 18 s nejvyšší prevalencí ve skupině nekuřaček nad 60 let [82]. HPV pozitivita byla prokázána jen v tumorózních buňkách, sousedící netumorózní buňky byly HPV negativní. Nicméně vztah etiopatogeneze plicních karcinomů a HPV infekce je stále nejasný. Kupříkladu jiná recentní studie vysledovala u 1/ 3 plicních dlaždicobuněčných karcinomů pozitivitu p16 [83]. Autoři nicméně polemizují, že vzhledem k absenci genotypů HPV 16 a HPV 18 není přítomnost p16 v plicních dlaždicobuněčných karcinomech markerem HPV infekce, jako je tomu v případech cervikálních a ezofageálních dlaždicobuněčných karcinomů [83].
Jen další prospektivní kohortní studie pomůžou lépe osvětlit roli HPV infekce v patogenezi karcinomu plic v souvislosti s pohlavím, kouřením a ostatními rizikovými faktory a tím odhadnout potenciální vliv HPV vakcinace [70].
Karcinom prsu
Karcinom prsu je celosvětově nejrozšířenější malignita u žen, jejíž incidence se neustále zvyšuje. V ČR je hlášeno v posledních letech přibližně 120 nových nádorů na 100 000 žen a rok [25]. Poznatky o vlivu HPV infekce v etiologii karcinomu prsu jsou stále kontroverzní. Metaanalýza 29 studií z let 1990 – 2011 uvádí HPV infekci v prsní tkáni u 23,0 % pacientek s karcinomem prsu na rozdíl od zdravé populace, kde prevalence dosahovala jen 12,9 %. V prevalenci mamární HPV infekce však byly zaznamenány poměrně velké regionální rozdíly od 13,4 % HPV pozitivních v Evropě až k 42,9 % HPV pozitivních v Severní Americe a Austrálii. V analýze devíti case ‑ control studií autoři deklarovali vyšší riziko karcinomu prsu v souvislosti s přítomností HPV infekce (OR (odds ratio) = 5,9; 95% CI3,26 – 10,67). Zjištěná data podporují názor, že HPV infekce by mohla hrát roli v etiologii prsního karcinomu, ale potenciální vliv HPV vakcinace nelze zatím vypočítat [84].
Kolorektální karcinom
Incidence kolorektálního karcinomu dosahuje v ČR téměř 80 nových onemocnění na 100 000 obyvatel za rok [25]. Vliv HPV infekce na kolorektální karcinom hodnotila metaanalýza zpracovávající 16 studií [85]. Přítomnost HPV infekce byla pozorována u 31,9 % pacientů. Nejnižší byla v Evropě (14,1 %) a nejvyšší v Jižní Americe (60,8 %). Genotyp HPV 18 byl nejčastěji detekován u pacientů s kolorektálním karcinomem v Asii (73,3 %) a v Evropě (47,3 %), zatímco genotyp HPV 16 byl nejčastěji nalezen u pacientů v Jižní Americe (58,3 %). Analýza pěti case ‑ control studií poukázala na vysoké riziko kolorektálního karcinomu v souvislosti s HPV pozitivitou (OR = 10,04; 95% CI 3,7 – 27,5) [85]. Uvedená data sice poskytují kvantitativní důkaz pro vztah mezi HPV infekcí a kolorektálním karcinomem, ale přímá účast viru v patogenezi tohoto karcinomu je dosud neprokázána. Proto ani nelze hodnotit případný přínos profylaktické vakcinace.
Karcinom prostaty
Incidence karcinomu prostaty přesahuje v ČR 130 nových případů na 100 000 mužů za rok [25]. Podíl HPV infekce na vzniku karcinomů urogenitální oblasti mužů je dlouhodobě diskutován. Kromě penilního karcinomu je zkoumána asociace HPV infekce s uroteliálním karcinomem a s karcinomem prostaty. Recentní metaanalýza 25 prací ale zjistila jen velmi malé relativní riziko (OR = 1,09; 95% CI 0,97 – 1,23) karcinomu prostaty při přítomnosti genotypu HPV 16 a ještě menší relativní riziko pro asociaci s genotypem HPV 18 (OR = 1,05; 95% CI 0,89 – 1,24) [86]. V souladu s uvedenými výsledky nezjistili ani Tachezy et al v české populaci rozdíl v prevalenci HPV infekce mezi pacienty s benigní hyperplazií prostaty a karcinomem (prevalence 2 % u obou diagnóz; p = 1,000) [87]. Také sérologické hladiny se nelišily, s výjimkou hladiny protilátek proti HPV 6 u pacientů s karcinomem (p = 0,018). Výsledky všech dostupných studií nepodporují účast HPV infekce v etiopatogenezi karcinomu prostaty. Některé práce ale pracují s hypotézou, že urogenitální trakt včetně prostaty může být rezervoárem HPV infekce k jejímu dalšímu šíření [87].
Rekurentní respiratorní papilomatóza
Laryngeální papilomatóza (rekurentní respiratorní papilomatóza – RRP) je vzácné benigní, ale obtížně léčitelné onemocnění s velmi závažným průběhem. Riziko maligní transformace je asi 2 %, u plicní formy však dosahuje až 80 % [88]. Genotypy HPV 6 a HPV 11, které jsou v 95 % s RRP asociovány, nelze tedy v oblasti dýchacího traktu považovat na nízkorizikové [43]. Juvenilní orální rekurentní respiratorní papilomatóza se obvykle přenáší během porodu z rodičky na plod, v případě výskytu genitálních bradavic v těhotenství riziko onemocnění narůstá až 200krát v porovnání s rodičkami bez přítomnosti genitálních bradavic [89]. Incidence RRP se u dospělých zvyšuje s množstvím sexuálních partnerů a provozováním orálně‑genitálních sexuálních praktik [90].
Nemocní trpí stálým nebo opakovaným chrapotem způsobeným laryngeálními papilomy, někdy může nastat až obstrukce laryngu. Bylo zkoušeno mnoho modalit terapie, často se signifikantními nežádoucími účinky a nedostatečnou efektivitou. V léčbě dominují chirurgické zákroky následované léčbou imunomodulátory, antivirotiky nebo chemoterapeutiky. Léčba je ale často neúčinná a pouze paliativní [1]. Manifestace v útlém dětství do 4. roku života má úpornější průběh a terapie vyžaduje více chirurgických zákroků [91]. Papilomy jsou nejčastěji lokalizovány v hrtanu, ale přibližně 17 % nemocných má postiženou tracheu a u 5 % pacientů jsou papilomy přítomny i v plicní tkáni [92]. Paralely mezi charakterem provozovaných sexuálních praktik a výskytem orofaryngeálního karcinomu a rekurentní respiratorní papilomatózy naznačují, že vakcinace proti genotypům HPV 6 a 11 před počátkem pohlavního života by mohla mít výrazný ochranný vliv [43].
Závěr
Odhaduje se, že HPV infekce je celosvětově každý rok zodpovědná za více než 550 000 nových malignit [20]. Existují jednoznačné důkazy pro spojitost HPV infekce s etiologií karcinomu děložního hrdla a silné důkazy o spojitosti s etiologií části karcinomů vulvy, vaginy, anu a penisu. Popsána je také silná spojitost HPV infekce s dlaždicobuněčnými karcinomy hlavy a krku, intenzivně se studuje role HPV v etiopatogenezi karcinomů jícnu a plic. Účast HPV infekce v etiologii karcinomu prsu a kolorektálního karcinomu je nejasná, přestože u relativně velké části případů byla prokázána HPV infekce. Naopak žádný význam HPV infekce nebyl pozorován při vzniku karcinomu prostaty.
Obě profylaktické vakcíny CervarixTM a Silgard® jsou vysoce účinné proti infekci způsobené nejčastějšími onkogenními genotypy HPV 16 a 18, vakcína Silgard® působí i proti neonkogenním HPV 6a 11. Přítomnost neutralizačních protilátek, které jsou indukovány po vakcinaci, by mohla bránit infikování celého organizmu. Vzhledem k prokázané signifikantní zkřížené ochraně i proti jiným nevakcinačním onkogenním genotypům, v případě Silgardu® proti HPV 31a v případě CervarixuTM proti HPV 31, 33, 39, 45 a 51, je poskytována širší ochrana proti lidským malignitám, než se původně přepokládalo. Mimo výrazné snížení incidence lézí děložního hrdla je neméně významná i ochrana proti prekancerózám a karcinomům vulvy, vaginy a anu, kde již proběhlé studie potvrdily významnou protekci. Velkou efektivitu vakcinace lze předpokládat u dlaždicobuněčných karcinomů penisu, dutiny ústní a orofaryngu, kde však účinnostní data dosud chybí.
Práce byla podpořena grantem IGA MZ ČR č. NT14079-3/2013 a projektem PRVOUK-P27//LF1/1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Borek Sehnal
Onkogynekologické centrum
Gynekologicko-porodnická klinika
1. LF UK a Nemocnice Na Bulovce
Budínova 2
180 00 Praha 8
e-mail: boreksehnal@seznam.cz
Obdrženo: 2. 2. 2014
Přijato: 21. 5. 2014
Zdroje
1. Spitzer M. Human papillomavirus: epidemiology, natural history, and clinical sequelae. OBG Management 2006; 18 (Suppl): S5 – S10.
2. Trollfors B. Human papillomavirus vaccines: an outsider’s point of view. Expert Rev Vaccines 2008; 7(8): 1131 – 1133. doi: 10.1586/ 14760584.7.8.1131.
3. Ciuffo G. Innesto positivo con filtrato di verruca volgare. Giorn Ital Mal Venereol 1907; 48 : 12 – 17.
4. Della Torre G, Pilotti S, de Palo G et al. Viral particles in cervical condylomatous lesions. Tumori 1978; 64(5): 549 – 553.
5. Laverty CR, Booth N, Hills E et al. Noncondylomatous wart virus infection of the postmenopausal cervix. Pathology 1978; 10(4): 373 – 378.
6. Muñoz N, Bosch FX, de Sanjose S et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348(6): 518 – 527.
7. zur Hausen H. Papillomaviruses in the causation of human cancers ‑ a brief historical account. Virology 2009; 384(2): 260 – 265. doi: 10.1016/ j.virol.2008.11.046.
8. von Knebel Doeberitz M, Rittmüller C, zur Hausen H et al. Inhibition of tumorigenicity of cervical cancer cells in nude mice by HPV E6 – E7 anti‑sense RNA. Int J Cancer 1992; 51(5): 831 – 834.
9. Yee C, Krishnan ‑ Hewlett I, Baker CC et al. Presence and expression of human papillomavirus sequences in human cervical carcinoma cell lines. Am J Pathol 1985; 119(3): 361 – 366.
10. Vonka V, Kanka J, Hirsch I et al. Prospective study on the relationship between cervical neoplasia and herpes simplex type ‑ 2 virus. II. Herpes simplex type ‑ 2 antibody presence in sera taken at enrollment. Int J Cancer 1984; 33(1): 61 – 66.
11. Fehrmann F, Laimins LA. Human papillomaviruses: targeting differentiating epithelial cells for malignant transformation. Oncogene 2003; 22(33): 5201 – 5207.
12. White EA, Sowa ME, Tan MJ et al. Systematic identification of interactions between host cell proteins and E7 oncoproteins from diverse human papillomaviruses. Proc Natl Acad Sci USA 2012; 109(5): E260 – E267. doi: 10.1073/ pnas.1116776109.
13. Viscidi RP, Schiffman M, Hildesheim A et al. Seroreactivity to human papillomavirus (HPV) types 16, 18, or 31 and risk of subsequent HPV infection: results from a population‑based study in Costa Rica. Cancer Epidemiol Biomarkers Prev 2004; 13(2): 324 – 327.
14. Carter JJ, Koutsky LA, Hughes JP et al. Comparison of human papillomavirus types 16, 18, and 6 capsid antibody responses following incident infection. J Inf Diseas 2000; 181(6): 1911 – 1919.
15. Schwarz TF. ASO4 - adjuvanted human papillomavirus – 16/ 18 vaccination: recent advances in cervical cancer prevention. Expert Rev Vaccines 2008; 7(10): 1465 – 1473. doi: 10.1586/ 14760584.7.10.1465.
16. Bouvard V, Baan R, Straif K et al. A review of human carcinogens – part B: biological agents. Lancet Oncol 2009; 10(4): 321 – 322.
17. Driák D, Sehnal B. Význam infekcí způsobených lidskými papilomaviry. Cas Lek Cesk 2013; 152(1): 15 – 19.
18. De Vuyst H, Clifford GM, Nascimento MC et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta‑analysis. Int J Cancer 2009; 124(7): 1626 – 1636. doi: 10.1002/ ijc.24116.
19. Kreimer AR, Clifford GM, Boyle P et al. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev 2005; 14(2): 467 – 475.
20. Zandberg DP, Bhargava R, Badin S et al. The role of human papillomavirus in nongenital cancers. CA Cancer J Clin 2013; 63(1): 57 – 81. doi: 10.3322/ caac.21167.
21. Weiss P, Zvěřina J (eds). Sexuální chování obyvatel v ČR. Praha: Dema 2003 : 28 – 32.
22. Zhou J, Sun XY, Stenzel DJ et al. Expression of vaccinia recombinant HPV 16 L1 and L2 ORF proteins in epithelial cell is sifficient for assembly of HPV virion‑like particles. Virology 1991; 185(1): 251 – 257.
23. Driák D, Dyrhonová M, Tachezy R. Vakcinace proti lidským papilomavirům a její kontroverze – II. Gynekolog 2009; 18 : 176 – 181.
24. Tomson TT, Roden RB, Wu TC. Human papillomavirus vaccines for the prevention and treatment of cervical cancer. Curr Op Invest Drugs 2004; 5(12): 1247 – 1261.
25. Svod.cz [internetova stranka]. Česky národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika; c2006. Dostupné z: http:/ / www.svod.cz.
26. Tachezy R, Rob L. Skrínink pro prevenci karcinomu děložního hrdla v České republice. Cas Lek Ces 2007; 146(12): 939 – 944.
27. Medicines.org.uk [homepage on the Internet]. Silgard SPC. Available from: http:/ / www.medicines.org.uk/ emc/ medicine/ 19016/ SPC/ gardasil/ .
28. Medicines.org.uk [homepage on the Internet]. Cervarix SPC. Available from: http:/ / www.medicines.org.uk/ emc/ medicine/ 20204/ SPC/ cervarix/ .
29. Tjalma WA, Fiander A, Reich O et al. Differences in human papillomavirus type distribution in high‑grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe. Int J Cancer 2013; 132(4): 854 – 867. doi: 10.1002/ ijc.27713.
30. Johnson LG, Madeleine MM, Newcomer LM et al. Anal cancer incidence and survival: the surveillance, epidemiology, and end results experience, 1973 – 2000. Cancer 2004; 101(2): 281 – 288.
31. Goodman MT, Shvetsov YB, McDuffie K et al. Sequential acquisition of human papillomavirus (HPV) infection of the anus and cervix: the Hawaii HPV Cohort Study. J Infect Dis 2010; 201(9): 1331 – 1339. doi: 10.1086/ 651620.
32. Tachezy R, Smahelova M, Salakova J et al. Human papillomavirus genotype distribution in Czech women and men with diseases etiologically linked to HPV. PLoS One 2011; 6(7): e21913. doi: 10.1371/ journal.pone.0021913.
33. Palefsky JM, Holly EA, Ralston ML et al. Prevalence and risk factors for anal human papillomavirus infection in human immunodeficiency virus (HIV) - positive and high‑risk HIV-negative women. J Infect Dis 2001; 183(3): 383 – 391.
34. Frisch M, Olsen JH, Melbye M. Malignancies that occur before and after anal cancer: clues to their etiology. Am J Epidemiol 1994; 140(1): 12 – 19.
35. Edgren G, Sparén P. Risk of anogenital cancer after diagnosis of cervical intraepithelial neoplasia: a prospective population‑based study. Lancet Oncol 2007; 8(4): 311 – 316.
36. Goodman MT, Shvetsov YB, McDuffie K et al. Acquisition of anal human papillomavirus (HPV) infection in women: the Hawaii HPV Cohort study. J Infect Dis 2008; 197(7): 957 – 966. doi: 10.1086/ 529207.
37. Melbye M, Sprogel P. Aetiological parallel between anal cancer and cervical cancer. Lancet 1991; 338(8768): 657 – 659.
38. Daling JR, Weiss NS, Hislop TG et al. Sexual practices, sexually transmitted diseases, and the incidence of anal cancer. N Engl J Med 1987; 317(16): 973 – 977.
39. Daling J, Madeleine M, Johnson L et al. Penile cancer: importance of circumcision, human papillomavirus and smoking in in situ and invasive disease. Int J Cancer 2005; 116(4): 606 – 616.
40. Fda.gov [homepage on the Internet]. U.S. Food and Drug Administration, USA. Available from: http:/ / www.fda.gov/ BiologicsBloodVaccines/ Vaccines/ ApprovedProducts/ ucm094042.htm.
41. Parkin DM, Bray F. Chapter 2: the burden of HPV‑related cancers. Vaccine 2006; 24 (Suppl 3): S11 – S25.
42. Shabbir M, Barod R, Hegarty PK et al. Primary prevention and vaccination for penile cancer. Ther Adv Urol 2013; 5(3): 161 – 169. doi: 10.1177/ 1756287212465456.
43. Gillison ML, Alemany L, Snijders PJ et al. Human papillomavirus and diseases of the upper airway: head and neck cancer and resipiratory papillomatosis. Vaccine 2012; 30 (Suppl 5): F34 – F54. doi: 10.1016/ j.vaccine.2012.05.070.
44. Jemal A, Bray F, Center MM et al. Global cancer statistics. CA Cancer J Clin 2011; 61(2): 69 – 90. doi: 10.3322/ caac.20107.
45. Syrjanen KJ, Pyrhonen S, Syrjanen SM et al. Immunohistochemical demonstration of human papilloma virus (HPV) antigens in oral squamous cell lesions. Br J Oral Surg 1983; 21(2): 147 – 153.
46. Weinberger PM, Yu Z, Haffty BG et al. Molecular classification identifies subset of human papillomavirus‑associated oropharyngeal cancers with favorable prognosis. J Clin Oncol 2006; 24(5): 736 – 747.
47. Ostwald C, Müller P, Barten M et al. Human papillomavirus DNA in oral squamous cell carcinomas and normal mucosa. J Oral Pathol Med 1994; 23(5): 220 – 225.
48. Klozar J, Tachezy R, Rotnáglová E et al. Human papillomavirus in head and neck tumors: epidemiological, molecular and clinical aspects. Wien Med Wochenschr 2010; 160(11 – 12): 305 – 309. doi: 10.1007/ s10354 ‑ 010 ‑ 0782 ‑ 5.
49. Näsman A, Attner P, Hammarstedt L et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral‑induced carcinoma? Int J Cancer 2009; 125(2): 362 – 366. doi: 10.1002/ ijc.24339.
50. Simard EP, Ward EM, Siegel R et al. Cancers with increasing incidence trends in the United States: 1999 through 2008. CA Cancer J Clin 2012; 62 : 118 – 128. doi: 10.3322/ caac.20141.
51. Mazur S, D‘Souza G, Westra WH et al. HPV ‑ asscociated head and neck cancer: a virus related cancer epidemic. Lancet Oncology 2010; 11(8): 781 – 789. doi: 10.1016/ S1470 ‑ 2045(10)70017 ‑ 6.
52. D’Souza G, Dempsey A. The role of HPV in head and neck cancer and review of the HPV vaccine. Prev Med 2011; 53 (Suppl 1): S5 – S11. doi: 10.1016/ j.ypmed.2011.08.001.
53. Bajos N, Bozon M, Beltzer N et al. Changes in sexual behaviours: from secular trends to public health policies. AIDS 2010; 24(8): 1185 – 1191. doi: 10.1097/ QAD.0b013e328336ad52.
54. Mork J, Lie AK, Glattre E et al. Human papillomavirus infection as a risk factor for squamous ‑ cell carcinoma of the head and neck. N Engl J Med 2001; 344(15): 1125 – 1131.
55. Jayaprakash V, Reid M, Hatton E et al. Human papillomavirus types 16 and 18 in epithelial dysplasia of oral cavity and oropharynx: a meta‑analysis, 1985 – 2010. Oral Oncol 2011; 47(11): 1048 – 1054. doi: 10.1016/ j.oraloncology.2011.07.009.
56. Chaturvedi AK, Engels EA, Pfeiffer RM et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011; 29(32): 4294 – 4301. doi: 10.1200/ JCO.2011.36.4596.
57. Gillison ML, D’Souza G, Westra W et al. Distinct risk factor profiles for human papillomavirus type 16-positive and human papillomavirus type 16 - negative head and neck cancers. J Natl Cancer Inst 2008; 100(6): 407 – 420. doi: 10.1093/ jnci/ djn025.
58. Hafkamp HC, Manni JJ, Haesevoets A et al. Marked differences in survival rate between smokers and nonsmokers with HPV 16‑associated tonsillar carcinomas. Int J Cancer 2008; 122(12): 2656 – 2664. doi: 10.1002/ ijc.23458.
59. Ang KK, Harris J, Wheeler R et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363(1): 24 – 35. doi: 10.1056/ NEJMoa0912217.
60. Herrero R, Quint W, Hildesheim A et al. Reduced prevalence of oral human papillomavirus (HPV) 4 years after bivalent HPV vaccination in a randomized clinical trial in Costa Rica. PLoS One 2013; 8(7): e68329. doi: 10.1371/ journal.pone.0068329.
61. Gholipour C, Shalchi RA, Abbasi M. A histopathological study of esophageal cancer on the western side of the Caspian littoral from 1994 to 2003. Dis Esophagus 2008; 21(4): 322 – 327. doi: 10.1111/ j.1442 ‑ 2050.2007.00776.x.
62. Chang F, Syrjänen SM, Wang L et al. Infectious agents in the etiology of esophageal cancer. Gastroenterology 1992; 103(4): 1336 – 1348.
63. Franceschi S, Munoz N, Bosch XF et al. Human papillomavirus and cancers of the upper aerodigestive tract: a review of epidemiological and experimental evidence. Cancer Epidemiol Biomarkers Prev 1996; 5(7): 567 – 575.
64. Syrjänen K, Pyrhönen S, Aukee S et al. Squamous cell papilloma of the esophagus: a tumour probably caused by human papilloma virus (HPV). Diagn Histopathol 1982; 5(4): 291 – 296.
65. Chang F, Syrjanen S, Shen Q et al. Human papillomavirus involvement in esophageal carcinogenesis in the high incidence area of China. A study of 700 cases by screening and type ‑ specific in situ hybridization. Scand J Gastroenterol 2000; 35(2): 123 – 130.
66. Syrjänen KJ. HPV infections and oesophageal cancer. J Clin Pathol 2002; 55(10): 721 – 728.
67. El ‑ Serag HB, Hollier JM, Gravitt P et al. Human papillomavirus and the risk of Barrett’s esophagus. Dis Esophagus 2013; 26(5): 517 – 521. doi: 10.1111/ j.1442 ‑ 2050.2012.01392.x.
68. Ribeiro U Jr, Posner MC, Safatle ‑ Ribeiro AV et al. Risk factors for squamous cell carcinoma of the oesophagus. Br J Surg 1996; 83(9): 1174 – 1185.
69. Subramanian J, Govindan R. Lung cancer in never smokers: a review. J Clin Oncol 2007; 25(5): 561 – 570.
70. Syrjänen K. Detection of human papillomavirus in lung cancer: systematic review and meta‑analysis. Anticancer Res 2012; 32(8): 3235 – 3250.
71. Yu Y, Yang A, Hu S et al. Correlation of HPV ‑ 16/ 18 infection of human papillomavirus with lung squamous cell carcinomas in Western China. Oncol Rep 2009; 21(6): 1627 – 1632.
72. Yu Y, Yang A, Hu S et al. Significance of human papillomavirus 16/ 18 infection in association with p53 mutation in lung carcinomas. Clin Respir J 2013; 7(1): 27 – 33. doi: 10.1111/ j.1752 ‑ 699X.2011.00277.x.
73. Klein F, Amin Kotb WF, Petersen I. Incidence of human papilloma virus in lung cancer. Lung Cancer 2009; 65(1): 13 – 18. doi: 10.1016/ j.lungcan.2008.10.003.
74. Cheng YW, Wu MF, Wang J et al. Human papilloma-virus 16/ 18 E6 oncoprotein is expressed in lung cancer and related with p53 inactivation. Cancer Res 2007; 67(22): 10686 – 10693.
75. Park MS, Chang YS, Shin JH et al. The prevalence of human papillomavirus infection in Korean non‑small cell lung cancer patients. Yonsei Med J 2007; 48(1): 69 – 77.
76. Aguayo F, Anwar M, Koriyama C et al. Human papillomavirus ‑ 16 presence and physical status in lung carcinomas from Asia. Infect Agent Cancer 2010; 5 : 20. doi: 10.1186/ 1750 ‑ 9378 ‑ 5 ‑ 20.
77. Iwakawa R, Kohno T, Enari M et al. Prevalence of human papillomavirus 16/ 18/ 33 infection and p53 mutation in lung adenocarcinoma. Cancer Sci 2010; 101(8): 1891 – 1896. doi: 10.1111/ j.1349 ‑ 7006.2010.01622.x.
78. Simen ‑ Kapeu A, Surcel HM, Koskela P et al. Lack of association between human papillomavirus type 16 and 18 infections and female lung cancer. Cancer Epidemiol Biomarkers Prev 2010; 19(7): 1879 – 1881. doi: 10.1158/ 1055 ‑ 9965.EPI ‑ 10 ‑ 0356.
79. Koshiol J, Rotunno M, Gillison ML et al. Assessment of human papillomavirus in lung tumor tissue. J Natl Cancer Inst 2011; 103(6): 501 – 507. doi: 10.1093/ jnci/ djr003.
80. Srinivasan M, Taioli E, Ragin CC. Human papillomavirus type 16 and 18 in primary lung cancers – a meta‑analysis. Carcinogenesis 2009; 30(10): 1722 – 1728. doi: 10.1093/ carcin/ bgp177.
81. Bishop JA, Ogawa T, Chang X et al. HPV analysis in distinguishing second primary tumors from lung metastases in patients with head and neck squamous cell carcinoma. Am J Surg Pathol 2012; 36(1): 142 – 148. doi: 10.1097/ PAS.0b013e3182395c7b.
82. Cheng YW, Chiou HL, Sheu GT et al. The association of human papillomavirus 16/ 18 infection with lung cancer among nonsmoking Taiwanese women. Cancer Res 2001; 61(7): 2799 – 2803.
83. Doxtader EE, Katzenstein AL. The relationship between p16 expression and high‑risk human papillomavirus infection in squamous cell carcinomas from sites other than uterine cervix: a study of 137 cases. Hum Pathol 2012; 43(3): 327 – 332. doi: 10.1016/ j.humpath.2011.05.010.
84. Simões PW, Medeiros LR, Simões PD et al. Prevalence of human papillomavirus in breast cancer: a systematic review. Int J Gynecol Cancer 2012; 22(3): 343 – 347. doi: 10.1097/ IGC.0b013e31823c712e.
85. Damin DC, Ziegelmann PK, Damin AP. Human papillomavirus infection and colorectal cancer risk: a meta‑analysis. Colorectal Dis 2013; 15(8): e420 – e428. doi: 10.1111/ codi.12257.
86. Lin Y, Mao Q, Zheng X et al. Human papillomavirus 16 or 18 infection and prostate cancer risk: a meta‑analysis. Ir J Med Sci 2011; 180(2): 497 – 503. doi: 10.1007/ s11845 ‑ 011 ‑ 0692 ‑ 6.
87. Tachezy R, Hrbacek J, Heracek J et al. HPV persistence and its oncogenic role in prostate tumors. J Med Virol 2012; 84(10): 1636 – 1645. doi: 10.1002/ jmv.23367.
88. Dedo HH, Yu KC. CO(2) laser treatment in 244 patients with resiratory papillomas. Laryngoscope 2001; 111(9): 1639 – 1944.
89. Silverberg MJ, Thorsen P, Lindeberg H et al. Condyloma in pregnancy is strongly predictive of juvenile ‑ onset respiratory papillomatosis. Obstet Gynecol 2003; 101(4): 645 – 652.
90. Kashima HK, Shah F, Lyles A et al. A comparison of risk factors in juvenile ‑ onset and adult ‑ onset recurrent respiratory papillomatosis. Laryngoscope 1992; 102(1): 9 – 13.
91. Buchinsky FL, Donfack J, Derkay CS et al. Age of child, more than HPV type, is associated with clinical course in recurrent respiratory papillomatosis. PLoS One 2008; 3(5): e2263. doi: 10.1371/ journal.pone.0002263.
92. Wiatrak BJ, Wiatrak DW, Broker TR et al. Recurrent respiratory papillomatosis: longitudinal study comparing severity associated with papilloma viral type 6 and 11 and other risk factors in a large pediatric population. Laryngoscope 2004; 114 (11 Pt 2 Suppl 104): 1 – 23.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuality z odborného tiskuČlánek Soutěž o nejlepší práciČlánek Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorůČlánek Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativaČlánek Aktuality z odborného tiskuČlánek Liga proti rakovině
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Aktuality z odborného tisku
- Soutěž o nejlepší práci
- Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů
- Brazilský příběh mutace p53 R337H
- Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem – data z reálné klinické praxe v České republice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
- Vzťah medzi sérovou hladinou karboanhydrázy IX, hypoxiou a rádiorezistenciou nádorov hlavy a krku
- Soutěž na podporu autorských týmů publikujících v zahraničních odborných titulech
- Vliv anakinry na cytokinové profily a profily lymfocytů/ monocytů u pacienta s Erdheim-Chesterovou nemocí
- Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorů
- Informace z České onkologické společnosti
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativa
- Aktuality z odborného tisku
- Liga proti rakovině
- Pacient s Cowdenovým syndromem způsobeným mutací v genu PTEN (archiv 2. LF UK a FN v Motole)
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Brazilský příběh mutace p53 R337H
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



