-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lobulární karcinom prsu u muže – kazuistika a přehled literatury
Lobular Breast Cancer in Man – Case Report and Review of the Literature
Case:
Herein we report a case of a man with a B ‑ cell non‑Hodgkin lymfoma, primarily diagnosed by topographic and morfology tokens as lobular breast carcinoma and, as such, it was treated by chemotherapy and endocrine therapy. The treatment resulted in complete remission for 3,5 years. However, the subsequent relapses that arised in retrocrural and left axilary area did not respond adequately to breast cancer targeted chemotherapy. Therefore the patient underwent re‑exstirpation of axillary lymph node yielding a surprising histology finding of folicular lymphoma. The primary biopsy specimen was histologicaly re‑evaluated and the initial diagnosis was re‑classified as folicular lymphoma. The patient was given an adequate chemotherapy and targeted treatment that established a complete remission. Six months afterwards there was a relapse detected in the retrocrural area. The patient underwent palliative radiotherapy that brought about complete remission and, so far, he is in good condition. It has been eight years since the cancer diagnosis was established. This case report is appended by review of literature dealing with diagnostic confusion of these two malignancies.Conclusion:
Re ‑ biopsy plays a significant role in case of treatment strategy controversies, predominantly on condition of atypical course of malignant disease. It should always be considered in case of cancer relapse, especially if the phenotype specfication could affect the treatment decision.Key words:
breast cancer lobular – folicular lymphoma – diagnosis – histology – male
Autoři: J. Navrátil 1; K. Petrakova 1; R. Nenutil 2; R. Vyzula 1; M. Svoboda 1
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno2 Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 1
Vyšlo v časopise: Klin Onkol 2014; 27(2): 97-102
Kategorie: Přehledy
Souhrn
Případ:
V našem sdělení popisujeme kazuistiku muže s ne ‑ Hodgkinovým lymfomem z B lymfocytární řady, který byl iniciálně topograficky a morfologicky diagnostikován jako lobulární karcinom prsu a léčený chemoterapií a hormonoterapií pro toto onemocnění. Léčbou bylo dosaženo kompletní klinické remise nemoci trvající 3,5 roku. Následně došlo k relapsům v retrokrurální oblasti a v levé axile, přičemž onemocnění špatně reagovalo na chemoterapii cílenou na karcinom prsu. Pro netypický průběh onemocnění byla provedena exstirpace axilární uzliny s překvapivým nálezem folikulárního lymfomu. Proto bylo přistoupeno i k revizi histologického vyšetření původní biopsie, která nakonec vedla k reklasifikaci diagnózy na folikulární lymfom. Pacientovi byla podána odpovídající cílená léčba a chemoterapie, která navodila kompletní remisi onemocnění, nicméně po půl roce nastal další lokalizovaný relaps v retrokrurální oblasti. Pacient podstoupil paliativní radioterapii, po které je až do současnosti v kompletní remisi a v dobrém klinickém stavu. Od diagnózy onkologického onemocnění přitom uplynulo již osm let. Naši kazuistiku doplňujeme přehledem publikované literatury vztahující se k problematice diagnostické záměny uvedených malignit.Závěr:
Rebiopsie má nezastupitelné místo v procesu přehodnocení algoritmu léčby při netypickém průběhu maligního onemocnění. Měla by být zvážena i při relapsu onemocnění, zejména pokud informace o fenotypu nádoru může ovlivnit postup léčby.Klíčová slova:
karcinom prsu lobulární – folikulární lymfom – diagnostika – histologie – mužiÚvod
V České republice je ročně diagnostikováno přibližně 6 500 žen s karcinomem prsu (121 na 100 000 žen), u muže je tato diagnóza s incidencí kolem 40 pacientů ročně (0,88 na 100 000 mužů) raritní, tvoří pouze 0,13 % zhoubných nádorů [1]. Incidence ne ‑ Hodgkinových lymfomů (NHL, syn. non‑hodgkinské lymfomy) činí v České republice přibližně 11 pacientů na 100 000 obyvatel, s mírnou převahou u mužů (1,15 : 1). Primární ne ‑ Hodgkinův lymfom prsu je rovněž vzácné onemocnění, tvoří méně než 0,5 % všech malignit prsu a 2 % ze všech extranodálních lymfomů [2].
Z hlediska vícečetného výskytu nádorů se ve vztahu k uvedeným malignitám můžeme v praxi nejčastěji setkat s metachronním karcinomem prsu u pacientek, které byly léčené radioterapií pro lymfomy. Kumulativní riziko vzniku karcinomu prsu ve 20 letech od léčby lymfomu dosahuje přibližně 11 %, po dalších 10 letech však může činit až 30 %, a to zejména u pacientek léčených radioterapií v mladším věku, v daném případě do 25 let [3]. Stejně tak se mohou vyskytovat maligní lymfomy u pacientek po léčbě karcinomu prsu, i když v tomto případě se jedná o mnohem nižší incidenci a souvislost s prodělanou léčbou je rovněž méně pravděpodobná. Nejčastěji se jedná o diagnózu NHL nízké malignity (např. B ‑ CLL/ SCLL) ve vyšším věku [4]. Poslední možností je synchronní výskyt obou nádorů, který jsme však zaznamenali pouze v podobě kazuistik [5 – 7].
V našem sdělení popisujeme kazuistiku muže s NHL z B lymfocytární řady, který byl původně diagnostikovaný jako lobulární karcinom prsu a léčený chemoterapií a hormonoterapií pro toto onemocnění. Iniciální léčbou bylo dosaženo kompletní klinické remise nemoci. Následný relaps a další progrese onemocnění však vedly k rozpakům nad vývojem onemocnění, a proto bylo přistoupeno k rebiopsii a následně i překlasifikování nemoci na folikulární B lymfom (typ NHL). Adekvátní léčba tohoto onemocnění vedla opět k dosažení celkové remise.
Popis případu
Dvaašedesátiletý pacient se v dubnu 2004 dostavil ke konzultaci do Masarykova onkologického ústavu (MOÚ) pro nádor v pravém prsu. Na původním pracovišti byla provedena biopsie z rezistence v pravém prsu a exstirpována zvětšená uzlina z nadklíčku. Patology byly obě histologie zhodnoceny jako infiltrující lobulární karcinom prsu exprimující estrogenové a progesteronové receptory, HER ‑ 2 negativní. Laboratorně byl pacient bez patologických nálezů, nádorové markery CEA i CA15 – 3 nebyly elevovány. Bylo provedeno i flowcytometrické vyšetření periferní krve, které nesvědčilo pro patologii v krevních elementech.
Pacient absolvoval stagingová vyšetření standardní pro karcinom prsu, která byla následně doplněna o CT plic a mediastina a celotělové PET vyšetření. CT vyšetření prokázalo masivní splývající metastatickou infiltraci pravého nadklíčku, horního mediastina a pravé axily. PET vyšetření potvrdilo nález mnohočetných ložisek viabilní nádorové tkáně v pravém nadklíčku, mediastinu a v.s. na pleuře pravé plíce (obr. 1). Scintigrafické vyšetření neprokázalo nádorovou diseminaci do skeletu. Souběžně proběhlo druhé hodnocení morfologického a imunohistologického vyšetření získaných biopsií, přičemž imunoprofil svědčil pro karcinom prsu, morfologicky nejspíše lobulární. Tento výsledek byl zcela v souladu s původním vyšetřením a dokumentací. U pacienta byla vyšetřena i genomická DNA a nebyla prokázána mutace v BRCA1 ani BRCA2 genu.
Obr. 1. Obraz celotělového PET vyšetření před zahájením iniciální protinádorové léčby (4/2004). Světlá místa značí vysokou metabolickou aktivitu. 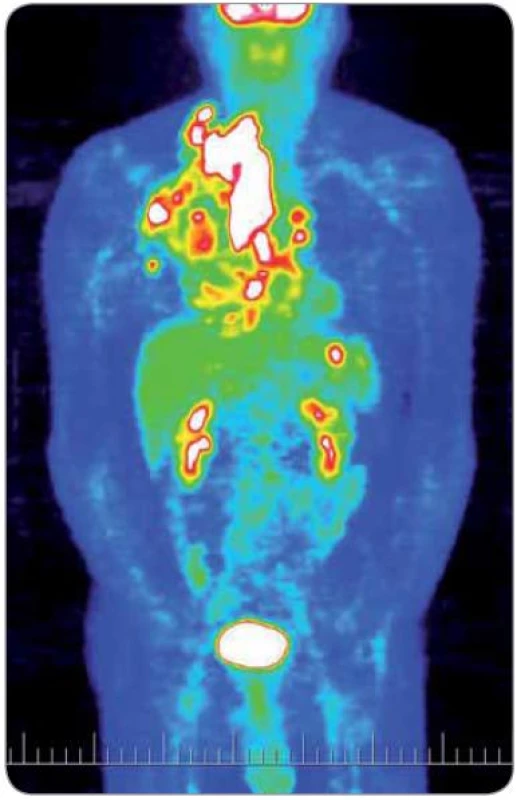
V květnu 2004 byla zahájena iniciální paliativní chemoterapie režimem FEC 75 (fluorouracil 500 mg/ m2, epirubicin 75 mg/ m2 a cyklofosfamid 500 mg/ m2) a po šesti sériích bylo dosaženo kompletní klinické remise onemocnění. Od září 2004 probíhala udržovací hormonální léčba Tamoxifenem (20 mg/ den, p.o.). V březnu 2008, po 42 měsících, byl při pravidelném přešetření zjištěn relaps onemocnění v podobě lymfadenopatie v retrokrurální oblasti vpravo (obr. 2). Do 2. linie paliativní chemoterapie byl zvolen režim Taxotere 100 mg/ m2. Celkem bylo podáno šest sérií s efektem stabilizace nemoci a následně byl pacient sledován.
Obr. 2. Obraz celotělového PET vyšetření zobrazující první relaps onemocnění (3/2008). Šipka ukazuje metabolicky aktivní infiltrát retrokrurálně. 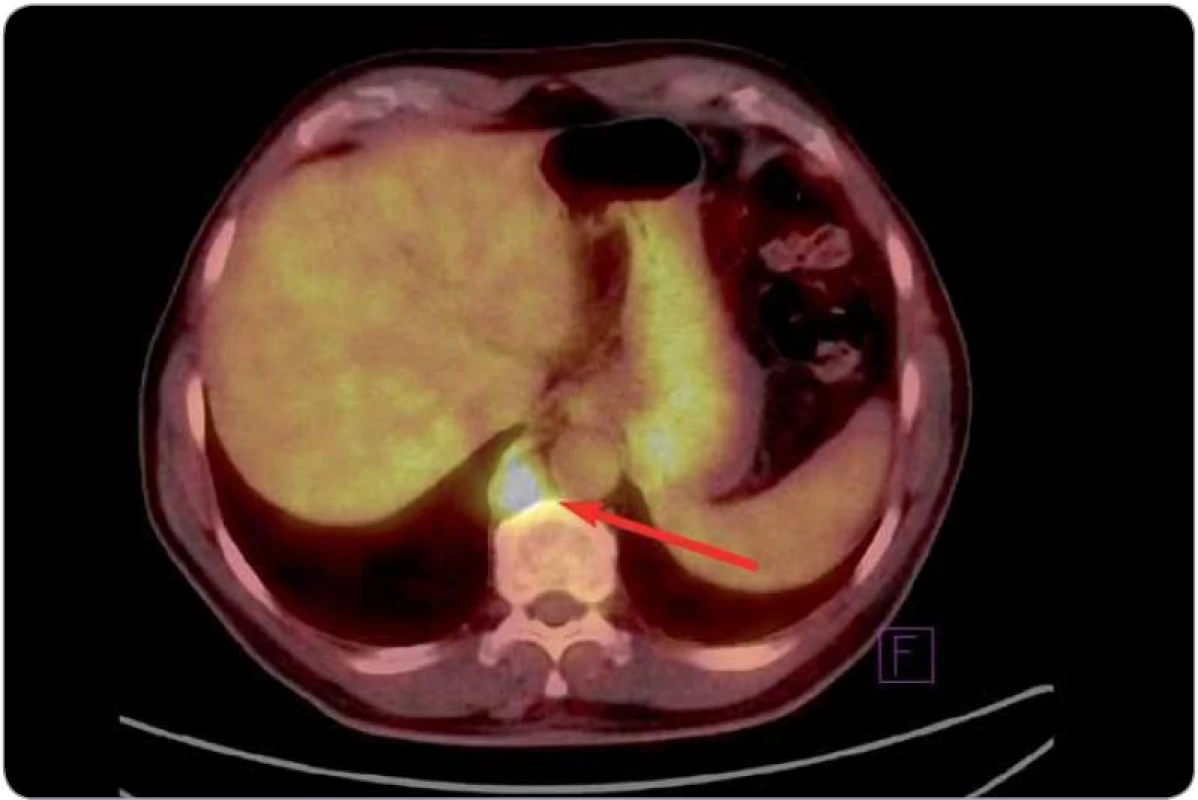
Po půl roce (leden 2009) nastala opět progrese paketu uzlin v retrokrurální oblasti. Pacient byl stále ve výborném celkovém stavu, proto byl do III. linie paliativní chemoterapie zvolen režim XENA (Xeloda 1 500 mg/ m2 p.o. ve dvou denních dávkách den 1 – 14, Navelbine 40 mg/ m2 p.o. v den 1 a 8). Po šesti sériích sice nastala regrese sledovaného paketu uzlin, při PET vyšetření však byla nově zjištěna patologická aktivita v uzlině v levé axile (obr. 3).
Obr. 3. Obraz celotělového PET vyšetření při dalším relapsu onemocnění (6/2009). Šipky ukazují metabolicky aktivní uzlinu v levé axile a sledovaný retrokrurální infiltrát. 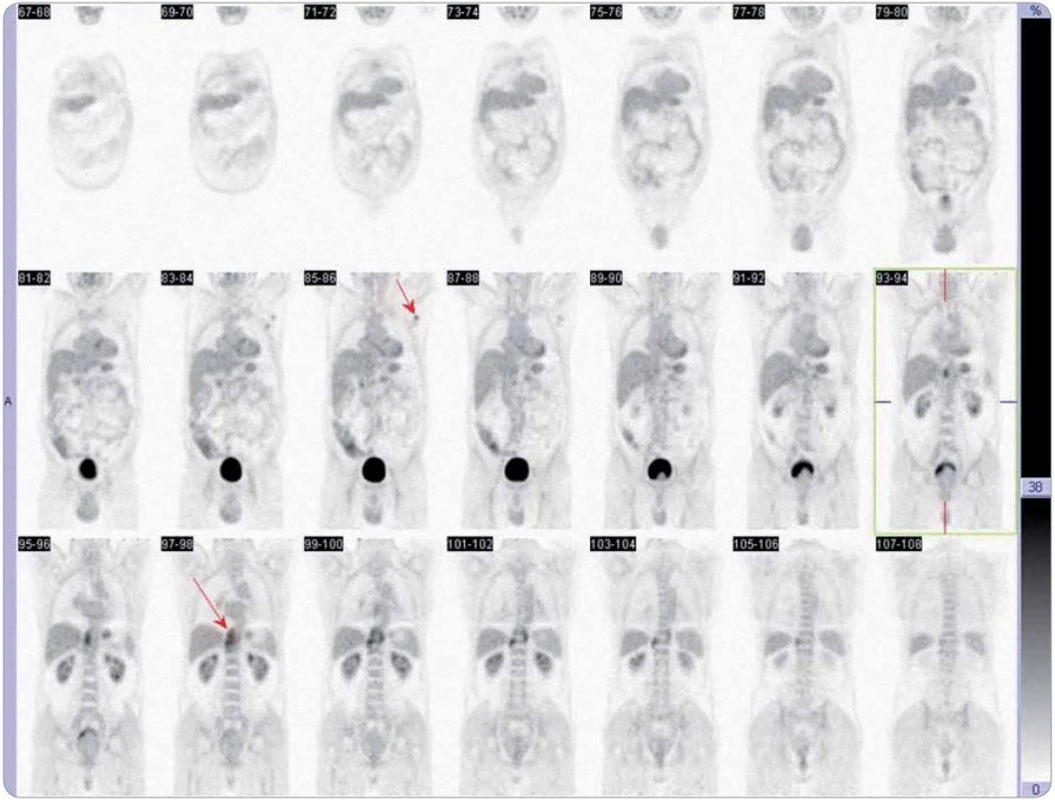
Vzhledem k netypickému průběhu onemocnění byla v červenci 2009 provedena exstirpace metabolicky aktivní uzliny z levé axily. Překvapivým nálezem byla infiltrace uzliny ne ‑ Hodgkinovým lymfomem z B lymfocytů – folikulárním lymfomem, grade 2, bez záchytu karcinomu prsu. Bylo proto přistoupeno k revizi histologického vyšetření biopsií z roku 2004, s nálezem folikulárního lymfomu, grade 1. Onemocnění bylo reklasifikováno a pacient byl odeslán k další léčbě na specializované pracoviště, kde mu byl 6krát aplikován režim R ‑ COP (rituximab 375 mg/ m2, cyklofosfamid 750 mg/ m2 + vinkristin 1,4 mg + prednison 100 mg/ den) a 2krát rituximab v monoterapii. Dávka antracyklinů byla vyčerpána při iniciální léčbě. Přešetření, PET/ CT, prokázalo významnou parciální regresi onemocnění. Za šest měsíců, v září 2010, však onemocnění opět progreduje, přičemž progrese je lokalizována pouze na retrokrurální oblast, a proto volba padá na aplikaci radioterapie (obr. 4). V listopadu 2010 pacient obdržel 33 Gy na oblast paketu retrokrurálních uzlin. Kontrolní PET/ CT vyšetření v březnu 2011 prokazuje parciální regresi infiltrátu a úplné vymizení jeho metabolické aktivity. Pacient je následně předán k dalšímu sledování na spádové pracoviště a dle posledního vyšetření v červnu 2013 stále trvá kompletní remise onemocnění.
Obr. 4. Obraz z celotělového PET/CT vyšetření před zahájením radioterapie (09/2010). Šipka ukazuje metabolicky aktivní infiltrát retrokrurálně. 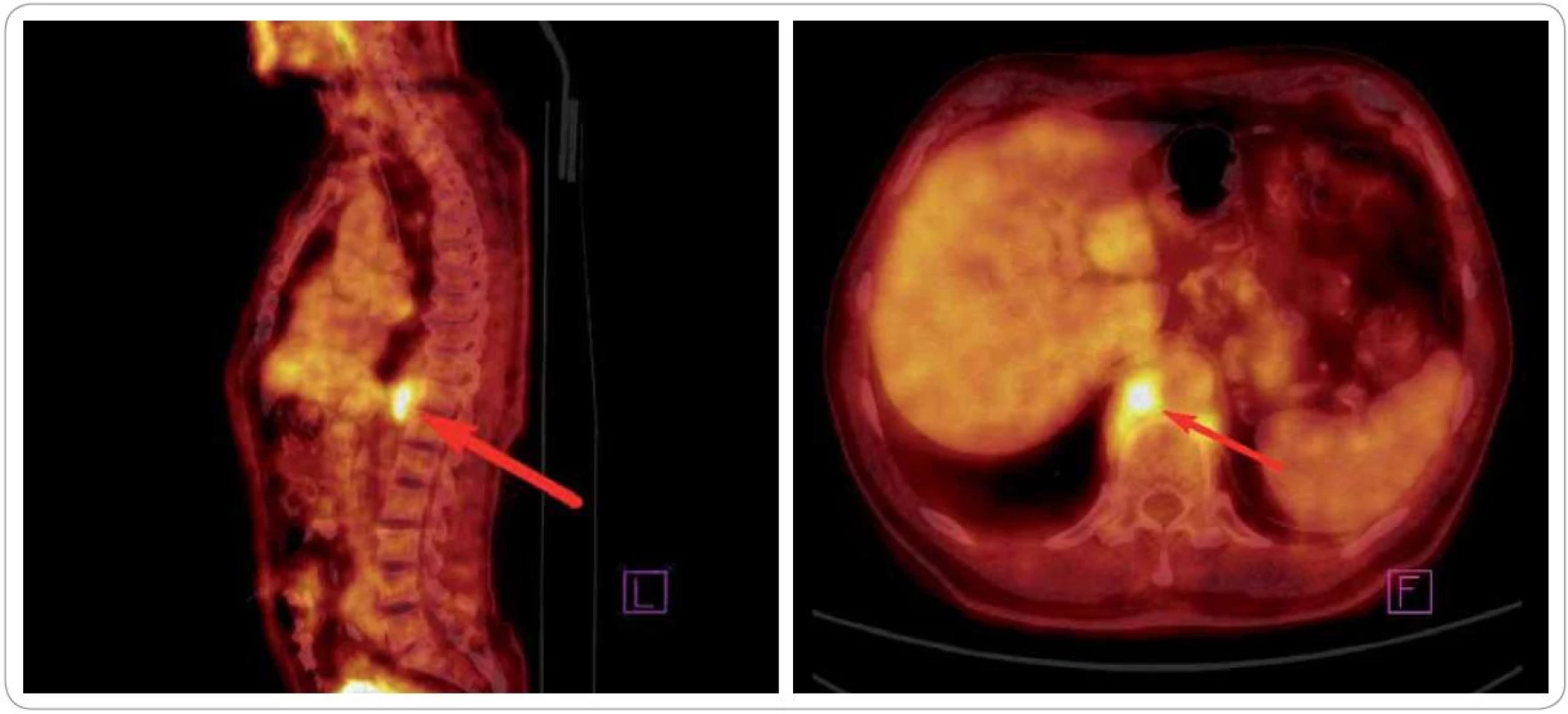
Diskuze
Popsali jsme kazuistiku muže s folikulárním NHL, který byl původně diagnostikovaný jako karcinom prsu a léčený chemoterapií a hormonoterapií pro toto onemocnění. Folikulární lymfom vzniká maligní transformací ze zralých B lymfocytů, je definován morfologickými a imunofenotypovými znaky a také přítomností translokace (14;18) (q32,q21), která vede ke vzniku fúzního genu, ve kterém se gen kódující antiapoptotický protein bcl ‑ 2 dostává z 18. chromozomu do oblasti genu kódujícího těžký imunoglobulinový řetězec (IgH) na 14. chromozomu. Výsledkem je nadměrná exprese bcl ‑ 2 proteinu, který inhibuje apoptózu nádorových buněk. Folikulární lymfomy představují kolem 20 % NHL a jejich incidence stále stoupá a pohybuje se mezi 2 – 3 případy na 100 000 obyvatel. Maximum incidence je ve věku 55 – 60 let, postiženy bývají o něco častěji ženy [8 – 10]. Z hlediska incidence je patrné, že u muže je v prsu vzácný jak výskyt primárního karcinomu, tak i primárního extranodálního NHL.
Zamýšleli jsme se nad příčinami, které vedly k počáteční chybné diagnóze a částečně tak i k neadekvátní léčbě. Případy, kdy došlo k mylné intrepretaci mikroskopického a klinického nálezu a kdy byl ne ‑ Hodgkinův lymfom iniciálně diagnostikován jako karcinom prsu, jsou v odborné literatuře popisovány pouze formou kazuistik [11 – 14]. V této souvislosti jsme zaznamenali jak případy, kdy byl NHL považován za inflamatorní karcinom prsu, tak případy, kdy se jednalo o nálezy „solidně“ uspořádaných tumorů v parenchymu prsní žlázy. Histologicky to byly různé typy NHL (např. difuzní velkobuněčný B lymfom, anaplastický B lymfom) a všechny práce shodně udávaly komplikovanost prezentovaného případu.
Myslíme si, že v případě našeho pacienta hrály významnou roli při chybném stanovení původní diagnózy tři faktory – topografie místa vzniku onemocnění, podobnost nádorového růstu a exprese steroidních receptorů.
V histologickém obraze vykazuje lobulární karcinom prsu často difuzní disociovaný růst a v případě infiltrace uzliny může narušovat její strukturu jen minimálně, přičemž folikulární zárodečná centra mohou být zachována. Exprese estrogenového receptoru (ER) na buňkách lymfatické tkáně není nic neobvyklého. Sapino et al prokázali expresi ER‑α u buněk nacházejících se v zárodečných centrech folikulů lymfatických uzlin, zatímco progesteronový receptor (PR)exprimovaly více buňky obklopující zárodečná centra [15]. Shim et al se zabývali expresí obou typů ER (α i β) na leukocytech. Prokázali, že ER ‑ α je dominantně exprimován zejména lymfocyty v zárodečných centrech, naopak exprese ER ‑ β převažovala u leukocytů periferní krve, sleziny a leukocytů infiltrujících nádorovou tkáň, stejně tak u lymfocytů některých lymfomů a u mnohočetného myelomu [16]. V kontextu s výsledky klinického vyšetření a s topografickou oblastí, ze které byla provedena první biopsie (prsní žláza a spádové lymfatické uzliny), se tedy histologický nález a základní imunoprofil shodoval s diagnózou karcinomu prsu. Pro patology byla zavádějící zejména informace o lokalizaci onemocnění, což bylo příčinou skutečnosti, proč již iniciálně nebyl nádor podroben cílenému imunohistochemickému vyšetření na hematologické malignity. Provedeno bylo naopak imunohistochemické vyšetření exprese ER ‑ α, které prokázalo jeho slabou a heterogenní pozitivitu, která byla z části přičtena na vrub technicky nezdařilého zpracování bioptického materiálu s obtížně hodnotitelnou morfologií v přehledném barvení (obr. 5, 6). Při rebiopsii lymfatické uzliny v levé axile v době relapsu choroby byl vzorek dobře zpracován (obr. 7), s neporušenou morfologií buněk a doplněné imunohistochemické vyšetření přineslo správné zařazení léze (exprese Bcl ‑ 2 proteinu, obr. 8).
Obr. 5. Technicky špatně zpracovaný vzorek tkáně z tumoru prsu (2004; barvení HE, 100×). 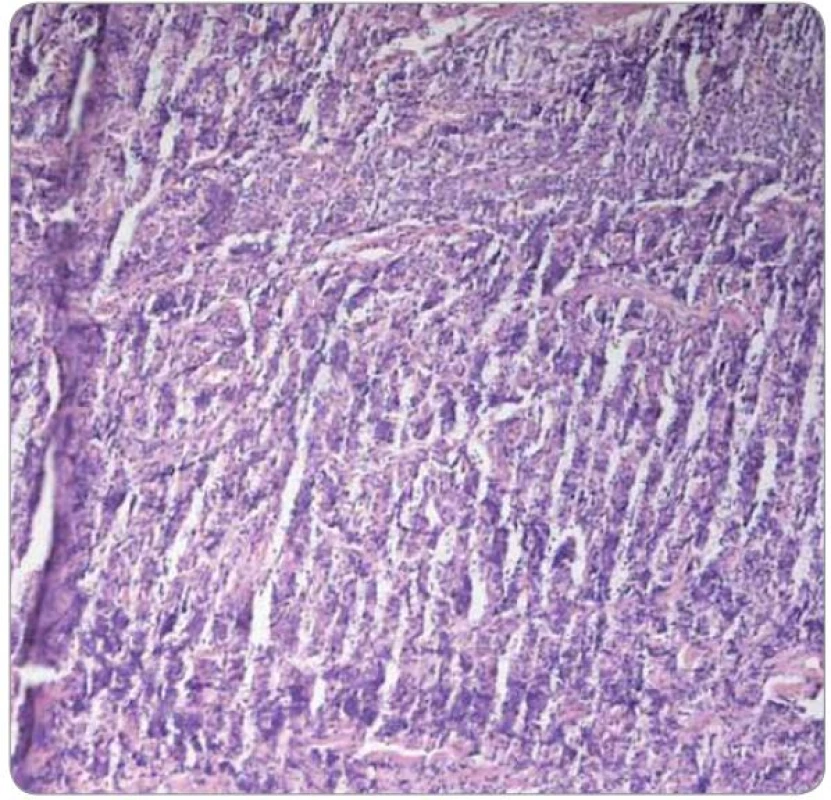
Obr. 6. Slabě a heterogenně pozitivní barvení ER-α při imunohistochemickém vyšetření nádoru z první biopsie (2004; 400×). 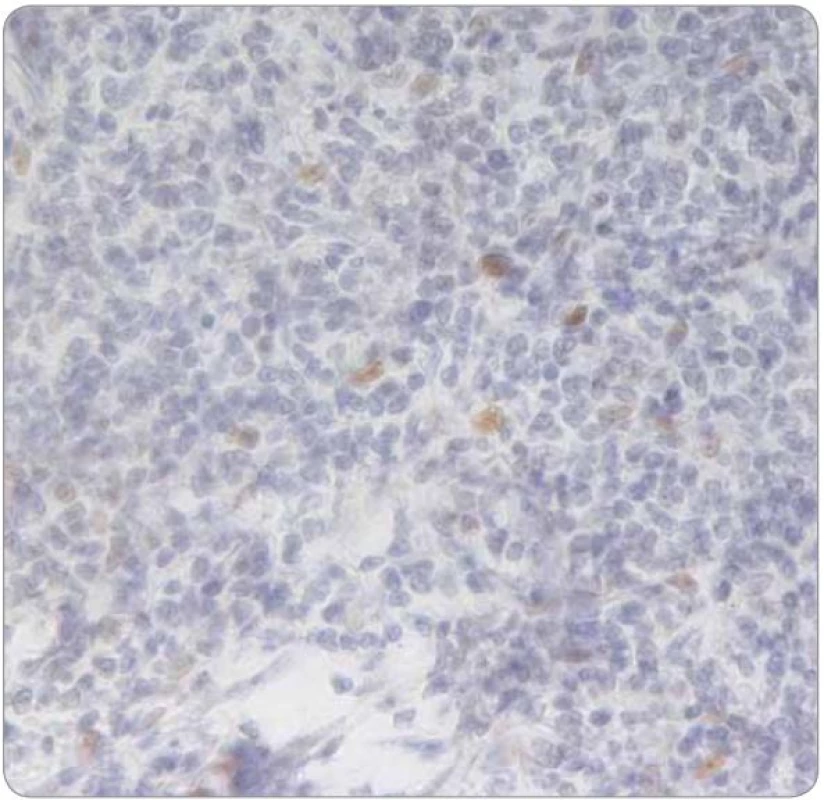
Obr. 7. Technicky dobře odebraný a zpracovaný vzorek z rebiopsie uzliny v levé axile (2009; barvení HE, 100×). 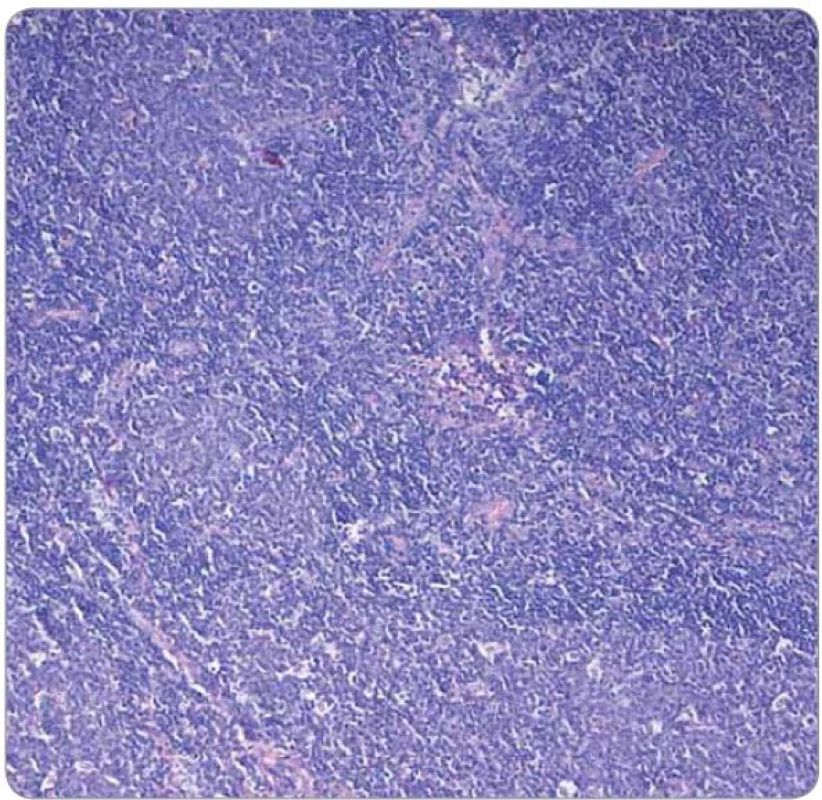
Obr. 8. Imunohistochemický průkaz exprese Bcl-2 proteinu v lymfocytech v nádorových folikulech potvrzující diagnózu folikulárního lymfomu (2009; 400×). 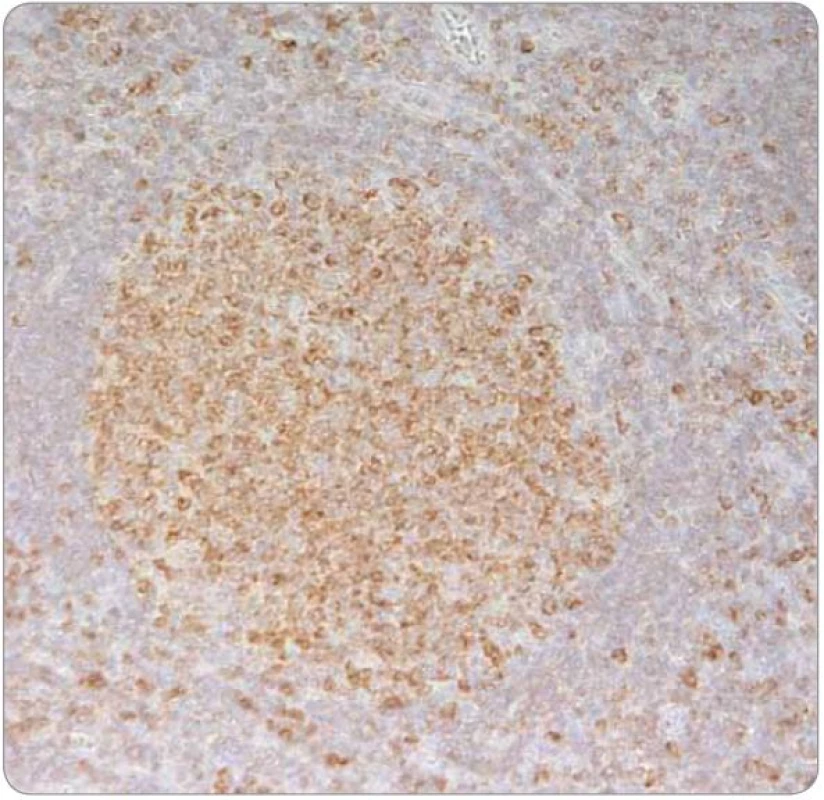
Zabývali jsme se rovněž otázkou, zda mohla být rebiopsie provedena dříve, a to v době prvního relapsu onemocnění. Obecně jistě mohla, ale nutno podotknout, že v našem případě hrála důležitou roli jak anatomická lokalizace prvního relapsu onemocnění, která nevylučovala relaps lobulárního karcinomu prsu, tak skutečnost, že onemocnění iniciálně odpovědělo kompletní remisí na chemoterapii a hormonoterapii určenou pro léčbu karcinomu prsu. Dalším faktorem bylo i to, že provedení biopsie by bylo možné pouze v rámci operačního zákroku v celkové anestezii.
V neposlední řadě jsme diskutovali i odpověď onemocnění na aplikovanou léčbu. Hlavní léčebnou modalitou v terapii folikulárního lymfomu je chemoterapie založená na kombinaci alkylačních cytostatik (cyklofosfamid), antracyklinových antibiotik (adriamycin), inhibitorů mitózy (vinkristin) a kortikoidů, v současnosti doplněná o anti‑CD20 cílenou terapii rituximabem (MabThera). První dvě uvedená cytostatika mají v léčbě hematologických malignit i solidních tumorů včetně karcinomu prsu velmi široké použití. Na druhou stranu řada dalších cytostatik užívaných v léčbě karcinomu prsu se u NHL neuplatnila, a to především pro svoji malou účinnost. Konkrétně použití docetaxelu v léčbě pacientů s NHL zkoumali američtí autoři Zekri et al či Budman et al ve studiích II. fáze. Léčba byla vždy provázena nezanedbatelnou toxicitou a limitovaným účinkem [17,18]. Obdobně užití paklitaxelu v týdenním podávání, zkoumané autory Kahl et al, nepřineslo kýžené výsledky [19]. Pro et al zkoumali užití paklitaxelu a fludafabinu u pacientů s nízce maligními NHL, kde zaznamenali určitou efektivitu tohoto kombinovaného režimu [20]. O užití vinorelbinu s prednisonem v léčbě pacientů s NHL se zmiňují italští autoři Monfardini et al [21]. Tato kombinace prokázala částečnou účinnost u nepředléčených starších pacientů, u kterých nebylo možné užít standardní agresivnější chemoterapii. Poslední z cytostatik použitých v léčbě našeho pacienta – 5 - FU – nemá v současné době využití ani v nestandardních kombinovaných režimech [22]. Protože lymfatické tkáně exprimují estrogenový receptor, bylo testováno podávání antiestrogenů pacientům s NHL. Zkoušelo se přidání tamoxifenu k režimu CHOP, ale tato změna neměla vliv na míru odpovědí na léčbu ani na celkové přežití [23]. Zkoumán byl i vztah tamoxifenu jako modulátoru mnohočetné lékové rezistence na farmakokinetiku doxorubicinu podávaného v režimu CHOP. Ani v této roli nebyl prokázán jeho klinický význam [24]. Neopominutelnou součástí léčebné strategie NHL je i radioterapie. U vybraných pacientů má své místo v rámci doplnění kurativní léčby chemoterapií a také u některých předtransplantačních režimů. Využívá se jí i k paliativní léčbě. U karcinomu prsu je radioterapie standardní součástí léčby.
V případě našeho pacienta jsme zaznamenali odpověď na léčbu v souladu s výše uvedenými informacemi. Folikulární lymfom zjevně zareagoval na iniciální chemoterapii založenou na antracyklinu a alkylační látce (epirubicin a cyklofosfomamid), stejně tak i na pozdější režim s vinorelbinem, tedy cytostatika, která se v léčbě non‑Hodgkinových lymfomů používají. Naopak od tamoxifenu ani docetaxelu nebylo možné výraznější efekt očekávat. Podání rituximabu s režimem COP a aplikace radioterapie bylo již jako součást standardní léčby NHL.
Závěr
Rebiopsie má nezastupitelné místo v procesu přehodnocení algoritmu léčby při netypickém průběhu maligního onemocnění. Měla by být zvážena i při relapsu onemocnění, zejména pokud informace o fenotypu nádoru může ovlivnit postup léčby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Obdrženo: 17. 11. 2013
Přijato: 25. 11. 2013
Zdroje
1. Úzis.cz [internetová stránka]. Ústav zdravotnických informací a statistiky ČR. Národní onkologický registr. © ÚZIS ČR 2010 – 2014 [citováno 10. 10. 2013]. Dostupné z: www.uzis.cz/ registry ‑ nzis/ nor.
2. Talwalkar SS, Miranda RN, Valbuena JR et al. Lymphomas involving the breast: a study of 106 cases comparing localized and disseminated neoplasms. Am J Surg Pathol 2008; 32(9): 1299 – 1309.
3. Sanna G, Lorizzo K, Rotmensz N et al. Breast cancer in Hodgkin‘s disease and non‑Hodgkin‘s lymphoma survivors. Ann Oncol 2007; 18(2): 288 – 292.
4. Sheen ‑ Chen SM, Eng HL. Development of malignant lymphoma subsequent to breast cancer. Eur J Cancer Care (Engl) 2007; 16(4): 331 – 332.
5. Barranger E, Marpeau O, Uzan S et al. Axillary sentinel node involvement by breast cancer coexisting with B ‑ cell follicular lymphoma in nonsentinel nodes. Breast J 2005; 11(3): 227 – 228.
6. Cuff KE, Dettrick AJ, Chern B. Synchronous breast cancer and lymphoma: a case series and a review of the literature. J Clin Pathol 2010; 63(6): 555 – 557.
7. Nagasaki E, Furuta N, Shinozaki E et al. Simultaneous detection of both non‑Hodgkin‘s lymphoma cells and breast cancer cells in pleural effusion: a case report. Gan To Kagaku Ryoho 2003; 30(10): 1523 – 1527.
8. Papajík T, Trněný M, Vášová I et al. Epidemiologie ne ‑ hodgkinových lymfomů v České republice, Evropě a Severní Americe. Onkologie 2009; 3(3): 141 – 146.
9. Benešová K, Trněný M. Folikulární lymfom. Postgrad Med 2010; 6 : 692 – 696.
10. Češka R et al (eds). Lymfomy non‑Hodgkinovy. Interna. Praha: Triton 2010.
11. Taubman K, McKay M. Axillary lymphoma masque-rading as inflammatory breast cancer. Biomed Imaging Interv J 2006; 2(3): e36.
12. Pereira EM, Maeda SA, Reis ‑ Filho JS. Sarcomatoid variant of anaplastic large cell lymphoma mimicking a primary breast cancer: a challenging diagnosis. Arch Pathol Lab Med 2002; 126(6): 723 – 726.
13. Anne N, Pallapothu R. Lymphoma of the breast: a mimic of inflammatory breast cancer. World J Surg Oncol 2011; 9 : 125.
14. Pruthi S, Stafyla VK, Phillips SW et al. Primary mammary (non‑Hodgkin) lymphoma presenting as locally advanced breast cancer. Mayo Clin Proc 2004; 79(10): 1310 – 1314.
15. Sapino A, Cassoni P, Ferrero E et al. Estrogen receptor α is a novel marker expressed by follicular dendritic cells in lymph nodes and tumor‑associated lymphoid infiltrates. Am J Pathol 2003; 163(4): 1313 – 1320.
16. Shim GJ, Gherman D, Kim HJ et al. Differential expression of oestrogen receptors in human secondary lymphoid tissues. J Pathol 2006; 208(3): 408 – 414.
17. Zekri JM, Hough RE, Davies JM at al. Phase II study of docetaxel in patients with relapsed or refractory malignant lymphoma. Br J Cancer 2003; 88(9): 1335 – 1338.
18. Budman DR, Petroni GR, Johnson JL et al. Phase II trial of docetaxel in non‑Hodgkin‘s lymphomas: a study of the Cancer and Leukemia Group B. J Clin Oncol 1997; 15(10): 3275 – 3279.
19. Kahl BS, Bailey HH, Smith EP et al. Phase II study of weekly low‑dose paclitaxel for relapsed and refractory non‑Hodgkin‘s lymphoma: a Wisconsin Oncology Network Study. Cancer Invest 2005; 23(1): 13 – 18.
20. Pro B, Hagemeister FB, McLaughlin P et al. Phase 2 study of fludarabine and paclitaxel in patients with recurrent low ‑ grade non‑Hodgkin‘s lymphoma. Leuk Lymphoma 2006; 47(9): 1818 – 1821.
21. Monfardini S, Aversa SM, Zoli V et al. Vinorelbine and prednisone in frail elderly patients with intermediate ‑ high grade non‑Hodgkin‘s lymphomas. Ann Oncol 2005; 16(8): 1352 – 1358.
22. Guglielmi C, Amadori S, Anselmo AP et al. Sequential combination chemotherapy of high‑grade non‑Hodgkin‘s lymphoma with 5 - fluorouracil, methotrexate, cytosine ‑ arabinoside, cyclophosphamide, doxorubicin, vincristine, and prednisone (F ‑ MACHOP). Cancer Invest 1987; 5(3): 159 – 169.
23. Ezzat AA, Ibrahim EM, Start RK et al: Adding high‑dose tamoxifen to CHOP does not influence response or survival in aggressive non‑Hodgkin‘s lymphoma: an interim analysis of a randomized phase III trial. Med Oncol 2000; 17(1): 39 – 46.
24. El ‑ Yazigi A, Berry J, Ezzat A et al. Effect of tamoxifen on the pharmacokinetics of doxorubicin in patients with non‑Hodgkin‘s lymphoma. Ther Drug Monit 1997; 19(6): 632 – 636.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Nejasný stín na plicích – kazuistika
-
Všetky články tohto čísla
- Aplikace poznatků psychoneuroimunologie v kontextu komplexní onkologické léčby karcinomu prsu
- Mamografický screening u brazilských žen z hlediska socio‑ ekonomické stratifikace
- Léčba anakinrou u Schnitzler‑ syndromu – výsledky první retrospektivní multicentrické studie šesti pacientů z České republiky
- Význam standardizace v hodnocení populačního přežití onkologických pacientů v ČR – metodický koncept a výsledky analýzy dat Národního onkologického registru
- Adenokarcinóm rete testis – zriedkavý prípad testikulárnej malignity
- Informace z České onkologické společnosti
- Renálny onkocytóm s histologickými črtami invázie – kazuistika
- Další postupný ústup od axilární disekce u časného karcinomu prsu
- Zajímavé případy z nutriční péče v onkologii
- Massive Cutaneous Metastasis of a Renal Cell Carcinoma
- Soutěž o nejlepší práci
- Editorial
- Role mikroRNA v molekulární patologii karcinomu jícnu a jejich potenciální využití v klinické onkologii
- Lobulární karcinom prsu u muže – kazuistika a přehled literatury
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Aplikace poznatků psychoneuroimunologie v kontextu komplexní onkologické léčby karcinomu prsu
- Renálny onkocytóm s histologickými črtami invázie – kazuistika
- Další postupný ústup od axilární disekce u časného karcinomu prsu
- Lobulární karcinom prsu u muže – kazuistika a přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



