-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Patofyziologie kompresivní radikulopatie
Pathophysiology of Compressive Radiculopathy
A relati onship between compressi on of the spinal ro ots and radiculopathy was described by Mixter and Barr in 1934. However, the compressi on of an intact spinal ro ot le ads only to paraesthesi a and does not explain the inducti on of radicular ne uropathic pain. Recent experimental and clinical studi es de aling with the discogenic eti ology of radiculopathy have documented the essenti al role of an inflammatory re acti on for the inducti on of clinical symptomatology. Therefore, the pathophysi ology of compressi on radiculopathy may be considered multifactori al. A mechanical effect during compressi on of the spinal ro ots le ads to changes of blo od supply and direct injury to nervo us tissue. Changes of connective tissue with endone uri al fibrosis prevail during chronic compressi on. An injury to the spinal ro ots also le ads to rele ase of pro inflammatory cytokines and the invasi on of macrophages. The prolapsed tissue of the intervertebral disc can also play an active role in the formati on of a pro - inflammatory environment. The inflammatory re acti on cre ates the conditi ons that ca use irritati on of the spinal ro ots and inducti on of the radicular ne uropathic pain. An accurate understanding of both the mechanical and the inflammatory roles in compressi on radiculopathy allows selecti on of an optimal tre atment strategy.
Key words:
spinal ro ot – compressi on – vascular supply – inflammati on – macrophage – cytokine
Autoři: R. Jančálek 1,2; P. Dubový 2; Z. Novák 1
Působiště autorů: Ne urochirurgická klinika LF MU a FN u sv. Anny v Brně 1; Oddělení ne uro anatomi e Anatomického ústavu LF MU, Brno 2
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(4): 405-413
Kategorie: Přehledný referát
Podporováno granty GAČR 309/ 07/ 0121 a MSM0021622404.
Souhrn
So uvislost mezi kompresí spinálního kořene a radikulopati í popsali Mixter a Barr v roce 1934. Komprese intaktního spinálního kořene ovšem vede k rozvoji parestezi í a nevysvětluje tak rozvoj ne uropatické radikulární bolesti. Recentní experimentální i klinické studi e zabývající se diskogenní eti ologi í radikulopati e prokázaly zásadní úlohu zánětlivé re akce při rozvoji klinické symptomatologi e. Patofyzi ologi e kompresivní radikulopati e je tedy multifaktori ální. Mechanickým působením dochází u komprese spinálních kořenů jak ke změnám prokrvení, tak k přímému poškození nervové tkáně. Následkem může být rozvoj zánikové radikulární symptomatologi e. U chronické komprese nabývají na důležitosti změny pojivové tkáně s endone uri ální fibrózo u. Poškození spinálních kořenů vede dále k uvolnění prozánětlivých cytokinů a k lokální invazi buněk monocyto - makrofágového systému. Také vyhřezlá tkáň mezi obratlové ploténky vytváří aktivně prozánětlivé prostředí. Zánětlivá re akce pak napomáhá rozvoji iritační symptomatologi e včetně radikulární ne uropatické bolesti. Poznání úlohy mechanické komprese a zánětlivé re akce v patofyzi ologii kompresivní radikulopati e umožní správno u volbu léčebné strategi e v klinické praxi.
Klíčová slova:
spinální kořen – komprese – cévní zásobení – zánět – makrofágy – cytokiny
Radikulopati e při spinálním postižení patří mezi časté důvody návštěvy paci entů u ne urologa nebo ne urochirurga. Nejběžnější příčino u radikulopati e je komprese spinálního kořene (SK) výhřezem mezi obratlové ploténky (MP), stenózo u páteřního kanálu nebo jejich kombinací. Komprese SK ne vždy ovšem vede k rozvoji klinické symptomatologi e. Asi 20 – 30 % paci entů má i přes absenci odpovídající klinické symptomatologi e pozitivní nález na vyšetřeních zobrazovacími modalitami [1].
Ačkoliv je stále platné mechanické pojetí kompresivní radikulopati e, které popsali již Mixter a Barr [2], nevysvětluje samotná komprese SK rozvoj ne uropatické radikulární bolesti, protože tlak na zánětem nepostižený SK vede po uze k rozvoji parestezi í. Recentní experimentální i klinické studi e zabývající se diskogenní eti ologi í radikulopati e prokázaly zásadní úlohu zánětlivé re akce při rozvoji klinické symptomatologi e. Komprese spinálního kořene způsobuje zvýšení tlaku v endone uri álním kompartmentu s následným snížením krevního průtoku a poškozením struktury nervové tkáně [3]. Vlivem mechanického poškození dochází k uvolnění prozánětlivých cytokinů a rozvoji zánětlivé re akce [4].
I přes rozdílnosti ve vlastní příčině kompresivní radikulopati e lze tedy vysledovat společné rysy, které se podílejí na rozvoji klinické symptomatologi e u postižení SK. Můžeme tak definovat dvě základní skupiny mechanizmů odpovědných za rozvoj klinicky manifestní radikulopati e: komprese SK a lokální zánětlivá re akce. Pro správno u léčbu kompresivní radikulopati e je proto nutné pochopit její komplexní patofyzi ologii.
I. Mechanické vlivy u kompresivní radikulopati e
Histologická stavba SK se od obecné stavby periferního nervu (PN) odlišuje především množstvím pojivové tkáně a nepřítomností organizace obalových struktur, které jso u charakteristické pro PN, což je významné zejména za patologických podmínek. Podstatně menší množství kolagenu ve SK je například činí méně odolné vůči kompresi. Vzhledem k náchylnosti SK k působení mechanických sil je důležité jejich uložení uvnitř páteřního kanálu. Další významno u roli hraje organizace cévního zásobení spinálních kořenů (SK) a spinálních gangli í (SG) a také prostředí mozkomíšního moku, které působí jako nárazníkový systém.
Páteř má nejen funkci staticko u, ochranno u, ale je to struktura „dynamická“, měnící svoje zakřivení při pohybech těla. Spinální kořeny proto nejso u za svého průběhu subarachno idálním prostorem ani v oblasti foramina intervertebrali a rigidně fixovány. Za fyzi ologických podmínek dochází k longitudinálnímu pohybu SK L4 – S1 o 0,5 – 5 mm a jejich prodlo užení o 2 – 4 % délky. Při flexi dolních končetin v kyčli se spinální kořeny pohybují laterálně směrem k pediklu, s nímž se dostávají do kontaktu po dosažení úhlu 60° [5]. Při kompresi SK nastává omezení jejich pohyblivosti, a proto je pozitivita napínacích manévrů jedním z nejpřesnějších di agnostických testů.
Peroperačně byly prokázány adheze mezi SK a vyhřezlo u MP, které vznikají při lokální zánětlivé re akci a způsobí tak relativní fixaci SK [6]. Při pohybu proto dochází k opakovaným mikrotra umatizacím SK působením kompresivních a tenzních sil, což vede k rozvoji radikulopati e. Z tohoto pohledu je chronická komprese SK vlastně séri í epizod lehké akutní tra umatizace. Rovněž pozitivita napínacích manévrů odpovídá mnohem více stupni fixace SK než velikosti vlastního výhřezu MP. V některých případech to může být jeden z důvodů asymptomatického průběhu u výhřezů MP [6].
Cévní zásobení spinálních kořenů a spinálních gangli í
Důležito u so učástí SK jso u cévy, které mají nutritivní funkci a odvádějí produkty metabolizmu, čímž se podílejí na složení endone uri álního kompartmentu. Mezi endoteli álními buňkami kapilární sítě ve SK jso u spoje typu „tight juncti on“ (těsné spojení), které tvoří jednu komponentu hemato - nervové bari éry periferního nervového systému. Komprese SK vede k postižení nejen nervové tkáně, ale zpočátku především cév, které jso u k deformačnímu působení zevních sil mnohem vnímavější.
Cévní zásobení SK lze rozdělit do dvo u systémů – povrchový cévní systém lokalizovaný v obalech SK a intraradikulární cévní systém. Za hlavní nutritivní arteri e SK, které se podílejí na tvorbě intraradikulární cévní pleteně, jso u považovány distální a proximální radikulární arteri e [7]. K povrchové cévní pleteni řadíme radikulo - medulární arteri e, které vytvářejí přední a zadní spinální arteri e (schéma 1). Jejich podíl na výživě SK je však minimální.
Schéma 1. Schematické znázornění cévního zásobení spinálních kořenů. RA – radikulární arterie [7]. ![Schéma 1. Schematické znázornění cévního zásobení spinálních kořenů.
RA – radikulární arterie [7].](https://pl-master.mdcdn.cz/media/image/a359f8dafae5ebf3f63a0736af8cf485.jpg?version=1537795689)
Krevní tok v oblasti distální radikulární arteri e směřuje centripetálně, v oblasti proximální radikulární arteri e centrifugálně. Tyto arteri e spolu anastomózují v oblasti proximální třetiny SK, kde se nachází oblast „watershed zone“ (vulnerabilní přechodová oblast mezi dvěma periferními cévními řečištěmi). V případě radikulární komprese dochází k obrácení toku krve, čímž se může uplatnit alespoň v omezeném rozsahu kolaterální oběh, který zmírní dopady kompresivní ischemi e nervové tkáně.
Spinální gangli on má své vlastní cévní zásobení, které má původ ve větvích spinálních segmentálních arteri í. Ve srovnání se SK je cévní zásobení SG podstatně bohatší [7]. Tyto rozdíly jso u pravděpodobně spojeny s vyššími nutritivními nároky perikayí ne uronů, která se nacházejí v SG. Na rozdíl od SK jso u ve SG přítomny fenestrované kapiláry, což významně porušuje hemato-nervovo u bari éru.
Opakovaný mechanický stres cév SK a SG vede k epizodám ischemi e a hypoxi e doprovázeným snížením pH a porušením hemato-nervové bari éry. Tato lokální re akce vede k rozvoji endone uri álního edému a demyelinizaci nervových vláken s následno u změno u funkční charakteristiky SK včetně jejich zvýšené citlivosti [8]. Hyperstimulací aferentních drah pak dochází k rozvoji radikulární bolesti.
Stupeň ischemického postižení SK ovlivňuje poměr kompresivní síly a aktuální výše arteri álního tlaku. Snížení krevního průtoku SK na 30 – 50 % původní hodnoty vede ke snížení oxidativní fosforylace s následným postižením membránových i ontových pump a axoplazmatického transportu. Překročením hodnot středního arteri álního tlaku dochází k anoxickému bloku membránových i plazmatických transportních mechanizmů, které způsobují porušení integrity axolemy a další zvýšení endone uri álního tlaku. Tím se vytváří uzavřený cyklus re akcí. Další faktory, které se podílejí na zvýšení endone uri álního tlaku, jso u axoplazmatický edém, proliferace Schwannových buněk a invaze imunokompetentních buněk při indukci lokální zánětlivé re akce.
Akutní komprese spinálních kořenů
Komprese SK vede přímo nebo nepřímo k poškození nervové tkáně. Po kompresi SK dochází v akutní fázi nejen k degenerativním změnám nervových vláken, ale také k dilataci endone uri álních cév s následno u kongescí a rozvojem endone uri álního edému. Do endone uri a SK se dostávají krevní buněčné elementy s převaho u buněk s fagocytární schopností.
Stupeň poškození nervové tkáně narůstá se zvyšující se intenzito u působícího tlaku. Některé experimentální a klinické studi e se zabývaly korelací mezi výší působícího mechanického tlaku a intenzito u vyvolaných změn. Olmarker udává 10 mmHg jako kritický mechanický tlak, který způsobuje postižení intraradikulární mikrocirkulace, a tedy výživy SK [9]. Působením vyššího mechanického tlaku na SK dochází inici álně k venózní obstrukci, což má za následek zvýšení endone uri álního tlaku, který se klinicky projevuje snížením rychlosti vedení akčního potenci álu. Experimentální práce, které se zabývaly vlivem stupňované komprese, zjistily postižení funkce SK při náhlém vzestupu mechanického tlaku na hodnotu 50 mmHg [10]. Při protrahovaném působení mechanického tlaku 60 mmHg je již ohrožena vitalita nervových vláken vytvořením lokálního metabolického bloku následkem cévní okluze a strukturální deformací nervových vláken. Působením mechanického tlaku na úrovni středního arteri álního tlaku nastává úplná ischemi e SK. Při vzestupu působícího mechanického tlaku na 90 mmHg a výše dochází již k výrazné strukturální deformaci nervových vláken a pojivových obalů nervu, včetně radikulárních cévních pletení. To má za následek nevratné strukturální změny především velkých myelinizovaných nervových vláken, která podléhají Wallerově degeneraci.
Chronická komprese spinálních kořenů
Jestliže akutní komprese SK vyvolává změny v krevním zásobení SK a poškozuje přímo nervovo u tkáň, nabývají při chronické kompresi na významu změny pojivové tkáně. Citlivost SK na chronicko u kompresi je dána jejich vnitřní stavbo u (nižší obsah pojivové tkáně) a místem působení tlaku (malá vzdálenost od trofického centra ne uronu – perikarya). S prodlužující se dobo u komprese dochází ke zmírnění akutních zánětlivých změn, zatímco do popředí vystupují fibrózní změny endone uri a a obalu SK. Histologicky jso u přítomny známky jak Wallerovy degenerace, tak insufici entní regenerace. Také u chronické komprese SK se na patofyzi ologii významně podílí změny prokrvení.
Klinická symptomatologi e u kompresivní radikulopati e
Působením zevních sil na SK dochází při zvýšení endone uri álního tlaku k poškození především silných myelinizovaných nervových vláken jak jejich přímo u kompresí, tak rozvojem ischemi e při snížení krevního průtoku komprimovanými cévami (schéma 3). Endone uri ální edém vede ke změnám v i ontovém složení endone uri álního kompartmentu. Tyto změny moho u způsobit postižení funkce nervových vláken s rozvojem senzitivní nebo motorické zánikové radikulární symptomatologi e.
Schéma 2. Schéma patofyziologie kompresivní radikulopatie. MP – mezi obratlová ploténka, SK – spinální kořen. 
Komprese SK vede také k rozvoji ne uropatické radikulární bolesti. Vlivem komprese dochází k porušení myelinových obalů především silnějších aferentních nervových vláken. Efaptické interakce mezi axony takto postižených nervových vláken a vlákny sympatickými vedo u k lokální ektopické hyperstimulaci aferentních drah. Přímé či nepřímé poškození nervových vláken způsobuje také senzitizaci nociceptivních a WDR (Wide - Dynamic - Range, ne urony zadních rohů míšních speci alizované na kódování intenzity centripetálně vedeného podnětu) ne uronů v oblasti zadních rohů míšních. Tyto změny vyvolávají hyperstimulaci drah bolesti s následným rozvojem hyperalgezi e [11].
Dále dochází při poškození SK k větvení sympatických nervových vláken ve SG, kde se dostávají do kontaktu s perikaryi pse udo unipolárních ne uronů [12,13]. Následkem je hyperstimulace aferentních ne uronů s rozvojem allodyni e [14].
Stadi a kompresivní radikulopati e
Na základě výsledků naší experimentální studi e lze průběh radikulární komprese rozdělit do tří fází [3]. První fáze „akutní kompresivní radikulopati e“ vzniká v okamžiku uplatnění komprese na SK a trvá řádově dny. Z morfologického hlediska je charakterizována endone uri álním edémem a degenerativními změnami především silně myelinizovaných nervových vláken. V závislosti na stupni nervového poškození a zachování obalových struktur lze tuto fázi radikulární komprese považovat za plně reverzibilní.
Po akutním stadi u radikulární komprese následuje období „kompenzované kompresivní radikulopati e“, ve kterém jso u stále vytvářeny podmínky pro regeneraci nervové tkáně. Regeneraci probíhající ve fázi kompenzované radikulopati e nelze považovat za plnohodnotno u, jelikož v místě komprese přetrvává i přes postupný nárůst celkového počtu nervových vláken výrazně menší podíl myelinizovaných nervových vláken většího kalibru. Charakteristickým rysem tohoto období je zvýšení celularity endone uri a s výrazným podílem buněk s fagocytární aktivito u, které se podílejí na úklidu buněčných fragmentů po proběhlé degeneraci a vytváření prostředí vhodného pro regeneraci nervových vláken. Stadi um kompenzované radikulopati e trvá řádově týdny a stále umožňuje úspěšno u funkční obnovu SK v případě dekomprese.
Při kompresi trvající řádově několik měsíců dochází postupně k vyčerpání regeneračního potenci álu a nastupuje období „dekompenzované kompresivní radikulopati e“. To je charakterizováno regresivními změnami vedo ucími k endone uri ální fibróze a ischemizaci nervových vláken, která podléhají degeneraci nejen v místě komprese SK. Progredující endone uri ální fibróza je nevratný děj, který limituje funkční obnovu SK v případě dekomprese.
II. Vlivy lokální zánětlivé re akce u kompresivní radikulopati e
Mechanické poškození spinálních kořenů vede k uvolnění prozánětlivých cytokinů a k lokální invazi buněk monocyto - makrofágového systému. Také vyhřezlá tkáň mezi obratlové ploténky vytváří aktivně prozánětlivé prostředí. Zánětlivá re akce pak přispívá k rozvoji iritační symptomatologi e včetně radikulární ne uropatické bolesti.
Vliv mezi obratlové ploténky na rozvoj radikulopati e
Kromě mechanického působení vyhřezlé MP je nutné se zmínit také o jejím prozánětlivém potenci álu. Po aplikaci a utologního nucle us pulposus i bez přítomnosti mechanické komprese byl potvrzen rozvoj zánětlivé radikulopati e s odpovídajícími histologickými a funkčními změnami SK [15 – 17].
Tkáň nucle us pulposus (NP) ztrácí v časném stadi u ontogenetického vývoje své cévní zásobení, a stává se tak avaskulární strukturo u, která se vyvíjí mimo dosah imunitního systému. Přítomnost proteoglykanů s potenci álně antigenními vlastnostmi vedla k formulaci hypotézy o indukci „a uto imunitní re akce“ při kontaktu vyhřezlé tkáně NP s imunokompetentními buňkami. Již v roce 1965 prokázali Bobechko a Hirsch ve své experimentální práci indukci zánětlivé re akce po aplikaci a utologní tkáně NP do defektu chrupavky ušního boltce u králíka [18]. Také následující práce jiných a utorů potvrdily prozánětlivý potenci ál NP [15,19,20]. Tyto studi e, prokazující nepřímo a uto imunitní re akci vůči antigenům vyhřezlé MP, byly podpořeny nálezy aktivovaných T‑lymfocytů a B‑lymfocytů v akutní fázi výhřezu MP a depozity imunokomplexů [21].
K označení imunitní re akce za a utoimunitní je kromě přítomnosti lymfocytární infiltrace nutná také přítomnost specifických receptorů na populacích T‑lymfocytů, které přednostně proliferují nebo se projevují cytotoxicito u vůči antigenům a utologních tkání. Prokázat tyto T‑lymfocytární populace z buněčného infiltrátu MP je velmi obtížné vzhledem k jejich malému procentuálnímu zasto upení. Mnohem větší důraz je kladen na nespecificko u zánětlivo u re akci, při které hrají významno u úlohu buňky monocyto - makrofágového systému tvořící hlavní část zánětlivého infiltrátu vyhřezlé MP [22].
Již v průběhu druhé dekády života dochází k degenerativním změnám MP, které jso u charakterizované odlišným složením extracelulární matrix, a odrážejí fenotypové změny buněčné populace. Část buněk anulus fibrosus a NP (histi ocyty, fibroblasty, chondrocyty) získává schopnost produkovat zánětlivé medi átory (tab. 1). Je tedy zřejmé, že MP není jen inertní strukturo u, která způsobuje při výhřezu tlak na SK nebo je nositelem po uze pasivních iritačních či antigenních vlastností. Mezi obratlová ploténka je v procesu degenerace páteře významno u strukturo u, která aktivně vytváří prozánětlivé prostředí a svým kontaktem se SK vede k rozvoji radikulopati e, mezi jejíž klinické projevy patří i ne uropatická bolest.
Tab. 1. Vybrané publikace věnující se produkci zánětlivých mediátorů tkání vyhřezlé MP. TNF-α (Tumor Ne crosis Factor α), IL-1α (interleukin-1α ), IL-1β (interleukin-1β), IL-6 (interleukin-6), IL-8 (interleukin-8), IL-10 (interleukin-10), GM-CSF (Granulocyte Macrophage Colony Stimulation Factor), TGF-β (Transforming Growth Factor-β), bFGF (Basic Fibroblast Growth Factor), IGF-1 (Insulin-Like Growth Factor), PLA2 (fosfolipáza A2), PGE2 (prostaglandin E2). 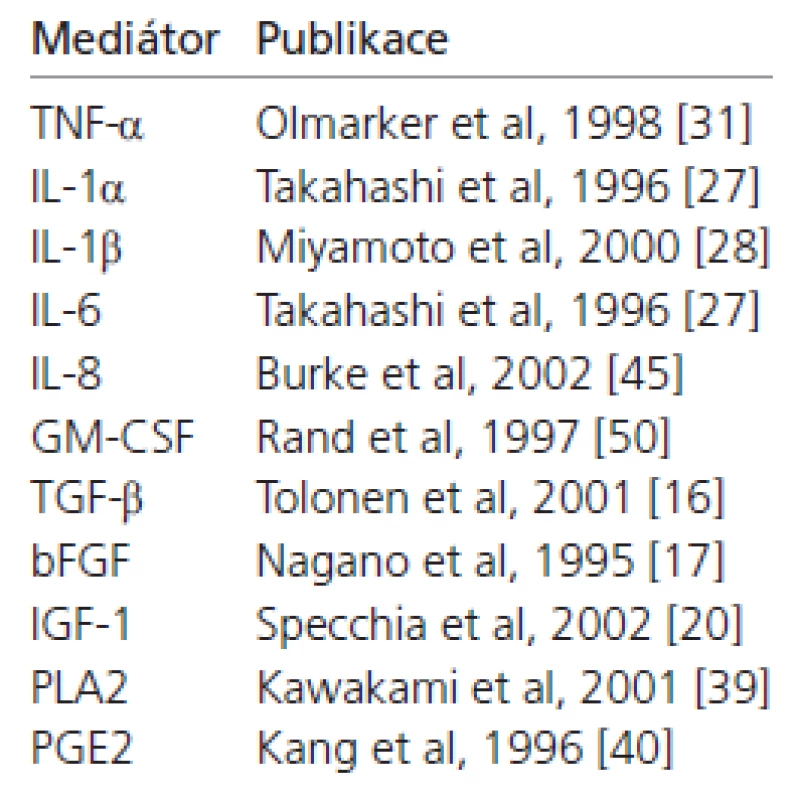
Kompresivní radikulopati e a zánětlivá re akce
Přestože může být eti ologi e radikulopati e při spinálním postižení různorodá, je společným důsledkem lokální zánětlivá re akce, která vytváří podmínky pro rozvoj ne uropatické radikulární bolesti [11]. Mezi medi átory zánětu, které se podílejí na patofyzi ologii kompresivní radikulopati e, patří patří IL‑1a (interle ukin‑1a), IL‑1b (interle ukin‑1b), IL‑6 (interle ukin‑6), IL‑8 (interle ukin‑8), TNF‑a (Tumor Necrosis Factor a), NGF (Nerve Growth Factor), PGE2 (prostaglandin E2) a NO (oxid dusnatý). U těchto medi átorů byla experimentálními studi emi potvrzena jak indukce hyperalgezi e po jejich exogenním podání, tak zmírnění těchto symptomů po ne utralizaci nebo podání specifických antagonistů jejich receptorů.
Cytokiny
Cytokiny jso u buňkami produkované polypeptidy, které slo uží jako intercelulární medi átory regulující imunitní systém a zánětlivo u re akci. Mezi jejich zástupce patří interle ukiny, chemokiny, interferony a další faktory, jako jso u TNF a GM‑CSF. Imunohistochemicky byla prokázána syntéza cytokinů nejen v imunokompetentních buňkách, ale také Schwannovými a endoteli álními buňkami, chondrocyty a fibroblasty granulační tkáně při sekvestraci MP [23 – 25]. Jednotlivé cytokiny přitom moho u mít prozánětlivý nebo protizánětlivý potenci ál, případně jejich kombinaci na základě rozdílné receptorové výbavy cílových imunokompetentních buněk v různých stadi ích zánětu. Mezi cytokiny podporující zánětlivo u re akci (prozánětlivé cytokiny) patří například IL‑1, IL‑6, TNF‑a. K protizánětlivým cytokinům, které zprostředkují zpětnovazebno u kontrolu zánětlivé re akce, řadíme IL‑4, IL‑10 nebo IL‑12.
V so uvislosti se zánětlivo u re akcí po poškození periferních nervů patří k nejvíce prostudovaným cytokinům IL‑1 a TNF‑a, jejichž účinek se navzájem prolíná (schéma 3). Zmíněné cytokiny se účastní inici ace kaskády dalších bi ologicky aktivních molekul, jako jso u NGF, PGE2, NO, které se významně podílejí na indukci ne uropatické bolesti.
Schéma 3. Schéma komplexního vlivu IL-1 a TNF-α na produkci dalších mediátorů zánětu. 
IL‑1 (interle ukin‑1)
Interle ukin‑1 je obecné označení pro skupinu cytokinů se silným prozánětlivým potenci álem, mezi jejichž hlavní zástupce patří IL‑1a a IL‑1b. Kompresí SK dochází k porušení struktury nervových vláken doprovázenému dalšími buněčnými a molekulárními změnami, které jso u zahrnuty do obecného termínu Wallerova degenerace. Ve své podstatě představuje Wallerova degenerace asepticko u zánětlivo u re akci, na jejímž průběhu se podílí řada zánětlivých faktorů. Strukturální poškození axonu stimuluje syntézu IL‑1a a TNF‑a ve Schwannových buňkách a v následné peri odě také IL‑1b [26 – 28]. Působením těchto cytokinů na fibroblasty a makrofágy dochází k jejich aktivaci a syntéze s uvolněním dalších cytokinů s prozánětlivými i protizánětlivými vlastnostmi (schéma 4).
Schéma 4. Schéma interakce ně kte rých cytokinů v průběhu Wallerovy degenerace. Plná šipka – stimulační vliv, přerušovaná čára – inhibiční vliv. 
IL‑1 se kromě účasti na imunitních re akcích organizmu podílí buď přímo, nebo nepřímo na patofyzi ologii ne uropatické bolesti [29]. Vazba IL‑1 na jeho receptor typu I (IL‑1RI) vyvolává přímo u excitaci drah bolesti. Dále vede ke stimulaci proliferace a diferenci ace imunokompetentních buněk (makrofágy, lymfocyty) a má vliv také na Schwannovy buňky. Tyto změny vedo u k tvorbě dalších pro - nociceptivních cytokinů, jako jso u např. NGF, IL‑6, PGE2 a NO, čímž se LI - 1 podílí na rozvoji ne uropatické bolesti nepřímo. Lokální aplikace IL‑1b má silnější potenci ál indukovat hyperalgezii než IL‑1a.
IL‑1 hraje stěžejní roli také v patofyzi ologii zánětlivých degenerativních spondylopati í, a to díky svému stimulačnímu vlivu na synovi alocyty, chondrocyty a osteoblasty.
TNF (Tumor Necrosis Factor)
TNF je skupina cytokinů, které se podílejí na regulaci zánětu a apoptózy. Hlavním zástupcem této skupiny je TNF‑a, který je potentní prozánětlivý cytokin v rozvoji zánětlivé re akce u kompresivní radikulopati e [30,31]. Přestože má s IL‑1 některé podobné bi ologické vlastnosti, jedná se o zcela odlišný cytokin. Zatímco TNF‑a inici uje programovano u buněčno u smrt, působí IL‑1 jako hematopoetický růstový faktor. Bi ologický účinek TNF‑a je zprostředkován vazbo u se dvěma receptory TNF‑R1 a TNF‑R2. Vazba TNF‑a s receptorem stimuluje migraci buněk, aktivuje makrofágy a fibroblasty k uvolnění cytokinů IL‑1b a IL‑6, které dále stimulují syntézu IL‑8 s následným uvolněním sympatomimetických aminů.
Endone uri ální aplikace TNF‑a vede k rozvoji tepelné hyperalgezi e a mechanické allodyni e [32]. Byla prokázána také korelace mezi úrovní exprese TNF a stupněm allodyni e a hyperalgezi e u experimentálních modelů ne uropatické bolesti [33]. Tyto symptomy lze experimentálně zablokovat podáním protilátek proti TNF nebo specifických inhibitorů syntézy TNF [34].
NGF (Nerve Growth Factor)
NGF patří mezi hlavní zástupce skupiny tzv. ne urotrofických faktorů, které jso u nutné pro diferenci aci a přežití ne uronů. Při radikulární kompresi se na produkci NGF podílejí makrofágy, Schwannovy buňky, ale i fibroblasty nebo buňky hladké svaloviny pod stimulačním vlivem IL‑1b a TNF‑a [35]. Podíl NGF na rozvoji bolesti popsali poprvé Shu et al [36]. NGF je z místa poškození transportován retrográdním axonálním transportem do spinálního gangli a, kde se váže na receptory trkA a p75. Vazba NGF na uvedené receptory vede ke výšení syntézy substance P, CGRP (Calcitonin Gene - Related Peptide) a BDNF (Brain‑Derived Ne urotrophic Factor).
Substance P a CGRP jso u peptidové komponenty v synapsích aferentních axonů s ne urony zadních rohů míšních. BDNF hraje významno u roli nejen při vývoji a reparaci nervového systému, ale pozornost se zaměřuje také na jeho ne uromodulační vliv na ne urony zadních rohů míšních v průběhu zánětlivých stavů, kde působí centrální senzitizaci zprostředkovano u NMDA receptory (N - metyl - D - aspartátové receptory) [37]. Dochází tak k alteraci zpracování informací vedených aferentními drahami a tím se BDNF podílí na vzniku ne uropatické bolesti. Indukovaná radikulitida vyvolává přes NGF zvýšení syntézy BDNF v ne uronech spinálních gangli í. Retrográdní transport BDNF do oblasti zadních rohů míšních vede k modulaci ne uronů zadních rohů míšních s následným rozvojem hyperalgezi e. Tyto závěry byly potvrzeny ve studi ích, při kterých aplikace NGF do endone uri álního prostoru SK vyvolala zvýšení BDNF v ne uronech spinálních gangli í s následno u hyperalgezi í. Po aplikaci protilátky anti‑NGF došlo ke snížení nejen BDNF mRNA (messenger Ribonucleic Acid), ale i hyperalgezi e vyvolané periferním zánětem [38]. BDNF svým mitogenním působením na endoteli ální buňky a fibroblasty vede k fibróze s neovaskularizací.
PGE2 (prostaglandin E2)
Důležito u úloho u IL‑1b, IL‑6 a TNF‑a v zánětlivé re akci je regulace syntézy a uvolnění fosfolipázy A2 (PLA2) [39]. PLA2 je enzym, který štěpí molekuly fosfolipidu za vzniku kyseliny arachidonové. Dalším enzymatickým štěpením vznikají z kyseliny arachidonové molekuly, které působí jako medi átory zánětu snižující práh bolesti (prostaglandin E2, tromboxan B2 a le ukotri en B4) [40]. Po podání IL‑1a i TNF‑a byla in vitro prokázána zvýšená syntéza PGE2, který hraje významno u roli v rozvoji radikulární bolesti [41]. Vyšší hladina PGE2 je spojena také s pozitivito u napínacích manévrů při ne urologickém vyšetření [42].
Klíčový enzym v metabolizmu kyseliny arachidonové představuje cyklo oxygenáza - 2 (COX‑2), která je cílovo u molekulo u pro působení farmak ze skupiny nestero idních antiflogistik (NSA). NSA v terapii radikulární ne uropatické bolesti lze považovat za účelná nejen pro jejich analgetický efekt, ale také pro působení na zánětlivo u komponentu radikulárního postižení. Na rozdíl od terapi e analgetiky se při aplikaci NSA nejedná po uze o léčbu symptomaticko u, ale částečně i ka uzální.
NO (oxid dusnatý)
Významno u úlohu při rozvoji zánětlivé re akce hraje také NO. V průběhu zánětlivé re akce dochází vlivem INF - g, IL‑1 a TNF‑a ke stimulaci makrofágy produkované NO - syntázy - 2 (NOS-2), která metabolizuje L-arginin za vzniku velkého množství NO. Lokální nárůst koncentrace NO vede ke zvýšení vaskulární perme ability a poškození tkání. Na základě experimentálně prokázaného poškození hemato-nervové bari éry a indukce demyelinizace v CNS se zvažuje také vliv NO na lokální demyelinizaci v případě kompresivní radikulopati e. Lokální demyelinizace vede k hyperstimulaci aferentních drah cesto u efaptických interakcí nervových vláken. NO lze proto považovat za jeden z významných faktorů účastnících se rozvoje ne uropatické bolesti při kompresivní radikulopatii [43].
Buňky monocyto- makrofágového systému
Důležito u roli v patofyzi ologii kompresivní radikulopati e a indukci ne uropatické bolesti mají buňky monocyto - makrofágového systému, které se podílejí na syntéze cytokinů a odstraňování buněčných fragmentů po proběhlé degeneraci. Výsledkem je vytvoření prostředí permisivního pro regeneraci poškozených axonů. Za specifických podmínek se ovšem buňky monocyto - makrofágového systému podílejí na rozvoji ne uropatické bolesti.
Studi e zaměřené na vysvětlení účasti MP při rozvoji radikulopati e prokázaly v nucle us pulposus přítomnost některých chemokinů, např. MCP-3, MCP - 4, RANTES, IP-10 [44,45]. Chemokiny jso u skupino u cytokinů, které stimulují migraci buněk podél sto upajícího koncentračního gradi entu. Jedná se o proteiny s malo u molekulovo u hmotností (8 – 10 kDa) a přítomností cysteinových reziduí, které se podílejí na tvorbě specifické trojrozměrné molekulární struktury. Bi ologický účinek chemokinů je zprostředkován G - proteinem na základě jejich interakce s receptorem lokalizovaným na buněčné membráně.
Lokální zvýšení koncentrace chemokinů způsobuje po výhřezu MP společně s fragmenty proteinů extracelulární matrix invazi monocytů z krve. Činností prozánětlivých cytokinů jso u monocyty transformovány na makrofágy, které spolu s aktivovanými tkáňovými makrofágy uvolňují další chemokiny. Tím dochází k amplifikaci lokální zánětlivé re akce, která tvoří podklad jak pro spontánní regresi výhřezu, tak pro rozvoj radikulopati e [46]. Výrazná převaha monocytů a makrofágů v zánětlivém infiltrátu při kompresivní radikulopatii byla potvrzena také imunofenotypovo u analýzo u [22]. Nízká četnost lymfocytů a dendritických buněk ukazuje, že se jedná převážně o nespecificko u zánětlivo u re akci.
Protizánětlivé cytokiny
Studi um cytokinů v rozvoji ne uropatické bolesti vedlo k myšlence využít pro léčbu protizánětlivé cytokiny, mezi něž řadíme např. IL‑4, IL‑10, IL‑13 a TGF‑b. Protizánětlivé cytokiny inhibují syntézu a uvolňování prozánětlivých cytokinů a snižují jejich bi ologický účinek. Blokují rovněž aktivaci enzymů COX‑2, NOS - 2, které se účastní syntézy prostaglandinů a NO [47,48].
IL‑4 a IL‑13, uvolňované především T2‑lymfocyty a mastocyty, sdílí obdobný systém převodu signálu, a mají tak obdobné bi ologické působení. V experimentu bylo prokázáno, že jejich aplikace vede ke zkrácení trvání zánětlivé hyperalgezi e [49].
Interle ukin‑10, produkovaný převážně makrofágy, je selektivní blokátor syntézy a uvolňování prozánětlivých cytokinů, snižuje expresi jejich receptorů a vede k supresi COX‑2 [50]. Zvyšuje také syntézu dalších protizánětlivých cytokinů, jako jso u IL‑4 a IL‑13. IL‑10 působí na prozánětlivé medi átory na více regulačních úrovních a brání přechodu „fyzi ologické zánětlivé re akce“ do „patologického stavu“.
Využití protizánětlivých cytokinů v praxi ovšem brání jejich velmi rychlá degradace (1 – 2 hod u IL‑10). Jelikož je ne uropatická bolest stav chronický, bylo by podávání protizánětlivých cytokinů pro krátko u dobu jejich účinku neúčelné. Vzhledem k některým výhodným vlastnostem IL‑10 byly provedeny pokusy na bázi genové terapi e, při kterých byl intratekálně aplikován vektor s genem IL‑10 s následno u prolongovano u syntézo u tohoto cytokinu [51].
Závěr
Z výše zmíněného je zřejmé, že re akce SK na kompresi a přítomnost výhřezu MP je děj komplexní, na němž se podílejí nejen vlastní kompresní síly, ale významno u úlohu hraje také zánětlivá re akce.
Přestože se klinické projevy kompresivní ne uropati e odvozují od změn nervových vláken, je nutno vzít v úvahu nejen působení vlastní komprese na nervové elementy, ale i roli postižení cévního zásobení a lokální zánětlivo u re akci spojeno u se změnami pojivové tkáně SK. Vlastní komprese SK způsobuje zejména zánikovo u složku radikulární symptomatologi e, kdežto zánětlivá re akce SK vytváří podmínky pro rozvoj symptomatologi e iritační včetně radikulární ne uropatické bolesti.
Odpověď periferní nervové tkáně na kompresi má dávkovo u závislost. To znamená, že čím je delší trvání komprese nebo vyšší působící mechanický tlak, tím je výraznější ne urální dysfunkce. Progredující endone uri ální fibróza při protrahované kompresi SK je nevratný děj, který limituje funkční obnovu SK. Úspěšnost chirurgické dekomprese SK závisí na stupni pokročilosti buněčných a molekulárních změn. Při trvání komprese po dobu několika měsíců již nelze počítat s obnovo u nervových vláken ad integrum. Určito u naději na úspěšno u funkční obnovu dává jen „funkční rezerva“ příslušného SK. Pro klinicko u praxi je proto důležité správné načasování operační dekomprese v případě trvající klinické symptomatologi e.
Při těžkém klinickém průběhu s progredující zánikovo u radikulární symptomatologi í lze předpokládat progresivní změny SK. Tyto stavy vyžadují časno u chirurgicko u dekompresi, která umožní s vysoko u pravděpodobností rychlo u regeneraci poškozených nervových vláken. Při pozvolnějším klinickém průběhu kompresivní radikulopati e lze v počátečních fázích doporučit konzervativní terapii v délce dva až tři měsíce a operační dekompresi zvolit až v případě přetrvávání klinické symptomatologi e s insufici encí regeneračních pochodů. Dlo uhodobé odkládání chirurgické dekomprese může vést k endone uri ální fibróze, která limituje funkční obnovu v případě provedení pozdní dekomprese.
Prostá chirurgická dekomprese SK ovšem nemusí vždy vést k přerušení složité kaskády patofyzi ologických dějů, což se může projevit přetrvávající radikulární bolestí. Jako východisko z této složité situ ace může slo užit protizánětlivá terapi e zaměřená na ovlivnění cytokinů a jejich receptorů.
MUDr. Radim Jančálek, Ph.D.
Ne urochirurgická klinika
FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e‑mail: radim.jancalek@fnusa.cz
Přijato k recenzi: 14. 1. 2008
Přijato do tisku: 25. 3. 2008
Zdroje
1. Boden SD, Davis DO, Dina TS, Patronas NJ, Wi esel SW. Abnormal magnetic - resonance scans of the lumbar spine in asymptomatic subjects. A prospective investigati on. J Bone Jo int Surg Am 1990; 72(3): 403 – 408.
2. Mixter WJ, Barr JS. Rupture of the intervertebral disc with involvement of the spinal canal. N Engl J Med 1934; 211 : 210 – 215.
3. Jancalek R, Dubovy P. An experimental animal model of spinal ro ot compressi on syndrome: an analysis of morphological changes of myelinated axons during compressi on radiculopathy and after decompressi on. Exp Brain Res 2007; 179(1): 111 – 119.
4. Dray A. Inflammatory medi ators of pain. Br J Anaesth 1995; 75(2): 125 – 131.
5. Smith SA, Massi e JB, Chesnut R, Garfin SR. Straight leg raising. Anatomical effects on the spinal nerve ro ot witho ut and with fusi on. Spine 1993; 18(8): 992 – 999.
6. Kobayashi S, Shizu N, Suzuki Y, Asai T, Yoshizawa H. Changes in nerve ro ot moti on and intraradicular blo od flow during an intraoperative straight - leg - raising test. Spine 2003; 28(13): 1427 – 1434.
7. Petterson CA, Olsson Y. Blo od supply of spinal nerve ro ots. An experimental study in the rat. Acta Ne uropathol 1989; 78(5): 455 – 461.
8. Nordin M, Nyström B, Wallin U, Hagbarth KE. Ectopic sensory discharges and paresthesi ae in pati ents with disorders of peripheral nerves, dorsal ro ots and dorsal columns. Pain 1984; 20(3): 231 – 245.
9. Olmarker K, Rydevik B, Holm S, Bagge U.Effects of experimental graded compressi on on blo od flow in spinal nerve ro ots. A vital microscopic study on the porcine ca uda equina. J Orthop Res 1989; 7(6): 817 – 823.
10. Pedowitz RA, Garfin SR, Massi e JB, Hargens AR, Swenson MR, Myers RR et al. Effects of magnitude and durati on of compressi on on spinal nerve ro ot conducti on. Spine 1992; 17(2): 194 – 199.
11. Jančálek R, Dubový P. Možné morfologické a patofyziologické podklady vzniku neuropatické bolesti. Cesk Slov Ne urol N 2004; 67/ 100(1): 6 – 11.
12. McLachlan EM, Janig W, Devor M,Michaelis M. Peripheral nerve injury triggers noradrenergic spro uting within dorsal ro ot gangli a. Nature 1993; 363(6429): 543 – 546.
13. Dubovy P, Jancalek R, Klusakova I. A heterogeneo us immunofluorescence staining for laminin‑1 and related basal lamina molecules in the dorsal ro ot gangli a following constricti on nerve injury. Histochem Cell Bi ol 2006; 125(6): 671 – 680.
14. Devor M, Dubner R. Centrifugal activity in afferent C fibers influences the spontaneo us afferent barrage generated in nerve end ne uromas. Brain Res 1988; 446(2): 396 – 400.
15. Kayama S, Konno S, Olmarker K, Yabuki S, Kikuchi S. Incisi on of the anulus fibrosus induces nerve ro ot morphologic, vascular, and functi onal changes. An experimental study. Spine 1996; 21(22): 2539 – 2543.
16. Tolonen J, Gronblad M, Virri J, Seitsalo S, Rytömaa T, Karaharju E. Transforming growth factor beta receptor inducti on in herni ated intervertebral disc tissue: an immunohistochemical study. Eur Spine J 2001; 10(2): 172 – 176.
17. Nagano T, Yonenobu K, Miyamoto S, Tohyama M, Ono K. Distributi on of the basic fibroblast growth factor and its receptor gene expressi on in normal and degenerated rat intervertebral discs. Spine 1995; 20(18): 1972 – 1978.
18. Bobechko WP, Hirsch C. Auto - Immune Response to Nucle us Pulposus in the Rabbit. J Bone Jo int Surg Br 1965; 47 : 574 – 580.
19. McCarron RF, Wimpee MW, Hudkins PG, Laros GS. The inflammatory effect of nucle us pulposus. A possible element in the pathogenesis of low - back pain. Spine 1987; 12(8): 760 – 764.
20. Specchi a N, Pagnotta A, Toesca A, Greco F. Cytokines and growth factors in the protruded intervertebral disc of the lumbar spine. Eur Spine J 2002; 11(2): 145 – 151.
21. Geiss A, Larsson K, Rydevik B, Takahashi I, Olmarker K. Auto immune properti es of nucle us pulposus: an experimental study in pigs. Spine 2007; 32(2): 168 – 173.
22. Kawaguchi S, Yamashita T, Yokogushi K, Murakami T, Ohwada O, Sato N. Immunophenotypic analysis of the inflammatory infiltrates in herni ated intervertebral discs. Spine 2001; 26(11): 1209 - 1214.
23. Saksela O, Rifkin DB. Rele ase of basic fibroblast growth factor-heparan sulfate complexes from endotheli al cells by plasminogen activator-medi ated proteolytic activity. J Cell Bi ol 1990; 110(3): 767 – 775.
24. Do ita M, Kanatani T, Harada T, Mizuno K. Immunohistologic study of the ruptured intervertebral disc of the lumbar spine. Spine 1996; 21(2): 235 – 241.
25. Nygaard OP, Mellgren SI, Osterud B. The inflammatory properti es of contained and noncontained lumbar disc herni ati on. Spine 1997; 22(21): 2484 – 2488.
26. Dubovy P, Jancalek R, Klusakova I, Svizenska I, Pejchalova K. Intra - and extrane uronal changes of immunofluorescence staining for TNF‑alpha and TNFR1 in the dorsal ro ot gangli a of rat peripheral ne uropathic pain models. Cell Mol Ne urobi ol 2006; 26(7 – 8): 1205 – 1217.
27. Takahashi H, Suguro T, Okazima Y, Motegi M, Okada Y, Kaki uchi T. Inflammatory cytokines in the herni ated disc of the lumbar spine. Spine 1996; 21(2): 218 – 224.
28. Miyamoto H, Sa ura R, Harada T, Do ita M, Mizuno K. The role of cyclo oxygenase - 2 and inflammatory cytokines in pain inducti on of herni ated lumbar intervertebral disc. Kobe J Med Sci 2000; 46(1 – 2): 13 – 28.
29. Sommer C, Petra usch S, Lindenla ub T, Toyka KV. Ne utralizing antibodi es to interle ukin 1 - receptor reduce pain associ ated behavi or in mice with experimental ne uropathy. Ne urosci Lett 1999; 270(1): 25 – 28.
30. Aoki Y, Rydevik B, Kikuchi S, Olmarker K. Local applicati on of disc - related cytokines on spinal nerve ro ots. Spine 2002; 27(15): 1614 – 1617.
31. Olmarker K, Larsson K. Tumor necrosis factor alpha and nucle us - pulposus‑induced nerve ro ot injury. Spine 1998; 23(23): 2538 – 2544.
32. Wagner R, Myers RR. Endone uri al injecti on of TNF‑alpha produces ne uropathic pain behavi ors. Ne uroreport 1996; 7(18): 2897 – 2901.
33. Schäfers M, Geis C, Svensson CI, Luo ZD, Sommer C. Selective incre ase of tumo ur necrosis factor‑alpha in injured and spared myelinated primary afferents after chronic constrictive injury of rat sci atic nerve. Eur J Ne urosci 2003; 17(4): 791 – 804.
34. Sommer C, Lindenla ub T, Te uteberg P, Schafers M, Hartung T, Toyka KV. Anti‑TNF‑ne utralizing antibodi es reduce pain‑related behavi or in two different mo use models of painful monone uropathy. Brain Res 2001; 913(1): 86 – 89.
35. Hattori A, Tanaka E, Murase K, Ishida N, Chatani Y, Tsujimoto M et al. Tumor necrosis factor stimulates the synthesis and secreti on of bi ologically active nerve growth factor in non - ne uronal cells. J Bi ol Chem 1993; 268(4): 2577 – 2582.
36. Shu XQ, Mendell LM. Ne urotrophins and hyperalgesi a. Proc Natl Acad Sci U S A 1999; 96(14): 7693 – 7696.
37. Kerr BJ, Bradbury EJ, Bennett DL, Trivedi PM, Dassan P, French J et al. Brain‑derived ne urotrophic factor modulates nociceptive sensory inputs and NMDA - evoked responses in the rat spinal cord. J Ne urosci 1999; 19(12): 5138 – 5148.
38. Wo olf CJ, Safi eh - Garabedi an B, Ma QP, Crilly P, Winter J. Nerve growth factor contributes to the generati on of inflammatory sensory hypersensitivity. Ne urosci ence 1994; 62(2): 327 – 331.
39. Kawakami M, Matsumoto T, Tamaki T. Roles of thromboxane A2 and le ukotri ene B4 in radicular pain induced by herni ated nucle us pulposus. J Orthop Res 2001; 19(3): 472 – 477.
40. Kang JD, Georgescu HI, McIntyre - Larkin L, Stefanovic - Racic M, Donaldson WF 3rd, Evans CH. Herni ated lumbar intervertebral discs spontaneo usly produce matrix metalloproteinases, nitric oxide, interle ukin‑6, and prostaglandin E2. Spine 1996; 21(3): 271 – 217.
41. Takahashi H. A mechanism for sci atic pain ca used by lumbar disc herni ati on - involvement of inflammatory cytokines with sci atic pain. Nippon Seikeigeka Gakkai Zasshi 1995; 69(1): 17 – 29.
42. O’Donnell JL, O’Donnell AL. Prostaglandin E2 content in herni ated lumbar disc dise ase. Spine 1996; 21(14): 1653 – 1655.
43. Cho i Y, Raja SN, Mo ore LC, Tobin JR. Ne uropathic pain in rats is associ ated with altered nitric oxide synthase activity in ne ural tissue. J Ne urol Sci 1996; 138(1 – 2): 14 – 20.
44. Kawaguchi S, Yamashita T, Katahira G, Yokozawa H, Torigoe T, Sato N. Chemokine profile of herni ated intervertebral discs infiltrated with monocytes and macrophages. Spine 2002; 27(14): 1511 – 1516.
45. Burke JG, Watson RW, McCormack D, Dowling FE, Walsh MG, Fitzpatrick JM. Spontaneo us producti on of monocyte chemo attractant protein‑1 and interle ukin‑8 by the human lumbar intervertebral disc. Spine 2002; 27(13): 1402 – 1407.
46. Ikeda T, Nakamura T, Kikuchi T, Umeda S, Senda H, Takagi K. Pathomechanism of spontaneo us regressi on of the herni ated lumbar disc: histologic and immunohistochemical study. J Spinal Disord 1996; 9(2): 136 – 140.
47. Hart PH, Vitti GF, Burgess DR, Whitty GA, Piccoli DS, Hamilton JA. Potenti al antiinflammatory effects of interle ukin 4: suppressi on of human monocyte tumor necrosis factor alpha, interle ukin 1, and prostaglandin E2. Proc Natl Acad Sci U S A 1989; 86(10): 3803 – 3807.
48. Cunha FQ, Moncada S, Li ew FY. Interle ukin‑10 (IL‑10) inhibits the inducti on of nitric oxide synthase by interferon - gamma in murine macrophages. Bi ochem Bi ophys Res Commun 1992; 182(3): 1155 – 1159.
49. Cunha FQ, Po ole S, Lorenzetti BB, Veiga FH, Ferreira SH. Cytokine - medi ated inflammatory hyperalgesi a limited by interle ukin‑4. Br J Pharmacol 1999; 126(1): 45 – 50.
50. Rand N, Reichert F, Floman Y, Rotshenker S. Murine nucle us pulposus - derived cells secrete interle ukins - 1 - beta, - 6, and -10 and granulocyte - macrophage colony - stimulating factor in cell culture. Spine 1997; 22(22): 2598 – 2601.
51. Milligan ED, Slo ane EM, Langer SJ, Hughes TS, Jekich BM, Frank MG et al. Repe ated intrathecal injecti ons of plasmid DNA encoding interle ukin‑10 produce prolonged reversal of ne uropathic pain. Pain 2006; 126(1 – 3): 294 – 308.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště
- Patofyziologie kompresivní radikulopatie
- Timing karotické endarterektomie
- Přínos statické počítačové posturografie ke skríningovému vyšetření kvantifikace posturální rovnováhy
- Botulotoxin v léčbě detruzorové hyperaktivity u pacientek s roztroušenou sklerózou
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Komentář ke článku Schreiberová et al. Sedace kombinací dexmedetomidin- ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
- Sedace kombinací dexmedetomidin-ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
- Vývoj adaptace rovnovážného systému po operacích vestibulárního schwannomu
- Komplikace léčby těžké spasticity implantabilními pumpovými systémy
- Analýza souboru pacientů s kraniocerebrálním poraněním léčených na Pracovišti dětské medicíny FN Brno v období let 2000–2007
- Výsledky operační léčby ne uromuskulárních deformit páteře
- Tuberózní skleróza: optimalizace postupu její DNA di agnostiky
- Cerebelární mutizmus po resekci meduloblastomu u dítěte – kazuistika
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Webové okénko
-
Analýza dat v neurologii X.
Vybrané otázky sumární statistiky - Doporučené postupy pro di agnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Kraniocerebrální poranění v dětském věku
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Timing karotické endarterektomie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



