-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Statínová myopatia – rarita, alebo realita?
Statin myopathy – rarity or reality?
Statins are the most effective drugs for reducing LDL‑cholesterol and have strong evidence based medicine documented by significant reduction of cardiovascular events in wide variety of patients. Despite this fact, they are still underused in common clinical practice. Many physicians have expressed concern about potential adverse effects, particularly severe muscle toxicity, which is an impediment to appropriate statin use. The clinical symptoms of statin myopathy include myalgia or muscle weakness, tiredness, cramps and/ or creatinkinase activity increases (CK). Because hypercholesterolaemia is usually asymptomatic, any unwanted effect of drug used for its management can undermine adherence. Therefore it is very important to evaluate myopathy magnitude, prompt and rational individual management, and if applicable, restart of lipid ‑ lowering therapy as soon as possible with regard to its type, dose and concomitant treatment.
Key words:
statin myopathy – statin‑associated myopathy – myalgia – myositis – rhabdomyolysis
Autori: D. Pella
Pôsobisko autorov: III. interná klinika Lekárskej fakulty UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednosta prof. MU Dr. Daniel Pella, PhD.
Vyšlo v časopise: Vnitř Lék 2010; 56(9): 972-976
Kategória: 60. narozeniny prof. MUDr. Andreje Dukáta, CSc., FESC, předsedy Slovenskej internistickej spoločnosti
Súhrn
Statíny sú najúčinnejšími liekmi na znižovanie LDL‑cholesterolu a zároveň disponujú silnou medicínou založenou na dôkazoch dokumentujúcou signifikantné zníženie kardiovaskulárnych príhod v rôznorodých skupinách pacientov. Napriek tejto skutočnosti je ich používanie v bežnej klinickej praxi stále nižšie oproti predpokladom. Mnohí lekári sa obávajú potenciálnych vedľajších účinkov statínov, najmä závažnej svalovej toxicity, ktorá sa tak stáva prekážkou adekvátneho užívania statínov. Klinické prejavy myopatie zahŕňajú svalové bolesti, slabosť, únavnosť, kŕče a/ alebo zvýšenie kreatínkinázy (CK). Pretože hypercholesterolémia je zvyčajne asymptomatická, každý neželaný efekt použitého lieku môže závažne narušiť adherenciu k terapii. Preto je veľmi dôležité posúdenie závažnosti myopatie, jej včasný, racionálny individuálny manažment a čo možno najskoršie znovunasadenie lipidy znižujúcej liečby s prihliadnutím na jej druh, dávku a konkomitantnú liečbu.
Kľúčové slová:
statínová myopatia – myopatia spojená so statínovou liečbou – myalgia – myozitída – rabdomyolýzaÚvod
Statíny sú účinné lipidy znižujúce farmaká, ktoré efektívne znižujú predovšetkým hladinu LDL-cholesterolu cestou inhibície syntézy cholesterolu blokovaním aktivity 3-hydroxy-3-metylglutarylkoenzým A reduktázy (HMG-CoA reduktáza). Ide o kľúčový enzým, ktorý determinuje rýchlosť a množstvo syntetizovaného cholesterolu. Čo je však ešte dôležitejšie, randomizované kontrolované klinické štúdie potvrdili, že ich podávanie je spojené s významným poklesom kardiovaskulárnych príhod a kardiovaskulárnej, ba dokonca i celkovej mortality [1]. Keďže hypercholesterolémia je prevažne asymptomatická, každý vedľajší účinok statínov môže znížiť adherenciu k tejto liečbe. Viaceré klinické štúdie ukázali, že sú to práve nežiaduce účinky liekov, ktoré sú v rozhodujúcej miere zodpovedné za predčasné ukončenie liečby alebo zníženie compliance k liečbe [2,3].
Pojem statínová myopatia (myopatia spojená so statínovou liečbou)
Klinické príznaky statínovej myopatie (v anglosaskej literatúre sa používajúdva termíny – „statin myopathy“ a „statin-associated myopathy“) sú mnohoraké a varírujú od zvýšenej únavnosti cez svalovú slabosť, bolesti svalov až po svalové kŕče [4]. Napriek týmto pomerne jasne definovaným symptómom boli v klinických štúdiách použité často odlišné kritériá na jej hodnotenie, čo pochopiteľne prispieva ku sťaženiu posudzovania jej výskytu, predovšetkým pri pokusoch o rôzne metaanalýzy takýchto štúdií [5].
Definícia myopatie podľa amerického systému hlásenia nežiaducich účinkov liekov FDA (The US Food and Drug Administration’s) je založená na vzostupe hladiny CK nad 10-násobok nad horný limit jej normálnych hladín. Diagnóza rabdomyolýzy je postavená na vzostupe hladiny CK nad 50-násobok nad horný limit normálnych hladín CK a je spojená s klinickými príznakmi orgánového poškodenia, najmä renálneho zlyhania [6].
Definícia myopatie podľa ACC/AHA/NHLBI (American College of Cardiology/American Heart Association/National Heart Lung and Blood Institute) hovorí o akejkoľvek chorobe svalov. Myalgia je akákoľvek bolesť alebo slabosť svalov bez elevácie hladiny CK a diagnóza rabdomyolýzy je postavená na prítomnosti svalových symptómov spolu so vzostupom hladiny CK (typicky značne nad 10-násobok nad horný limit jej normálnych hladín) a kreatinínu a prítomnosťou myoglobínu v tmavohnedom moči [7].
Napokon expertný panel National Lipid Association navrhol definíciu založenú na prítomnosti svalových symptómov a stupni vzostupu kreatínkinázy. Podľa tejto klasifikácie sú všetky svalové ťažkosti (vrátane svalových bolestí, kŕčov a slabosti) spojené so statínovou liečbou tzv. symptomatickou myopatiou. Asymptomatická myopatia predstavuje stav, kedy je zaznamenaný vzostup CK bez symptómov svalového poškodenia. Vzostup CK je hodnotený ako mierny (pokiaľ hladina CK je zvýšená, ale nepresahuje 10-násobok horného limitu jej normálnych hladín), stredne závažný (ak je hladina CK medzi 10–50-násobkom horného limitu jej normálnych hladín) a závažný (CK nad 50 násobok horného limitu normálnych hladín) [8].
Možné príčiny statínovej myopatie
Presná príčina vzniku statínovej myopatie doposiaľ nebola objasnená. Statíny blokovaním HMG-CoA reduktázy neznižujú len syntézu mevalonátu, ale blokujú celú kaskádu biochemických dejov závislých práve od syntézy mevalonátu (obr. 1).
Obr. 1. Metabolická cesta syntézy cholesterolu, koenzýmu Q10, zápalových a proliferačne pôsobiacich proteínov. 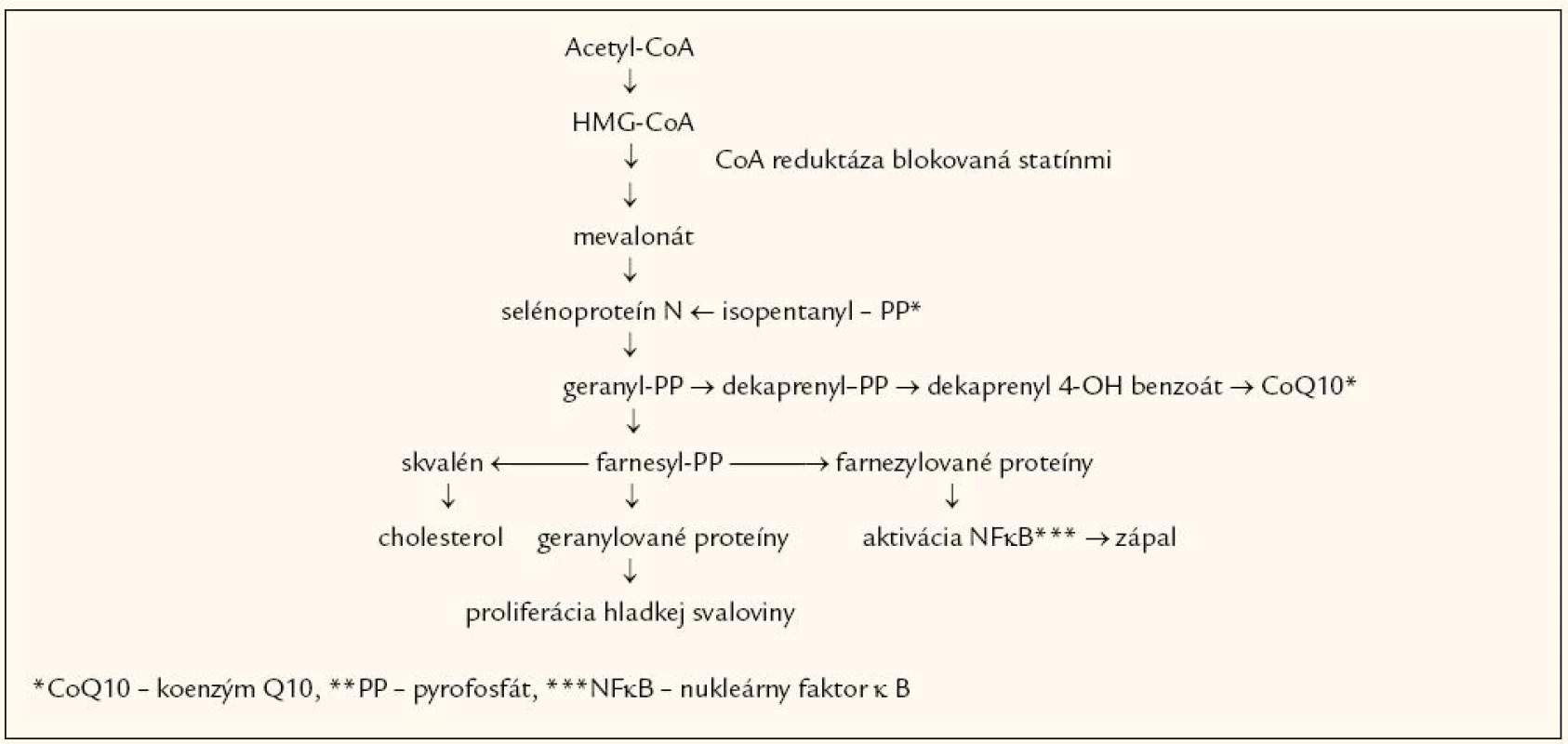
Dochádza ku inhibícii syntézy geranylovaných a farnezylovaných proteínov (možné vysvetlenie antiproliferačných, resp. protizápalových účinkov statínov), ale aj inhibícii endogénnej syntézy koenzýmu Q10 (ubichinónu) a niektorých selénoproteínov [9]. Medzi možné príčiny statínovej myopatie patrí pokles dostupného cholesterolu pre plnohodnotnú sarkolému, integritu T-tubulov, ďalej zníženie G-proteínov, ale aj zníženie hladiny koenzýmu Q10 [10–12]. Medzi ďalšie možné príčiny patrí upregulácia aktivity svalových LDL receptorov, ktorá vedie ku zvýšenému vychytávaniu na triacylglyceroly bohatých VLDL so vznikom tzv. „fat myopathy“ („tukovej myopatie“), prípadne ku zvýšenému vychytávaniu fytosterolov obdobným mechanizmom, alebo zmeny proteínov v proteázových reakciách spojené s katabolizmom proteínov v myocytoch [13,14]. Všetky tieto procesy vedú ku zvýšenej fluididite bunkovej membrány myocytov, a tým ju robia náchylnejšou na poškodenie.
Ďalšia, pomerne logicky zdôvodniteľná príčina tkvie v skutočnosti, že liečba statínmi vedie ku mitochondriálnej dysfunkcii, čo je spojené so svalovou apoptózou a myopatiou. Statíny, tak ako už bolo vyššie zmienené, znižujú tvorbu farnezyl pyrofosfátu a geranylgeranyl pyrofosfátu, ktoré prenyláciou aktivujú regulačné proteíny (Rho, Ras, Ras-GTP), ktoré zabezpečujú normálne fyziologické deje v bunke a jej rast. V prípade nedostatku týchto proteínov naopak dochádza ku apoptóze [15]. Napokon nedávno publikované dáta poukazujú na možný deficit vitamínu Enavodený statínovou liečbou. Presný mechanizmus poklesu hladiny a tokoferolu síce nie je objasnený, ale predpokladá, že k nemu dochádza vplyvom poklesu hladiny LDL-cholesterolu (ako jeho transportéra). Vitamín E je hojne prítomný v myocytoch a jeho deficit môže narušiť bunkovú integritu [16].
Prevalencia statínovej myopatie a jej rizikové faktory
Výskyt statínovej myopatie v randomizovaných klinických štúdiách bol veľmi nízky (nepresiahol 1–5 % pacientov) a bol porovnateľný s výskytom myopatie v placebovej skupine pacientov [17]. Na druhej strane prospektívne štúdie a registre z bežnej praxe hovoria o podstatne vyššom percente pacientov so statínovou myopatiou pohybujúcou sa v rozmedzí od 9 do 20 % spomedzi všetkých pacientov [18].
Štúdia PRIMO bola zrejme doteraz najväčšou observačnou štúdiou monitorujúcou svalové nežiaduce účinky statínov. Do sledovania bolo zaradených 7 924 pacientov liečených vysokodávkovanými statínmi (atorvastatín v dávkach 40–80 mg denne, simvastatín 40–80 mg denne, pravastatín 40 mg a fluvastatín najmä vo forme s predĺženým uvoľňovaním XL v dávke 80 mg denne) [19]. Celkom u 832 pacientov, t.j. 10,5 % z celého súboru, boli zaznamenané svalové nežiaduce účinky, pričom najmenej frekventné boli u pacientov užívajúcich fluvastatín („najslabší“ spomedzi statínov z hľadiska sily hypolipemického účinku) – celkom 5,1 % pacientov, ďalej nasledovali pacienti liečení pravastatínom – 10,9 %, atorvastatínom – 14,9 %. Najčastejšie svalové nežiaduce účinky boli v skupine pacientov užívajúcich simvastatín – 18,2 %, čo koreluje aj s výsledkami viacerých klinických štúdií, kde rabdomyolýza bola najčastejšie pozorovaná pri vyšších dávkach simvastatínu a pri liečbe s dnes už nepoužívaným cerivastatínom [20]. Štúdia PRIMO tiež poukázala na viaceré rizikové faktory myopatie (vrátane druhu statínu – zmienené vyššie). Najvýznamnejším rizikovým faktorom myopatie sa ukázala byť prítomnosť svalového nežiaduceho účinku s iným hypolipemicky pôsobiacim liekom v anamnéze (viac ako 10-násobne vyššie riziko), ďalej v anamnéze nevysvetliteľných kŕčov (4krát vyššie riziko), anamnéza vyšších hladín CK (2krát vyššie riziko), ďalej hypotyreóza a iné faktory. Harper s Jacobsonom a Smogorzewski podrobne popísali rizikové faktory statínovej myopatie a rozdelili ich do 3 kategórií:
- súvisiace s pacientom;
- súvisiace s druhom statínu;
- súvisiace s liekovými interakciami (medzi statínom a inými súčasne podávanými liekmi) [4,21].
Prehľad týchto rizikových faktorov je uvedený v tab. 1.
Tab. 1. Rizikové faktory statínovej myopatie. 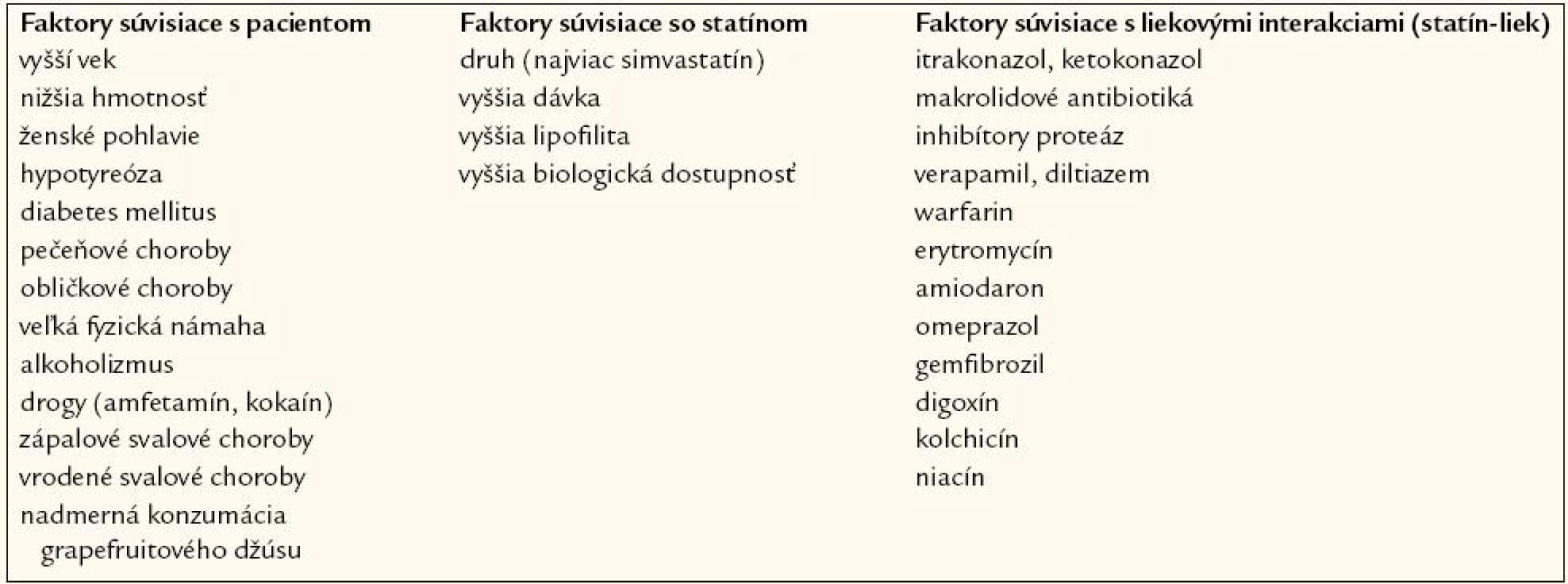
Liekové interakcie, najmä na úrovni inhibítorov cytochrómu CYP3A4 (napr.antimykotiká, makrolidové antibiotiká, blokátory kalciových kanálov typuverapamilu a diltiazemu) a CYP2C9 (amiodaron, omeprazol, fibráty, najmä gemfibrozil, digoxín, niacín), ale i ostatné rizikové faktory podrobne analyzuje nedávno publikovaná práca Chatsizizisa et al [22].
Rovnako medzi najnovšie patrí literárny prehľad prác, ktoré spájajú riziko statínovej myopatie s preexistujúcimi subklinickými vrodenými svalovými poruchami na podklade genetických polymorfizmov proteínov kódovaných SLCO1B1 (gén kódujúci transportný polypeptid C, ktorý je zodpovedný za vychytávanie statínov v pečeni) alebo enzýmovým systémom cytochrómu P [23]. Najsilnejšia asociácia bola zistená pri génoch ovplyvňujúcich transport statínov v hepatocytoch organickým aniónom transportným polypeptidom C (OATP1B1), ktorý je kódovaný SLCO1B1. Dve nedávne štúdie potvrdili úlohu genetických variácií SLCO1B1 pri statínovej myopatii [24,25].
Manažment statínovej myopatie
Manažment statínovej myopatie v bežnej klinickej praxi je neuspokojivý. Jej diagnostika je pomerne obtiažna, pretože pri porovnávacích štúdiách (statíny oproti placebu) bol jej výskyt porovnateľný v oboch ramenách, placebovom i statínovom, teda falošne pozitívna diagnóza myopatie bola zrejme častejším javom. Na druhej strane existuje značný rozdiel vo výskyte statínovej myopatie v bežnej klinickej praxi (oveľa frekventnejšia ako v zaslepených štúdiách). Kde možno hľadať príčiny?
Vysvetlenie je, zdá sa, pomerne jednoduché. V randomizovaných klinických štúdiách prebieha pred samotnou randomizáciou v dobe skríningu výber pacientov podľa dopredu stanovených kritérií. Je len samozrejmé, že z týchto štúdií boli a priori vylúčení pacienti s predchádzajúcimi nežiaducimi účinkami statínov, s anamnézou svalových ťažkostí alebo chorôb, anamnézou rizikových faktorov myopatie (napr. zvýšenými hladinami CK, hypotyreózou atď.).
Rozhodujúcou pre správne stanovenie diagnózy statínovej myopatie je dôkladná anamnéza s cieleným pátraním po všetkých rizikových faktoroch. Rutinné stanovovanie CK u všetkých pacientov užívajúcich statíny sa dnes neodporúča, avšak pri podozrení na myopatiu je nevyhnutnosťou [8]. V liečbe statínom je možné pokračovať, pokiaľ symptómy myopatie sú tolerovateľné zo strany pacienta a pokiaľ súčasne hladina CK nepresiahne 10-násobok horného limitu normálnych hodnôt. Liečbu je potrebné naopak prerušiť, pokiaľ pacient netoleruje symptómy (aj bez zvýšenia CK!), alebo ak je CK zvýšené nad 10-násobok horného limitu normálnych hodnôt (v tomto prípade aj u asymptomatického pacienta!). Svalová biopsia je namieste, pokiaľ aj po vysadení statínu myopatia dlhodobo pretrváva. Je potrebné konzultovať špecialistu na svalové ochorenia, pretože symptómy statínovej myopatie zvyčajne i v tých ťažších prípadoch ustupujú v priebehu niekoľkých dní od vysadenia liečby.
V prípadoch, kedy bolo potrebné liečbu prerušiť, je možné pokračovať niekoľkými spôsobmi (v závislosti od predchádzajúcej anamnézy pacienta, závažnosti priebehu myopatie, pre ktorú bol statín primárne vysadený):
- reštartovať liečbu tým istým statínom v redukovanej dávke,
- reštartovať liečbu tým istým statínom v pôvodnej dávke („test reprodukovateľnosti myopatie“),
- nasadiť liečbu iným, spravidla bezpečnejším statínom (z tohto pohľadu je „najhorším“ simvastatín, „najlepšími“ sú fluvastatín a pravastatín, nasledované rosuvastatínom a atorvastatínom),
- pokiaľ nie je možné znovu nasadiť statín, prikláňame sa k liečbe ezetimibom alebo kyselinou nikotínovou,
- pri znovunasadení statínu (najmä pri podaní nižších dávok, alebo menej účinného statínu) a súčasnom nedosahovaní cieľových hodnôt pre LDL-cholesterol sa odporúča kombinácia s ezetimibom, menej s kyselinou nikotínovou alebo fibrátmi.
V prípade diagnostikovania rabdomyolýzy je namieste okamžité prerušenie statínovej liečby, hospitalizácia pacienta s parenterálnou rehydratačnou terapiou, monitorovaním renálnych funkcií a CK.
V posledných rokoch sa veľa diskutuje o úlohe koenzýmu Q10 v prevencii, prípadne liečbe statínovej myopatie. Jeho použitie je zatiaľ v zmysle výsledkov klinických štúdií nejasné, ale zdá sa, že jeho pozitívna úloha by mohla byť predovšetkým v liečbe mitochondriálnych myopatií [26,27].
Siddiqi a Thompson odporúčajú podávanie koenzýmu Q10 pacientom so symptomatickou statínovou myopatiou (kde nebola prerušená liečba) s cieľom redukovať symptomatológiu a takisto u pacientov, u ktorých bola reštartovaná statínová terapia (bez ohľadu na to, či sú symptomatickí, alebo nie) [5].
Medzi lekármi je mnoho takých, ktorí odmietajú liečbu výživovými doplnkami typu koenzýmu Q10, a naopak veľa je aj tých, ktorí tieto výživové doplnky preceňujú. Prečo sú výsledky klinických štúdií s koenzýmom Q10 také rozporuplné? Je potrebné povedať hneď na úvod, že metodológia už realizovaných štúdií bola rozdielna (často nejednoznačná, nepresná), dávky a druh koenzýmu Q10 sa rovnako značne líšili. Dnes napr. vieme, že amorfné formy koenzýmu Q10 sa vstrebávajú len veľmi málo a že nedochádza ku signifikantnému zvýšeniu plazmatických hladín koenzýmu Q10 (tobôž nie hladín v tkanivách, a teda aj vo svaloch!), a teda nemožno očakávať pozitívne klinické výsledky. Preto je nutné používať kryštalické formy koenzýmu Q10 a aplikovať ich v dostatočne vysokých dávkach (okrem toho výhodnejšia je redukovaná forma koenzýmu Q10 – ubichinol – oproti doteraz viac používanému ubichinolu). Zatiaľ nie sú stanovené odporúčané dávky pre liečbu statínovej myopatie, ale napr. pri použití koenzýmu Q10 v experimentálnych štúdiách pri chronickom srdcovom zlyhávaní bol pozitívny výsledok dosiahnutý len v prípade, ak došlo aspoň ku 160% nárastu plazmatických hladín, čo dobre korelovalo aj s nárastom jeho hladín v myokarde. V reálnej praxi to znamenalo použiť dávky okolo 300 mg denne [28,29].
Napokon v pilotnej, dvojito-slepej randomizovanej klinickej štúdii na našom pracovisku sme testovali v skupine 60 pacientov so symptómami statínovej myopatie (nevynucujúcej si prerušenie statínovej liečby) vplyv koenzýmu Q10 v dávke 200 mg denne oproti placebu podávaného počas 3 mesiacov na symptómy statínovej myopatie a hladiny koenzýmu Q10. Zaznamenali sme štatisticky významný pokles symptómov statínovej myopatie (svalová bolesť – p = 0,0001, svalová slabosť – p = 0,011, svalová únavnosť – p = 0,024 a svalové kŕče – p = 0,005) v aktívnej skupine. Naopak v placebovej skupine sa symptómy signifikantne nezmenili. S uvedenými nálezmi dobre koreloval štatisticky signifikantný nárast plazmatických hladín koenzýmu Q10 v aktívnej skupine (z 0,77 ± 0,37 μg/ml na 2,91 ± 1,61 μg/ml), pričom hladiny v placebovej skupine zostali nezmenené (z 0,72 ± 0,35 μg/ml na 0,74 ± 0,35 μg/ml). Nezaznamenali sme žiadne vedľajšie účinky terapie koenzýmom Q10 [30]. Samozrejme limitáciou našej štúdie bol predovšetkým menší súbor pacientov a jeho nehomogenita (rôzne druhy statínov v rôznych dávkach). Výskyt nežiaducich účinkov statínov bol však aj v našej štúdii, kde sme skrínovali celkom 1 142 pacientov, podobný ako v štúdii PRIMO, a pohyboval sa v rozpätí od 5,47 % (fluvastatín XL) po 12,28 % (simvastatín).
Záver
Statínová myopatia patrí medzi zriedkavé komplikácie statínovej liečby. Predstavuje i napriek svojmu zväčša benígnemu priebehu a reverzibilite orgánového poškodenia závažný medicínsky problém, pretože býva spojená so signifikantne horšou adherenciou pacientov ku takejto liečbe. Aj keď je liečba statínmi bezpečná a sprevádzaná minimom nežiaducich účinkov, je potrebné mať na zreteli skutočnosť, že ich preskripcia dramaticky narastá. Je to nielen kvôli lepšej edukácii medicínskeho personálu, ale aj kvôli rozširovaniu spektra indikácií statínov. Naviac, statíny sú predpisované čoraz viac (nielen v klinických štúdiách) vo vysokých terapeutických dávkach. Preto i pri relatívne nízkom percentuálnom výskyte nežiaducich účinkov sú tieto v absolútnych číslach pomerne vysoké. Diagnostika statínovej myopatie je plná úskalí. Je možné tak „nadhodnotenie“ i „podhodnotenie“ symptómov, hladina kreatínkinázy môže byť nielen potvrdením diagnózy, ale i falošne pozitívnym nálezom. Každopádne je potrebné starostlivým vyšetrením pacienta, rozborom jeho anamnézy, komorbidít a konkomitantnej terapie, čo najskôr odhaliť príčinu svalových symptómov (so zvýšením alebo bez zvýšenia CK) a pokúsiť sa buď o čo najskoršiu reindukciu statínovej liečby (pri neprítomnosti zvýšeného rizika nežiaducich účinkov), alebo jej zmenu s cieľom redukcie kardiovaskulárneho rizika toho ktorého pacienta. Liečebné možnosti pri dokázanej statínovej myopatii v súčasnosti sú značne limitované a sú zamerané skôr na elimináciu jej príčin (komorbidity a rizikové faktory na strane pacienta, zníženie rizika potenciálnych liekových interakcií). Substitučná liečba koenzýmom Q10 si vyžaduje overenie väčšími randomizovanými kontrolovanými klinickými štúdiami. Doterajšie dôkazy pre takýto prístup sú obmedzené, aj keď na druhej strane je potrebné objektívne konštatovať, že suplementácia koenzýmom Q10 nebola spojená s vyšším rizikom vedľajších účinkov a v jednotlivých prípadoch viedla ku zlepšeniu symptómov myopatie
prof. MUDr. Daniel Pella, PhD.
www.upjs.sk
e-mail: daniel.pella@upjs.sk
Zdroje
1. Baigent C, Keech A, Kearney PM et al. Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol ‑ lowering treatment: prospective meta‑analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet 2005; 366 : 1267 – 1278.
2. Hughes DA, Walley T. Predicting “real world” effectiveness by integrating adherence with pharmacodynamic modeling. Clin Pharmacol Ther 2003; 74 : 1 – 8.
3. Kiortsis DN, Giral P, Bruckert E et al. Factors associated with low compliance with lipid ‑ lowering drugs in hyperlipidemic patients. J Clin Pharm Ther 2000; 25 : 445 – 451.
4. Harper CR, Jacobson TA. The broad spectrum of statin myopathy: from myalgia to rhabdomyolysis. Curr Opin Lipidol 2007; 18 : 401 – 408.
5. Siddiqi SA, Thompson PD. How do you treat patients with myalgia who take statins? Curr Atheroscler Rep 2009; 11 : 9 – 14.
6. Sewright KA, Clarkson PM, Thompson PD. Statin myopathy: incidence, risk factors, and pathophysiology. Curr Atheroscler Rep 2007; 9 : 389 – 396.
7. Pasternak RC, Smith SC Jr, Bairey ‑ Merz CN et al. American College of Cardiology; American Heart Association; National Heart, Lung and Blood Institute. ACC/ AHA/ NHLBI clinical advisory on the use and safety of statins. J Am Coll Cardiol 2002; 40 : 567 – 572.
8. McKenney JM, Davidson MH, Jacobson TA et al. National Lipid Association Statin Safety Assessment Task Force. Final conclusions and recommendations of the National Lipid Association Statin Safety Assessment Task Force. Am J Cardiol 2006; 97 (Suppl 8A): 89C – 94C.
9. Moosmann B, Behl C. Selenoprotein synthesis and side effects of statins. Lancet 2004; 363 : 892 – 894.
10. Sirvent P, Mercier J, Lacampagne A. New insights into mechanisms of statin‑associated myotoxicity. Curr Opin Pharmacol 2008; 8 : 333 – 338.
11. Draeger A, Monastyrskaya K, Mohaupt M et al. Statin therapy induces ultrastructural damage in skeletal muscle in patients without myalgia. J Pathol 2006; 210 : 94 – 102.
12. Duncan AJ, Hargreaves IP, Damian MS et al. Decreased ubiquinone availability and impaired mitochondrial cytochrome oxidase activity associated with statin treatment. Toxicol Mech Methods 2009; 19 : 44 – 50.
13. Päivä H, Thelen KM, Van Coster R et al. High‑dose statins and skeletal muscle metabolism in humans: a randomized, controlled trial. Clin Pharmacol Ther 2005; 78 : 60 – 68.
14. Hanai J, Cao P, Tanksale P et al. The muscle ‑ specific ubiquitin ligase atrogin‑1/ MAFbx mediates statin‑induced muscle toxicity. J Clin Invest 2007; 117 : 3940 – 3951.
15. Golomb BA, Evans MA. Statin adverse effects: a review of the literature and evidence for a mitochondrial mechanism. Am J Cardiovasc Drugs 2008; 8 : 373 – 418.
16. Galli F, Iuliano L. Do statins cause myopathy by lowering vitamin E levels? Med Hypotheses 2010; 74 : 707 – 709.
17. Armitage J. The safety of statins in clinical practice. Lancet 2007; 370 : 1781 – 1790.
18. Buettner C, Davis RB, Leveille SG et al. Prevalence of musculoskeletal pain and statin use. J Gen Intern Med 2008; 23 : 1182 – 1186.
19. Bruckert E, Hayem G, Dejager S et al. Mild to moderate muscular symptoms with high‑dosage statin therapy in hyperlipidemic patients – the PRIMO study. Cardiovasc Drugs Ther 2005; 19 : 403 – 414.
20. Staffa JA, Chang J, Green L. Cerivastatin and reports of fatal rhabdomyolysis. N Eng J Med 2002; 346 : 539 – 540.
21. Smogorzewski M. The myopathy of statins. J Ren Nutr 2005; 15 : 87 – 93.
22. Chatzizisis YS, Koskinas KC, Misirli G et al. Risk factors and drug interactions predisposing to statin‑induced myopathy: implications for risk assessment, prevention and treatment. Drug Saf 2010; 33 : 171 – 187.
23. Ghatak A, Faheemb O, Thompson PD. The genetics of statin‑induced myopathy. Atherosclerosis 2010; 210 : 337 – 343.
24. Link E, Parish S, Armitage J et al. SLCO1B1 variants and statin‑induced myopathy – a genome wide study. N Engl J Med 2008; 359 : 789 – 799.
25. Voora D, Shah SH, Spasojevic I et al. The SLCO1B1*5 genetic variant is associated with statin‑induced side effects. J Am Coll Cardiol 2009; 54 : 1609 – 1616.
26. Caso G, Kelly P, McNurlan MA et al. Effect of coenzyme Q10 on myopathic symptoms in patients treated with statins. Am J Cardiol 2007; 99 : 1409 – 1412.
27. Young JM, Florkowski CM, Molyneux SL et al. Effect of coenzyme Q(10) supplementation on simvastatin‑induced myalgia. Am J Cardiol 2007; 100 : 1400 – 1403.
28. Mortensen SA. Overview on coenzyme Q10 as adjunctive therapy in chronic heart failure. Rationale, design and end‑points of “Q ‑ symbio” – a multinational trial. Biofactors 2003; 18 : 79 – 89.
29. Molyneux SL, Florkowski CM, George PM et al. Coenzyme Q10: an independent predictor of mortality in chronic heart failure. J Am Coll Cardiol 2008; 52 : 1435 – 1441.
30. Fedačko J, Pella D, Rybár R et al. Coenzyme Q10 and selenium in the treatment of statin‑associated myopathy. Results of randomized double‑blind clinical study. Eur Heart J 2009; Suppl 30: Abstract 234.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Metabolický syndróm a tuhosť aorty
- Liečime správne pacientov s claudicatio intermittens?
- Normalizovaný smoothness index a parametrický populační RDH index losartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Kardiovaskulárna morbidita u pacientov po liečbe nádorov testis
- Rivaroxaban a inhibitory faktoru Xa v klinické praxi
- Hereditární angioedém – opomíjená diagnóza
- XV. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek, 25.– 28. mája 2010, Lausanne (Švajčiarsko)
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
-
Zemřel doc. MU Dr. Dušan Mrkos, CSc.,
editor emeritus časopisu Vnitřní lékařství - Profesor Jiří Ehrmann jubilantem
-
Cikánková V, Forejtová Š, Ištvánková E et al. Rehabilitace po revmatochirurgických výkonech.
Praha: Maxdorf Jessenius 2010. Počet stran 223. ISBN 978- 80-7345- 206- 3. - Prof. MU Dr. Andrej Dukát, CSc., FESC – šesťdesiatročný
- Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov
- Artériová hypertenzia spojená s ortostatickou hypotenziou
- Imunoterapia a dlhodobá chemoprofylaxia v prevencii recidivujúcich uroinfekcií u žien
- Adrenálne incidentalómy – je súčasný manažment racionálny?
- Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
- Statínová myopatia – rarita, alebo realita?
- Kontrola glykemie u kriticky nemocných je oprávněná a účinná
- Srdce a obličky – osudový vzťah
- Hypertenze u pacienta s diabetes mellitus
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Srdce a obličky – osudový vzťah
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Statínová myopatia – rarita, alebo realita?
- Adrenálne incidentalómy – je súčasný manažment racionálny?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



