-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
Asymmetric dimethylarginine - a novel cardiovascular risk factor
Understanding metabolism of nitric oxide (NO), signal molecule releasing from endothelial cells and influencing vascular tone, belongs to the most remarkable knowledge of last ten years. NO increases vascular tone, inhibits adhesion of monocytes and leukocytes to the vascular endothelium and reduces atherogenic process. Low NO level is one of pathogenic factors starting cardiovascular diseases. Asymmetric dimethylarginine (ADMA) is an endogenous inhibitor of enzyme NO synthase, enzyme catalyzing NO production from arginine. This article gives a brief overview of contemporary state of the relation between ADMA and cardiovascular diseases. Increased ADMA levels are associated with reduced NO synthesis as assessed by impaired endothelium-dependent vasodilatation. In several prospective studies, ADMA evolved as a marker of cardiovascular risk. In the first chapters is described state of the art of biosynthesis, degradation and excretion of ADMA in connection with endothelial dysfunction, coronary artery disease, chronic heart failure, cardiovascular risk in haemodialysis patients, diabetes mellitus, hypertension, lipid metabolism disorders and intensive care unit treatment. Next chapters shortly summarize methods of ADMA detection and their applications. In conclusion clinical relevance of measurement of ADMA levels as a marker of endothelial dysfunction is discussed. Future research tasks of ADMA lead to prospective studies with different types of patients and also healthy population. Moreover ADMA is becoming a goal for pharmacotherapeutic intervention to improve endothelium-dependent vascular function in subjects with high ADMA levels.
Key words:
endothelial dysfunction - nitric oxide - asymmetric dimethylarginine - prognosis - cardiovascular disease
Autoři: R. Široká; R. Cibulka; D. Rajdl; J. Racek
Působiště autorů: Ústav klinické biochemie a hematologie Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Jaroslav Racek, DrSc.
Vyšlo v časopise: Vnitř Lék 2006; 52(3): 249-255
Kategorie: Přehledný referát
Souhrn
K nejvýznamnějším poznatkům minulých deseti let patří pochopení úlohy oxidu dusnatého (NO), signální molekuly uvolňované z buněk endotelu, na cévní systém: snižuje tonus cévní stěny, brání adhezi buněk k cévní stěně, působí proti aktivaci trombocytů a brání rozvoji aterosklerózy. Snížená biologická dostupnost NO je považována za jeden z patogenetických faktorů při vzniku kardiovaskulárních onemocnění. Asymetrický dimetylarginin (ADMA) je endogenní inhibitor syntázy oxidu dusnatého, enzymu katalyzujícího vznik NO z argininu. Tento článek předkládá stručný pohled na současný stav problematiky vztahu mezi ADMA a kardiovaskulárním onemocněním. Zvýšená hladina ADMA je spojena se sníženou produkcí NO způsobující vazokonstrikci. V několika prospektivních studiích byl ADMA prokázán jako marker kardiovaskulárního rizika. V prvých kapitolách je popsán dosavadní výzkum biosyntézy, degradace a vylučování ADMA ve vztahu k endotelové dysfunkci, koronárnímu onemocnění srdce, kardiovaskulárnímu riziku u hemodialyzovaných, k diabetes mellitus, hypertenzi, poruchám lipidového metabolizmu a prognóze nemocných v intenzivní péči. Další kapitoly stručně popisují metody detekce ADMA a frekvenci jejich využití. V závěru je diskutován klinický význam stanovení ADMA jako markeru endotelové dysfunkce. Budoucnost výzkumu úlohy ADMA zřejmě směřuje k prospektivním studiím různých skupin pacientů, jakož i běžné populace s výhledem na možnost farmakologického ovlivnění vysokých hladin ADMA.
Klíčová slova:
endotelová dysfunkce - oxid dusnatý - asymetrický dimetylarginin - prognóza - kardiovaskulární onemocněníÚvod
Přítomností tradičních rizikových faktorů, jako je hypercholesterolemie, hypertenze, kouření a diabetes mellitus, se dá vysvětlit asi 80 % případů koronárních onemocnění. Přestože u zbývající části pacientů s koronárním onemocněním tyto rizikové faktory chybí, dochází k progresi choroby. V průběhu několika posledních let byly objeveny a popsány nové rizikové faktory aterosklerózy a vysvětleno jejich působení na molekulární úrovni. Jedním z míst, kde dochází k funkčním změnám, vedoucím později k rozvoji k aterosklerotického procesu, jsou buňky endotelu. Poškození endotelu je jedním z několika intenzivně zkoumaných parametrů předpovídajících riziko rozvoje aterosklerózy. Většina nových studií udává, že důležité prognostické informace o kardiovaskulárních komplikacích lze zjistit sledováním některých parametrů v periferním krevním oběhu. Jedním z nich je i oxid dusnatý, resp. jeho radikál (·NO), který vzniká dvoustupňovou reakcí z L-argininu působením syntázy oxidu dusnatého (NO-synthasy, NOS), ale i bez jejího vlivu, a to působením superoxidu. Tyto reakce umožňují vznik NO i ve tkáních neobsahujících NOS. NO způsobuje vazodilataci a je klíčovým inhibitorem adheze a agregace trombocytů. Navíc tato molekula snižuje produkci superoxidového radikálu v cévách a působí jako inhibitor oxidace lipoproteinů o nízké hustotě (LDL). Inhibicí produkce tkáňového faktoru v monocytech brzdí NO iniciaci koagulační kaskády. Hojivé pochody a remodelace cévní stěny jsou rovněž kontrolovány NO. Vzhledem k významnému vlivu NO na cévní stěnu je jeho mezinárodní název „endogenous anti-atherosclerotic molecule“ více než výstižný.
ADMA - endogenní inhibitor NOS
Oxid dusnatý resp. jeho radikál (·NO) způsobuje vazodilataci a je klíčovým inhibitorem adheze a agregace trombocytů [1]. Syntéza NO je selektivně inhibována kompetitivní blokádou aktivního centra NOS dvěma deriváty L-argininu: NG-monometyl-L-argininem (L-NMMA) a NG,NG-dimetyl-L-argininem (asymetrický dimetylarginin - ADMA). Koncentrace ADMA v krvi je desetkrát vyšší než koncentrace druhého derivátu (L-NMMA) a tím je určena i jeho role hlavního inhibitoru NOS [2,3]. Valace et al byli první, kdo popsali ADMA jako hlavní endogenní inhibitor NOS v plazmě, ačkoli ještě neznali způsob interference metylargininů se signální transdukční cestou. Na rozdíl od ADMA, symetrický dimetylarginin (SDMA) nezpůsobuje inhibici NOS.
Data z experimentálních studií potvrzují patologickou koncentraci ADMA v rozmezí 3-15 µmol/l, kdy prokazatelně dochází k inhibici produkce NO endotelem [4-7]. Faraci et al [6] určili hodnotu 1,8 ± 0,1 µmol/l jako IC50 pro inhibici syntázy NO molekulou ADMA v homogenátu krysích mozečků (IC50 je taková koncentrace inhibitoru, která působí pokles aktivity příslušného enzymu, v našem případě NOS, na polovinu). U experimentů in vitro (aortální buňky endotelu hovězího dobytka) bylo nedávno prokázáno, že vysoká koncentrace ADMA (IC50 = 3,9 µmol/l) inhibuje aktivitu jak endotelové tak neuronální NOS [24].
NOS je dimer složený ze dvou domén, oxidující a redukující. Za ideálních katalytických podmínek (je přítomen substrát L-arginin a kofaktory: tetrahydrobiopterin, kalmodulin, NADPH, flavinmononukleotid - FMN a flavinadenindinukleotid - FAD v optimální koncentraci) probíhá transfer elektronu z molekuly kyslíku přes kaskádu kofaktorů až k L-argininu. Produkty této reakce jsou NO a L-citrulin. Pokud dojde k porušení optimálních podmínek (deficit L-argininu, převaha LDL cholesterolu, přítomnost ADMA), cyklus přenosu elektronu je přerušen a dochází ke vzniku superoxidového radikálu (O2·-) jako důsledek přijetí elektronu molekulou kyslíku [8-10].
Biosyntéza, metabolizmus a vylučování ADMA
Biochemické cesty přeměny asymetrického dimetylargininu a jeho odbourávání jsou znázorněny na obr. 1. Působením enzymu proteinmetyltransferázy (PRMT) I a II dochází k metylaci zbytků argininu v molekulách proteinů. Při jejich degradaci vznikají dva stereoizomery, ADMA a SDMA. Lidské endotelové buňky jsou schopny syntetizovat ADMA i SDMA [11-15]. ADMA zde za určitých podmínek, např. za přítomnosti oxidovaných LDL, figuruje jako autokrinní regulátor aktivity entotelové NOS. Ito et al [16] prokázali, že po inkubaci oxidovaných LDL a TNF-α (tumor necrosis factor) s buňkami endotelu dochází na rozdíl od kontrolní skupiny ke zvýšení hodnot ADMA. Hladina dimetylargininů v cytoplazmě (nikoliv v extracelulárním prostoru) byla též zvýšena. Bogle et al [17] demonstrovali kompetitivní inhibici ADMA na vazebném místu pro L-arginin. Stejné výsledky popsali Azuma et al [14] u balónové angioplastiky. Prokázali, že regenerovaný endotel produkuje více ADMA než kontrolní buňky.
Obr. 1. Biosyntéza a metabolizmus ADMA. 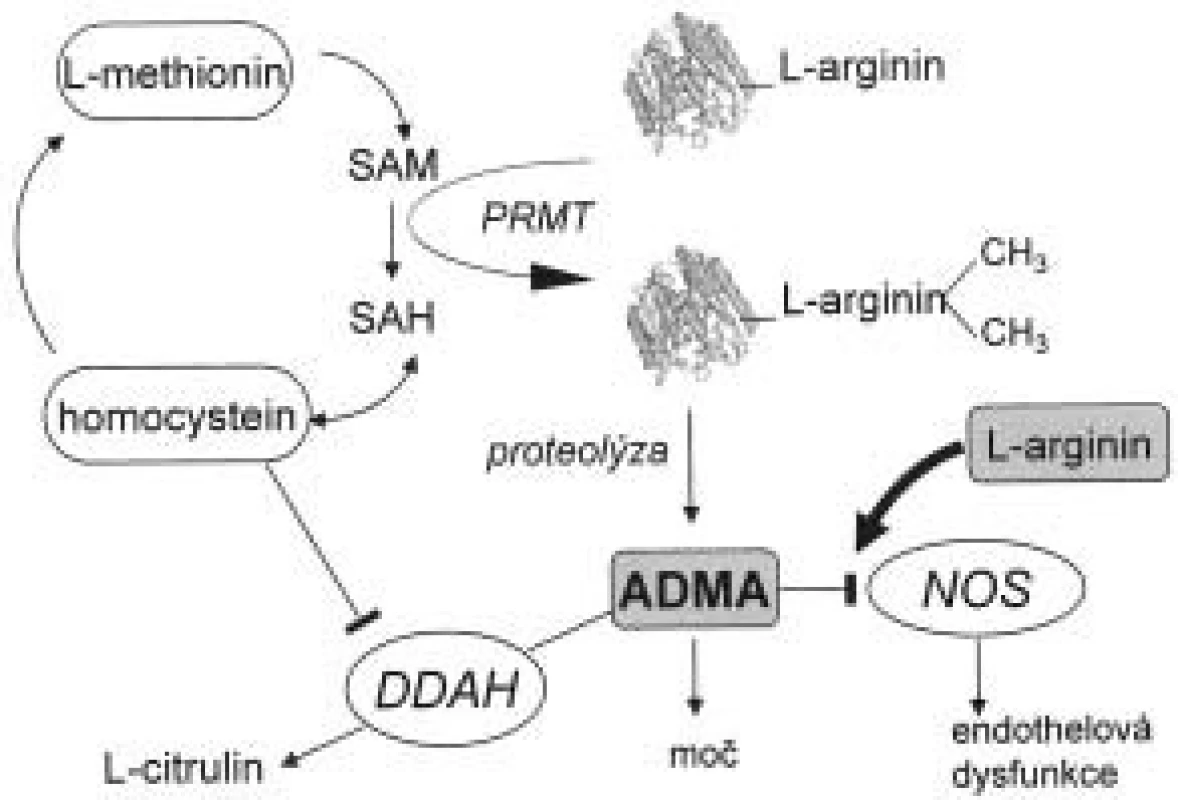
Zkratky vysvětleny v textu. Jak ADMA, tak SDMA jsou eliminovány renální exkrecí. Je známo, že pacienti v terminální fázi renálního onemocnění (end stage renal disease - ESRD) mají hodnoty ADMA v plazmě až 5krát vyšší než zdravé kontroly. Velké skupiny pacientů s renálním selháním byla sledována jak v Evropě, tak v USA. Výsledky těchto prací shrnul Kielstein et al [18], a ačkoli se absolutní hodnoty koncentrací ADMA liší v závislosti na použité metodě měření, je z této práce patrné zvýšení ADMA i SDMA řádově 2krát až 10krát vůči zdravým kontrolám. U hemodialyzovaných pacientů lze nalézt vysokou hladinu jak ADMA tak SDMA na rozdíl od pacientů léčených peritoneální dialýzou, kde je zvýšen pouze SDMA a nikoli ADMA [19,20]. Lze tedy konstatovat, že eliminace SDMA probíhá pouze ledvinami, na rozdíl od ADMA, kde bylo nutné hledat další metabolickou dráhu pro jeho odbourání. Gross et al nalezli vztah koncentrace ADMA k vazodilataci závislé na endotelu, kdy při peritoneální dialýze hodnoty ADMA byly zvýšeny, nedocházelo k vazodilataci endotelu na rozdíl od hemodialyzovaných po hemodialýze s nízkou hodnotou ADMA, kde vazodilatace byla prokázána [21].
Metabolizmus ADMA, ale nikoli SDMA, probíhá hydrolytickou degradací na citrulin a dimetylamin pomocí enzymu dimetylarginin-diaminohydrolázy (DDAH) [22].
Inhibice DDAH způsobuje vazokonstrikci, která je reverzibilní za přítomnosti L-argininu [15]. Jsou známy dvě izoformy DDAH: DDAH-1 a DDAH-2. První z nich lze nalézt v tkáni syntetizující neuronální NOS a druhou v tkáních zodpovědných za syntézu endotelové NOS [23]. Aktivita tohoto enzymu je závislá na komplexu regulačních mechanizmů, které ještě nejsou zcela detailně popsány. Bylo prokázáno, že oxidační stres indukovaný oxidovanými LDL nebo TNF-α snižuje aktivitu DDAH, ale nikoli expresi jejího proteinu v buňkách endotelu in vitro [16]. Aktivita DDAH je blokována zvýšenou koncentrací homocysteinu (Hcy) v buňce jednak pomocí redox přenašečů a zároveň přímou interferencí Hcy se samotnou DDAH. Oba mechanizmy vedou ke zvýšení koncentrace ADMA [24]. Dále je DDAH inaktivována S-nitrosylací [25], což vede k předpokladu zpětné regulace hladiny ADMA při zvýšené hladině NO. Exprese genu DDAH je indukována tzv. all-trans retinovou kyselinou [26]. Závěrem lze tedy konstatovat, že ADMA je produkován zcela běžně v důsledku přeměny proteinů a k jejímu hromadění dochází zejména v závislosti na aktivitě DDAH.
ADMA u jednotlivých klinických stavů
Endotelová dysfunkce je někdy považována za časné stadium aterosklerózy. Dochází ke snížené syntéze oxidu dusnatého (NO) v cévní stěně (hlavní vazodilatační látka) a naopak ke zvýšené produkci látek s vazokonstričními účinky (endotelin-1, tromboxan A2, prostaglandin H2 aj.). Přehled onemocnění souvisejících se zvýšenou hladinou ADMA udává tab. 1.
Tab. 1. Onemocnění zvyšující koncentraci ADMA v plazmě/séru (vzhledem ke zdravým kontrolám). 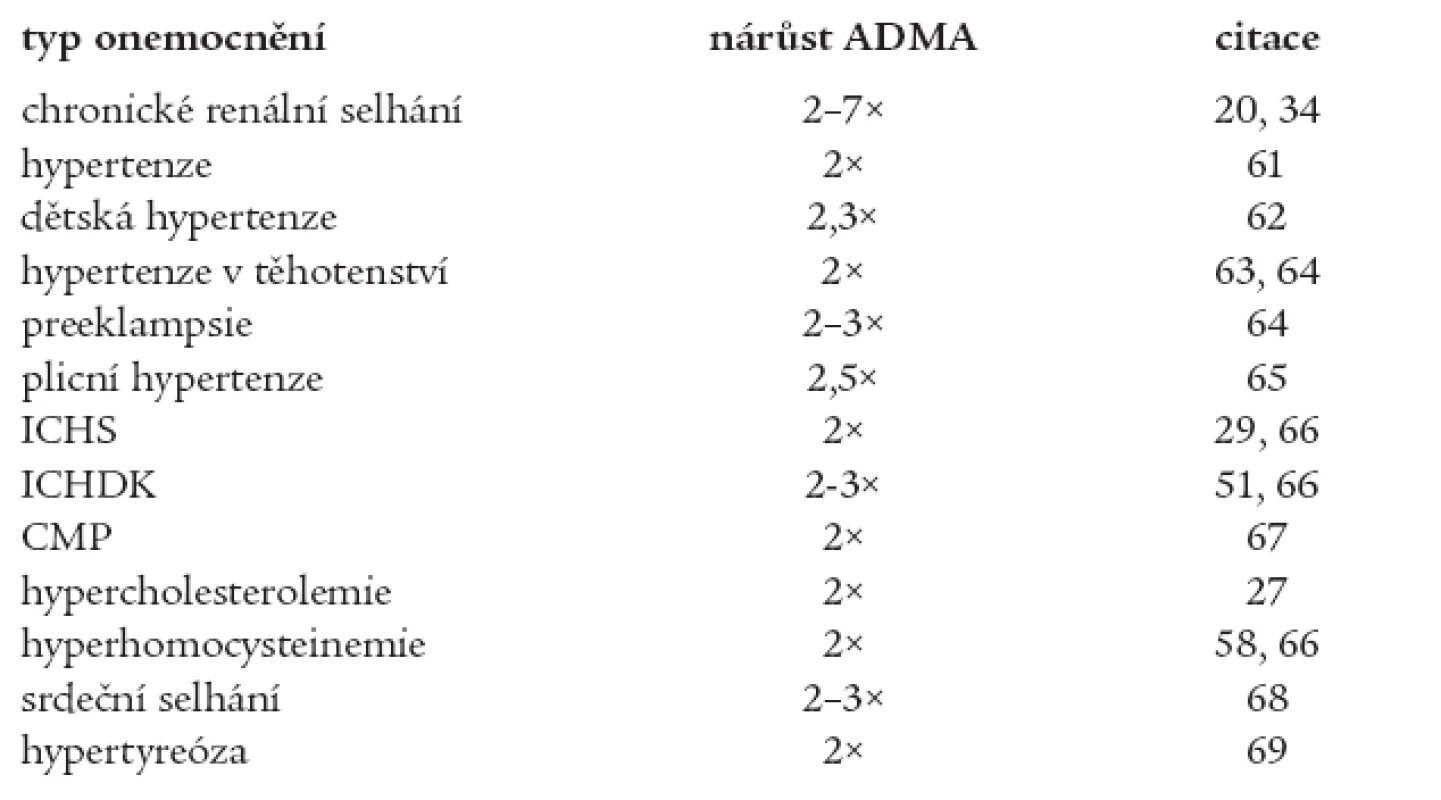
ADMA a kardiovaskulární onemocnění
Zvýšená hodnota ADMA v lidské plazmě u nemocných s hypercholesterolemií s aterosklerózou byla prokázána již v roce 1998. Koncentrace ADMA (u zdravých jedinců 1,0 µmol/l) dosáhla hodnoty 2,2 µmol/l u mladých, klinicky asymptomatických jedinců s hypercholesterolemií [27]. U starších pacientů s onemocněním periferních arterií a generalizovanou aterosklerózou byly změřeny hladiny ADMA od 2,5 do 3,5 µmol/l; jejich výše odpovídala stadiu poškození cévního systému [28]. Multicentrická studie CARDIAC, provedená v Německu a zahrnující 400 pacientů s koronárním onemocněním srdce (CAD) a více než 400 zdravých jedinců, potvrdila signifikantně zvýšené hodnoty ADMA u pacientů s CAD na rozdíl od věkem a pohlavím srovnatelných zdravých jedinců [29].
Pacienti s chronickou srdeční nedostatečností mají vyšší koncentraci ADMA než zdraví jedinci [34]. Echokardiografické parametry ukazující funkci levé srdeční komory u 198 pacientů s ESRD jevily významný vztah k hladině ADMA: pozitivní byla korelace mezi koncentrací ADMA a tloušťkou stěny levé komory myokardu, významný inverzní vztah byl nalezen mezi ADMA a hodnotou ejekční frakce [35]. Další z poznatků souvisejících se zvýšenou hladinou ADMA je inverzní vztah mezi ADMA a maximální spotřebou kyslíku během fyzické zátěže [34].
ADMA u hemodialyzovaných pacientů
Pacienti s chronickou renální insuficiencí byli první skupinou s vysokou hladinou ADMA, získané výsledky byly publikovány a potvrzeny mnoha dalšími studiemi [30,31,32]. Zvýšení hladiny ADMA u hemodialyzovaných pacientů je částečně způsobeno zhoršenou eliminací ADMA během dialýzy [20]. Takto chronicky zvýšená hladina ADMA může částečně souviset s vysokým výskytem kardiovaskulární morbidity a mortality u pacientů s chronickou renální insuficiencí [30]. Vzhledem k výše uvedeným výsledkům byla provedena prognostická studie s 224 hemodialyzovanými pacienty: pacienti s hodnotou ADMA v nejvyšším kvartilu vykazovali nejvyšší celkovou úmrtnost a nejvíce kardiovaskulárních příhod během dalších tří let, kdy byli sledováni (graf 1). Např. celková úmrtnost pacientů během 33 měsíců sledování byla o 72 % vyšší u pacientů s hodnotou ADMA nad mediánem (2,52 µmol/l) ve srovnání s těmi, jejichž koncentrace ADMA byla nižší než medián [33]. Přestože je díky omezené glomerulární filtraci vysoká hladina ADMA u hemodialyzovaných obvyklá, lze tyto nemocné podle koncentrace ADMA rozdělit na skupiny s vysokým a nízkým rizikem.
Graf 1. Graf přežití u hemodialyzovaných pacientů (pravděpodobnost úmrtí z kardiovaskulárních příčin) vzhledem k výchozím hodnotám koncentrace ADMA. 
Zkratky vysvětleny v textu. ADMA a diabetes mellitus
ADMA může též hrát důležitou roli jako ukazatel rizika kardiovaskulárních komplikací u diabetických pacientů. V sérii studií různých autorů je popsána zvýšená hladina ADMA u diabetiků 2. typu [36-38]. Molekulární mechanizmus zvýšení ADMA v plazmě u diabetiků lze objasnit například oxidačním stresem, který porušuje aktivací PRMT rovnováhu mezi tvorbou ADMA a jeho odbouráváním účinkem DDAH [41] nebo mechanizmem závislým na angiotenzimu II [40].
ADMA a metabolizmus lipidů
Existuje zřejmě vztah mezi přítomností tradičních rizikových faktorů aterosklerózy (dyslipidemie) a endotelovou dysfunkcí. Jedním z mechanizmů, spojujících poruchy lipidového metabolizmu s endotelem, je aminokyselina ADMA. Ta působí jako inhibitor základního enzymu, potřebného pro tvorbu oxidu dusnatého - NOS. Bylo například zjištěno, že u zdravých osob s hypercholesterolemií dochází asi k dvojnásobnému zvýšení koncentrace ADMA ve srovnání s osobami s normální hladinou cholesterolu. Jednalo se o mladé jedince bez klinické manifestace aterosklerózy. Zvýšení koncentrace ADMA bylo navíc doprovázeno zhoršenou schopností vazodilatace a sníženou hladinou metabolitů NO v moči [27]. Podobné změny byly pozorovány i v některých pokusech na zvířecích modelech [41]. Dále bylo prokázáno, že rovněž hypertriacylglycerolemie, další významný rizikový faktor aterogeneze, je asociována se zvýšenou koncentrací ADMA [31]. Patofyziologie zvýšené koncentrace ADMA u poruch lipidového metabolizmu je však zatím neznámá [42] a lze pouze předpokládat vliv léčby fibráty na zvýšení hladiny Hcy, a tím nepřímo i na ADMA.
Intenzivní péče
V holandské studii s 52 pacienty léčenými na jednotkách intenzivní péče byl ADMA při použití mnohorozměrné analýzy jedním ze silných prediktorů přežití [43]. Pacienti s hodnotou ADMA v nejvyšším kvartilu byli 17krát více ohroženi rizikem selhání životních funkcí. Také bylo prokázáno, že hladina ADMA v plazmě je kontrolována z velké části funkcí ledvin a jater [43,44]. Některé studie hovoří v této souvislosti o zvýšení ADMA u pacientů se selháním jaterních funkcí [45].
Metody detekce ADMA
První metoda měření ADMA byla založena na vysokorozlišovací kapalinové chromatografii (HPLC). Tato metoda umožňuje kvantitativně rozdělit dva velmi podobné stereoizomery, ADMA a SDMA (symetrický dimetylarginin). Metoda je založena na separaci vzorku pomocí chromatografie na reverzní fázi na koloně C18 izokratickým způsobem. Po preanalytické fázi (deproteinace a následná derivatizace všech homologů L-argininu) následuje nástřik na kolonu a fluorescenční detekce [46,47].
V současné době je tato metoda nahrazována jinou, časově i finančně méně náročnou enzymatickou imunoanalýzou (enzyme-linked immunosorbent assay - ELISA). Tato nová metoda využívá vysoké specifity polyklonálních protilátek (kompetitivní princip, odlišení dvou stereoizomerů ADMA a SDMA se děje acylací) a byla srovnána s metodami kapalinové (LC-MS, Liquid Chromatography-Mass Spectrometry) a plynové chromatografie (GC-MS, Gas Chromatography-Mass Spectrometry). Výsledkem byla dobrá korelace těchto dvou metod, daná korelačním koeficientem r = 0,424 [48].
Klinický význam stanovení ADMA
Výsledky výše zmíněných studií naznačují, že by zvýšená koncentrace ADMA mohla sloužit jako marker endotelové dysfunkce a časných stadií aterogeneze. Její monitorování by tedy mohlo být prospěšné zejména v primární prevenci těchto poruch. Skutečnost, že významné zvýšení rizika bylo zjištěno pouze u pacientů s hodnotou ADMA v nejvyšším kvartilu, ukazuje, že existuje nějaká „kritická koncentrace“ ADMA v plazmě, která je důležitá při uplatnění jeho patologického vlivu.
S rostoucími poznatky o metabolizmu ADMA lze dále diskutovat možná terapeutická řešení, z nichž nejjednodušší se jeví suplementace L-argininem. Schopnost exogenního L-argininu zlepšovat funkci a strukturu cév byla prověřena několika experimentálními a klinickými studiemi. Tyto studie prokázaly, že L-arginin zlepšuje funkci endotelu a zároveň redukuje klinické symptomy prodělaných kardiovaskulárních onemocnění [49-53]. Mechanizmus působení je jasný - přirozený substrát L-arginin vytěsňuje s aktivního centra NOS kompetitivní inhibitor tohoto enzymu, ADMA. Některé prameny rovněž uvádějí snížení hladiny ADMA v důsledku podávání ACE inhibitorů nebo blokátorů angiotenzinových receptorů [54] a pod vlivem substituce folátem [55]. Další možností snížení koncentrace ADMA představuje podání statinů [56,57], i když naopak Jing et al ve své studii popírají vliv simvastatinu na aktivitu DDAH či snížení koncentrace ADMA [58]. Další možností je ovlivnění oxidačního stresu podáváním antioxidantů - superoxid totiž zvyšuje aktivitu metylačních enzymů a tedy následně i produkci ADMA [59]. Zdá se, že pomůže i snížení hmotnosti - u morbidně obézních pacientek (BMI = 49) byla plazmatická koncentrace ADMA vyšší než u kontrol (BMI < 25) a při poklesu hmotnosti na BMI 34 koncentrace ADMA signifikantně klesla [60].
Závěr
Objev a popsání metabolizmu ADMA a dalších metabolitů z cyklu homocysteinu představuje další pokrok v prevenci a léčbě onemocnění souvisejících s oxidačním stresem. Na základě dnešních poznatků se zdá, že ADMA je významným prediktorem rozvoje aterosklerózy a onemocnění endotelu (endotelové dysfunkce). Je známo, že dosud sledované rizikové faktory nevysvětlují zcela vznik všech akutních koronárních příhod. Sledování ADMA by mohlo tuto situaci alespoň u některých pacientů zlepšit. Je nutné pokračovat v dalších multicentrických studiích s cílem detailněji popsat vliv ADMA na regeneraci endotelu a ev. i určení tzv. kritické hladiny u rizikových skupin pacientů.
Tato práce vznikla za podpory grantu GA UK 78/2005/C/LFP.
Mgr. Romana Široká
www.fnplzen.cz
e-mail: sirokar@fnplzen.cz
Doručeno do redakce: 24. 11. 2005
Přijato po recenzi: 2. 1. 2006
Zdroje
1. Racek J, Holeček V. Enzymy a volné radikály. Chem Listy 1999; 93 : 774-780.
2. Kielstein JT, Frölich JC, Haller H et al. ADMA: an atherosclerotic disease mediating agent in patient with renal disease? Nephrol Dial Transplant 2001; 16 : 1742-1745.
3. Miyazaki H, Matsuoka H, Cooke JP et al. Endogenous nitric oxide synthase inhibitor. A novel marker of atherosclerosis. Circulation 1999; 99 : 1141-1146.
4. Vallance A, Leone A, Calver J et al. Accumulation of an endogenous inhibitor of NO synthesis in chronic renal failure. Lancet 1992; 339 : 572-575.
5. Kurose R, Wolf MB, Grisham DN et al. Effects of an endogenous inhibitor of nitric oxide synthesis on postcapillary venules. Am J Physiol 1995; 268: H2224-H2231.
6. Faraci FM,. Brian JE, Heistad DD. Response of cerebral blood vessels to an endogenous inhibitor of nitric oxide synthase. Am J Physiol 1995; 269: H1522-H1527.
7. Segarra G, Medina P, Ballester RM et al. Effects of some guanidino compounds on human cerebral arteries. Stroke 1999; 30 : 2206-2211.
8. Klatt P, Schmidt K, Uray G et al. Multiple catalytic functions of brain nitric oxide synthase. J Biol Chem 1994; 268 : 14781-14787.
9. Vasquez-Vivar J, Kalyanaraman B, Martasek P et al. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc Natl Acad Sci USA 1998; 95 : 9220-9225.
10. Pritchard KA, Groszek L, Smalley DM et al. Native low-density lipoprotein increases endothelial nitric oxide synthase generation of superoxide anion. Circ Res 1995; 77 : 510-518.
11. Fickling SA, Leone AM, Nussey SS et al. Synthesis of NG,NG-dimethylarginine by human endothelial cells. Endothelium 1993; 1 : 137-140.
12. MacAllister RJ, Fickling SA, Whitley GSJ et al. Metabolism of methylarginines by human vasculature: implications for the regulation of nitric oxide synthesis. Br J Pharmacol 1994; 112 : 43-48.
13. Böger RH, Sydow K, Borlak J et al. Cholesterol upregulates synthesis of asymmetric dimethylarginine (ADMA) in human endothelial cells. Involvement of S-adenosylmethionine-dependent methyltransferases. Circ Res 2000; 87 : 99-105.
14. Azuma H, Sato J, Hamasaki H et al. Accumulation of endogenous inhibitors for nitric oxide synthesis and decreased content of L-arginine in regenerated endothelial cells. Br J Pharmacol 1995; 115 : 1001-1004.
15. MacAllister RJ, Parry H, Kimoto M et al. Regulation of nitric oxide synthesis by dimethylarginine dimethylaminohydrolase. Br J Pharmacol 1996; 119 : 1533-1540.
16. Ito S, Teak PS, Adimoolam S et al. Novel mechanism for endothelial dysfunction. Dysregulation of dimethylarginine dimethylaminohydrolase. Circulation 1999; 99 : 3092-3095.
17. Bogle RG, MacAllister RJ, Whitley GSJ et al. Induction of NG-monomethyl-arginine uptake: a mechanism for differential inhibition of NO synthases? Am J Physiol 1995; 269: C750-C756.
18. Kielstein JT, Bode-Böger SM, Frölich JC et al. Relationship of asymmetric dimethylarginine to dialysis treatment and atherosclerotic disease. Kidney Int 2001; 78, Suppl: S9-S13.
19. MacAllister RJ, Rambausek MH, Vallance P et al. Concentration of dimethyl-arginine in the plasma of patients with end-stage renal failure. Nephrol Dial Transplant 1996; 11 : 2449-2452.
20. Kielstein JT, Böger RH, Bode-Böger SM et al. Asymmetric dimethylarginine plasma concentrations differ in patients with end-stage renal disease: relationship to treatment method and atherosclerotic disease. J Am Soc Nephrol 1999; 10 : 594-600.
21. Gross JM, Donald AE, Vallance P et al. Dialysis improves endothelial function in humans. Nephrol Dial Transplant 2001; 16 : 823-1829.
22. Ogawa T, Kimoto M, Sasanka K. Occurrence of a new enzyme catalysing the direct conversion of NG,NG-dimethyl - arginine to-citrulline in rats. Biochem Biophys Res Commun 1987; 148 : 671-677.
23. Leiper JM, Santa Maria J, Chubb A et al. Identification of two human dimethylarginine dimethylaminohydrolases with distinct tissue distributions and homology with microbial arginine deiminases. Biochem J 1999; 343 : 209-214.
24. Stühlinger MC, Tsao PS, Her JH et al. Homocysteine impairs the nitric oxide synthase pathway. Role of asymmetric dimethylarginine. Circulation 2001; 104 : 2569-2575.
25. Leiper J, Murray-Rust J, Macdonald N et al. S-Nitrosylation of dimethylarginine dimethylaminohydrolase regulates enzyme activity: further interactions between nitric oxide synthase and dimethylarginine dimethylaminohydrolase. Proc Natl Acad Sci 2002; 99 : 13527-13532.
26. Achan V, Tran CT, Strigoni F et al. All-trans-retinoic acid increases nitric oxide synthesis by endothelial cells: a role for the induction of dimethylarginine dimethylaminohydrolase. Circ Res 2002; 90 : 764-769.
27. Böger RH, Bode-Böger SM, Szuba A et al. Asymmetric dimethylarginine: a novel risk factor for endothelial dysfunction. Its role in hypercholesterolemia. Circulation 1998; 98 : 1842-1847.
28. Böger RH, Bode-Böger SM, Thiele W et al. Biochemical evidence for impaired nitric oxide synthesis in patients with peripheral arterial occlusive disease. Circulation 1997; 95 : 2068-2074.
29. Böger RH, Lenzen H, Hanefeld C et al. Asymmetric dimethylarginine: an endogenous inhibitor of NO synthase is a predictor of the risk for coronary heart disease - Result of multicenter CARDIAC study. Circulation 2003; 108: IV-256 52.
30. Böger RH, Zoccali C. ADMA: A novel risk factor that explains excess cardiovascular event rate in patient with end-stage renal disease. Atherosclerosis Suppl 2003; 4 : 23-28.
31. Široká R, Trefil L, Rajdl D et al. Asymmetric dimethylarginine, homocysteine and renal function - is there a relation? Clin Chem Lab Med 2005, 43; 1147-1150.
32. Široká R, Trefil L, Rajdl D et al. Asymetrický dimethylarginin, homocystein a funkce ledvin. KBM 2005; in press.
33. Zoccali C, Bode-Böger SM, Mallamaci F et al. Asymmetric dimethylarginine (ADMA): an endogenous inhibitor of nitric oxide synthase predicts mortality in end-stage renal disease (ESRD). Lancet 2001; 358 : 2113-2117.
34. Hornig B, Arakawa N, Böger RH et al. Plasma levels of ADMA are increased and inversely related to endothelium-mediated vasodilatation in patients with chronic heart failure: a new predictor of endothelial dysfunction? Circulation 1998; 98(Suppl): I-318.
35. Zoccali C, Mallamaci F, Maas R et al. Left ventricular hypertrophy, cardiac remodelling and asymmetric dimethylarginine (ADMA) in hemodialysis patients. Kidney Int 2002; 62 : 339-345.
36. Abbasi F, Asagmi T, Cooke JP et al. Plasma concentrations of asymmetric dimethylarginine are increased in patients with type 2 diabetes mellitus. Am J Cardiol 2001; 88 : 1201-1203.
37. Fard A, Tuck CH, Donis JA et al. Acute elevations of plasma asymmetric dimethylarginine and impaired endothelial function in response to a high-fat meal in patients with type 2 diabetes. Arterioscler Thromb Vasc Biol 2000; 20 : 2039-2044.
38. Stühlinger M, Abbasi F, Chu et JW et al. Relationship between insulin resistance and an endogenous nitric oxide synthase inhibitor. J Am Med Assoc 2002; 287 : 420-426.
39. Lin KY, Ito A, Asagami T et al. Impaired nitric oxide synthase pathway in diabetes mellitus. Role of asymmetric dimethylarginine and dimethylarginine dimethylaminohydrolase. Circulation 2002; 106 : 987-992.
40. Ito A, Egashira K, Narishige T et al. Angiotensin-converting enzyme activity is involvedin the mechanism of increased endogenous nitric oxide synthase inhibitor in patients with type 2 diabetes mellitus. Circ J 2002; 66 : 811-815.
41. Rainer H, Böger RH. Asymmetric Dimethylarginine, an Endogenous Inhibitor of Nitric Oxide Synthase, Explains the ”L-Arginine Paradox” and Acts as a Novel Cardiovascular Risk Factor 1,2. Nitric Oxide 2004; 11 : 1-8.
42. Lundman P, Eriksson, MJ, Stühlinger M et al. Mild-to-moderate hypertriglyceridemia in young men is associated with endothelial dysfunction and increased plasma concentrations of asymmetric dimethylarginine. J Am Coll Cardiol 2001; 38 : 111-116.
43. Nijveldt RJ, Teerlink T, Van Der Hoven B et al. Asymmetrical dimethylarginine (ADMA) in critically ill patients: high plasma ADMA concentration is an independent risk factor of ICU mortality. Clin Nutr 2003; 22 : 23-30.
44. Nijveldt RJ, Teerlink T, Siroen MP et al. The liver is an important organ in the
metabolism of asymmetrical dimethylarginine (ADMA). Clin Nutr 2003; 22 : 17-22.
45. Tsikas D, Rode I, Becker T et al. Elevated plasma and urine levels of ADMA and 15(S)-8-iso-PGF2alpha in end-stage liver disease. Hepatology 2003; 38 : 1063-1064.
46. Teerlink T, Nijveldt RJ, de Jong S et al. Determination of arginine, asymmetric dimethylarginine, and symmetric dimethylarginine in human plasma and other biological samples by high-performance liquid chromatography. Anal Biochem 2002; 303 : 131-137.
47. Široká R, Racek J, Filipovský J. Asymetrický dimethylarginin (ADMA). Klin Biochem Metab 2005; 13 : 131-134.
48. Schulze F, Wesemann R, Schwedhelm E et al. Determination of asymmetric dimethylarginine (ADMA) by a novel ELISA assay. Clin Chem Lab Med 2004; 42 : 1377-1383.
49. Böger RH, Bode-Boger SM, Thiele W et al. Restoring vascular nitric oxide formation by L-arginine improves the symptoms of intermittent claudication in patients with peripheral arterial occlusive disease. J Am Coll Cardiol 1998; 32 : 1336-1344.
50. Rector TS, Bank AJ, Kuklen KA et al. Randomized, double-blind, placebo-controlled study of supplemental oral L-arginine in patients with heart failure. Circulation 1996; 93 : 2135-2141.
51. Ceremuzynksi L, Chamiec T, Herbacynska-Cedro K. Effect of supplemental oral L-arginine on exercise capacity in patients with stable angina pectoris. Am J Cardiol 1997; 80 : 331-333.
52. Maxwell AJ, Anderson BE, Cooke JP. Nutritional therapy for peripheral arterial disease: a double-blind, placebo-controlled, randomized trial of Heart Bar. Vasc Med 2000; 5 : 11-19.
53. Tousoulis D, Davies GJ, Tentolouris C et al. Effects of L-arginine on flow mediated dilatation induced by atrial pacing in diseased epicardial coronary arteries. Heart 2003; 89 : 531-534.
54. Delles C, Schneider MP, John S et al. Angiotensin converting enzyme inhibition and angiotensin II AT1-receptor blockade reduce the levels of asymmetrical N(G), N(G)-dimethylarginine in human essential hypertension. Am J Hypertens 2002;15 : 590-593.
55. Holven KB, Haugstad TS, Holm T et al. Folic acid treatment reduces elevated plasma levels of asymmetric dimethylarginine in hyperhomocysteinaemic subjects. Br J Nutr 2003; 89 : 359-363.
56. Valkonen VP, Laakso J, Paiva H et al. Asymmetrical dimethylarginine (ADMA) and risk of acute coronary events. Does statin treatment influence plasma ADMA levels?
Atheroscler Suppl 2003; 4 : 19-22.
57. Lu TM, Ding YA, Leu HB et al. Effect of rosuvastatin on plasma levels of asymmetric dimethylarginine in patients with hypercholesterolemia. Am J Cardiol 2004; 94 : 157-161.
58. Jiang JL, Jiang DJ, Tang YH et al. Effect of simvastatin on endothelium-dependent vaso-relaxation and endogenous nitric oxide synthase inhibitor. Acta Pharmacol Sin 2004; 25 : 893-901.
59. Sydow K, Munzel T. ADMA and oxidative stress. Atheroscler Suppl 2003; 4 : 41-51.
60. Krzyzanowska K, Mittermayer F, Kopp HP et al. Weight loss reduces circulating asymmetrical dimethylarginine concentrations in morbidly obese women. J Clin Endocrinol Metab 2004; 89 : 6277-6281.
61. Surdacki A, Nowicki M, Sandmann J et al. Effects of acute euglycemic hyperinsulinemia on urinary nitrite/nitrate excretion and plasma endothelin-1 levels in men with essential hypertension and normotensive controls. Metabolism 1999; 48 : 887-891.
62. Goonasekera CD, Shah V, Rees DD et al. Vascular endothelial cell activation associated with increased plasma asymmetric dimethyl arginine in children and young adults with hypertension: a basis for atheroma? Blood Press 2000; 9 : 16-21.
63. Holden DP, Fickling SA, Whitley GS et al. Plasma concentrations of asymmetric dimethylarginine, a natural inhibitor of nitric oxide synthase, in normal pregnancy and preeclampsia. Am J Obstet Gynecol 1998; 178 : 551-556.
64. Savvidou MD, Hingorani AD, Tsikas D et al. Endothelial dysfunction and raised plasma concentrations of asymmetric dimethylarginine in pregnant women who subsequently develop pre-eclampsia. Lancet 2003; 361 : 1511-1517.
65. Gorenflo M, Zheng C, Werle E et al. Plasma levels of asymmetrical dimethyl-L-arginine in patients with congenital heart disease and pulmonary hypertension. J Cardiovasc Pharmacol 2001; 37 : 489-492.
66. Sydow K, Hornig B, Arakawa N et al. Endothelial dysfunction in patients with peripheral arterial disease and chronic hyperhomocysteinemia: potential role of ADMA.Vasc Med 2004; 9 : 93-101.
67. Yoo JH, Lee SC. Elevated levels of plasma homocyst(e)ine and asymmetric dimethylarginine in elderly patients with stroke. Atherosclerosis 2001; 158 : 425-430.
68. Usui M, Matsuoka H, Miyazaki H et al. Increased endogenous nitric oxide synthase inhibitor in patients with congestive heart failure. Life Sci 1998; 62 : 2425-2430.
69. Hermenegildo C, Medina P, Peiro M et al. Plasma concentration of asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase, is elevated in hyperthyroid patients. J Clin Endocrinol Metab 2002; 87 : 5636-5640.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2006 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- PET - možnosti a limitace - editorial
- Molekulární biologie a diabetes: kam teď? - editorial
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Hypertenze v těhotenství
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Jak vidí endokrinologové profesora MUDr. Josefa Marka, DrSc.
- Když přišel Josef Marek před 40 lety na 3. interní kliniku
- I. Žucha, I. Hulín: Myšlienky. Bratislava: Slovak Academic Press 2006. 255 stran. ISBN 80-89104-75-4.
- Sninčák M. Artériová hypertenzia: súčasné klinické trendy. Košice: TypoPress 2005. 284 stran. ISBN 80-89089-39-9.
- Hoffmann GF et al. Dědičné metabolické poruchy. Praha: Grada 2005. 416 stran. ISBN 80-247-0831-0.
- 130. internistický den v Olomouc věnovaný revmatologii
- Sdělení výboru České internistické společnosti
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



