-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diabetes mellitus a ochorenia štítnej žľazy
Diabetes mellitus and thyroid diseases
The prevalence of thyroid diseases in patients with diabetes mellitus is approximately 10 - 15% (in non-diabetic population is about 6 %). The relationship between diabetes mellitus type 2 and thyreopathies is complex and not completely researched at present time. Autoimmune thyropathies are frequent in patients with type 1 diabetes mellitus. At present there are some studies demonstrating higher prevalence of autoimmune thyreopathies also in type 2 diabetes mellitus. Chronic autoimmune thyroiditis is the most frequent form of autoimmune thyropathies also in patients with diabetes mellitus. Clinical relevance ot thyroid diseases in patients with DM significantly increases if the thyroid diseases are associated with deteriorated function. Subclinical thyroid dysfunctions are frequent in patients with diabetes mellitus, where belong subclinical hypothyreosis and subclinical hyperthyreosis. Subclinical thyroid dysfunctions in diabetics can lead to higher fluctuations of glycaemias and to deterioration of compensation of diabetes mellitus.
Key words:
diabetes mellitus – mutual relationship – thyreopathies
Autori: Zdenek Schroner 1; Vladimír Uličiansky 2
Pôsobisko autorov: SchronerMED s. r. o., interná a diabetologická ambulancia, Košice 1; Via medica, s. r. o. Košice 2
Vyšlo v časopise: Forum Diab 2014; 3(3): 135-141
Kategória: Hlavná téma
Súhrn
Ochorenia štítnej žľazy postihujú približne 10–15 % diabetikov (pre porovnanie - u nediabetikov sa uvádza výskyt tyreopatií obvykle okolo 6 %). Mechanizmy vzájomnej súvislosti medzi diabetes mellitus (DM) a tyreopatiami sú komplexné a nie sú ešte zďaleka objasnené. Autoimunitné tyreopatie (AIT) sa často vyskytujú u diabetikov 1. typu. V súčasnosti pribúdajú práce, ktoré potvrdzujú zvýšený výskyt autoimunitných tyreopatií aj pri diabetes mellitus 2. typu (DM2T). Z autoimunitných tyreopatií je aj u pacientov s DM najfrekventovanejšia chronická autoimunitná tyreoiditída. Klinická závažnosť tyreopatií u pacientov s DM sa výrazne zvyšuje pri súčasnej poruche funkcie štítnej žľazy. U diabetikov sa často stretávame aj s tzv. subklinickými poruchami tyreoidálnej funkcie, ku ktorým radíme subklinickú hypotyerózu a subklinickú hypertyreózu. Už subklinické poruchy funkcie štítnej žľazy môžu u diabetikov viesť ku kolísaniu glykémií a zhoršeniu kompenzácie diabetu.
Kľúčové slová:
diabetes mellitus – tyreopatie – vzájomná súvislosťÚvod
Ochorenia štítnej žľazy postihujú približne 10–15 % diabetikov (pre porovnanie: u nediabetikov sa uvádza výskyt tyreopatií obvykle okolo 6 %).Výskyt tyreopatií stúpa s vekom, výrazne je ovplyvnený aj pohlavím a typom diabetes mellitus (DM). Muži sú častejšie ohrození eufunkčnou strumou, ženy autoimúnnymi zápalmi. Najvyšší výskyt tyreopatií sa zisťuje u žien s DM 1. typu (DM1T) vzniknutým v dospelosti, kde býva chronická autoimunitná tyreoditída (AITD) diagnostikovaná až u 30–45 % pacientov [1–4]. V súčasnosti pribúdajú práce, ktoré potvrdzujú zvýšený výskyt autoimunitných tyreopatií aj pri DM 2. typu (DM2T) [5]. Z neimunitných tyreopatií sú u diabetikov 2.typu najdôležitejšie ochorenia z nedostatku jódu - hlavne eufunkčná struma. Klinická závažnosť tyreopatií u pacientov s DM sa výrazne zvyšuje pri súčasnej poruche funkcie štítnej žľazy. U diabetikov sa často stretávame aj s tzv. subklinickými poruchami tyreoidálnej funkcie, ku ktorým radíme subklinickú hypotyreózu a subklinickú hypertyreózu. Už subklinické poruchy funkcie štítnej žľazy môžu u diabetikov viesť ku kolísaniu glykémií a zhoršeniu kompenzácie DM [6–8].
Mechanizmy vzájomnej súvislosti medzi diabetes mellitus a tyreopatiami
Postihnutie štítnej žľazy u diabetikov a naopak vznik PGT a DM pri ochoreniach štítnej žľazy je klinicky najdôležitejším problémom vzťahu DM a ostatných endokrinopatií. Mechanizmy vzájomnej súvislosti medzi DM a tyreopatiami sú komplexné a nie sú ešte zďaleka objasnené. DM ani tyreopatie nepredstavujú jednotnú nozologickú jednotku, etiopatogenéza rôznych typov DM aj tyreopatií je odlišná, preto sú nesporne odlišné aj ich vzájomné vzťahy.
Už v minulosti viaceré experimentálne štúdie demonštrovali, že pri nadbytku tyreoidálnych hormónov dochádza k urýchleniu utilizácie glukózy. Zdanlivo logickým následkom by mali byť hypoglykemické stavy pri hypertyreóze, avšak z kliniky je známe, že pri nej prevláda sklon k hyperglykémii a porušenej glukózovej tolerancii. Pri hypotyreóze je krivka orálneho glukózo-tolerančného testu plochá a odozva inzulínu je znížená. Znížená je aj reabsorbcia glukózy z čreva a spomalená je tiež degradácia inzulínu.
Mechanizmy zmien metabolizmu glukózy pri ochoreniach štítnej žľazy sú komplexné a môžeme ich schématicky rozdeliť:
Priame pôsobenie hormónov štítnej žľazy na metabolizmus sacharidov
Tyreoidálne hormóny ovplyvňujú všetky zložky sacharidového metabolizmu. Podľa systémových aspektov delíme vplyv tyreoideálnych hormónov na sacharidový metabolizmus na:
- vplyv na rezorpciu sacharidov
- vplyv na ich metabolizmus v pečeni
- vplyv na ich metabolizmus v periférnych tkanivách.
V experimente malé dávky tyroxínu zvyšujú syntézu glykogénu za prítomnosti inzulínu, zatiaľ čo veľké dávky zvyšujú hepatálnu glykogenolýzu a depléciu glykogénu. Veľké dávky tyroxínu zvyšujú aj glukoneogenézu tým, že zvyšujú dostupnosť prekurzorov ako je laktát a glycerol. Zvyšujú aj intestinálnu resorpciu glukózy a galaktózy.
Pôsobenie hormónov štítnej žľazy
Pôsobenie hormónov štítnej žľazy , tyreostimulačného hormónu (TSH) a tyreoliberínu (TRH) na sekréciu, účinnosť a metabolizmus iných hormónov zasahujúcich do glukoregulácie. Dôležité sú vplyvy na hypotalamické hormóny, hypofyzárne hormóny (predovšetkým rastový hormón), inzulárne hormóny (inzulín, glukagón, somatostatín), hormóny kôry nadobličiek (predovšetkým kortizol), katecholamíny, ostatné hormóny (enterohormóny, parathormón, kalcitonín). Tieto interakcie s ostatnými hormónmi sú značne komplexné a zložité, zasahujú do všetkých oblastí endokrinológie.
Sekundárne podmienené zmeny metabolizmu sacharidov
Sekundárnym vplyvom, ktorý pôsobí na glukoregulačné deje pri tyreopatiách, je zmenený príjem potravy. Pacienti s tyreotoxikózou väčšinou zvyšujú príjem potravy, obzvlášť sacharidov. Pri zvýšenom metabolickom obrate však u nich dochádza často k pocitom hladu. V katabolickej fáze sa pri tyreotoxikóze objavuje malnutrícia a výrazne negatívna dusíková bilancia. Pri hypotyreóze je okrem sklonu k retencii tekutín často tiež sklon k prírastku tukovej masy. Všetky uvedené zmeny ovplyvňujú glukózovú toleranciu. K ďalším sekundárnym vplyvom, ktoré môžu spôsobiť zmeny sacharidového metabolizmu pri tyreopatiách, patria rôzne zmeny iónového a minerálneho zloženia (napr. vplyv zmien hladín kalcia, magnézia na glukoregulačný mechanizmus) [2,8].
Aj keď všetky uvedené vplyvy pôsobia na sacharidový metabolizmus , nie je však dokázané, že by viedli k vzniku klinicky manifestného DM.
Druhou stránkou vzájomných vzťahov DM a tyreopatií sú zmeny metabolizmu tyreoidálnych hormónov a poruchy funkcie štítnej žľazy u diabetikov. Z klinického hľadiska sú dôležité zmeny cirkulujúcich hormónov štítnej žľazy: trijódtyronín (T3), tyroxín (T4) a reverzný trijódtyronín (rT3) u diabetikov. Nedostatočná kompenzácia DM môže viesť ku zmenám T3 a dekompenzácia DM s ketoacidózou vyvolá výraznejšie zmeny t.j. zníženie hladiny T3 a vzostup rT3, čo je spôsobené hlavne zmenami dejodácie T4 predovšetkým v pečeni. Okrem zmien cirkulujúcich hormónov štítnej žľazy pri dekompenzovanom DM sa zistili aj poruchy väzby T3 na jadrové receptory. Uvedené zmeny nie sú prejavom hypotyreózy, ale dôsledkom hypometabolizmu a sú obranným mechanizmom proti metabolickej aktivite T3. Tento stav sa nazýva syndróm nízkeho T3 alebo euthyroid sick syndróm [9]. Klinická závažnosť tohto syndrómu spočíva v jeho negatívnych dôsledkoch na metabolizmus periférnych tkanív. Klesá transport glukózy do buniek, znižuje sa intenzita utilizácie glukózy aj jej ďalšie energetické využitie. Prehlbujú sa tak diabetické zmeny v bunkovej látkovej premene, čo ďalej zhoršuje kompenzáciu DM. Úpravu syndrómu nízkeho T3 nedocielime substitučnou tyreoidálnou liečbou, ale dobrou metabolickou kompenzáciou DM. Veľkým problémom DM2T je nadváha a obezita. Výsledky redukčných režimov sú dlhodobo neuspokojivé. Na tomto stave sa pravdepodobne podieľa vzostup rT3, pokles T3 v dôsledku zníženej aktivity tkanivových dejodáz pri diabetickej poruche metabolizmu [10]. Klinický vzťah DM a tyreopatií nie je však vysvetliteľný iba priamym pôsobením nadbytku alebo nedostatku hormónov štítnej žľazy [11,12].
Rôzne experimentálne, klinické práce a genetické, epidemiologické štúdie dokazujú imunologické a genetické vzťahy medzi DM a tyreopatiami. Pre genetické vzťahy svedčia napr. štúdie jednovaječných dvojčiat, súčasný výskyt DM a tyreopatií v niektorých rodinách a častejší výskyt tyreopatií u príbuzných diabetikov, a naopak DM u príbuzných s tyreopatiami. Vzhľadom k tomu, že mechanizmy dedičnosti DM a tyreopatií nie sú zďaleka objasnené, sú pokusy o definitívny záver ešte predčasné.
V súčasnej dobe je najviac dôkazov o význame genetických faktorov pri autoimunitných chorobách, pričom väčšina v našej populácii sa vyskytujúcich tyreopatií a DM1T sú klasickými orgánovo špecifickými autoimunitnými chorobami. Tak ako pri autoimunitných tyreopatiách aj pri DM1T hrajú významnú úlohu HLA antigény II. triedy, predovšetkým z lokusov DR a DQ. Pritom rizikové a ochranné typy haplotypov sú pri DM1T a pri autoimunitných tyreopatiách podobné, pri chronických tyreoiditídach sa častejšie vyskytuje aj antigén DR3 a DR5 [13]. Santamariaet al udávajú, že nosičstvo HLA DQB1 predisponuje pri DM1T k tyreoidálnej autoimunite [14]. Avšak pri vzniku autoimunitných tyreopatií aj DM1T hrajú pravdepodobne úlohu aj gény mimo HLA systému [13–16].
Tab. ukazuje imunogenetickú predispozíciu niektorých génov (daná odds ratio – OR) pre DM1T a AITD.
Tab. 1. Imunogenetická predispozícia niektorých génov pre DM1T a AITD 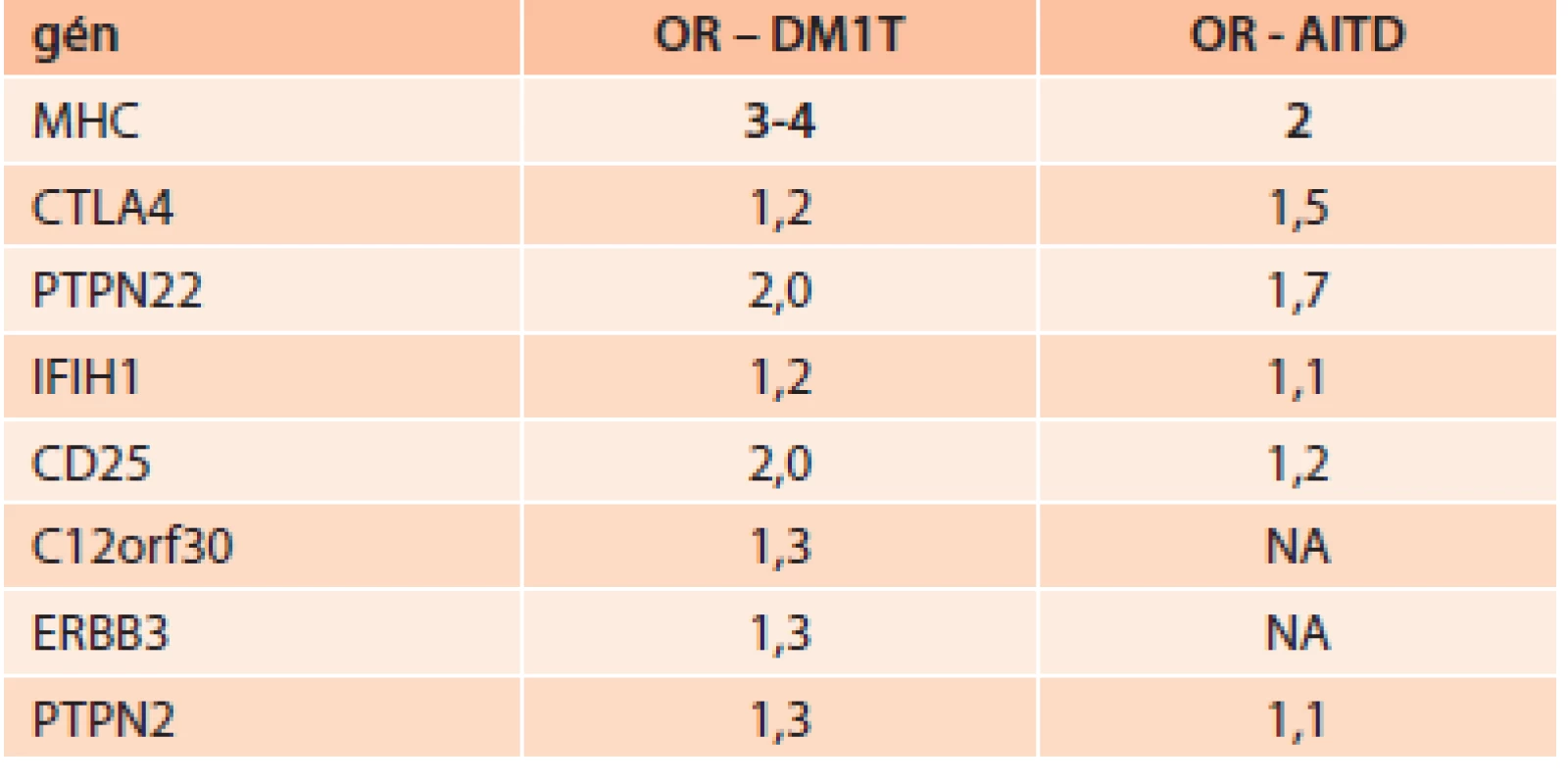
AITD – chronická autoimunitná tyreoiditída DM1T – diabetes mellitus 1. typu OR – odds ratio NA – bez asociácie V súčasnosti pribúdajú práce, ktoré potvrdzujú zvýšený výskyt autoimunitných tyreopatií aj pri DM2T [17]. Príčina zvýšeného výskytu chronickej autoimunitnej tyreoiditídy (AITD) pri DM2T nie je známa. Diskutovaná je otázka genetických vzťahov medzi DM2T a tyreopatiami. Genetická podstata vzťahu medzi DM2T a ochoreniami štítnej žľazy sa v súčasnosti hľadá napr. v polymorfizmoch génov dejodináz. Typ II dejodinázy je kľúčovým enzýmom pre tvorbu intracelulárneho T3 [18]. U nediabetikov s polymorfizmom dejodinázy II (DII) Thr92Ala bolo pozorované až o 20 % znížené vstrebávanie glukózy. Navyše Ala alela u homozygótov bola asociovaná s vyššou inzulínovou rezistenciou (IR) u diabetikov 2. typu a zníženou aktivitou DII v tkanivách, čo bolo preukázané aj tkanivovými biopsiami z priečne pruhovaných svalov [19]. Predpokladá sa, že nižšie hladiny intracelulárneho T3, ktoré sú dôsledkom práve tohto polymorfizmu, môžu vyvolať stav relatívnej intracelulárnej hypotyreózy, pri ktorej klesá intenzita transportéra GLUT4, čo podporuje vznik a nárast IR [20]. Mentuccia et al dokázali, že u Indiánov z kmeňa PIMA, u ktorých je veľmi vysoká prevalencia IR a DM2T, je zvýšený výskyt homozygócie Ala92Ala [21]. Kolektív brazílskych vedcov dokázal, že, Ala/Ala genotyp DII je asociovaný so zvýšeným rizikom vzniku DM2T [22]. Veľmi sľubná sa zdá byť tiež asociácia medzi polymorfizmami génov pre kódovanie dejodináz a polymorfizmami génu pre aktivátory receptorov aktivujúcich proliferáciu peroxizómov (peroxisome proliferator-activated receptor – PPAR) (najmä vzájomný vzťah polymorfizmov DII-Thr92Ala a PPARγ2-Pro12Ala [23]. PPAR sú skupinou jadrových receptorov, ktorých úlohou je transkripcia faktorov regulujúcich expresiu génov. PPAR sa podieľajú tiež na regulácii diferenciácie adipocytov a sú súčasťou intracelulárnej signálnej kaskády inzulínu. Poznáme tri základné typy PPAR(α,β,γ). A práve skupina orálnych antidiabetík tiazolidíndióny sú selektívnymi agonistami nukleárnych receptorov PPARg.
Z faktorov vonkajšieho prostredia, ktoré by mohli vysvetľovať vzťah medzi DM2T a tyreopatiami, by to mohli byť infekcie a stres. Pozornosť sa obracia aj na psychický stres, a to obzvlášť na jeho chronickú formu.
Riziko tyreopatií u diabetikov zvyšuje aj jodopénia, ktorá podľa súčasných názorov je u diabetikov častá. Mechanizmus nie je ešte presne objasnený. Uplatňujú sa tu zvýšené straty jódu močom a aj niektoré diétne vplyvy. Z diétnych vplyvov je to predovšetkým obmedzenie príjmu soli (ktorá je u nás hlavným zdrojom jódu). Diabetici hlavne 2. typu majú znížený príjem soli odporúčaný pre súčasne často prítomné kardiovaskulárne ochorenia.
Diabetes mellitus a autoimunitné tyreopatie
Najčastejšie sa vyskytujúcim ochorením štítnej žľazy u diabetikov sú autoimunitné tyreopatie [24]. Z autoimunitných tyreopatií je najfrekventovanejšia AITD. AITD ohrozuje klinický stav diabetika hlavne nepriamo cez vzniknuté poruchy funkcie štítnej žľazy. AITD je najčastejšou príčinou hypotyreózy nielen u diabetikov. Pre klinický priebeh DM so súčasne prítomnou AITD je tiež významné, že u takýchto pacientov dochádza v porovnaní s diabetikmi bez AITD k podstatne rýchlejšiemu zániku vlastnej sekrécie inzulínu. DM1T s autoimunitnou tyreopatiou je charakterizovaný pretrvávajúcou humorálnou reaktivitou proti Langerhansovým ostrovčekom, hlavne proti dekarboxyláze kyseliny glutámovej (GAD) [25]. Výskyt AITD je typicky viazaný na DM1T a ženské pohlavie (pomer muži : ženy = 1 : 3–5) [26–28]. Zamrazil et al udávajú , že tiež údaje v rodinnej anamnéze môžu svedčať o zvýšenom riziku výskytu tyreopatií u pacientov s DM. Je to predovšetkým nahromadenie autoimunitných a alergických ochorení, obzvlášť tyreopatií u pokrvných príbuzných. Výskyt AITD sa výrazne zvyšuje s vekom, v ktorom sa manifestuje DM. Holl et al, Roldan et al nachádzajú AITD u diabetikov 1. typu v predškolskom veku do 5 % pacientov, pri manifestácii DM1T v adolescencii medzi 15–25 %. Výskyt AITD pri manifestácii DM1T v dospelosti je udávaný medzi 20–51 %. Údaje v svetovej literatúre o výskyte AITD u pacientov s DM1T – podtyp LADA sa však vzájomne dosť líšia, čo môže byť spôsobené etnickými a regionálnymi rozdielmi [29]. Pre porovnanie, epidemiologické údaje u nediabetikov založené na veľmi senzitívnych metódach uvádzajú prevalenciu AITD v rozmedzí 1–5 % u mužov a 10–24 % u žien. DM1T s autoimunitnou tyreopatiou je charakterizovaný pretrvávajúcou humorálnou reaktivitou proti Langerhansovým ostrovčekom, hlavne proti dekarboxyláze kyseliny glutámovej [30–32].
O výskyte tyreopatií pri DM2T je v literatúre oveľa menej údajov. Pribúdajú však práce, ktoré potvrdzujú zvýšený výskyt AITD aj pri DM2T. Krejčí et al v skupine 83 diabetikov 2. typu stanovili diagnózu AITD u 27 % pacientov [33].
Klinicky najčastejšou formou AITD u diabetikov je tzv. Hashimotova tyreoiditída [34,35]. V klinickom obraze Hashimotovej tyreoiditídy nachádzame strumu, ktorá je častejšie nodózna ako difúzna. Struma môže byť citlivá, málokedy však bolestivá. Pri palpačnom vyšetrení v typickom prípade nájdeme tuhú, nebolestivú, malú strumu. Nakoľko pri chronickom zápale sa tkanivo žľazy stáva tuhším, štítna žľaza môže byť hmatateľná aj pri jej nezväčšenom objeme. Typická je prítomnosť autoprotilátok proti štítnej žľaze (hlavne opakovaná pozitivita protilátok proti tyreoidálnej peroxidáze). Významné miesto v diagnostike AITD patrí ultrasonografickému (USG) vyšetreniu štítnej žľazy. Pri USG vyšetrení štítnej žľazy typicky nachádzame u pacientov s Hashimotovou tyreoiditídou zníženie echogenity. USG-vyšetrenie preukazuje zápalové prejavy väčšinou fokálneho rozsahu, pre pokročilé štádiá je charakteristické difúzne postihnutie. Echoštruktúra je zvyčajne nehomogénna. Objem parenchýmu môže byť zväčšený ale aj nezmenený. Vo väčšine prípadov stačí k stanoveniu diagnózy AITD okrem klinického obrazu opakovane zistená pozitivita protilátok proti štítnej žľaze a typický nález pri USG-vyšetrení. Len v prípade diferenciálne-diagnostických rozpakov o biologickej povahe zistených ložiskových zmien je indikované cytologické vyšetrenie vzorky získanej biopsiou tenkou ihlou [26,27].
Pri Hashimotovej tyreoiditíde býva funkcia štítnej žľazy spočiatku normálna. Zriedkavo sa, avšak len v počiatočných fázach, Hashimotova tyreoiditída prejaví hypertyreózou, ktorá je vyvolaná stimulujúcimi protilátkami proti TSH receptorom. Neskôr (v rôznom veku a nie u všetkých pacientov) spolu s likvidáciou funkčného tkaniva autoimunitným procesom sa postupne vyvíja obraz hypotyreózy. Dôležité je, že sonografické prejavy autoimunitného zápalu v štítnej žľaze a vývoj hypofunkcie môžu u určitého percenta pacientov predchádzať dôkazu pozitivity protilátok proti štítnej žľaze. Asi až u 20 % pacientov sa zápal rozpozná až vo fáze hypotyreózy [36,37].
U diabetikov sa stretávame aj s inou variantou AITD tzv. atrofickou formou chronickej autoimunitnej tyreoiditídy. Podľa Vondru et al je väčšia klinická závažnosť tejto formy daná tým, že na rozdiel od Hashimotovej tyreoiditídy podstatne rýchlejšie vedie k hypotyreóze. Typicky sa táto forma AITD manifestuje v prvých rokoch po stanovení diagnózy DM1T (maximum medzi 1.–5. rokom). Pre diabetikov s prítomnou atrofickou formou AITD je typická pozitívna rodinná anamnéza tyreopatií. Klinický priebeh atrofickej formy chronickej autoimunitnej tyreoiditídy sa v typickom prípade vyznačuje negatívnym palpačným nálezom na krku a chýbaním ďalších lokálnych príznakov. Až rozvíjajúca sa hypotyreóza núti ošetrujúceho lekára hľadať príčinu zvýšenej lability DM, tendencie k hypoglykémiám, zhoršovaniu lipidogramu. Odhalenie hypotyreózy ako dôvodu zhoršovania klinického obrazu DM môže byť ale v tejto fáze obtiažne, pre často len nešpecifickú povahu celkových príznakov imitujúcich prejavy iných ochorení alebo sénia. Pri tejto forme tyreoiditídy je typická opakovaná pozitivita nielen protilátok proti tyreoperoxidáze ale aj proti tyreoglobulínu. V pokročilých, resp. terminálnych štádiách atrofickej formy AITD nemusia byť špecifické tyreoidálne protilátky už prítomné. Sonografické vyšetrenie dokazuje vo včasných štádiách difúzne hypoechogénny a nehomogénny parenchým, v ďalšom priebehu obvykle fibrózu (v terminálnych štádiách môže štítna žľaza aj chýbať) [38,39].
Medzi autoimunitné tyreopatie patrí tiež Gravesova - Basedowova choroba, ktorá je najčastejšou príčinou hypertyreózy hlavne u mladších diabetikov, a to predovšetkým dievčat a žien s DM1T. Je obzvlášť obávanou komplikáciou v popôrodnom období. U mladších diabetikov sú zvyčajne prítomné plne rozvinuté príznaky tyreotoxikózy. Diagnózu potvrdíme nálezom vysokých hodnôt voľných frakcií tyroxínu a trijodtyronínu, prítomné sú suprimované hodnoty TSH, pozitívne sú protilátky proti TSH receptoru (TRAK). Sonograficky sú okrem zníženej echogenity aj známky zvýšeného prietoku v štítnej žľaze (zisťované dopplerovským vyšetrením). Avšak prítomnosť uzlov v štítnej žľaze autoimunitný pôvod tyreotoxikózy nevylučuje. Kalman et al dokázali, že u diabetikov s Gravesovou-Basedowovou chorobou je vyšší výskyt endokrinnej oftalmopatie a postihnutia nervus opticus, poruchy vízu majú horšiu prognózu [40].
Osobitnú pozornosť treba venovať diagnostike autoimunitných tyreopatií u gravidných diabetičiek. Autoimunitné tyreopatie majú nepriaznivý vplyv na kompenzáciu DM počas tehotenstva aj po pôrode [41]. Cielené vyšetrenie tyreoidálnych protilátok v prekoncepčnom období dokazuje cca u 30–40 % diabetičiek pozitivitu protilátok proti peroxidáze (antiTPO). Behom tehotenstva titer potilátok obvykle klesá, ale prudko sa opäť zvýši po pôrode. Vondra et al zistili u diabetičiek s pozitívnym titrom antiTPO horšiu kompenzáciu DM počas tehotenstva, obvzlášť v II. a III. trimestri a vo včasnom popôrodnom období. Napriek vyššej spotrebe inzulínu zistili v tomto období vyššie hodnoty glykovaného hemoglobínu. Presný mechanizmus pôsobenia nie je známy, môže sa jednať o súčasne prítomnú subklinickú hypotyreózu, ale aj priamy vplyv protilátok. U pacientiek s pozitívnymi antiTPO protilátkami je tiež nepriaznivo ovplyvnený vývoj plodu. Bol dokázaný častejší výskyt spontánnych potratov, predčasných pôrodov aj prenášania u tehotných diabetičiek. Zvýšený titer tyreoidálnych protilátok pred a na začiatku gravidity je spojený s výrazne vyšším rizikom porúch funkcie štítnej žľazy počas tehotenstva a obzvlášť po pôrode. Prítomnosť pozitivity antiTPO protilátok je tiež rizikovým faktorom pre vznik popôrodnej tyreoiditídy. Stanovenie TSH a tyreoidálnych protilátok by malo byť prevedené u každej diabetičky 1. typu, ktorá plánuje koncepciu [41–44].
Diabetes mellitus a poruchy funkcie štítnej žľazy
Diabetes mellitus a hypotyreóza
Prevalencia subklinickej a manifestnej formy hypotyreózy je spolu v detskej a adolescentnej diabetickej populácii popisovaná medzi 5–15 %, v dospelosti dosahuje až 24 %. U žien je až 7-krát častejšia, výrazný je vzostup vo vyššom veku. Pre porovnanie, u nediabetikov je prevalencia hypotyreózy v závislosti na veku a pohlaví 3–21 %. Subklinická hypotyreóza je obvykle definovaná ako stav, v ktorom hodnota ultrasenzitívneho TSH (usTSH) je v rozmedzí 5–10 mIU/l pri ešte normálnych hodnotách tyreoidálnych hormónov [45]. Manifestná hypotyreóza je charakterizovaná vysokými hodnotami TSH a nízkymi hodnotami voľného T4 a T3. Nerozpoznaná hypotyreóza je príčinou neuspokojivej kompenzácie DM a vedie k častým, protrahovaným hypoglykémiám [12]. Hypotyreóza u diabetikov urýchľuje tiež rozvoj dlhodobých, predovšetkým makroangiopatických komplikácií. V dôsledku oneskorenej a nedostatočnej reakcie kontraregulačných hormónov a zníženej odpovede glykogenolýzy a predovšetkým glukoneogenézy je korekcia hypoglykémií u hypotyreóznych diabetikov výrazne znížená a oneskorená. Zhoršenie psychomotorických funkcií v dôsledku hypotyreózy a hypoglykémie sa môžu nepriaznivo prejaviť v situáciách, k riešeniu ktorých je nutná rýchla reakcia a rozhodovanie (napr. riadenie motorových vozidiel) . Pri hypotyreóze je znížená tiež účinnosť inzulínu v dôsledku poklesu transportu glukózy do buniek a jej ďalšej intracelulárnej metabolizácie. Pokles účinnosti inzulínu pri zníženej činnosti štítnej žľazy môže viesť k protrahovaným postprandiálnym hyperglykémiam. Hypotyreóza tiež výrazne zhoršuje lipidogram. Komplexný vplyv hypotyreózy na metabolizmus glukózy ukazuje schéma 1.
Schéma 1. Hypotyreóza a metabolizmus glukózy 
Mohn et al vo svojej práci zistili, že subklinická hypotyreóza u diabetikov 1. typu je spojená so zvýšeným rizikom symptomatických hypoglykémií, a preto na základe zistených výsledkov autori navrhujú začať so substitučnou liečbou hormónmi štítnej žľazy hneď pri jej diagnostikovaní [46,48]. Hak et al v svojej práci dokázali, že už subklinická hypotyreóza negatívne ovplyvňuje lipidový metabolizmus a je nezávislým rizikovým faktorom pre vznik infarktu myokardu. Tento vplyv je u diabetikov závažnejší než u nediabetikov, obzvlášť vo vyššom veku [48]. Bakker et al vo svojej práci našli pozitívnu asociáciu medzi TSH a LDL-cholesterolom u jedincov s inzulínovou rezistenciou. Teda TSH postihuje tento dôležitý kardiovaskulárny rizikový faktor, akým nesporne LDL-cholesterol je, ešte viac u pacientov, ktorí pre súčasne prítomnú inzulínovú rezistenciu už majú vysoké kardiovaskulárne riziko. Podľa autorov teda vysokorizikoví pacienti s inzulínovou rezistenciou by mali byť liečení hormónmi štítnej žľazy už vo fáze subklinickej hypotyreózy s cieľom dosiahnuť TSH na dolnej hranici fyziologického rozmedzia [49].
Diabetes mellitus a hypertyreóza
Hypertyreóza sa vyskytuje u diabetikov menej často ako hypotyreóza. Jej prevalencia bez rozlíšenia subklinickej a manifestnej formy a bez bližšej klasifikácie DM sa udáva medzi 1–3 %, pri DM1T je referovaný výskyt až medzi 8–10 % [50]. Pre porovnanie, v nediabetickej populácii je výskyt hypertyreózy okolo 2 %. Subklinická hypertyreóza je stav charakterizovaný supresiou TSH a normálnymi hladinami tyreoidálnych hormónov. Pre manifestnú hypertyreózu je typický nález nízkej hladiny TSH a zvýšenej hladiny tyreoidálnych hormónov. U mladších diabetikov, a to predovšetkým dievčat a žien s DM1T, je najčatejšou príčinou hypertyreózy Graves - Basedowova choroba [40]. U starších diabetikov hypertyreózy mávajú často neautoimunitný pôvod. Tu sa obvykle stretávame s oligosymptomatickým priebehom hypertyreózy. Môže sa prejavovať iba subkompenzáciou diabetu, kardiovaskulárnou symptomatológiou (napr. fibriláciou predsiení, obehovou nedostatočnosťou), niekedy prevláda obraz porušenej funkcie centrálneho nervového systému so stavmi zmätenosti, niekedy imitujúce až psychózu. Veľmi obávanou príčinou tyreotoxikózy u diabetikov je jej iatrogénne navodenie, a to aplikáciou kontrastnej látky pri angiografii a iných diagnostických výkonoch. Diabetici sú často liečení pre rôzne poruchy srdcového rytmu antiarytmikom amiodaronom. V klinickej praxi treba myslieť na pomerne častý nepriaznivý vplyv amiodaronu na štítnu žľazu. Veľmi obávanou komplikáciou pri liečbe amiodaronom je predovšetkým tzv. amiodaronová tyreotoxikóza, ktorá môže až ohroziť život pacienta. Rozlišujeme dva typy tyreotoxikózy po amiodarone. I. typ sa objavuje u pacientov už s predtým poškodenou štítnou žľazou. II. typ sa vyskytuje u pacientov s predtým neporušenou štítnou žľazou. Tento typ je vyvolaný vyplavovaním tyreoidálnych hormónov z deštruovanej štítnej žľazy [51].
Pri hyperfunkcii štítnej žľazy u diabetikov je vysoká aktivita pečeňovej glukoneogenézy. Vysoká endogénna produkcia glukózy si obvykle vynúti zvyšovanie dávok inzulínu alebo aktívnejšiu liečbu. Charakteristické pre porušenú glukoreguláciu pri tyreotoxikóze sú vysoké hladiny glukagónu, ktoré len málo reagujú na zvýšenie glykémie a inzulínu. Na vzniku postprandiálnej hyperglykémie sa podieľa aj zrýchlená žalúdočná evakuácia a resorpcia živín v tráviacom trakte pri hypertyreóze. Dôsledkom poruchy sekrécie aj účinku inzulínu a ďalších glukoregulačných hormónov a zvýšenej oxidácie lipidov pri neliečenej tyreotoxikóze u diabetika je ťažko ovplyvniteľná akcentovaná ketogenéza [52]. Z klinického hľadiska je závažnosť aktívnej hypertyreózy daná okrem vplyvu na kompenzáciu DM predovšetkým vo zvýšenom výskyte rôznych porúch srdcového rytmu. Komplexný vplyv hypertyreózy na metabolizmus glukózy je uvedený v schéme 2.
Schéma 2. Hypertyreóza a metabolizmus glukózy 
Záverečné odporúčanie
Aj keď v súčasnosti neexistujú definitívne závery ako postupovať pri podozrení na tyreopatie u pacientov s DM, aj podľa našich výsledkov je plne odôvodnené odporúčanie vyšetrovať 1-krát ročne protilátky proti štítnej žľaze a hladinu TSH u diabetikov 1. typu s cieľom zachytiť čo najskôr laboratórne prejavy tyreoidálnej autoimunity aj eventuálne rozvíjajúcu sa funkčnú poruchu [53]. Výsledky viacerých prác potvrdzujú, že u diabetikov 2. typu je vhodné vyšetrovať TSH v čase stanovenia diagnózy DM2T a potom najmenej 1-krát za 5 rokov [54].
doc. MUDr. Zbynek Schroner, PhD.
zbynek.schroner@gmail.com
SchronerMED s.r.o., interná a diabetologická ambulancia, Košice
MUDr. Vladimír Uličiansky
Doručené do redakcie 1. 9. 2014
Prijaté do tlače po recenzii 30. 9. 2014
Zdroje
1. Volzke H, Kroh U, Wallascchofski H et al. The spectrum of thyroid disorders in adult type 1 diabetes mellitus. Diabetes Metab Res Rev 2007; 23(3): 227–233.
2. Vondra K, Zamarazil V. Onemocnění štítné žlázy u dospělých diabetiků. In: Perušičová J. Trendy soudobé diabetologie. Svazek 9. Galén: Praha 2004. 31–48. ISBN 8072622919.
3. Vondra K, Vrbíková J, Ivašková E et al. Výskyt protilátek proti tyreoglobulínu a proti mikrozomům u dospělých diabetiků 1. typu a jejich možný klinický význam. Vnitř Lék 1996; 42(11): 767–771.
4. Vondra K, Vrbíková J, Šterzl I. Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování. Vnitř Lék 2006; 52(10): 864 - 872.
5. Mentucia D. Association between a novel variant of the human type 2 deiodinase gene Thr92Ala and insulin resistance: evidence of interaction with the Trp64Arg variant of the beta-adrenergic receptor. Diabetes 2002, 51(3): 880–883.
6. Límanová Z. Choroby štítné žlázy. In: Klener P et al. Vnitřní lékařství. 2nd ed. Galén: Praha 2001. 763–777. ISBN 8072621017.
7. Perros P, McCrimon RJ, Shaw G et al. Frequency of thyroid dysfunction in diabetic patients: value of annual screening. Diabet Med 1995; 12(7): 622–627.
8. Zamrazil V, Vondra K. Štítná žľáza a diabetes. In: Bartoš V, Pelikánová T. Praktická diabetologie.4th ed. Maxdorf: Praha 2010. 625–640. ISBN 978–80–7345–216–2.
9. Tahirovic H, Ducic V et.al. Euthyroid sick syndrome in type I diabetes mellitus in children and adolescents. Acta Paedr Hung 1991; 31(1): 67–73.
10. Krotkiewski M. Thyroid hormones and treatment of obesity. Int J Obes Relat Metab Disord 2000, 24(Suppl 2): 116–119.
11. Vondra K, Zamrazil V. Endokrinní systém a diabetes mellitus. In: Blahoš J, Zamrazil V. Endokrinologie interdisciplinární obor. Triton: Praha 2006 : 353–366. ISBN 80–7254–788–7.
12. Žákovičová E, Zamrazil V jr. Vliv endokrinních onemocnení na kompenzaci diabetes mellitus, sekundární diabetes melitus. Postgaduální medicína 2009; 4(11): 446–450.
13. Pearce SHS, Merriman TR. Genetics of type 1 diabetes and autoimmune thyroid disease. Endocrinol Metab Clin N Am 2009; 38(2): 289–301.
14. Santamaria P, Barbosa JJ, Lindstrom AL et al. HLA DQB1-associated susceptiblity that distinguishes Hashimoto`s disease in type 1 diabetic patients. J Clin Endocrinol Metab 1994; 78(4): 878–883.
15. Donner H, Rau H, Walfish PG et al. CTLA 4 alanine –17 confers genetic susceptiblity to Graves´disease and type 1. diabetes mellitus. J Clin Endocrinol Metab 1997; 82(1): 143–146.
16. Vaidya B, Paarce S. The emerging role of CTLA-4 gene in autoimmune endocrinopathies. Eur J Endocrinol 2004; 150(5): 619–626.
17. Diez JJ, Sanchez P, Iglesias P. Prevalence of thyroid dysfunction in patiens with type 2 diabetes. Exp Clin Endocrinol Diabetes 2011; 119(4): 201–207.
18. Bianco AC, Kim BW. Deiodinases:implications of the local control of thyroid hormone action. J Clin Invest 2006; 16(10): 2571–2579.
19. Canani LH. The type 2 deiodinase A/G (Thr92Ala) polymorphism is associated with decreased velocity and increased resitance in patiensts with type 2 diabetes mellitus. J Clin Endocrinol Metab 2005; 90(6): 3472–3478.
20. Lambadiari V, Mitoru P, Maratou E et al. Thyroid hormones are positively associated with insulin resistance early in the development of type 2 diabetes. Endocrine 2011; 39(1): 28–32.
21. Mentucia D. Association between a novel variant of the human type 2 deiodinase gene Thr92Ala and insulin resistance:evidence of interaction with the Trp64Arg variant of the beta-adrenergic receptor. Diabetes 2002; 51(3): 880–883.
22. Dora JM, Machado WE, Rheinheimer J et al. Association of the type 2 deiodinase Thr92ALA polymorphis with the type 2 diabetes: case control study and meta-analysis. Europ J Endocrinol 2010; 163(3): 427–434.
23. Estivalet A. DII Thr92Ala and PPARγ 2 Pro12Ala polymorhism interact in the modulation of insulin resistance in type 2 diabetic patients. Obesity (Silver Spring) 2011; 19(4): 825–832.
24. Kiňová S, Payer J, Kalafutová I et al. Výskyt autoimunitnej tyreopatie u pacientov s diabetes mellitus 1. typu. Bratisl Lek Listy 1998; 99(1): 23–25.
25. Akawaza S, Kawasaki E et.al. Autoantibodies to glutamic acid decarboxylase (GAD), 64,000-Mr islet cell protein (64K) antibodies and islet cell antibodies (ICA) in insulin–dependent diabetes mellitus with and without autoimmune disease in Japan. Diabetes Res Clin Pract 1994; 24(Suppl): S89 - S93.
26. Límanová Z, Jiskra J. Autoimunitní tyreopatie-královna endokrinných syndromu. DMEV 2004; 7(Suppl2): 32–35.
27. Límanová Z, Němec J, Zamrazil V. Nemoci štítné žlázy. Galén: Praha 1995. ISBN 80–85824–25–6.
28. Límanová Z, Zamarazil V. Má být zaveden screening funkčních tyreoidálnych onemocnění u dospělých v České republice? DMEV 2004; 7 : 124–129.
29. Anděl M, Kraml P, Potočková J et al. The differences between type 2. and LADA (Type 1.) diabetic patients of same age. Diabetes Res Clin Pract 2000; 50(Suppl 1): 113.
30. Běhanová-Matějková M. Latent autoimmune diabetes in adults (LADA) and autoimmune thyroiditis. Endocr Regul 2001; 35(3): 167–172.
31. Běhanová-Matějková M, Zamrazil V et al. Middle aged Onset type 1 diabetes: differences among individuals with and without autoimmune thyroiditis. Diabetologia 2000; 43(Suppl 1): A110.
32. Kawasaki E, Takino H et.al. Autoantibodies to glutamic acid decarboxylase in patients with IDDM and autoimmune thyroid disease. Diabetes 1994; 43(1): 80–86.
33. Krejčí H, Perušičová J. Autoimunitní tyreopatie u diabetes mellitus 1. a 2. typu. DMEV 2004; 7(3). Abstr 164.
34. McCanlies E, Oleary LA, Foley TF et al. Hashimoto´s thyroiditis and insulin dependent diabetes mellitus: differences among individuals with and without abnormal thyroid function. J Clin Endocrinol Metab 1998; 83(5): 1548–1551.
35. Dorman J, Kramer MK, O‘Lear LA et al. Molecular epidemiology of autoimmune thyroid disease. Gac Med Mex 1997; 133(Suppl 1): 97–103.
36. Wartofsky. Diseases of the Thyroid. In: Fauci AS. et al. Harrison´s Principles of Internal Medicine 14th edition. 2012–2035. McGraw-Hill: 1997. ISBN 13 : 978–0070202924.
37. Wilson JD et al. William´s textbook of endocrinology. 9th ed. W.B. Saunders: 1998. ISBN 978–0721661520.
38. Vondra K, Zamarazil V. Onemocnění štítné žlázy u nemocných s diabetes mellitus. DMEV 2002; 5(2): 78–84.
39. Vrbíková J, Vondra K, Matys Z. Autoimunitní orgánově specifická oněmocnení u pacientu s autoimunitním diabetem mellitem. In: Stárka L et al. Aktuální endokrinologie. Maxdorf: Praha 1999. 634–639. ISBN 9788085912104.
40. Kalmann R, Mourits MP. Diabetes mellitus: a risk factor in patients with Graves orbithopathy. Br J Ophthalmol 1999; 83(4): 463–465.
41. Dvořáková M, Němec J. Poruchy štítné žlázy, těhotenství a vývoj plodu. In: Stárka L et al. Aktuální endokrinologie. Maxdorf: Praha 1999 : 405–415. ISBN 9788085912104.
42. Fernadez-Soto L, Gonzales A, Lobon et al. Thyroid peroxidase autoantibodies predict poor metabolic control and need for thyroid treatment in pregnant IDDM women. Diabetes Care 1997; 20(10): 1524–1528.
43. Hauerová D, Pikner R et al. Tyreopatie u těhotných žen a jejich vývoj po porodu. Vnitř Lék 2002; 48(11): 1060–1064.
44. Hauerová D, Topolčan O et al. Poruchy štítné žlázy v gravidite a jejich léčba. DMEV 2003; 6(4): 200–203.
45. Drbalová K, Herdová K, Pačesová M et al. Subklinické tyreopatie. Vnitř Lék 2006; 52(10): 963 - 968.
46. Ayala A, Wartofsky L. Minimally symptomatic (subclinical) hypothyroidism. The Endocrinologist 1997; 7 : 44–50.
47. Mohn A, Di-Michelle S et al. The effect of subclinical hypothyroidism on metabolic control in children and adolescents with type 1 diabetes mellitus. Diabet Med 2002; 19(1): 70–73.
48. Hak AE, Pols HAP et al. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: The Rotterdam Study. Ann Int Med 2000; 132(4): 270–278.
49. Bakker SJ, ter Maaten JC, Popp-Snijders C et al. The relationship between thyrotropin and low density lipoprotein cholesterol is modified by insulin sensitivity in healthy euthyroid subjects. J Clin Endocrinol Metab 2001; 86(3): 1206–1211.
50. Komiya I, Takasu N, Yamada T et al. Studies on the association of NIDDM in Japanese patients with hyperthyroid Grave`s disease. Horm Res 1992; 38(5–6): 264–268.
51. Zamrazil V, Němec J. Vliv amiodaronu na štítnou žlázu. In: Stárka L et.al. Aktuální endokrinologie. Maxdorf: Praha 1999 : 415–424. ISBN 80–85912–10–4.
52. Paul DT, Mollah FH et al. Glycemic status in hyperthyroid subjects. Mymensingh Med J 2004; 13(1): 71–75.
53. Schroner Z, Lazúrová I, Petrovičová J. Autoimuniutné tyreopatie u diabetikov. Vnitř lek 2006; 52(2): 137–143.
54. Ober K. Polyendocrine syndromes. In: Leahy J, Clark N, Cafalu W. Medical Management of Diabetes Mellitus. Marcel Dekker, New York 2000 : 699–717.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek EditorialČlánek Metabolický syndróm a pečeň
Článok vyšiel v časopiseForum Diabetologicum
Najčítanejšie tento týždeň
2014 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Editorial
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
- Diabetes mellitus a ochorenia štítnej žľazy
- Vitamín D a metabolický syndróm u žien so syndrómom polycystických ovárií
- Metabolický syndróm a pečeň
-
Účinnosť a znášanlivosť vildagliptínu ako lieku druhej voľby v porovnaní s inými perorálnymi antidiabetikami pri diabetes mellitus 2. typu
Celosvetová observačná štúdia v podmienkach reálnej klinickej praxe (EDGE – výsledky subanalýzy pacientov zaradených na Slovensku) - Asociácia srdcového zlyhávania Európskej kardiologickej spoločnosti
- Montpellierska lekárska škola
- Autodidaktický test hodnotený kreditmi SACCME
- Register kľúčových slov, autorov a lektorov
- Forum Diabetologicum
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diabetes mellitus a ochorenia štítnej žľazy
- Metabolický syndróm a pečeň
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



