-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neinvazívne meranie dĺžky bunkového cyklu v prvých dňoch embryonálneho vývoja - objektívne merateľný ukazovateľ životaschopnosti ľudských embryí
Non-invasive monitoring of the timing of early embryo cleavages – objectively measurable predictor of human embryo viability
Objective:
The evaluation of the developmental abilities of human embryos according to the timing of their early mitotic cleavages.Design:
Retrospective study.Setting:
Prague Fertility Centre and Institute for Care of Mother and Child, CAR, Prague.Methods:
The embryos obtained in IVF program were used for further observations and subjected to automated time-lapse monitoring (PrimoVision, Cryo-Innovation, 1 picture/10 min, intermittent white-light illumination) under standard cultivation conditions (37.0 °C, 5% CO2 in humid air). Image sequences were digitally recorded for later use. For intravital spindle detection we used polaryzing microscopy (Oosight, Research Instruments) and Hoechst 33342 fluorescent dye for intravital chromatin visualization. A total number of 180 human embryos which gave a vital pregnancies (FHB, fetal heart beat) were analysed retrospectively for timing of early cleavages. In our study, the exact timing of the four interphases (IP) and synchrony of sister cell divisions (ID, interval division) occurring after fertilization were identified and manually recorded. Interphases: IP1 was defined as the period from fertilization till 2 cell stage. IP2 between 2 and 3 cells stages, IP3 between 3 and 5 and IP4 between 5 and 9 cells embryo.Interval division:
ID2 was recorded as a time interval between 3 and 4 cells, ID3 between 5 and 8 cells and ID4 between 9 and 16 cells stage embryos.Results:
In the embryos giving viable pregnancies, the durations of IP1 was 20–26 hrs. IP2 was 10–12 hrs, IP3 was 14-16 hrs and IP4 was 20–26 hrs. In these embryos, the sister blastomeres cleaved in a very synchronous manner. The duration of ID1 was recorded to varry from 120 to 210 min. ID2 from 20 to 60 min., ID3 from 120 to 240 min. and ID4 from 230 to 360 min.Conclusion:
The viable embryos cleave in a very similar time pattern which can be defined and applied as referencial value. Non-invasive monitoring of the timing of early embryo cleavages can be used as an objectively measurable predictor of human embryo.Key words:
noninvasive embryo imaging, time-lapse in human embryos, cell cycle analysis, embryo selection criteria.
Autoři: D. Hlinka 1; S. Lazarovská 1; J. Rutarová 2; M. Pichlerová 1; J. Řezáčová 2; M. Dudáš 3
Působiště autorů: Prague Fertility Centre, Praha 1; Ústav pro péči o matku a dítě, CAR, Praha 2; Univerzita P. J. Šafárika, Institute of Biology and Ecology, Košice 3
Vyšlo v časopise: Ceska Gynekol 2012; 77(1): 52-57
Kategorie: Původní práce
Souhrn
Cieľ:
Posúdenie vývojových schopností ľudských embryí na základe časového priebehu prvých bunkových delení.Typ štúdie:
Retrospektívna analýza.Názov a sídlo pracoviska:
Prague Fertility Centre a Ústav pro péči o matku a dítě, CAR, Praha.Metodika:
Vývoj embryí z IVF programu bol monitorovaný za použitia time-lapse (PrimoVision, Cryo-Innovation, 1 obr./10 min, intermittent white-light illumination) v štandardných kultivačných podmienkach (37,0 °C, 5 % CO2 vo vlhkom vzduchu). Získané záznamy boli uschované pre účely retrospektívnej analýzy. Priebeh 1. mitotického delenia embryí sme sledovali za pomoci intravitálneho farbenia chromatínu fluorescenčným farbivom (Hoechst 33342) a deliace vretienko sme vizualizovali pomocou polarizačnej mikroskopie (Oosight, Research Instruments). Analyzovali sme záznamy 180 embryí, ktorých vývoj jednoznačne viedol k vzniku klinického tehotenstva (dg. FHB, fetal heart beat). Časový priebeh prvých štyroch interfáz (IP) a synchrónia delenia dcérskych buniek (ID, interval delenia) boli manuálne zaznamenané a vyhodnotené u týchto embryí. IP1(prvá interfáza) bola definovaná ako časový interval od oplodnenia do syngamie. IP2 od 2bunkového do 3bunkového embrya, IP3 interval medzi 3–5bunkovým štádiom a IP4 bol časový interval medzi 5bunkovým a 9bunkovým štádiom. Interval delenia sesterských buniek v danej mitóze (tj. vyjadrenie synchrónnosti delenia) bol zaznamenaný ako ID1: interval od syngamie do 2bunkového štádia, ID2: interval od 3 do 4 buniek, ID3: od 5 do 8 buniek a ID4: od 9bunkového do 16bunkového embrya.Výsledky:
U 180 embryí, ktorých vývoj viedol k vzniku klinickej gravidity, sme namerali tieto dĺžky interfáz: IP1 (prvá interfáza) trvala: 20–26 hod., IP2 : 10–12 hod., IP3 : 14–16 hod. a IP4 : 20–26 hod. Intervaly delenia sesterských buniek v danej mitóze boli u týchto embryí nasledovné: ID1 : 120–210 min., ID2 : 20–60 min., ID3 : 120–240 min. a ID4 : 230–360 min.Záver:
Vitálne embryá sa delia vo veľmi podobných časových intervaloch, ktoré je možné odmerať a vytvoriť referenčné hodnoty. Neinvazívne meranie dĺžky bunkového cyklu v prvých dňoch embryonálneho vývoja je možné použiť ako objektívne merateľný ukazovateľ životaschopnosti ľudských embryíKľúčové slová:
neinvazívne zobrazovanie, bezkontaktné meranie, ľudské embryo, bunkový cyklus, selekčné kritéria, liečba neplodnosti.ÚVOD
Napriek enormnej snahe o definovanie jednoznačného ukazovateľa(ov) vitality ľudského embrya je statické mikroskopické posudzovanie morfológie embrya aj naďalej najpoužívanejšou metódou výberu embrya k transferu. Tento systém je však zaťažený veľkou subjektívnosťou v posudzovaní a otáznou relevantnosťou sledovaných parametrov. Nové monitorovacie time-lapse technológie umožňujú bezkontaktné sledovanie dynamiky vývoja embryí v reálnom čase bez narušenia podmienok in-vitro kultivácie. Uchované záznamy vývoja sú následne vhodné pre akékoľvek retrospektívne analýzy. Cieľom našej práce bolo posúdiť relevantnosť merania dĺžky bunkových cyklov vo vzťahu k zaznamenaným klinickým tehotenstvám.
Nami navrhnutý systém analýzy je založený na troch základných vlastnostiach včasného embryonálneho vývoja:
- Embryonálny vývoj je daný sumou mitotických delení jednotlivých sesterských buniek a jeho priebeh je objektívne merateľný do kompaktácie buniek (obr. 1).
- Rovnomernosť distribúcie oocytárnych organel a metabolitov do buniek dvojbunkového embrya je esenciálnym predpokladom pre vývojovú rovnocennosť dcérskych buniek (viď línia delenia v 1. mitóze: obr. 2 a obr. 3). Táto homogenita buniek embrya je zodpovedná za synchrónnosť delenia sesterských buniek v danom mitotickom cykle a jej časové vyjadrenie predstavuje interval delenia (ID).
- (Ne)aktivita embryonálneho genómu (EGA, embryonic genom activity) ovplyvňuje dĺžku interfázy (IP, interphase) a tým celého bunkového cyklu (obr. 4).
Obr. 1. Embryonálny vývoj je daný sumou mitotických delení jednotlivých sesterských buniek a jeho priebeh je objektívne merateľný do kompaktácie buniek. Toto obdobie zahŕňa 4 kompletné bunkové cykly a končí vznikom 16bb (bunkového) embrya na prelome 3. a 4. dňa vývoja. Autor obrázku D. Hlinka 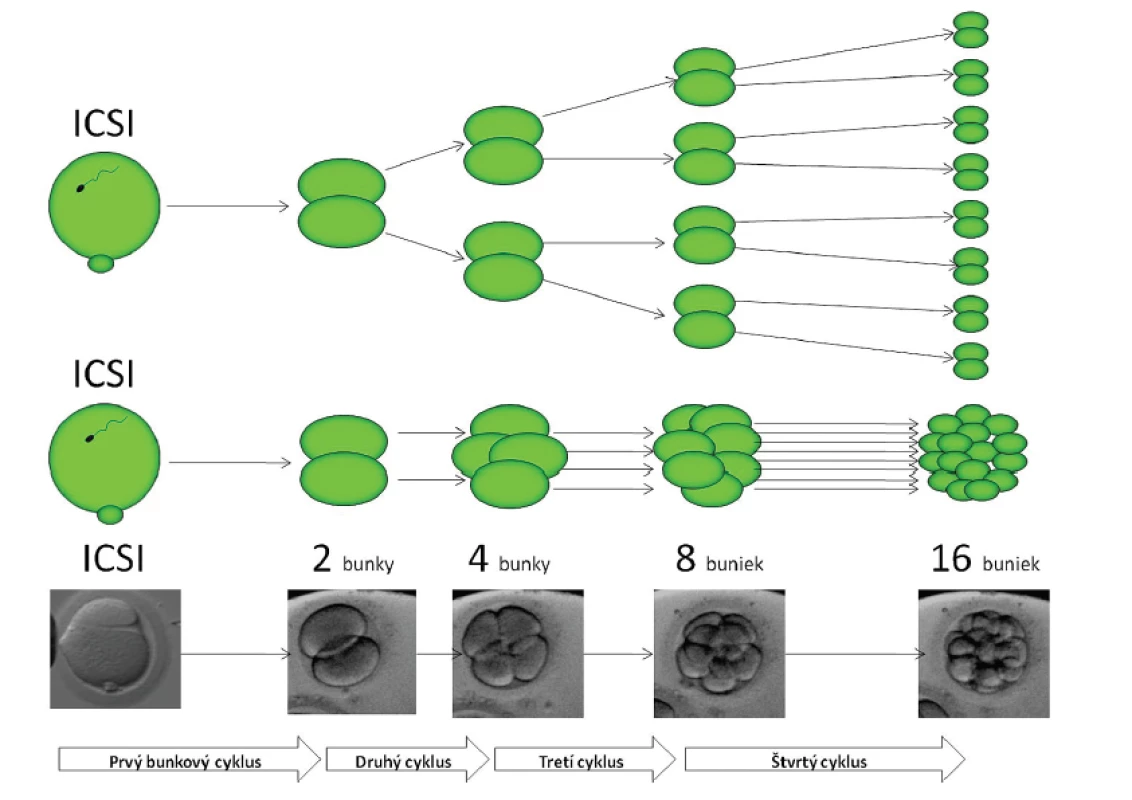
Obr. 2. Rovnomernosť distribúcie polarizovanej ooplazmy je ovplyvnená rovinou delenia, ktorá je daná polohou prvojadier pred nástupom syngamie. 1a/b. 3D rekonštrukcia polohy deliaceho vretienka v závislosti od polohy prvojadier. 2a/b. embryo v reálnom zobrazení pred a po ukončení prvého bunkového cyklu. Autor obrázkov a 3D modelov D. Hlinka 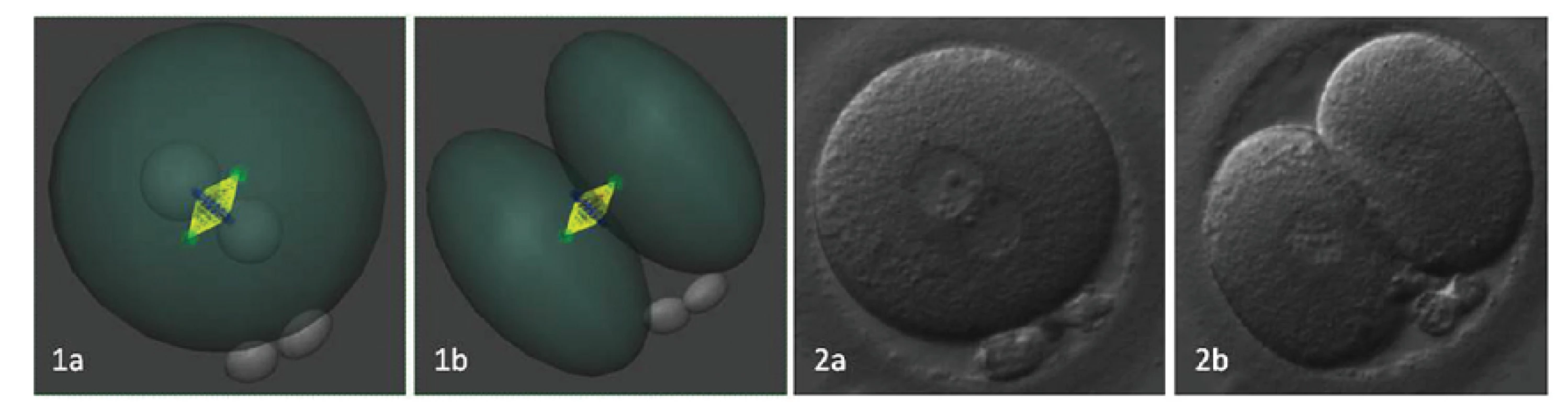
Obr. 3. Líniu delenia v 1. mitóze ovplyvňuje poloha prvojadier pred nástupom syngamie a možná orientácia deliaceho vretienka v priestore. Autor 3D modelov D. Hlinka 
Obr. 4. Schematické znázornenie základných fáz bunkového cyklu u mitoticky sa deliacich buniek. Dĺžka bunkových cyklov u včasných embryí je ovplyvňovaná: A. špecifickými dejmi v postfertilizačnom období, tj. ukončenie 2. meiotického delenia oplodnených oocytov, migrácia/rotácia prvojadier a zmiešavanie maternálnych a paternálnych chromozómov, B. transkripčnou a proteinsyntetickou aktivitou, ktorá sa objavuje postupne s aktiváciou embryonálneho genómu v priebehu 3. a 4. bunkového cyklu 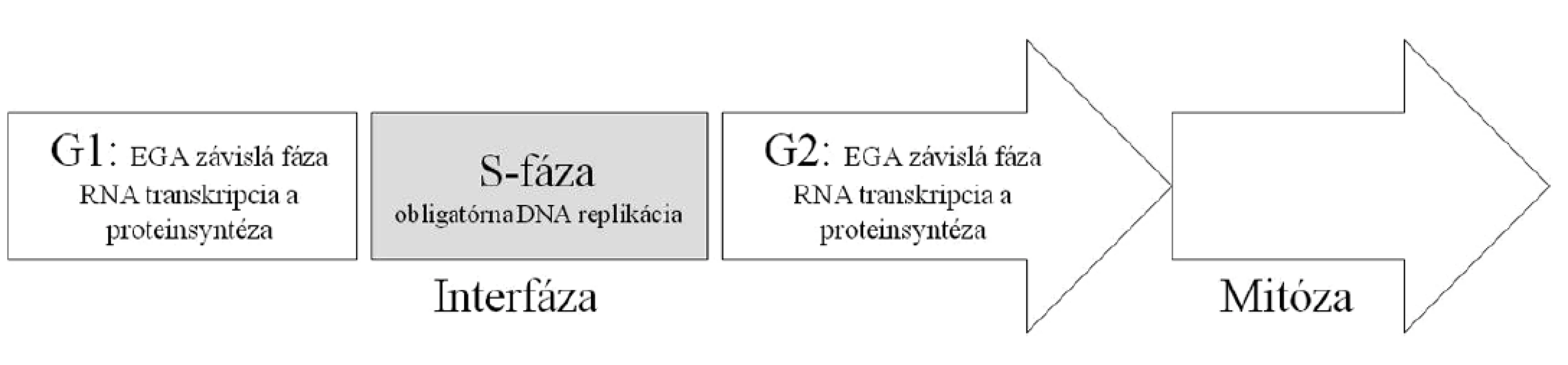
Pre definovanie základných hodnôt časového priebehu dĺžky interfáz a intervalov delenia (timingu) sme použili retrospektívnu analýzu vývoja u embryí, ktoré jednoznačne skončili klinickým tehotenstvom. Objektívne merateľný je embryonálny vývoj do kompaktácie buniek tj. v priebehu prvých štyroch bunkových cykloch. Toto obdobie zahŕňa 4 kompletné bunkové cykly a končí vznikom 16bb (bunkového) embrya na prelome 3. a 4. dňa vývoja
Časové vyjadrenie priebehu týchto dejov sme označili ako ECR (embryo cleavage rating), ktorý by mal slúžiť pre stanovenie referenčných hodnôt priebehu mitotických delení u životaschopných embryí.
SÚBOR A METODIKA
Vývoj embryí z IVF programu bol monitorovaný za použitia time-lapse zariadenia (PrimoVision, Cryo-Innovation, 1 obr./10 min, intermittent white-light illumination) v štandardných kultivačných podmienkach (37,0 °C, 5 % CO2 vo vlhkom vzduchu). Získané záznamy boli uschované pre účely retrospektívnej analýzy. Analyzovali sme záznamy 180 embryí, ktorých vývoj jednoznačne viedol k vzniku klinického tehotenstva (dg. FHB, fetal heart beat). Klinické tehotenstvo a korektnosť delenia každej bunky na dve bunky dcérske (viz obr. 1) boli jedinými kritériami pre zaradenie embrya do retrospektívnej analýzy. Časový priebeh prvých štyroch interfáz (IP) a synchrónia delenia dcérskych buniek (ID, interval delenia) boli manuálne zaznamenané a vyhodnotené u týchto embryí. IP1 (prvá interfáza) bola definovaná ako časový interval od oplodnenia do syngamie. IP2 od 2bunkového do 3bunkového embrya, IP3 interval medzi 3bunkovým až 5bunkovým štádiom a IP4 bol časový interval medzi 5bunkovým a 9bunkovým štádiom. Interval delenia sesterských buniek v danej mitóze (tj. vyjadrenie synchrónnosti delenia) bol zaznamenaný ako ID1: interval od syngamie do vzniku 2bunkového štádia, ID2: interval od 3 do 4 buniek, ID3: od 5 do 8 buniek a ID4: od 9 do 16 buniek embrya.
VÝSLEDKY
U 180 embryí, ktorých vývoj viedol k vzniku klinickej gravidity, sme namerali tieto dĺžky interfáz: IP1 (prvá interfáza) trvala: 20-26 hod., IP2 : 10-12 hod., IP3 : 14-16 hod. a IP4 : 20-26 hod. Intervaly delenia sesterských buniek v danej mitóze boli u týchto embryí nasledovné: ID1 : 120-210 min., ID2 : 20-60 min., ID3 : 120-240 min. a ID4 : 230-360 min. (tab. 1. obr. 5–8).
Obr. 5. Schematické znázornenie časového priebehu a definovanie prvých 4bunkových cyklov u ľudských embryí, ktorých vývoj viedol k vzniku klinického tehotenstva. Autor obrázkov D. Hlinka 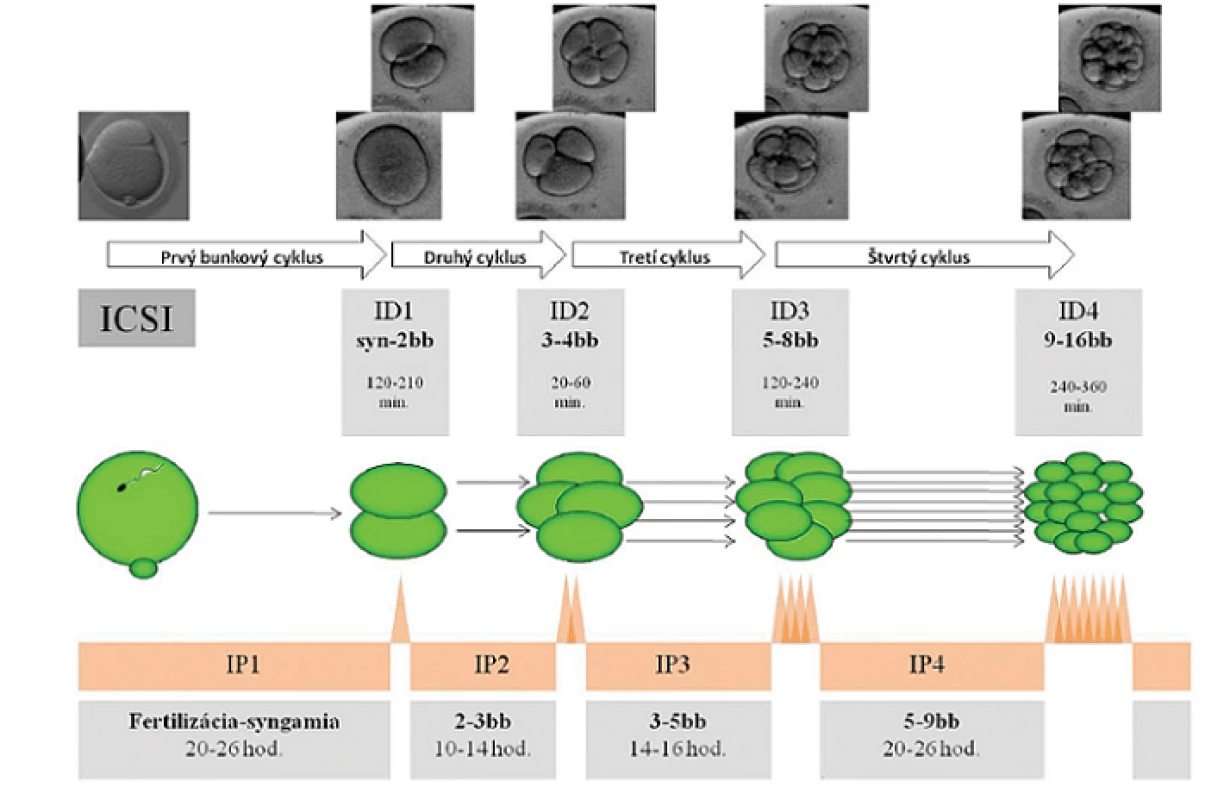
Obr. 6. Rotácia prvojadier (PN, pronuclei) v období od oplodnenia do nástupu syngamie. Obrázky 1–4 zachytávajú posledné 3 hod. 1. interfázy. V tomto období obe PN rotujú do polohy, ktorá umožní optimálnu líniu delenia vo vzťahu k polohe 1. polového telieska. Kondenzované chromozómy sa v 1. metafáze zoskupujú v pozdĺžnej línii spájajúcej polohu oboch PN. Orientácia PN teda predurčuje líniu delenia. Autor obrázkov D. Hlinka 
Obr. 7. Priebeh 1. mitotického delenia embryí: Hoffman Modulation Contrast (1–5) a intravitálne farbenia chromatínu farbivom Hoechst 33342 (1a–5a). Časový priebeh: Prometafáza (1–2): vymiznutie prvojadier (tj. koniec prvej interfázy), zmiešanie maternálnych a paternálnych chromozómov a začiatok tvorby deliaceho vretienka: 20–30 min. Metafáza (3): usporiadanie kondenzovaných chromozómov v equatoriálnej rovine a plné vyvinutie bipolárneho deliaceho vretienka: 120–140 min. Anafáza (4), Telofáza (5): segregácia chromozómov do dcérskych buniek: 20–30min. Následne obe bunky vstupujú do druhej interfázy. Autor obrázkov D. Hlinka 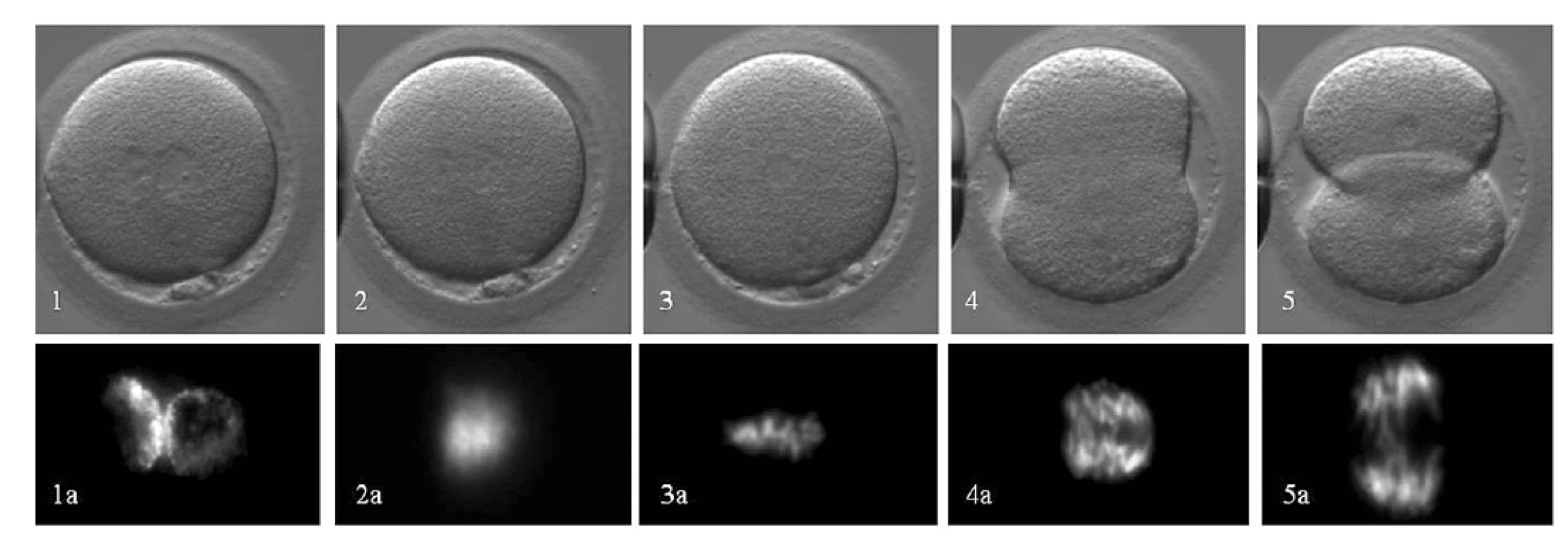
Obr. 8. Priebeh 1. mitotického delenia embryí: Dvojité intravitálne farbenie a) chromatínu farbivom Hoechst 33342, b) deliace vretienko bolo vizualizované pomocou polarizačnej mikroskopie (Oosight, Research Instruments). Autor obrázkov D. Hlinka 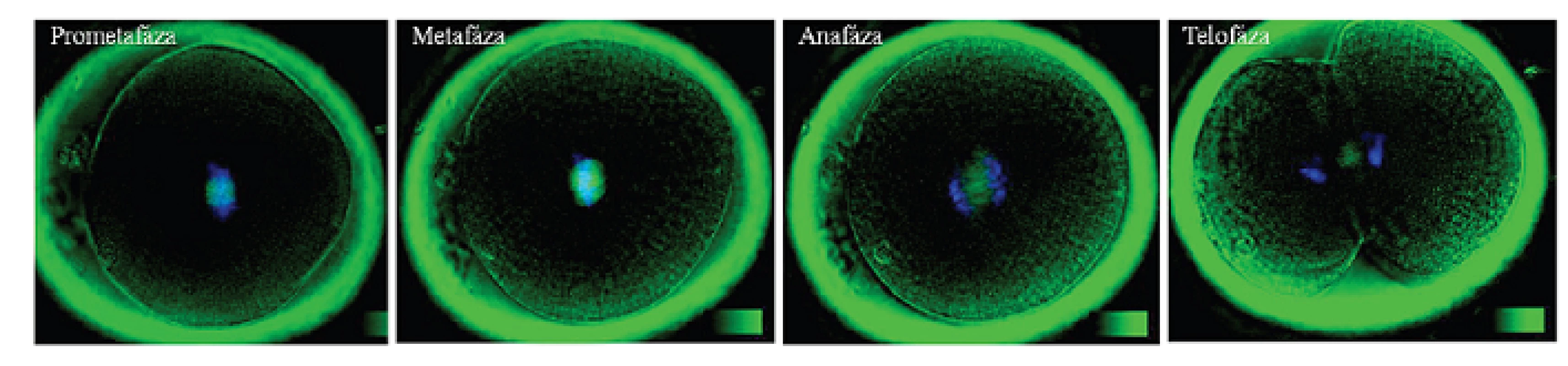
Tab. 1. Časový priebeh (IP, interfáza) prvých štyroch bunkových cyklov a synchrónia delenia dcérskych buniek (ID, interval delenia) u ľudských embryí, ktorých vývoj viedol k vzniku klinického tehotenstva. Referenčné hodnoty: ECR - embryo cleavage rating 
DISKUSIA
Už naše predchádzajúce práce poukazovali na súvislosti medzi životaschopnosťou embryí a 1. mitotickým delením (línia delenia, dĺžka trvania syngamie, rovnomernosť distribúcie ooplazmy apod.) [2, 5]. Tieto korelácie medzi časovým priebehom postfertilizačných dejov a vitalitou embryí popisovali aj iné štúdie [1, 3, 6–9]. Základným nedostatkom všetkých týchto pozorovaní boli limitované možnosti dynamického monitorovania celého preimplantačného vývoja. Zásadný posun v poznatkoch a prístupoch nastal až po zavedení klinicky aplikovateľných time-lapse systémov. Tým nastal zásadný posun v chápaní významu timingu embryonálneho vývoja. Potvrdením našich sledovaní sú aj nedávne výsledky prác iných autorov [4, 11], ktoré dynamiku a časovanosť embryonálneho vývoja dávajú do kontextu doterajších vedomostí.
Výsledná chronológia dejov v prvých 3–4 dňoch embryonálneho vývoja má teda svoju logiku a je možné ju vcelku jasne definovať.
Synchrónnosť delenia sesterských buniek nie je nijakým prekvapením, pokial si uvedomujeme, že embryonálny vývoj je počas relatívne dlhej doby riadený výlučne alebo hlavne na základe maternálnych metabolitov a organél. Rovnomerné rozdelenie obsahu totipotentnej bunky – oocytu je tak esenciálnou podmienkou, ktorá zabezpečuje vývojovú homogenitu dcérskych buniek. Tie sa v následujucom období správajú veľmi uniformne a výsledkom je krátky časový interval delenia v danej mitóze. Doba delenia sa postupne predlžuje v korelácii s celkovým počtom buniek, ktoré do delenia v príslušnej mitóze vstupujú. Logicky bude potom interval delenia dlhší v štvrtej mitóze (delí sa 8 sesterských buniek) ako v mitóze druhej, kde sa delia bunky dve (obr. 5). Výnimkou v tomto kontexte je dĺžka mitózy prvej. Tá trvá od nástupu syngamie do vzniku 2bb embrya 120–210 min. (obr. 7. a 8). Pri deleniach v následujúcich cykloch (2., 3. a 4. cyklus) je trvanie samotnej mitózy (metafáza, anafáza a telofáza) u jednej bunky krátke: asi 20–30 min. Prvé delenie je však špecifické. Predstavuje prvé spojenie dvoch haploidných sád maternálnych a paternálnych chromozómov do novej diploidnej konfigurácie. Vytvorenie nových interchromozomálnych spojení, usporiadanie kondenzovaných chromozómov v equatoriálnej rovine a plné vyvinutie bipolárneho deliaceho vretienka potom spôsobuje relatívne dlhé trvanie prvého embryonálneho delenia. V tomto zmysle môžeme aj prvú interfázu považovať za veľmi špecifickú a jej dlhé trvanie (20–26 hod.) má svoje opodstatnenie v dejoch, ktoré sa v neskorších bunkových cykloch už neodohrávajú. Za špecifiká postfertilizačného obdobia považujeme predovšetkým:
- A. ukončenie 2. meiotického delenia u oocytu a vylúčenie 2. polového telieska;
- B. vývoj a migrácia prvojadier (PN, pronuclei) (obr. 6).
Rovnomernost distribúcie polarizovanej ooplazmy do 2bb embrya je ovplyvnená rovinou delenia, ktorá je daná polohou prvojadier pred nástupom syngamie. Z toho dôvodu obe PN rotujú do polohy, ktorá zabezpečí optimálnu líniu delenia (obr. 2). Akékoľvek anomálie vyplývajúce z asynchrónie medzi ukončením migrácie/rotácie a nástupom delenia spôsobujú poruchy v syngamii (napr. uniparentálna segregácia chromozómov) resp. vyústia do abnormálneho delenia a porúch embryonálneho vývoja. Dĺžka interfáz v 2.–4. bunkovom cykle je v zásade ovplyvnená dejmi, akými sú: A. obligatórna, tj. nevyhnutná reduplikácia DNA pre zachovanie diploidnej kontinuity v nových bunkách embrya a B. transkripčná a translačná aktivita, ktorá má postupne sa zvyšujúcu aktivitu. Aktívna transkripcia a nová proteinsyntéza začína postupne nahradzovať oocytárne zásoby novými, embryonálnymi génovými produktami až po aktivácii embryonálneho genómu. Výrazný nástup embryonálnej transkripčnej aktivity možno u ľudských embryí pozorovať v treťom a hlavne štvrtom bunkovom cykle [10, 11]. Tomu zodpovedajú aj dĺžky interfáz v 2.–4. bunkovom cykle (obr. 8). Najkratšia je IP1 (10–12hod.), kedy nebola detekovaná žiadna transkripcia. Mierne predĺženie IP2 (14–16 hod.) poukazuje na prvé transkripčné aktivity [10]. Robustný nástup novej transkripcie a proteinsyntézy (EGA, embryonal genom activation) koreluje s enormným predĺžením 4. interfázy (IP4, 20–26hod.) a je signálom zdarného prepnutia s maternálneho na embryonálne riadenie ďalšieho vývoja.
ZÁVER
Retrospektívnou analýzou vývoja embryí, ktorých vývoj viedol k vzniku klinickej gravidity, sme zistili, že vitálne embryá sa delia vo vymedzených a v každej mitóze veľmi sychrónnych časových intervaloch. Definovali sme základné hodnoty časového priebehu prvých štyroch bunkových cyklov (ECR, embryo cleavage rating), ktoré budú môcť slúžiť ako základ pre stanovenie referenčných hodnôt dĺžky interfáz a intervalov delenia vitálnych ľudských embryí.
Bezkontaktné a neinvazívne sledovanie a vyhodnocovanie embryonálneho vývoja za pomoci nových time-lapse monitorovacích zariadení vstupuje do plného klinického využitia.
MVDr. Daniel Hlinka, Ph.D.
Prague Fertility Centre
Milady Horákové 386/63
170 00 Praha 7
Zdroje
1. Brezinova, J., Oborna, I., Svobodova, M., et al. Evaluation of day one embryo quality and IVF outcome – a comparison of two scoring systems. Reprod Biol Endocrinol, 2009, 3,7. p. 9.
2. Dudas, M., Hlinka, D., Dankovcik, R., et al. Combining novel experimental and bioinformatic tools for the advancement of preimplantation genetic diagnosis. In: Pilka, L., Lesnik, F. (Eds.), Reproductive medicine - Presence and perspectives. 2009. Olomouc: Naklad. Olomouc, Inc., p. 176-194.
3. Kilani, S., Cooke, S., Kan, A., et al. Are there non-invasive markers in human oocytes that can predict pregnancy outcome? Reprod Biomed Online, 2009, 18, 5, p. 674-680.
4. Kiessling, A. Timing is everything in the human embryo. Nature Biotechnol, 2010, 28, p. 1025–1026.
5. Hlinka, D., Dudas, M., Rutarova, J., et al. Permanent embryo monitoring and exact timing of early cleavages allow reliable prediction of human embryo viability, P-176 – Abstracts of the 26th Annual Meeting of the European Society of Human Reproduction and Embryology, Rome, Italy, 27-30 June 2010, 25, suppl. 1.
6. Magli, MC., Gianaroli, L., Ferrarettim, AP., et al. Embryo morphology and development are dependent on the chromosomal complement. Fertil Steril, 2007, 87, p. 534-541.
7. Nagy, ZP., Janssenswillen, C., Janssens, R., et al. Timing of oocyte activation, pronucleus formation and cleavage in humans after intracytoplasmic sperm injection (ICSI) with testicular spermatozoa and after ICSI or in-vitro fertilization on sibling oocytes with ejaculated spermatozoa. Hum Reprod, 1998, 13, p. 1606-1612.
8. Sakkas, D., Shoukir, Y., Chardonnens. D., et al. Early cleavage of human embryos to the two-cell stage after intracytoplasmic sperm injection as an indicator of embryo viability. Hum Reprod, 1998, 13, p. 182-187.
9. Scott, L., Finn, A., O`Leary, T., et al. Morphologic parameters of early cleavage-stage embryos that correlate with fetal development and delivery: prospective and applied data for increased pregnancy rates. Hum Reprod, 2007, 22, 1, p. 230-240.
10. Tesarik, J., Kopecny, V., Plachot, M., et al. Early morphological signs of embryonic genome expression in human preimplantation development as revealed by quantitative electron microscopy. Devl Biol, 1988, 15, p. 128.
11. Wong, CC., Loewke, KE., Bossert, NL., et al. Non-invasive imaging of human embryos before embryonic genome activation predicts development to the blastocyst stage. Nature Biotechnol, 2010, 28, p. 1115-1121.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2012 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Fytoestrogeny v menopauze: mechanismus účinku a výsledky léčby v sestavě 28 pacientek
- Psychosociální potřeby novorozence v kontextu perinatální péče
- Nové kolposkopické znaky – výběžky a vnitřní hranice
- Představuje asymptomatické nosičství mutace FV Leiden a FII protrombin v heterozygotní konfiguraci zvýšené riziko trombembolických komplikací v průběhu těhotenství, porodu a šestinedělí?
- Centralizace gynekologicko-porodnické péče
- Rizikové faktory pro vznik recidivy u borderline nádorů ovaria
- Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání?
- Nákladová efektivita a další ekonomické aspekty strategií prenatálního screeningu trizomie 21 v České republice
- Infekce dolních močových cest u žen – možnosti diferencovaného přístupu léčby a prevence
- Neinvazívne meranie dĺžky bunkového cyklu v prvých dňoch embryonálneho vývoja - objektívne merateľný ukazovateľ životaschopnosti ľudských embryí
- Genetické faktory v etiopatogenezi děložních myomů
- Invazivní karcinom cervixu od depistážních akcí k národnímu screeningu v České republice
- Reakce na závěry Sekce UZ diagnostiky ČGPS publikované v Zpravodaji SSG ČR 4, 2011
- Reakce na připomínky MUDr. Petra Poláka, CSc., k dokumentům České gynekologické a porodnické společnosti (ČGPS) České lékařské společnosti (ČLS) Jana Evangelisty Purkyně (JEP)
- Změny ve specializačním vzdělávání v gynekologii a porodnictví od roku 2012
- PERIPARTÁLNÍ ŽIVOT OHROŽUJÍCÍ KRVÁCENÍ mezioborové konsenzuální stanovisko
- Problematika nabízení LBC v rámci screeningu karcinomu děložního hrdla v gynekologických ordinacích za úhradu pacientkou
- Metoda redukce odlesku v kolposkopii
- CELOSTÁTNÍ KONFERENCE České gynekologické porodnické společnosti ČLS JEP a Sdružení soukromých gynekologů ČR
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání?
- Nové kolposkopické znaky – výběžky a vnitřní hranice
- Rizikové faktory pro vznik recidivy u borderline nádorů ovaria
- Psychosociální potřeby novorozence v kontextu perinatální péče
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



