-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prevalence trombofilních mutací FV Leiden, protrombinu G20210A a PAI-1 4G/5G a jejich vzájemných kombinací v souboru 1450 zdravých osob středního věku v regionu Praha a střední Čechy (výsledky real-time PCR analýzy FRET)
Prevalence of thrombophilic mutations of FV Leiden, prothrombin G20210A and PAI-1 4G/5G and their combinations in a group of 1,450 healthy middle-aged individuals in the Prague and Central Bohemian regions (results of FRET real-time PCR assay)
Background.
Factor V Leiden (G1691A) and prothrombin gene (FII G20210A) mutations are independent risk factors of venous thrombosis and this risk is further increased by the combined genotype 4G/4G PAI-1.Aim.
The primary objective was to identify the frequency of mutations of minor alleles and genotypes of FVL, FII G20210A and PAI-1 4G/5G in healthy Caucasians in the Prague and Central Bohemia regions. The secondary objective was to identify the occurrence of their mutual combinations.Method.
Genotyping was performed in 1,450 healthy individuals (blood donors, 981 men and 469 women) using robotic DNA isolation and subsequent PCR and melting curve analysis (Light Cycler 480 System, Roche).Results.
The minor allele frequencies in FV Leiden and FII G20210A mutations were 4.5 % and 1.3% respectively. The frequency of the 4G PAI-1 allele was 55.9%. The genotype frequencies were as follows: GG 91.10%, GA 8.83% and AA 0.07% for FV Leiden; GG 97.38%, GA 2.55% and AA 0.07% for FII G20210A and 4G/4G 30.69%, 4G/5G 50.34% and 5G/5G 18.97% for PAI-1. No differences in these frequencies were found between the genders. The occurrence of the combined heterozygous FII and heterozygous FV Leiden mutations was 0.14%. The PAI-1 4G/4G genotype was combined with the heterozygous FV Leiden mutation in 2.83% of cases and with the heterozygous FII mutation in 0.62% of cases.Conclusions.
The found frequencies of genotypes and alleles confirm a relatively high prevalence of hereditary thrombophilia in the Czech Republic.Key words:
FV Leiden, FII G20210A, PAI-1 4G/5G, genotype, alleles, prevalence.
Autori: Jan Kvasnička 1; Jaroslava Hájková 1; Petra Bobčíková 1; Tomáš Kvasnička 1; Daniela Dušková 2; Šárka Poletínová 2; Veronika Kieferová 2
Pôsobisko autorov: Univerzita Karlova v Praze, Ústav klinické biochemie a laboratorní diagnostiky, Trombotické centrum a Centrální hematologické laboratoře 1; Univerzita Karlova v Praze, 1. lékařská fakulta, Fakultní transfúzní oddělení VFN 2
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 76-82
Kategória: Původní práce
Súhrn
Východisko.
Faktor V Leiden (G1691A) či mutace genu pro protrombin FII G20210A jsou nezávislé rizikové faktory žilní trombózy a kombinovaný výskyt genotypu 4G/4G PAI-1 ještě toto riziko zvyšuje.Cíl.
Primárním cílem bylo zjistit frekvenci minoritních alel a genotypů FVL, FII G20210A a PAI-1 4G/5G u zdravých osob kavkazské rasy v Praze a v regionu středních Čech. Druhotným cílem bylo zjistit výskyt jejich vzájemných kombinací.Metody.
Genotypizace byla provedena u 1450 zdravých osob (dárců krve, 981 mužů a 469 žen) pomocí robotické izolace DNA a následnou amplifikací PCR s analýzou křivky tání (Light Cycler 480 System, Roche).Výsledky.
Frekvence minoritních alel mutací FV Leiden a FII G20210A byla 4,5 %, respektive 1,3 %. Frekvence alely 4G PAI-1 byla 55,9 %. Frekvence genotypů byly: GG 91,10 %, GA 8,83 % a AA 0,07 % pro FV Leiden; GG 97,38 %, GA 2,55 % a AA 0,07 % pro FII G20210A a 4G/4G 30,69 %, 4G/5G 50,34 % a 5G/5G 18,97 % pro PAI-1. U obou pohlaví se tyto frekvence nelišily. Kombinace heterozygotní mutace FII s heterozygotní mutací FV Leiden se vyskytovala v 0,14 %. Kombinace genotypu PAI-1 4G/4G s heterozygotní mutací FV Leiden se vyskytovala v 2,83 % a s heterozygotní mutací FII v 0,62 %.Závěry.
Zjištěné frekvence genotypů a alel potvrzují relativně vysokou prevalenci hereditárních trombofilií v České republice.Klíčová slova:
FV Leiden, FII G20210A, PAI-1 4G/5G, genotyp, alely, prevalence.Úvod
V Evropě v současné době umírá stále asi 500 000 osob ročně na komplikace tromboembolické nemoci (TEN) přesto, že se jedná o onemocnění, kterému již lze zabránit vhodnou profylaxí. Také incidence tohoto onemocnění je stále vysoká. Během 1 roku dochází k výskytu 148 případů žilní trombózy a 95 případů plicní embolie v přepočtu na každých 100 000 obyvatel (1). Vysoký výskyt TEN dokládají i další velké epidemiologické studie (2, 3) a tento nepříznivý stav se příliš nemění (4).
V České republice s 10,5 miliony obyvatel zatím nemáme k dispozici přesná statistická čísla a vycházíme proto z kvalifikovaných odhadů Puchmayera s Roztočilem (5) a Chocholy (6), kteří uvádějí, že ročně je zde diagnostikováno asi 15 000 až 25 000 případů žilní trombózy.
Dnes již není pochyb, že se v etiopatogenezi TEN neuplatňuje jen jeden faktor, ale že se jedná o onemocnění multifaktoriální (7). Jde o interakci mezi různými environmentálními faktory (jako je trauma, hormonální léčba, gravidita aj.) a vlivy genetickými (8). Při určení výše rizika vzniku žilního tromboembolismu spojeného s výskytem genetických mutací lze vycházet z výsledků zatím nejrozsáhlejší metaanalytické studie Gohila et al. (9). Zahrnuje výsledky 173 studií provedených celkem u 22 000 nemocných s TEN a u 37 000 kontrolních osob, ve kterých bylo vyšetřováno 28 polymorfismů 21 genů spojovaných s trombofilií. Riziko vzniku TEN je zde vyhodnoceno na základě výpočtu O.R. (poměr šancí, angl. odds ratio) a tzv. populačního atributivního rizika P.A.R. (population attributable risk), které jsou považovány za nejvhodnější ukazatele (10) rizika vzniku onemocnění v populaci. Pro osoby evropského původu zde byla zjištěna pro heterozygotní mutaci FV Leiden G1691A (dále FVL) hodnota O.R. ve výši 4,93 a hodnota P.A.R. 17,0 %. Pro homozygoty FVL bylo stanoveno O.R. 9,6. Pro osoby s heterozygotní mutací genu pro protrombin G20210A (dále mFII) bylo vypočteno O.R. ve výši 3,7 a hodnota P.A.R. 6,2 %. Ze sledovaných 28 polymorfismů splňoval kritérium středně vysokého rizika TEN, to je O.R. > 1,5 (11, 12), vedle FVL a mFII ještě polymorfismus genu inhibitoru aktivátoru plazminogenu PAI-1 4G/5G s O.R. 1,62 a hodnotou P.A.R. 30,1 %.
Vyšší riziko vzniku TEN než FVL, mFII nebo PAI-1 4G vyvolává sice dědičný výskyt deficitu nebo dysfunkce přirozených inhibitorů koagulace antitrombinu (AT), proteinu C (PC) a proteinu S (PS) (7–20×), ale jejich prevalence je v populaci velmi nízká (dohromady jen asi 1 %) (13). Navíc se tyto trombofilní stavy vyskytují jen mezi členy určitých rodin. To pak spolu s velkým množstvím již zjištěných polymorfismů v genech AT, PC a PS (řádově stovky) limituje význam jejich genetického stanovení pro epidemiologické účely (14). Prevalence těchto trombofilních stavů se proto určuje jen na základě stanovení aktivity nebo koncentrace antigenu AT, PC nebo PS.
Cílem naší studie bylo zjistit frekvenci genotypů a alel trombofilních mutací spojených s klinicky významným rizikem vzniku TEN (OR > 1,5) v naší populaci u zdravých osob středního věku 18–60 let. Z té by pak již bylo možné vycházet při hledání optimální strategie zaměřené na snížení incidence TEN u rizikových skupin obyvatelstva. Vybrány byly tyto tři polymorfismy – FV Leiden G1691A, protrombin G20210A a PAI-1 4G/5G.
Ke vzniku mutace FV Leiden vede bodová mutace genu koagulačního faktoru V, který je umístěn na 1. choromozomu v oblasti 1q23. V jeho 10. exonu v pozici 1691 zde dochází k záměně nukleotidu guaninu G za adenin A (G1691A, rs6025). Ta pak při syntéze proteinu F5 způsobí záměnu aminokyseliny arginin (R) za glutamin (Q) v pozici 506 (FV: Q506) (15). Podle místa objevu je tato mutace nazvána FV Leiden. Způsobí, že aktivovaný FV Leiden je rezistentní vůči proteolytickému štěpení aktivovaným PC. Po vytvoření trombinu a aktivaci PC pak nedojde k účinné zpětné vazebné inhibici koagulačního procesu a tvorba trombinu proto dále částečně přetrvává (jedná se o tzv. APC rezistenci). K hyperkoagulaci přispívá i to, že FV Leiden není na rozdíl od fyziologického FV způsobilý podílet se s dalším přirozeným inhibitorem koagulace PS i na inaktivaci aktivovaného FVIIIa.
Mutace G20210A genu protrombinu, který je lokalizován na 11. chromozomu v oblasti 11p11-q12, je opět bodovou mutací se záměnou nukleotidu guaninu G za adenin A v pozici 20210 (FII G20210A, rs1799963) v nepřekládané oblasti 3’ konce, která je spojena s poruchou kontroly translace mRNA a tvorbou většího množství funkčního protrombinu (> 1,15 U/ml) (16,17).
Polymorfismus genu PAI-1 (synonymum serpin E1) 4G/5G ( 675 4G/5G, rs1799889) souvisí s delecí nebo inzercí guaninu G v pozici -675 v promotorové oblasti genu PAI-1, který je lokalizován v oblasti chromozomu 7q21.3-q22. Alela 4G (s delecí guaninu) vede ke zvýšenému přepisu genu PAI-1, protože ztrácí represorovou funkci, a tím i ke zvýšení produkce inhibitoru aktivátoru plazminogenu typu 1 (PAI-1). Alela 5G (s insercí guaninu) naopak represorovou funkci plní. Osoby s genotypem 4G/4G pak mají hladinu plazmatického PAI-1 o 25 % vyšší než homozygoti s genotypem 5G/5G a při zátěži u nich dochází k vyšší inhibici aktivity aktivátoru plazminogenu, a tím i ke snížení fibrinolýzy, což souvisí s následnou trombofilií (18).
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Výběr souboru zdravých osob ve věku 18–60 let
Do studie bylo náhodným výběrem zařazeno celkem 1450 anonymních dárců krve z fakultního transfuzního oddělení Všeobecné fakultní nemocnice v Praze. Vyšetření bylo provedeno v rámci studie VZ MZO VFN 2005 Diagnostika a léčba geneticky podmíněných poruch II schválené etickou komisí 1. lékařské fakulty UK a Všeobecné fakultní nemocnice v Praze. Všichni byli evropského původu a pocházeli z oblasti města Prahy nebo Středočeského kraje České republiky. Další demografické údaje o této kohortě jsou uvedeny v tabulce 1.
Tab. 1. Základní charakteristiky studované populace 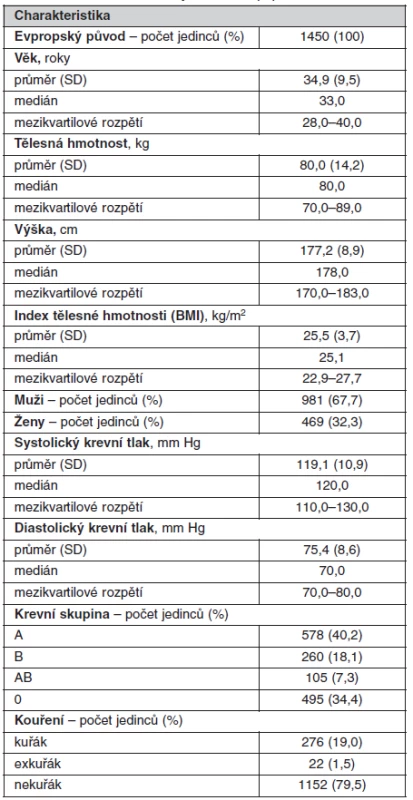
Genetické testy
Vyšetření polymorfismů
Genomová DNA (deoxyribonukleová kyselina) byla extrahována z leukocytů periferní krve a izolována pomocí MagNA Pure LC Nucleic Acid Extraction system™ se soupravou MagNA Pure DNA Isolation Kit I™ (vše Roche Diagnostics, Mannheim, Německo) podle návodu výrobce. Vstupní a výstupní objemy vzorku byly nastaveny na 100 ml. DNA byla izolována podle protokolu MagNA Pure High-Performance DNA Extraction™.
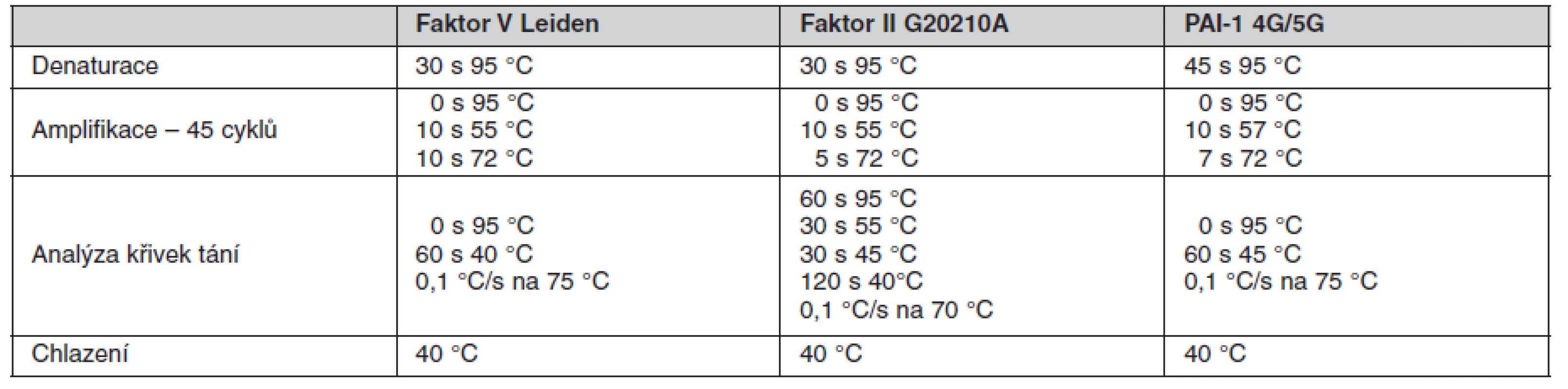
Sledované mutace byly stanoveny pomocí polymerázové řetězové reakce (PCR) následované analýzou křivky tání se specifickými fluorescenčně značenými hybridizačními sondami v procesu FRET (fluorescence resonance energy transfer). Vyšetření bylo provedeno na přístroji LightCycler® 480 System s použitím kitů LC® 480 Genotyping Master (vše Roche Diagnostics, Mannheim, Německo) podle instrukcí výrobce.
Sekvenčně specifické primery a fluorescenčně značené sondy byly navrženy ve spolupráci s firmou TIB MOLBIOL (Berlín, Německo), kde byly také na zakázku připraveny. Primery byly použity v 0,4 μM koncentraci a fluorescenční sondy v 0,1 μM, resp. 0,3 μM koncentraci. Reakce proběhla v prostředí Mg2+ kationtů. V tabulce 2 jsou uvedeny sekvence použitých primerů a sond a v tabulce 3 jsou uvedeny parametry provedených PCR. Všechna tato vyšetření byla provedena v molekulárně biologické laboratoři Trombotického centra VFN v Praze a splňují kritéria spolehlivosti při pravidelné externí kontrole prováděné institucí INSTAND (Düsseldorf, Německo).
Tab. 2. Použité primery a sondy 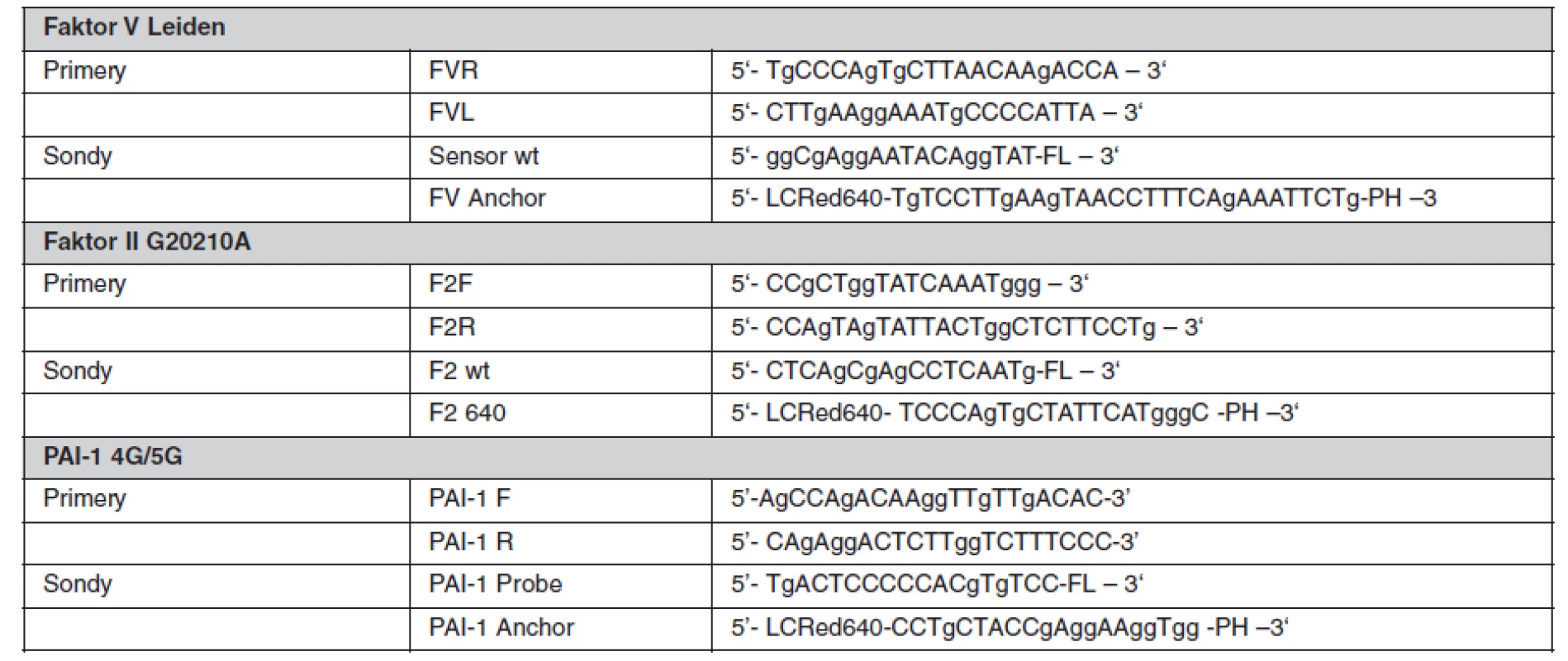
Statistické testy
Ke stanovení odchylky od Hardy-Weinbergova zákona (p > 0,05) byl použit χ2-test. Vzhledem k nízkému procentnímu zastoupení homozygotních mutací jsme použili přesnější variantu – exact test – ke stanovení HWE pro rozložení polymorfismů FV Leiden a FII G20210A. Interval 95% spolehlivosti byl kalkulován metodou dle Walda. Rozdíly mezi zastoupením genotypů a frekvencí alel mezi muži a ženami byly vyhodnoceny opět χ2-testem.
K výpočtu byl použit statistický program SAS, verze 9.2 (SAS Institute, NC, USA) s genetickým souborem.
Výsledky
Určené genotypy a frekvence alel FVL, mFII a PAI-1 4G/5G v celém souboru a poté zvlášť u žen a mužů jsou uvedeny v tabulkách 4, 5 a 6. Všechny splňovaly požadavky Hardy-Weinbergovy rovnováhy. V tabulce 7 jsou pak uvedeny prevalence kombinací sledovaných mutací.
Tab. 4. Frekvence genotypů a alel ve sledované české populaci 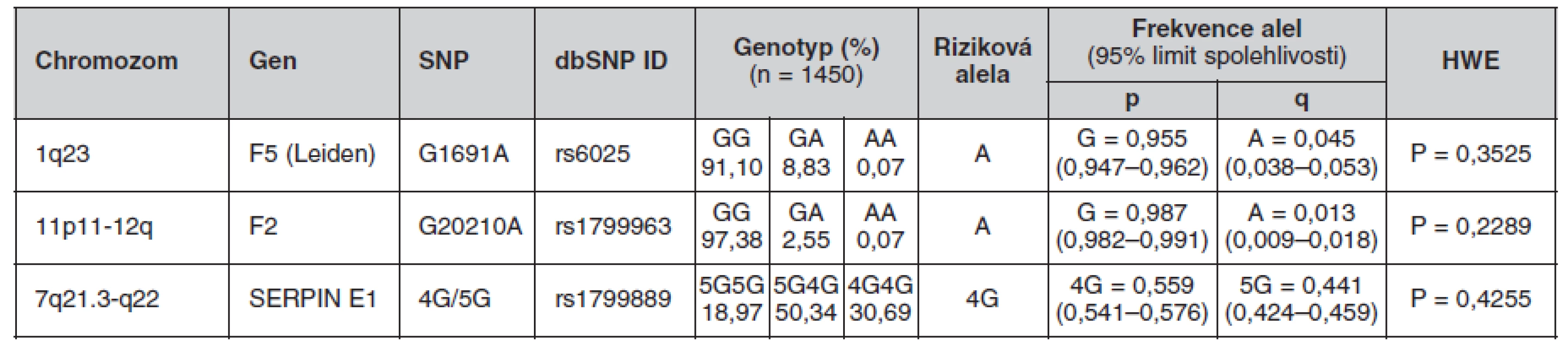
Tab. 5. Frekvence genotypů a alel ve sledované české populaci (muži) 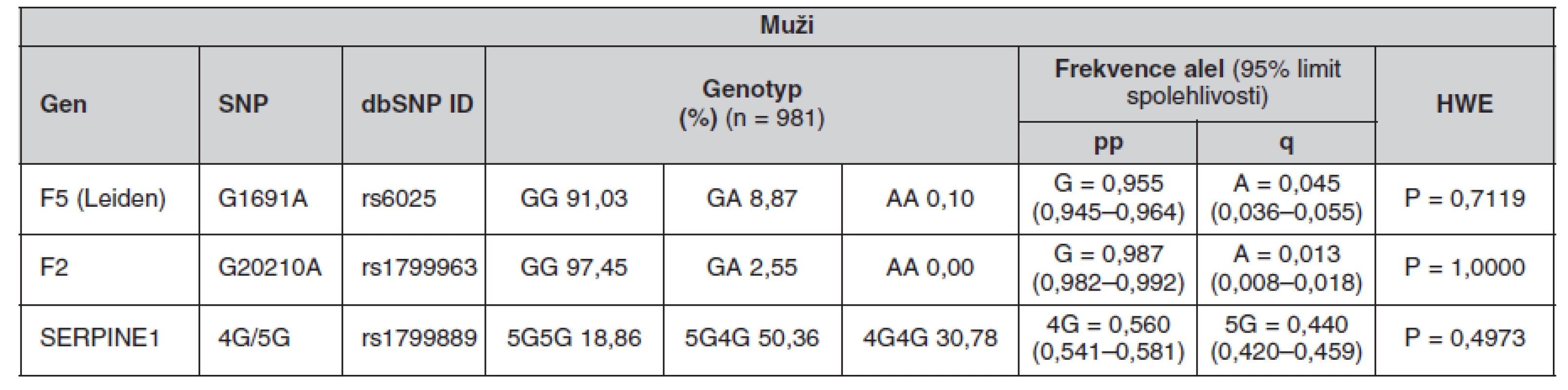
Tab. 6. Frekvence genotypů a alel ve sledované české populaci (ženy) 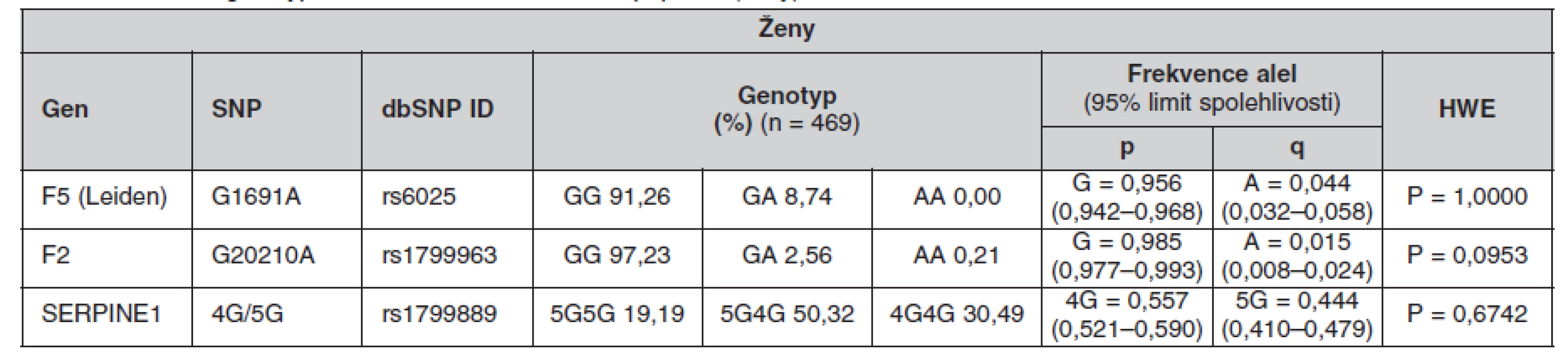
Tab. 7. Prevalence kombinací sledovaných mutací 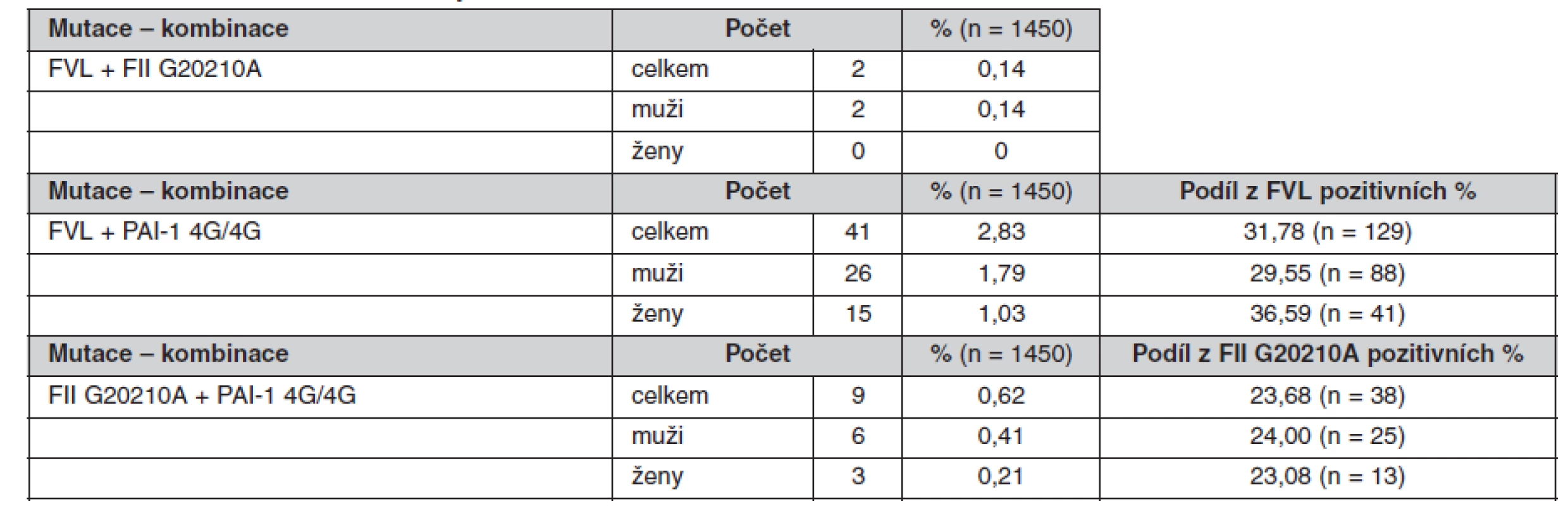
Pozn.: Symboly genů, rs čísla, SNP typy a čísla chromozomů vycházejí z National Center for Biotechnology Information build 37.1. Diskuze
Je již známo, že o prevalenci mutace FVL a mutace FII G20210A rozhoduje především etnický původ zkoumané populace. V rozsáhlé epidemiologické studii provedené ve Spojených státech amerických byl heterozygotní výskyt mutace FVL zjištěn u osob evropského původu v 5,27 %, u osob latinsko-amerického původu v 2,21 %, u amerických černochů v 1,23 %, u osob indiánského původu v 1,25 % a jen 0,45 % u osob asijského původu. Podobně nízký, respektive nulový, byl u neevropské populace zjištěn i výskyt mutace FII G 20210A (19).
To, že se obě mutace vyskytují převážně jen u kavkazské rasy, dokumentují výsledky i další studie zaměřené již na celosvětový průzkum jejich výskytu (20). Například v Japonsku se tyto mutace nevyskytují vůbec – ani u zdravých osob ani u nemocných s žilní trombózou (21).
Předpokládá se proto, že obě trombofilní mutace vznikly v Evropě přibližně před více než 20 000 až 24 000 lety (22). Pro své nositele představovaly svým způsobem určité výhody. Chrání například před vyšším krvácením při porodu (23) a snad i proti infekcím (24).
V evropské populaci kolísá výskyt heterozygotů FVL mezi 2–15 % (25, 26) a FII G20210A mezi 1–5 % (27). V různých regionech Evropy jsou tedy nacházeny poměrně velké rozdíly patrně díky migraci obyvatel v mladší době kamenné a poté. Například ve Francii s průměrnou prevalencí heterozygotů FVL 3,84 % je vyšší výskyt této mutace na severu a východě proti jihu a západu země (28). Velmi nízký je třeba výskyt FVL v Baskicku (29), kde k migraci v neolitu nedošlo, a také v oblasti Nimes na jihu Francie (30) s migrací obyvatel z Afriky. Jsou však výjimky. V jižní Itálii byla zase nalezena poměrně vysoká prevalence heterozygotů FVL a FII G20210A – 9,5 %, resp. 5,7 % (31). Zde je zase předpokládána migrace z jiných oblastí kolem Středozemního moře.
Ve Slovenské republice, se kterou tvořila Česká republika do roku 1993 jeden stát, a kde lze předpokládat podobné složení populace slovanského původu, je udávána prevalence asi 4 % heterozygotů FVL (32). V Německu byla zjištěna prevalence heterozygotů FVL 7,8 % a heterozygotů FII G20210A 3,5 % (33). Je zde však potřeba počítat s nerovnoměrným geografickým výskytem FVL v ose sever – jih, s vyšším počtem FVL na jihu. Například heterozygotů FVL je v Bavorsku nalézáno 7,8 %, v Drážďanech jen 3,0 % (34, 35).
Pokud zvolíme z epidemiologického hlediska vhodnější ukazatel – to je frekvenci mutovaných alel, ta se v okolních státech pohybuje mezi 1,6–4 %, pokud se jedná o FVL, resp. alelu F5 1691A, a kolem 1 % pro frekvenci mutace FII, resp. alely F2 20210A. V Polsku byla u novorozenců zjištěna frekvenci alely F5 1691A ve 2,2 % a u zdravých osob středního věku v 1,6 % (36). V Německu je zjištěna frekvence alely F5 1691A 3,9 % a mutace F2 20210A 1,8 % (33). Stejné frekvence byly zjištěny i v sousedním Rakousku – 3,9% výskyt alely F5 A1691 a 1,8% výskyt alely F2 20210A) (37).
V České republice byly zatím publikovány nálezy prevalence nosičství jednotlivých hlavních trombofilních mutací u zdravých osob až na výjimky v poměrně malých souborech do 500 jedinců. Většinou nejsou také uváděny údaje o provedení testu Hardy-Weinbergovy rovnováhy. První údaje o prevalenci mutace FVL ve zdravé populaci dárců krve uvádí v roce 1998 Matýšková et al. (38). V souboru 244 dárců krve z Prahy bylo nalezeno 6,5 % heterozygotů FVL, z toho mezi ženami 8,2 % heterozygotů a mezi muži 4,92 % (frekvence mutované alely 4,1 %). Nepřímé údaje o prevalenci mutace FVL ve Východočeském kraji pak o rok později uvádí i Dulíček et al. (39). Publikuje 1,6% výskyt rezistence na aktivovaný protein C (APC-R) určený v roce 1996 koagulačním testem v souboru 500 zdravých osob – dárců krve – s tím, že u nosičů FVL se APC-R vyskytuje v 90 %. Tento údaj o možné prevalenci FVL ve východních Čechách je tedy v porovnání s výše uvedeným údajem o výskytu FVL poměrně nízký. V roce 1999 jsou Hrachovinovou et al. (40) uvedeny i první údaje o zastoupení mutace FII G20210A v české populaci – 3,4 % heterozygotů. V roce 2000 Paseka et al. (41) publikuje údaj o 6,5% prevalenci FVL, nyní v souboru 448 žen užívajících hormonální kontracepci. Další údaje o frekvenci heterozygotů FVL a FII G20210A publikuje v roce 2005 Raušová et al. (42). V neselektované populaci českých novorozenců z oblasti Praha a Středočeský kraj nachází v 5 % mutaci FVL a v 1,5 % mutaci FII G20210A.
Výskyt homozygotní mutace PAI-1 4G/4G je v evropské populaci poměrně velmi rozšířen. Například v Německu je distribuce homozygotů 4G/4G 29,4 %, heterozygotů 4G/5G 48,2 % a „wild type“ genotypu 5G/5G 22,3 % s frekvencí variantní alely 4G ve výši až 57,6 % (33). Dle Asselbergse et al. (43) je zde rozdíl v zastoupení genotypů podle pohlaví. Vyšší prevalenci genotypu 4G/4G nacházejí u žen (28,1 %) než u mužů (18 %). Údaje o prevalenci polymorfismu PAI-1 v Čechách byly zatím uvedeny ve dvou studiích. V roce 2002 Bucková et al. (44) uvádějí ve skupině zdravých osob frekvenci genotypů PAI-1 4G/4G 28,5 %, PAI-1 4G/5G 44,6 % a PAI-1 5G/5G 26,9 %. Jejich studie však byla zaměřena na zjištění vztahu výskytu variantního polymorfismu 4G/4G s alergií, který zde potvrdili. Tato asociace se zatím nejasným vysvětlením mechanismu účinku PAI-1 v etiologii alergických chorob byla popsána i v dalších studiích (45, 46). Další údaje o prevalenci genotypů PAI-1 u zdravých osob v České republice publikují v roce 2010 Hubáček et al. (47). U mužů (n 1191) nacházejí zastoupení varianty 4G/4G v 29,7 %, heterozygotů bylo 49,7 % a genotyp 5G/5G se vyskytoval ve 20,6 %. U žen (n 1368) zjišťují zastoupení variantního polymorfismu 4G/4G ve 31,8 %, heterozygotů 4G/5G bylo 46,6 % a v 21,6 % zjistili genotyp 5G/5G. Frekvence u žen ale nesplňovaly požadavek Hardyho-Weinbergovy rovnováhy (p = 0,03). Tato studie byla provedena za účelem zjištění asociace polymorfismu PAI 1 s výskytem akutního koronárního syndromu, kterou však nepotvrdila.
Z našich výsledků vyplývá, že prevalence jak mutace FVL, tak i mFII a PAI-1 se u zdravých osob v regionu Praha a střední Čechy příliš neliší od údajů citovaných výše, jak v Čechách, tak i v sousedním Německu a Rakousku, s výjimkou údajů o prevalenci FVL, resp. výskytu rezistence vůči aktivovanému proteinu C ve východních Čechách. Na Slovensku se však zdá být prevalence FVL poněkud nižší, podobně je tomu i v Polsku. Nižší prevalence FVL v populaci zdravých osob – 3,5 % heterozygotů – byla zjištěna směrem dále na východ – na Ukrajině (48). Zda tyto údaje souvisí s hypotézou o vzniku, a proto vyšší akumulaci nosičů FVL ve střední Evropě (49), však zatím nelze potvrdit. Nejvyšší zastoupení heterozygotů FVL bylo totiž zjištěno v jižním Švédsku (11 %) (26) a v Libanonu (14,2 %), dále v Sýrii (13,6 %), na Kypru (13,4 %) a v Jordánsku (12,3 %) (50).
Klinický význam mutací FVL a FII G20210A v etiopatogenezi TEN, popřípadě trombotických komplikací v graviditě, byl již opakovaně potvrzen (51) a není o tom sporu. Zatím však nebyla nalezena shoda o vlivu těchto mutací, a to i v homozygotním nebo kombinovaném výskytu při rekurenci TEN, včetně doporučení k dlouhodobé antikoagulační léčbě po prodělané TEN u homozygotů nebo v případě nálezu kombinovaného výskytu FVL a mutace FII G20210A (52–55). Patrně je při určení výše rizika opakování TEN třeba vycházet z nálezu dalších rizikových faktorů včetně rodinné anamnézy, pohlaví (u mužů je riziko rekurence vyšší), zda se jednalo o plicní embolii anebo dle výše hladiny D-dimeru. Zkouší se i skórovací model (56), který tato rizika vyhodnocuje a stanovuje pravděpodobnost rekurence TEN.
Alela 4G je spojena s vyšší hladinou inhibitoru aktivátoru plazminogenu PAI-1, tedy s nižší fibrinolytickou odpovědí, což zvyšuje riziko vzniku intravaskulární trombózy v žilním, ale i v arteriálním systému (57, 58). Působí však spíše jako další přídatný faktor jiných vrozených trombofilií, které v jejich protrombogenním účinku podporuje (59, 60). Selhání spontánní trombolýzy po vzniku žilní trombózy a její rezistence u nosičů alely 4G je nyní nazýváno jako syndrom PAI-1/4G (61). Inhibitor aktivátoru plazminogenu PAI-1 je však proteinem akutní fáze a jeho syntéza v játrech, endotelu nebo v tukové tkáni závisí mimo vlivu uvedené mutace i na aktivitě celé řady hormonů jako inzulínu, glukokortikoidů a katecholaminů, aktivitě zánětlivých cytokinů IL-1 beta, TNF-alfa nebo IL-6, či na denní době nebo léčbě statiny (62). Z těchto důvodů a pro poměrně nízké riziko vzniku TEN (O.R. 1,62), jak bylo uvedeno výše, se zatím genetické vyšetření polymorfismu PAI-1 4G/5G v praxi neprovádí. V konsenzu pěti odborných společností (63) k provádění genetických vyšetření pro určení rizika vzniku TEN je v České republice doporučeno v indikovaných situacích provádět v praxi pouze vyšetření trombofilních mutací FVL a FII G20210A.
Z vědeckého hlediska je však zajímavé, že všechny tři mutace, FV Leiden, mutace FII G20210A i PAI-1 4G, jsou též spojovány s výskytem aterotrombotických komplikací v koronárních tepnách (64). Sumární výše O.R. zjištěná na základě poolované studie výsledků 32 metaanalýz 965 individuálních studií uvedených v databázi epidemiologie lidského genomu (HuGE) není sice veliká, ale je statisticky významná, a vede tedy i k přehodnocení stávajících představ o jejich výlučné roli v patogenezi žilní TEN. Pro mutaci F2 G20210A bylo vypočteno sumární O.R. 1,31, pro mutaci FVL O.R. 1,17 a pro variantu PAI-1 4G O.R. 1,06. Navíc byla nyní nalezena souvislost i s vyšším výskytem ischemického iktu (65). Z tohoto hlediska se tedy jedná při výše určené vyšší prevalenci FVL, mutace FII G20210A a PAI-1 4G/4G v naší populaci o další důležitý poznatek pro výzkum v epidemiologii těchto závažných chorob.
Zkratky
APC-R – aktivovaný protein C
dbSNP – databáze SNP
F2 – koagulační faktor II, protrombin
F5 – koagulační faktor V
FVL – V Leiden faktor
HWE – Hardy-Weinbergovo equilibrium
O.R. – odds ratio (poměr šancí)
p – frekvence „major“ alely
P.A.R. – population attributable risk (populační atributivní riziko)
PCR – polymerázová řetězová reakce (polymerase chain reaction)
q – frekvence „minor“ alely
rs – reference SNP ID
SERPIN E1 – serpin peptidase inhibitor, clade E (inhibitor aktivátoru plazminogenu (PAI-1))
SNP – single nucleotide polymorphism
TEN – tromboembolická nemoc
Studie byla podpořena VZ MZ0VFN 2005.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Jan Kvasnička, DrSc.
Centrální hematologické laboratoře VFN
Karlovo náměstí 32, 128 00 Praha 2
fax: +420 224 966 414, e-mail: kvasnicka.jan@vfn.cz
Zdroje
1. Cohen AT, Agnelli G, Anderson FA, et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality.Thromb Haemost 2007; 98 : 756–764.
2. Oger E et EPI-GETBO Study Group. Incidence of venous thromboembolism: A community-based study in Western France. Thromb Haemost 2000; 83 : 657–660.
3. White RH. The epidemiology of venous thromboembolism. Circulation 2003; 107(Suppl 1): 4–8.
4. Silverstein MD, Heit J, Mohr DN, Petterson T M, O’Fallon M, Melton J. Trends in the incidence of deep velus thrombosis and pulmonary embolism: a 25-year population-based, cohort study. Arch Intern Med 1998;158 : 585–593.
5. Puchmayer V, Roztočil K. Praktická angiologie. Praha: Triton 2000; s. 191.
6. Chochola M, Vařejka P, Staněk F, et al. Novinky v diagnostice a léčbě hluboké žilní trombózy dolních končetin. Čas Lék čes 2000; 139 : 583.
7. Rosendaal FR. Venous thrombosis: a multicausal disease. Lancet 1999; 353 : 1167–1173.
8. Margaglione M, Grandone E. Population genetics of venous thromboembolism. A narrative review. Thromb Haemostas 2011; 105 : 221–231.
9. Gohil R, Peck G, Sharma P. The genetics of venous thromboembolism. A meta-analysis involving approximately 120,000 cases and 180,000 controls. Thromb Haemost 2009; 102 : 360–370.
10. Šimon J, Rosolová H, Mayer O jr. Základy epidemiologie kardiovaskulárních chorob. Cor Vasa 2008; 50 : 87–93.
11. Dahlbäck B. Advances in understanding pathogenic mechanisms of thrombophilic disorders. Blood 2008; 112 : 19–27.
12. Rosendaal FR, Reitsma PH. Genetics of venous thrombosis. J Thromb Haemostas 2009; 7(Suppl 1): 301–304.
13. Bertina RM, Rosendaal FR. Venous thrombosis – the interaction of genes and environment. N Engl J Med 1998; 338 : 1840–1841.
14. van Boven HH, Vandenbroucke JP, BriĎt E, Rosendaal FR. Gene-gene and gene-environment interactions determine risk of thrombosis in families with inherited antithrombin deficiency. Blood 1999; 94 : 2590–2594.
15. Bertina RM, Koeleman BP, Koster T, Rosendaal FR, Dirven RJ, de Ronde H, van der Velden PA, Reitsma PH. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994; 369 : 64–67.
16. Poort SR, osendaal FR, eitsma PH, ertina RM. A common genetic variation in the 3‘-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood 1996; 88 : 3698–3703.
17. Gehring NH, Frede U, Neu-Yilik G, Hundsdoerfer P, Vetter B, Hentze MW, Kulozik AE. Increased efficiency of mRNA 3-prime end formation: a new genetic mechanism contributing to hereditary thrombophilia. Nature Genet 2001; 28 : 389–392.
18. Eriksson P, Kallin B, van‘t Hooft FM, BĆvenholm P, Hamsten A. Allele-specific increase in basal transcription of the plasminogen–activator inhibitor 1 gene is associated with myocardial infarction. PNAS 1995; 92 : 1851–1855.
19. Ridker PM, Miletich JP, Hennekens ChH, Buring JE. Ethnic distribution of Factor V Leiden in 4047 men and women. Implications for venous thromboembolism screening. JAMA 1997; 277 : 1305–1307.
20. Rees DC, Chapman NH, Webster MT, Guerreiro JF, Rochette J, Clegg JB. Born to clot: the European burden. Br J Haematol 1999; 105 : 564–566.
21. Miyata T, Kawasaki T, Fujimura H, Uchida K, Tsushima M, Kato H. The prothrombin gene G20210A mutation is not found among Japanese patients with deep vein thrombosis and healthy individuals. Blood Coagul Fibrinolysis 1998; 9 : 451–452.
22. Zivelin A, Mor-Cohen R, Kovalsky V, Kornbrot N, Conard J, Peyvandi F, Kyrle PA, Bertina R, Peyvandi F, Emmerich J, Seligsohn U. Prothrombin 20210G-A is an ancestral prothrombotic mutation that occurred in whites approximately 24,000 years ago. Blood 2006; 107 : 4666–4668.
23. Kjellberg U, van Rooijen M, Bremme K, Hellgren M. Factor V eiden and pregnancy–related complications. Am J Obstet Gynecol 2010; 203: e1–8.
24. Bryce A, Kerlin S,Yan B, Isermann BH, Brandt JT, Sood R, Basson BR, Joyce DE, Weiler H, Dhainaut J-F. Survival advantage associated with heterozygous factor V Leiden mutation in patients with severe sepsis and in mouse endotoxemia. Blood 2003; 102 : 3085–3092.
25. Lucotte G, ercier G. Population genetics of factor V Leiden in Europe. Blood Cells Mol Dis 001; 27 : 362–367.
26. Holm J, Zöller B, Berntorp E, Erhardt L, Dahlbäc B. Prevalence of factor V gene mutation amongst myocardial infarction patients and healthy controls is higher in Sweden than in other countries. J Intern Med 1996; 239 : 221–226.
27. Bertina RM. The prothrombin 20210 G to A variation and thrombosis. Curr Opin Hematol 998; 5 : 339–342.
28. Mazoyer E, Ripoll L, Gueguen R, Tiret L, Collet JP, Sollier CB, Roussi J, Drouet L; for the FITENAT Study Group. Prevalence of factor V Leiden and prothrombin G20210A mutation in a large French population selected for nonthrombotic history: geographical and age distribution. Blood Coagul Fibrinolysis 2009; 20 : 503–510.
29. Bauduera FD, Lacombeb D. Minireview. Factor V Leiden, prothrombin 20210A, methylenetetrahydrofolate reductase 677T, and population genetics. Molecular Genetics and Metabolism 2005; 86 : 91–99.
30. Lissalde-Lavigne G, Fabbro-Peray P, Cochery-Nouvellon E, Mercier E, Ripart-Neveu S, Balducchi J-P, Daures J-P, Perneger T, Quere I, Dauzat M, Mares P, Gris J-C. Factor V Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first intended pregnancy: the matched case-control ‘NOHA first’ study. J Thromb Haemost 2005; 3 : 2178–2184.
31. Sottilotta G, ammď C, urlė G, riana V, atella C, rapani I, Lombardo V. High incidence of factor V Leiden and prothrombin G20210A in healthy southern Italians. Clin Appl Thromb Hemost 009; 15 : 356–359.
32. Honzák R. Faktor V Leiden a slovenská populace. Prakt Lék 1999; 12 : 845–850.
33. Hoppe B, Tolou F, Dörner T, Kiesewetter H, Salama A. Gene polymorphisms implicated in influencing susceptibility to venous and arterial thromboembolism: frequency distribution in a healthy German population. Thromb Haemost 2006; 96 : 465–470.
34. Schwender S, Grossmann R, Keller F. High prevalence of Factor V eiden mutation is detected in a north to south axis through Germany. Journal of Laboratory Medicine 1997; 21 : 347–353.
35. Braun A, Muller B, Rosche AA. Population study of the G1691A mutation (R 506 Q, FV eiden) in the human factor V ene that is associated with resistance to activated protein C. Hum Genet 1996; 97 : 263–264.
36. Adler G, Parczewski M, Czerska E, Loniewska B, Kaczmarczyk M, Gumprecht J, Grzeszczak W, Szybinska A, Mossakowska M, Ciechanowicz A. An age-related decrease in factor V Leiden frequency among Polish subjects. ournal of Applied Genetics 2010; 51 : 337–341.
37. Renner W, Koppel H, Hoffmann Ch, Schallmoser K, Stanger O, Toplak H, Wascher TC, Pilger E. Prothrombin G20210A, factor V eiden, and factor XIII Val34Leu: common mutation of blood coagulation factors and deep vein thrombosis in Austria. Thrombosis Res 2000; 99 : 35–39.
38. Matýšková M, Paseka J, Vorlová Z, Bulíková A, Hrachovinová I, Janků L. Prevalence of factor V eiden mutation in healthy women. In: I.Scharrer, W.Schramm eds.: 29. Hämophilie Symposion Hamburg 1998. Berlin – Heidelberg: Springer Verlag 1999; 309–311.
39. Dulíček P, Chrobák L, Kalousek I, Pešanová L, Pecka M, Stránský P. Is Factor V eiden associated with an increased risk for fetal loss ? In: I.Scharrer, W.Schramm eds. 30th Hemophilia Symposium Hamburg 1999. Berlin – Heidelberg: Springer Verlag 2001; 217 – 221.
40. Hrachovinová I, Vorlová Z, Matýšková M, Janků L. Thrombotic risk of the prothrombin gene G20210A mutation and clinical features of thrombophilia in 50 carriers of mutation. Thromb Haemostas 1999 (Suppl); Abstract No 2060, XVIIth Congress of the ISTH, Washington D.C., USA, s. 652.
41. Paseka J, Unzeitig V, Cibula D, Buliková A, Matýškova M, Chroust K. Leidenská mutace faktoru V u uživatelek hormonální antikoncepce. Čes Gynekol 2000; 65 : 156–159.
42. Raušová E, Hadačová I, Macek M. Hereditární trombofilie – jeden z odelů molekulární mediciny. Klin Biochem Metab 2005; 13 : 68–76.
43. Asselbergs FW, Williams SM, Hebert PR, Coffey CS, Hillege HL, Navis G, Vaughan DE, van Gilst WH, Moore JH. Gender-specific correlations of plasminogen activator inhibitor-1 and tissue plasminogen activator levels with cardiovascular disease-related traits. J Thromb Haemost 2007; 5 : 313–320.
44. Bucková D, Izakovicová-Hollá L, Vácha J. Polymorphism 4G/5G in the plasminogen activator inhibitor-1 (PAI-1) gene is associated with IgE-mediated allergic diseases and asthma in the Czech population. Allergy 2002; 57 : 446–448.
45. Ma Z, Paek D, Oh CK. Plasminogen activator inhibitor-1 and asthma: role in the pathogenesis and molecular regulation. Clin Exp Allergy 2009; 39 : 1136–1144.
46. Kowal K, Bodzenta-Lukaszyk A, Pampuch A, Szmitkowski M, Zukowski S, Donati MB, Iacoviello L. Analysis of -675 4 g/5 G SERPINE1 and C-159T CD14 polymorphisms in house dust mite-allergic asthma patients. J Investig Allergol Clin Immunol 2008; 18 : 284–292.
47. Hubáček JA, Staněk V, Gebauerová M, Pilipčincová A, Poledne R, Aschermann M, Skalická H, Matoušková J, Kruger A, Pěnička M, Hrabáková H, Veselka J, Hájek P, Lánská V, Adámková V, Pit‘ha J. Lack of an association between connexin-37, stromelysin-1, plasminogen activator-inhibitor type 1 and lymphotoxin-alpha genes and acute coronary syndrome in Czech Caucasians. Exp Clin Cardiol 2010; 15: e52–e56.
48. Tatarskyy P, Kucherenko A, Livshits L. Allelic polymorphism of F2, F5 and MTHFR genes in population of Ukraine. Tsitol Genet 2010; 44 : 3–8.
49. Herrmann FH, Koesling M, Schroder W, Altmann R, Jimenéz Bonilla R, Lopaciuk S, Perez-Requejo JL, Singh JR. Prevalence of factor V eiden mutation in various population. Genet Epidemiol 1997; 14 : 403–411.
50. Irani-Hakime N, Tamim H, Elias G, Finan RR, Daccache JL, Almawi WY. High Prevalence of Factor V utation (Leiden) in the Eastern Mediterranean. Clinical Chemistry 2000; 46 : 134–136.
51. Wu O, Robertson L, Twaddle S, t al. Screening for thrombophilia in high-risk situations: systematic review and cost-effectiveness analysis. The Thrombosis: Risk and Economic Assessment of Thrombophilia Screening (TREATS). Health Technol Assess 2006; 10 : 1–110.
52. De Stefano V, Martinelli I, Mannucci PM, Paciaroni K, Chiusolo P, Casorelli I, Rossi E, Leone G. The risk of recurrent deep venous thrombosis among heterozygous carriers of both factor V Leiden and the G20210A prothrombin mutation. New Eng J Med 1999; 341 : 801–806.
53. Evaluation of Genomic Applications in Practice and Prevention (EGAPP) Working Group. Collaborators: Berg AO, Botkin J, Calonge N, Campos–Outcalt D, Haddow JE, Hayes M, Kaye C, Klein RD, Offit K, Pauker SG, Piper M, Richards CS, Scott JA, Strickland OL, Teutsch S, Veenstra DL. Recommendations from the EGAPP Working Group: routine testing for Factor V Leiden (R506Q) and prothrombin (20210G>A) mutations in adults with a history of idiopathic venous thromboembolism and their adult family members. Genet Med 2011; 13 : 67–76.
54. Marchiori A, Mosena L, Prins MH, Prandoni P. The risk of recurrent venous thromboembolism among heterozygous carriers of factor V Leiden or prothrombin G20210A mutation. A systematic review of prospective studies. Haematologica 2007; 92 : 1107–1114.
55. Kyrle PA, Rosendaal FR, Eichinger S. Risk assessment for recurrent venous thrombosis. Lancet 2010; 376(9757): 2032–2039.
56. Eichinger S, Heinze G, Jandeck LM, Kyrle PA. Risk assessment of recurrence in patients with unprovoked deep vein thrombosis or pulmonary embolism: the Vienna prediction model. Circulation 2010; 121 : 1630–1636.
57. Tsantes AE, Nikolopoulos GK, Bagos PG, Bonovas S, Kopterides P, Vaiopoulos G. The effect of the plasminogen activator inhibitor–1 4G/5G polymorphism on the thrombotic risk. Thromb Res 2008; 122 : 736–742.
58. Stegnar M, Uhrin P, Peternel P, Mavri A, Salobir-Pajnic B, Stare J, Binder BR. The 4G/5G sequence polymorphism in the promoter of plasminogen activator inhibitor-1 (PAI-1) gene: relationship to plasma PAI-1 level in venous thromboembolism. Thromb Haemost 1998; 79 : 975–979.
59. Seguí R, Estellés A, Mira Y, EspaĖa F, Villa P, Falcó C, Vayá A, Grancha S, Ferrando F, Aznar J. PAI-1 promoter 4G/5G genotype as an additional risk factor for venous thrombosis in subjects with genetic thrombophilic defects. Br J Haematol 2000; 111 : 122–128.
60. Sartori MT, Danesin C, Saggiorato G, Tormene D, Simioni P, Spiezia L, Patrassi GM, Girolami A. The PAI-1 gene 4G/5G polymorphism and deep vein thrombosis in patients with inherited thrombophilia. Clin Appl Thromb Hemost 2003; 9 : 299–307.
61. Bern MM, McCarthy N. Failure to lyse venous thrombi because of elevated plasminogen activator inhibitor 1 (PAI-1) and 4G polymorphism of its promotor genome (The PAI–1/4G Syndrome). Clin Appl Thromb Hemost 2010; 16 : 574–578.
62. Kruithof EKO. Regulation of plasminogen activator inhibitor type I gene expression by inflammatory mediators and statins. Thromb Haemost 2008; 100 : 969–975.
63. Kvasnička J. Dědičné trombofilie – doporučení k rovádění genetických testů v linické praxi. Čas Lék čes 2010; 149 : 468–471.
64. Kitsios GD, Dahabreh IJ, Trikalinos TA, Schmid CH, Huggins GS, Kent DM. Heterogeneity of the phenotypic definition of coronary artery disease and its impact on genetic association studies. Circ Cardiovasc Genet 2011; 4 : 58–67.
65. Bentley P, Peck G, Smeeth L, Whittaker J, Sharma P. Causal relationship of susceptibility genes to ischemic stroke: comparison to ischemic heart disease and biochemical determinants. Plos One 2010; 5: e9136.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Moravský kazuistický seminářČlánek Geny KRT1, KRT10Článek KnihaČlánek Julius AxelrodČlánek Relabujúca polychondritída
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- 12. konference Tabák a zdraví v Lékařském domě
- Spolek českých lékařů v Praze
- Mezinárodní konference Analytical Cytometry VI
- XVIII. jihočeské onkologické dny
- XXIV. kurz endoskopické endonazální chirurgie
- Beskydské alergologické a imunologické dny 2011
- Moravský kazuistický seminář
- Otologický den k 85. narozeninám prof. MUDr. Lubomíra Faltýnka, DrSc.
- 11. setkání lékařů ČR a SR v Litomyšli
- Prof. Koďousek pětaosmdesátiletý
- Geny KRT1, KRT10
- Kniha
- Julius Axelrod
- Morfologie a etiopatogeneze aneuryzmatu břišní aorty
- Plánované akce odborných složek ČLS JEP
- Relabujúca polychondritída
- Plánované akce odborných složek ČLS JEP
- Mužský hypogonadismus a civilizační nemocnění*
- Jodový deficit – současný stav a problémy
- Současný výskyt diabetes mellitus typu 1 a autoimmunitní tyroiditidy – klinické aspekty
- Abdominální obezita a metabolický syndrom u dospívajících – výsledky studie COPAT(Childhood Obesity Prevalence and Treatment)
- Prevalence trombofilních mutací FV Leiden, protrombinu G20210A a PAI-1 4G/5G a jejich vzájemných kombinací v souboru 1450 zdravých osob středního věku v regionu Praha a střední Čechy (výsledky real-time PCR analýzy FRET)
- Problematika činnosti etických komisí v České republice*
-
Ostravský den preventivní pediatrie
16. března 2012, Ostrava – hotel Clarion Congress - Projekt spolupráce a kategorizace pracovišť pro léčbu závislosti na tabáku v Evropě
- XI. sjezd České společnosti chirurgie ruky ČLS JEP s mezinárodní účastí
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prevalence trombofilních mutací FV Leiden, protrombinu G20210A a PAI-1 4G/5G a jejich vzájemných kombinací v souboru 1450 zdravých osob středního věku v regionu Praha a střední Čechy (výsledky real-time PCR analýzy FRET)
- Relabujúca polychondritída
- Mužský hypogonadismus a civilizační nemocnění*
- XI. sjezd České společnosti chirurgie ruky ČLS JEP s mezinárodní účastí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy