-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
Dynamics of interleukin 6 levels in the patients with cardiogenic and septic shock and in a control group of patients with uncomplicated AMI
Introduction:
Cardiogenic shock (CS) is the leading cause of mortality in patients with acute myocardial infarction (AMI). Inflammatory response seems to be common response in patients with AMI, especially those with CS. We have therefore conducted a study to determine diagnostic and prognostic utility of interleukin 6 (IL6) levels in the cohort of patients with cardiogenic and septic shock (SS) and in a control group of patients with uncomplicated AMI.Methods:
In this prospective study 71 patients fulfilled the inclusion criteria: 30 patients with cardiogenic shock, 21 patients with septic shock and 20 patients with ST elevation myocardial infarction (STEMI). Plasma levels of IL6 were measured at 8 time points. The main endpoint was 3 month mortality.Results:
We have shown that the highest IL6 levels during the first week were recorded in patients with septic shock with peak value at admission. The maximum level of IL6 was detected between 12 to 24 hours after the onset of MI among patients with cardiogenic shock. According to Receiver operating characteristic (ROC) statistics levels of IL6 > 357 pg/ml at admission (AUC 0.730, p = 0.031) were typical for patients with CS in comparison with control group of STEMI patients. Values of IL6 > 1 237 pg/ml at admission and > 1 071 pg/ml at 24 hours (after admission?) were typical for thouse in septic shock in comparison with CS patients. We found only a non-significant trend of IL6 for the prediction of mortality in the cohort of CS patients for levels ≥ 1 854 pg/ml (AUC 0.769, p = 0.066) sampled 12 hours after admission. There was no association of plasma levels of IL6 with mortality in septic shock patients.Conclusions:
Patients with cardiogenic shock demonstrated more pronounced cytokine response as evidenced by increased levels of IL6 compared to patients with uncomplicated STEMI. Levels of IL6 peaked in SS patients at admission, in CS patients 12–24 hours after admission. In daily clinical practice routine measurement of IL6 levels for prediction of prognosis both in cardiogenic and septic shock are of little value mainly due to significant interindividual variability of IL6 values.Keywords:
cardiogenic shock – interleukin 6 – myocardial infarction – predictor – prognostic – septic shock
Autoři: Jiří Pařenica 1,3; Jan Maláska 4; Jiří Jarkovský 5; Kateřina Helánová 3; Petr Jabandžiev 2; Jaroslav Michálek 2; Zuzana Veselková 2; Simona Littnerová 5; Lenka Kubková 1,3; Roman Gál 4; Pavel Ševčík 6; Monika Pávková Goldbergová 7; Jiří Litzman 8; Zdena Čermáková 9,10; Jindřich Špinar 1,3
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 1; Lékařská fakulta MU, Brno, děkan prof. MUDr. Jiří Mayer, CSc. 2; Mezinárodní centrum klinického výzkumu FN u sv. Anny, Brno, ředitel Gorazd B. Stokin, M. D., MSc., Ph. D. 3; Klinika anesteziologie, resuscitace a intenzivní medicíny LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Roman Gál, Ph. D. 4; Institut biostatistiky a analýz LF MU, Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 5; Klinika anesteziologie, resuscitace a intenzivní medicíny FN Ostrava, přednosta prof. MUDr. Pavel Ševčík, CSc. 6; Ústav patologické fyziologie LF MU, Brno, přednostka prof. MUDr. Anna Vašků, CSc. 7; Ústav klinické imunologie a alergologie LF MU a FN u sv. Anny, Brno, přednosta prof. MUDr. Jiří Litzman, CSc. 8; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Milan Dastych, CSc., MBA 9; Katedra laboratorních metod LF MU, Brno, přednosta doc. MUDr. Milan Dastych, CSc., MBA 10
Vyšlo v časopise: Vnitř Lék 2014; 60(2): 114-122
Kategorie: Původní práce
Souhrn
Úvod:
Kardiogenní šok (KŠ) je hlavní příčinou úmrtí pacientů hospitalizovaných pro akutní infarkt myokardu. V rámci akutního infarktu myokardu a kardiogenního šoku byl pozorován rozvoj zánětlivé odpovědi. Cílem naší práce bylo popsat dynamiku interleukin 6 (IL6) u pacientů v kardiogenním šoku a porovnat ji s dynamikou interleukinu 6 u pacientů v septickém šoku (SŠ) a kontrolní skupinou pacientů s nekomplikovaným akutním infarktem myokardu s elevacemi ST (STEMI) a vyhodnotit jeho diagnostické a prognostické možnosti.Metodika a pacienti:
V prospektivní observační studii bylo zařazeno celkem 71 pacientů, kteří splnili zařazovací kritéria: 30 pacientů v kardiogenním šoku, 21 pacientů v septickém šoku a 20 pacientů se STEMI. Hladiny IL6 byly stanoveny celkem 8krát po dobu 3 měsíců. Hlavním sledovaným parametrem byla 3měsíční mortalita.Výsledky:
Nejvyšší hodnoty IL6 byly detekovány v průběhu 1. týdne u pacientů v septickém šoku s maximální hodnotou při přijetí. U pacientů v KŠ dosáhly hladiny IL6 maxima za 12–24 hodin od vzniku infarktu. Podle ROC analýzy byly zvýšené hodnoty IL6 > 357 pg/ml při přijetí (AUC 0,730; p = 0,031) typické pro KŠ v porovnání s kontrolní skupinou pacientů se STEMI. Hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml po 24 hodinách byly dle ROC analýzy charakteristické pro pacienty v SŠ v porovnání s pacienty v KŠ. Zjistili jsme pouze statisticky nesignifikantní trend pro IL6 v predikci mortality u pacientů v kardiogenním šoku pro hodnoty ≥ 1 854 pg/ml (AUC 0,769, p = 0,066) stanovené 12 hodin od přijetí. Nezjistili jsme žádný význam IL6 v predikci 3měsíční mortality u pacientů v septickém šoku.Závěr:
Pacienti v kardiogenním šoku produkují vyšší hladinu prozánětlivého IL6 ve srovnání s pacienty se STEMI. Maximálních hodnot IL6 dosahují pacienti v septickém šoku při přijetí na anesteziologické oddělení, pacienti v kardiogenním šoku za 12–24 hodin od přijetí. Vzhledem k výrazné interindividuální variabilitě hladiny IL6 jak u pacientů v kardiogenním, tak i septickém šoku se rutinní použití IL6 v klinické praxi nejeví jako přínosné pro predikci prognózy pacientů v kardiogenním či septickém šoku.Klíčová slova:
infarkt myokardu – interleukin 6 – kardiogenní šok – prognóza – septický šokÚvod
Pacienti s akutním infarktem myokardu (AIM) komplikovaným kardiogenním šokem (KŠ) mají špatnou prognózu s vysokou hospitalizační mortalitou 50–60 % navzdory moderní intenzivní péči [1,2] a revaskularizační léčbě [3]. U části pacientů v KŠ se nesetkáme s typickým obrazem daným kombinací těžké systolické dysfunkce levé komory doprovázeným výrazným zvýšením periferní vaskulární rezistence (systemic vascular resistance – SVR) vedoucím k obrazu studené periferie a mramorované kůže. Výsledky rozsáhlé prospektivní studie SHOCK trial provedené u pacientů s AIM komplikovaným KŠ ukázaly, že minimálně 20 % pacientů má projevy systémové zánětlivé reakce (systemic inflammatory response syndrome – SIRS) provázené normální nebo sníženou periferní vaskulární rezistencí, přičemž u 1/3 z těchto pacientů byla vyloučena přítomnost infekce [4]. Řada prací jednoznačně prokázala, že v průběhu AIM dochází ke zvýšení zánětlivých markerů, jako je C-reaktivní protein (CRP) [5,6] nebo interleukin 6 (IL6) [7]. Zvýšená plazmatická hladina IL6 byla ve skupině pacientů s AIM komplikovaným KŠ signifikantním prediktorem 30denní mortality, a to u pacientů s úspěšnou revaskularizací i bez ní [8]. V další práci Geppert et al srovnávali hodnoty IL6 mezi pacienty v kardiogenním a septickém šoku. Pacienti v SŠ měli vyšší hodnoty IL6 ve srovnání s pacienty v KŠ. Hodnota IL6 ve skupině pacientů v KŠ významně závisela na celkové tíži stavu daném rozvojem multiorgánového selhání (multiple organ failure – MOF). Hodnoty IL6 ve skupině pacientů v KŠ s MOF byli signifikantně vyšší ve srovnání s hladinami IL6 u pacientů v KŠ bez MOF a srovnatelné s hladinami IL6 u pacientů v SŠ [9]. Ve skupině pacientů v septickém šoku spíše než maximální hladiny IL6 byly s nepříznivou prognózou spojeny přetrvávající vysoké hladiny IL6 [10]. Při interpretaci těchto výsledků je nutné si uvědomit, že hladiny IL6 u pacientů v SŠ výrazně kolísají [11–13] a tvorba cytokinů jako odezva organizmu na sepsi je významně ovlivněna etiologickým agens septického stavu a původem infekce [14]. Cílem naší práce je popsat rozvoj zánětlivé reakce pomocí IL6 u pacientů s AIM komplikovaným kardiogenním šokem a porovnat ho jednak s kontrolní skupinou pacientů s nekomplikovaným akutním infarktem myokardu s elevacemi ST a zároveň ho porovnat se skupinou pacientů v SŠ, u kterých předpokládáme vysoce vystupňovanou zánětlivou reakci.
Pacienti a metodika
Protokol studie byl schválen Etickou komisí FN Brno a je v souladu s etickými principy Helsinské deklarace. Účastníci studie podepsali informovaný souhlas s účastí ve sledování při vstupu do studie nebo po nabytí plného vědomí, a v případě, že pacient vědomí nenabyl, byl souhlas získán od nejbližšího příbuzného.
Populace
Soubor představuje pacienty v kardiogenním šoku, septickém šoku a pacienty s akutním infarktem myokardu s elevacemi ST (STEMI) bez KŠ zařazené v období od ledna roku 2008 do června roku 2010. Pacienti v septickém šoku přijatí na pracoviště anesteziologické a resuscitační medicíny byli zařazeni do studie co nejdříve od okamžiku, kdy splnili kritéria pro septický šok, pacienti v KŠ a pacienti se STEMI byli zařazeni do studie při přijetí na koronární jednotku. Kritéria pro septický šok odpovídají kritériím International Sepsis Definitions Conference, ACCP/SCCM, konkrétně kritériím sepse s trvalou hypotenzí (systolický krevní tlak ≤ 90 mm Hg) přes adekvátní nálož tekutin (> 30 ml/kg) [15]. SIRS byla definována podle publikovaných kritérií [16]. Sepsí indukované selhání jakéhokoliv orgánu nesmělo při vstupu do studie trvat déle než 24 hodin.
Kardiogenní šok byl definován jako setrvalá hypotenze trvající minimálně 30 min se systolickým tlakem ≤ 90 mm Hg přes adekvátní plnění levé komory (tlak v zaklínění v plícnici – PCWP nebo enddiastolický tlak levé komory – LVEDP musel být > 15 mm Hg) nebo pacient se srdečním selháním vyžadoval podání vazopresorů (dopamin ≥ 7 µg/kg/min nebo noradrenalin ≥ 0,15 µg/kg/min) po dobu minimálně 30 min k udržení systolického krevního tlaku > 90 mm Hg a zabránění orgánové hypoperfuzi (oligurii < 20 ml/hod, encefalopatii) a periferní hypoperfuzi (studené končetiny, periferní cyanóza a mramorovaná kůže, laktátová acidóza) [17].
Diagnóza STEMI byla založena na symptomech odpovídajících myokardiální ischemii s odpovídajícími EKG známkami akutní ischemie (elevace úseku ST nebo nový blok levého Tawarova raménka) a elevací markerů myokardiální nekrózy (troponin T) [18].
Vylučovacími kritérii byl nesouhlas s účastí ve studii, hematologická či jiná malignita, známé systémové autoimunitní onemocnění, trauma nebo popáleniny vedoucí k rozvoji septického šoku, a těhotenství.
Odběr krevních vzorků
Krevní vzorky byly odebrány ihned při zařazení pacientů do studie (vzorek č. 1), po 12 hodinách (vzorek č. 2), po 24 hodinách (vzorek č. 3) a dále v následujících dnech vždy v 6 hodin ráno: 3. den (přibližně 36–48 hodin od přijetí – vzorek č. 4), 4. den (vzorek č. 5), 5. den (vzorek č. 6), 7. den nebo při propuštění (vzorek č. 7) a po 3 měsících (vzorek č. 8). Vzorky byly ihned centrifugovány v chlazené centrifuze a vzorky séra a plazmy byly uchovávány až do zpracování při -80 °C. Centrifuga i hlubokomrazící boxy byly umístěny přímo na koronární jednotce, kde probíhalo zpracování vzorků. Rutinní biochemické a hematologické vyšetření bylo prováděno při přijetí. Hodnota hs-troponinu T byla u pacientů s akutním infarktem myokardu stanovena vždy 24 hodin od vzniku symptomů. U všech pacientů v septickém šoku bylo při přijetí stanoveno APACHE II skóre (Acute Physiology and Chronic Health Evaluation) [19]. Tříměsíční sledování bylo prováděno v rámci ambulantní kontroly.
Laboratorní metody
Ve vzorcích plazmy získaných zpracováním periferní krve pacientů byly měřeny hladiny IL6 pomocí kitu Th1/Th2 11-plex (Bender Medsystems GmbH, Vídeň, Rakousko) metodikou založenou na detekci analytu pomocí kuliček potažených monoklonální protilátkou. Vzorky byly ředěny 10krát pufrem a analyzovány podle pokynů výrobce na 96jamkové destičce včetně 2 stripů pro 8 hodnot standardní křivky a blanku. Koncentrace analytů přímo úměrná intenzitě fluorescence byla měřena pomocí průtokové cytometrie na systému FACSArray (BD Biosciences, San Jose, CA, USA) a byla vyjádřena v pg/ml. Data získaná z BD FACSArray software verze 1.0.4 (BD Biosciences, San Jose, CA, USA) byla analyzována pomocí softwaru FlowCytomix™ Pro 2.4 (BD Biosciences, San Jose, CA, USA).
Troponin T byl stanoven pomocí elektrochemiluminiscence na analyzátoru Cobas® 8000 (Roche Diagnostics), rozsah měření 0,005–10 pg/ml, detekční limit 0,005 pg/ml. C-reaktivní protein (CRP) byl stanoven imunoturbidimetricky na analyzátoru Cobas® 8000 (Roche Diagnostics), rozsah měření 1,0–350 mg/l, detekční limit 0,3 mg/l.
Statistická analýza
Koncentrace markerů byly popsány mediánem a 5.–95. percentilovým rozsahem. Analýza rozptylu byla využita pro srovnání hodnot markerů mezi skupinami pacientů; analýza byla z důvodu porušení předpokladu normality dat provedena na logaritmicky transformovaných hodnotách. ROC (receiver operating characteristic) analýza byla využita pro definici cut-off markerů odlišující pacienty se septickým a kardiogenním šokem a cut-off pro mortalitu pacientů; definované cut-off byly popsány pomocí senzitivity a specificity.
Výsledky
Charakteristika populace
Do analýzy bylo zařazeno celkem 30 pacientů v kardiogenním šoku, 21 pacientů v septickém šoku a 20 pacientů s nekomplikovaným průběhem STEMI. Základní charakteristika pacientů je uvedena v tab. 1. Všechny 3 skupiny pacientů byly srovnatelné v základních demografických parametrech (věk, BMI a pohlaví). Pacienti v septickém šoku měli vstupně nejvyšší tepovou frekvenci, intraaortální balónková kontrapulzace byla zavedena u 40 % pacientů v KŠ a kontinuální podporu funkce ledvin vyžadovalo 13 % pacientů v KŠ a 57 % pacientů v SŠ. Umělou plicní ventilaci vyžadovalo 93 % pacientů v KŠ, všichni pacienti v SŠ a přechodně 1 pacient v kontrolní skupině po resuscitaci pro fibrilaci komor v úvodu akutního STEMI. Medián maximální hodnoty C-reaktivního proteinu byl nejvyšší u pacientů v SŠ (310 mg/l), u pacientů v KŠ byl výrazně vyšší ve srovnání s kontrolní skupinou pacientů se STEMI (166 vs 23 mg/l).
Tab. 1. Základní charakteristika souboru pacientů v kardiogenním šoku, septickém šoku a kontrolní skupiny se STEMI 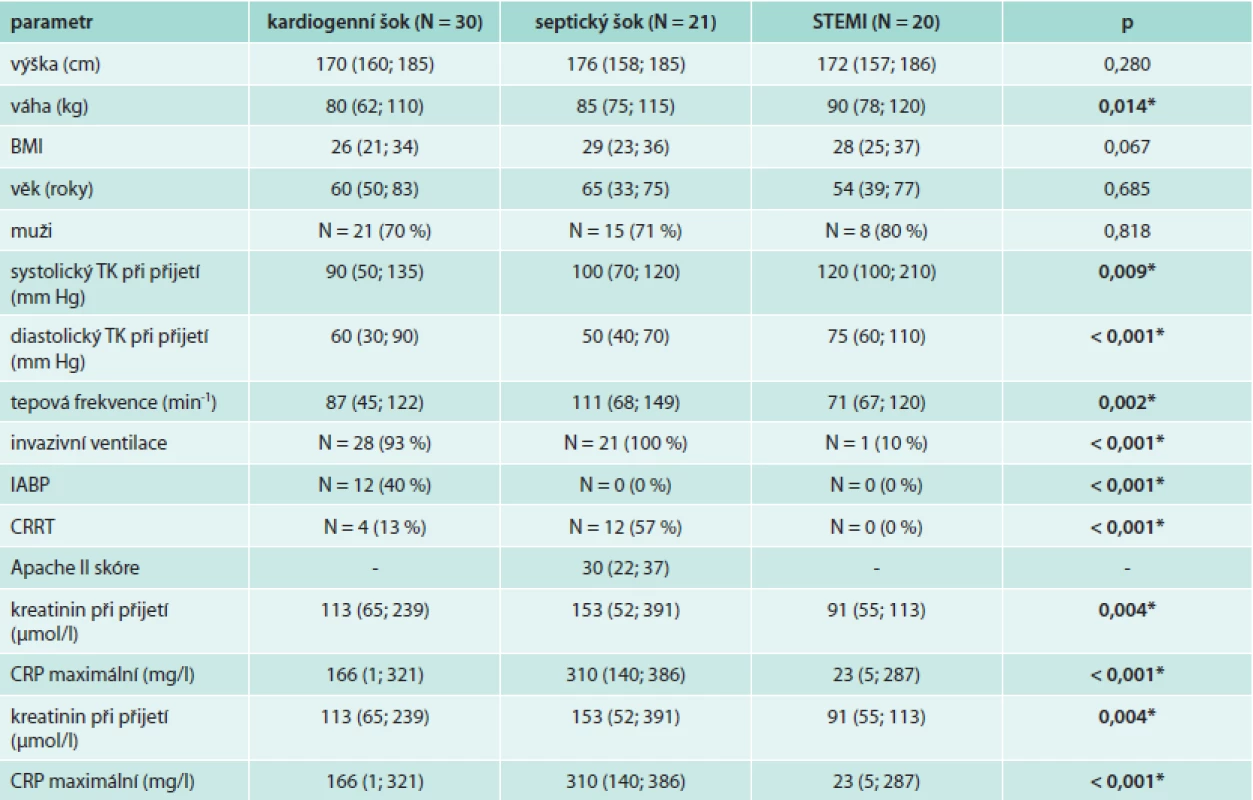
Hodnoty kontinuálních proměnných jsou uvedeny jako medián (5.–95. percentil), p (Kruskal-Wallis test nebo ML χ2) TK – krevní tlak APACHE II – Acute Physiology and Chronic Health Evaluation II BMI – Body Mass Index CRRT – kontinuální podpora renálních funkcí IABP – intraaortální balónková kontrapulzace Dynamika hodnot interleukinu 6 ve sledovaných skupinách
Jak dokládají hodnoty plazmatických hladin IL6 (tab. 2 a graf 1), existuje především u pacientů v septickém šoku výrazný interindividuální rozptyl hodnot, hodnoty 5.-95. percentilu IL6 při přijetí se pohybují v rozmezí 386–189 316 pg/ml. Pacienti v septickém a kardiogenním šoku mají při přijetí v porovnání s kontrolní skupinou pacientů se STEMI statisticky významně vyšší hodnoty IL6. Hodnoty IL6 byly ve skupině pacientů v SŠ v průběhu prvních 4 dní významně vyšší v porovnání s pacienty v KŠ. Pacienti v SŠ měli nejvyšší hodnoty při přijetí s poklesem v prvních 24 hodinách a následným vzestupem 3. den (graf 1, s. 118). Pacienti v KŠ dosáhli maximálních hodnot za 12 hodin od přijetí (tedy asi 16 hodin od vzniku infarktu myokardu), a pak postupně docházelo k poklesu hodnot na úroveň srovnatelnou s hodnotami IL6 v kontrolní skupině pacientů se STEMI. U většiny pacientů v KŠ byl zaznamenám přechodný mírný vzestup hodnot IL6 (3.–5. den od přijetí), který však není v grafu 1 (s. 118) jednoznačně patrný vzhledem ke značnému rozptylu hodnot mezi jednotlivými pacienty. Toto přechodné zvýšení hodnot IL6 u pacientů v KŠ nelze vysvětlit jednoznačně přítomností klinických známek systémové zánětlivé reakce (SIRS), která byla diagnostikována u 66 % pacientů v KŠ (graf 2, s. 120), ani rozvojem infekce, která byla diagnostikována u 33 % pacientů v KŠ (většinou se jednalo o pneumonie u pacientů na ventilátorech a o infekce močových cest, graf 3, s. 121).
Tab. 2. Hodnoty plazmatických hladin IL6 během prvních 24 hodin od přijetí v jednotlivých sledovaných skupinách 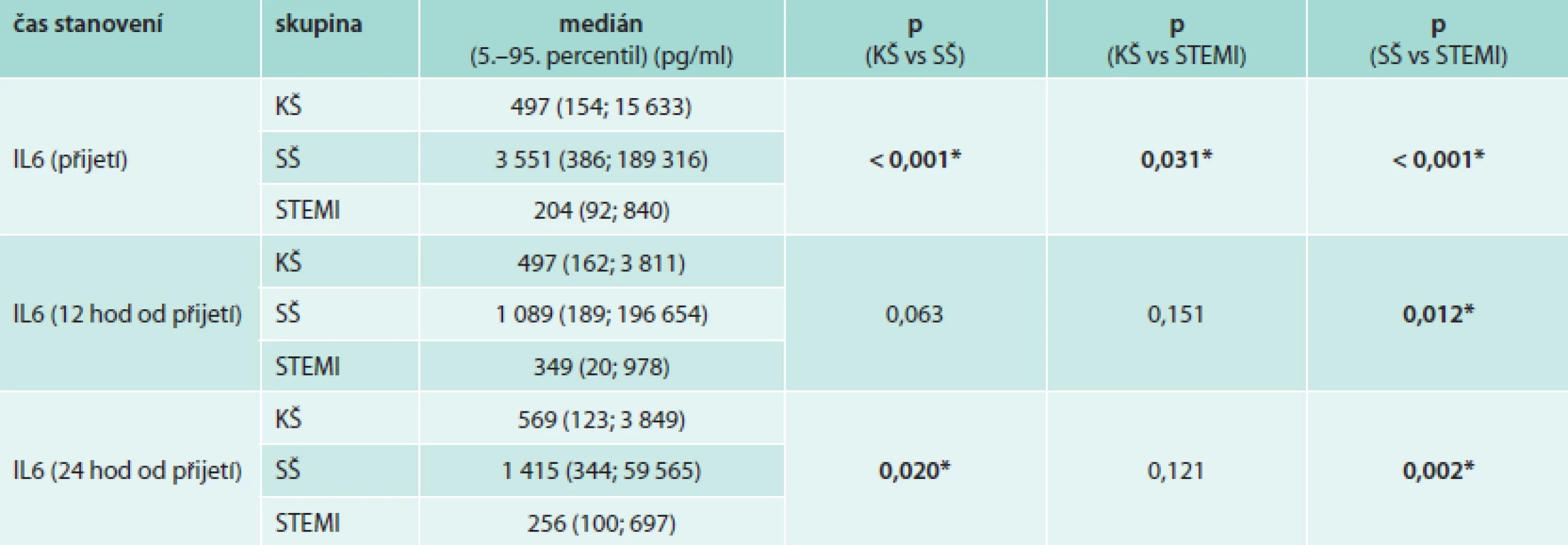
*signifikantní rozdíl, p (Kruskal-Wallis test) Graf 1. Srovnání hodnot interleukinu 6 v čase u pacientů v septickém šoku, kardiogenním šoku a u kontrolní skupiny pacientů se STEMI 
Pro srovnání hodnot IL6 mezi skupinami byla použita analýza rozptylu (ANOVA). Graf 2. Průběh IL6 u pacientů v kardiogenním šoku podle přítomnosti SIRS 
Graf 3. Průběh IL6 u pacientů v kardiogenním šoku podle diagnostikované infekce 
Rozdíly mezi hodnotami interleukinu 6 ve sledovaných skupinách
Byla provedena analýza ROC ke stanovení cut-off hodnot, které by dovolily rozlišení hodnot IL6 typických pro KŠ, SŠ a nekomplikovaný AIM. Hodnoty IL6 > 357 pg/ml při přijetí byly typické pro pacienty v kardiogenním šoku v porovnání s pacienty s nekomplikovaným STEMI (tab. 3a). Hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml po 24 hodinách byly charakteristické pro pacienty v SŠ v porovnání s pacienty v KŠ.
Tab. 3a. Analýza ROC pro stanovení cut-off hodnoty IL6 rozlišující pacienty v kardiogenním šoku a pacienty s nekomplikovaným STEMI 
*signifikantní AUC Tab. 3b. Analýza ROC pro stanovení cut-off hodnoty IL6 rozlišující pacienty v kardiogenním a septickém šoku 
*signifikantní AUC Interleukin 6 jako prediktor mortality
Mortalita byla během 3měsíčního sledování ve skupině pacientů v KŠ 42,8 %, ve skupině pacientů v SŠ 31,8 %. Přestože byl medián hodnot IL6 v prvních 24 hodinách ve skupině zemřelých pacientů v KŠ i SŠ vyšší v porovnání s pacienty přežívajícími (tab. 4), rozdíl nebyl statisticky významný a podle provedené analýzy ROC byl pouze u pacientů v KŠ po 12 hodinách při hodnotě IL6 > 1 854 pg/ml trend k predikci nepříznivé prognózy (při senzitivitě 0,5 a specificitě 1,0). Ve skupině pacientů v KŠ mělo vstupně 5 pacientů hodnoty IL6 nad 1 854 pg/ml (228 798 pg/ml, 15 633 pg/ml, 8 787 pg/ml, 4 047 pg/ml a 2 356 pg/ml) a všichni tito pacienti zemřeli do 48 hodin.
Tab. 3. Analýza ROC k predikci mortality pomocí IL6 u pacientů v septickém a kardiogenním šoku 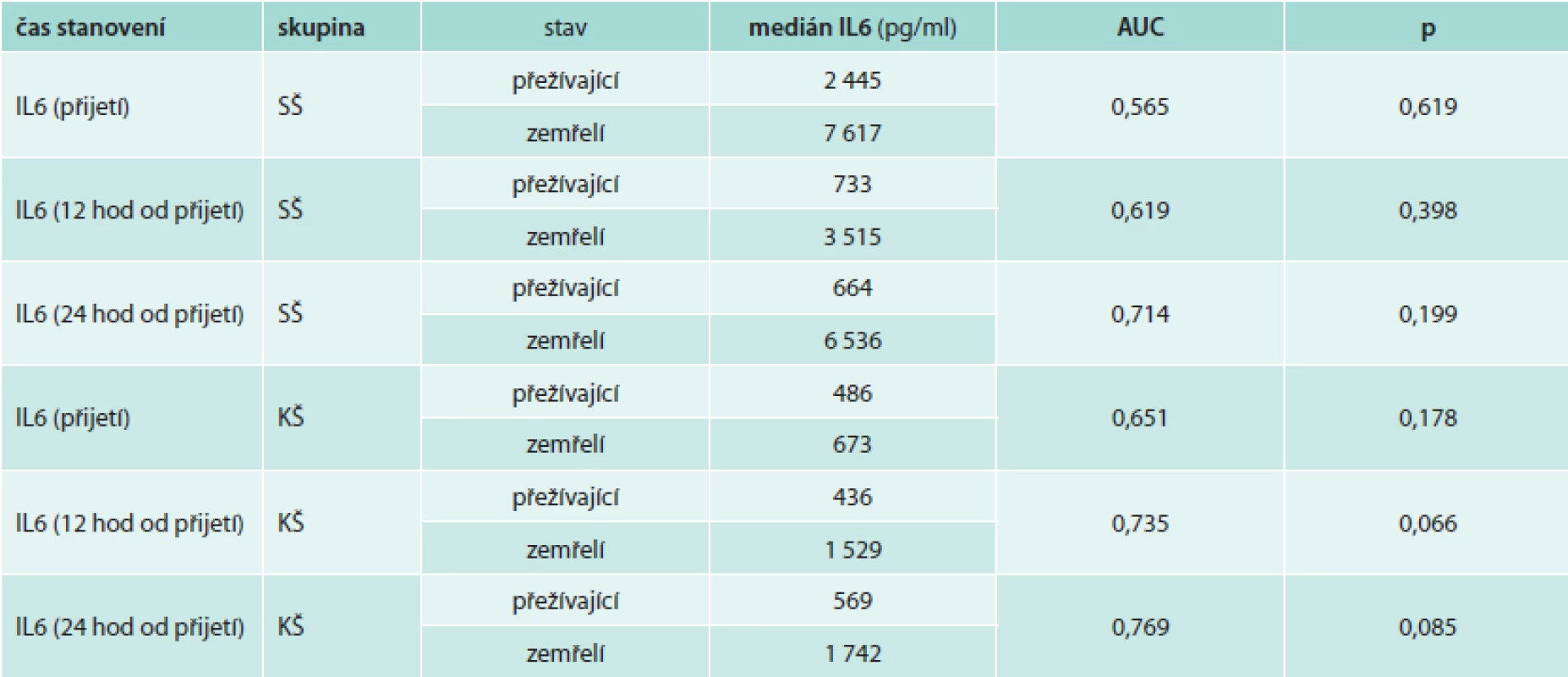
Diskuse
Hlavní výsledky naší práce lze shrnout do následujících bodů:
- při hodnocení hladin IL6 existuje výrazný interindividuální rozdíl mezi pacienty se stejnou základní diagnózou
- pacienti v septickém šoku mají v průběhu prvních 4 dní významně vyšší hodnoty IL6 ve srovnání s pacienty v KŠ a pacienty s nekomplikovaným STEMI; u pacientů v SŠ dosahují hodnoty IL6 maxima nejčastěji při přijetí, u pacientů v kardiogenním šoku hodnoty IL6 dosahují maxima za 12 hodin od přijetí; v obou skupinách dochází k dalšímu mírnému přechodnému vzestupu hodnoty IL6 mezi 3.–5. dnem od přijetí
- podle výsledků provedené analýzy ROC jsou hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml za 24 hodin od přijetí typické spíše pro pacienty v SŠ v porovnání s pacienty v KŠ
- vysoké hodnoty IL6 > 1 854 pg/ml u pacientů v KŠ jsou spojeny s nepříznivou prognózou, ale k časnému úmrtí došlo i u pacientů s hodnotami IL6 kolem 400 pg/ml
V současné době existuje pouze limitované množství literárních informací, které by srovnávaly pacienty v KŠ a SŠ. Geppert et al vyhodnotili hladiny IL6 u 51 pacientů v KŠ a 26 pacientů v SŠ, kontrolní skupinu tvořilo 11 pacientů hospitalizovaných na jednotce intenzivní péče, kteří nebyli v kritickém stavu [9]. Absolutní hodnoty IL6 této a naší práce nelze zcela porovnat, protože laboratorní metodika stanovení byla odlišná (Geppert et al použili metodu ELISA, R&D system, Wiesbaden, Německo), medián hodnot IL6 byl u pacientů v KŠ 112 pg/ml (95% CI 1–156), u pacientů v SŠ 250 pg/ml (95% CI 196–319). Nicméně byl prezentován obdobný trend jako v naší práci: pacienti v kardiogenním šoku měli významně vyšší hodnoty IL6 než kontrolní skupina pacientů v nekritickém stavu, ale nižší hodnoty IL6 než pacienti v SŠ. Výše hodnot IL6 u pacientů v KŠ korelovala s přítomností multiorgánového selhání a pacienti v KŠ s multiorgánovým selháním měli hodnoty IL6 srovnatelné s pacienty v SŠ.
Brunkhorst et al sledovali rozvoj zánětlivé reakce u 29 pacientů v KŠ, u kterých nebyla zjištěna žádná infekce a srovnávali ji se zánětlivou reakcí u 26 pacientů v septickém šoku [20]. IL6 byl stanoven opět jinou metodikou (EASIA – enzyme amplified sensitivity immunoassay, Medgenix Diagnostics, Fleurus, Belgie). Pacienti v SŠ měli rovněž v porovnání s pacienty v KŠ vyšší vstupní (1 640 vs 500 pg/ml) a maximální hodnoty IL6 (1 616 vs 629 pg/ml). Podobně jako v naší práci měli pacienti v SŠ maximální hodnoty IL6 při přijetí a poté došlo k jejich poklesu, pacienti v KŠ dosáhli maximálních hodnot IL6 za 24 hodin.
V práci Pudila et al byla demonstrována kinetika IL6 u pacienta se STEMI komplikovaným kardiogenním šokem. Byla pozorována 2 signifikantní maxima, první peak po 9 hodinách (362 pg/ml), poté došlo k poklesu a následnému vzestupu IL6 až na hodnotu 859 pg/ml [21]. Podobný průběh byl zaznamenán i u větší části pacientů v KŠ v naší práci. Vzhledem k velké interindividuální variabilitě hodnot IL6 a skutečnosti, že doba 2. maxima IL6 byla v závislosti na jednotlivých pacientech 3.–5. den, a vyhodnoceni byli i pacienti zemřelí před rozvojem 2. maxima, není druhý peak z grafu 1 (s. 118) zřetelně patrný. Zvažovali jsme, zda 2. maximum nesouvisí s rozvojem zánětlivé reakce nebo rozvojem infekce, ale podobný průběh hodnot IL6 s dvěma maximy měli i pacienti bez prokázané infekce nebo bez klinických projevů SIRS (graf 2 a graf 3).
V klinické praxi se setkáváme s pacienty v kardiogenním šoku, u kterých se časně do 24–48 hodin rozvinou známky zánětlivé reakce s febriliemi a vysokými hodnotami C-reaktivního proteinu, aniž by byly přítomny zjevné známky infektu (např. dýchacích cest provázené odsáváním hnisavého sputa, močová infekce a jiné) a výsledky kultivace hemokultur k vyloučení sepse nejsou ihned k dispozici. Naše výsledky srovnání pacientů v kardiogenním a septickém šoku naznačují, že hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml za 24 hodin jsou spíše typické pro septický šok a mohly by napomoci časně identifikovat sepsi u pacientů v KŠ, nicméně srovnáme-li hodnoty IL6 u pacientů v KŠ s prokázanou infekcí a bez infekce (graf 3), nezdá se IL6 dostatečně specifický k časné diagnostice infekce u pacientů v KŠ.
V rozsáhlé studii COMMA u pacientů se STEMI léčených primární PCI (percutaneous coronary intervention), která sledovala vliv podání monoklonální protilátky proti C5 složce komplementu na mortalitu a rozvoj kardiogenního šoku, byly vysoké hodnoty IL6, C-reaktivního proteinu a TNFα stanovené při přijetí, za 24 a 72 hodin prediktorem zvýšené mortality a rozvoje kardiogenního šoku. Tato práce jednoznačně potvrdila, že v patofyziologii akutního infarktu myokardu hraje rozvoj zánětlivé reakce důležitou roli [7]. Přestože byly vysoké hodnoty IL6 > 1 854 pg/ml i v naší práci spojeny se zvýšenou mortalitou, vzhledem k menšímu počtu pacientů a vysokému rozptylu hodnot nebyl výsledek analýzy ROC statisticky významný.
Důležitou otázkou v hodnocení hodnot IL6 jsou absolutní hodnoty IL6 u zdravých osob (kontrolní skupina). V rámci naší práce jsme stanovili hodnoty IL6 ve skupině 11 zdravých osob, hodnota mediánu IL6 byla 149 pg/ml (78–244 pg/ml, 5.–95. percentil). Vzhledem k tomu, že hodnoty IL6 významně závisí na metodice stanovení, je problematické srovnání s jinými pracemi, které stanovily IL6 u zdravých osob [22]. Naše výsledky dokumentují výraznou variabilitu hodnot IL6 i u zdravých osob.
Výsledky této práce dokládají velmi časnou produkci IL6: hodnota IL6 je zvýšená u pacientů s AIM již při přijetí ve srovnání se zdravými kontrolami a maxima dosahuje asi po 16 hodinách od vzniku infarktu myokardu. Hodnota IL6 souvisela s tíží stavu; pacienti v kardiogenním šoku měli významně vyšší hodnoty v porovnání s pacienty se STEMI a hodnoty IL6 > 1 854 pg/ml byly spojeny se zvýšenou mortalitou. Na druhé straně řada pacientů v KŠ zemřela navzdory relativně nízké hladině IL6, a proto se nám stanovení IL6 nejeví jako ideální biomarker k predikci mortality u pacientů v KŠ. U pacientů v septickém šoku je situace ještě komplikovanější z důvodu různých etiologických patogenů, původu infekce a tíže onemocnění. Přestože je dnes význam stanovení hladin cytokinů u pacientů v sepsi ve srovnání s minulostí hodnocen střízlivěji, některá pracoviště mají velmi dobré zkušenosti s využitím IL6 v klinické praxi [23] a jeho dynamika může jako relativně nespecifický zánětlivý marker odrážet aktuální stav pacienta.
Limitace
Naše práce má řadu limitací. Nejzávažnější limitací je relativně nízký počet vyhodnocených pacientů, přestože ve srovnání s obdobnými publikovanými pracemi je počet sledovaných pacientů srovnatelný [9,20].
Přestože byly základní demografické charakteristiky jednotlivých skupin srovnatelné, hladiny IL6 mohly být ovlivněny dalšími komorbiditami a rovněž průběh onemocnění mohl být u jednotlivých pacientů rozdílný.
Navzdory maximálnímu úsilí o standardizované provádění odběrů a jejich okamžité zpracování a zamrazení, by mohly preanalytické chyby ovlivnit výsledky naší práce. Tento aspekt by měl být zvažován zejména u markerů s krátkým poločasem a nízkou stabilitou [24].
Závěr
Zánětlivá reakce není typickým rysem pouze pacientů v septickém šoku, ale hraje významnou roli i v průběhu akutního infarktu myokardu komplikovaného kardiogenním šokem. Rozvoj zánětlivé reakce je heterogenní jak mezi sledovanými skupinami, tak mezi jednotlivými pacienty v kardiogenním a septickém šoku. Pacienti v SŠ mají v porovnání s pacienty v KŠ v průběhu 1. týdne významně vyšší hodnoty IL6. Pacienti v KŠ dosahují maximální hodnoty IL6 asi za 16 hodin od vzniku infarktu. Stanovení IL6 má malý prognostický význam u pacientů v kardiogenním šoku a nezjistili jsme ani žádný vztah k prognóze pacientů v septickém šoku.
Podpořeno grantem Masarykovy univerzity MUNI/A/0914/2012, projektem MZ ČR pro koncepční rozvoj výzkumné organizace 65269705 (FN Brno) a projektem European Regional Development Fund – projekt FN u sv. Anny v Brně a ICRC (No. CZ.1.05/1.1.00/02.0123).
MUDr. Jan Maláska, Ph.D.
jmalaska@fnbrno.cz
Klinika anesteziologie, resuscitace a intenzivní medicíny LF MU a FN Brno, pracoviště Bohunice, Brno
www.fnbrno.cz
Doručeno do redakce: 24. 5. 2012
Přijato po recenzi: 17. 10. 2013
Zdroje
1. Hochman JS, Buller CE, Sleeper LA et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. J Am Coll Cardiol 2000; 36: (3 Suppl A): 1063–1070.
2. Spinar J, Parenica J, Vitovec J et al. Baseline characteristics and hospital mortality in the Acute Heart Failure Database (AHEAD) Main registry. Critical Care 2011; 15(6): R291.
3. Kala P, Miklik R. Pharmaco-mechanic Antithrombotic Strategies to Reperfusion of the Infarct-Related Artery in Patients with ST-Elevation Acute Myocardial Infarctions. J Cardiovasc Transl Res 2013; 6(3): 378–387.
4. Kohsaka S, Menon V, Lowe AM et al. Systemic Inflammatory Response Syndrome After Acute Myocardial Infarction Complicated by Cardiogenic Shock. Arch Intern Med 2005; 165(4): 1643–1650.
5. Griselli M, Herbert J, Hutchinson WL et al. C-Reactive Protein and Complement Are Important Mediators of Tissue Damage in Acute Myocardial Infarction. J Exp Med 1999; 190(12): 1733–1740.
6. Pietllä KO, Harmoinen AP, Jokiniitty J et al. Serum C-reactive protein concentration in acute myocardial infarction and its relationship to mortality during 24 months of follow-up in patients under thrombolytic treatment. Eur Heart J 1996; 17(9): 1345–1349.
7. Theroux P, Armstrong PW, Mahaffey KW et al. Prognostic significance of blood markers of inflammation in patients with ST-segment elevation myocardial infarction undergoing primary angioplasty and effects of pexelizumab, a C5 inhibitor: a substudy of the COMMA trial. Eur Heart J 2005; 26(19): 1964–1970.
8. Geppert A, Dorninger A, Delle-Karth G et al. Plasma concentrations of interleukin-6, organ failure, vasopressor support, and successful coronary revascularization in predicting 30-day mortality of patients with cardiogenic shock complicating acute myocardial infarction. Crit Care Med 2006; 34(8): 2035–2042.
9. Geppert A, Steiner A, Zorn G et al. Multiple organ failure in patients with cardiogenic shock is associated with high plasma levels of interleukin-6. Crit Care Med 2002; 30(9): 1987–1994.
10. Pinsky MR, Vincent JL, Deviere J et al. Serum cytokine levels in human septic shock. Relation to multiple-system organ failure and mortality. Chest 1993; 103(2): 565–575.
11. Wu HP, Chen CK, Chung K et al. Serial cytokine levels in patients with severe sepsis. Inflamm Res 2009; 58(7): 385–393.
12. Mera S, Tatulescu D, Cismaru C et al. Multiplex cytokine profiling in patients with sepsis. APMIS 2011; 119(2): 155–163.
13. Bozza F, Salluh J, Japiassu A et al. Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care 2007; 11(2): R49.
14. Kellum JA, Kong L, Fink MP et al. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Markers of Sepsis (GenIMS) Study. Arch Intern Med 2007; 167(15): 1655–1663.
15. Levy MM, Fink MP, Marshall JC et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Intensive Care Med 2003; 29(4): 530–538.
16. Bone RC, Sibbald WJ, Sprung CL. The ACCP-SCCM consensus conference on sepsis and organ failure. Chest 1992; 101(6): 1481–1483.
17. Alexander JH, Reynolds HR, Stebbins AL et al. Effect of tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock: the TRIUMPH randomized controlled trial. JAMA 2007; 297(15): 1657–1666.
18. Steg P, James SK, Atar D et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33(20): 2569–2619.
19. Knaus WA, Draper EA, Wagner DP et al. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13(10): 818–829.
20. Brunkhorst F, Clark A, Forycki Z et al. Pyrexia, procalcitonin, immune activation and survival in cardiogenic shock: the potential importance of bacterial translocation. Int J Cardiol 1999; 72(1): 3–10.
21. Pudil R, Krejsek J, Pidrman V et al. Inflammatory response to acute myocardial infarction complicated by cardiogenic shock. Acta Medica (Hradec Kralove) 2001; 44(4): 149–151.
22. Matejovic M, Chvojka J, Sykora R et al. A 24-h work shift in intensive care personnel: biological pathways between work stress and ill health. J Int Med Res 2011; 39(2): 629–636.
23. Kula R, Chýlek V, Sklienka P et al. Balíčky péče pro těžkou sepsi. Postgraduální medicína 2001; 12 : 1048–1051.
24. Hosnijeh FS, Krop EJ, Portengen L et al. Stability and reproducibility of simultaneously detected plasma and serum cytokine levels in asymptomatic subjects. Biomarkers 2010; 15(2): 140–148.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Úvodník po volbách aneb programové miniprohlášení předsedy ČIS
- VÝBOR ČIS pro funkční období 2014–2018
- Orální infekce a revmatická onemocnění – editorial
- Septický/infikovaný trombus prechodu hornej dutej žily a pravej predsiene v súvislosti so zavedeným centrálnym žilným katétrom – editorial
- Septický/infikovaný trombus přechodu horní duté žíly a pravé síně se zavedeným centrálním žilním katétrem – editorial
- Hodnocení diastolické funkce levé komory pomocí radionuklidové ventrikulografie u pacientů s chronickým srdečním selháním a sníženou ejekční frakcí
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Orální infekce a revmatická onemocnění
- Renální denervace pro léčbu arteriální hypertenze – nezodpovězené otázky
- Léčba Waldenströmovy makroglobulinemie v roce 2013
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
- Izolovaná nonkompaktní kardiomyopatie: souhrnný článek s kazuistickým příkladem
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- David Školoudík, Daniel Šaňák et al. Rekanalizační terapie akutní ischemické cévní mozkové příhody.
- Omluva
- Ondřej Šimetka, Radovan Vlk, Martin Procházka. HELP syndrom.
- Oznam/Oznámení
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



