-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možný vplyv génového polymorfizmu v oblasti GSTs génov na sérovú hladinu polychlorovaných bifenylov (PCB)
Possible influence of genetic polymorphism in the area of GSTs genes on the serum PCB level
Objective:
To find out whether the serum PCB level depends on genetic polymorphism in the area of GSTs genes.Material and methods:
In the group of 147 men (112 with an average age of 59.1 ± 10.1 and serum PCB level > 1,000 ng/ g lipid – PCB1, and 35 with an average age of 56.2 ± 12.9 and serum PCB level < 700 ng/ g lipid – PCB2), the PCR ‑ RLFP analysis of DNA was used to determine the genetic polymorphism in the area of GSTs genes.Results:
As regards PCB, an association was found between serum PCB concentrations and the null genotype of GSTT1 gene. Men above the median PCB levels displayed, with significantly greater frequency, the null genotype GSTT1 compared to men below the median PCB levels, both in the PCB1 set and in the PCB2 set. In the PCB1 set, the presence of the null genotype GSTT1 increased the risk of high PCB levels 11 – fold, in the PCB2 set 4 – fold (p < 0.001). In the PCB2 set, an association was also discovered between GSTP1 Val/ Val genotype and higher PCB levels. The risk of high PCB levels in the individuals with the Val/ Val genotype was 5 – fold higher than in the carriers of the Ile allele (p < 0.001). In neither set was the GSTM1 genotype associated with serum PCB concentrations.Conclusion:
The association between high PCB levels and the GSTT1 null and GSTP1 Val/ Val suggests that harmful effects depend not only on the intake amounts of PCB but also on the ability of the organism to detoxify these substances. Individuals living in the same environment are therefore at different risks of developing a disease when exposed to PCB. Polymorphism in the area of GSTTl gene (GSTT1 null) could be a potential genetic risk marker.Key words:
polychlorinated biphenyls – genetic polymorphism of GSTs genes
Autoři: M. Tajtáková 1; A. Pidaničová 2; M. Kmeťová‑ sivoňová 3; A. Kočan 4; B. Drobná 4; M. Javorský 5
Působiště autorů: Endokrinologická ambulancia Nemocnice Košice‑ Šaca, a. s., Slovenská republika, riaditeľ MU Dr. Juraj Vančík, CSc. 1; I. interná klinika Lekárskej fakulty UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednostka prof. MU Dr. Ivica Lazúrová, CSc., FRCP 2; Ústav lekárskej biochémie Jesseniovej lekárskej fakulty UK Martin, Slovenská republika, vedúci prof. MU Dr. Dušan Dobrota, CSc. 3; Národné referenčné centrum pre dioxíny a príbuzné zlúčeniny Lekárskej fakulty SZU Bratislava, Slovenská republika, vedúci centra Ing. Kamil Čonka 4; IV. interná klinika Lekárskej fakulty UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednosta prof. MU Dr. Ivan Tkáč, PhD. 5
Vyšlo v časopise: Vnitř Lék 2013; 59(5): 352-356
Kategorie: Původní práce
Souhrn
Cieľ:
Zistiť, či sérová hladina PCB závisí od génového polymorfizmu v oblasti GSTs génov.Materiál a metódy:
V skupine 147 mužov (112 s priemerným vekom 59,1 ± 10,1 a sérovou hladinou PCB > 1 000 ng/ g tuku – PCB1 a 35 s priemerným vekom 56,2 ± 12,9 a sérovou hladinou PCB < 700 ng/ g tuku – PCB2) sa PCR ‑ RLFP analýzou DNA zisťoval génový polymorfizmus v oblasti GSTs génov.Výsledky:
Vo vzťahu k PCB sa zistila asociácia medzi sérovými koncentráciami PCB a null genotypom GSTT1 génu. Muži nad mediánom hodnôt PCB mali signifikantne častejšie genotyp GSTT1 null v porovnaní s mužmi pod mediánom PCB hodnôt, a to aj v súbore PCB1, aj v súbore PCB2. V súbore PCB1 zvyšovala prítomnosť GSTT1 null genotypu riziko vysokých hladín PCB 11násobne, v súbore PCB2 4násobne (p < 0,001). V súbore PCB2 sa zistila aj asociácia GSTP1 Val/ Val genotypu s vyššími hladinami PCB. Riziko vysokých hladín PCB pre jedincov s genotypom Val/ Val bolo 5násobne vyššie oproti nosičom alely Ile (p < 0,001). GSTM1 genotyp nebol asociovaný so sérovými koncentráciami PCB ani v jednom zo súborov.Záver:
Asociácia vysokých hladín PCB s GSTT1 null a GSTP1 Val/ Val predpokladá, že škodlivé účinky závisia nielen od prijatého množstva PCB, ale aj od schopnosti organizmu tieto látky detoxikovať. Jedinci žijúci v rovnakom prostredí sú preto rozdielne ohrození vznikom ochorení pri expozícii PCB. Polymorfizmus v oblasti GSTTl génu (GSTT1 null) by mohol byť potenciálny genetický rizikový marker.Kľúčové slová:
polychlorované bifenyly – génový polymorfizmus GSTs génovÚvod
Polychlórované bifenyly (PCB) sú jednými z najvýznamnejších polutantov životného prostredia [1]. PCB patria do skupiny výrazne toxických a dlhodobo pôsobiacich chemických látok. V prostredí sú mimoriadne stabilné, vysoko lipofilné, veľmi pomaly sa metabolizujú a sú praktický rezistentné voči degradácii v životnom prostredí [2]. Ich toxické vlastnosti podľa vyhlásenia EC [Commission of the European Comunities: Community Strategy for Dioxins, Furans and Polychlorinated Biphenyls, Brussels 24. 10. 2001 COM (1001) 593 final] sú podhodnocované. Objavujú sa stále nové epidemiologické a toxikologické údaje, ktoré potvrdzujú, že majú väčší dopad na zdravie ako sa pôvodne predpokladalo.
PCB sa vo svete začali vyrábať v roku 1927 (The History of PCBs:
www.foxriverwatch.com/ monsanto2b ‑ pcb ‑ pcb.html). Ich výroba sa na východnom Slovensku v podniku Chemko Strážske v okrese Michalovce začala v roku 1959 a trvala do roku 1984. V dôsledku ich výroby je táto oblasť východného Slovenska najviac kontaminovanou oblasťou PCB na celom svete [3 – 5]. Znečistenie východného Slovenska PCB malo určite negatívny dopad na zdravie obyvateľstva.Polychlorované bifenyly majú výrazné biologické účinky a toxicitu v závislosti od počtu a pozície atómov chlóru v molekule a ich väzby na jadrový arylhydrokarbónový receptor (AhR) [6]. Delia sa na dve základné skupiny, na koplanárne PCB (neorto ‑ substituované) alebo „dioxin‑like“ a nekoplanárne PCB (orto ‑ substituované), s odlišnými chemickými a biologickými vlastnosťami. Koplanárne PCB pôsobia cestou indukcie enzýmov cytochrómu P450 a cestou väzby na jadrový AhR. Nekoplanárne PCB sa viažu na AhR len v relatívne vysokých koncentráciách a môžu pôsobiť ako slabí AhR agonisti [7]. Indukujú tiež enzýmy napojené na cytochróm P450 a interagujú s hormónmi, cytokínmi a neurotransmitermi [8]. Najbežnejšou cestou kontaminácie PCB u človeka je príjem kontaminovanej potravy. Vzhľadom na ich lipofilný charakter sa PCB hromadia najmä v tukovej zložke potravy (živočíšne tuky, mäsové výrobky, mlieko a mliečne výrobky, vajcia). Strava tak predstavuje viac ako 90% zdroj kontaminácie [9,10]. Distribúcia v orgánoch a tkanivách závisí od obsahu tuku v nich. Hlavným miestom metabolizmu a ukladania PCB sú pečeň a tukové tkanivo. Prípustná hladina PCB je 100 – 500 ng/ g tuku [11].
Vie sa, že PCB pôsobia ako endokrinné disruptory, čím môžu spôsobiť poruchy reprodukcie, nervové a psychické poruchy, narušiť imunitné funkcie, iniciovať karcinogenézu. V literatúre sú s expozíciou PCB spájané zmeny pomeru pohlaví (menej mužských potomkov), znižovanie kvality a počtu spermií, zvyšovanie výskytu anomálií mužského pohlavného ústrojenstva (hypospádie a kryptorchizmu), karcinómu semenníkov a prostaty. U žien sú PCB obviňované z vyššieho výskytu predčasnej puberty, endometriózy, porúch menštruačného cyklu, spontánnych potratov, neplodnosti a vyššej incidencie karcinómu endometria a prsníka. V súvislosti so schopnosťou endokrinnej disrupcie sú popisované aj poruchy činnosti štítnej žľazy, poruchy vývoja nervovej sústavy, neuroendokrinných funkcií, poruchy správania a imunity [7,12 – 15].
Citlivosť jedincov na environmentálne faktory nie je v populácii rovnaká. Interindividuálne rozdiely vo vnímavosti na škodlivé chemické látky môžu byť podmienené genetickými faktormi. Genetické polymorfizmy môžu ovplyvňovať aktivitu detoxikačných enzýmov a tým metabolizmus xenobiotík vstupujúcich do tela. Rôzni jedinci môžu byť v závislosti od genetického vybavenia rezistentní alebo naopak extrémne senzitívni na chemické látky [16 – 19].
Doteraz sme sa venovali vplyvu PCB na štítnu žľazu. Pozorovala sa asociácia medzi vysokým obsahom PCB v sére a častejším výskytom väčších objemov a zmien v echogenite štítnej žľazy pri jej ultrasonografickom vyšetrení. Zároveň sa v skupine ohrozenej PCB pozoroval vyšší výskyt protilátok proti tyreoperoxidáze (anti‑TPO), tyreoglobulínu (anti‑TG) a receptoru pre TSH (anti‑TSHr) [14].
Tentokrát nás zaujímalo,
- aké je v sledovanej oblasti zastúpenie jednotlivých genotypov v oblasti glutation S ‑ transferázových génov (GSTs),
- či môže závisieť sérová hladina PCB od genotypu v oblasti GSTs génov s osobitným zreteľom na polymorfizmus v oblasti GSTT1, GSTP1 a GSTM1 génu.
Materiál a metódy
V roku 2007 sa vyšetrilo 147 mužov, ktorí boli rozdelení do 2 skupín. Celkovo 112 mužov (priemerný vek 59,1 ± 10,1 rokov, medián 59, vekové rozpätie 27 – 84), ktorí dlhodobo, prakticky od narodenia, žili v kontaminovanej oblasti východného Slovenska (PCB1). Časť mužov tejto skupiny bola cielene vybraná z databázy ľudí, ktorí boli v roku 2001 vyšetrení v rámci projektu PCBRISK a u ktorých sérové koncentrácie PCB prevyšovali 5 000 ng/ g tuku (vo vzorkách ľudského séra prepočítané na tukový podiel). Na základe pretrvávajúceho znečistenia prostredia a dlhého biologického polčasu PCB v sére sme predpokladali, že aktuálne hodnoty PCB sú u týchto mužov naďalej niekoľkonásobne zvýšené oproti norme. Táto skupina bola doplnená o novo oslovených mužov z PCB oblasti, u ktorých sa najprv vyšetrila aktuálna sérová koncentrácia PCB. Do súboru boli zaradení tí muži, u ktorých aktuálna sérová koncentrácia PCB prevyšovala 1 000 ng/ g tuku (PCB1). Kontrolnú skupinu tvorilo 35 mužov s priemerným vekom 56,2 ± 12,9 rokov (medián 58, vekové rozpätie 37 – 69). Muži neboli v priamom vzťahu k PCB. Koncentrácie PCB v ich sére boli pod 700 ng/ g tuku (PCB2). Kontrolná oblasť bola zvolená identicky podľa vzoru z predchádzajúceho výskumu v rámci projektu PCBRISK. Oblasť leží proti prúdu riek a smeru fúkania vetrov asi 60 km severne od kontaminovanej oblasti.
Génové polymorfizmy glutation S ‑ transferázových génov GSTP1, GSTM1 a GSTT1 sa vyšetrili metódou PCR a PCR ‑ RLFP analýzou DNA z periférnej krvi. Stanovenie koncentrácií PCB v sére sa realizovalo v Národnom referenčnom centre pre dioxíny a príbuzné zlúčeniny Ústavu chémie, klinickej biochémie a laboratórnej diagnostiky Lekárskej fakulty SZU v Bratislave pomocou vysokovýkonnej mikrokapilárovej plynovej chromatografie s následnou detekciou pomocou hmotnostnej spektrometrie.
Štatistické spracovanie
Asociácia medzi génovými polymorfizmami a kategorickými premennými v rôznych genetických modeloch (kodominantný, recesívny, dominantný) sa testovala pomocou χ2 testu podľa Pearsona, Fisherovho exaktného testu a logistickej regresie.
Hardyho ‑ Weinbergova rovnováha bola testovaná pomocou χ2 testu (goodness ‑ of ‑ fit), resp. Fisherovho exaktného testu porovnaním pozorovaných genotypových frekvencií s teoretickým rozdelením (1 = p2 + 2pq + q2; q = 1 – p; p = frekvencia častejšej alely).
Hladina štatistickej významnosti bola stanovená na p < 0,05. Výpočty sa realizovali v programoch Microsoft Excel a SPSS v. 13.
Výsledky
Pri hodnotení prevalencie jednotlivých genotypov GSTP1, GSTM1 a GSTT1 sa zastúpenie jednotlivých alel a genotypov neodchyľovalo od Hardyho ‑ Weinbergovho equilibria. Nezistili sa signifikantné rozdiely v zastúpení genotypov medzi skupinou PCB1 a PCB2 (tab. 1).
Tab. 1. Zastúpenie jednotlivých GSTs genotypov v súbore PCB1 a PCB2. 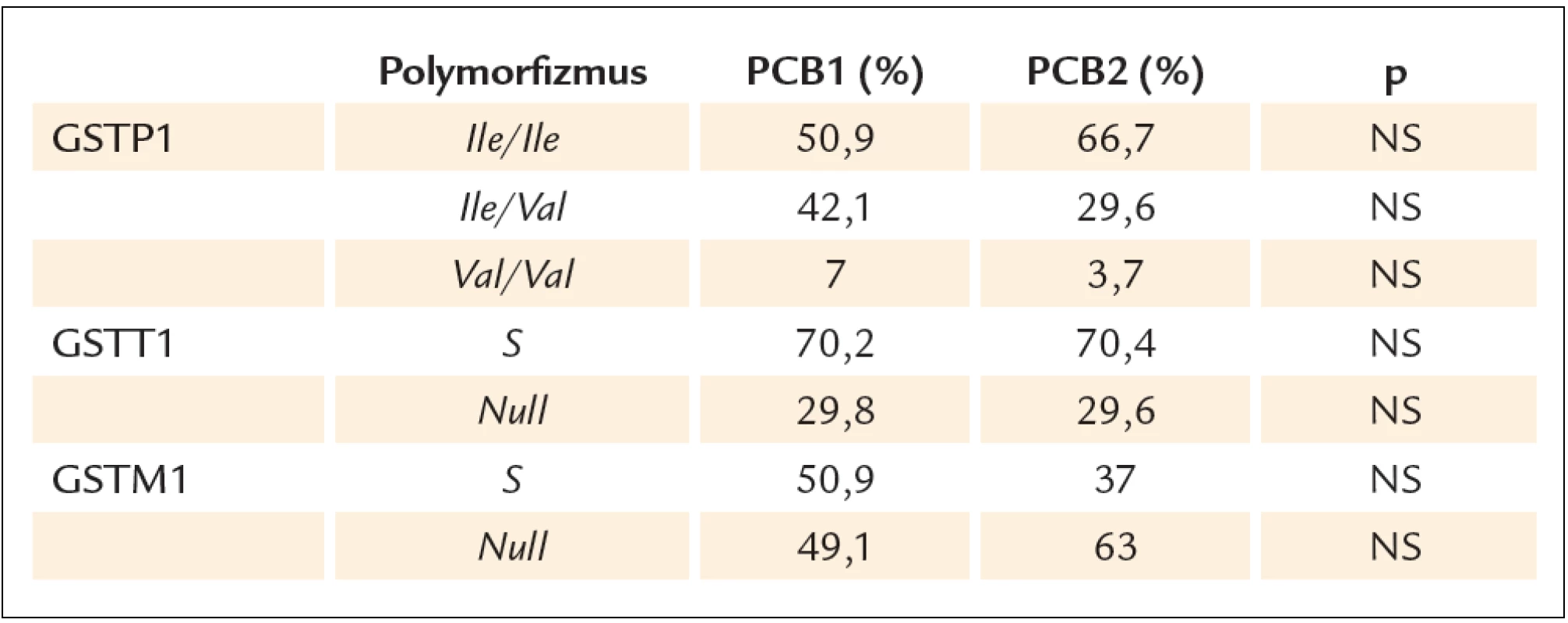
Vo vzťahu k PCB sa zistila asociácia medzi sérovými koncentráciami PCB a null genotypom GSTT1 génu. Muži nad mediánom hodnôt PCB mali signifikantne častejšie genotyp GSTT1 null v porovnaní s mužmi pod mediánom PCB hodnôt, a to aj v súbore PCB1, aj v súbore PCB2. V súbore PCB1 zvyšovala prítomnosť GSTT1 null genotypu riziko vysokých hladín PCB 11násobne, v súbore PCB2 4-násobne (p < 0,001).
V súbore PCB2 sa zistila aj asociácia GSTP1 Val/ Val genotypu s vyššími hladinami PCB. Riziko vysokých hladín PCB pre jedincov s genotypom Val/ Val bolo 5-násobne vyššie oproti nosičom alely Ile (p < 0,001). GSTM1 genotyp nebol asociovaný so sérovými koncentráciami PCB ani v jednom zo súborov (tab. 2).
Tab. 2. Asociácia GSTs genotypov so sérovými koncentráciami PCB v súbore PCB1 a PCB2 na základe mediánu hodnôt PCB. 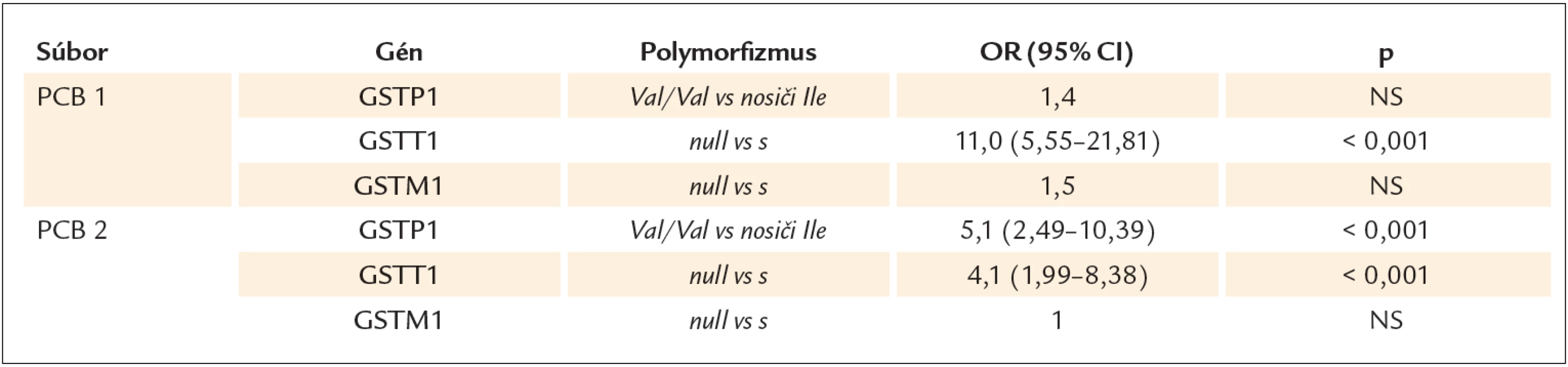
Diskuzia
PCB po väzbe na AhR môžu regulovať expresiu širokej škály génov. Produkty týchto génov sú buď proteíny regulujúce rast, alebo enzýmy metabolizujúce xenobiotické látky [20]. PCB aktivujú syntézu CYP enzymov na jednej strane, ako aj GSTs enzymov na druhej strane, čím sa spustí proces detoxikácie a eliminácie xenobiotík včítane PCB [21].
V prvom kroku detoxikácie sa PCB pomocou CYP oxidujú na arénoxidy, nebezpečné metabolity, ktoré sa môžu viazať na DNA za tvorby DNA adduktov s následnými mutáciami DNA. Úlohou GSTs enzýmov je detoxikovať arénoxidy ich konjugáciou s glutatiónom za vzniku glutatiónkonjugátov [7]. Metabolizácia PCB prostredníctvom CYP enzymov na hydroxymetabolity vedie k tvorbe reaktívnych kyslíkových radikálov [22]. Tieto kyslíkové radikály zapríčiňujú oxidatívny stres bunky, poškodenie lipidov, proteínov a DNA. V prípade génového polymorfizmu v oblasti génov kódujúcich CYP alebo GSTs enzymy môže byť stimulačný proces zvýšený a detoxikačný znížený. Absencia alebo deficit GSTs enzymovej aktivity môže viesť k zhoršenej eliminácii nebezpečných metabolitov a kancerogénov. GSTs deficiencia zvyšuje riziko somatických mutácií, čo môže viesť až k formovaniu tumoru.
PCB môžu priamo ovplyvňovať gény kódujúce tieto enzymy.
Glutation S ‑ transferázový gén (GSTT1) je lokalizovaný na chromozome 22q11.23 a kóduje GSTT1 enzym, ktorý sa zúčastňuje detoxikácie mnohých xenobiotík a kancerogénov v organizme. GSTT1 enzym bol detekovaný v pečeni, v pľúcach, čreve, v prsníku, v slezine, v erytrocytoch, v mozgu, v obličkách, v srdci a vo svaloch. Chýbanie homozygotnej alely GSTT1 (GSTT1 null) vedie k strate enzymatickej aktivity GSTT1 enzymu. Pre takto postihnutých sa zvyšuje genotoxicita látok zo znečisteného životného prostredia. Takýto jedinci sú preto viacej ohrození rozvojom karcinómov pod vplyvom kancerogénov včítane látok zo znečisteného životného prostredia. Glutation S ‑ transferázový gén (GSTP1) je lokalizovaný na chromozome 11q13 a kóduje GSTP1 enzym, ktorý hrá tiež dôležitú detoxikačnú úlohu vplývajúc na metabolizmus xenobiotík. Polymorfizmus v oblasti tohto génu hrá takisto dôležitú úlohu pri rozvoji karcinómov a iných ochorení. Glutation S ‑ transferázový gén (GSTM1) je lokalizovaný na chromozóme 1p13.3. Kóduje ezym GSTM tiež s detoxikačnými účinkami. Aj tento gén môže vykazovať rozličné polymorfizmy, ktoré potom u svojich nosičov môžu meniť individuálnu odpoveď jedinca na kancerogény. Mutácia null je často spojená s vyšším rizikom vzniku a rozvoja karcinómov [23,28,29].
V našej štúdii sme zistili vzťah medzi sérovými hladinami PCB a genovým polymorfizmom v oblasti GSTT1 a GSTP1 génu. Chýbanie alely GSTT1 (GSTT1 null) bolo spojené s vyššími hladinami PCB v sére, a to v oboch súboroch, teda pri vysokých aj relatívne nízkych hladinách PCB. V súbore PCB2 sme zistili aj asociáciu GSTP1 Val/ Val genotypu s vysokými hladinami PCB. GSTM1 genotyp nebol asociovaný so sérovými koncentráciami PCB ani v jednom zo súborov. Vplyv genetických polymorfizmov v GSTs génoch na sérové koncentrácie PCB nebol doposiaľ sledovaný.
Viaceré práce však dokazujú, že polymorfizmy v GSTs génoch sú asociované s rôznymi ochoreniami vznikajúcimi pod vplyvom vonkajšieho prostredia včítane karcinómov [15,17,18,23,24]. GSTT1, GSTM1 null genotypy a GSTP1 Val/ Val genotyp zvyšujú riziko astmy v kontaminovanom prostredí [25]. Kožné alergie a chlor ‑ akné po expozícii PCB sa vyskytujú častejšie u osôb s GSTM1 null genotypom [26]. Riziko karcinómu prostaty je vyššie u pracovníkov exponovaných polycyklickými aromatickými uhlovodíkami, ktorí sú nosičmi variantnej alely Val v GSTP1 géne [27]. Polymorfizmus GSTT1, GSTP1 zvyšoval riziko karcinómu u fajčiarov [28] a kolorektálny karcinóm [29,30]. U žien ohrozených PCB v prípade endometriozy ale nebol zistený vzťah ku génovému polymorfizmu GSTs genov [31].
Asociácia vysokých hladín PCB s GSTT1 null a GSTP1 Val/ Val v našej štúdii potvrdzuje, že škodlivé účinky týchto látok závisia nielen od prijatého množstva PCB, ale aj od schopnosti organizmu tieto látky detoxikovať. Jedinci žijúci v rovnakom prostredí sú preto rozdielne ohrození vznikom ochorení pri expozícii PCB. Polymorfizmus v oblasti GSTT1 génu (GSTT1 null) by mohol byť potenciálny genetický rizikový marker.
Záver
Génové polymorfizmy ovplyvňujú citlivosť jedincov na škodlivé účinky environmentálnych látok. Asociáciu určitých genotypov detoxikačných enzýmov s vyššími sérovými hladinami PCB potvrdzuje i predkladaná práca.
prof. MU Dr. Mária Tajtáková, PhD.
www.nemocnicasaca.sk
e‑mail: maria.tajtakova@gmail.com
Doručeno do redakce: 10.1. 2013
Přijato po recenzi: 4. 3. 2013
Zdroje
1. Johnson BL, Hicks EH, Jones ED et al. Public Health Implications of Toxic Substances in the Great Lakes and St.Lawrence Basins. J Great Lakes Res 1998; 24 : 698 – 722.
2. Moreles NM, Tuey DB, Colbrun WA et al. Pharmacokineties of multiple oral doses of selected polychlorinated biphenyls in mice. Toxicol Appl Pharmacol 1997; 48 : 397 – 470.
3. Kočan A, Petrík J, Drobná B et al. Levels of PCBs and some organochlorine pesticides in the human population of selected areas of the Slovak Republik I. Blood. Chemosphere 1994; 29 : 2315 – 2325.
4. Jursa S, Chovancová J, Petrík J et al. Dioxin‑like and non ‑ dioxin‑like PCBs in human serum of Slovak population. Chemosphere 2006; 64 : 689 – 691.
5. Petrík J, Drobná B, Pavúk M et al. Serum PCBs and organochlorine pesticides in Slovakia: age, gender, and residence as determinants of organochlorine concentrations. Chemosphere 2006; 65 : 408 – 410.
6. McKinney JD, Darden T, Lyerly AM et al. PCB and Related Coumpound Binding to the Ah Receptor(s) Theoretical Model Based on Molecular Parameters and Molecular Mechanics. QSAR 2002; 4 : 166 – 170.
7. Safe SH. Endocrine disruptors and human healt ‑ is there a problem. Toxicology 2004; 205 : 3 – 10.
8. LaRocca C, Mantovani A. From environment to food: the case PCB. Ann Ist Super Sanita 2006; 42 : 410 – 416.
9. Zmetáková Z, Šalgovičová D. Polychlorované bifenyly, životné prostredie a človek. TRENDY v potravinárstve 2006; 13.
10. Šalgovičová D. Estimation of long ‑ term dietary exposure of the inhabitants of Slovac Republic to polychlorinated biphenyls. J Food Nutr Res 2007; 46 : 186 – 194.
11. Schell ML, Hubicki LA, Gallo MV et al. Organochlorines, lead and mercury in akwesasne Mohawk youth. Environ Health Perspect 2003; 111 : 954 – 961.
12. James RC, Busch H, Tamburro GH et al. Polychlorynated Biphenyls Exposure and Human Disease. J Occul Environ Med 1993; 35 : 136 – 148.
13. Colborn T, Vom Saal FS, Soto AM et al. Developmental effects of endocrine ‑ disrupting chemicals in wildlife and humans. Environ Health Perspect 1993; 101 : 378 – 384.
14. Langer P, Tajtáková M, Kočan A et al. Thyroid ultrasound volume, structure and functions after longe term high exposure of large population to polychlorinated biphenyls, pesticides and dioxin. Chemosphere 2007; 69 : 118 – 127.
15. Hatcher ‑ Martin JH, Gearing M, Steenland K et al. Association between polychlorinated biphenyl and Parkinsons Disease neuropathology. Neurotoxicology 2012; 33 : 1298 – 1304.
16. Šalagovič J, Kalina I, Dudáš M. Genetic polymorphism in xenobiotics metabolizing enzymes as a susceptibility factor to cancer. Bratisl Lek Listy 2000; 101 : 512 – 521.
17. Zhang Y, Wise JP, Holford TR et al. Serum Polychlorinated Biphenyls, Cytochrome P.450 1A1 Polymorphysms, and Risk of Breast Cancer in Connecticut Wonen. Am J Epidemiol 2004; 160 : 1177 – 1183.
18. Božina N, Bradamante V, Lovrič M. Genetic Polymorphysm of Metabolic Enzymes P450(CYP) as a Susceptibility Factor for Drug Response. Toxicity and Cancer Risk. Arch Hig Rada Toksikol 2009; 60 : 217 – 242.
19. Mitra PS, Ghosh S, Zang S et al. Analysis of the toxicogenomic effects of exposure to persistent arganic pollutnts (POPs) in Slovakian girls: correlation between gene expression and disease risk. Environ Int 2012; 39 : 188 – 199.
20. Brevini AL, Zanetto SB, Cillo F. Effect of endocrine disruptors on developmental and reproductive functions. Current Drug Targets ‑ Imnune, Endocrine and Metabolic Disorders 2005; 5 : 1 – 10.
21. Hrycay EG, Bandiera SM. Spectral interactions of tetrachlorbiphenyls with hepatic microsomal cytochrome P450 enzymes. Chemico ‑ Biological Interactions 2003; 146 : 285 – 296.
22. Mclean MR, Twarowski TP, Robertson LW. Redox cycling of 2 - (x’ - mono, - di, - trichlorphenyl)-1,4 - benzoquinones, oxidation products of polychlorinated biphenyls. Arch Biochem Biophys 2000; 376 : 449 – 455.
23. Tiwawech D, Chindavijak S, Sornprom A et al. Detection of GSTT1 Polymorphysm in Cancer Patients by Real ‑ Time PCR. Thai Cancer J 2008; 28 : 172 – 183.
24. Dutta SK, Mitra PS, Ghosh S et al. Differential gene expression and functional analysis of PCB ‑ exposed children: understanding disease and disorder development. Environ Int 2012; 40 : 143 – 154.
25. Tamer L, Calikoglu M, Ates NA et al. Glutathion ‑ S transferase gene polymorphism (GSTT1,GSTM1,GSTP1) as increased risk factor for asthma. Respirology 2004; 9 : 493 – 498.
26. Pei Chien Tsai, Wenya Huang, Yeu ‑ Chin Lee et al. Genetic Polymorphism in Cyo 1A1 and GSTM1 predispose hunabs to PCBs/ PCSFs‑induced skin lesions. Chemosphere 2006; 63 : 1410 – 1418.
27. Rybicki BA, Neslund ‑ Dudas C, Nock NL et al. Prostate cancer risk from occupational exposure to polycyclic aromatic hydrocarbons interacting with the GSTP1 Ile 105 Val polymorphism. Cancer Detect Prev 2006; 30 : 412 – 422.
28. Jourenkova ‑ Mironova N, Voho A, Bouchardy C et al. Glutathione S ‑ transferase GSTM1,GSTM3,GSRP1 and GSTT1 genotypes and the risk of smoking ‑ releted oral and pharyngeal cancers. Int J Cancer 1999; 81 : 44 – 48.
29. Rajagopal R, Deakin M, Fawole AS et al. Glutathion S ‑ transferase Tl polymorphisms are associated with outcome in colorectal cancer. Carcinogenesis 2005; 26 : 2157 – 2163.
30. Economopoulous KP, Sergentamis TN. GSTM1, GSTT1, GSTP1, GSTA1 and colorectal cancer risk: a comprehensive meta‑analysis. Eur J Cancer 2012; 46 : 1617 – 1613.
31. Vichi S, Medda E, Ingelido AM et al. Glutathione transferase polymorphisms and risk of endometriosis associated with polychlorinated biphenyls exposure in Italian women: a gene ‑ environment interaction. Fertil Steril 2012; 97 : 1143 – 1151.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Choroby způsobené lepkem
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Endokrinní disruptory – neviditelná hrozba – editorial
- Koncept spondyloartritid – editorial
- Maligní nádory srdce – editorial
- Distribuce s lipoproteiny asociované fosfolipázy A2 v české populaci a její interakce s konvenčním kardiovaskulárním rizikem
- Možný vplyv génového polymorfizmu v oblasti GSTs génov na sérovú hladinu polychlorovaných bifenylov (PCB)
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Poruchy srdcového rytmu u pacientov s diabetes mellitus
- Kombinovaná terapie arteriální hypertenze
- Prevence náhlé srdeční smrti při sportu ve světle nových doporučení
- Choroby způsobené lepkem
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Fixní kombinace telmisartanu a thiazidového diuretika v léčbě hypertenze
- Paraneoplastická hypoglykémia – popis prípadu a prehľad problematiky
- Malígnym melanómom imitovaný akútny koronárny syndróm alebo reálny akútny koronárny syndróm?
- Spondylodiscitida, epidurální empyém jako komplikace syndromu diabetické nohy
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diastolická dysfunkce levé komory ve vyšším věku. Nemoc, nebo fyziologický projev stárnutí?
- Spondyloartritidy: aktuální pohled na diagnostiku a klasifikaci
- Srovnání MRCP a ERCP v diagnostice choledocholitiázy
- Choroby způsobené lepkem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



