-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ischemická choroba dolních končetin a diabetes
Peripheral arterial disease and diabetes
Peripheral arterial disease (PAD) is a disease characterised by narrowing and blockade of peripheral arteries, usually based on underlying obliterating atherosclerosis. According to the results of large epidemiological studies, the risk of PAD in patients with diabetes mePADtus (DM) is fourfold higher compared to non‑diabetic population. Patients with DM and PAD have a high risk of cardiovascular morbidity and mortality. Diabetes worsens the prognosis of patients with PAD; the onset of PAD in diabetics occurs at an earlier age, the course is faster than in non‑diabetic patients and the disease is often diagnosed at its advanced stages. All these factors reduce the likelihood of revascularisation in DM patients with PAD. A range of factors (higher age, arterial hypertension, smoking, obesity, hyperfibrinogenaemia, insulin resistance etc.) contribute to the development of PAD in DM. Diabetes control is an independent risk factor of PAD as every 1% increase of hemoglobin A1C is associated with 28% increase of PAD. There are different clinical signs of PAD in diabetic and non‑diabetic patients. In addition to the history of claudications, PAD diagnostic criteria include the presence of murmur over the large arteries, signs of chronic ischemia on the skin and distal ulcerations and gangrene. Among the imaging techniques, non‑invasive investigations including Doppler pressure measurement, ankle brachial pressure index, color duplex ultrasonography, plethysmography, transcutaneous tension measurement, MR and CT angiography are preferred. Ankle brachial pressure index measurement is the easiest and the main investigation technique. The key principles of PAD treatment in diabetic patients include modification of risk factors, pharmacotherapy and revascularisation interventions aimed at improving clinical signs and prevention of cardiovascular morbidity and mortality. Antiplatelet treatment may prevent PAD progression and reduce cardiovascular events in DM patients. Early diagnosis of PAD in DM patients, rigorous prevention and aggressive management of the risk factors may significantly impact on the high incidence of amputations and decrease cardiovascular morbidity and mortality.
Key words:
diabetes mellitus – peripheral arterial disease – ankle brachial index – risk factors – critical limb ischemia – treatment
Autori: R. Malý 1; V. Chovanec 2
Pôsobisko autorov: Subkatedra angiologie I. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Jan Vojáček, DrSc., FESC, FACC2Radiologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Pavel Eliáš, CSc. 1
Vyšlo v časopise: Vnitř Lék 2010; 56(4): 341-346
Kategória: 11. celostátní diabetologické sympozium „Diabetes a angiologie“ , Hradec Králové, 5.– 6. června 2009
Súhrn
Ischemická choroba dolních končetin (ICHDK) je onemocnění, které je charakterizované zúžením nebo uzávěrem končetinových tepen, nejčastěji na podkladě obliterující aterosklerózy. Přítomnost diabetes mellitus (DM) zvyšuje riziko ICHDK podle velkých epidemiologických studií 4násobně ve srovnání s populací bez diabetu. Nemocní s DM a ICHDK mají vysoké riziko kardiovaskulární morbidity a mortality. Přítomnost diabetu zhoršuje prognózu nemocných s ICHDK, která se objevuje v časnějším věku, probíhá rychleji než u nediabetiků a často bývá diagnostikována v pozdních fázích choroby, což zhoršuje možnosti revaskularizace. Na vzniku ICHDK u DM se účastní řada rizikových faktorů (vyšší věk, arteriální hypertenze, kouření, obezita, hyperfibrinogenemie, inzulinová rezistence a další). Kontrola diabetické kompenzace je nezávislým rizikovým faktorem ICHDK, protože každý 1% vzestup glykovaného hemoglobinu je spojen se zvýšením ICHDK o 28 %. Klinické projevy ICHDK jsou rozdílné u diabetických a nediabetických pacientů. Při diagnostice ICHDK jsou kromě anamnézy klaudikací dalšími diagnostickými známkami ICHDK přítomnost šelestů nad velkými tepnami, známky chronické ischemie na kůži a distální ulcerace a gangrény. Ze zobrazovacích metod ICHDK jsou preferovány neinvazivní testy, jako je stanovení distálních dopplerovských tlaků, měření indexu kotník ‑ paže, barevná duplexní ultrasonografie, pletysmografie, transkutánní tenze kyslíku, MR a CT angiografie. Stanovení indexu kotník ‑ paže je nejjednodušší a základní vyšetřovací metodou. Základní principy léčby diabetiků s ICHDK zahrnují ovlivnění rizikových faktorů, medikamentózní terapii a revaskularizační intervence s cílem zlepšení klinických příznaků a prevence kardiovaskulární morbidity a mortality. Protidestičková léčba může zabránit progresi ICHDK a redukovat kardiovaskulární příhody u pacientů s DM. Časná detekce ICHDK u pacientů s DM, důsledná prevence a agresivní léčba rizikových faktorů mohou výrazně ovlivnit vysoký výskyt amputací a také snížit kardiovaskulární morbiditu a mortalitu.
Klíčová slova:
diabetes mellitus – ischemická choroba dolních končetin – index kotník ‑ paže – rizikové faktory – kritická končetinová ischemie – léčbaÚvod
Ischemická choroba dolních končetin (ICHDK) je onemocnění, které je charakterizováno zúžením nebo uzávěrem končetinových tepen, nejčastěji na podkladě obliterující aterosklerózy. Pacienti s ICHDK mohou být asymptomatičtí nebo mohou mít intermitentní klaudikace a/ nebo projevy kritické končetinové ischemie (klasifikace dle Fontaine a Rutheforda v tab. 1). Kritická končetinová ischemie (CLI – critical limb ischemia) jako manifestace ICHDK je podle dokumentu TASC II (Trans-Atlantic Inter - Society Consensus) charakterizována chronickými klidovými bolestmi, ischemickými ulceracemi nebo gangrénou [1]. Nemocní s diabetes mellitus (DM) mají vysoké riziko kardiovaskulární morbidity a mortality. Přítomnost DM mnohonásobně zvyšuje riziko ICHDK [2]. ICHDK se u pacientů s DM objevuje v časnějším věku, probíhá rychleji než u nediabetiků a bývá často diagnostikována až pozdějších fázích choroby, což zhoršuje možnosti revaskularizace [3]. U diabetiků bývá vyšší výskyt CLI často s nutností amputace [1]. Samotná diagnóza ICHDK je nezávislým faktorem, který zvyšuje riziko mortality na kardiovaskulární onemocnění [4]. Časná detekce ICHDK pomocí základního fyzikálního vyšetření a neinvazivních zobrazovacích metod, jako je stanovení indexu kotník-paže (ABI – ankle-brachial index), může pomoci redukovat progresi onemocnění a zlepšit osud nemocných s DM.
Tab. 1. Klasifikace ICHDK: stadia dle Fontaine a Ruthefordova klasifikace [1]. ![Klasifikace ICHDK: stadia dle Fontaine a Ruthefordova klasifikace [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/30a15e7c1e59883a1a472ab949228e11.jpeg)
Epidemiologie
Přesná incidence ICHDK u pacientů s DM není známa. Významný počet pacientů s ICHDK nemá projevy intermitentních klaudikací díky maskující periferní neuropatii [2]. Na základě rozsáhlých populačních studií se ukazuje vyšší prevalence ICHDK u pacientů s DM. Ve Framinghamské studii bylo prokázáno 3,5 a 8,6násobně vyšší riziko vzniku ICHDK u diabetiků ve skupině mužů, resp. žen [5]. V epidemiologických studiích s ICHDK (diagnostika s využitím ABI) je prevalence diabetu mezi 30 a 35 % [6]. Nezdá se, že by typ diabetu měl vliv na prevalenci ICHDK. Kumulativní incidence ICHDK u DM byla ve studii Rochester 21,3 na 1 000 u mužů a 17,6 na 1 000 u žen [7]. Ve Framinghamské studii byla incidence ICHDK v populaci diabetiků 12,6 na 1 tisíc u mužů a 8,4 na 1 000 u žen [5]. Epidemiologická data pro ICHDK u pacientů s DM přehledně uvádí tab. 2.
Tab. 2. Epidemiologická data o výskytu ICHDK a pacientů s DM [8]. ![Epidemiologická data o výskytu ICHDK a pacientů s DM [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/31ed00c435c03de27139ce98d82684b1.jpeg)
Pacienti s DM a ICHDK mají 3 – 6násobně vyšší mortalitu v porovnání se zdravými jedinci, přičemž osoby s CLI a DM mají kratší dobu přežití po amputaci nežli pacienti s CLI bez DM. 5letá mortalita diabetiků s CLI je 30 % [1].
Rizikové faktory ICHDK u diabetes mellitus
Řada rizikových faktorů se účastní na vzniku ICHDK u DM. Vyšší věk je silným prediktorem vzniku ICHDK u pacientů s 1. a 2. typem diabetes mellitus [9]. Incidence ICHDK je vyšší u mužů nežli u žen. Ženy diabetičky mají vyšší výskyt ICHDK ve srovnání s ženami bez diabetu stejného věku [5]. Jak prokázala prospektivní studie UKPDS, je rovněž kontrola diabetické kompenzace nezávislým rizikovým faktorem ICHDK, každý 1% vzestup glykovaného hemoglobinu (HbA1c) byl spojen se zvýšením ICHDK o 28 % [10]. Zvýšená hodnota systolického krevního tlaku je podle UKPDS nezávislým rizikovým faktorem ICHDK. Každé zvýšení systolického krevního tlaku o 10 mm Hg bylo spojeno s 25% zvýšením rizika ICHDK [8,10]. Přehled rizikových faktorů ICHDK u pacientů s diabetem představuje tab. 3.
Tab. 3. Rizikové faktory ICHDK u diabetu. 
Klinická manifestace ICHDK u DM
Klinické projevy ICHDK jsou rozdílné u diabetických a nediabetických pacientů. U diabetiků je typické postižení tepen v oblasti pod kolenem a na bérci a postižení hluboké stehenní tepny. Velmi často se jedná o symetrické a víceetážové postižení s tvorbou kolaterál. Naproti tomu u pacientů bez diabetu je ICHDK obvykle unilaterální, lokalizovaná do jedné etáže a preferenčně postihující proximální tepenné řečiště. Některé studie uvádí, že ICHDK progreduje rychleji u pacientů s DM [3,8]. Většina diabetiků s ICHDK je asymptomatická (až 75 %) [11]. Diagnóza ICHDK je u nich založena na stanovení ABI, který je nižší než 0,9 [1]. Periferní neuropatie a ICHDK jsou známé rizikové faktory vzniku ulcerací na noze. Přibližně 40 – 60 % diabetiků s ulcerací na noze má ICHDK, které představují vyšší výskyt amputací a mortality. Diabetici s ICHDK mají celkově sníženou funkční schopnost chůze, tolerují kratší interval ve srovnání s nediabetickými jedinci [12,13].
Diagnóza ICHDK
Anamnéza intermitentních klaudikací nebo absence pulzací na končetinách jsou základními kritérii pro stanovení diagnózy ICHDK. Je prokázáno, že asi 10 – 15 % zdravé populace nemá kongenitálně hmatnou pulzaci na a. dorsalis pedis. Kromě anamnézy klaudikací jsou dalšími diagnostickými známkami ICHDK přítomnost šelestů nad velkými tepnami, známky chronické ischemie na kůži (chlad nohou, vymizení ochlupení, bledost při elevaci končetin) a distální ulcerace a gangrény. Ze zobrazovacích metod ICHDK jsou preferovány neinvazivní testy, jako je stanovení distálních dopplerovských tlaků, měření ABI, barevná duplexní ultrasonografie (BDU), pletysmografie, transkutánní tenze kyslíku (TcPO2), zobrazení tepen pomocí magnetické rezonance (MR) a výpočetní tomografie (CT) (tab. 4) [1,8,14].
Tab. 4. Vyšetření u diabetiků s ICHDK. 
Stanovení ABI je základní a nejjednodušší vyšetřovací metodou. Hodnota ABI < 0,9 je označována jako kritérium pro ICHDK ve většině studií (tab. 5). K hodnocení ABI se využívá 10 – 12 cm manžeta sfygnomanometru umístěná nad kotníkem a na paži a dopplerovská sonda (4 – 8 MHz) pro určení systolického dopplerovského tlaku na a. dorsalis pedis, a. tibialis posterior a a. brachialis. Vyšetření je prováděno nejčastěji v klidu vleže, ale i po zátěži (např. treadmill – chodecký test na pohyblivém pásu s definovaným sklonem) [1].
Tab. 5. Hodnocení dopplerovských tlaků, ABI, TcPO<sub>2</sub>. 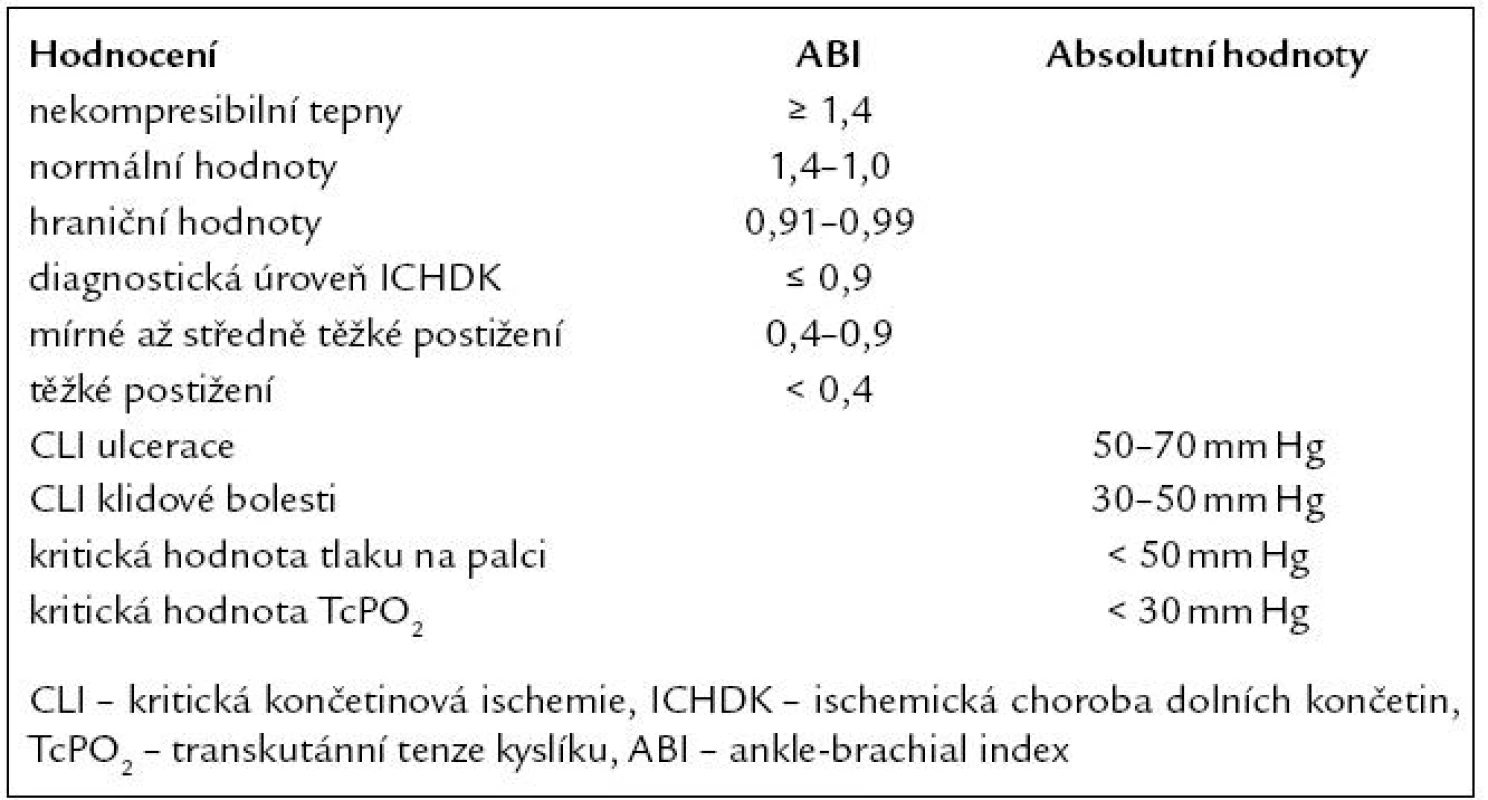
Stanovení ABI se využívá nejen k dia-gnóze ICHDK, ale také ke stanovení kardiovaskulární mortality. Hodnoty ABI < 0,9 a > 1,4 jsou spojeny s vyšším rizikem kardiovaskulární mortality (infarkt myokardu, cévní mozková příhoda, náhlá srdeční smrt) (graf 1) [15]. ABI má 90% senzitivitu a 98% specificitu pro určení stenóz nad 50 % v končetinových tepnách [4,16].
Graf 1. Riziko kardiovaskulární mortality ve vztahu k hodnotám ABI [15]. ![Riziko kardiovaskulární mortality ve vztahu k hodnotám ABI [15].](https://pl-master.mdcdn.cz/media/image/60a55c2fea40bb5b375e61ab13362adf.jpeg?version=1537790299)
Přítomnost mediokalcinózy, která často doprovází DM, nemocné s renální insuficiencí, znemožňuje kompresibilitu distálních arterií (ABI > 1,4) a může zastřít přítomnou ICHDK [1,4,17]. Recentní studie předpokládají, že ABI > 1,4 u diabetiků je označován jako ekvivalent ICHDK [18]. Pro přesnější stanovení ICHDK u těchto nemocných se využívá měření distálních dopplerovských tlaků na palci (TBI – toe brachial index), TcPO2 nebo BDU. BDU, CT a MR angiografie pomáhají lokalizovat stenózy či uzávěry tepen a naplánovat chirurgickou nebo endovaskulární intervenci (schéma 1). Digitální subtrakční angiografie není pouze diagnostickou metodou, ale je převážně využívána pro endovaskulární revaskularizaci [18].
Schéma 1. Postup při stanovení diagnózy ICHDK u diabetiků [18]. ![Schéma 1. Postup při stanovení diagnózy ICHDK u diabetiků [18].](https://pl-master.mdcdn.cz/media/image/c4c5009d71afc27d56ec270ba31a6e29.jpeg?version=1537790299)
Léčba
Základní principy léčby diabetiků s ICHDK zahrnují zlepšení klinických příznaků a prevenci kardiovaskulární morbidity a mortality. Léčbu ICHDK můžeme rozdělit do tří stupňů: ovlivnění rizikových faktorů, medikamentózní terapie a revaskularizační intervence (tab. 6) [8]. Ovlivnění životního stylu, které je prvním krokem v terapii ICHDK, zahrnuje přerušení kouření, fyzické cvičení, redukce váhy a dietní opatření. Kouření cigaret je nejdůležitější faktor aterosklerózy a může zastavit progresi choroby [16]. Kouření zvyšuje riziko CLI a snižuje klinickou úspěšnost cévních intervencí [1]. Fyzické cvičení zlepšuje toleranci námahy a umožňuje prodloužení bezbolestného intervalu a dosažení lepší maximální vzdálenosti při chůzi [19].
Tab. 6. Principy a možnosti léčby ICHDK u DM. 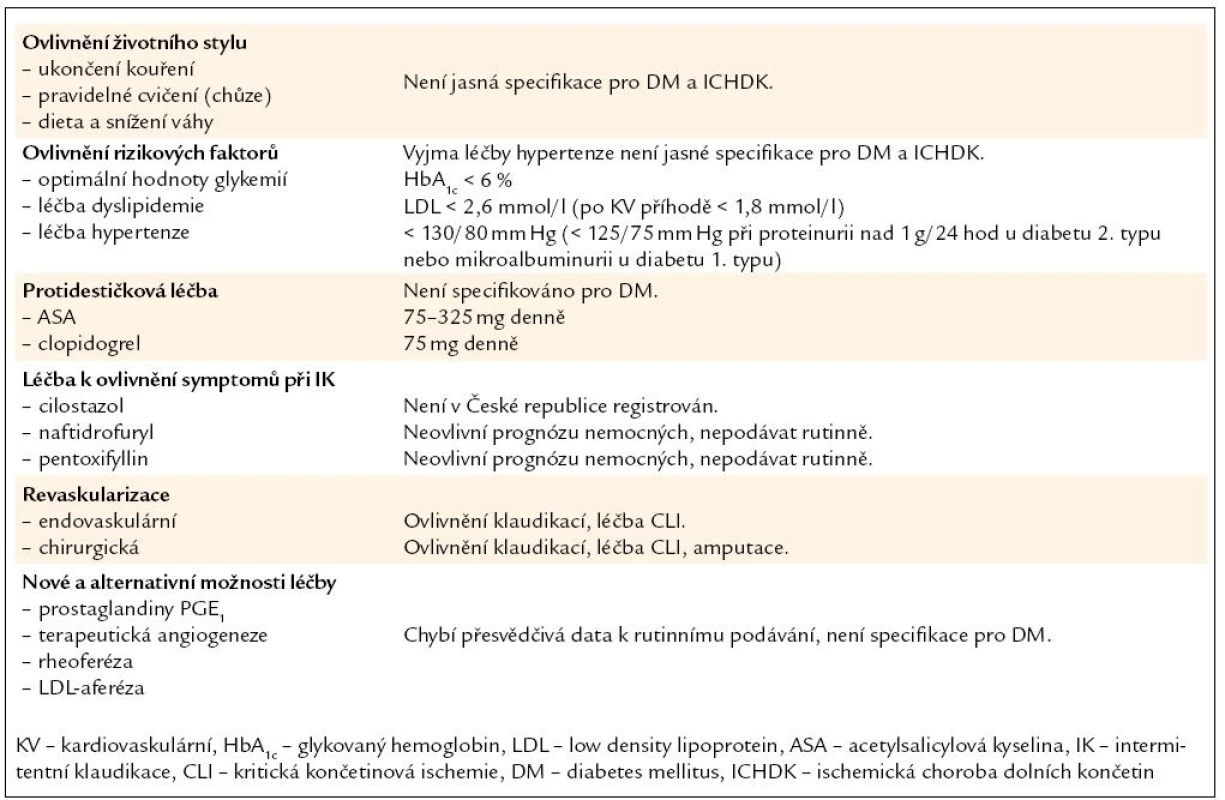
Není ověřena hypotéza, že optimální kontrola glykemií sníží riziko ICHDK [20]. Na druhé straně hyperglykemie výrazně zvyšuje riziko kardiovaskulárních příhod [10]. Podle TASC II je optimální cílová hodnota HbA1c u DM s ICHDK menší než 6 % [1]. Agresivní hypolipidemická léčba u pacientů s DM a ICHDK má za úkol snížit LDL cholesterol na hodnoty < 2,6 mmol/ l, popř. < 1,8 mmol/ l u těch jedinců, kteří mají anamnézu postižení koronárních tepen. Statiny jsou označovány jako léky volby. Optimální kontrola hypertenze (TK < 130/ 80 mm Hg) snižuje riziko cévních mozkových příhod a úmrtí. Intenzivní léčba hypertenze snižuje riziko kardiovaskulárních příhod u diabetiků s ICHDK. Léčba beta blokátory není doporučována pouze u pacientů s CLI [1,8].
Protidestičková léčba
Protidestičková léčba je základním opatřením u pacientů s kardiovaskulárním onemocněním v rámci sekundární prevence aterosklerózy. Podávání acetylsalicylové kyseliny (ASA) snižuje výskyt kardiovaskulárních příhod o 25 % [21]. Na základě TASC II je ASA doporučována všem pacientům s ICHDK v dávce 75 – 325 mg denně [1]. Clopidogrel (75 mg denně), představitel 2. generace thienopyridinů, ve studii CAPRIE snížil výskyt infarktu myokardu a mozkové příhody a smrti z vaskulárních příčin ve srovnání s ASA v podskupině pacientů s ICHDK. Nicméně přítomnost DM nebyla v této studii sledována [22]. Je lékem volby při alergii na ASA nebo laboratorně prokázané rezistenci na léčbu ASA.
Pro léčbu intermitentních klaudikací se nabízejí k využití tři preparáty: pentoxifyllin, naftidrofuryl, cilostazol. Cilostazol, selektivní inhibitor fosfodiesterázy III, je nejúčinnějším preparátem u pacientů s klaudikacemi a diabetem, bohužel není v České republice dosud registrován. Rutinní podávání pentoxifyllinu a naftidrofurylu není u pacientů s DM a ICHDK doporučováno. Stejně tak prostaglandiny (PGE1 – alprostadil, iloprost) nejsou doporučovány pro léčbu intermitentních klaudikací [8,16,23].
Pokud v rámci léčby CLI není možná revaskularizace, využívá se lokální terapie, chirurgický debridement ulcerací, v případě infekce antibiotika [8,24]. PGE1 (iloprost) v recentních studiích zlepšil hojení defektů, ale zásadně neovlivnil prognózu nemocných včetně záchrany končetiny [1]. Terapeutická angiogeneze (aplikace růstových faktorů endotelu a fibroblastu, transplantace kmenových buněk kostní dřeně atd.), rheoferéza a LDL aferéza představují nové a potenciálně slibné terapeutické možnosti u pacientů, kteří jsou odsouzení k větší amputaci [8,25 – 28].
Revaskularizační intervence
Revaskularizace může zlepšit klaudikační obtíže, zlepšit kvalitu života a odstranit projevy CLI. Revaskularizační techniky zahrnují endovaskulární léčbu (perkutánní angioplastika, implantace stentu nebo stentgraftu, subintimální angioplastika, mechanická trombektomie a aterektomie, aspirace trombů, katétrem řízená trombolýza) a chirurgické přístupy (endarterektomie, bypass s využitím autologního žilního nebo syntetického štěpu). Počet revaskularizačních intervencí je 8 – 16krát vyšší u pacientů s DM než u pacientů bez diabetu [4,29]. U pacientů s DM je endovaskulární léčba vzhledem k distální lokalizaci ICHDK, polymorbiditě a věku často metodou volby. Endovaskulární léčba je méně invazivní, zkracuje hospitalizaci, je opakovatelná, umožňuje ošetřit distální segmenty tepen, ale je finančně náročnější ve srovnání s chirurgickou léčbou. Výskyt restenóz je mnohem častější u pacientů s DM, stejně jako je vyšší výskyt uzávěru bypassu [1,30]. Velmi slibné je ovlivnění restenóz použitím lékem potažených stentů a/ nebo balónkových dilatačních katétrů. Přežití diabetiků po chirurgické revaskularizaci je jen mírně nižší ve srovnání s jedinci bez DM, nicméně osud nemocných po amputaci je u diabetiků s ICHDK výrazně horší [4]. 3leté přežívání po amputaci u pacientů s DM a ICHDK je menší než 50 % [3].
Závěr
Pacienti s DM mají vysoké riziko vzniku ICHDK. ICHDK u nich začíná v nižším věku, rychleji progreduje a ve velkém procentu je asymptomatická. Typické bývá postižení bércových tepen a vyšší výskyt CLI s ulceracemi a gangrénou s vysokým rizikem amputace. Základním léčebným opatřením je změna životního stylu, přerušení kouření, redukce váhy, pravidelné fyzické cvičení, péče o kůži dolní končetiny a diabetická dieta. Protidestičková léčba může zabránit progresi ICHDK a redukovat kardiovaskulární příhody u pacientů s DM. Současně je třeba farmakologicky ovlivnit přítomné rizikové faktory aterosklerózy, zejména dyslipidemii, hypertenzi a samozřejmě diabetes mellitus. Terapeutickou intervencí u CLI je chirurgická a v poslední době zejména endovaskulární revaskularizace. Časná detekce ICHDK u pacientů s DM, důsledná prevence a agresivní léčba rizikových faktorů může výrazně ovlivnit vysoký výskyt amputací a také snížit kardiovaskulární morbiditu a mortalitu [1,3,8,22,29]. Mezioborová spolupráce je více než důležitá.
Práce byla podpořena výzkumným záměrem MZO 00179906.
MUDr. Radovan Malý, Ph.D.
www.fnhk.cz
e-mail: malyr@volny.czDoručeno do redakce: 19. 2. 2010
Zdroje
1. Norgren L, Hiatt WR, Dormandy JA et al. Inter ‑ Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007; 33 (Suppl 1): S1 – S75.
2. Jude EB. Intermittent claudication in the patient with diabetes. Br J Diabetes Vasc Dis 2004; 4 : 238 – 242.
3. Jude EB, Oyibo SO, Chalmers N et al. Peripheral arterial disease in diabetic and nondiabetic patients: a comparison of severity and outcome. Diabetes Care 2001; 24 : 1433 – 1437.
4. American Diabetes Association. Peripheral arterial disease in people with diabetes. Diabetes Care 2003; 26 : 3333 – 3341.
5. Kannel WB, McGee DL. Update on some epidemiologic features of intermittent claudication: the Framingham Study. J Am Geriatr Soc 1985; 33 : 13 – 18.
6. Hirsch AT, Criqui MH, Treat ‑ Jacobson D et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001; 286 : 1317 – 1324.
7. Melton LJ 3rd, Macken KM, Palumbo PJ et al. Incidence and prevalence of clinical peripheral vascular disease in a population‑based cohort of diabetic patients. Diabetes Care 1980; 3 : 650 – 654.
8. Jude EB, Eleftheriadou I, Tentolouris N. Peripheral arterial disease in diabetes ‑ a review. Diabet Med 2010; 27 : 4 – 14.
9. Walters DP, Gatling W, Mullee MA et al. The prevalence, detection, and epidemiological correlates of peripheral vascular disease: a comparison of diabetic and non‑diabetic subjects in an English community. Diabet Med 1992; 9 : 710 – 715.
10. Adler AI, Stevens RJ, Neil A et al. UKPDS 59: hyperglycemia and other potentially modifiable risk factors for peripheral vascular disease in type 2 diabetes. Diabetes Care 2002; 25 : 894 – 899.
11. Hirsch AT, Hiatt WR. PAD awareness, risk, and treatment: new resources for survival – the USA PARTNERS program. Vasc Med 2001; 6 (Suppl 3): 9 – 12.
12. Moulik PK, Mtonga R, Gill GV. Amputation and mortality in new‑onset diabetic foot ulcers stratified by etiology. Diabetes Care 2003; 26 : 491 – 494.
13. Dolan NC, Liu K, Criqui MH et al. Peripheral artery disease, diabetes, and reduced lower extremity functioning. Diabetes Care 2002; 25 : 113 – 120.
14. Karetová D, Staněk F. Angiologie pro praxi. Praha: Maxdorf 2001.
15. Resnick HE, Lindsay RS, McDermott MM et al. Relationship of high and low ankle brachial index to all‑cause and cardiovascular disease mortality: the Strong Heart Study. Circulation 2004; 17; 109 : 733 – 739.
16. Marso SP, Hiatt WR. Peripheral arterial disease in patients with diabetes. J Am Coll Cardiol 2006; 47 : 921 – 929.
17. Aboyans V, Ho E, Denenberg JO et al. The association between elevated ankle systolic pressures and peripheral occlusive arterial disease in diabetic and nondiabetic subjects. J Vasc Surg 2008; 48 : 1197 – 1203.
18. Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001; 344 : 1608 – 1621.
19. Tsai JC, Chan P, Wang CH et al. The effects of exercise training on walking function and perception of health status in elderly patients with peripheral arterial occlusive disease. J Intern Med 2002; 252 : 448 – 455.
20. Holman RR, Paul SK, Bethel MA et al. 10‑year follow‑up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359 : 1577 – 1589.
21. Secondary prevention of vascular disease by prolonged antiplatelet treatment. Antiplatelet Trialists’ Collaboration. Br Med J (Clin Res Ed) 1988; 296 : 320 – 331.
22. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348 : 1329 – 1339.
23. Chapman TM, Goa KL. Cilostazol: a review of its use in intermittent claudication. Am J Cardiovasc Drugs 2003; 3 : 117 – 138.
24. Šmahelová A. A role of diabetologist in management of infections in diabetics. Vnitř Lék 2006; 52 : 443 – 445.
25. Procházka V, Gumulec J, Chmelová J et al. Autologous bone marrow stem cell transplantation in patients with end‑stage chronical critical limb ischemia and diabetic foot. Vnitř Lék 2009; 55 : 173 – 178.
26. Talapková R, Hudeček J, Sinák I et al. The salvage of ischaemic limb by therapeutical angiogenesis. Vnitř Lék 2009; 55 : 179 – 183.
27. Bláha M, Rencová E, Bláha V et al. Rheopheresis in vascular diseases. Int J Artif Organs 2008; 31 : 456 – 457.
28. Weiss N. Lipid apheresis and rheopheresis for treatment of peripheral arterial disease. Atheroscler Suppl 2009; 10 : 62 – 69.
29. Varu VN, Hogg ME, Kibbe MR. Critical limb ischemia. J Vasc Surg 2010; 51 : 230 – 241.
30. Maca TH, Ahmadi R, Derfler K et al. Influence of lipoprotein(a) on restenosis after femoropopliteal percutaneous transluminal angioplasty in type 2 diabetic patients. Diabet Med 2002; 19 : 300 – 306.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Úvodní slovoČlánek Angiopatie a oko
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Úvodní slovo
- Diabetes a prediktivní medicína – paralaxa současnosti
- Endokrinní odchylky a cévy u diabetiků
- Diabetes mellitus a protrombotická aktivita
- Co spojuje obezitu a aterosklerózu?
- Pohybová aktivita v prevenci cévních komplikací a diabetes
- Hyperglykemie v akutní fázi mozkové ischemie a rekanalizační léčba
- Diabetes mellitus a ischemická choroba srdeční
- Léčba hypertenze u pacientů s diabetes mellitus a ischemickou chorobou dolních končetin
- Antihyperglykemická léčba a cévní onemocnění
- Chirurgická léčba ischemické choroby srdeční a diabetes mellitus
- Perkutánní intervenční výkony na věnčitých tepnách u diabetiků
- Péče o diabetika s cévním onemocněním
- Flebologické problémy a diabetes
- Angiopatie a oko
- Ischemická choroba dolních končetin a diabetes
- Komplexní péče o diabetika se syndromem diabetické nohy
- Klinický význam cévního postižení u diabetiků s onemocněním ledvin – pohled nefrologa
- Lokální léčba ran a cévní zásobení
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Angiopatie a oko
- Ischemická choroba dolních končetin a diabetes
- Chirurgická léčba ischemické choroby srdeční a diabetes mellitus
- Diabetes mellitus a ischemická choroba srdeční
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



