-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 2, p. 128-129.
Kategorie: Výběr z tisku a zprávy o knihách
Omar Abdel-Wahab, MD, Assistant Member, Attending Physician Memorial Sloan Kettering Cancer Center, New York, NY
Nedávné genomické analýzy myeloidních neoplazií odhalily celou řadu rekurentních genetických změn. Zatímco je pravděpodobné, že tyto objevy přinesou popis nových slibných molekulárních cílů léčby, tak ale také celá řada nalezených genetických změn představuje mutace tzv. „loss-of-function“ (ztráta funkčnosti genu), které patrně nebude možné cílit přímo. Takovým příkladem jsou změny na genu TET2, jehož delece či mutace „loss-of-function“ již byla popsána prakticky u všech typů myelodních neoplazií [1]. Většina mutací a delecí v TET2 zasahuje pouze jednu alelu. Experimenty na myších však ukázaly, že již ztráta jedné alely TET2 zásadně snižuje sebeobnovovací schopnosti hematopoetických kmenových buněk (HSC) a zvyšují sklon k myeloidní transformaci [2].
TET2 je člen rodiny proteinů TET (TET1, TET2 a TET3), které fungují jako α-ketoglutarát a Fe2+-dependentní dioxygenázy katalyzující oxidaci 5-methylcytosinu na 5-hydroxymethylcytosin, 5-formylcytosin a 5-karboxylcytosin (obr. 1). Jde o metabolické kroky vedoucí k postupné demetylaci DNA a ztráta funkce TET2 tedy asociuje s globální hypermethylací DNA. Nedávné studie skupin Luisy Cimmino [3] a Michalise Agathocleouse [4] zcela nezávisle přinesly poznatky o schopnosti vitaminu C mimikovat funkci TET2, a tím obnovit hematopoézu v myších i v lidských buňkách s nedostatkem funkčního proteinu TET2. Tomuto objevu přecházelo pozorování in vitro popisující schopnost vitaminu C zvyšovat aktivitu všech proteinů rodiny TET [5], nikdy dříve ani později netestováno in vivo.>
Obr. 1. Enzymy z rodiny TET jsou α-ketoglutarát a Fe2+- dependentní dioxygenázy katalyzující oxidaci 5-methylcytosinu (5mC) na 5-hydroxymethylcytosin (5hmC), 5-formylcytosin (5fC) a 5-karboxylcytosin (5caC). Ztráta TET2, běžná u myeloidních neoplazií a klonální hematopoézy, vede k poškození seboeobnovovací kapacity HSC. Podání vitaminu C (kofaktor α-ketoglutarát a Fe2+-dependentní dioxygenázy) obnoví aktivitu proteinů TET a potlačí rozvoj leukemie. Oxidace DNA skrze TET2 (indukovaná vitaminem C) zvyšuje citlivost k inhibitorům PARP. 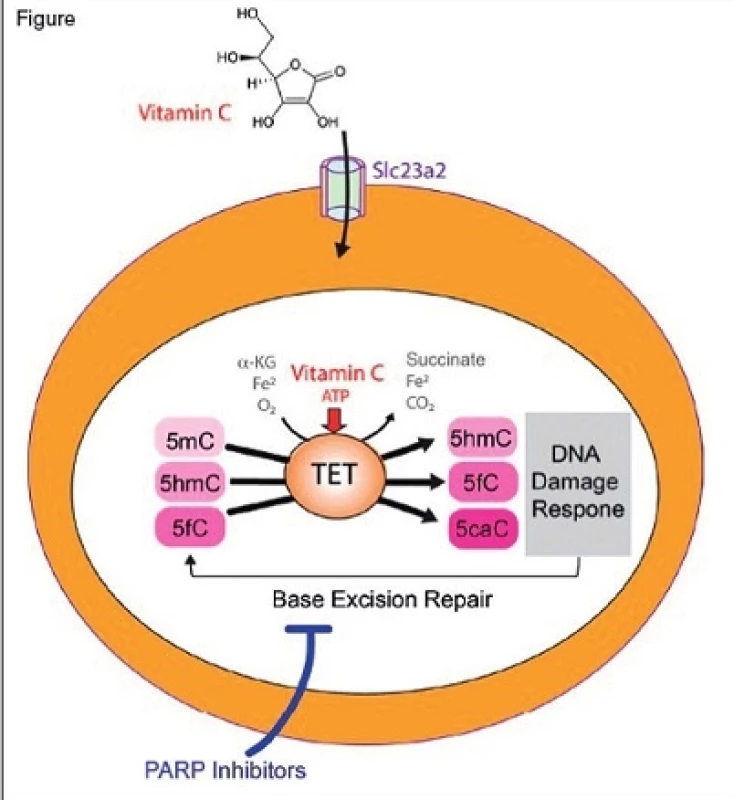
Laboratoř doktorky Cimmino zpočátku řešila otázku, zda je deficience TET2 nezbytná pro udržení leukemického bloku [5]. Využitím myšího modelu s reverzibilním možností snížení hladiny Tet2 autoři popsali zvýšení myeloidní transformace při snížené hladině Tet2 a obnovení sebeobnovovací schopnosti HSC po opětovném zvýšení exprese Tet2. Toto opětovné zvýšení navíc spustilo tranzientní buněčnou odpověď na poškození DNA, což je patrně způsobeno zvýšením hladiny metabolitů 5-formylcytosinu a 5-karboxylcytosinu. Takto modifikovaný cytosin je buňkou totiž reparačně vystřižen. Jedním z řídicích prvků této excize je poly(ADP-ribose) polymeráza (PARP). Autoři přepokládají, že oxidace DNA skrze proteiny TET (indukované vitamínem C) stojí za hypersenzitivitou buněk k inhibici PARP. Tento závěr opírají o pozorování, že PARP inhibitor olaparid podávaný in vitro v kombinaci s vitaminem C vede ke zvýšené mortalitě leukemických buněk, než indukuje olaparid samotný.
Skupina kolem Michalise Agathocleouse identifikovala též kritickou roli vitaminu C v regulaci hematopoézy skrze děje závislé na enzymech TET, nicméně ve zcela odlišném kontextu. Srovnáním metabolické analýzy HSC vs. diferencující progenitory ukazuje, že myší i lidské HSC se vyznačují vysokou hladinou vitaminu C. To je dáno skutečností, že HSC ve srovnání s progenitory exprimují zhruba 20krát vyšší hladinu Slc23a2, importéru pro vitamin C.
Deplece vitaminu C delecí enzymu nezbytného pro syntézu vitaminu C u myši (gulonolakton oxidáza) v kombinaci s omezenou schopností přijímat vitamin C do buňky vede ke zvýšené kumulaci HSC, která může být překonána podáním vitaminu C.
Z pohledu maligní hematopoézy se ukazuje, že ztráta funkce Tet2 kooperuje s mutací Flt3ITD v transformaci do akutní myeloidní leukemie (AML) u myši [6]. Není tedy překvapivé, že deplece vitaminu C též přispívá k leukemogenezi ve Flt3ITD mutantních myších a v myších s mutací Flt3ITD a haploinsuficienci Tet2. Obdobně jako v práci skupiny doktorky Cimmino, podávání vitaminu C těmto myším mělo antileukemický efekt, dokonce i při již plně rozvinuté AML.
Z výše uvedeného je zřejmé, že fyziologicky měnící se hladina vitaminu C reguluje funkčnost HSC a ovlivňuje iniciační procesy maligního zvratu. Vysoká variabilita hladiny vitaminu C v populaci tedy otevírá otázku významnosti hladiny vitaminu C v iniciaci a progresi leukemie. Práce obou výše zmíněných vědeckých skupin popisují, že vysoká dávka intravenózně podaného vitaminu C mohou představovat klíč k účinnější léčbě klonálních hematologických onemocnění asociovaných s deficiencí TET2 a představují kandidátní klinickou studii kombinující dávkování vitaminu C s inhibitory PARP v léčbě leukemických onemocnění.
Převzato z portálu The Hematologist – publikováno 27. října 2017 (Vitamin C Treatment Restores TET2 Deficiency and Confers Sensitivity to PARP Inhibition).
Zdroje
1. Abdel-Wahab O, Mullally A, Hedvat C, et al. Genetic characterization of TET1, TET2, and TET3 alterations in myeloid malignancies. Blood. 2009;114(1):144–147.
2. Moran-Crusio K, Reavie L, Shih A, et al. Tet2 loss leads to increased hematopoietic stem cell self-renewal and myeloid transformation. Cancer Cell. 2011;20(1):11–24.
3. Cimmino L, Dolgalev I, Wang Y, et al. Restoration of TET2 Function Blocks Aberrant Self-Renewal and Leukemia Progression. Cell. 2017;170(6):1079-1095 e1020.
4. Agathocleous M, Meacham CE, Burgess RJ, et al. Ascorbate regulates haematopoietic stem cell function and leukaemogenesis. Nature. 2017;549(7673):476–481.
5. Blaschke K, Ebata KT, Karimi MM, et al. Vitamin C induces Tet-dependent DNA demethylation and a blastocyst-like state in ES cells. Nature. 2013;500(7461):222–226.
6. Shih AH, Jiang Y, Meydan C, et al. Mutational cooperativity linked to combinatorial epigenetic gain of function in acute myeloid leukemia. Cancer Cell. 2015;27(4):502–515.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 2- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Predikce vzniku inhibitoru faktoru VIII v kohortě SIPPET pomocí analýzy mutací a měření antigenu faktoru VIII
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
- Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11
- 100. výročí založení Československé republiky – vzpomínky hematologa
- Prof. MUDr. Milan Bláha, CSc., osmdesátníkem
- Doc. MUDr. Adela Bártová, CSc. (1927–2018)
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- Srovnatelná účinnost přímých antikoagulancií a warfarinu u pacientů s rakovinou a fibrilací předsíní
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



