-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
Hereditary erythroenzymopathies associated with haemolytic anaemia – their diagnostics in the czech and Slovak populations
Hereditary red blood cell (RBC) enzymopathies are genetic disorders affecting genes encoding red blood cell enzymes. They cause a specific type of anaemia designated hereditary nonspherocytic haemolytic anaemia. Enzymopathies affect cellular metabolism, which in the RBC mainly consists of anaerobic glycolysis, the hexose monophosphate shunt, glutathione metabolism and nucleotide metabolism.
Enzymopathies are commonly associated with normocytic/slightly macrocytic normochromic haemolytic anaemia. In general, RBC enzymopathies are not characterized by specific abnormalities in RBC morphology. Routinely used haematology methods are unable to pinpoint a specific enzyme defect. Definitive diagnosis is based on the detection of reduced specific enzyme activity and molecular characterization of the defect at DNA level.
This work represents advanced and up-to-date information regarding RBC enzyme deficiencies in the Czech and Slovak populations dating from the 1980s, when mutations in Czech and Slovak subjects resulting in glucose-6-phosphate dehydrogenase (G6PD) and pyruvate kinase (PK) deficiencies were first described. Both deficiencies represent the most common erythroenzymopathies worldwide. Since 2013, our laboratory has focused on the introduction of direct enzyme assays supplemented by genetic testing in patients with haemolytic anaemia and suspected erythroenzymopathy. To date, several different enzyme defects have been diagnosed in twenty-four patients. Apart from G6PD and PK deficiencies (9 and 12 cases), 2 families with glucose phosphate isomerase (GPI) defect and 1 family with the very rare hexokinase (HK) deficiency have been identified. The two latter deficiencies were diagnosed in the Czech and Slovak populations for the first time. Among the 22 identified mutations, were novel and have not been previously reported in literature:
5, namely G6PD p.(Phe216Tyr), PK p.(Arg518Leufs*12), p.(Asp293Val) and GPI p.(Ser160Pro), p.(Arg472Cys).
Key words:
erythrocytes – haemolytic anemia – enzymopathies
Autoři: P. Kořalková 1; R. Mojzíková 1; D. Pospíšilová 2; K. Indrák 3; J. Čermák 4; V. Divoký 1,3
Působiště autorů: Ústav biologie, Lékařská fakulta, Univerzita Palackého v Olomouci 1; Dětská klinika, Lékařská fakulta Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc 2; Hemato-onkologická klinika, Lékařská fakulta Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc 3; Ústav hematologie a krevní transfuze, Praha 4
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 2, p. 104-114.
Kategorie: Souhrnné a edukační práce
Souhrn
Erytrocytární enzymopatie je genetické onemocnění vyznačující se vrozenými kvantitativními či kvalitativními abnormalitami erytrocytárních enzymů, které jsou jednou z příčin vzniku vrozené nesférocytární hemolytické anémie. V případě zralých erytrocytů, které neobsahují jádro, mitochondrie ani endoplazmatické retikulum, se enzymopatie týkají glykolýzy a pentózafosfátového cyklu, popř. metabolismu glutathionu a nukleotidů. Mezi nejrozšířenější abnormality patří deficit pyruvátkinázy a glukóza-6-fosfátdehydrogenázy, které jsou vzácnou příčinou vzniku hemolytické anémie v české i slovenské populaci.
Enzymopatie jsou charakterizovány normo-/lehce makrocytární normochromní anémií s obecnými znaky hemolýzy. Při negativní rodinné anamnéze, je diagnostika enzymopatií vzhledem k minimálním charakteristickým abnormalitám v morfologii erytrocytů komplikovaná (proto byly dříve označovány jako vrozené nesférocytární hemolytické anémie). Základní diferenciální diagnostika nedokáže rozlišit jednotlivé enzymové defekty. Přesná diagnóza může být určena až na základě snížené specifické aktivity daného enzymu a potvrzena dále na molekulárně-genetické úrovni.
Deficit glukóza-6-fosfátdehydrogenázy (G6PD) a pyruvátkinázy (PK) byl v české a slovenské populaci popsán již v 80. letech. Ucelený přehled o výskytu tohoto onemocnění v české a slovenské populaci, zvláště pak o jeho vzácnějších formách, doposud chybí. Od roku 2013 se naše laboratoř zabývá metodou přímého stanovení aktivity enzymů s následným genetickým vyšetřením u pacientů se suspektní enzymopatií. V současné době jsme jedinou specializovanou laboratoří zabývající se touto diagnostikou v České republice, resp. ve střední Evropě. Doposud byl enzymový deficit diagnostikován u dvaceti čtyř pacientů. Vedle nejčastějších deficitů G6PD a PK (9 a 12 případů), byly identifikovány 2 rodiny s deficitem glukózafosfátizomerázy (GPI) a 1 rodina s velmi vzácným deficitem hexokinázy (HK). Deficit GPI a HK jsme v české a slovenské populaci diagnostikovali poprvé. Celkově bylo dosud identifikováno dvacet dva kauzálních mutací, z nichž pět bylo v literatuře popsáno poprvé – G6PD p.(Phe216Tyr), PK p.(Arg518Leufs*12), p.(Asp293Val), GPI p.(Ser160Pro) a p.(Arg472Cys).
Klíčová slova:
erytrocyty – hemolytická anémie – enzymopatie
ÚVOD
Metabolismus erytrocytů
Erytrocyty patří k nejspecializovanějším buňkám lidského těla. Diferenciací a zráním ztrácí erytrocyty řadu významných organel – mitochondrie, ribozomy, jádro, endoplazmatické retikulum, které jsou nezbytné pro syntézu proteinů, lipidů a oxidativní fosforylaci. Navzdory tomu si buňky udržují svoji integritu a jsou schopny vykonávat své funkce. Většina metabolických potřeb erytrocytů je tak závislá na anaerobní glykolýze, pentózafosfátové dráze a metabolismu glutathionu a nukleotidů (obr. 1).
Obr. 1. Hlavní metabolické dráhy erytrocytu
Degradací glukózy anaerobní glykolýzou a pentózafosfátovou dráhou vznikají tři základní metabolické produkty (ATP, NADH a NADPH) nezbytné pro udržení životaschopnosti erytrocytu. ATP – adenosintrifosfát; ADP – adenosindifosfát; AMP – adenosinmonofosfát; NADP/NADPH – oxidovaná/ redukovaná forma nikotinamidadenindinukleotidfosfátu; NAD/NADH – oxidovaná/redukovaná forma nikotinamidadenindinukleotidu; MetHb – methemoglobin, Hb – hemoglobin (upraveno podle [50])![Hlavní metabolické dráhy erytrocytu<br> Degradací glukózy anaerobní glykolýzou a pentózafosfátovou dráhou vznikají tři základní metabolické produkty (ATP, NADH a NADPH) nezbytné pro udržení životaschopnosti erytrocytu. ATP – adenosintrifosfát; ADP – adenosindifosfát; AMP – adenosinmonofosfát; NADP/NADPH – oxidovaná/ redukovaná forma nikotinamidadenindinukleotidfosfátu; NAD/NADH – oxidovaná/redukovaná forma nikotinamidadenindinukleotidu; MetHb – methemoglobin, Hb – hemoglobin (upraveno podle [50])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/53be1f0d0276058ba79b9d41a397576e.jpeg)
Anaerobní glykolýza představuje díky tvorbě adenosintrifosfátu (ATP) hlavní zdroj energie erytrocytů. Během několikastupňového procesu je glukóza metabolizována (popř. fruktóza, manóza, galaktóza) na laktát za vzniku redukovaného nikotinamidadenin-dinukleotidu (NADH) a ATP. Zatímco ATP zajišťuje pohon sodno-draselných pump, a podílí se tak na udržení bikonkávního tvaru buňky, NADH jako kofaktor cytochrom-b5-reduktázy umožňuje redukci oxidovaných forem hemoglobinu. Je tedy nezbytným prvkem obranného mechanismu proti reaktivním radikálům. Důležitou součástí anaerobní glykolýzy savčích erytrocytů je Rapoport-Lueberingův cyklus generující 2,3-bis--fosfoglycerát, který společně s ATP zásadním způsobem ovlivňuje afinitu hemoglobinu ke kyslíku [1–5]. Za standardních fyziologických podmínek se 90 % glukózy spotřebuje anaerobní glykolýzou. Zbylá glukóza je metabolizována pomocí pentózafosfátové (PP) dráhy. Tento důmyslný způsob metabolizace glukózy společně s metabolismem glutathionu poskytuje vysoce účinnou ochranu buňky před oxidativním stresem. Hlavním cílem PP dráhy je tvorba redukčního potenciálu ve formě NADPH, který slouží jako donor elektronů pro řadu významných enzymatických reakcí a bývá nezbytným pro ochranu před oxidativními radikály. Současně NADPH působí jako kofaktor glutathionreduktázy (metabolismus glutathionu), která udržuje glutathion ve své redukované formě (GSH), a zajištuje tak ochranu před reaktivními radikály [6, 7]. Metabolismus nukleotidů zahrnuje syntézu a degradaci purinových a pyrimidinových nukleotidů, které určují intracelulární koncentraci ATP a guanosintrifosfátu (GTP). Ve většině buněk lidského těla jsou purinové nukleotidy syntetizovány de novo nebo tzv. šetřící cestou (salvage pathway). Zralé erytrocyty nejsou schopny syntetizovat glutamin-5-fosforibozyl-1-pyrofosfátamidotransferázu, která je nezbytná pro syntézu de novo. Syntéza purinových nukleotidů proto probíhá pouze „šetřící cestou“. Syntéza probíhá z již existujících volných purinových bází nebo nukleosidů vzniklých degradací nukleových kyselin [8]. K dalším typickým znakům metabolismu erytrocytu patří minimální koncentrace pyrimidinových nukleotidů uvnitř erytrocytu. Během diferenciace erytrocytů dochází pomocí pyrimidin-5´-nukleotidázy k degradaci ribozomální RNA, čímž se snižuje i koncentrace pyrimidinových nukleotidů. Jsou proto ve zralém erytrocytu zastoupeny deriváty adeninu (adenosinmonofosfát – AMP, ADP, ATP) více než 97 % [9].
Erytrocytární enzymopatie
Erytrocytární enzymopatie je heterogenní skupina onemocnění vznikajících v důsledku geneticky podmíněných metabolických poruch (bodová mutace, inzerce, delece) erytrocytárních enzymů. Deficit či funkční porucha těchto enzymů má za následek zkrácené přežívání erytrocytů v krevním oběhu s hlavním klinickým projevem vrozené nesférocytární hemolytické anémie (hereditary nonspherocytic hemolytic anemia, HNSHA) [10, 11].
Vzhledem k „omezenému“ metabolismu erytrocytů se enzymové poruchy vyskytují ve 4 metabolických drahách – anaerobní glykolýza (Embden-Meyerhofova dráha), PP dráha, metabolismus glutathionu a nu-kleotidů. Jakákoliv změna (nedostatek enzymu nebo jeho omezená funkce) vede k nevratnému poškození celého metabolismu erytrocytu a předčasné hemolýze. Rychlost i stupeň hemolýzy závisí na rozsahu poškození daného enzymu a funkčních vlastnostech mutantního enzymu, popř. na uplatnění kompenzačních mechanismů, jako je zvýšení produkce červených krvinek projevující se retikulocytózou [12].
Od roku 1956, kdy byl poprvé popsán deficit glukóza-6-fosfátdehydrogenázy (G6PD), jsou v současnosti známy mutace většiny enzymů všech 4 metabolických drah (tab. 1). Mezi nejfrekventovanější defekty, které budou popsány v následujících odstavcích, patří deficit pyruvátkinázy (PK), G6PD a pyrimidin-5´-nukleotidázy (P5N).
Tab. 1. Přehled klinicky významných enzymových defektů vedoucích k HNSHA 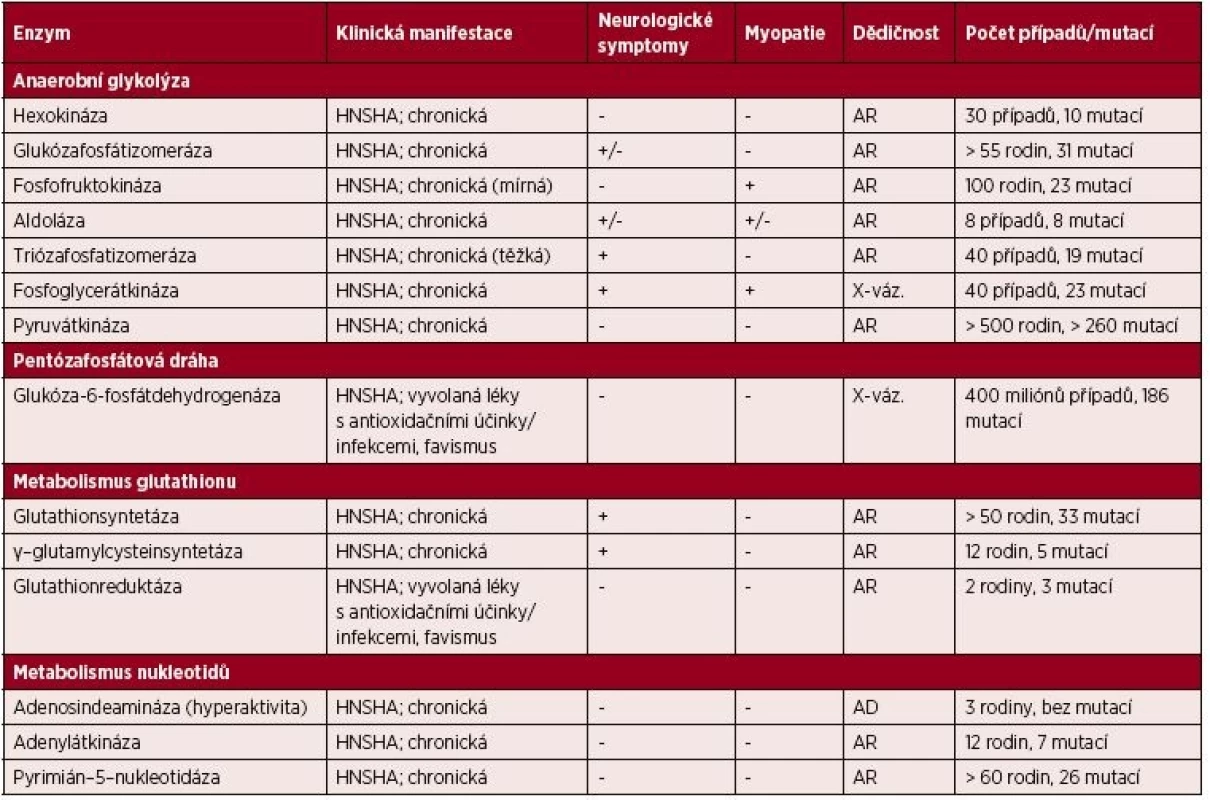
HNSHA – chronická nesférocytární hemolytická anémie; AR – autozomálně recesivní, AD – autozomálně dominantní; X-váz. – onemocnění vázané na chromozom X Enzymopatie glykolýzy
Anaerobní glykolýza představuje hlavní dráhu pro metabolizaci glukózy. Rychlost glykolýzy je regulována pomocí tvz. „rate-limiting“ enzymů (hexokináza, fosfofruktokináza a PK) a dostupností NADH a ATP. Většina enzymových defektů je spojena s HNSHA. Dědičnost enzymopatií je autozomálně recesivní. Výjimku tvoří deficit fosfoglycerátkinázy (vázaný na X chromozom) a enolázy (autozomálně dominantní) [11].
Deficit PK je nejčastější enzymový defekt anaerobní glykolýzy. Odhadovaná frekvence jeho výskytu u bílé populace je 1 : 20 000 [13]. PK katalyzuje ireverzibilní přeměnu fosfoenolpyruvátu na pyruvát za uvolnění ATP. Enzym je alostericky regulován fruktózou-1,6-bisfosfátem (pozitivní regulace) a inhibován ATP. Savčí PK se vyskytuje ve čtyřech izoenzymech – M1, M2, L a R. Liší se od sebe jak kinetickými vlastnostmi, tak i lokalizací. Izoenzymy jsou kódovány dvěma různými geny PKM a PKLR. Gen PKLR, lokalizovaný na chromozomu 1 (1q21) [14], řídí expresi PK-R a PK-L v erytrocytech a játrech. Nedostatek PK-R má dva hlavní metabolické důsledky: snížení tvorby ATP a akumulaci 2,3-bisfosfoglycerátu [15]. Zatímco nedostatek ATP vede k předčasnému odstranění erytrocytu z krevního oběhu, zvýšená hladina 2,3-bisfosfoglycerátu snižuje afinitu hemoglobinu ke kyslíku, a částečně tak kompenzuje tkáňovou hypoxii způsobenou anémií [16]. V současnosti známe přes 260 mutací genu PKLR spojených s deficitem PK (http://www.hgmd.org/). Většinou se jedná o jednonukleotidové záměny (72 %) vedoucí především k aminokyselinovým substitucím; ve 12 % mutací dochází k předčasné tvorbě stop kodonu. Až 60 % hlášených mutací je distribuováno v Evropě [17]. Mezi nejčastější mutace vedoucí k deficitu patří mutace 1456T a 1529A [18]. Klinický obraz deficitu PK je velmi variabilní. Je popsán výskyt mírných plně kompenzovaných hemolytických procesů bez známky anémie až po velmi těžké, kdy jsou pacienti závislí na transfuzích [17, 18]. V několika případech byl deficit PK příčinou hydrops fetalis a úmrtí v neonatálním období [19]. V dospělosti je klinický obraz obvykle stabilní, může se zhoršit během infekcí nebo jiných forem fyziologického stresu. Splenektomie má za následek nejen zvýšení hladiny Hb, ale paradoxně i množství retikulocytů. Přetížení železem vyskytující se u většiny pacientů s deficitem PK je považováno za multifaktoriální [20].
Druhým nejčastějším defektem anaerobní glykolýzy je deficit GPI. Doposud bylo identifikováno 34 mutací spojených s deficitem GPI a HNSHA. Primárně se jedná o jednobodové mutace. Jsou však známy i mutace vedoucí k tvorbě stop kodonu nebo sestřihové mutace (http://www.hgmd.org/). U homozygotních nosičů je aktivita enzymu menší než 25 %. Jeho úplný deficit je letální již v embryonálním období. Na rozdíl od jiných enzymopatií je pozorován častější výskyt hydrops fetalis [21]. Současně může být deficit GPI spojen i s nehematologickými poruchami, zejména neurologickými defekty nebo mentální retardací [11].
Deficit fosfofruktokinázy (PFK), deficit aldolázy (ALD) a triozafosfátizomerázy (TPI) patří mezi vzácnější enzymové defekty. Erytrocytární PFK se skládá ze dvou typů podjednotek: PFK-L (játra) a PFK-M (sval), které mohou tvořit 5 různých izoenzymů (M4, M3L1, M2L2, M1L3, L4). V případě mutace podjednotky PFK-M je v erytrocytech exprimována pouze funkční podjednotka PFK-L, což způsobuje částečný deficit PFK. Pacienti s deficitem PFK proto obvykle vykazují jen mírnou nebo plně kompenzovanou hemolytickou anémii (HA). Naopak svalové buňky obsahují pouze PFK-M podjednotku, deficit má tedy těžší charakter a následně vede k myopatii [22]. Deficit TPI je nejzávažnější poruchou anaerobní glykolýzy a vede k úmrtí již v raném dětství. TPI katalyzuje konverzi mezi dihydroxyacetonfosfátem (DHAP) a glyceraldehyd-3-fosfátem. Právě akumulace DHAP způsobená deficitem TPI pravděpodobně vede k rozvoji těžké anémie [23]. Nicméně deficit TPI je spojen i se závažnějšími následky, jako je mentální retardace a jiné neurologické dysfunkce. Ty se mohou objevit v důsledku tvorby toxických proteinových agregátů, které jsou vyvolány nesprávným složením enzymové molekuly TPI [23, 24]. U pacientů s deficitem aldolázy je pozorována středně těžká až těžká HA. Stejně jako u deficitu TPI je deficit ALD spojen s neurologickými poruchami [24]. U několika postižených jedinců byly přítomny opakující se epizody rabdomyolýzy a svalových slabostí [25]. Těžký deficit ALD je pravděpodobně letální již v embryonálním období [26].
Hexokináza (HK) katalyzuje přenos fosfátu na glukózu za tvorby glukóza-6-fosfátu. Tato reakce je jedním z regulačních míst anaerobní glykolýzy. HK je enzym s nejnižší aktivitou in vitro [11]. Lidské erytrocyty obsahují 2 různé izoenzymy – HK-1 a HK-R. Oba izoenzymy jsou kódovány stejným genem, avšak jejich transkripce je řízena alternativními promotory. Zatímco izoenzym HK-R je přítomen pouze v erytrocytech, izoenzym HK-1 je exprimován v různých savčích tkáních [27]. Nedostatek tohoto klíčového regulačního enzymu je obecně spojen s těžkou HA a může vést ke smrti v neonatálním období. Doposud bylo popsáno více než 30 případů deficitu HK [28].
Fosfoglycerátkináza (PGK) je jediný enzym glykolýzy, jehož gen je lokalizován na chromozomu X. Deficit PGK je spojen s chronickou hemolýzou, neurologickými poruchami (včetně mentální retardace a ataxie) a myopatií [29]. Existuje jen několik postižených jedinců, kteří trpí celým spektrem klinických příznaků. Klinický projev postižených jedinců vykazuje vysokou variabilitu. Byly popsány případy, kdy deficit PGK byl spojen pouze s myopatií, ale bez přítomnosti hemolýzy [30].
Ačkoliv byl popsán deficit i jiných glykolytických enzymů – glyceraldehyd-3-fosfátdehydrogenázy, fosfoglycerátmutázy a enolázy, přítomnost hemolýzy u těchto defektů nebyla popsána.
Enzymopatie PP dráhy a metabolismu glutathionu
Hlavní funkcí PP dráhy a metabolismu glutathionu je ochrana buňky před oxidativním stresem. NADPH produkovaný PP dráhou udržuje glutathion v jeho redukované formě. Ten následně chrání molekuly hemoglobinu a další makromolekuly proti reaktivním kyslíkovým radikálům (ROS). Klíčovým enzymem PP dráhy je G6PD. Jeho deficit patří k nejčastějším enzymopatiím jak ve světové populaci, tak i v ČR. Naopak výskyt deficitu glutathionreduktázy, popř. glutathion - syntetázy je velmi nízký. Defekty všech tří enzymů jsou spojeny s HNSHA [4].
G6PD katalyzuje přeměnu glukóza-6-fosfátu na 6-fosfoglukonolakton za uvolnění redukčního potenciálu ve formě NADPH. Za fyziologických podmínek je tato reakce zcela ireverzibilní, tudíž je brána jako regulační („rate-limiting step“). NADPH zajišťuje redukovanou formu glutathionu, který udržuje hemoglobin a další proteiny v redukované formě. Deficit G6PD patří k nejrozšířenějším a nejpočetnějším enzymovým abnormalitám na světě. Postihuje přes 400 milionů lidí [31]. G6PD deficit je výrazně rozšířen v endemických oblastech malárie – Asii, subsaharské Africe a Americe [32]. Gen kódující G6PD je lokalizován na chromozomu X a je vysoce polymorfní. Bylo popsáno více než 400 variant G6PD, z nichž 186 mutací je spojeno s deficitem G6PD. Ve většině případů se jedná o jednonukleotidové záměny, nicméně byly identifikovány i delece popř. intronové mutace (G6PD Varnsdorf, G6PD Zurich) [33, 34, 35]. Většina jedinců s deficitem G6PD je asymptomatická; pouze v důsledku zvýšeného oxidativního stresu (infekce, léky s oxidačním potenciálem, požití bobů Vicia faba) může docházet k rozvoji akutní hemolytické krize. Naopak G6PD varianty, které jsou charakterizovány velmi nízkou aktivitou G6PD (< 1 %), jsou spojeny s chronickou HNSHA [34]. Typickým morfologickým znakem deficitu G6PD je výskyt Heinzových tělísek. Vznikají v důsledku precipitace hemoglobinu (oxidační stres) a projevují se vznikem insolubilních tělísek na okrajích erytrocytu [36].
Glutathionreduktáza (GR) katalyzuje přeměnu oxidované formy glutathionu na redukovanou. Společně s G6PD patří ke klíčovým enzymům ochranného mechanismu erytrocytu. Poprvé byl deficit GR popsán v roce 1976. Je to autozomálně recesivní onemocnění, které je způsobeno převážně jednobodovými mutacemi vedoucími k záměně aminokyseliny nebo vzniku stop kodonu. Klinické příznaky jsou shodné s deficitem G6PD tj. hemolytická krize vyvolaná léky nebo požitím bobů Vicia faba, popř. novorozenecká žloutenka [37]. Glutathion (GSH) je v erytrocytech syntetizován z cysteinu, glutaminu a glycinu ve dvoustupňovém procesu katalyzovaném γ-glutamylcysteinsyntetázy (γ-GCS) a glutathionsyntetázy (GS). Jejich deficit snižuje obsah buněčného GSH a tím zvyšují citlivost buněk vůči oxidativnímu stresu. Poruchy těchto enzymů jsou velmi vzácné. Doposud bylo popsáno pouze 50 rodin s deficitem GS a 12 rodin s deficitem γ-GCS. Kromě akutních hemolytických krizí se může deficit projevit i poruchami nehematologického charakteru, jako jsou mentální retardace (deficit γ-GCS) a 5-oxyprolinurie (deficit GS) [38].
Enzymopatie metabolismu nukleotidů
Erytrocyty patří k buňkám s vysokým energetickým obratem. Ve zralém erytrocytu jsou více než v 97 % zastoupeny deriváty adeninu (AMP, ADP, ATP) [9]. To je zajištěno díky pyrimidin-5´-nukleotidáze (P5N), která během diferenciace erytrocytu umožňuje degradaci ribozomální RNA, čímž se snižuje kon-centrace pyrimidinových nukleotidů [8].
Deficit P5N patří k 3. nej-častější enzymopatii spojené s HNSHA, postižení jedinci vykazují mírnou až těžkou chronickou HA, splenomegalii a žloutenku. Deficit nebo snížená funkce P5N způsobí zvýšení koncentrace pyrimidinových nukleotidů, které následně v buňce precipitují ve formě nerozpustných agregátů, které jsou viditelné jako bazofilní tečkování na nátěru periferní krve [39]. Mechanismus rozvoje HA v důsledku akumulace pyrimidinových nukleotidů není znám. Nicméně nedávné studie prokázaly, že v důsledku deficitu dochází ke změně koncentrace GSH a transketolázy a aktivity ribóza-fosfátpyrofosfokinázy [40, 41].
LABORATORNÍ DIAGNOSTIKA A LÉČBA
Erytrocytární enzymopatie jsou spojeny s normocytární/lehce makrocytární normochromní anémií a obecnými znaky hemolýzy, tj. zvýšená koncentrace nekonjugovaného bilirubinu a laktátdehydrogenázy či sníženou koncentrací haptoglobinu a zvýšeným až vysokým počtem retikulocytů [42]. Kromě výrazného bazofilního tečkování v případě deficitu P5N a výskytu Heinzových tělísek souvisejících s deficitem G6PD a GR, neexistují žádné specifické morfologické znaky charakterizující enzymopatie [34, 39]. Testy tepelné stability, testy autohemolýzy, kryohemolýzy a testy osmotické rezistence bývají v případě enzymopatií negativní. Základní diferenciální diagnostika může pouze podpořit/vyloučit podezření na enzymový deficit; není však schopna rozlišit jednotlivé enzymové defekty (obr. 2).
Obr. 2. Diferenciální diagnostika vrozených nesférocytárních hemolytických anémií
Základní diferenciální diagnostika může pouze podpořit/vyloučit podezření na enzymový deficit, není však schopna rozlišit jednotlivé enzymové defekty, které umožní rozlišit až biochemické analýzy. N – normální; ↓ – snížený; ↑ – zvýšený; XLSA – sideroblastická anémie s dědičností vázanou na chromozom X; α-tal. – α-talasemie minor; β-tal. – β-talasemie minor; IRIDA – „iron refractory iron deficiency anemia“ tzv. anémie z nedostatku železa, která nereaguje na léčbu železem; DMT1 def. – anémie způsobená mutací v genu pro transmembránový transportér železa DMT1; SB – sideroblasty; HbA2 – varianta hemoglobinu dospělého typu skládající se z alfa a delta řetězců; HbF – fetální hemoglobin; Fe – železo, Hb – hemoglobin; MCV – střední objem erytrocytu; HbF – fetální hemoglobin; LDH – laktátdehydrogenáza.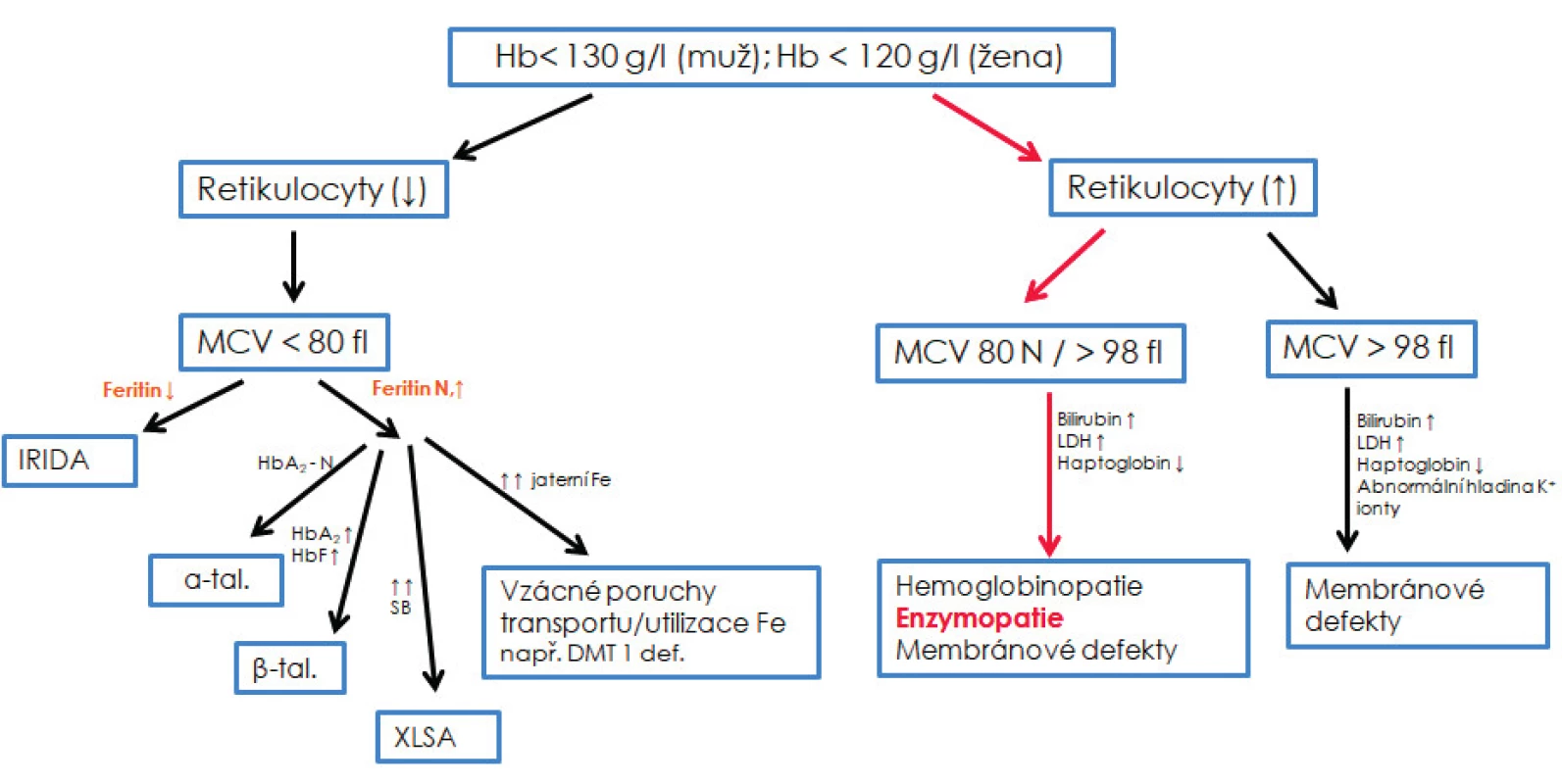
V současné době existuje řada kvantitativních nebo semikvantitativních screeningových testů pro stanovení deficitu G6PD a PK. Tyto testy jsou založeny na přímém/nepřímém detekování a/nebo kvantifikaci NADPH/NADH produkovaného G6PD, resp. PK [36]. Přestože jsou tyto testy obvykle rychlé a levné, jsou schopny rozpoznat pouze nejčastější enzymové defekty.
Jedním z klasických přístupů, který dokáže odhalit i vzácné enzymopatie, je přímé stanovení aktivity erytrocytárních enzymů pomocí ultrafialové spektroskopie, které se však provádí jen v některých specializovaných laboratořích, mezi které patří i olomoucké pracoviště. Na základě specifické reakce, charakteristické pro daný enzym a jeho substrát (NAD+, NADP+, NADH, NADPH), je kontinuálně sledován nárůst (či pokles) absorbance v čase. Specifická aktivita konkrétního enzymu je pak vyjádřena jako U/g Hb [1]. I přes řadu výhod (vysoká citlivost a vysoká specifičnost) má tato metoda řadu úskalí, které mohou ovlivnit výsledky a jejich interpretaci. Enzymová aktivita může být ovlivněna faktory, jako jsou:
- podmínky skladování a přepravy vzorků krve (tj. stabilita enzymů in vitro),
- nedostatečná separace leukocytů a krevních destiček (leukocyty a krevní destičky mohou zvyšovat specifickou aktivitu),
- krevní transfuze (vzorek krve může obsahovat erytrocyty dárce),
- věk pacienta (exprese mnoha enzymů je závislá na věku) a
- zvýšený počet retikulocytů (u mladých erytrocytů je aktivita řady enzymů např. HK, PK, G6PD a P5N vyšší). V případě vysokého počtu retikulocytů může jakýkoliv defektní enzym vykazovat normální, nebo dokonce zvýšenou in vitro aktivitu [1, 2].
V případě deficitu erytrocytárních enzymů u nosičů homozygotní mutace je pokles specifické aktivity pod 25 %.Samotný průkaz snížení specifické aktivity daného enzymu ovšem nestačí k určení diagnózy. Ta musí být potvrzena následně na molekulárně-genetické úrovni, a to prokázáním kauzální mutace genu kódujícího příslušný enzym.
V současné době neexistuje specifická léčba pro jednotlivé typy enzymových defektů. U pacientů s těžkou a chronickou HA je léčba založena na transfuzích erytrocytární masy a chelatační terapii regulující množství ukládaného železa v organismu. V případě deficitu GPI, PK, PGK a P5N může být přínosná splenektomie. Terapeutický efekt je však variabilní a obtížně předvídatelný. Indrák et al. popsali fenotyp 2 mladých nepříbuzných žen s deficitem PK, kterým byla v raném dětství provedena splenektomie pro těžkou HA. Splenektomie sice vedla ke zvýšení hladiny Hb, paradoxně však došlo i k nárustu počtu retikulocytů. Pacientky měly přetrvávající těžkou chudokrevnost, avšak bez potřeby transfuzní léčby s hodnotami hemoglobinu kolem 75 g/l, s počtem erytrocytů kolem 1,5–1,9 x 1012/l a s nápadnou retikulocytózou kolem 70 %. Transfuzi dostaly obě nemocné jen po porodu, který u obou proběhl bez komplikací [43]. U deficitu enzymů podílející se na ochraně erytrocytu proti ROS (např. G6PD nebo GR), je nutné minimalizovat příjem léků s oxidačními účinky [5]. Určitou naději na úspěšnou léčbu v případě závažných deficitů je transplantace kostní dřeně. Ačkoliv tato terapie byla využita u pacientů s PK popř. HK, jedná se stále spíše o experimentální terapii, která s sebou nese řadu vedlejších efektů. Nedávno byla představena nová terapie deficitu PK, přípravky AG–348 a AG–519, které působí jako aktivátory mutantní PK zvyšující hladinu ATP. Ačkoliv studie nebyla doposud dokončena, předběžné výsledky ukazují rychlý nárůst a stabilizaci hladiny Hb [44, 45].
ENZYMOPATIE V ČESKÉ A SLOVENSKÉ POPULACI
Na základě spolupráce se zahraničními laboratořemi byl deficit G6PD a PK v české a slovenské populaci diagnostikován již v 80. a 90. letech minulého století. V případě deficitu G6PD byly popsány varianty – G6PD Praha, G6PD Olomouc a G6PD Varnsdorf. V případě G6PD Varnsdorf se jednalo o vůbec první popsanou intronovou mutaci G6PD genu [35]. Molekulární analýzy genu kódující PK u českých a slovenských nemoc-ných odhalily mutace p.(Arg510Gln), p.(Arg498His), p.(Arg532Trp), p.(Ser332Gly) a p.(Arg486Trp) [46]. Později, již naší skupinou, byl v ČR popsán případ získaného parciálního deficitu GR vyskytujícího se společně s nestabilní hemoglobinovou variantou Hb Haná [47].
Absence vhodné diagnostické metody komplikovala diagnostiku erytrocytárních enzymopatií v ČR, a donedávna tak byla diagnostika těchto poruch založena pouze na vyloučení ostatních příčin vedoucích k HA.
Od roku 2013 se naše laboratoř zabývá metodou přímého stanovení aktivity enzymů s následným genetickým vyšetřením u pacientů se suspektní enzymopatií. V současné době jsme jedinou specializovanou laboratoří zabývající se touto diagnostikou v České republice, respektive ve střední Evropě.
Doposud byl deficit PK diagnostikován u 12 pacientů. Klinický obraz vyšetřovaných pacientů byl velmi variabilní. Vyskytovali se jedinci jak s lehkou plně kompenzovanou HA bez známky anémie, tak pacienti s těžkou hemolýzou s nutností podávání pravidelných transfuzí a rozvojem sekundární hemochromatózy (Hb: 65–121 g/l, retikulocyty: 2–81 %, bilirubin: 33–172 μM, feritin: 16–2000 μg/l). Stanovená aktivita PK odpovídala ve většině případů 30 % hodnoty normálních kontrol. Na základě molekulárně-genetické analýzy bylo identifikováno 11 mutací. Opakovaně byly detekovány již výše uvedené mutace p.(Arg510Gln), p.(Arg498His), p.(Arg532Trp), p.(Ser332Gly) a p.(Arg486Trp). Současně však byl zaznamenán výskyt mutací, které do-posud nebyly v české a slovenské populaci popsány p.(Arg116-Lys117delinsGlnHisCys), p.(Gly275Arg), p.(Ala154Thr) a c.1618+1delG. Navíc v případě mutace p.(Asp293Val) a p.(Arg518Leufs*12) jde o prioritně popsané mutace [48]. Deficit G6PD byl prokázán u 9 pacientů. Celkem bylo detekováno 8 mutací – p.(Asp282His), p.(Thr336Ala), p.(Phe381Leu), p.(Phe216Tyr), p.(Ser188Phe), p.(Met159Ile), p.(Val68Met), p.(Asn126Asp), z nichž pouze mutace p.(Phe216Tyr) nebyla doposud v literatuře popsána. Ve vyšetřovaném souboru pacientů byl výskyt chronické hemolýzy (Hb: 100–133 g/l, retikulocyty: 7,5–17,8 %) popsán u 4 jedinců (ve všech případech se jednalo o muže/hemizygoty) s mutacemi: p.(Phe216Tyr), p.(Phe381Leu) – G6PD Olomouc a p.(Thr336Ala) – G6PD Torun. Aktivita G6PD v těchto případech nepřekročila 10 % kontrolních hodnot. Vzácně byl deficit G6PD diagnostikován i u dvou žen. Aktivita G6PD se pohybovala na úrovni 30–50 % kontrolních hodnot. V obou případech byl deficit G6PD spojen i s jinými poruchami. V prvním případě se jednalo o kombinaci deficitu G6PD (dvojitě heterozygotní mutace p.(Val68Met)/p.(Asn126Asp)) a abnormální hemoglobinové varianty HbS. Ve druhém případě byl deficit G6PD, homozygotní mutace p.(Met159Ile) – G6PD Gond, doprovázen parciálním deficitem HK (heterozygotní mutace p.(Arg93Gln)). Zajímavý byl klinický projev tohoto deficitu, kdy pacientka trpěla pouze mírnou methemoglobinemií (6–11 %) bez známek hemolýzy.
Poprvé byl v české a slovenské populaci zaznamenán výskyt vzácnějších defektů – deficit GPI a HK. Deficit GPI byl diagnostikován u 3 pacientů ze dvou nepříbuzných rodin. Molekulární analýza odhalila doposud nepopsané mutace p.(Ser160Pro) a p.(Arg472Cys) v GPI genu. Enzymový deficit (aktivita odpovídající 10–20 % kontrolních hodnot) byl charakterizován těžkou makrocytární anémií (Hb: 86–101 g/l, retikulocyty: 16–46 %, MCV: 119–136 fl) s nutností pravidelných transfuzí (před splenektomii) a dysplazií erytroidních prekurzorů (koincidence vrozené dyserytropoetické anémie byla molekulárními analýzami vyloučena). Současně u všech pacientů bylo prokázáno přetížení železem [49]. Deficit HK byl popsán u chlapce s těžkou HA závislou na transfuzích. Dítě pochází z příbuzenského vztahu rodičů (sestřenice a bratranec), těhotenství bylo bezproblémové a porod proběhl císařským řezem. Těžká anémie se projevila ihned po narození (erytrocyty: 1,77 x 1012/l, Hb: 77 g/l, MCV: 145,7 fl, retikulocyty: 99 %, bilirubin: 170 µM). Ve věku 8 měsíců byl závislý na transfuzích (erytrocyty: 2,40 x 1012/l, Hb: 74 g/l, MCV: 83,9 fl, retikulocyty: 6,3 %, bilirubin: 120 µM), vykazoval retardaci v psychomotorickém vývoji a byla u něj diagnostikována sekundární epilepsie. Hemoglobinopatie a membránové poruchy byly vyloučeny. Enzymová analýza prokázala snížení specifické aktivity HK pod 50 % kontrolních hodnot. Následná molekulární analýza potvrdila přítomnost homozygotní mutace c.278G>A v 3. exonu HK1 genu vedoucí k záměně p.Arg93Gln; oba rodiče pacienta jsou heterozygoty pro tuto mutaci. Je zajímavé, že tato mutace byla v heterozygotní formě identifikována i u další pacientky, která (jak už bylo výše zmíněno) byla současně nositelkou G6PD varianty G6PD Gond. Další případ parciálního deficitu HK (heterozygotní mutace) byl popsán u pacientky s intro-novou mutací c.493-1G>A v HK1 genu. Deficit HK byl v tomto případě charakterizován mírnou hemolýzou a retikulocytózou (erytrocyty: 4,25 x 1012/l, Hb: 135 g/l, retikulocyty: 3,1 %, bilirubin: 100 µM). Reziduální aktivita HK byla pod úrovní 50 % kontrolních hodnot. Ačkoliv jsou tyto parciální deficity laboratorně detekovatelné, většina heterozygotních mutací není spojena s klinickými příznaky. U této pacientky byl závažnější klinický projev pravděpodobně způsoben Gilbertovým syndromem [28].
ZÁVĚR
Od roku 2013, kdy se naše laboratoř zabývá metodou přímého stanovení aktivity erytrocytárních enzymů s následným genetickým vyšetřením u pacientů se suspektní enzymopatií, se nám podařilo diagnostikovat enzymový deficit u 24 pacientů. Vedle nejčastějších deficitů G6PD a PK (9 a 12 případů), byly identifikovány 2 rodiny s deficitem GPI a 1 rodina s velmi vzácným deficitem HK. Biochemická a molekulární analýza jednotlivých defektů erytrocytárních enzymů přispívá nejen ke zdokonalení diagnostiky a zpřesnění léčebných přístupů u postižených jedinců, ale i k lepšímu pochopení patofyziologie této skupiny onemocnění.
Zkratky
ADA – adenosindeamináza
AK – adenylátkináza
ALD – aldoláza
AMP – adenosinmonofosfát
ATP – adenosintrifosfát
G6PD – glukóza-6-fosfátdehydrogenáza
GPI – glukóza-6-fosfátizomeráza
GR – glutathionreduktáza
GS – glutathionsyntetáza
GSH – redukovaný glutathion
GSSG – oxidovaná forma glutathionu
GTP – guanosintrifosfát
HA – hemolytická anémie
Hb – hemoglobin
HK – hexokináza
HNSHA – vrozená nesférocytární hemolytická anémie
MCV – střední objem erytrocytů
NAD – nikotinamidadenindinukleotid
NADH – nikotinamidadenindinukleotid (redukovaný)
NADP – nikotinamidadenindinukleotidfosfát
NADPH – nikotinamidadenindinukleotidfosfát (redukovaný)
PP – pentózafosfátová dráha
P5N – pyrimidin-5´-nukleotidáza
PFK – fosfofruktokináza
PGK – fosfoglycerátkináza
PK – pyruvátkináza
ROS – reaktivní kyslíkové radikály
TPI – triózafosfátizomeráza
γ-GCS – γ-glutamylcysteinsyntetázy
GS – glutathionsyntetáza
Podíl autorů na přípravě rukopisu
KP a MR – provádění analýz, zpracování a interpretace výsledků, napsání rukopisu a příprava jeho finální verze
PD, IK a ČJ – diagnostika a léčba pacientů, připomínkování rukopisu
DV – interpretace výsledků, příprava finální verze rukopisu
Poděkování
Lékařům hematologických pracovišť v České republice a na Slovensku za poskytnutí pacientských vzorků a za spolupráci.
Tato práce byla podpořena grantem IGA-LF-2017-015 Univerzity Palackého v Olomouci.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Do redakce doručeno dne 24. 1. 2018.
Přijato po recenzi dne 16. 2. 2018.
Mgr. Pavla Kořalková, Ph.D.
Ústav biologie, Lékařská fakulta, Univerzita Palackého v Olomouci
Hněvotínská 3
775 15 Olomouc
email: pavla.koralkova@gmail.com
Zdroje
1. Beutler E. Red Cell Metabolism: A Manual of Biochemical Methods-3rd edition, Grune & Stratton, New York, USA, 1984 : 2–179.
2. Arya R, Layton DM, Bellingham AJ. Hereditaryred cell enzymopathies. Blood Rev 1995;9 : 165–175.
3. Jacobasch G, Rapoport SM. Hemolytic anemias due to erythrocyte enzyme deficiencies. Mol Aspects Med 1996;17 : 143–170.
4. van Solinge WW, van Wijk R. Erythrocyte enzyme disorders. In: Williams Hematology. Kaushansky KJ, Lichtman MA, Prchal JT, Levi MM, Press OW, Burns LJ, Caligiuri MA (eds). New York: McGraw-Hill, 2016 : 689–723.
5. Prchal JT, Gregg XT. Red cell enzymes. Hematology Am Soc Hematol Educ Program. 2005 : 19–23.
6. Rapoport S, Luebering J. The formation of 2,3-diphosphoglycerate in rabbit erythrocytes: the existence of a diphosphoglyceratemutase. J Biol Chem 1950;183 : 507–516.
7. van Zwieten R, Verhoeven AJ, Roos D. Inborn defects in the antioxidant systems of human red blood cells. Free Radic Biol Med 2014;67 : 377–386.
8. Dudzinska W, Hlynczak AJ, Skotnicka E, Suska M. The purine metabolism of humanerythrocytes. Biochemistry 2006;71 : 467–475.
9. Valentine WN, Paglia DE. Erythrocyte disorders of purine and pyrimidine metabolism. Hemoglobin 1980;4 : 669–681.
10. Beutler, E. Red cell enzyme defects as nondiseases and as diseases. Blood 1979;54 : 1–7.
11. van Wijk R, van Solinge WW. The energy-less red blood cell is lost: erythrocyte enzyme abnormalities of glycolysis. Blood 2005;106 : 4034–4042.
12. Climent F, Roset F, Repiso A, Pérez de la Ossa P. Red cell glycolytic enzyme disorders caused by mutations: An update. Cardiovasc Hematom Disord Drug Targets 2009;9 : 95–106.
13. Beutler E, Gelbart T. Estimating the prevalence of pyruvate kinase deficiency from the gene frequency in the general white population. Blood 2000;95 : 3585–3588.
14. Kanno H, Fujii H, Miwa S. Structural analysis of human pyruvate kinase L-gene and identification of the promoter activity in erythroid cells. Biochem Biophys Res Commun 1992;188 : 516–523.
15. Valentine WN, Paglia DE. The primary cause of hemolysis in enzymopathies of anaerobic glycolysis: a viewpoint. Blood Cells 1980;6 : 819–829.
16. Oski FA, Marshall BE, Cohen PJ, Sugerman HJ, Miller LD. The role of the left-shifted or right-shifted oxygen-hemoglobin equilibrium curve. Ann Intern Med 1071;74 : 44–46.
17. Canu G, De Bonis M, Minucci A, Capoluongo E. Red blood cell PK deficiency: An update of PK-LR gene mutation database. Blood Cells Mol Dis 2016;57 : 100–109.
18. Zanella A, Fermo E, Bianchi P, Valentini G. Red cell pyruvate kinase deficiency: molecular and clinical aspects. Br J Haematol 2005;130 : 11–25.
19. Ferreira P, Morais L, Costa R, et al. Hydrops fetalis associated with erythrocyte pyruvate kinase deficiency. Eur J Pediatr 2000;159 : 481–482.
20. Zanella A, Fermo E, Bianchi P, Chiarelli LR, Valentini G. Pyruvate kinase deficiency: the genotype-phenotype association. Blood Rev 2007;21 : 217–231.
21. Matthay KK, Mentzer WC. Erythrocyte enzymopathies in the newborn. Clin Haematol 1981;10 : 31–55.
22. Nakajima H, Raben N, Hamaguchi T, Yamasaki T. Phosphofructokinase deficiency; past, present and future. Curr Mol Med 2002;2 : 197–212.
23. Ahmed N, Battah S, Karachalias N, et al. Increased formation of methylglyoxal and protein glycation, oxidation and nitrosation in triosephosphate isomerase deficiency. Biochim Biophys Acta 2003;1639 : 121–132.
24. Beutler E, Scott S, Bishop A, Margolis N, Matsumoto F, Kuhl W. Red cell aldolase deficiency and hemolytic anemia: a new syndrome. Trans Assoc Am Physicians 1973;86 : 154–166.
24. Orosz F, Olah J, Ovadi J. Triosephosphate isomerase deficiency: new insights into an enigmatic disease. Biochem Biophys Acta 2009;1792 : 1168–1174.
25 Yao DC, Tolan DR, Murray MF, et al. Hemolytic anemia and severe rhabdomyolysis caused by compound heterozygous mutations of the gene for erythrocyte/muscle isozyme of aldolase, ALDOA(Arg303X/Cys338Tyr). Blood 2004;103 : 2401–2403.
26. Esposito G, Vitagliano L, Costanzo P, et al. Human aldolase A natural mutants: relationship between flexibility of the C-terminal region and enzyme function. Biochem J 2004;380 : 51–56.
27. Murakami K, Kanno H, Tancabelic J, Fujii H. Gene expression and biological significance of hexokinase in erythroid cells. Acta Haematol 2002;108 : 204–209.
28. Koralkova P, Mojzikova R, van Oirschot B, et al. Molecular characterization of six new cases of red blood cell hexokinase deficiency yields four novel mutations in HK1. Blood Cells Mol Dis 2016;59 : 71–76.
29. Fermo E, Bianchi P, Chiarelli LR, et al. A new variant of phosphoglycerate kinase deficiency (p.I371K) with multiple tissue involvement: Molecular and functional characterization. Mol Genet Metab 2012;106 : 455–461.
30. Beutler E. PGK deficiency. Br J Haematol 2007;136 : 3–11.
31. Nkhoma ET, Poole C, Vannappagari V, Hall SA, Beutler E. The global prevalence of glucose-6-phosphate dehydrogenase deficiency: a systematic review and meta-analysis. Blood Cells Mol Dis 2009;42 : 267–278.
32. Howes RE, Piel FB, Patil AP, et al. G6PD deficiency prevalence and estimates of affected populations in malaria endemic countries: a geostatistical model-based map. PLoS Med 2009;9:e1001339.
33. Efferth T, Bachli EB, Schwarzl SM, et al. Glucose-6-phosphate dehydrogenase (G6PD) deficiency-type Zurich: a splice site mutation as an uncommon mechanism producing enzyme deficiency. Blood 2004;104 : 2608.
34. Minucci A, Moradkhani K, Hwang MJ, Zuppi C, Giardina B, Capoluongo E. Glucose-6-phosphate dehydrogenase (G6PD) mutations database: review of the „old“ and update of the new mutations. Blood Cells Mol Dis 2012;48 : 154–165.
35. Xu W, Westwood B, Bartsocas CS, Malcorra-Azpiazu JJ, Indrak K, Beutler E. Glucose-6 phosphate dehydrogenase mutations and haplotypes in various ethnic groups. Blood 1995;85 : 257–263.
36. Cappellini MD, Fiorelli G. Glucose-6-phosphate dehydrogenase deficiency. Lancet 2008;371 : 64–74.
37. Kamerbeek NM, van Zwieten R, de Boer M, et al. Molecular basis of glutathione reductase deficiency in human blood cells. Blood 2007;109 : 3560–3566.
38. Ristoff E, Larsson A. Inborn errors in the metabolism of glutathione. Orphanet J Rare Dis 2007;2 : 16.
39. Zanella A, Bianchi P, Fermo E, Valentini G. Hereditary pyrimidine 5‘-nucleotidase deficiency: from genetics to clinical manifestations. Br J Haematol 2006;133 : 113–123.
40. Barasa BA, van Oirschot BA, Bianchi P, et al. Proteomics reveals reduced expression of transketolase in pyrimidine 5‘-nucleotidase deficient patients. Proteomics Clin Appl 2016;10 : 859–869.
41. Magni G, Amici A, Orsomando G. The enzymology of cytosolic pyrimidine 5‘-nucleotidases: functional analysis and physiopathological implications. Curr Med Chem 2013;20 : 4304–4316.
42. Tefferi A. Anemia in adults: a contemporary approach to diagnosis. Mayo Clin Proc 2003;78 : 1274–1280.
43. Indrák K, Mojzíková R, Divoký V. Anémie hemolytické – enzymopatické (enzymopatické hemolytické anémie, erytrocytární enzymopatie). In: Indrák K (Ed). Hematologie a transfuzní lékařství. Lékařské repetitorium. Praha/Kroměříž: Triton, 2014 : 43–49.
44. Hixon J, Kosinski PA, Clasquin M, et al. AG-519 is a potent activator of mutant pyruvate kinase associated with hemolytic anemia. In: Cools J. (Ed.), EHA, Copenhagen, Denmark, 2016.
45. Hixon J, Kosinski PA, Histen G. Small molecule activation of pyruvate kinase normalizes metabolic activity in red cells from patients with pyruvate kinase deficiency-associated hemolytic anemia. Blood 2013;122 : 2180–2180.
46. Lenzner C, Nurnberg P, Jacobasch G, Gerth C, Thiele BJ. Molecular analysis of 29 pyruvate kinase-deficient patients from central Europe with hereditary hemolytic anemia. Blood 1997;89 : 1793–1799.
47. Mojzikova R, Dolezel P, Pavlicek J, Mlejnek P, Pospisilova D, Divoky V. Partial glutathione reductase deficiency as a cause of diverse clinical manifestations in a family with unstable hemoglobin (Hemoglobin Hana, beta63(E7) His-Asn). Blood Cells Mol Dis 2010;45 : 219–222.
48. Mojzikova R, Koralkova P, Holub D, et al. Iron status in patients with pyruvate kinase deficiency: neonatal hyperferritinaemia associated with a novel frameshift deletion in the PKLR gene (p.Arg518fs), and low hepcidin to ferritin ratios. Br J Haematol 2014;165 : 556–563.
49. Mojzikova R, Koralkova P, Holub D, et al. Two novel mutations (p.(Ser160Pro) and p.(Arg472Cys)) causing glucose-6-phosphate isomerase deficiency are associated with erythroid dysplasia and inappropriately suppressed hepcidin. Blood Cells Mol Dis 2018;69 : 23–29.
50. Koralkova P, van Solinge WW, van Wijk R. Rare hereditary red blood cell enzymopathies associated with hemolytic anemia – pathophysiology, clinical aspects, and laboratory diagnosis. Int J Lab Hematol 2014;36 : 388–397.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 2- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Predikce vzniku inhibitoru faktoru VIII v kohortě SIPPET pomocí analýzy mutací a měření antigenu faktoru VIII
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
- Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11
- 100. výročí založení Československé republiky – vzpomínky hematologa
- Prof. MUDr. Milan Bláha, CSc., osmdesátníkem
- Doc. MUDr. Adela Bártová, CSc. (1927–2018)
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- Srovnatelná účinnost přímých antikoagulancií a warfarinu u pacientů s rakovinou a fibrilací předsíní
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



