-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Splanchnic vein thrombosis in patients with Ph-negative myeloproliferative neoplasms
Ph (Philadelphia chromosome) negative myeloproliferative neoplasms are chronic clonal disorders of haematopoietic stem cells, characterized by increased autonomic proliferation of one or more myeloid cell lines. They are a common prothrombogenic state found in patients with splanchnic vein thrombosis. The prevalence of the Ph negative myeloproliferative neoplasms is 40% in patients with Budd-Chiari syndrome and 30% in patients with portal vein thrombosis. The risk factors for splanchnic vein thrombosis are younger age, female sex, JAK2 V617F mutation, and concomitant hypercoagulable disorders. It appears that local endothelial changes play a significant role in the pathophysiology of splanchnic vein thrombosis. The treatment of splanchnic vein thrombosis is problematic, despite the anticoagulation treatment, the risk of recurrence after the thrombosis remains high. Therefore, it is necessary to verify the effectiveness of new treatment modalities in secondary prophylaxis. Moreover, the results from randomized controlled trials to support our treatment decisions are missing in these patients. The purpose of this article is to review the pathophysiology, clinical and molecular risk factors, and provides a practical guidance for the select an effective treatment strategy of splanchnic vein thrombosis in patients with Ph-negative myeloproliferative neoplasms.
Keywords:
Ph negative myeloproliferative neoplasms – JAK2 V617F – thrombosis – portal vein – Budd Chiari syndrome – mesenteric veins
Autoři: M. Palová; A. Hluší; K. Indrák; T. Papajík
Působiště autorů: Hemato-onkologická klinika, LF UP a FN Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 2, p. 69-78.
Kategorie: Souhrnné a edukační práce
Souhrn
Ph (Philadelphia chromosome) negativní myeloproliferativní nemoci jsou chronickým, klonálním onemocněním kmenových hemopoetických buněk, charakterizovaným zvýšenou autonomní proliferací jedné či více myeloidních buněčných linií. Jsou častým protrombogenním stavem zjištěným u pacientů s trombózou splanchnických žil. Prevalence Ph-negativních myeloproliferativních chorob je 40 % u pacientů s Budd-Chiariho syndromem a 30 % u nemocných s trombózou portální žíly. Mezi rizikové faktory trombózy splanchnických žil patří mladší věk, ženské pohlaví, mutace JAK2 V617F a přídatný trombofilní stav. Ukazuje se, že v patogenezi splanchnické žilní trombózy hrají významnou roli lokální změny endotelu. Léčba trombózy splanchnických žil je často problematická a navzdory antikoagulační léčbě zůstává riziko rekurence trombózy po prodělané příhodě poměrně významné. Je proto potřeba ověřit účinnost nových léčebných modalit v sekundární prevenci trombózy. Navíc výsledky z randomizovaných kontrolovaných studií, jimiž bychom podpořili naše terapeutické rozhodnutí, u této populace nemocných chybí. Cílem práce je shrnutí etiopatogeneze, klinických a molekulárních rizikových faktorů a poskytnutí praktického návodu při výběru účinné léčebné strategie trombózy splanchnických žil u pacientů s Ph-negativní myeloproliferativní nemocí.
Klíčová slova:
Ph-negativní myeloproliferativní nemoc – JAK2 V617F – trombóza – portální žíla – Budd-Chiariho syndrom – mezenterické žíly
ÚVOD
Trombotické příhody patří mezi závažné komplikace Ph-negativních myeloproliferativních nemocí (Ph-MPN), které nepříznivě ovlivňují kvalitu i délku života těchto pacientů. Venózní trombózy se u nich nezřídka vyskytují v atypických lokalizacích, včetně trombóz splanchnických žil (SVT). Mezi SVT zahrnujeme trombózu portální žíly (PVT), lienální žíly, mezenterických žil (MVT) a Budd-Chiariho syndrom (BCS, trombóza jaterních žil nebo suprahepatální části dolní duté žíly). Chronická Ph-MPN je u pacientů s SVT, při absenci lokálních vyvolávajících faktorů (např. cirhózy, malignity jater či pankreatu), jedním z nejčastějších protrombogenních stavů [1].
EPIDEMIOLOGIE
Podle WHO klasifikace hematologických malignit 2016 patří mezi hlavní jednotky Ph-MPN primární myelofibróza (PMF), pravá polycytemie (PV) a esenciální trombocytemie (ET). Incidence PMF je 1,5 případu na 100 000 obyvatel za rok. Incidence PV je vyšší u mužů než u žen, a to 2,8 versus 1,3 případu na 100 000 obyvatel za rok. Incidence ET je 2,5 případu na 100 000 obyvatel za rok [2]. Reálný výskyt významných arteriálních trombóz a žilního tromboembolismu (TEN) nelze stanovit pro heterogenitu metodiky a výběru pacientů jednotlivých studií. Udávaná incidence arteriálních a žilních trombóz je 5,5 na 100 paciento/roků u PV, 1–3 na 100 paciento/roků u ET a 2 na 100 paciento/roků u PMF. Ve třetině případů se jedná o trombózy venózní [3]. Prevalence SVT v populaci je 1–2 % (incidence PVT a MVT se pohybuje v rozmezí 0,7–2,7 na 100 000 obyvatel za rok, incidence raritního BCS 0,8–2 na 1 milion obyvatel za rok) [4, 5, 6]. Ve skupině nemocných s Ph-MPN je prevalence SVT signifikantně vyšší, a to 5–10 % u PV, 9–13 % u ET a 0,6–1 % u PMF. Nejčastějším typem SVT je až v 60 % případů trombóza portální žíly, zatímco BCS představuje asi 17 % případů. Velká metaanalýza pacientů s PVT a BCS, u kterých byla vyloučena cirhóza a nehematologická malignita, udává prevalenci Ph-MPN 40 % u pacientů s BCS a 30 % u nemocných s PVT. U BCS bývá nejčastěji diagnostikována pravá polycytemie, u PVT myelofibróza [7].
PATOGENEZE
V patogenezi Ph-MPN hraje zásadní roli deregulace, respektive konstitutivní aktivace JAK/STAT signální dráhy, jež vede k autofosforylaci STAT proteinů (Signal transducer and activator of transcription). Fosforylované formy STAT proteinů pak přestupují do buněčného jádra a podílejí se na aktivaci transkripce genů regulujících buněčnou proliferaci, diferenciaci a apoptózu. Výsledkem je na cytokinech nezávislá proliferace hemopoetických buněk a aktivace dalších signálních drah STAT3, STAT5, MAPK, ERK, PI3K-AKT [8]. Konstitutivní aktivace JAK/STAT dráhy může být způsobená buď přímo somatickou mutací genu JAK2 v pozici V617F, nebo nepřímo mutacemi v genu s regulačním vlivem na tuto signální dráhu (MPL) [9]. Taktéž mutace v genu pro kalretikulin (CALR) je spojena s aktivací STAT proteinů. V roce 2005 objevená somatická mutace JAK2 V617F vedla k průlomu v klasifikaci, diagnostice a pochopení Ph-negativních myeloproliferativních chorob. Je detekována u 95–97 % PV, a u 50–60 % PMF a ET [10]. V dalších 5–8 % případů ET a PMF prokazujeme mutaci v kodonu 515 nebo 505 genu, který kóduje trombopoetinový receptor (MPL) [9]. Když v roce 2013 Klampfl et al. a Nangalia et al. popsali somatické rekurentní mutace postihující exon 9 v genu CALR, které se vyskytují u většiny JAK2 a MPL nemutovaných pacientů s ET a PMF, vzrostl počet nemocných se známým molekulárním markerem klonality na 80–85 %. Gen CALR kóduje protein kalretikulin, chaperon endoplazmatického retikula schopný vázat Ca2+. Mutace v CALR genu jsou značně heterogenní skupinou čítající nejméně 50 různých krátkých delecí, insercí nebo substitucí lokalizovaných v 9. exonu genu CALR na chromozomu 19. Většina CALR mutací způsobuje posun čtecího rámce, přičemž alternativní čtecí rámec dává vznik mutantním bílkovinám. Mutovaný kalretikulin pak preferenčně interaguje s trombopoetinovým receptorem (MPL), vede k jeho aktivaci a následné stimulaci JAK/STAT signální dráhy. Dvě nejčastěji se vyskytující (v 80 % případů) jsou 52-bp delece (CALR del52/TypI) a 5-bp inserce (CALR ins5/TypII) [11].
Patogeneze trombóz u pacientů s Ph - MPN je komplexní. Souvisí nejen s kvantitativními, ale také s kvalitativními změnami klonálních buněk (tab. 1). Získaný trombofilní stav asociovaný s Ph-MPN je multifaktoriální etiologie. Vyplývá nejen z protrombogenního fenotypu cirkulujících buněk MPN klonu, ale také z imunitní odpovědi hostitele na přítomnost nádorového klonu se zvýšenou produkcí inflamatorních cytokinů, vedoucí k aktivaci leukocytů a endotelu [3]. Odlišné rizikové faktory spojené s SVT (např. mladší věk, ženské pohlaví) ve srovnání s rizikovými faktory asociovanými s trombózami v jiných lokalizacích, naznačují přítomnost dalších lokálně specifických patogenetických mechanismů. Předpokládá se, že samotná mutace v genu JAK2 ovlivňuje lokální poměry v žilním systému splanchnické oblasti. Již dříve bylo prokázáno, že endoteliální buňky hepatálních venul pacientů s BCS nesou mutaci JAK2 V617F [12]. Pozdější práce identifikovaly u SVT pacientů mutaci v genu JAK2 také v endoteliálních buňkách splenických venul a kapilár. Rosti et al. prokázali vyšší zastoupení progenitorů entoteliálních buněk JAK2 V617F pozitivních, které se vyznačovaly vyšší adherencí k mononukleárním buňkám, jen u nemocných s anamnézou SVT. Naproti tomu v endotelu vén pacientů s žilními trombózami v jiných lokalizacích byla zjištěna mutace JAK2 V617F v méně než 1 % [13, 14]. Pomalejší krevní proud v žilách splanchnické oblasti umožňuje prolongovanou interakci mezi protrombogenně naladěnými klonálními buňkami a aberantním endotelem. Přesný mechanismus ale zůstává neznámý. Zdá se, že patogeneze SVT se částečně liší od mechanismu vzniku arteriálních a žilních trombóz v jiné lokalizaci. Příčina silné asociace mezi SVT a Ph-MPN není zcela známá a je předmětem probíhajícího výzkumu. Její pochopení nám může pomoci objasnit nejen patogenezi trombózy, ale také evoluci MPN klonu.
Tab. 1. Získaný trombofilní stav asociovaný s Ph-negativní myeloproliferativní nemocí (Ph-MPN) 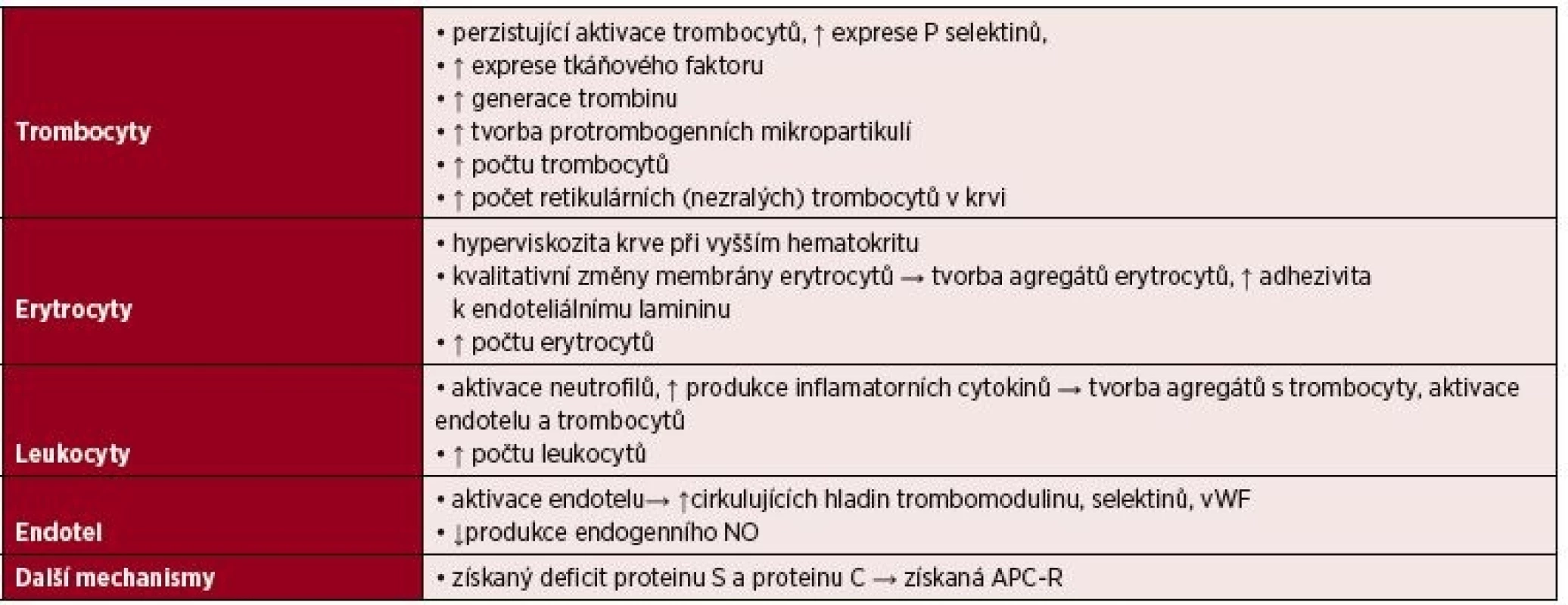
Vysvětlivky: vWF – von Willebrandův faktor, NO – oxid dusnatý, APC-R – rezistence na aktivovaný protein C RIZIKOVÉ FAKTORY SVT
Rizikové faktory SVT lze rozdělit na lokální a systémové. Nejčastější stavy asociované s SVT jsou malignity (hepatobiliární, pankreatu, střev), cirhóza jater, abdominální infekce a zánětlivá onemocnění, břišní chirurgické výkony nebo traumata, trombofilní stavy a chronická myeloproliferativní nemoc. K rizikovým faktorům vázaným na pohlaví řadíme hormonální antikoncepci, graviditu a puerperium [1, 7]. Z hematologických příčin je nejvýznamnějším rizikovým faktorem Ph-negativní myeloproliferativní nemoc, na dalším místě stojí vrozené či získané trombofilní stavy. Nezřídka se jednotlivé příčiny kombinují [1, 7, 15]. Evropská leukemická síť (European Leukemia Net, ELN) považuje za hlavní rizikové faktory trombózy věk nad 60 let a pozitivní anamnézu TEN [16]. Tefferi v roce 2015 revidoval systém stratifikace pacientů založený na míře rizika trombózy podle věku, prodělané TEN, přítomnosti JAK2 V617F a obecných kardiovaskulárních rizik (kouření, diabetes mellitus, hypertenze) [17]. Podle některých autorů je prokázaným rizikovým faktorem také leukocytóza [18]. Pro hodnocení trombocytemie jako rizikového faktoru nejsou v publikovaných pracích posledních let jednotné závěry. Zajímavá práce českých autorů ukázala, že v momentě před trombózou mají Ph-MPN pacienti v průměru vyšší počty trombocytů [19]. Česká pracovní skupina pro Ph-myeloproliferativní onemocnění (CZEMP) stratifikuje pacienty s Ph-MPN a trombocytemií podle modifikovaných českých doporučení a uznává jako rizikové faktory také trombocytemii a přítomnost vrozených či získaných trombofilních stavů (deficit proteinu C, deficit proteinu S, mutaci genu faktoru V (G1691A) „Leiden“, mutaci protrombinového genu (G20210A) a deficit antitrombinu) [20].
Rizikové faktory asociované s SVT se částečně liší od rizikových faktorů trombóz v jiných lokalizacích. Ve skupině nemocných s SVT převažují mladé ženy. Lussana a spol. v analýze 538 nemocných uvádějí, že u žen mladších 40 let byl výskyt SVT významně vyšší oproti zbylé MPN populaci (79 % versus 7,5 %) [21]. Tuto skutečnost potvrzují také další publikované soubory [22]. Aktuálně De Stefano et al. prokázali v kohortě nemocných s SVT a Ph-MPN prevalenci ženského pohlaví (65,2 %) s menším podílem pacientů starších 60 let (22,1 %). Ve většině případů byla objektivně potvrzena splenomegalie a v 93 % pozitivita JAK2 V617F. U 35 % pacientů byl v době trombotické komplikace vedle MPN přítomen další získaný či vrozený trombofilní stav. Ve většině případů (85,6 %) nebyl zjištěn provokující faktor [23]. Další analýzy pacientů s Ph-MPN a SVT zjistily vyšší prevalenci mutace JAK2 V617F s nižší alelickou náloží JAK2 V617F ve skupině žen. Autoři předpokládají, že tento rozdílný molekulární profil se může spolupodílet na četnějším výskytu SVT u žen [24,25]. Obecně je hormonální antikoncepce (HAK) disponujícím faktorem hluboké žilní trombózy, a to zejména v přítomnosti vrozených trombofilních stavů. Je pravděpodobné, že užívání HAK může u žen s Ph-MPN zvyšovat riziko SVT, a částečně se tak podílet na vyšším výskytu SVT u žen ve srovnání s muži. Míra zvýšení rizika SVT v souvislosti s HAK není známá díky limitacím dosud publikovaných souborů (např. nedostatečně zdokumentované užívání HAK, současná přítomnost dalších trombofilních stavů, nedostatečná identifikace získaných rizikových faktorů). Není vyloučena ani možnost jiných, dosud nepotvrzených rizikových faktorů vázaných na pohlaví. Dosud potvrzenými rizikovými faktory SVT jsou mutace JAK2 V617F, mladší věk, ženské pohlaví a přídatný trombofilní stav [26].
MUTACE JAK2V617F U PACIENTŮ S SVT
Prevalence mutace JAK2 V617F je u pacientů s SVT poměrně vysoká, asi 40 % u BSC a 28 % u PVT. Značná část těchto nemocných (15–17 %) však nemá v době SVT zřetelné známky Ph-MPN. Polycytemie je často maskována portální hypertenzí, splenomegalií a s tím spojeným hypersplenismem, možnými krevními ztrátami, hemodilucí, popřípadě neadekvátně zvýšenou hladinou erytropoetinu při ischemii hepatálních buněk [27]. Dalším možným vysvětlením je, že pacienti s SVT a izolovanou pozitivitou JAK2 V617F reprezentují odlišný typ Ph-MPN nebo velmi časnou fázi onemocnění [15]. V nedávno publikované analýze souboru 181 pacientů s SVT a Ph-MPN se uvádí, že v 58 % případů předcházela trombóza splanchnických žil diagnóze Ph-MPN [23]. SVT představuje první trombotickou komplikaci u 7,5 % pacientů s již diagnostikovanou PV a ET. Tato pozorování naznačují, že SVT může být projevem časné fáze onemocnění, ještě před rozvojem klinického fenotypu nemoci. Dentali et al. udávají, že u 51 % pacientů s SVT a izolovanou pozitivitou JAK2 V617F se v průběhu sledování rozvinul klinický fenotyp Ph-MPN [28]. Colaizzo et al. prokazují, že u 62 % nemocných s SVT a izolovanou pozitivitou JAK2 V617F byla diagnostikována Ph-MPN v průběhu následujících 64 měsíců. Dále popisují, že u šesti z osmi iniciálně JAK2 V617F negativních pacientů s SVT byla v průběhu následujících 21 měsíců prokázána pozitivita této mutace s rozvojem klinického obrazu [29]. To autoři vysvětlují buďto přítomností nádorového klonu ještě před objevením se mutace v genu JAK2, nebo příliš nízkou alelickou náloží JAK2 V617F v době SVT, která byla pod hranicí detekovatelnosti konvenčními laboratorními metodami. Pro hypotézu, že SVT je časným projevem Ph-MPN částečně svědčí i fakt, že převážná část těchto pacientů je mladších s nízkou alelickou náloží JAK2 V617F [26, 30]. U nemocných s klinicky manifestovanou Ph-MPN a trombózou splanchnických žil je prevalence mutace JAK2 V617F signifikantně vyšší (70–100 %) než u pacientů s trombózami v dalších lokalizacích [31].
OSTATNÍ MUTACE U PACIENTŮ S SVT A PH-NEGATIVNÍ MYELOPROLIFERATIVNÍ NEMOCÍ
Jakou roli hrají v patogenezi SVT další řídící („driver“) mutace CALR a MPL není jasné. Recentní studie nepotvrdily zvýšenou incidenci těchto mutací u nemocných s SVT. Mutace CALR byla identifikována v 0–2 % případů, incidence mutace MPL genu je ještě nižší (0,7 %) [30]. To je v souladu s pozorováním, že u CALR mutace je riziko trombóz ve srovnání s JAK2 V617F mutací nižší. Riziko tromboembolických komplikací zůstává nižší u nemocných nesoucích jak typ 1, tak typ 2 mutace CALR genu [32]. Význam dalších subklonálních mutací v genech ASXL1, SRSF2, EZH2 a IDH1/2 spojených s horší prognózou a vyšším rizikem leukemické transformace, není v souvislosti s SVT zatím znám.
KLINICKÝ OBRAZ A DIAGNOSTIKA SVT
Buddův-Chiariho syndrom, trombóza portální žíly a mezenterických žil se mohou vyskytovat samostatně, ačkoliv současné postižení dvou a více splanchnických žil není vzácností.
Buddův-Chiariho syndrom – lze podle průběhu dělit na fulminantní, akutní, subakutní nebo chronický. Klinický obraz závisí na rozsahu a rychlosti vzniku obstrukce a rozvoji kolaterálního oběhu. Fulminantní BCS je extrémně vzácný a obvykle je spojený s fatální hepatocelulární nekrózou, ikterem a rozvojem jaterní encefalopatie během osmi týdnů od vzniku ikteru. Akutní BCS charakterizuje hepatomegalie, bolest v pravém horním břišním kvadrantu, ascites, ischemie jater a absence žilních kolaterál. V případě subakutního a chronického BCS jsou již vytvořeny venózní kolaterály. V důsledku dekomprese sinusoid venózními kolaterálami může být ascites i nekróza jater u subakutního BCS minimální. U chronického BCS bývají v popředí příznaky vyplývající z portální hypertenze a cirhózy jater. Až 15 % BCS je asymptomatických. Na BCS bychom měli pomýšlet u všech pacientů s bolestí v pravém horním břišním kvadrantu, s ascitem a hepatomegalií při negativní anamnéze předchozího jaterního poškození [15, 33].
Trombóza portální žíly – klinický průběh se i zde odvíjí od rozsahu a rychlosti vzniku obstrukce a rozvoji kolaterálního oběhu. Akutní PVT je urgentní stav hrozící růstem trombu do vena mesenterica superior s následnou ischemií střeva. Projevuje se náhle vzniklou bolestí břicha s možnými nespecifickými symptomy jako teplota, nauzea, zvracení a průjem. Může také probíhat i nepozorovaně s následnou tvorbou jícnových varixů v důsledku zvýšeného portálního tlaku. Chronická trombóza portální žíly je charakterizována asymptomatickým vznikem trombu. Následkem několik měsíců trvající okluze portální žíly dochází k vytvořením sítě periportálních kolaterálních žil, jež se pro svůj radiologický vzhled nazývají kavernom porty. Kavernomatózní přestavba bývá diagnostickým znakem chronické trombózy portální žíly nebo neúspěšné rekanalizace akutní trombózy. Pacienti s chronickou PVT mohou být asymptomatičtí nebo mohou mít příznaky portální hypertenze a portální cholangiopatie [34].
Trombóza mezenterických žil – probíhá akutně, subakutně nebo chronicky. Akutní MVT je jednou z příčin akutní, život ohrožující viscerální ischemie. Může se manifestovat bolestí břicha periumbilikálně, nauzeou a zvracením. Více než 75 % pacientů udává bolest trvající alespoň dva dny, předtím než vyhledali lékaře. Porucha drenáže při okluzi mezenterické žíly vede k intramurálnímu edému střeva se sekvestrací tekutiny do třetího prostoru a následné hypovolemii. Při růstu trombu z hlavních žilních kmenů do periferie dochází k ischemii střeva projevující se bolestmi břicha, ileem, iritací pobřišnice, přítomností krve v rektu. Při subakutním průběhu se tyto symptomy objevují několik dnů až týdnů před diagnózou. Chronická MVT je často asymptomatická nebo se projevuje až komplikacemi provázejícími portální hypertenzi [35].
Portální hypertenze – je definována jako zvýšený portosystémový gradient přesahující 5 mm Hg. Za klinicky významnou hypertenzi považujeme hodnoty nad 10–12 mm Hg. Hlavními a závažnými komplikace portální hypertenze je krvácení z jícnových a gastrických varixů, hypersplenismus. Mezi méně časté a nespecifické projevy zahrnujeme dyspepsie, ascites, kognitivní změny až jaterní encefalopatii.
Zobrazovací vyšetření – ultrazvukové vyšetření (UZ) s dopplerem má senzitivitu v diagnostice PVT a BCS 90%, často bývá vyšetřením první volby. Přesnost UZ vyšetření ovlivňují jak fyzikální charakteristiky pacienta (např. obezita, meteorismus), tak zkušenosti provádějícího lékaře. V případech nejasného UZ nálezu a trvajícího podezření na SVT je nutno doplnit vyšetření počítačovou tomografií (CT) s intravenózně aplikovanou kontrastní látkou, případně magnetickou rezonancí (MR). CT/MR má být realizováno i v případech ultrasonograficky diagnostikovaných PVT a BCS k přesnějšímu posouzení rozsahu trombu, identifikaci vyvolávajícího faktoru a posouzení možné infarzace tenkého střeva při progresi trombu do vena mesenterica superior. Při podezření na trombózu mezenterických žil není UZ vyšetření nápomocné a je nutné provedení CT/MR [33].
Diferenciální diagnostika a léčba pacientů s Ph-MPN a SVT
Léčba SVT vyžaduje multidisciplinární přístup gastroenterologa, hepatologa, hematologa, intervenčního radiologa, chirurga.
U pacientů s diagnostikovanou SVT má být v první řadě vyloučena cirhóza jater a nehematologická malignita (neoplazie hepatobiliární, pankreatu, střev) jakožto nejčastější příčiny SVT. V případech necirhotických SVT bez průkazu nehematologické malignity je mandatorní vyšetření mutace JAK2 V617F, trombofilní screening, případně test na paroxyzmální noční hemoglobinurii (PNH). Incidence ostatních mutací (CALR, MPL, exon 12 genu JAK2) je nízká.
Trepanobiopsie kostní dřeně je v souladu s WHO diagnostickými kritérii doporučována u všech JAK2 V617F pozitivních SVT k histologické verifikaci choroby. Trepanobiopsie může být přínosná i ve skupině JAK2 negativních SVT, kde histologické vyšetření kostní dřeně vykazuje známky Ph-MPN v 7–23 % případů a může přispět k podchycení dalších nemocných s Ph-MPN [36, 37]. Podmínkou je však zkušenost hodnotícího patologa.
Antikoagulační léčba – diagnóza SVT by měla vést k promptnímu zahájení léčby, protože v závislosti na lokalizaci trombu jsou pacienti ohroženi rozvojem portální hypertenze, jaterního selhání, intestinální ischemie, portální cholangiopatie. Mnohdy však SVT představuje u pacientů s Ph-MPN značný terapeutický problém. Důvodem je vysoké riziko rekurence či progrese trombózy a současně riziko krvácivých komplikací, vyplývající z antikoagulační léčby, portální hypertenze nebo trombocytopenie. Vezmeme-li ale v úvahu vysoké riziko rekurence a progrese trombózy a s tím spojené komplikace významně ovlivňující kvalitu a délku života, je proti tomu riziko mortality v důsledku krvácení v souvislosti s antikoagulační léčbou necirhotických pacientů relativně nižší [38]. Navíc právě úspěšná rekanalizace trombu efektivně redukuje krvácivé komplikace úpravou tlaku v portálním řečišti [33]. Současná doporučení se proto přiklánějí k dlouhodobé antikoagulační terapii. Samozřejmě jen individuální posouzení obou rizik u každého jednotlivého pacienta pomáhá minimalizovat výskyt komplikací. Nedílnou součástí efektivní prevence krvácení je úzká spolupráce gastroenterologa, včetně pravidelné endoskopické monitorace jícnových a gastrických varixů a profylaxe varikózního krvácení neselektivními betablokátory, ligacemi varixů atd.
Antikoagulační léčba je doporučena u všech symptomatických trombóz splanchnických žil (podle 9. edice a revidované 10. edice ACCP doporučených postupů) [39, 40]. V akutní fázi zahajujeme neprodleně antikoagulační léčbu nízkomolekulárními hepariny (LMWH), nejsou-li přítomny zásadní kontraindikace léčby. Včasně zahájenou léčbou se snažíme zabránit růstu trombu, rekanalizovat žílu, a předejít tak následným komplikacím. Podle ITAC-CME doporučení jsou i v dlouhodobé léčbě žilního TEN u nádorových onemocnění preferovány LMWH [41]. Pro řadu pacientů je však dlouhodobá subkutánní aplikace neakceptovatelná. Na perorální antikoagulancia převádíme pacienty po vyloučení krvácivých komplikací a stabilizaci stavu [33]. V multicentrickém registru SVT tvořily 29,8 % trombózy incidentální, zjištěné náhodně zobrazovacími metodami prováděnými z jiných důvodů [42]. Přínos antikoagulační léčby je v těchto případech nejasný. Hlavním cílem antikoagulační léčby je vedle zabránění růstu trombu, také předcházení recidivě trombózy. Vzhledem k již často přítomné portální hypertenzi u chronických trombóz může riziko krvácivých komplikací převyšovat přínos nasazené léčby. Obecně se současná ACCP doporučení přiklánějí k nepodávání antikoagulační léčby incidentálním trombózám splanchnických žil. Nicméně přítomnost Ph-MPN, jakožto permanentního rizikového faktoru, je akceptovatelným důvodem k zahájení antikoagulační léčby i u incidentálních SVT [39]. Nezbytností v této klinické situaci je endoskopický screening jícnových varixů s implementací adekvátních profylaktických opatření varikózního krvácení. Nemocné s perzistujícími rizikovými faktory krvácení (např. přítomnost varixů, trombocytopenie) ponecháváme raději v dlouhodobé terapii LMWH v dávce zohledňující individuální riziko pacienta. Rozhodnutí neaplikovat antitrombotickou léčbu může být opodstatněno jen velmi vysokým rizikem krvácení, aktivním krvácením nebo infaustním stavem s krátkou předpokládanou dobou přežití nemocného v terminálním stavu maligního onemocnění. Antikoagulační léčba SVT u Ph-MPN je dlouhodobá, časově neomezená [33]. Pro její vyšší bezpečnost je nezbytná pravidelná re-evaluace individuálního rizika krvácení včetně endoskopií horního gastrointestinálního traktu.
Zatímco míra rekurence trombózy nemocných neléčených antagonisty vitaminu K (VKA) je 7,2 případů na 100 paciento/roků, léčba VKA snižuje rekurenci na 3,9 případů na 100 paciento/roků s rizikem krvácivých komplikací 2 případy na 100 paciento/roků. I přes antikoagulační léčbu VKA zůstává riziko rekurence po SVT poměrně významné [23]. U pacientů s nesplanchnickou hlubokou žilní trombózou v dlouhodobé léčbě VKA je míra rekurence menší než 1 případ na 100 paciento/roků s rizikem krvácivých komplikací 0,9 na 100 paciento/roků, což nepřímo ukazuje, že antitrombotická profylaxe VKA má u SVT nižší účinnost a bezpečnost než u jiných žilních trombóz [43]. Ve světle těchto zjištění je třeba ověřit možný přínos nových antikoagulancií (NOAC). Farmakokinetické a farmakodynamické vlastnosti NOAC naznačují jejich potenciál zlepšit výsledky antikoagulační léčby SVT. Zatím, i přes narůstající užívání NOAC v této indikaci, jsou klinické zkušenosti stále limitované a data z kontrolovaných studií srovnávající efektivitu a bezpečnost nových antikoagulancií s warfarinem či LMWH u této skupiny nemocných chybí. Další nevýhodou je nedostupnost antidota rivaroxabanu a apixabanu v rutinní klinické praxi a snížená eliminace NOAC při renální insuficienci, která se nezřídka u komorbidních nemocných vyskytuje.
Antiagregační léčba – přínos kyseliny acetylsalicylové (ASA) nebo dalších antiagregancií v rámci prevence rekurence trombózy po prodělané SVT je ještě méně jasný. Naše znalosti stran krvácivých komplikací asociovaných s ASA u pacientů s portální hypertenzí pocházejí převážně ze studií s cirhotickými pacienty, kde je medikace ASA v přítomnosti jícnových varixů spojena s vysokým rizikem krvácení [44]. Zda to platí i v případě SVT necirhotických MPN pacientů není ověřeno. De Stefano et al. ve svém souboru 181 pacientů s SVT a Ph-MPN nepotvrdili přínos přidání ASA k VKA, nicméně počet takto léčených nemocných byl příliš malý na to, aby dovoloval validní vyhodnocení. V deseti případech došlo po prodělané SVT k recidivě trombózy v arteriálním řečišti s incidencí 1,3 na 100 paciento/roků, ve všech případech při absenci ASA, což ukazuje na menší účinnost VKA v prevenci arteriálních trombóz [23]. Další retrospektivní analýza MPN pacientů s prodělanou žilní trombózou prokázala srovnatelnou účinnost jak ASA, tak VKA na snížení incidence recidivy trombózy s přijatelným bezpečnostním profilem. Naproti tomu kombinovaná terapie ASA s VKA vedla k neúměrně vysokému výskytu krvácivých komplikací (2,8 na 100 paciento/roků, versus 0,8 na 100 paciento/roků u ASA a 0,9 na 100 paciento/roků u VKA) [45]. Nutno zdůraznit, že tato kohorta pacientů nezahrnovala pacienty s trombózou v oblasti splanchnických žil. Vzhledem k uvedeným přednostem a rizikům spojeným s ASA, je u pacientů s SVT a portální hypertenzí třeba zvýšené opatrnosti při užívání antiagregancií, a to zejména v kombinaci s VKA.
U pacientů s SVT není systémová trombolýza využívaná pro vysoké riziko významných krvácivých komplikací. Ve srovnání s tím má lokální trombolýza méně významných krvácivých komplikací, zkušenosti s ní jsou ale limitované, získané na malých počtech pacientů. Lokální trombolýza představuje terapeutickou možnost ve velmi selektovaných případech při nelepšícím se stavu i přes antikoagulační léčbu [33].
Cytoredukční léčba – v roce 2011 vydala ELN doporučení pro léčbu klasických Ph-MPN, podle nichž je prodělaná trombotická komplikace indikací k cytoredukční léčbě (hydroxyurea, interferon alfa) v rámci sekundární prevence TEN [16]. Pracovní skupina CZEMP stratifikuje léčbu nemocných s Ph-MPN a trombocytemií podle vlastních modifikovaných doporučení s preferováním tromboreduktivní léčby anagrelidem a/nebo interferonem alfa u mladších pacientů do 65 let, u starších hydroxyureou, s cílem normalizace počtu trombocytů [20]. U PV je při zvýšeném hematokritu (Hct) vedle cytoredukční léčby indikována také venepunkce s cílovou hodnotou Hct pod 0,45 [46]. V případech SVT s portální hypertenzí má však cytoredukce určitá úskalí. Portální hypertenze s hypersplenismem se může podílet na snížení hodnot hemoglobinu, leukocytů a trombocytů v periferní krvi, avšak bez vlivu na proliferační aktivitu nádorového klonu, který je zodpovědný za zvýšené riziko trombózy. Mnohdy je pro cytopenii v periferní krvi cytoredukční léčba nemožná. Stejně tak není přesně stanovena míra poklesu rekurence splanchnické trombózy v souvislosti s cytoredukční léčbou. De Stefano et al. sice ve své práci nepotvrdili vliv cytoredukční terapie na snížení incidence rekurence trombózy, ale výpovědní hodnota těchto výsledků je nejspíše významně ovlivněna limitacemi restrospektivní analýzy a v neposlední řadě také skutečností, že ve více než polovině případů došlo k recidivě trombózy u pacientů s polycytemií nedostatečně kontrolovanou cytoredukční léčbou. Pro absenci jednoznačných doporučených postupů svědčí i variabilita léčebných přístupů v klinické praxi hematologických pracovišť, a to jak ve výběru a délce antikoagulace, tak v užití cytoredukce [23]. V případech SVT s pouze izolovanou pozitivitou JAK2 V617F bez dalších projevů Ph-MPN není v současné době cytoredukční léčba doporučovaná.
Předpoklad, že JAK inhibitory mohou snižovat incidenci trombózy, vychází z pozorování některých autorů, že splenomegalie je nezávislým rizikovým faktorem rekurence trombózy, i když jiné práce tuto souvislost nepotvrdily. Ruxolitinib, JAK1/2 inhibitor, zmenšuje splenomegalii. Zda je toto zmenšení spojeno se snížením rizika rekurence trombózy, není zatím jasné. Výsledky nedávné metaanalýzy ale naznačují, že ruxolitinib redukuje výskyt trombóz u pacientů s PV a PMF [47].
Za povšimnutí stojí výsledky aktuální retrospektivní analýzy, která popisuje srovnatelnou mortalitu jak u pacientů s BCS (1,4 na 100 paciento/roků), tak u dalších SVT (2,0 na 100 paciento/roků) [23]. Dosud byl BCS považován za onemocnění s vyšší mortalitou. Výsledky této studie však ukazují, že současná léčba pacientů s BCS s využitím antikoagulační léčby, intervenčních metod (angioplastika, transjugulární intrahepatický portosystémový shunt (TIPS), chirurgická portosystémová spojka, eventuálně lokální trombolýza) smazává rozdíl v úmrtnosti nemocných. Asi 10–20 % pacientů s BCS se po selhání výše zmíněných intervencí stává kandidáty pro transplantaci jater. V retrospektivní analýze 78 případů BCS se desetileté přežití po transplantaci nelišilo mezi MPN a non-MPN populací (68 % versus 73 %). Mezi přežívajícími nebyla zaznamenána progrese do myelofibrózy nebo akutní leukemie v mediánu sledování 12,4 roku [48].
Vzhledem k terapeutickým potížím zůstává aktuál-ní potřeba identifikace dalších laboratorních ukazatelů přesněji reflektujících sklon k trombóze nebo krvácení v těchto klinických situacích. V poslední době se analyzuje možný přínos trombin generačního testu (TGT). Zatím první publikované výsledky prokazují rozdíly v jednotlivých parametrech TGT u nemocných s Ph-MPN oproti zdravé populaci [49]. Ale jak přesně je TGT schopen detekovat rizikové nemocné s MPN, jak je možno interpretovat výsledky, vliv typu Ph-MPN, pokročilosti choroby, mutačního stavu a terapie na hodnoty TGT je předmětem probíhajícího výzkumu. Navíc nejednotná metodika vyšetření (vyšetření prováděné v plazmě bohaté versus chudé na destičky, použité spouštěče) znemožňuje přímé porovnávání publikovaných výsledků jednotlivých laboratoří. Zda eventuální změny hodnot TGT navozené léčbou Ph-MPN odrážejí snížení výskytu trombózy v reálné praxi, bude muset být ověřeno budoucími studiemi.
ZÁVĚR
Etiologie trombóz splanchnických žil u pacientů s Ph-MPN je multifaktoriální. Potvrzenými rizikovými faktory jsou mutace JAK2 V617F, mladší věk, ženské pohlaví a přídatný trombofilní stav [26]. Výskyt SVT významně ovlivňuje kvalitu a délku života pacientů s Ph-MPN. Právě přesná identifikace, důsledná prevence a léčba rizikových nemocných může snížit jejich morbiditu a mortalitu. Definování jednoznačných, na důkazech založených doporučených postupů zůstává v případě léčby SVT u Ph-MPN nesplněným klinickým přáním. Většina doporučení vychází ze závěrů observačních studií. Vzhledem k epidemiologii SVT a Ph-MPN je ale otázkou, zda vůbec budou někdy dostupné prospektivní studie s dostatečně velkým vzorkem pacientů, srovnávající bezpečnost a efektivitu jednotlivých léčebných protokolů. V klinické praxi představují trombózy splanchnických žil často stále obtížně řešitelný problém se spoustou nezodpovězených otázek týkajících se zejména významu JAK inhibitorů a NOAC v sekundární prevenci trombózy, cytoredukční léčby v případě izolované pozitivity molekulárního markeru a využití nových globálních koagulačních testů k posouzení rizika nemocných a monitoraci léčby.
Seznam zkratek
ACCP – American College of Chest Physicians
ASA – kyselina acetylsalicylová
BCS – Buddův-Chiariho syndrom
CALR – kalretikulin
CZEMP – Česká pracovní skupina pro Ph-myeloproliferativní onemocnění
ELN – European Leukemia Net
ET – esenciální trombocytemie
HAK – hormonální antikoncepce
Hct – hematokrit
ITAC-CME – International Initiative on Thrombosis and Cancer
JAK – Janusova kináza
JAK2 V617F – mutace genu pro Janusovu kinázu 2 v pozici 617
LMWH – low molecular weight heparin, nízkomolekulární hepariny
MPL – myeloproliferative leukemia virus oncogene
MVT – trombóza mezenterické žíly
NOAC – nová antikoagulancia
Ph-MPN – Philadelphia chromosome negativní myeloproliferativní nemoci
PMF – primární myelofibróza
PNH – paroxyzmální noční hemoglobinurie
PV – pravá polycytemie
PVT – trombóza portální žíly
STAT – signal transducer and activator of transcription
SVT – trombóza splanchnických žil
TEN – tromboembolická nemoc
TGT – trombin generační test
TIPS – transjugulární intrahepatický portosystémový shunt
VKA – antagonista vitaminu K
Podíl autorů na přípravě rukopisu
MP – příprava rukopisu
KI, AH, TP – podíleli se na revizi, úpravách, doplnění a finální verzi rukopisu
Prohlášení o konfliktu zájmů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů. Vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce vznikla s podporou grantu IGA_LF_2017_007.
Doručeno do redakce dne 14. 8. 2017.
Přijato po recenzi dne 22. 11. 2017.
MUDr. Miroslava Palová
Hemato-onkologická klinika Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: miroslava.palova@fnol.cz
Zdroje
1. De Stefano V, Martinelli I. Splanchnic vein thrombosis: clinical presentation, risk factors and treatment. Intern Emerg Med 2010;5 : 487–494.
2. Moulard O, Metha J, Fryzek J, et al. Epidemiology of myelofibrosis, essential thrombocythemia, and polycythemia vera in the European Union. Eur J Haematol 2014;92 : 289–297.
3. Barbui T, Carrobio A, Cervantes F, et al. Thrombosis in primary myelofibrosis: incidence and risk factors. Blood 2010;115 : 778–782.
4. Acosta S, Alhadad A, Svensson P, Ekberg O. Epidemiology, risk and prognostic factors in mesenteric venous thrombosis. Br J Surg 2008;95 : 1245–1251.
5. Rajani R, Melin T, Björnsson E, et al. Budd-Chiari syndrome in Sweden: epidemiology, clinical characteristics and survival - an18-year experience. Liver Int 2009;29 : 253–259.
6. Ageno W, Dentali F, Pomero F, et al. Incidence rates and case fatality rates of portal vein thrombosis and Budd-Chiari syndrome. Thromb Haemost 2017;117 : 794–800.
7. Smalberg J, Arends L, Valla D, Kiladjian J, Janssen H, Leebeek F. Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis. Blood 2012;120 : 4921–4928.
8. Reilly JT, McMullin MF, Beer PA, et al. Guideline for the diagnosis and management of myelofibrosis. Br J Haematol 2012;158 : 453–471.
9. Pikman Y, Lee BH, Mercher T, et al. MPLW515L is a novel somatic activating mutation in myelofibrosis with myeloid metaplasia. PLoS Med 2006;3(7):e270.
10. Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl J Med 2005;352 : 1779–1790.
11. Araki M, Yang Y, Masubuchi N, et al. Activation of the thrombopoietin receptor by mutant calreticulin in CALR-mutant myeloproliferative neoplasms. Blood 2016;127 : 1307–1316.
12. Sozer S, Fiel M, Schiano T, Xu M, Mascarenhas J, Hoffman R. The presence of JAK2 V617F mutation in the liver endothelial cells of patients with Budd-Chiari syndrome. Blood 2009;113 : 5246–5249.
13. Teofili L, Martini M, Iachininoto M, et al. Endothelial progenitor cells are clonal and exhibit the JAK2(V617F) mutation in a subset of thrombotic patients with Ph-negative myeloproliferative neoplasms. Blood 2011;117 : 2700–2707.
14. Rosti V, Villani L, Riboni R, et al. Spleen endothelial cells from patients with myelofibrosis harbor the JAK2 V617F mutation. Blood 2013;121 : 360–368.
15. Dulíček P, Malý J. Budd-Chiari syndrom – úloha hematologa v multidisciplinárním přístupu. Vnitř Lék 2008;54(9):842–845.
16. Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European Leukemia Net. J Clin Oncol 2011;29(6):761–770.
17. Tefferi A, Barbui T. New and treatment–relevant risk stratification for thrombosis in essential thrombocythemia and polycythemia vera. Am J Hematol 2015;90(8):683–685.
18. Landolfi R, DiGennaro L, Barbui T, European collaboration on low-dose aspirin in polycythemia vera (ECLAP), et al. Leukocytosis as a major thrombotic risk factor in patients with polycythemia vera. Blood 2007;109(6):2446 –2452.
19. Schwarz J, Ovesná P, Černá O, et al. Thrombosis in thrombocythemic Ph-myeloproliferations is associated with higher platelet count prior to the event: results of analyses of prothrombotic risk factors from a registry of patients treated with anagrelide. Eur J Haematol 2016;96 : 98–106.
20. Penka M, Schwarz J, Campr V, et al. Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloprolifertivní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii bcr-abl negativních myeloproliferací. Vnitř Lék 2012;58(2):163–168.
21. Lussana F, Carobbio A, Randi M, et al. A lower intensity of treatment may underlie the increased risk of thrombosis in young patients with masked polycythaemia vera. Br J Haematol 2014;167 : 541–546.
22. Dulíček P, Hůlek P, Krajina A, et al. Diagnosis, etiology and management of the Budd-Chiari syndrome: a blood coagulation and hepatological study on the course of the disease treated with TIPS. Int Angiol 2016;35 : 90–97.
23. De Stefano V, Vannucchi AM, Ruggeri M, et al. Splanchnic vein thrombosis in myeloproliferative neoplasms: risk factors for recur-rences in a cohort of 181 patients. Blood Cancer J 2016;6:e493.
24. Stein BL, Rademaker A, Spivak JL, Moliterno AR. Gender and vascular complications in the JAK2 V617F positive myeloproliferative neoplasms. Thrombosis 2011;2011 : 874146.
25. Colaizzo D, Tiscia GL, Boffuno V, et al. Sex modulation of the occurence of JAK2V617F mutation in patients with splanchnic vein thrombosis. Thromb Res 2011;128(3):233–236.
26. How J, Zhou A, Oh S, et al. Splanchnic vein thrombosis in myeloproliferative neoplasms: pathophysiology and molecular mechanisms of disease. Ther Adv Hematol 2017;8 : 107–118.
27. Jones C, Levy Y, Tong AW. Elevated serum erythropoietin in a patient with polycythaemia vera presenting with Budd-Chiari syndrome. BMJ Case Rep; publikováno elektronicky 1. 12. 2014. DOI: 10.1136/bcr-2014-205663.
28. Dentali F, Sqiuzzato A, Brivio L, et al. JAK2 V617F mutation for the early diagnosis of Ph-myeloproliferative neoplasms in patients with venous thromboembolism: a meta-analysis. Blood 2009;113 : 5617–5623.
29. Colaizzo D, Amitrano L, Guardascione M, et al. Outcome of patients with splanchnic venous thrombosis presenting without overt MPN: a role for the JAK2 V617F mutation re-evaluation. Thromb Res 2013;132 : 99–104.
30. Stein B, Williams D, Wang N, et al. Sex differences in the JAK2 V617F allele burden in chronic myeloproliferative disorders. Haematologica 2010;95 : 1090–1097.
31. Austin S, Lambert J. The JAK2 V617F mutation and thrombosis. Br J Haematol 2008;143 : 307–320.
32. Rumi E, Pietra D, Ferretti V, et al. JAK2 or CALR mutation status defines subtypes of essential thrombocythemia with substantially different clinical course and outcomes. Blood 2014;123 : 1544–1551.
33. Ageno W, Dentali F, Squizzato A. How I treat splanchnic vein thrombosis. Blood 2014;124 : 3685–3691.
34. Hoekstra J, Janssen HL, et al. Vascular liver disorders (II): portal vein thrombosis. Neth J Med 2009;67 : 46–53.
35. Harnik IG, Brandt LJ, et al. Mesenteric venous thrombosis. Vasc Med 2010;15 : 407–418.
36. Kiladjian J, Cervantes F, Franck W, et al. The impact of JAK2 and MPL mutations on diagnosis and prognosis of splanchnic vein thrombosis: a report on 241 cases. Blood 2008;111 : 4922–4929.
37. Primignani M, Barosi G, Bergamaschi G, et al. Role of the JAK2 mutation in the diagnosis of chronic myeloproliferative disorders in splanchnic vein thrombosis. Hepatology 2006;44 : 1528–1534.
38. De Franchis R, Baveno VI Faculty. Expanding consensus in portal hypertension: report of the Baveno VI consensus workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol 2015;63 : 743–752.
39. Kearon C, Akl EA, Comerota AJ, et al. American college of chest physicians. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141 : 419S–494S.
40. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic therapy fot VTE disease, Chest guideline and expert panel report. Chest 2016;149(2):315–352.
41. Farge D, Bounameaux B, Brenner B, et al. International clinical practice guidelines including guidance for direct oral anticoagulants in the treatment and prophylaxis of venous thromboembolism in patients with cancer. Lancet Oncol 2016;17:e452–e466.
42. Ageno W, Riva N, Schulman S, et al. Antithrombotic treatment of splanchnic vein thrombosis: results of an international registry. Semin Thromb Hemost 2014;40 : 99–105.
43. Kearon C, Ginsberg JS, Kovacs MJ, et al. Comparison of low-intensity warfarin therapy with conventional-intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism. N Engl J Med 2003;349 : 631–639.
44. De Lédinghen V, Heresbach D, Fourdan O, et al. Antiinflammatory drugs and variceal bleeding: a case-control study. Gut 1999;44 : 270–273.
45. De Stefano V, Ruggeri M, Cervantes F, et al. Hight rate of recurrent venous thromboembolism in patients with myeloproliferative neoplasms and effect of prophylaxis with vitamin K antagonists. Leukemia 2016;30 : 2032–2038.
46. Spivak JL. Polycythemia vera, the hematocrit, and blood-volume physiology. N Engl J Med 2013;368 : 76–78.
47. Samuelson BT, Vesely SK, Chai-Adisaksopha C, Scott BL, Crowther M, Garcia D. The impact of ruxolitinib on thrombosis in patients with polycythemia vera and myelofibrosis: a meta-analysis. Blood Coagul Fibrinolysis 2016;27 : 648–652.
48. Potthoff A, Attia D, Pischke S, et al. Long-term outcome of liver transplant patients with Budd-Chiari syndrome secondary to myeloproliferative neoplasms. Liver Int 2015;35 : 2042–2049.
49. Tripodi A, Chantarangkul V, Gianniello F, et al. Global coagulation in myeloproliferative neoplasms. Ann Hematol 2013;92 : 1633–1639.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2018 Číslo 2- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Predikce vzniku inhibitoru faktoru VIII v kohortě SIPPET pomocí analýzy mutací a měření antigenu faktoru VIII
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
- Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11
- 100. výročí založení Československé republiky – vzpomínky hematologa
- Prof. MUDr. Milan Bláha, CSc., osmdesátníkem
- Doc. MUDr. Adela Bártová, CSc. (1927–2018)
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- Srovnatelná účinnost přímých antikoagulancií a warfarinu u pacientů s rakovinou a fibrilací předsíní
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



