-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mohou nádorové markery předpovídat výsledek embolizace větve portální žíly u nemocných s primárně inoperabilním nádorem jater?
Třeška V., Topolčan O., Vrzalová J., Pešta M., Liška V., Skalický T., Sutnar A., Fichtl J., Ňaršanská A., Polák M., Vachtová M., Doležal J., Šlauf F., Ferda J., Mírka H.: Can Tumor Markers Predict Outcomes of Portal Vein Branch Embolization in Patients with Primary Inoperable Liver Tumors?
Introduction:
Portal vein embolization (PVE) is one of the options to increase the number of resecable cases in patients with primary inoperable liver tumors. However, insufficient growth of liver parenchyma or postoperative tumor progression remains problematic in PVE procedures. Generally, tumor markers are of significance in patient postoperative monitoring for the disease recurrence. The aim of this study is to assess the potential of tumor markers in predicting PVE outcomes.Method:
The study group included 43 subjects with primary or secondary tumors, in whom serum α-fetoprotein (AFP), carcinoembryonic antigen (CEA), thymidine kinase (TK), tissue polypetide antigen (TPS) and MonoTotal levels were assessed 28 days following PVE. The liver parenchyma growth or tumor progression were assessed based on computer tomography.Results:
Sufficient liver parenchyma hypertrophy was recorded in 27 (62.8 %) patients with subsequent liver resection. Insufficient post-PVE liver parenchyma growth was recorded in 5 (11.6 %) patients and tumor progression was recorded in 11 (25.6 %) subjects. The following tests were considered significant predictive tumor markers of PVE outcomes: serum levels of CEA, TPA, Mono Total prior to PVE, and serum levels of TK, TPA, Mono Total within 28 days following PVE.Conclusion:
Tumor markers may be significant in predicting PVE outcomes in patients with primary inoperable liver tumors. However, in order to make final conclusions on their clinical significance, larger patient group studies should be performed.Key words:
tumor markers – portal vein branch embolization – liver hypertrophy – tumor progression
Autoři: V. Třeška; O. Topolčan 1; J. Vrzalová 1; F. Šlauf 2; V. Liška; T. Skalický; A. Sutnar; J. Fichtl; A. Ňaršanská; M. Vachtová
Působiště autorů: Chirurgická klinika FN a LF UK v Plzni, přednosta: prof. MUDr. V. Třeška, DrSc. ; Úsek imunoanalýzy a CRL FN a LF UK v Plzni, přednosta: prof. MUDr. O. Topolčan, CSc. 1; Radiodiagnostická klinika LF UK a FN v Plzni, přednosta: doc. MUDr. B. Kreuzberg, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 5, s. 285-289.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Embolizace větve portální žíly (PVE) je jednou z možností jak zvýšit počet resekabilních nemocných s primárně inoperabilními nádory jater. Problémem PVE však zůstává u některých nemocných nedostatečný nárůst jaterního parenchymu, nebo progrese nádoru po PVE. Nádorové markery mají obecně význam pro pooperační sledování nemocných z hlediska recidivy nádorového onemocnění. Práce hodnotí možnost využití nádorových markerů pro predikci výsledku PVE.Metoda:
U 43 nemocných s primárním nebo sekundárním nádorem jater byly stanovovány sérové hladiny α fetoproteinu (AFP), karcinoembryonálního antigenu (CEA), tymidinkinázy (TK), tkáňově polypeptického antigenu (TPS) a MonoTotalu v intervalu 28 dní po PVE. Stupeň nárůstu jaterního parenchymu nebo progresi nádoru jsme hodnotili pomocí výpočetní tomografie.Výsledky:
U 27 (62,8 %) nemocných došlo k dostatečné hypertrofii jaterního parenchymu s následnou resekcí jater. U 5 (11,6 %) nemocných nedošlo po PVE k dostatečnému nárůstu jaterní tkáně a u 11 (25,6 %) došlo k progresi nádoru v játrech. Významnými prediktivními nádorovými markery výsledku PVE byly sérové hladiny CEA, TPA, Mono Totalu před PVE a TK, TPA, Mono Totalu v průběhu 28 dní po PVE.Závěr:
Nádorové markery mohou mít prediktivní význam pro výsledek PVE u nemocných s primárně inoperabilními jaterními nádory. Pro definitivní určení jejich klinického významu je však zapotřebí větší soubor nemocných.Klíčová slova:
nádorové markery – embolizace větve portální žíly – hypertrofie jater – progrese nádoruStudie byla podpořena granty NS 9727-4/08, NS 10240-3/09,NS 9723-4 a VZ MSM 0021620819.
ÚVOD
Resekce jater je metodou volby léčby primárních a sekundárních nádorů jater. Bohužel jen 15–25 % nemocných je primárně resekabilních. Jednou z hlavních příčin inoperability nemocných je nedostatečný funkční zbytek jaterní tkáně (tzv. future remnant liver volume – FRLV) po resekci nádoru jater. Embolizace větve portální žíly (PVE) na straně jaterního nádoru ve většině případů vede k hypertrofii druhostranného jaterního laloku a tudíž umožňuje následnou resekci primárně neoperabilních nádorů jater [1, 2]. U některých nemocných nedochází však k dostatečnému nárůstu jaterní tkáně nebo dochází k progresi primárního nebo sekundárního nádoru v játrech nebo organismu po provedené PVE [3].
Nádorové markery slouží především jako ukazatelé možné recidivy nádoru při sledování nemocných po provedené resekci jater. Otázkou je, zda jejich sérové hladiny mohou být použity i v jiných situacích. Zajímalo nás proto, zda nádorové markery mají prediktivní a prognostický význam i u nemocných s PVE z hlediska růstu jaterního parenchymu, či progrese nádorového onemocnění v organismu.
MATERIÁL A METODA
V prospektivní nerandomizované studii (1. 1. 2003 – 31. 12. 2010) jsme provedli PVE u 43 nemocných (38 nemocných s metastázami kolorektálního karcinomu, 2 s metastázou karcinomu prsní žlázy, jedna s metastázou karcinomu ovaria a 2 nemocní s hepatocelulárním karcinomem) v důsledku nedostatečné FRLV. Průměrný věk nemocných byl 60,4 roků (33,3–70,6 let). U nemocných jsme stanovovali sérové hladiny rutinně zjišťovaných nádorových markerů – α fetoproteinu (AFP), karcinoembryonálního antigenu (CEA) chemiluminiscenční metodou na přístroji DXI 800 firmy Beckman, proliferačního markeru tymidinkinázy (TK) radioenzymatickou metodou soupravou firmy Immunotech, cytokeratinových solubilních fragmentů tkáňového polypeptického antigenu (TPA) a MonoTotalu (MT) imunoradiometrickou metodou za použití souprav DiaSorin a IDL firmy Biotech. Vzorky periferní žilní krve byly standardně odebírány z vena cubitalis mezi 6. a 7. hodinou ranní v časovém intervalu 0.–28. den po provedené PVE. PVE jsme prováděli zpočátku pomocí embolizačních spirálek, nyní využíváme směsi Histoacrylu (BBraun, SRN) s lipiodolem (Cedex, Francie). Změnu FRLV jsme sledovali ve 14denních intervalech až do 8 týdnů po PVE pomocí CT volumometrie na přístroji Somatom Definition (Siemens, Forchheim, SRN) s využitím software Syngo Volume Calculation od stejné firmy. Jakmile dosáhla požadovaného objemu, nemocný byl indikován k resekci jater. Pokud nemocný byl léčen chemoterapií, či biologickou léčbou (často v kombinaci), tuto léčbu jsme před PVE ukončili a pokračovali jsme přibližně 3 týdny po jaterní resekci. Progresi nádoru jsme hodnotili pomocí ultrazvukového, CT a PET CT vyšetření.
Statistické zpracování výsledků jsme provedli pomocí statistického software Statistica 9.0 (StatSoft, Praha).
VÝSLEDKY
K hypertrofii jaterní tkáně po PVE došlo u 27 (62,8 %) nemocných. Velkou resekci jater (více jak 3 segmenty) jsme mohli provést u 23 nemocných v průměru za 27,5 dne (20–52 dní) po PVE. U čtyřech nemocných jsme vzhledem ke zhoršení závažných přidružených především kardiovaskulárních onemocnění nemohli provést radikální resekční výkon a byla provedena pouze radiofrekvenční ablace – nemocní nebyli následně statisticky hodnoceni. U 16 (37,2 %) nemocných jsme nemohli provést jaterní resekci. Důvodem byl u 5 (11,6 %) nedostatečný nárůst jaterního parenchymu po PVE, nebo progrese nádoru v játrech či rozvoj mimojaterních metastáz u 11 (25,6 %) nemocných (Tab. 1).
Tab. 1. PVE u nemocných s primárním a sekundárním nádorem jater (N = 42) Tab. 1 PVE in patients with primary or secondary liver tumors (N = 42) 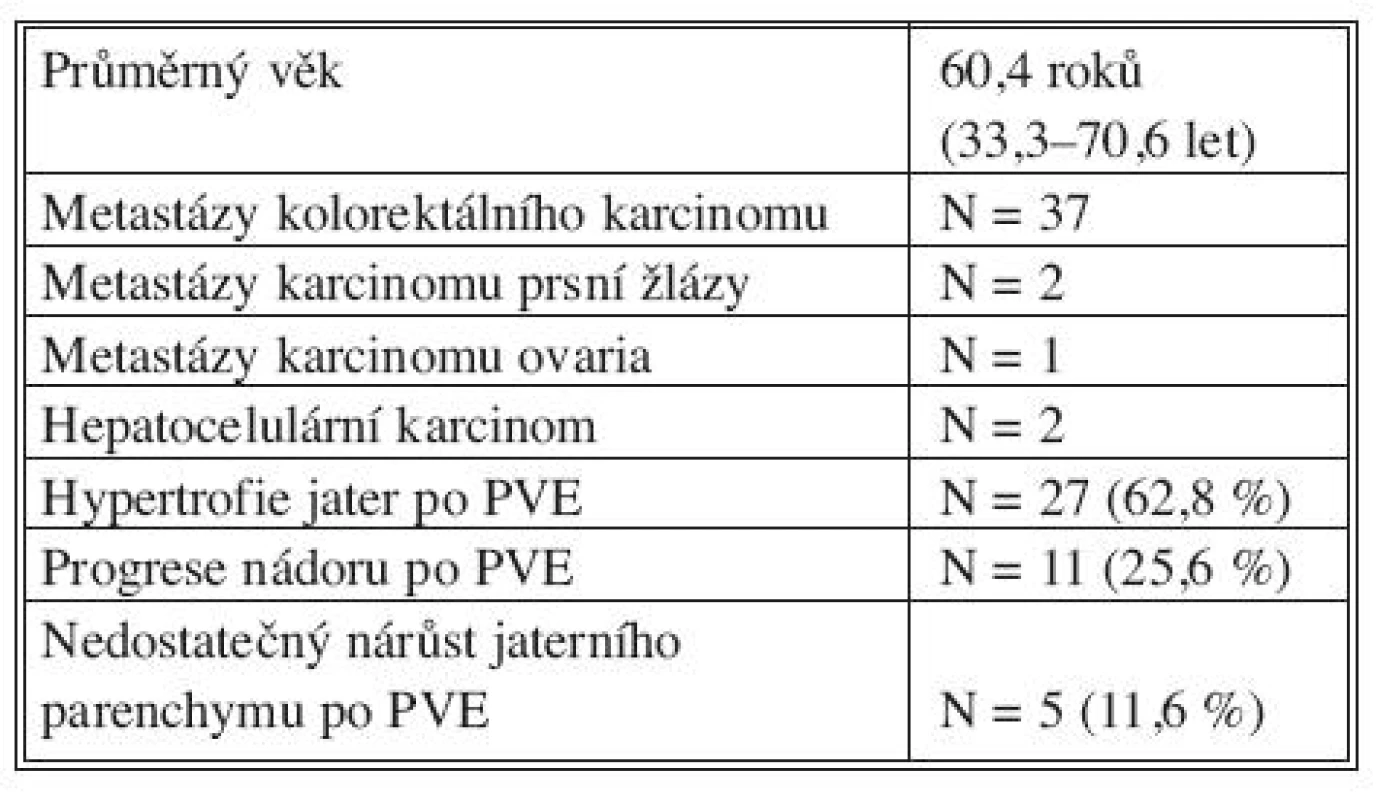
Sérové hladiny nádorových markerů před provedením PVE a v průběhu 28 dní po PVE jsme korelovali s výsledným efektem PVE u všech tří skupin nemocných (Tab. 2). Porovnáním výsledků se jeví být prediktivními faktory dostatečného nárůstu jaterní tkáně či progrese nádoru po PVE TPA (p < 0,03) a MT (p < 0,04). Hladiny CEA jsou signifikantně vyšší u nemocných s progresí nádoru po PVE (p < 0,09). Z hlediska úspěchu (hypertrofie jaterního laloku a následné resekce jater) a neúspěchu (progrese nádoru, nedostatečný nárůst jaterního parenchymu) se jeví jako důležité prediktivní markery TPA (p < 0,08) a MT (p < 0,016), jejichž vysoké hladiny mohou signalizovat dostatečný nárůst jaterního parenchymu po PVE (Tab. 3). Pokud jsme porovnali změny sérových hladin jednotlivých nádorových markerů v 28denním intervalu po PVE s jejím výsledkem, pak pro růst jaterní tkáně či progresi nádoru mají význam TK, TPA a MT (Tab. 4, Graf 1–3).
Tab. 2. Sérové hladiny nádorových markerů (TM) před PVE v korelaci s růstem jaterní tkáně a progresí nádoru po PVE Tab. 2. Tumor markers (TM) serum levels prior to PVE, in correlation with liver tissue growth and tumor progression following PVE 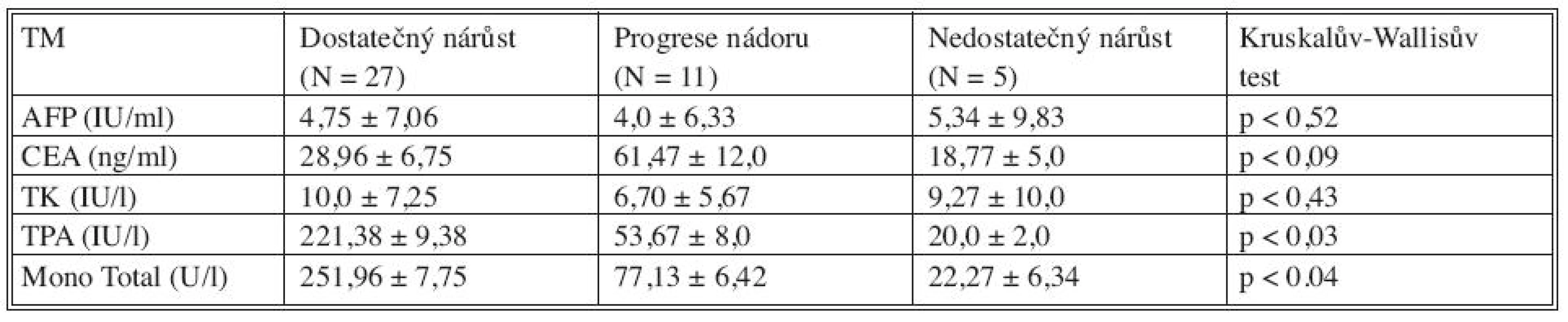
Tab. 3. Sérové hladiny biomarkerů před PVE v korelaci s výsledkem PVE Tab. 3. Serum levels of biomarkers prior to PVE , in correlation with PVE outcome 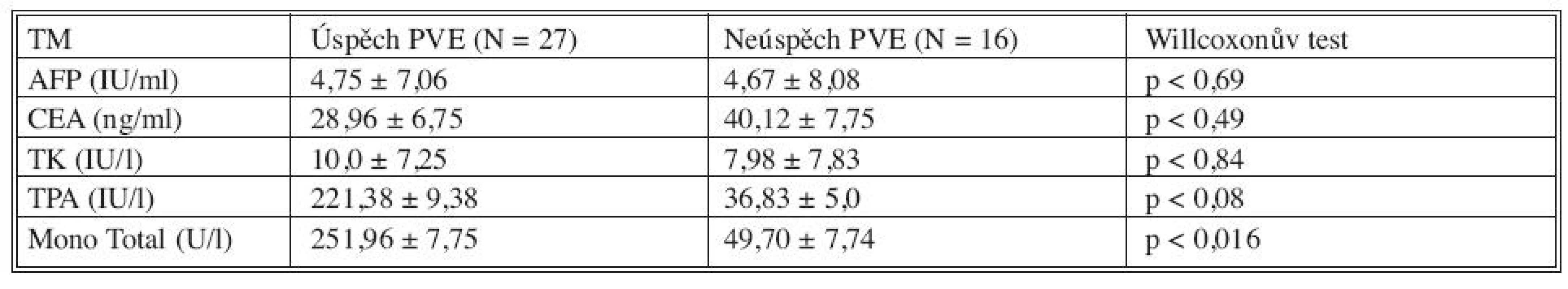
Tab. 4. Význam vývoje sérových hladin markerů (0.–28. den) na výsledek PVE Tab. 4. Significance of the course of TM serum levels (Day 0–28 after PVE) in correlation with PVE outcomes 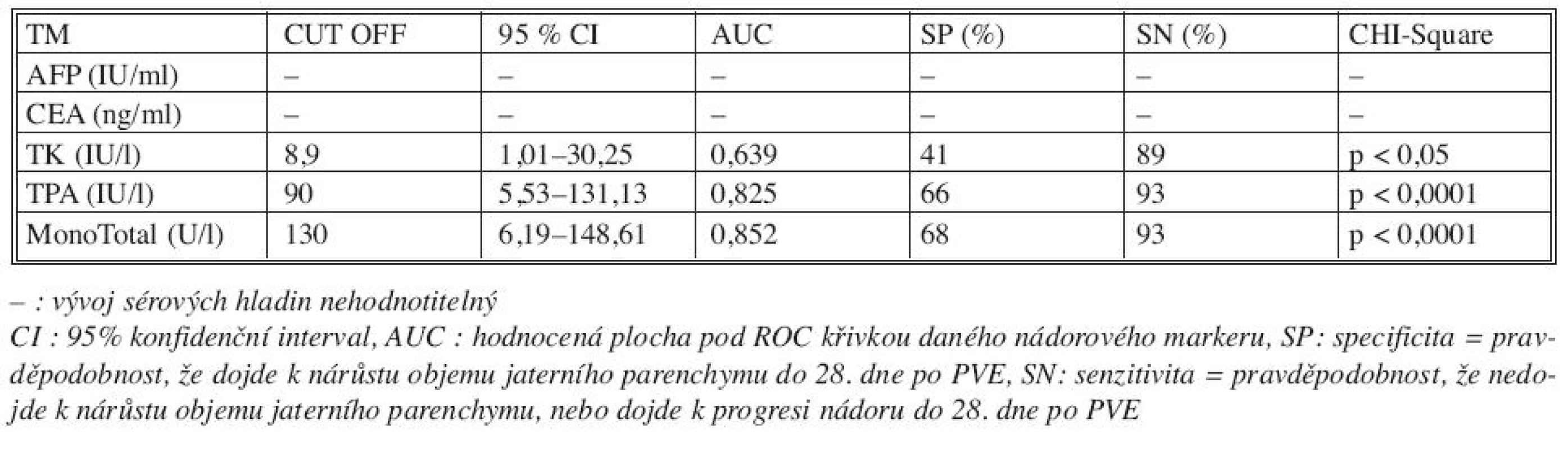
Graf 1. Časový vývoj průměrných hodnot sérových hladin TK (0.–28. den po PVE) Graph 1. Time curve of mean TK serum levels (Day 0 –28 after PVE) 
Graf 2. Časový vývoj průměrných hodnot sérových hladin TPA(0.–28. den po PVE) Graph 2. Time curve of mean TPA serum levels (Day 0 –28 after PVE) 
Graf 3. Časový vývoj průměrných hodnot sérových hladin MonoTotalu (0.–28. den po PVE) Graph 3. Time curve of mean MonoTotal serum levels (Day 0 –28 after PVE) 
DISKUSE
PVE je dnes zavedenou metodou, která rozšiřuje možnosti resekční terapie jater u primárně inoperabilních primárních a sekundárních nádorů jater [4, 5]. Kromě svých výše uvedených pozitiv, má i negativa, která spočívají v nedostatečném nárůstu jaterní tkáně nebo bohužel i v progresi nádorového onemocnění v játrech nebo organismu. Proto jistou výhodou by bylo znát určité prediktivní ukazatele výsledku PVE a dle toho volit optimální léčebný způsob pro jednotlivé nemocné s primárně neresekabilními nádory jater. V naší studii jsme se zaměřili na běžně stanovované nádorové markery, které jednak souvisí s charakterem metastatického postižení jater nebo primárními nádory u naší sledované skupiny nemocných a jednak mohou do jisté míry odrážet regenerační pochody vedoucí k hypertrofii jater po PVE. Základním klinickým významem nádorových markerů u nemocných s primárním nebo sekundárním nádorem jater je včasné zachycení možné recidivy malignity v různém časovém intervalu po operaci. V oblasti chirurgie jater zatím nejsou známy studie, které by se zabývaly prognostickým vztahem sérových hladin nádorových markerů k nárůstu jaterního parenchymu nebo progresi nádoru po PVE.
Po PVE ve většině případů dochází k dostatečné hypertrofii jaterního parenchymu s následnou možnou resekcí jater postižených nádorem. U některých nemocných však k hypertrofii jaterního parenchymu po PVE nedojde, nebo, co je horší, dojde k progresi nádoru v játrech, nebo organismu. Některé příčiny nedostatečného nárůstu objemu jater po PVE jsou známy – diabetes mellitus, nebo technicky nedostatečná PVE, či přítomnost portální hypertenze s tvorbou portosystémových spojek [6, 7], další příčiny však nejsou zcela jasné.
Příčiny progrese jaterních nádorů, která byla přítomna i u 11 našich nemocných, jsou doposud nejasné. Jednou z příčin může být aktivace metabolických procesů kancerogeneze. Zvýšení proliferační aktivity jaterních metastáz dokumentuje rovněž tkáňový proliferační marker Ki-67, který byl významně vyšší u metastáz po PVE v porovnání s metastázami bez PVE [8, 9]. Obdobný nález popsal Hayashi [10] u primárních jaterních nádorů, kde růst nádoru po PVE byl 2,37 cm3/den v porovnání k 0,59 cm3/den před PVE. Problémem samozřejmě může být i růst nádoru (především mikrometastáz) na jiném místě v organismu, protože po PVE je uvolňována do cirkulace celá řada růstových faktorů, cytokinů, která může mít vliv na progresi nádoru v organismu [11, 12, 13].
Zajímavé zjištění plynoucí z naší studie je, že některé nádorové markery mohou mít námi předpokládaný prediktivní charakter. Nicméně vzhledem k jejich rozmanité biologické aktivitě by bylo předčasné vyvozovat definitivní závěry. U nádorových markerů lze jejich předoperační hodnoty jen obtížně hodnotit ve vztahu k regeneraci jaterního parenchymu či progresi nádoru po PVE. Vyšší sérové hladiny CEA byly ukazatelem progrese nádoru v jaterním parenchymu, což může souviset s v posledních letech prezentovanou funkcí tohoto markeru u Kupfferových buněk. Některé experimentální a klinické studie dokumentují stimulaci Kupfferových buněk pomocí CEA k produkci tumor necrosis factoru – α, interleukinu-1 beta a interleukinu-6, které stimulují endoteliální buňky jaterních sinusoidů k produkci adhezivních molekul [14, 15]. Tyto molekuly pak zvyšují adhezi nádorových buněk v jaterním parenchymu.
Cytokeratinové solubilní fragmenty nejsou typickými nádorovými markery, jejich sérové hladiny se mění především v souvislosti se změnami buněčného cytoskeletonu. K jejich vyplavení dochází na jedné straně při poškození nekrózou, v souvislosti s apoptózou apod. a na druhé straně v souvislosti se zvýšeným dělením buněk, a to jak při nádorovém bujení, tak při rychlém buněčném dělení i z benigních příčin např. při regeneraci tkání. Je proto logické, že vysoké sérové hladiny TPA a MT nacházíme u nemocných s dostatečnou regenerací jaterního parenchymu po PVE. Navíc se ukazuje, že při současném sledování CEA a cytokeratinových fragmentů bude pravděpodobně možné odlišit regeneraci jaterního parenchymu od nádorové progrese. Při nádorové progresi se zvyšují jak CEA, tak i částečně cytokeratinové fragmenty, při regeneraci se výrazně zvyšují cytokeratinové fragmenty a CEA je nízké, nebo dokonce klesá. Při nedostatečné regeneraci jaterního parenchymu se cytokeratinové fragmenty nemění [16, 17].
Jsme si vědomi nedostatků této prospektivní nerandomizované studie. Především jsme hodnotili nesourodou skupinu nemocných danou metastázami kolorektálního, dále metastázami nekolorektálních karcinomů do jater a primárních nádorů jater. Jako vstupní kritérium jsme nehodnotili proliferační aktivitu jednotlivých nádorů, která pochopitelně může mít význam v progresi nádoru po PVE. Nicméně všechny primární i sekundární nádory jater byly diagnostikovány před PVE pomocí neinvazivních diagnostických metod a event. biopsie nádoru byla z etického hlediska nepřijatelná a zároveň i z onkologického hlediska kontraindikovaná. Vzhledem k malé skupině nemocných s nedostatečnou hypertrofií jater po PVE jsme se spíše orientovali na úspěch (hypertrofie jater) či neúspěch (progrese nádoru, nedostatečná hypertrofie jater) po provedené PVE. Naše studie probíhá dále a bude jistě zajímavé s odstupem času prezentovat naše výsledky s dostatečnými daty zejména u skupin s nedostatečnou regenerací jaterního parenchymu a progresí nádoru po PVE.
ZÁVĚR
Přes výše uvedené nedostatky se ale domníváme, že některé nádorové markery mohou být důležité pro predikci výsledku PVE, což může mít velký význam pro strategii onkologické a onkochirurgické léčby u každého individuálního pacienta.
Prof. MUDr. Vladislav Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e-mail: treska@fnplzen.cz
Zdroje
1. Gilson, N., Honoré, C., De Roover, A., Coimbra, C., Kohnen, L., Polus, M., Piront, P., van Daele, D., Honoré, P., Meurisse, M. Surgical management of hepatic metastases of colorectal origin. Acta gastro-enterol. belg., 2009; 72 : 321–326.
2. Makuuchi, M., Thai, B. L., Takayasu, K. Preoperative portal vein embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: a preliminary report. Surgery, 1990; 107 : 521–527.
3. Shimada, H., Tanaka, K., Endou, I., Ichikawa, Y. Treatment for colorectal liver metastases: a review. Langenbecks Arch Surg, 2009; 394 : 973–983.
4. Třeška, V., Skalický, T., Sutnar, A., Liška, V. Chirurgická léčba jaterních metastáz kolorektálního karcinomu. Rozhl. Chir., 2009; 88 : 69–75.
5. Neumann, U. P., Seehofer, D., Neuhaus, P. The surgical treatment of hepatic metastases in colorectal carcinoma. Dtsch. Arztbl. Int., 2010; 107 : 335–342.
6. Shim, J. H., Park, J. W., Kim, J. H., An, M., Kong, S. Y., Nam, B. H., Choi, J. I., Kim, H. B., Lee, W. J., Kim, C. M. Association between incrwement of serum VEGF level and prognosis after transcatheter arterial chemoembolization in hepatocellular carcinoma patients. Cancer Sci., 2008; 99 : 2037–2044.
7. Lygidakis, N. J., Bhagat, A. D., Vrachnos, P., Grikorakos, L. Challenges in everyday surgical practice: Synchronous bilobar hapatic colorectal metastases – newer multimodality approach. Hepato-Gastroenterology, 2007; 54 : 1020–1024.
8. Kokudo, N., Tada, K., Seki, M., Ohta, H., Azekura, K., Ueno, M., Ohta, K., Yamaguchi, T., Matsubara, T., Takanashi, T., Nakajima, T., Muto, T., Ikari, T., Yanagisawa, A., Kato, Y. Proliferative activity of intrahepatic colorectal metastases after preoperative hemihepatic portal vein embolization. Hepatology, 2001; 34 : 267–272.
9. Liu, H., Zhu, S. Present status and future perspectives of preoperative portal vein embolization. Am. J. Surg., 2009; 197 : 686–690.
10. Hayashi, S., Baba, Y., Ueno, K. Acceleration of primary liver tumor growth rate in embolized hepatic lobe after portal vein embolization. Acta Radiol., 2007; 48 : 721–727.
11. Ribero, D., Abdalla, E. K., Madoff, D. C., Donadon, M., Loyeer, E. M., Vauthey, J. N. Portal vein embolization before major hepatectomy and its effects on regeneration. Br. J. Surg., 2007;94 : 1386–1394.
12. Liu, H., Zhu, S. Present status and future perspectives of preoperative portal vein embolization. Am. J. Surg., 2009; 197 : 686–690.
13. Gulik, T., Esschert, J. W., Graaf, W., Lienden, K. P., Busch, O. R. C., Heger, M., Delden, O. M., Laméris, J., Gouma, D. J. Controversies in the use of portal vein embolization. Dig. Surg., 2008; 25 : 436–444.
14. Yokoyama, Y., Nagino, M., Nimura, Y. Mechanisms of hepatic regeneration following portal vein embolization and partial hepatectomy: a review. World J. Surg., 2007; 31 : 367–374.
15. Schetter, A. J, Nguyen, G. H., Mathé, E. A., Yuen, S. T., Hawkes, J. E., Croce, C. M., Leung, S. Y., Harris, C. C. Association of inflammation-related and microRNA gene expression with cancer-specific mortality of colon adenocarcinoma. Clin. Cancer Res., 2009; 15 : 5878–5887.
16. Aarons, C. B., Bajenova, O., Andrews, C., Heydrick, S., Bushell, K. N., Red, K. L., Thomas, P., Becker, J. M., Stucchi, A. F. Carcinoembryonic antigen-stimulated THP-1 macrophages activate endothelial cells and increase cell-cell adhesion of colorectal cancer cells. Clin. Exp. Metastasis, 2007; 24 : 201–209.
17. Holubec, L. jr,, Topolčan, O., Pikner, R. Biologická aktivita kolorektálního karcinomu. Cas. Lek. Ces., 2002; 141 : 508–512.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Epidemiológia defektov neurálnej rúry
- Chirurgická léčba symptomatických obratlových hemangiomů
- Mnohočetný myelom páteře a jeho chirurgická léčba
- Mediastinální cysty, chirurgické řešení
- Caroliho nemoc – dilatace intrahepatálních žlučových cest
- Mohou nádorové markery předpovídat výsledek embolizace větve portální žíly u nemocných s primárně inoperabilním nádorem jater?
- Perforace žaludku patnáctileté dívky, způsobená objemným trichobezoárem–Rapunzelin syndrom
- „Low volume“ laparoskopická nefrektomie pro příbuzenskou transplantaci
- Uskřinutí akcesorního orgánu břišní dutiny jako neobvyklá peroperační diagnóza – kazuistika
- Pilonidální sinus – chirurgická léčba na našem pracovišti
- Intratorakální struma – nediagnostikovatelná – přece odoperovaná
- Augmentace dekompresivní kraniektomie obvazovou textilií COM 30 v terapii refrakterní nitrolební hypertenze – kazuistika
- Památce prof. MUDr. Jaroslava Mayzlíka, CSc.
- Zápis z Redakční rady časopisu Rozhledy v chirurgii
- Několik slov k imprimatur a ke článku „Přednosti klasického operačního přístupu v chirurgické léčbě plicních metastáz“ (Rozhl. Chir., 2011, roč. 90, č. 3, s. 162–165).
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pilonidální sinus – chirurgická léčba na našem pracovišti
- Caroliho nemoc – dilatace intrahepatálních žlučových cest
- Chirurgická léčba symptomatických obratlových hemangiomů
- Mediastinální cysty, chirurgické řešení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



