-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Terapie lymfokély po transplantaci ledviny
Therapy of Lymphocele Following Kidney Transplantation
About 20% of post-transplant lymphoceles are symptomatic and require treatment. Correct treatment indication and accurate treatment approach could ensure the transplanted kidney from lymphocele complications. There is wide scale of treatment modalities from noninvasive to surgical procedures. The most frequently used miniinvasive procedure is sclerotisation. The first choice surgical method is a laparoscopic drainage of the lymphocele into the peritoneal cavity. Correctly treated lymphocele does not impair graft function even in long-term follow-up.
Key words:
complication – kidney transplantation – lymphocele – treatment
Autoři: J. Pacovsky; M. Broďák; P. Navrátil
Působiště autorů: Urologická klinika FN a LF UK v Hradci Králové, doc. MUDr. Richard Fiala, CSc., FEBU
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 11, s. 596-600.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Přibližně 20 % lymfokél po transplantaci ledviny je symptomatických a vyžadují léčbu. Správná indikace k léčbě a vhodně zvolená technika dokáže ochránit transplantovanou ledvinu před komplikacemi lymfokély. Možností léčby je široká škála od neinvazivních až po operační. Z miniinvazivních technik je nejčastěji používaná sklerotizace. Metodou volby chirurgického řešení lymfokély je laparoskopická drenáž do peritoneální dutiny. Správně léčená lymfokéla neovlivňuje funkci transplantované ledviny dokonce ani z dlouhodobého hlediska.
Klíčová slova:
komplikace – léčba – lymfokéla – transplantovaná ledvinaLymfokéla patří mezi chirurgické komplikace transplantace ledviny s incidencí okolo 20 % [5]. Svým přímým tlakem na okolí může poškozovat funkci transplantované ledviny, ale i okolních orgánů. Lymfokéla může působit i nepřímo, a to fibrotizací okolních tkání.
Cílem terapie lymfokély je snížit její objem a tím tlak na okolní struktury a současně provést opatření, která by měla minimalizovat riziko recidivy nebo v optimálním případě toto riziko zcela eliminovat. Jen tak jsme schopni zajistit dobrou funkci transplantované ledviny. Správně léčená lymfokéla, včetně chirurgických výkonů, nemá z dlouhodobého hlediska negativní vliv na funkci [14].
Přibližně 15–20 % lymfokél je symptomatických a vyžadují terapii [11]. V těchto případech je razantní terapie zcela na místě, neboť taková léčba má možnost zachovat funkční transplantovanou ledvinu.
Řešení lymfokély, jako chirurgické komplikace transplantace má v současnosti poměrně široké spektrum dobře propracovaných technik. Volba optimálního přístupu je závislá na velikosti, lokalizaci a symptomatice přítomné lymfokély.
PROSTÁ ASPIRACE
Prostá perkutánní aspirace tenkou jehlou, která je zavedena do dutiny lymfokély pod ultrazvukovou kontrolou by měla být prvním krokem. Tímto jediným způsobem jsme schopni získat k vyšetření obsah lymfokély, je tedy naprosto nezbytným krokem v diagnostice. U malých nekomplikovaných stabilizovaných lymfokél je často možno tímto způsobem aspirovat většinu obsahu. V takovém případě může být i prostá aspirace výkonem terapeutickým [16]. Bohužel recidivy lymfokély po perkutánní aspiraci mohou dosahovat až 90 %. Prostá aspirace je tedy vyhrazena pro diagnostické účely a v případě terapie ji lze doporučit jen jako odlehčující výkon při akutním ohrožení štěpu s výhledem definitivního řešení jiným způsobem.
PERKUTÁNNÍ DRENÁŽ
Perkutánní zavedení drénu, který je možno ponechat i několik týdnů je velmi konzervativní a minimálně zatěžující možnost léčby lymfokély [20]. Pod ultrazvukovou kontrolou je zavedena tenká jehla do lymfokély a po dilataci kanálu je zaveden perkutánní drén.
Principem této drenáže je detenze lymfokély, eliminace tlaku lymfokély na štěp a jeho struktury. Ze zkušeností vyplývá, že prostá drenáž může být dostatečným výkonem z hlediska léčby. V cca 20 % případů dojde ke spontánnímu zastavení toku lymfy a uzavření dutiny lymfokély a jejímu zajizvení. Tento výkon je prováděn v lokální anestezii, je tedy pro nemocného minimálně zatěžující (Obr. 1).
Obr. 1. Perkutánní drén v lymfokéle v pravém podbřišku Fig. 1. Percutaneous drain introduced in a lymphocele in the right hypogastrium 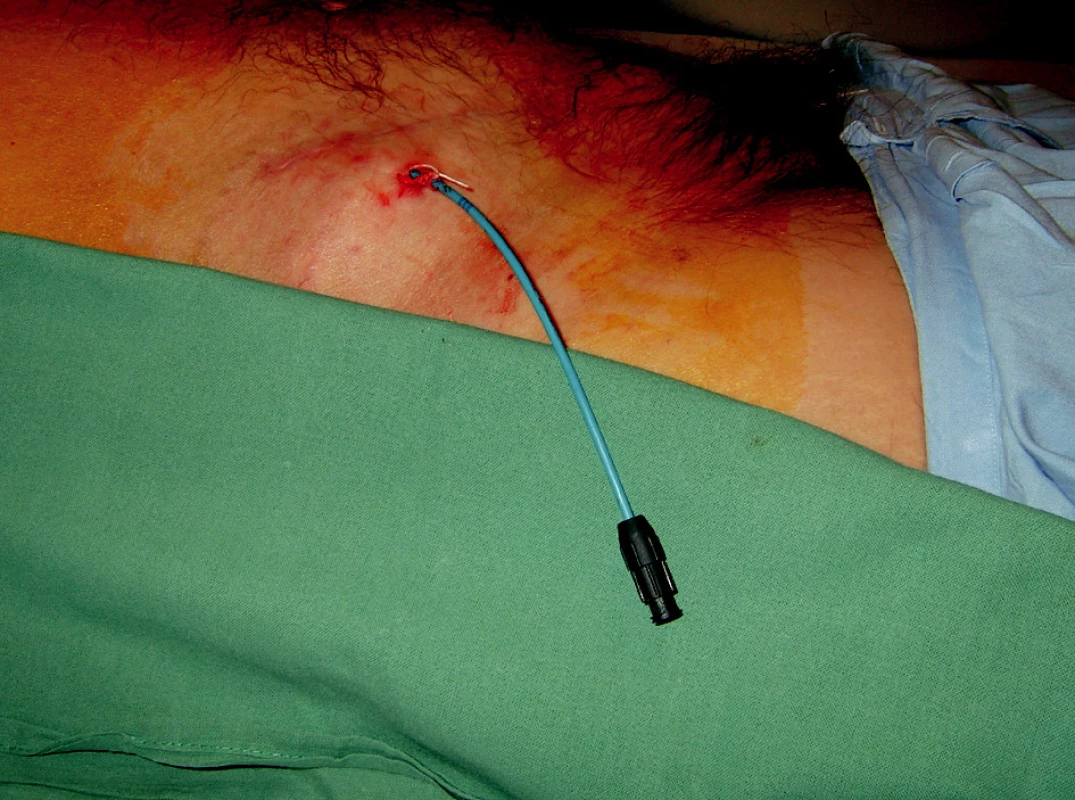
Perkutánní drenáž lymfokély může být použita jako samostatný léčebný úkon, většinou je však použita, jako východisko dalších technik. Perkutánní drén je velmi vhodný ke sklerotizaci lymfokély, neboť umožňuje opakovanou aplikaci sklerotizační látky. V případě následné chirurgické léčby má perkutánní drén nezastupitelnou roli v peroperační vizualizaci lymfokély pomocí aplikace metylénové modři drénem [3].
V případě aspiračního nálezu infikovaného obsahu lymfokély je založení perkutánního drénu a současné podání antibiotik naprosto nezbytným opatřením. Další chirurgický výkon nesmí být proveden, dokud není infekce sanována.
Prostá perkutánní drenáž má též řadu nevýhod. Dyskomfort nemocného, který má řadu týdnů perkutánní drén je jedním z nich. Vyžaduje velmi dobrou spolupráci nemocného ve zvýšené péči o drén a jeho okolí. V řadě případů je špatná compliance nemocného kontraindikací k tomuto způsobu léčby. Mnohem závažnější je vysoké riziko sekundární infekce obsahu lymfokély při dlouhodobé perkutánní drenáži. V takovém případě je nutná razantní antibiotická terapie a zajištění dokonalé drenáže obsahu. Dlouhodobá perkutánní drenáž lymfokély je též spojena s nezanedbatelnými ztrátami proteinů, které v závislosti na objemech může dosahovat i gramových hodnot denně [19]. To může v konečném důsledku zhoršit celkový zdravotní stav nemocného, který se tak snadno může dostat do hypoproteinémie a katabolického stavu.
SKLEROTIZACE
Nevýhody dlouhodobého zavedení perkutánního drénu vedly ke snahám o rychlejší vyřešení problému a zkrácení doby drenáže. Principem sklerotizační terapie je vyvolání sterilního zánětu uvnitř lymfokély, který zastaví další sekreci lymfy a vyvolá adheze stěn, jež definitivně lymfokélu obliterují. Některé používané prostředky přímo ovlivňují aktivitu tkáňových kolagenáz, a tím aktivně a zejména cíleně působí v léčbě lymfokély [8]. K vyvolání sterilního zánětu byla vyzkoušena řada chemických i fyzikálních činitelů s rozlišnými výsledky. Cestou aplikace sklerotizačního agens je nejčastěji perkutánní přístup. Postup je shodný s perkutánní aspirací, ale po aspiraci a evakuaci obsahu lymfy je zpět do dutiny aplikována sklerotizační látka. Některé preparáty se podávají jednorázově, pak je možné jejich podání přímo jehlou, kterou byla lymfokéla evakuována. Některé preparáty je možné podávat opakovaně. Zde je pak s výhodou zavedení perkutánního drénu, který jednak umožňuje kontinuálně evakuovat lymfu z nitra lymfokély, ale i opakovanou sklerotizaci.
Nejčastěji používaným sklerotizačním prostředkem je povidone-iodine v 10% koncentraci. Nespornou výhodou použití povidone-iodinu je jeho cenová dostupnost a možnosti opakovaného použití. Přestože při sklerotizaci lymfokély nedochází k systémovému působení, je použití tohoto preparátu kontraindikováno u všech forem alergie na jodové přípravky. Hodnocení efektivity sklerotizace povidone-iodinem je velmi diskutabilní. Publikované výsledky se pohybují v extrémních hodnotách 0–100 % [9, 13].
Dalším často používaným sklerotizačním prostředkem je 95% etanol [17]. I tento preparát je finančně dostupný. Efektivita této léčby je poměrně vysoká. Publikovaná data udávají četnost rekurence lymfokély po sklerotizaci etanolem až 45 % [7]. V případě rekurence je doporučováno použití fibrinových lepidel. Na druhou stranu použití 95% etanolu je zatíženo nejzávažnějšími komplikacemi. Byly publikovány jednotlivé případy, kdy instilace 95% etanolu vedla k poškození cévního zásobení s akutní trombózou žíly i tepny nebo močovodu. Tyto případy vždy vedly ke ztrátě štěpu [6].
Mezi nejúčinnější prostředky používané ke sklerotizaci lymfokély patří doxycyklin a fibrinová lepidla. Oba preparáty se podávají jednorázově. Doxycyklin se aplikuje v dávce 200 mg [5]. Kromě sterilní zánětlivé reakce, doxycyklin přímo ovlivňuje tkáňovou koleganázu. Tím je vysvětlována vysoká efektivita této léčby dosahující 91–93 % [5].
Fibrinová tkáňová lepidla patří k nejmodernějším prostředkům, které lze využít k účinné sklerotizaci lymfokély. Podávají se jednorázově, lze je použít v případě rekurence lymfokély po předchozí sklerotizaci a jejich použití je ze všech používaných metod nejbezpečnější. Účinnost sklerotizace lymfokély fibrinovými lepidly dosahuje 72–90 % [14]. Jedinou nevýhodou použití fibrinových lepidel v konzervativní léčbě potransplantační lymfokély je jejich vysoká cena.
V historii transplantací a snahy o sklerotizaci komplikujících lymfokél byla použita velká řada preparátů. Většina z nich pro nízkou efektivitu nebo vysoká rizika spojená s jejich užitím upadla v zapomnění. Nicméně i v současné literatuře lze najít návrat k některým starším způsobům, jakým je například lokální podání talku [18], rentgen kontrastní látky amidotrizoátu [2], kyseliny octové [1] a dalších preparátů. Nelze předpokládat jejich využití v širším měřítku.
Skleroterapie lymfokély patří k prvním aktivním léčebným přístupům potransplantační lymfokély. Jejich nevýhodou je mnohdy nízká efektivita a v některých případech i vysoká cena. Rovněž nelze očekávat přínos sklerotizace u lymfokél velkých objemů. I přes nejistý výsledek takové léčby zůstává sklerotizace lymfokély stále dost atraktivní přístup pro svou nenáročnost na provedení a relativně vysokou bezpečnost. V léčebných algoritmech zůstává doporučená, jako metoda volby u malých lymfokél. Velké lymfokély, jejichž obsah převyšuje 500 ml jsou pro sklerotizaci kontraindikovány. Předchozí neúspěšná sklerotizace obvykle vede ke strukturálním změnám uvnitř lymfokély, často dochází k tvorbě sept. Tyto změny pak mohou negativním způsobem ovlivnit možnosti následné radikální chirurgické léčby. Je tedy nutno vždy zvážit, zda přistoupit ke sklerotizaci nebo primárně provést operační výkon.
LAPAROSKOPICKÁ DRENÁŽ
Laparoskopické řešení lymfokély po transplantaci ledviny je považována za optimální metodu. Principiálně jde o drenáž obsahu lymfokély do peritoneální dutiny. Tím dochází k obnovení možnosti přirozené cirkulace lymfy, která je přerušena díky zapouzdření tekutiny ve fibrózním pouzdru. Při operaci se resekuje fibrózně změněné nástěnné peritoneum, které se postupně vyvinulo v pouzdro lymfokély. Laparoskopická operace je v současné době nejčastěji používaným způsobem chirurgické léčby [12].
Před vlastní operací je nutno získat dokonalé topografické znalosti daného regionu. Při operaci musíme znát lokalizaci hilových cév a průběh močovodu. V tom nám může pomoci předoperačně provedené vyšetření CT nebo magnetickou rezonancí (MR). Při vlastní operaci nám může orientaci v prostoru usnadnit diafanoskopie přes břišní stěnu a nebo přímo přes kapsulu lymfokély. Zcela precizní znalosti o lokalizaci cév a močovodu při operaci nám poskytne peroperační ultrazvuk pomocí laparosondy. Tímto způsobem je téměř eliminováno riziko poranění těchto struktur. K lepší orientaci nám též může pomoci předoperačně zavedený perkutánní drén, který umožní peroperačně instilaci metylénové modři do dutiny lymfokély, a tím lepší možnost odlišení stěny od stěny ledviny [3].
Laparoskopická fenestrace lymfokély patří mezi radikální chirurgické metody léčby lymfokély, ale z hlediska zátěže pro nemocného patří mezi výkony miniinvazivní. K vlastní operaci jsou potřeba jen 3 porty: 1x 10mm pro optiku a 2x 5mm porty pro pracovní nástroje. Umístění portů musí zajistit dokonalý přehled v oblasti štěpu a přilehlé lymfokély. V zásadě se doporučuje zavedení videoportu pod pupkem ve střední linii, pracovní porty pak v podbřišku kontralaterálně od lymfokély. Jejich definitivní rozložení je však zcela individuální podle zvyklostí operatéra.
Při vlastní operaci musíme lokalizovat stěnu lymfokély, je možné provedení probatorní aspirace a pak široce otevřeme stěnu lymfokély směrem do peritoneální dutiny její resekcí (Obr. 2, 3).
Obr. 2. Peroperační laparoskopická aspirace obsahu lymfokély Fig. 2. Intraoperative laparoscopic aspiration of the lymphocele contents 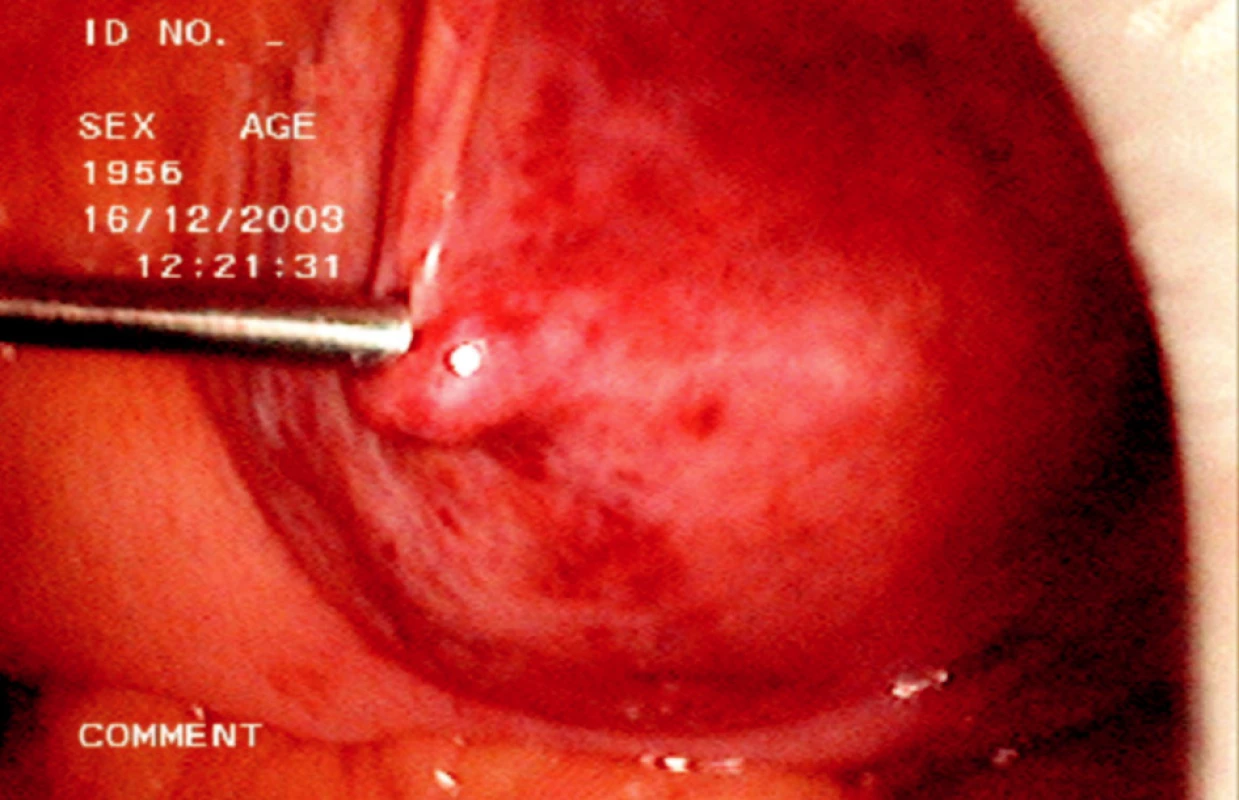
Obr. 3. Laparoskopická fenestrace lymfokély Fig. 3. Laparoscopic fenestation of the lymphocele 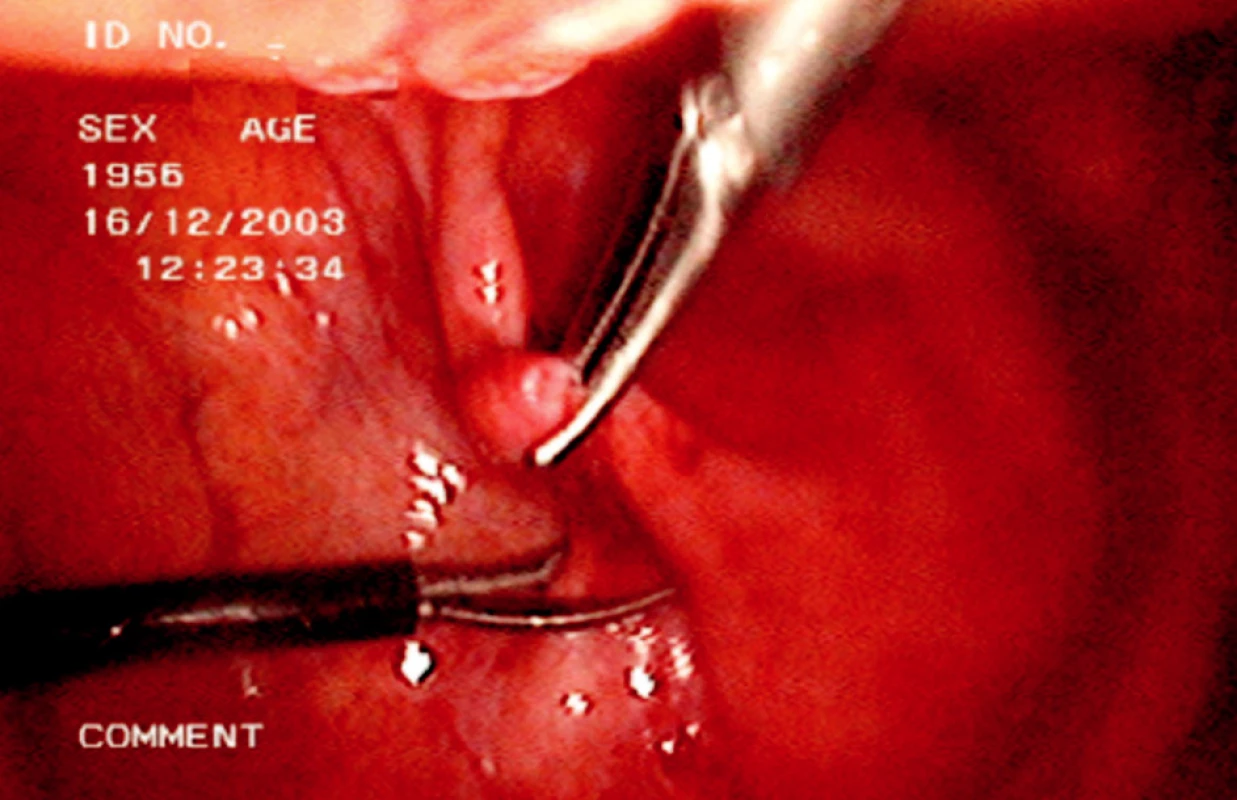
Laparoskopické ošetření lymfokély je v současnosti „zlatým standardem“ chirurgické léčby lymfokély [13]. I s ohledem na fakt, že operujeme pacienta po transplantaci ledviny se všemi důsledky, je laparoskopická operace relativně málo riziková a málo zatěžující.
Vzhledem k tomu, že obsah lymfokély je evakuován do peritoneální dutiny, musíme před operací vyloučit případnou infekci obsahu. Proto je nutné i mikrobiologické vyšetření před operací. Pokud je infekce přítomna, je fenestrace kontraindikována. V takovém případě je nutná nejprve perkutánní drenáž a antibiotická terapie a teprve po sanaci infekce je možno operaci provést.
Laparoskopické operace mají i svá omezení. I zde platí obecné kontraindikace laparoskopického přístupu. Nitrobřišní infekce, předchozí rozsáhlé břišní operace, srůsty, ... Dalším důležitým faktorem, který rozhoduje o tom, zda použít nebo nepoužít laparoskopii k řešení lymfokély je její lokalizace vzhledem k ledvině. Laparoskopický přístup nám umožňuje velmi dobrý přístup ke kaudální, mediální, ventrální a kraniální části štěpu. Pokud je lymfokéla lokalizována v těchto oblastech je laparoskopicky dobře dostupná a lze jí touto cestou řešit. Pokud je však lymfokéla umístěna laterálně od štěpu, tak je při laparoskopickém přístupu nedosažitelná nebo dosažitelná s neúměrně vysokým rizikem poranění štěpu. V takovém případě jsme nuceni preferovat otevřenou operaci.
OTEVŘENÁ OPERACE
Jak již bylo řečeno, laparoskopická drenáž patří ke „zlatému standardu“ léčby lymfokély. Přesto existuje řada indikací k fenestraci otevřenou operací [4]. Nejčastější indikací k otevřené drenáži je kontraindikace laparoskopie. Zejména u nemocných s anomálními močovými cestami, u kterých byla provedena před transplantací provedena jejich rekonstrukce. Stejně tak resekční výkony na zažívacím traktu. V těchto případech jsou v peritoneální dutině přítomny rozsáhlé změny a lze očekávat i četné srůsty. V takovém případě je vysoce rizikové již samotné založení kapnoperitonea. Navíc laparoskopie v takto nepřehledném terénu je vždy spojeno s neúměrně vysokým nárůstem poranění cévní stopky střeva či transplantované ledviny. Další jasnou indikací k otevřené operaci je vlastní lokalizace lymfokély. Pokud je uložena laterálně či dorzálně od štěpu, je laparoskopický přístup kontraindikován. Indikací k otevřené drenáži je i recidiva lymfokély po předchozí laparoskopické operaci.
Operační přístup při otevřené operaci lymfokély je doporučován transperitoneálně. Přistupujeme buď z dolní střední laparotomie nebo původním řezem, kterým byla provedena transplantace. Palpačně nebo vizuálně lokalizujeme lymfokélu a provedeme fenestraci do peritonea. Vždy musíme kontrolovat lokalizaci štěpu, jeho cév a močovodu. Otevřená operační drenáž lymfokély do peritoneální dutiny je zatížena menším rizikem poranění těchto struktur. Pro snížení rizika recidivy je doporučována omentopexe do dutiny původní lymfokély. Tato tkáň brání uzavření vytvořené komunikace, navíc omentum je schopno resorbovat přítomnou tekutinu.
Obr. 4. Objemná lymfokéla, která vyklenuje do operační rány Fig. 4. A large lymphocele, buldging into the surgical wound 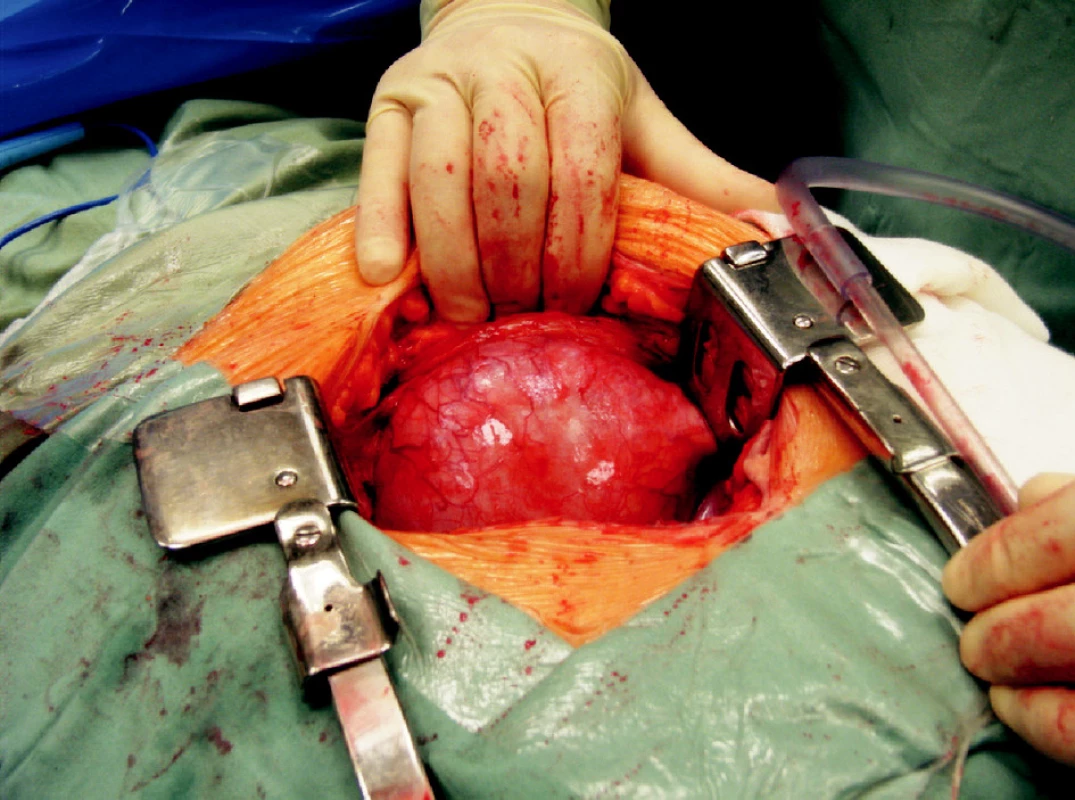
INTRAPERITONEÁLNÍ KATETRIZACE
Spojení dutiny lymfokély a dutiny peritoneální je cílem chirurgické léčby lymfokély. Způsobů, jak takového spojení dosáhnout, je mnoho. V poslední době se objevují techniky, které lze provádět i ambulantně. Jednou z nich je založení intraperitoneálního katétru [10]. Jedná se o plastovou trubici, která se pod ultrazvukovou kontrolou zavede jedním koncem do dutiny lymfokély, dále je vedena podkožním tunelem až k místu, kde je zavedena do dutiny peritoneální. Je to technika minimálně zatěžující a je indikována pro nekomplikované lymfokély. Zatím jsou s ní jen malé zkušenosti, a proto není doposud široce užívaná.
Obr. 5. Intraperitoneální fenestrace objemné lymfokély otevřenou cestou Fig. 5. Intraperitoneal fenestration of the large lymphocele using open surgery 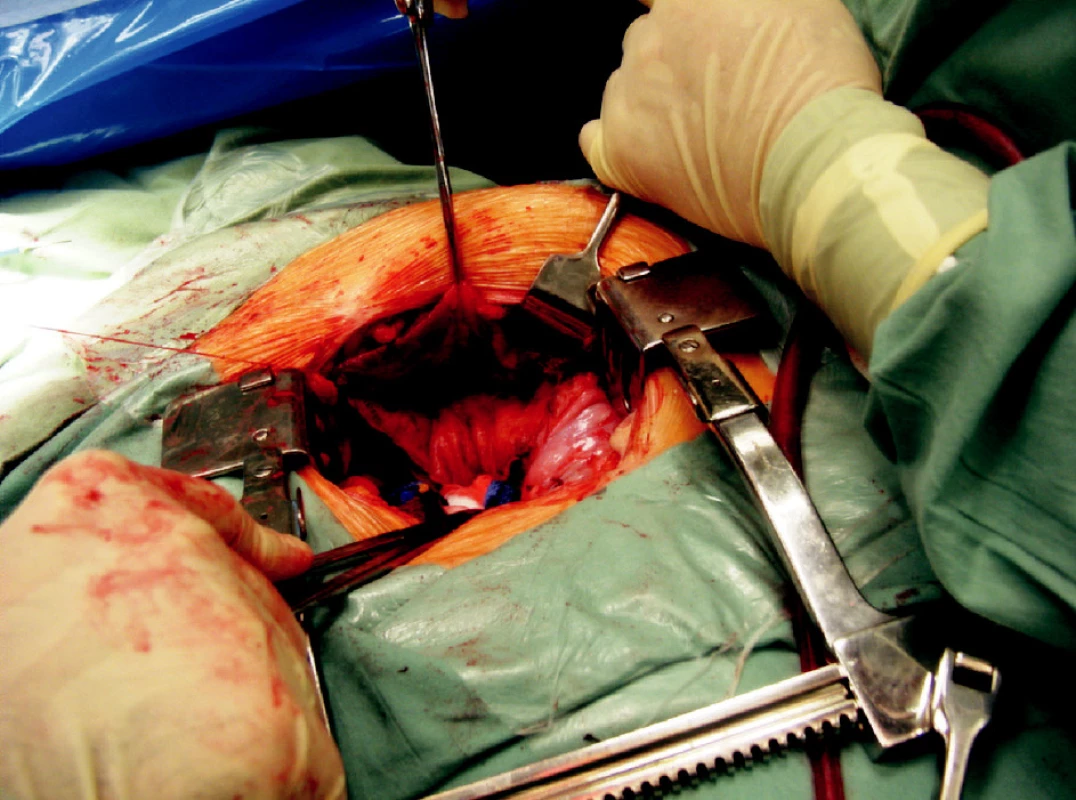
MEDIKAMENTÓZNÍ LÉČBA
Možností medikamentózní léčby se zabývá řada odborníků, neboť myšlenka použití léků k eliminaci invazivních výkonů je velmi lákavá. Bohužel jen málo z nich dosáhlo reálných úspěchů. V současnosti existuje možnost subkutánní podání octreotidu, jako syntetického derivátu somatostatinu. Mechanismus působení není ještě zcela objasněn, nicméně se předpokládá přímý vliv na lymfatické cévy [19]. Použití octreotidu má mnoho omezení. Tento preparát lze použít jen ve fázi protrahované lymforhey, ve fázi vzniku fibrózního pouzdra již nemá jeho podání význam. Je prokázáno, že podání somatostatinu zkracuje dobu lymforhey na 50 %. Finanční nároky na takovou léčbu jsou tak vysoké, že nelze předpokládat její uplatnění v klinické praxi. Tento způsob je zde zmiňován jen pro úplnost pohledu na možnosti léčby lymfokély.
ZÁVĚR
Existuje široké spektrum možností léčby lymfokély, z kterého je možno vybrat optimální postup. Správná volba je závislá na správně provedené diagnostice. Indikaci k léčbě je vždy pečlivě uvážit i s ohledem na fakt, že jen cca 15–20 % lymfokél je symptomatických a vyžadují léčbu. Každý z možných léčebných postupů je zatížen větším či menším rizikem a naším prvořadým úkolem je toto riziko minimalizovat, případně zcela eliminovat. Na druhou stranu správně indikovaná a správně provedená léčba ochrání nemocného a dlouhodobě zajistí stabilní funkci štěpu [15].
MUDr. J. Pacovský
Bratří Čapků 877
500 03 Hradec Králové
e-mail: japacovsky@post.cz
Zdroje
1. Adani, G. L., Baccarani, U., Bresadola, V. A., et al. Graft loss due to percutaneous sclerotherapy of a lymphocele using acetic acid after renal transplantation. Cardiovasc. Intervent. Radiol., 2005; 26 : 836–838.
2. Carrera, C., Burgos, F. J., Rodrigues, R., et al. Sclerotherapy of post-renal transplantation lymphocele with percutaneous instillation of amidotrizoate. Actas Urol. Esp., 1996; 20 : 389–394.
3. Esterl, R. M., Halff, G. A. The use of methylene blue in the identification of lymphoceles after renal transplantation. Urology, 1995; 45 : 1088–1089.
4. Fuller, T. F., Kang, S. M., Hirose, R., et al. Management of lymphoceles after renal transplantation: laparoscopic versus open drainage. J. Urol., 200; 169 : 2022.
5. Hamza, A., Fisher, K., Koch, E., et al. Diagnostic and therapy of lymphoceles after kidney transplantation. Transplant. Proc., 2006; 38 : 701–706.
6. Huilgol, A. K., Sundar, S., Karunadagaran, S., et al. Lymphoceles and their management in renal transplantation. Transplant. Proc., 2003; 35 : 32.
7. Kuzuhara, K., Inoue, S., Dobashi, Y., et al. Ethanol ablation of lymphocele after renal transplantation: a minimally invasive approach. Transplant. Proc., 199; 29 : 147–150.
8. Lin, J. J., Sorbi, D., Uy, J. P., et al. Doxycycline sclerotherapy of lymphocele after renal transplantation and its inhibiton gelatonase activity. Transplant. Proc., 1993; 25 : 3320–3324.
9. Martinez Jabaloyas, J. M., Morera Martinez, J., Pontones Moreno, J. L., et al. Lymphocele as a complication of renal transplantation. Actas Urol. Esp., 1994; 18 : 106–110.
10. Nghiem, D. D., Beckman, I. Intraperitoneal catheter drainage of lymphocele: an outpatient procedure. Transpl. Int., 2005; 18 : 721.
11. Reyes-Acevedo, R., Bezaury-Rivas, P., Alberu, J., et al. Post-transplant perirenal collections: clinical significance. Transplant. Proc., 1996; 28 : 3449–3450.
12. Risalti, A., Corno, V., Donini, A., et al. Laparoscopic treatment of symptomatic lymphoceles after kidney transplantation. Surg. Endosc., 2000; 14 : 293.
13. Seeling, M. H., Klingler, P. J., Oldenburg, W. A. Treatment of a postoperative cervical chylous lymphocele by percutaneous sclerosing with povidone-iodine. J. Vasc. Surg., 1999; 27 : 1148.
14. Schurawitzki, H., Karnel, F., Mostbeck, G., et al. Radilogic therapy of symptomatic lymphoceles following kidney transplantation. Rofo Fortschr. Geb. Rontgenstr. Neuen Bildgeb. Verfahr., 1999; 152 : 71–75.
15. Smith, G. P., Beitz, G., Eng, M. P., et al. Long-term outcome of cadaveric renal transplant after treatment of symptomatic lymphocele. J. Urol., 2006; 173 : 1069–1072.
16. Spigos, D., Capek, V. Utrasonically guided percutaneous aspiration of lymphoceles following renal transplantation: a diagnostic and therapeutic method. J. Clin. Ultrasound., 1976; 4 : 45–46.
17. Tasar, M., Gulec, B., Saglam, M., et al. Posttransplant symptomatic lymphocele treatment with percutaneous drainage and ethanol sclerosis: Long-term follow-up. J. Cloníc. Imaging, 2004; 29 : 109.
18. Teiche, P. E., Pauer, W., Schmid, N. Use of talcum in sclerotherapy of pelvic lymphoceles. Tech. Urol., 1999; 5 : 52–53.
19. Ulibarri, J. I., Sanz, Y., Fuentes, C., et al. Reduction of lymphorragia from ruptured thoracic duct by somatostatin. Lancet, 1990; 336 : 25.
20. van Sonnenberg, E., Wittich, G. R., Casola, G., et al. Lymphoceles: Imaging chracteristics and percutaneous management. Radiology, 1986; 161 : 593.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2008 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Když se ve střevech děje něco nepatřičného...
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
-
Všetky články tohto čísla
- Miniinvazivní chirurgie v České republice
- Závislost úbytku hmotnosti na velikosti neožaludku po laparoskopické bandáži žaludku
- Biliárny ileus – naďalej reálna komplikácia cholecystolitiázy
- První výsledky studie bipolární RFITT koagulace vyšších vyšších stadií hemoroidální nemoci
- Operační léčba zlomenin diafýzy humeru
- Použití biodegradabilních materiálů v léčbě kostních cyst u dětí
- Hybridní roboticky asistovaná operace, aortobifemorální bypass s rekonstrukcí kýly v jizvě
- Kontinentní nálevové stoma u dětí s dysfunkcí pánevních orgánů
- Terapie lymfokély po transplantaci ledviny
- Výsledky transperitoneální laparoskopické nefrektomie pro renální adenokarcinom
- Poranění růstové zóny proximální tibiální epifýzy v dětském věku a možnosti její léčby
- K životnímu jubileu docenta MUDr. Jana Bedrny, CSc., emeritního přednosty chirurgické kliniky v Hradci Králové
- Odpověď na komentář prof. Adamce, Rozhl. Chir., 2008, roč. 87, č. 7, s. 387 k článku „Cévní chirurgie nebo endovaskulární léčba“ autorů Čertík B., Třeška V., et al., Rozhl. Chir., 2006, roč. 85, č. 12, s. 609–612.
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Použití biodegradabilních materiálů v léčbě kostních cyst u dětí
- Biliárny ileus – naďalej reálna komplikácia cholecystolitiázy
- Operační léčba zlomenin diafýzy humeru
- Miniinvazivní chirurgie v České republice
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



