-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hepatocelulární karcinom z pohledu transplantologa
Hepatocellular carcinoma from the view of a transplant surgeon
Curative treatments for hepatocellular carcinoma (HCC) traditionally include liver transplantation, liver resection, and in some very early HCCs, local ablation. Of these methods, transplantation brings the best long-term prognosis. Therefore, it should be considered by all multidisciplinary teams. Transplant treatment of HCC has developed significantly in recent years as does the concept of transplant oncology and in some centers HCC has already been the most common indication for liver transplantation. The aim of this work is to review the role of liver transplantation in the treatment of patients with HCC, its indications, results and the current situation in IKEM, the biggest transplantation center in the Czech Republic.
Keywords:
hepatocellular carcinoma – liver transplantation – transplant oncology
Autori: MUDr. Kočík Matěj 1; MUDr. Taimr Pavel 2; doc. MUDr. Froněk Jiří, Ph.D. 1
Pôsobisko autorov: Klinika transplantační chirurgie, IKEM, Praha 1; Klinika hepatogastroenterologie, IKEM, Praha 2
Vyšlo v časopise: Klin Onkol 2020; 33(Supplementum 3): 13-19
Kategória: Přehled
doi: https://doi.org/10.14735/amko20203S13Súhrn
Transplantace jater (LTx) je zavedená léčebná metoda, která u hepatocelulárního karcinomu (HCC) poskytuje nejlepší dlouhodobé výsledky a měla by tak být zahrnuta do rozhodování všech multidisciplinárních týmů, které léčí HCC. V některých centrech je již HCC nejčastější indikací k LTx. Vždy když je vyloučena makroangioinvaze a extrahepatální šíření a pacient je vzhledem k celkovému stavu schopen transplantaci podstoupit, léčebné úsilí by mělo k transplantaci směřovat. V případě, že pacient primárně indikační kritéria překračuje, měl by být pomocí lokoregionální event. systémové léčby učiněn pokus o downstaging nebo stabilizaci onemocnění a následně znovu zvážena LTx. V případě, že jako primární léčebná metoda je zvolena resekce jater nebo ablace, měl by být pacient pečlivě dispenzárně sledován s vědomím, že rekurence HCC je potenciálně radikálně řešitelná LTx. Cílem této práce je shrnout současný pohled na transplantaci jater pro HCC, ukázat její indikace, výsledky, koncept transplantační onkologie a současnou situaci v IKEM.
Klíčová slova:
hepatocelulární karcinom – transplantace jater – transplantační onkologie
Úvod
Kurativní léčebné metody hepatocelulárního karcinomu (HCC) tradičně zahrnují transplantaci jater (LTx), resekci jater a u některých velmi časných HCC i lokální ablaci. Z těchto metod transplantace přináší nejlepší dlouhodobé výsledky. Měla by tak všemi multidisciplinárními týmy být zvažována. Transplantační léčba HCC se v posledních letech výrazně rozvíjí a vyvíjí, stejně jako koncept transplantační onkologie a v některých centrech je již HCC nejčastější indikací k LTx. Cílem této práce je ukázat úlohu transplantace jater v léčbě pacientů s HCC, její indikace, výsledky a současnou situaci v IKEM.
Transplantace jater
Transplantace jater je vyspělá léčebná metoda s velmi dobrými dlouhodobými výsledky [1]. Z onkologického hlediska je pro HCC ohraničený na játra ideální léčebnou metodou. Odstranění celých jater zaručuje maximální resekční okraj a zároveň eliminuje další možná drobná nepoznaná ložiska HCC. Vzhledem k tomu, že až 90 % HCC vzniká na podkladě chronického jaterního onemocnění a jaterní cirhózy, předchází LTx i vzniku de novo HCC v postiženém jaterním parenchymu. Zároveň toto chronické jaterní onemocnění léčí a proti resekci jater nezáleží na jeho pokročilosti. Proto 10leté přežívání bez rekurence je po resekci jater okolo 22–25 % [2,3] ve srovnání s 50–70 % po LTx [1,4].
Indikační kritéria k transplantaci jater
Přestože HCC byl jednou z prvních indikací k LTx, indikační kritéria, která znamenala dobré dlouhodobé výsledky, byla publikována až v roce 1996 jako tzv. Milánská kritéria (jedno ložisko do 5 cm; max. tři ložiska, žádné > 3 cm, bez makroangioinvaze) (tab. 1) [5]. Při jejich dodržení lze očekávat 4leté přežívání pacientů 75 %. Pokud bylo histologické vyšetření explantovaných jater v souladu se zobrazovacími vyšetřeními před transplantací a tento histologický nález též splňoval Milánská kritéria, bylo 4leté přežívání pacientů 85 %. Tato kritéria byla mnohokrát validována a jsou dosud celosvětově akceptována. Velký úspěch těchto kritérií a zároveň zjištění, že někteří pacienti, kteří Milánská kritéria překračují, mohou mít po transplantaci obdobné přežívání, vyvolaly velký zájem na rozšiřování těchto kritérií. Od té doby byla publikována řada dalších kritérií, která Milánská kritéria různým způsobem rozšiřují a přinášejí obdobné výsledky. Některá z nich jsou společně s 5letým přežíváním uvedena v tab. 1 [6–14]. Širšího používání doznala pouze kritéria UCSF (University of California, San Francisco; jedno ložisko ≤ 6,5 cm; max. tři ložiska, žádné > 4,5 cm; součet velikostí ložisek do 8 cm, bez makroangioinvaze). Ostatní kritéria se spíše uplatňují v jednotlivých centrech.
Tab. 1. Indikační kritéria hepatocelulárního karcinomu k transplantaci jater. 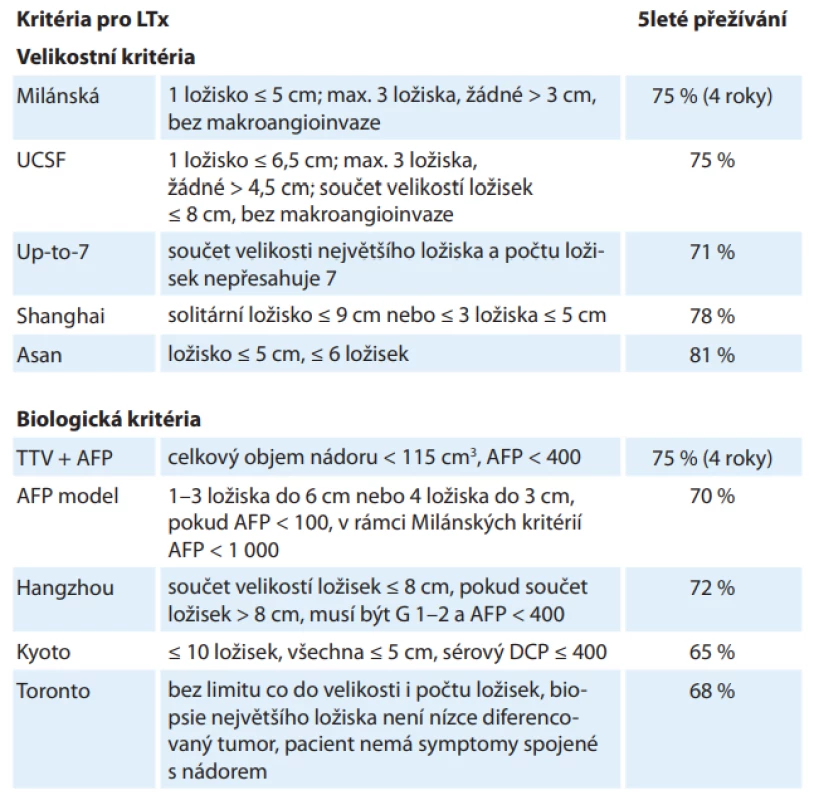
AFP – alfa-fetoprotein, DCP – des-gama-carboxy protrombin, G – grading, TTV – celkový objem nádoru, UCSF – University of California, San Francisco Velikostní kritéria jsou jednoduše dostupná ze zobrazovacích metod před transplantací. Výsledky LTx však ukazují, že prognóza pacientů závisí spíše na biologické povaze nádoru a posuzování pacientů pouze podle velikostních kritérií není optimální. Některá centra tak k velikostním kritériím přidávají i kritéria biologická (tab. 1) – hodnocení sérových biomarkerů, histologie nádoru či některých radiologických vyšetření.
Nejrelevantnější ze sérových biomarkerů je v současné době hladina alfa-fetoproteinu (AFP) jako markeru nádorové diferenciace a vaskulární invaze, který pomáhá identifikovat pacienty s vyšším rizikem rekurence HCC po LTx. Mezní hodnota pro LTx však není jednoznačně známa a publikované hodnoty jsou v rozmezí 100–1 000 ng/ml [15]. Des-gama-karboxy protrombin (DCP) v některých, zejména asijských pracích lépe predikoval rekurenci HCC po LTx a některá asijská centra DCP, příp. v kombinaci s AFP, do svých indikačních kritérií zařazují [15]. V současné době probíhá řada studií hodnotících různé sérové biomarkery, dosud však bez široce klinicky významných výsledků [16]. Zejména hodnocení genetických markerů, jako jsou cirkulující nádorové buňky, volná DNA, RNA či miRNA, se zdá mít významný potenciál [15,16].
Negativní vliv vysokého gradingu nádoru (nízce diferencovaný HCC) na prognózu po LTx byl prokázán v řadě prací [17,18]. Naopak při vyloučení nízce diferencovaných nádorů (Hangzhou, Torontská kritéria) mohou být úspěšně transplantováni pacienti s nádory i výrazně překračujícími standardní Milánská (event. UCSF) kritéria [12,14].
Dalším zástupným způsobem posouzení biologické povahy nádoru se zdá být odpověď na lokoregionální terapii (nejčastěji transarteriální chemoembolizaci – TACE) ve formě downstagingu či stabilizace onemocnění. Pacienti, kteří splní kritéria k LTx po úspěšném downstagingu, kdy bereme v úvahu pouze aktivní nádorová ložiska (tzn. ložiska sytící se kontrastní látkou na CT vyšetření), mohou podstoupit LTx s výsledky stejnými jako pacienti, kteří transplantační kritéria splňují primárně [19,20].
Použití FDG PET (fluorodeoxyglukóza, pozitronová emisní tomografie) pro diagnózu či sledování HCC je omezeno velmi variabilní akumulací FDG nádory. Nedávné studie ukazují, že pacienti s negativním PET vyšetřením a nádory mimo Milánská kritéria mají stejnou prognózu jako pacienti, kteří Milánská kritéria splňují [21]. PET byla shledána jako nezávislý prognostický faktor rekurence HCC po transplantaci [22]. U pacientů, kteří Milánská kritéria splňují, není PET vyšetření indikováno.
Vzhledem k výše uvedenému množství různých parametrů a indikačních kritérií je zřejmé, že univerzálně akceptovaná kritéria, která Milánská kritéria rozšiřují, k dispozici nejsou. Řada center tak použila velké databáze k vytvoření skórovacích systémů a prediktivních modelů, které pomáhají určit prognózu konkrétních pacientů po LTx, a tím pomáhají zlepšit výběr pacientů k transplantaci. Nejznámější z nich je projekt Metroticket (čím déle jedu metrem, tím více platím za lístek, principem odpovídá – čím více rozšířím kritéria pro LTx, tím větší cenu platím ve formě zhoršeného přežívání). Vznikl za podpory ELITA (European Liver and Intestine Transplant Association) a ILTS (International Liver Transplantation Society). Na základě zpětného hodnocení > 1 000 LTx přesahujících Milánská kritéria byl podle velikosti nádorů a AFP vytvořen kalkulátor potransplantačního přežívání. Kalkulátor je nyní k dispozici online [23] a použitelný i pro pacienty po předchozí lokoregionální terapii a downstagingu. K dispozici jsou však i další, např. Model of Recurrence after Liver Transplant – MORAL, RETREAT, HALTHCC [24–26].
Transplantace jater pro rekurenci HCC po resekci nebo ablaci
Resekce jater nebo (u velmi časných HCC) ablace mohou být potenciálně kurativní léčebné metody, které mohou nabídnout 5leté celkové přežívání až 50–70 %. Ať už jsou tyto metody jako primární zvoleny z důvodů medicínských nebo přání pacienta, vždy je třeba počítat s vysokým výskytem rekurence HCC, dle některých prací až 80–90 % [27]. Až u 61 % pacientů je rekurence v rámci Milánských kritérií a umožnuje následnou „salvage“ LTx. Cherqui publikoval u 27 pacientů po „salvage“ LTx 5leté celkové přežívání a přežívání bez rekurence 72, resp. 44 % od doby LTx. Od doby primární resekce bylo přežívání 87 % [28]. V jiné práci z kanadského Toronta bylo u 48 pacientů po „salvage“ LTx 5leté celkové přežívání 70 % a 5leté kumulativní riziko rekurence 32 % [27]. Metaanalýza 840 pacientů s rekurencí HCC po resekci jater ukázala lepší 5leté celkové přežívání po LTx než po kurativní lokoregionální léčbě. Při srovnání LTx a reresekce jater byl rozdíl nesignifikantní. Rozdíl v přežívání bez rekurence byl však po LTx lepší než po reresekci již od 3 let [29].
Downstaging, bridging a neoadjuvantní léčba HCC před transplantací
Jak bylo zmíněno výše, je již na poměrně velkém množství pacientů prokázáno, že pokud po absolvování lokoregionální léčby dojde k downstagingu HCC do požadovaných indikačních kritérií, jsou výsledky LTx stejné jako u pacientů, kteří tato kritéria splnili primárně [30]. Úloha lokoregionální léčby jako „bridging“ terapie během doby čekání na transplantaci u pacientů, kteří transplantační kritéria splňují, není jednoznačně prokázána. Dle některých názorů se zdá tento přístup ospravedlnitelný a je doporučen [31].
Sorafenib je hlavní součástí léčby pokročilých stadií HCC. Jeho účinnost v neoadjuvantní léčbě HCC před LTx však zatím prokázána nebyla a dle některých prací došlo ke zvýšení počtu chirurgických komplikací po LTx [32,33].
Uplatnění checkpoint inhibitorů v neoadjuvantní léčbě HCC před LTx je jistě otázka do budoucnosti. V současné době existuje pouze kazuistika s úspěšným dowstagingem HCC k LTx. V případě checkpoint inhibitorů je však vždy nutné brát v úvahu riziko následné těžké a obtížně léčitelné rejekce jaterního štěpu po transplantaci [34].
Rekurence hepatocelulárního karcinomu po transplantaci
Rekurence HCC po LTx se vyskytuje v 10–20 % a může být vyšší při rozšiřování indikačních kritérií k LTx [21]. Většina recidiv je extrahepatálně (plíce, kosti, mozek, lymfatické uzliny v dutině břišní). Postupně přibývá prací, které ukazují, že agresivní léčba (chirurgická resekce, lokoregionální léčba, systémová léčba) recidivy HCC zlepšuje přežívání pacientů [35]. Až u 31,4 % pacientů je možný pokus o kurativní řešení s 5letým přežíváním 31 %. Přežívání pacientů 5 let po resekci recidivy je signifikantně lepší než přežívání pacientů, u kterých resekce možná není. Retransplantace jater indikována není [36]. Z 96 pacientů na University of Pennsylvania měli medián přežívání signifikantně delší pacienti po resekci (33 měsíců) a ablaci (21 měsíců) než pacienti pouze se systémovou léčbou [37]. Práce z čínského Hangzhou ukázala šest pacientů, kteří byli léčeni resekcí jater a následně sorafenibem a lenvatinibem s úpravou imunosuprese na mTOR inhibitor s 2letým přežíváním 80 %. V jiné práci u pacientů pouze se systémovou léčbou sorafenib–lenvatinib byl medián přežití 19,5 měsíce [38]. Italská multicentrická studie uvádí u pacientů, kteří podstoupili resekci plicních metastáz, pravděpodobnost 5letého přežívání 43 % a medián přežívání 51 měsíců [39].
Podle publikovaného systematického review je medián přežívání po rekurenci HCC po LTx okolo 13 měsíců. Nejlepší výsledky přináší resekce jater (42 měsíců) a u recidiv mimo játra zlepšuje přežívání podávání sorafenibu (18 měsíců) spolu s úpravou imunosupresivní léčby (mTOR inhibitory) [40].
Imunoterapie, která u HCC přináší slibné výsledky, je dosud po LTx spojena s vysokým výskytem na léčbu rezistentní rejekce jaterního štěpu s možností jeho ztráty [41].
Údaje o pozitivních účincích sorafenibu jako adjuvantní léčby k prevenci rekurence HCC po LTx chybí. Na základě údajů, že sorafenib podávaný jako adjuvantní léčba po radikální resekci jater pro HCC neměl vliv na výskyt rekurence, není po LTx doporučován [42].
Transplantace jater pro hepatocelulární karcinom bez chronického jaterního onemocnění
HCC v terénu zdravých jater (bez přítomnosti chronického jaterního onemocnění) tvoří pouze 10–20 % všech HCC. Přesná indikační kritéria k LTx zde neexistují. Primární léčbou je jaterní resekce. K transplantaci mohou být indikováni pacienti s neresekabilním nádorem nebo rekurencí nádoru po resekci. Velikost či počet ložisek na potransplantační přežívání vliv nemají. Významným negativním prognostickým faktorem s výrazně horšími dlouhodobými výsledky je makroangioinvaze a postižení hilových lymfatických uzlin. Při absenci těchto faktorů lze dosáhnout 5letého přežívání u 58 % pacientů. U nemocných po LTx pro recidivu HCC po předchozí resekci je navíc prognosticky nepříznivý vznik rekurence do 1 roku po resekci. Pokud k rekurenci dojde v pozdějším období, je 5leté přežívání pacientů 83 % [43].
Transplantační onkologie
V počátcích LTx byly hepatobiliární malignity hlavní indikací k transplantaci. Pro špatné výsledky však od nich bylo záhy upuštěno. Postupné zlepšování chirurgických technik, perioperační péče a rozvoj imunosupresivní léčby vedly ke zlepšování výsledků LTx celkově. LTx jako léčebná metoda tak nyní přináší roční přežívání pacientů > 90 %. Vzhledem k tomu spolu se snahou o zvyšování počtu vhodných dárců jater, a tím počtu transplantací docházelo k rozšiřování indikací k LTx, mezi které byly opět zařazeny hepatobiliární malignity. Zejména HCC tak dnes tvoří > 20 % indikací k LTx. Zároveň se LTx stala metodou potenciálně kurativní a poskytující nejlepší dlouhodobé výsledky, a vedla tím ke změně řady onkologických léčebných postupů.
Vznikl tak koncept transplantační onkologie s cílem rozvoje řady oblastí do budoucna. Zejména:
- zahrnutí LTx do standardního rozhodování multidisciplinárních týmů léčících hepatobiliární malignity;
- rozšíření techniky resekcí jater o techniky používané při transplantaci (např. ex situ resekce jater při jejich hypotermní perfuzi konzervačním roztokem, použití venovenózního bypassu a následně autotransplantace jater);
- propojení nádorové a transplantační imunologie (např. imunosupresivní léčba protinádorovými léky, vztah imunoterapie nádorů a vzniku rejekce transplantovaných jater);
- výzkum mechanizmů vzniku jaterních onemocnění a karcinogeneze, genetické studie (např. explantovaná játra postižená chronickým jaterním onemocněním poskytují k výzkumu jak nádor samotný, tak řadu stadií prekancerózy).
Transplantace jater pro hepatocelulární karcinom v IKEM
V IKEM bylo do konce roku 2019 provedeno 1 882 LTx, z toho 346 pacientů mělo HCC. Z grafu 1 je jednoznačně patrný vzestup počtu transplantací pro HCC v posledních letech. HCC je v současné době v IKEM zároveň nejčastější indikací k LTx a každý rok přesahuje 20 % indikovaných pacientů (graf 2). Tab. 2 a grafy 3 a 4 ukazují dlouhodobé výsledky LTx v IKEM. Přežívání všech pacientů a pacientů s HCC 5 a 10 let po LTx je 84,1 a 75,2 %, resp. 74,9 a 54,8 %. Pro srovnání je v tab. 2 též uvedeno přežívání pacientů transplantovaných pro jiné malignity než HCC.
Graf 1. Vývoj počtu transplantací jater a transplantací jater pro hepatocelulární karcinom v IKEM. 
HCC – hepatocelulární karcinom, LTx – transplantace jater Graf 2. Indikace k transplantaci jater v IKEM za období 2016–2019. 
ALF – akutní jaterní selhání, HVB – virus hepatitidy B, HCC – hepatocelulární karcinom, HVC – virus hepatitidy C, NASH – nealkoholická steatohepatitída, PBC – primární biliární cholangitida, PSC – primární sklerotizující cholangitida Graf 3. Celkové přežívání pacientů po transplantaci jater v IKEM za období 1994–2019. 
Graf 4. Celkové přežívání pacientů s hepatocelulárním karcinomem po transplantaci jater v IKEM za období 1994–2019. 
Tab. 2. Celkové přežívání pacientů po transplantaci jater v IKEM za období 1994–2019. 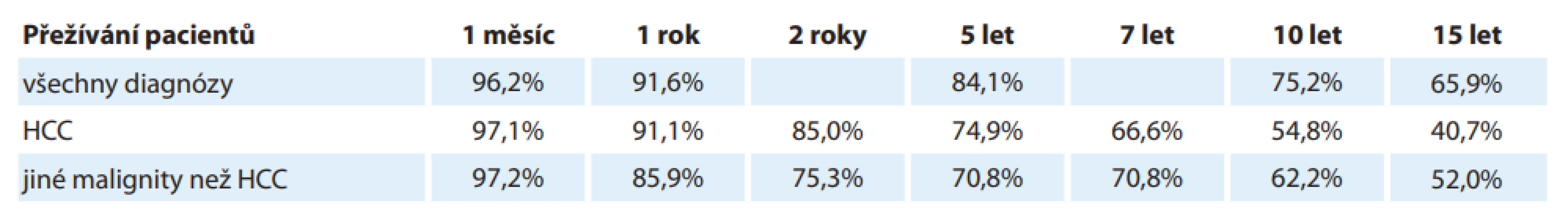
HCC – hepatocelulární karcinom Podle dosud platných kritérií v IKEM jsou pacienti s chronickým jaterním onemocněním a HCC splňující Milánská kritéria přímo zařazováni na čekací listinu k LTx. U nádorů > 3 cm je zároveň provedena TACE jako prevence progrese během doby čekání. U nádorů mírně přesahujících Milánská kritéria, ale stále splňujících kritéria UCSF je postupováno obdobně, s výjimkou nádorů s vysokým gradingem (G3). Pacienti s nádory překračujícími tato kritéria mohou být k transplantaci indikováni s odstupem v případě předpokladu příznivého biologického chování nádoru. Nejprve je provedena TACE. V případě downstagingu či alespoň stabilizace onemocnění na kontrolních zobrazovacích vyšetřeních po 3 měsících (event. 6 měsících dle nálezu) a nízkého AFP mohou být zařazeni na čekací listinu. Vždy musí být vyloučena makroangioinvaze a extrahepatální postižení nádorem.
V současné době probíhá v IKEM podrobný audit výsledků LTx pro HCC. Definitivní závěry nejsou dosud k dispozici. Dle předběžných výsledků se ukazuje, že indikační kritéria k LTx pro HCC v IKEM mohou být dále rozšířena bez výrazného negativního vlivu na výsledky LTx pro HCC či na ostatní pacienty čekající na LTx s jinými diagnózami. U nádorů přesahujících Milánská kritéria je hlavním parametrem určujícím horší prognózu vysoký grading (nízce diferencovaný HCC, G3). U nádorů s nízkým gradingem (dobře či středně diferencovaný HCC, G1 a G2) neovlivňuje velikost či počet ložisek negativně prognózu. Úspěšně tak mohou být transplantováni i pacienti s nádory, které co do velikosti či počtu ložisek Milánská kritéria výrazně přesahují.
Pacienti s nádorem ve zdravých játrech (tzn. bez chronického jaterního onemocnění) jsou k LTx indikováni v případě neresekabilních nádorů bez makroangioinvaze, bez omezení velikosti nádoru či počtu ložisek a po vyloučení extrahepatálního postižení.
Závěr
Transplantace jater je zavedená léčebná metoda, která u HCC poskytuje nejlepší dlouhodobé výsledky, jež jsou v současné době prokázány již v mnoha pracích. Zároveň by transplantace měla být zahrnuta do rozhodování všech multidisciplinárních týmů, které léčí HCC, a transplantační chirurg by měl být těchto týmů součástí. Vždy, když je vyloučena makroangioinvaze a extrahepatální šíření a pacient je vzhledem k celkovému stavu schopen transplantaci podstoupit, by mělo léčebné úsilí k transplantaci směřovat. V případě, že pacient primárně indikační kritéria překračuje, by měl být pomocí lokoregionální, event. systémové léčby učiněn pokus o downstaging nebo stabilizaci onemocnění a následně znovu zvážena LTx. V případě, že bude jako primární léčebná metoda zvolena resekce jater nebo ablace, by měl být pacient pečlivě dispenzárně sledován s vědomím, že rekurence HCC je potenciálně radikálně řešitelná LTx.
Přestože se indikační kritéria k LTx v současné době spíše rozšiřují, bude nadále nutné jejich zpřesňování a identifikování pacientů s horší prognózou po LTx. Zejména se jedná o nalezení zástupných markerů hodnotících biologickou povahu nádoru, která prognózu podmiňuje (např. hodnocení genetických markerů, jako jsou cirkulující nádorové buňky, volná DNA, RNA či miRNA nebo některých radiologických metod).
Pravidelné sledování by mělo platit i pro pacienty po LTx k umožnění radikální léčby, event. rekurence.
Dalším úkolem do budoucna bude i nalezení správné úlohy systémové terapie (nové léky, precizní léčba) a jejího možného uplatnění jako léčby neoadjuvantní či adjuvantní po LTx a jako léčby rekurence HCC po transplantaci.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Matěj Kočík IKEM
Vídeňská 1958/9
140 21 Praha 4
e-mail: matej.kocik@ikem.cz
Obdrženo/Submitted: 1. 7. 2020
Zdroje
1. Adam R, Karam V, Cailliez V et al. 2018 Annual Report of the European Liver Transplant Registry (ELTR) – 50-year evolution of liver transplantation. Transpl Int 2018; 31 (12): 1293–1317. doi: 10.1111/tri.13358.
2. Eguchi S, Kanematsu T, Arii S et al. Recurrence – free survival more than 10 years after liver resection for hepatocellular carcinoma. Br J Surg 2011; 98 (4): 552–557. doi: 10.1002/bjs.7393.
3. Giuliante F, Ardito F, Pinna AD et al. Liver resection for hepatocellular carcinoma ≤ 3cm: results of an Italian multicenter study on 588 patients. J Am Coll Surg 2012; 215 (2): 244–254. doi: 10.1016/j.jamcollsurg.2012.04.013.
4. Pinna AD, Yang T, Mazzaferro V et al. Liver transplantation and hepatic resection can achieve cure for hepatocellular carcinoma. Ann Surg 2018; 268 (5): 868–875. doi: 10.1097/SLA.0000000000002889.
5. Mazzaferro V, Regalia E, Doci R et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334 (11): 693–699. doi: 10.1056/NEJM199603143341104.
6. Yao FY, Ferrell L, Bass NM et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology 2001; 33 (6): 1394–1403. doi: 10.1053/jhep.2001.24563.
7. Mazzaferro V, Llovet JM, Miceli R et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: a retrospective, exploratory analysis. Lancet Oncol 2009; 10 (1): 35–43. doi: 10.1016/S1470-2045 (08) 70284-5.
8. Fan J, Yang GS, Fu ZR et al. Liver transplantation outcomes in 1078 hepatocellular carcinoma patients: a multi-center experience in Shanghai. J Cancer Res Clin Oncol 2009; 135 (10): 1403–1412. doi: 10.1007/s00432-009-0584-6.
9. Lee SG, Hwang S, Moon DB et al. Expanded indication criteria of living donor liver transplantation for hepatocellular carcinoma at one large-volume center. Liver Transpl 2008; 14 (7): 935–945. doi: 10.1002/lt.21445.
10. Toso C, Meeberg G, Hernandez-Alejandro R et al. Total tumor volume and alpha-fetoprotein for selection of transplant candidates with hepatocellular carcinoma: A prospective validation. Hepatology 2015; 62 (1): 158–165. doi: 10.1002/hep.27787.
11. Duvoux C, Roudot-Thoraval F, Decaens T et al. Liver transplantation for hepatocellular carcinoma: a model including a-fetoprotein improves the performance of Milan criteria. Gastroenterology 2012; 143 (4): 986–994. doi: 10.1053/j.gastro.2012.05.052.
12. Zheng SS, Xu X, Wu J et al. Liver transplantation for hepatocellular carcinoma: Hangzhou experiences. Transplantation 2008; 85 (12): 1726–1732. doi: 10.1097/TP. 0b013e31816b67e4.
13. Kaido T, Ogawa K, Mori A et al. Usefulness of Kyoto criteria as expanded selection criteria for liver transplantation for hepatocellular carcinoma. Surgery 2013; 154 (5): 1053–1060. doi: 10.1016/j.surg.2013.04.056.
14. Sapisochin G, Goldaracena N, Laurence JM et al. The extended Toronto criteria for liver transplantation in patients with hepatocellular carcinoma: A prospective validation study. Hepatology 2016; 64 (6): 2077–2088. doi: 10.1002/hep.28643.
15. Citores M, Lucena J, Fuente S et al. Serum biomarkers and risk of hepatocellular carcinoma recurrence after liver transplantation. World J Hepatol 2019; 11 (1): 50–64. doi: 10.4254/wjh.v11.i1.50.
16. Abreu P, Gorgen A, Oldani G. Recent advances in liver transplantation for cancer: The future of transplant oncology. JHEP Reports 2019; 1 (5): 377–391. doi: 10.1016/j.jhepr.2019.07.004.
17. Decaens T, Roudot-Thoraval F, Badran H et al. Impact of tumour differentiation to select patients before liver transplantation for hepatocellular carcinoma. Liver Int 2011; 31 (6): 792–801. doi: 10.1111/j.1478-3231.2010.02425.x.
18. Cillo U, Vitale A, Bassanello M et al. Liver transplantation for the treatment of moderately or well differentiated hepatocellular carcinoma. Ann Surg 2004; 239 (2): 150–159. doi: 10.1097/01.sla.0000109146.72827.76.
19. Ravaioli M, Grazi GL, Piscaglia F et al. Liver transplantation for hepatocellular carcinoma: results of down-staging in patients initially outside the Milan selection criteria. Am J Transplant 2008; 8 (12): 254–757. doi: 10.1111/j.1600-6143.2008.02409.x.
20. Yao FY, Kerlan Jr RK, Hirose R et al. Excellent outcome following down-staging of hepatocellular carcinoma prior to liver transplantation: an intention-to-treat analysis. Hepatology 2008; 48 (3): 819–827. doi: 10.1002/hep.22412.
21. Vibert E, Schwartz M, Olthoff K. Advances in resection and transplantation for hepatocellular carcinoma. J Hepatol 2020; 72 (2): 262–276. doi: 10.1016/j.jhep.2019.11.017.
22. Lee SM, Kim HS, Lee S. Emerging role of 18F-fluorodeoxyglucose positron emission tomography for guiding management of hepatocellular carcinoma. World J Gastroenterol 2019; 25 (11): 1289–1306. doi: 10.3748/wjg.v25.i11.1289.
23. http: //www.hcc-olt-metroticket.org
24. Halazun KJ, Najjar M, Abdelmessih RM et al. Recurrence after liver transplantation for hepatocellular carcinoma. Ann Surg 2017; 265 (3): 557–564. doi: 10.1097/SLA.0000000000001966.
25. Mehta N, Heimbach J, Harnois D et al. Validation of a risk estimation of tumor recurrence after transplant (RETREAT) score for hepatocellular carcinoma recurrence after liver transplant. AMA Oncol 2017; 3 (4): 493–500. doi: 10.1001/jamaoncol.2016.5116.
26. Firl D, Sasaki K, Agopian V et al. Charting the path forward for risk prediction in liver transplant for hepatocellular carcinoma: International validation of HALTHCC among 4,089 Patients. Hepatology 2020; 71 (2): 569–582. doi: 10.1002/hep.30838.
27. Muaddi H, Al-Adra D, Beecroft R et al. Liver transplantation is equally effective as a salvage therapy for patients with hepatocellular carcinoma recurrence following radiofrequency ablation or liver resection with curative intent. Ann Surg Oncol 2018; 25 (4): 991–999. doi: 10.1245/s10434-017-6329-x.
28. Cherqui D, Laurent A, Mocellin N et al. Liver resection for transplantable hepatocellular carcinoma: long-term survival and role of secondary liver transplantation. Ann Surg 2009; 250 (5): 738–746. doi: 10.1097/SLA.0b 013e3181bd582b.
29. Wang HL, Mo DC, Zhong J-H et al. Systematic review of treatment strategy for recurrent hepatocellular carcinoma: Salvage liver transplantation or curative locoregional therapy. Medicine 2019; 98 (8): e14498. doi: 10.1097/MD.0000000000014498.
30. Mazzaferro V, Citterio D, Bhoor S et al. Liver transplantation in hepatocellular carcinoma after tumour downstaging (XXL): a randomised, controlled, phase 2b/3 trial. Lancet Oncol 2020; 21 (7): 947–956. doi: 10.1016/S1470-2045 (20) 30224-2.
31. Mehta N, Bhangui P, Yao F et al. Liver transplantation for hepatocellular carcinoma. Working Group Report from the ILTS Transplant Oncology Consensus Conference. Transplantation 2020; 104 (6): 1136–1142. doi: 10.1097/TP.0000000000003174.
32. Eilard M, Andersson M, Naredi P et al. A prospective clinical trial on sorafenib treatment of hepatocellular carcinoma before liver transplantation. BMC Cancer 2019; 19 (1): 568. doi: 10.1186/s12885-019-5760-8.
33. Kardashian A, Agopian V. Reply to: Role of sorafenib in liver transplantation outcomes of patients with hepatocellular carcinoma presenting beyond Milan criteria? Hepatology 2020; [in press]. doi: 10.1002/hep.31283.
34. Schwacha-Eipper B, Minciuna I, Banz V et al. Immunotherapy as a downstaging therapy for liver transplantation. Hepatology 2020; [in press]. doi: 10.1002/hep.31234.
35. Lee D, Sapisochin G, Mehta N et al. Surveillance for HCC after Liver Transplantation: Increased monitoring may yield aggressive treatment options and improved postrecurrence survival. Transplantation 2020; 104 (10): 2105–2112. doi: 10.1097/TP.0000000000003117.
36. Sapisochin G. et al. Benefit of treating hepatocellular carcinoma recurrence after liver transplantation and analysis of prognostic factors for survival in a large Euro-American series. Ann Surg Oncol 2015; 22 (7): 2286–2294. doi: 10.1245/s10434-014-4273-6.
37. Ekpanyapong S, Philips N, Loza B et al. Predictors, presentation, and treatment outcomes of recurrent hepatocellular carcinoma after liver transplantation: A large single center experience. J Clin Exp Hepatol 2020; 10 (4): 304–315. doi: 10.1016/j.jceh.2019.11.003.
38. Yang Z, Wang S, Tian XY et al. Impact of treatment modalities on patients with recurrent hepatocellular carcinoma after liver transplantation: preliminary experience. Hepatobiliary Pancreat Dis Int; 19 (4): 365–370. doi: 10.1016/ j.hbpd.2020.06.002.
39. Invenizzi F, Iavarone M, Donato MF et al. Pulmonary resection for metastasis of hepatocellular carcinoma recurring after liver transplant: An Italian multicenter experience. Front Oncol 2020; 10 : 38. doi: 10.3389/fonc.2020.00381.
40. de’Angelis N, Landi F, Carra MC et al. Managements of recurrent hepatocellular carcinoma after liver transplantation: A systematic review. World J Gastroenterol 2015; 21 (39): 11185–11198. doi: 10.3748/wjg.v21.i39.11185.
41. Hu B, Yang XB, Sang XT. Liver graft rejection following immune checkpoint inhibitors treatment: a review. Medical Oncology 2019; 36 (11): 94. doi: 10.1007/s12032-019-1316-7.
42. Berenguer M, Burra P, Ghobrial M et al. Posttransplant management of recipients undergoing liver transplantation for hepatocellular carcinoma. Working Group Report from the ILTS Transplant Oncology Consensus Conference. Transplantation 2020; 104 (6): 1143–1149. doi: 10.1097/TP.0000000000003196.
43. Mergental H, Adam R, Ericzon BG et al. Liver transplantation for unresectable hepatocellular carcinoma in normal livers. J Hepatol 2012; 57 (2): 297–305. doi: 10.1016/j.jhep.2012.03.022.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2020 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Nejasný stín na plicích – kazuistika
-
Všetky články tohto čísla
- Editorial
- Hepatocelulární karcinom – zobrazovací metody a intervence pod kontrolou zobrazovacích metod
- Hepatocelulární karcinom z pohledu transplantologa
- Současné možnosti léčby hepatocelulárního karcinomu
- Budoucí možnosti léčby hepatocelulárního karcinomu
- Chirurgická léčba hepatocelulárního karcinomu
- Hepatocelulární karcinom z pohledu gastroenterologa/hepatologa
- Shrnutí
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Budoucí možnosti léčby hepatocelulárního karcinomu
- Současné možnosti léčby hepatocelulárního karcinomu
- Hepatocelulární karcinom – zobrazovací metody a intervence pod kontrolou zobrazovacích metod
- Hepatocelulární karcinom z pohledu gastroenterologa/hepatologa
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



