-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cytokinové profily mnohočetného myelomu a Waldenströmovy makroglobulinemie
Cytokine Profiles of Multiple Myeloma and Waldenström Macroglobulinemia
Multiple myeloma (MM) and Waldenström macroglobulinemia (WM) are malignant disorders of B lymphocytes. These diseases are characterized by monoclonal immunoglobulin production and bone marrow infiltration, which further lead to disease manifestation mainly via osteolytic lesions and disruption of hematopoiesis. The bone marrow microenvironment plays a crucial role in pathogenesis of both of these diseases, as it is well known that interaction between malignant cells and bone marrow cells facilitates both survival and growth of these tumor cells. The interactions are mediated by several different factors, including cytokines. Their production leads to tumor cell growth, proliferation and survival contributing to pathogenesis of MM and WM. In this review, we focus on function of the most important cytokines in both these diseases.
Key words:
multiple myeloma − Waldenström macroglobulinemia – cytokines − bone marrow microenvironment
This study was supported by scientific programs of the Ministry of Education, Youth and Sports MSM0021622434, by grant of Integral Grant Agency of the Czech ministry of Health NT14575 and NT12130 and by internal grant MUNI/11//InGA17/2012. Further it was supported by project of the Ministry of Health for conceptual development of research organization 65269705 (UH Brno).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
5. 9. 2013Accepted:
7. 11. 2013
Autoři: L. Sedlaříková 1,2; K. Sadílková 1; L. Kubiczková 1,2; R. Hájek 1,2; S. Ševčíková 1,2
Působiště autorů: Babákova myelomová skupina, Ústav patologické fyziologie, LF MU, Brno 1; Oddělení klinické hematologie, FN Brno 2
Vyšlo v časopise: Klin Onkol 2014; 27(1): 18-23
Kategorie: Přehled
Souhrn
Mnohočetný myelom (MM) a Waldenströmova makroglobulinemie (WM) jsou nádorová onemocnění B lymfocytů, pro která je charakteristická nadprodukce monoklonálního imunoglobulinu a infiltrace kostní dřeně (KD) maligními buňkami. Tyto patologické jevy vedou posléze k typickým klinickým příznakům onemocnění, především ke vzniku osteolytických lézí a poruchám krvetvorby. U obou těchto onemocnění hraje velmi významnou roli mikroprostředí KD, jelikož interakce nádorových buněk s buňkami KD usnadňuje růst a přežívání těchto maligních buněk. Tyto interakce jsou zprostředkovány mimo jiné také cytokiny. Jejich produkce umožňuje růst, proliferaci a přežívání nádorových buněk, a tak významně přispívají k patogenezi MM i WM. V předkládaném přehledovém článku jsme se zaměřili na funkci nejdůležitějších cytokinů u obou onemocnění.
Klíčová slova:
mnohočetný myelom − Waldenströmova makroglobulinemie – cytokiny − mikroprostředí kostní dřeněÚvod
Mnohočetný myelom (multiple myeloma − MM) je hematoonkologické onemocnění charakterizované proliferací monoklonálních plazmatických buněk v kostní dřeni (KD), produkcí monoklonálního imunoglobulinu (IgM) a vývojem z asymptomatického stadia monoklonální gamapatie nejasného významu (monoclonal gammopathy of undetermined significance − MGUS). MM se vyskytuje především u starších osob, medián věku při stanovení diagnózy je 65 let. Pouze 2 % pacientů jsou mladší 40 let. Onemocnění je doprovázeno celou řadou příznaků, např. osteolytickými lézemi kostí, imunodeficiencí nebo selháním ledvin [1].
Waldenströmova makroglobulinemie (WM) je B buněčné lymfoproliferativní onemocnění charakterizované infiltrací KD populací malých B lymfocytů, které se mohou transformovat do plazmatických buněk. Pro tyto buňky je rovněž charakteristická produkce IgM. Původ WM je neznámý, nicméně podobně jako u MM je prekurzorovým stavem MGUS. Onemocnění postihuje především starší lidi ve věku kolem 63−68 let. Mezi nejtypičtější klinické příznaky patří hyperviskozita krevní plazmy, dále anémie a cytopenie, únava, bolest hlavy, rozmazané vidění a neuropatie. Velmi neobvyklé jsou u WM osteolytické léze, na rozdíl od MM, kde se vyskytují v hojné míře [2].
Mikroprostředí KD spolu s cytokiny produkovanými buňkami KD hrají klíčovou roli v patofyziologii jak MM, tak i WM. KD je primární lymfoidní tkání a hlavní orgán krvetvorby. Nachází se v centrální dutině axiálních a dlouhých kostí a je složena z ostrůvků krvetvorné tkáně a tukových buněk obklopených cévami. Skládá se ze tří složek − buněčné složky, extracelulární matrix a rozpustné složky. Součástí rozpustné složky jsou cytokiny, růstové faktory, adhezivní molekuly a další faktory, které jsou vylučovány hematopoetickými i nehematopoetickými buňkami v KD [3]. Buňky KD nejsou vzájemně těsně spojeny a jejich komunikace je zprostředkována právě pomocí výše zmíněných molekul.
Cytokiny jsou různorodou skupinou rozpustných glykoproteinů a nízkomolekulárních peptidů. Zprostředkovávají interakce mezi buňkami a jsou zodpovědné za regulaci buněčných a tkáňových funkcí. Důležitou roli hrají při koordinaci embryonálního vývoje, růstu a zrání buněk, hojení ran, imunitní odpovědi a také při formaci nových krevních cév [4]. Interakce cytokinů může být buď intrakrinní, autokrinní, nebo parakrinní. Parakrinní interakce ovlivňuje jiné buňky než ty, které produkují cytokin. U autokrinní interakce působí cytokin na tutéž buňku. V případě intrakrinní interakce zůstává cytokin i receptor uvnitř v buňce, ovšem tento případ je vzácný.
Cytokiny mohou být produkovány téměř všemi typy buněk a ve všech typech tkání, a to prostřednictvím sekrečních drah. Mnoho z nich je vylučováno buď v aktivní formě, nebo jako neaktivní prekurzory, které aktivaci teprve vyžadují. Produkce a vylučování cytokinů je velmi přísně regulováno.
Kromě svých základních funkcí jsou zapojeny také do růstu a šíření nádorových buněk, které produkují cytokiny konstitutivně. Cytokiny tak mohou působit buď apokrinně přímo na nádorové buňky, nebo působí na podpůrné tkáně, čímž pozitivně ovlivňují šíření maligních buněk [5].
V další části článku se zaměříme na nejdůležitější cytokiny u obou onemocnění.
Interleukin‑6
Interleukin‑6 (IL‑6) je multifunkční cytokin, který je popsán jako jeden z nejvíce deregulovaných cytokinů u různých typů nádorů. Je produkován různými typy buněk včetně nádorových, jelikož přispívá k nádorovému růstu tím, že dokáže inhibovat apoptózu maligních buněk a indukovat angiogenezi [6].
IL‑6 je hlavním růstovým faktorem pro buňky MM, umožňuje jejich přežívání a navozuje rezistenci buněk k léčbě [7]. Nádorové buňky ovlivňuje buď přes parakrinní, nebo autokrinní regulační mechanizmy (obr. 1). Podle exprese IL‑6 se zdá, že se u WM jedná spíše o autokrinní produkci IL‑6, zatímco u MM jde o produkci parakrinní, kdy je IL‑6 produkován především stromálními buňkami KD [8]. Produkce IL‑6 stromálními buňkami KD je spuštěna v závislosti na adhezi myelomových buněk ke stromálním buňkám KD.Rovněž může být spuštěna v závislosti na produkci dalších faktorů mikroprostředí KD, např. VEGF [9,10].
Obr. 1. Autokrinní a parakrinní sekrece IL- 6. Autokrinní sekrece IL-6 nádorovými buňkami i parakrinní sekrece IL-6 stromálními buňkami kostní dřeně pozitivně ovlivňují další transkripci a sekreci IL-6, a také proliferaci nádorových buněk. 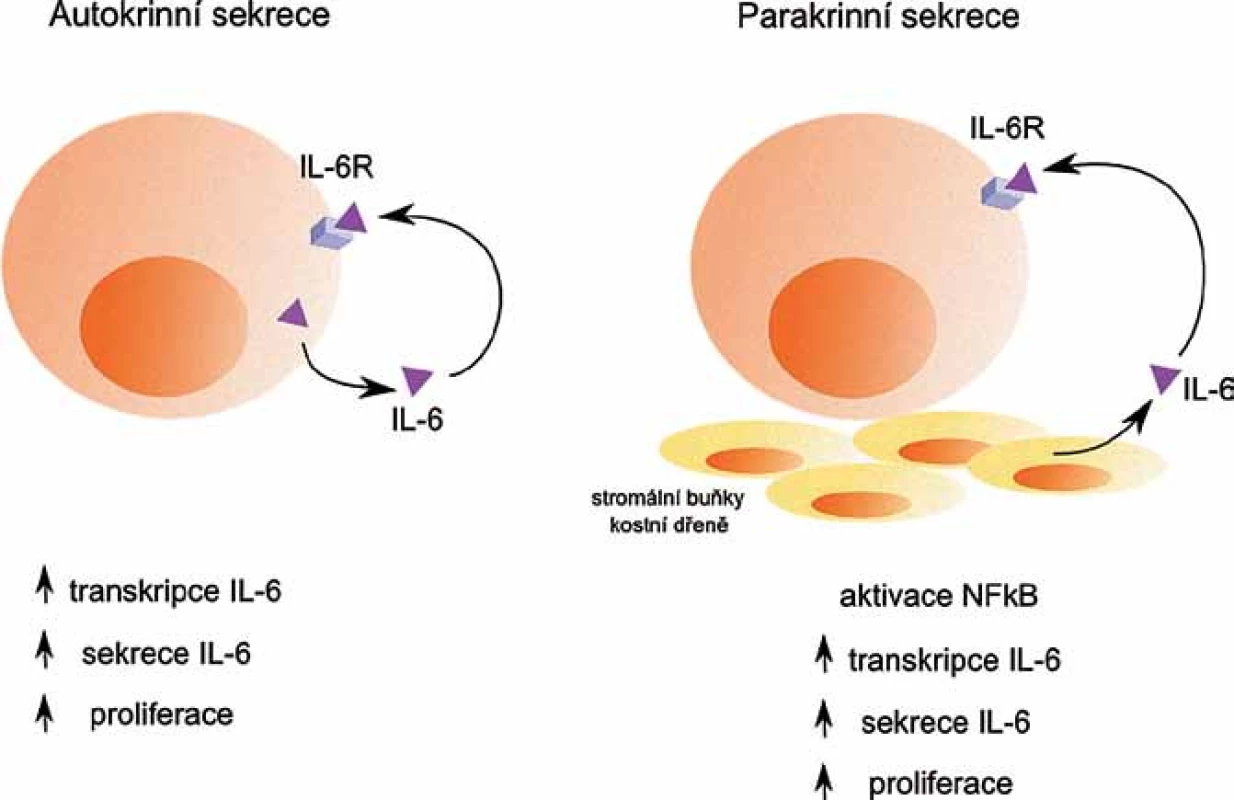
IL‑6 působí odlišně při různých koncentracích. Vysoké koncentrace IL‑6 zajišťují přežití myelomových buněk pomocí regulace anti‑apoptotických proteinů, zatímco nízké koncentrace IL‑6 myelomové buňce stačí pro postup buněčným cyklem [11].
Hladina IL‑6 v séru tedy koreluje jak u pacientů s MM, tak i u WM s progresí onemocnění. U zdravých jedinců je hladina nízká, nebo dokonce nedetekovatelná, kdežto u nemocných s MM i WM se IL‑6 nachází ve vysokém množství [12,13].
IL‑6 se u MM podílí na kostní degradaci a podporuje sekreci IgG [14]. Jeho důležitou rolí u WM je podpora růstu plazmocytoidních lymfocytů a je zodpovědný za produkci IgM [13,15].
RANKL
RANKL je součástí cytokinového systému důležitého pro činnost osteoklastů. Ten se skládá z receptorového aktivátoru NF ‑ κB ligandu (RANKL), jeho receptoru RANK a rozpustného receptoru osteoprotegerinu (OPG). RANKL se společně se svými receptory RANK a OPG podílí na kostní formaci (obr. 2). Jeho hlavní úlohou je stimulace diferenciace osteoklastů z prekurzorových buněk, stimulace kostní resorpce zralými osteoklasty a inhibice jejich apoptózy. OPG blokuje RANKL a funguje jako inhibitor formace osteoklastů [16].
Obr. 2. Aktivace osteoklastů pomocí RANKL. Po spojení RANKL s RANK na prekurzoru osteoklastu dojde k diferenciaci a vzniku osteoklastu, který je zodpovědný za resorpci kosti. Navázání OPG na RANKL zabrání aktivaci osteoklastu a k resorpci tak nedochází. 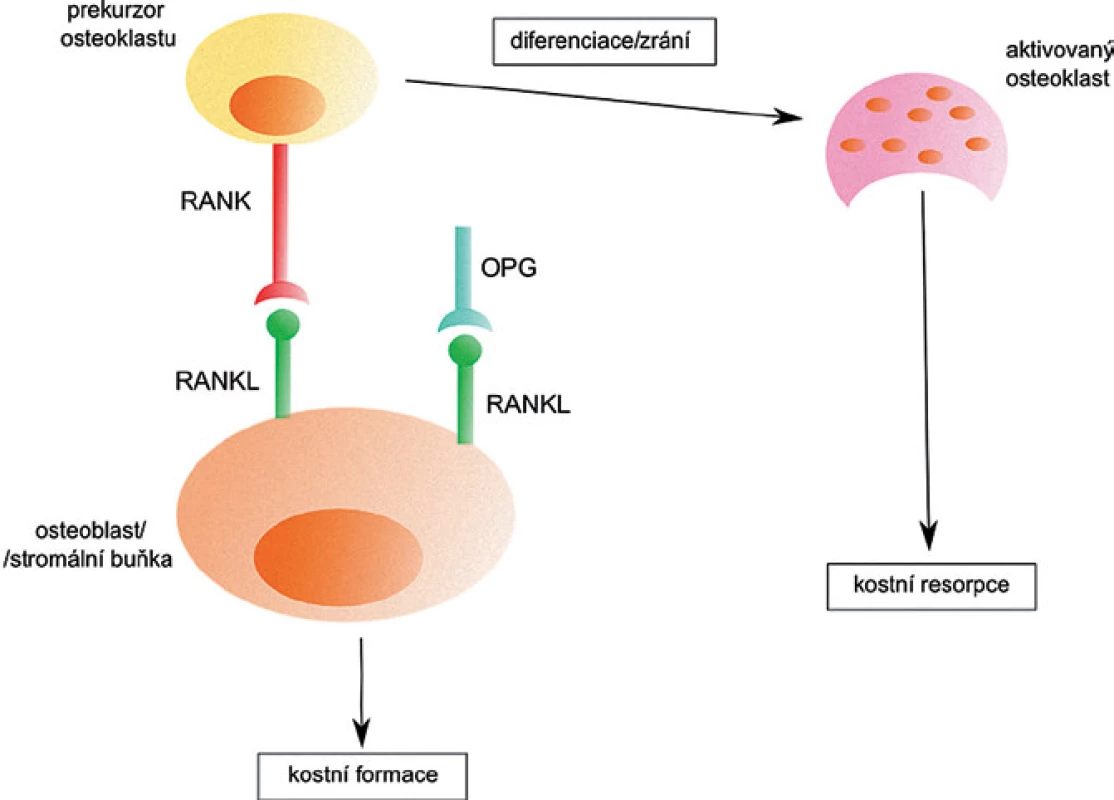
Buňky MM indukují nerovnováhu meziRANKL a OPG a to tak, že zvyšují expresi RANKL a naopak snižují hladinu OPG v kostním mikroprostředí a tím indukují zvýšení aktivity osteoklastů a zvyšují kostní resorpci [17]. Existuje korelace mezi hladinou těchto molekul a klinickou manifestací MM, stejně tak jako se závažností kostního postižení u MM [18].
Také u pacientů s WM se nachází zvýšené hodnoty rozpustného RANKL, které se s rostoucí fází onemocnění nemění. Nicméně takto zvýšená aktivita osteoklastů nevede k vývoji kostních lézí. Bylo totiž zjištěno, že i hladina OPG a markerů novotvorby kostí je vyšší. To je v souladu s teorií, že nadměrná resorpce kostí je u WM přítomna ve stejném rozsahu jako u MM, ale novotvorba kostí se zdá být normální a vyrovnává abnormální remodelaci kostí [19,20].
MIP‑1α
Makrofágový zánětlivý protein‑1α (MIP‑1α) je členem rodiny CC chemokinů a je znám také pod názvem CCL3 [21]. Podílí se především na zánětlivém procesu, neboť vykazuje řadu protizánětlivých aktivit. Může hrát roli u chronických zánětlivých onemocnění [22]. Účastní se krvetvorby, kde působí jako inhibitor proliferace krvetvorných kmenových buněk a je spojován s poškozením kostí, protože je silným aktivátorem osteoklastů [23].
U MM je MIP‑1α produkován myelomovými buňkami. Doposud provedené studie zjistily, že u pacientů s MM je hladina MIP‑1α vyšší než u zdravých jedinců, a to především u jedinců s aktivním onemocněním a rozsáhlejším poškozením kostí. Množství MIP‑1α tedy koreluje s aktivitou onemocnění [24]. Myelomové buňky adherují ke stromálním buňkám a osteoblastům v KD přes receptor ze skupiny integrinů (VLA4), který na kostních buňkách váže příbuzný ligand, vaskulární adhezivní molekulu 1 (VCAM‑1). Tato interakce musí být aktivována pomocí MIP‑1α. Dráha aktivovaná interakcí VCAM‑1 - VLA4 přispívá k růstu a přežití buněk MM a je zodpovědná za tvorbu osteoklastů a kostní resorpci [25]. Ve studii Valleta et al (2011) objevili, že MIP‑1α je rovněž zodpovědný za inhibici funkce osteoklastů, čímž rovněž přispívá k rozvoji osteolýzy [26].
MIP‑1α má však i přímý vliv na myelomové buňky. Ve studii Lentzsche et al (2003) bylo zjištěno, že MIP‑1α hraje roli v přežívání myelomových buněk, jejich růstu a migraci a významně se tak podílí na patofyziologii tohoto onemocnění [27].
MIP‑1α je produkován i buňkami WM. Jeho funkce u tohoto onemocnění není zatím dostatečně známa, ovšem některé studie poukazují na korelaci mezi zvýšenou hladinou MIP‑1α a kostní resorpcí. Omezení tvorby kostních lézí, které nejsou u WM přítomné, je připisováno poměru RANKL/ OPG [20].
VEGF
Vaskulární endoteliální růstový faktor (vascular endothelial growth factor − VEGF) je glykoprotein vázající heparin. Kromě toho, že je nezbytným regulátorem fyziologického růstu endoteliálních buněk, je také zásadním faktorem krvetvorby. Je spojován s indukcí angiogeneze a je důležitým regulátorem vaskulogeneze. Kromě toho může také indukovat vazodilataci cév, cévní propustnost a migraci buněk [28].
VEGF může být sekretován různými buňkami včetně myelomových a jeho sekrece je stimulována jinými cytokiny a produkty některých aktivovaných onkogenů [29]. Jeho činnost je zprostředkována především prostřednictvím jeho receptorů (obr. 3). Jedním z nich je VEGFR ‑ 1, označovaný také jako FLT ‑ 1, druhým je VEGFR ‑ 2, který je známý také pod názvem KDR, příp. Flk ‑ 1, a méně často je přítomen také receptor VEGFR ‑ 3, označovaný jako FLT ‑ 4 [30].
Obr. 3. VEGF a jeho receptory. Po navázání VEGF na své receptory dojde ke spuštění transdukčních kaskád, které vedou k indukci angiogeneze. 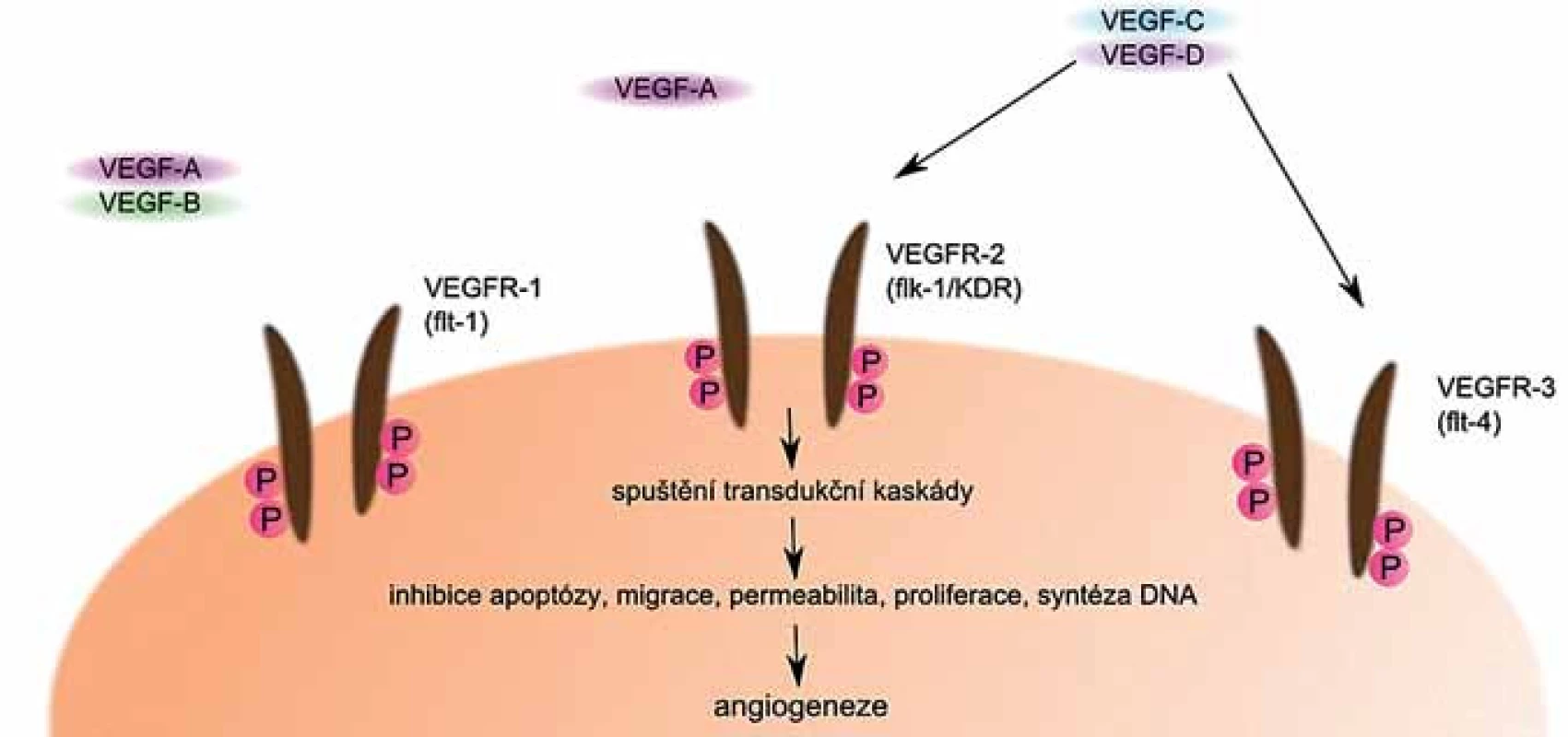
Změna angiogeneze je u MM jednou z charakteristických změn v mikroprostředí KD. Lze ji považovat za jeden z faktorů ovlivňujících růst nádorů a může být důležitým indikátorem aktivity onemocnění [31]. Nadměrná exprese VEGF maligními buňkami je přítomna u většiny pacientů s MM a přispívá k tvorbě nových cév v KD [32]. Přímým měřítkem angiogeneze je mikrovaskulární hustota (microvascular density − MVD). Byla prokázána významná korelace mezi mírou MVD a proliferační aktivitou buněk MM [33].
VEGF indukuje proliferaci myelomových buněk, spouští jejich migraci a je zodpovědný za produkci dalších cytokinů, jako např. IL‑6. Ten zpětně způsobuje nadměrnou sekreci VEGF a jeho receptoru. Tím, že je VEGF schopný stimulovat produkci IL‑6, působí také nepřímo jako regulátor růstu buněk, jejich migrace a přežívání [34]. Další funkcí VEGF je schopnost ovlivnit aktivitu osteoklastů. To vede k tvorbě kostních lytických lézí typických pro MM [35].
U pacientů s WM byly rovněž zjištěny zvýšené hodnoty VEGF, což naznačuje, že by i v patogenezi tohoto onemocnění mohla hrát angiogeneze významnou roli. Rozdíly hodnot mezi různými fázemi onemocnění však zjištěny nebyly [36]. Hladina VEGF a jeho receptoru je mezi pacienty s WM a nově diagnostikovanými MM podobná [37].
IGF‑1
IGF‑1 je malý peptid patřící do rodiny peptidů příbuzných s inzulinem [38]. IGF‑1 reguluje buněčnou proliferaci, transformaci a apoptózu. Je jedním z nejdůležitějších růstových faktorů u MM. Tento cytokin je zodpovědný za proliferaci myelomových buněk, jejich růst a přežívání, ochranu před apoptózou a také umožňuje jejich migraci. Kromě toho podporuje angiogenní procesy, které stimulují buňky MM k sekreci VEGF [39,40].
IGF‑1 je považován za prognostický znak MM i přesto, že se jeho hladiny u zdravých jedinců a pacientů velmi neliší [41]. U WM toho o tomto cytokinu není příliš známo. Ovšem v jedné studii, která se zabývala účinkem perifosinu na léčbu tohoto onemocnění, bylo popsáno, že by se IGF‑1 mohl podílet na proliferaci buněk WM a na lékové rezistenci [42].
BLyS
BLyS, označovaný někdy také jako BAFF, je stimulátor B lymfocytů, který patří do rodiny tumor nekrotizujících faktorů (TNF) [43]. Hraje velmi významnou roli v udržování správného vývoje B buněk a vývoji homeostáze. Některé studie naznačují, že je ko ‑ stimulátorem proliferace B lymfocytů a podílí se i na sekreci imunoglobulinů [44]. Nedostatečná hladina BLyS může vést k imunitním dysfunkcím, zatímco nadměrná exprese je zodpovědná za vznik autoimunitních onemocnění a B buněčných malignit [45].
Pro BLyS byly identifikovány tři receptory. Jsou jimi BCMA, TACl a BAFF ‑ R. Jedná se o jednoduché receptory, které patří do rodiny TNF receptorů. BAFF ‑ R je považován za hlavní receptor pro BLyS, který je zodpovědný za B buněčnou homeostázi, vývoj a přežití B buněk. BAFF ‑ R váže BLyS specificky, zatímco TACl a BCMA mohou vázat také příbuznou molekulu APRIL [46,47]. Tento ligand je zodpovědný za stimulaci růstu nádorových buněk [48].
Myelomové buňky exprimují na svém povrchu všechny tři typy receptorů. Hladina BLyS je u MM zvýšená a pravděpodobně podporuje přežívání myelomových buněk. Zabezpečuje také jejich proliferaci, ovšem BLyS sám o sobě na ni nemá žádný efekt, proto je zřejmé, že mechanizmus, kterým proliferaci ovlivňuje, je ve schopnosti tlumit apoptózu [49]. BLyS dokáže také ovlivnit buňky MM tak, aby reagovaly na přítomnost IL‑6 a IGF‑1, a tímto umožňuje jejich růst a přežívání [50].
Také na povrchu buněk WM jsou přítomny všechny tři typy receptorů [51]. Produkce BLyS je zvýšená i u tohoto onemocnění, ovšem v porovnání s MM je poměrně nízká [49]. U normálních B buněk je BLyS zodpovědný za regulaci sekrece IgM. Spojitost mezi zvýšenou hladinou BLyS a zvýšenou hladinou IgM u pacientů s WM tak naznačuje, že zde hraje zásadní roli, spolu s dalšími cytokiny. Zvýšená hladina BLyS v séru nebo v mikroprostředí KD podporuje také přežívání a proliferaci buněk WM, proto je možné, že by jeho inhibice mohla přispět k léčbě WM tím, že by došlo ke snížení hladiny IgM [51].
HGF
Hepatocytární růstový faktor (hepatocyte growth factor − HGF) je cytokin s pleiotropními účinky. HGF se s vysokou afinitou váže na receptor c ‑ Met, což je tyrozinkináza účastnící se celé řady procesů odehrávajících se v nádorových buňkách. HGF tak spouští vnitrobuněčnou signalizaci vedoucí k buněčné proliferaci, migraci a přežívání. Tento cytokin hraje rovněž roli v inhibici apoptózy indukcí proapoptotických proteinů či snížením aktivity kaspázy 3 [52]. Dráha HGF/ c ‑ Met se účastní vývoje a progrese B buněčných malignit, jako je např. MM [53]. U B buněčných nádorových onemocnění je aktivace receptoru c ‑ Met nejčastěji zprostředkována HGF produkovaným samotnými nádorovými buňkami, případně buňkami mikroprostředí KD [54]. HGF pak ovlivňuje proliferaci, růst, migraci, adhezi myelomových buněk, invazivitu onemocnění a novotvorbu cév [55,56].
Bylo prokázáno, že koncentrace HGF v krvi a plazmě KD je výrazně zvýšená u pacientů s MM oproti zdravým kontrolám a vyšší hladina HGF znamená horší prognózu onemocnění [57]. Ve studii Alexandrakise et al (2003) navíc sérová koncentrace HGF korelovala se stadii podle Durieho a Salmona. Dále byla jeho hladina v korelaci s hladinami IL‑6 a TNF‑α, což jsou cytokiny účastnící se stimulace osteoklastů u MM [58]. IL‑6 indukovaná proliferace myelomových buněk byla také ovlivněna signalizací pomocí HGF/ c ‑ Met dráhy u některých myelomových linií. To naznačuje, že signalizace HGF/ c ‑ Met hraje roli při zesílení efektu dalších růstových faktorů u MM [59]. Receptor c ‑ Met je exprimován také na osteoblastech a osteoklastech. Vysoká hladina HGF v séru pak koreluje s pokročilými stadii kostních lézí u MM [57,58]. Dále bylo prokázáno, že HGF inhibuje osteoblastogenezi in vitro [60]. HGF také indukuje adhezi myelomových buněk k fibronektinu a podporuje tak migraci myelomových buněk. HGF také hraje klíčovou roli v angiogenezi asociované s myelomem [61].
Ve studii Minaříka et al (2012) srovnali hladinu HGF u pacientů s MGUS a různými stadii MM. Bylo zjištěno, že sérová hladina HGF odráží aktivitu onemocnění a zvyšuje se s pokročilejším stadiem onemocnění. Může tak být užitečná při odlišení MGUS, asymptomatického myelomu a aktivní nemoci [62]. V jiné studii bylo rovněž pozorováno, že k odlišení MM od MGUS přispívá zvýšená sérová hladina HGF. Nicméně přestože statistická analýza srovnávající hladiny HGF u MM a MGUS ukázala vysoký význam, diagnostický potenciál sérové hladiny HGF se přesto jeví jako omezený z toho důvodu, že hodnoty u MM a MGUS se vzájemně překrývaly [63].
Ve studiích Poura et al se hladina HGF v plazmě periferní krve i KD před zahájením léčby zdála být dobrým markerem pro hodnocení angiogenní aktivity a dobrým prediktivním faktorem pro pacienty s MM léčené vysoce dávkovanou chemoterapií s autologní transplantací [64,65]. V další studii byla pak nízká hladina HGF před zahájením léčby asociovaná s léčebnou odpovědí na bortezomib [66].
Role HGF u WM prozatím nebyla popsána, ale je pravděpodobné, že bude hrát velkou roli i u tohoto onemocnění, stejně jako u MM.
Souhrn
Mikroprostředí KD hraje velmi významnou roli ve vývoji jak MM, tak i WM. Jedním ze způsobů komunikace mezi nádorovými buňkami a buňkami KD je sekrece cytokinů. Produkce jednotlivých cytokinů významně ovlivňuje růst, proliferaci a přežívání maligních buněk a rovněž se podílí na klinické manifestaci MM i WM.
Nicméně na základě dosud studovaných cytokinových profilů nejsme schopni tyto dvě choroby odlišit a pro jejich rozlišení musí být využita jiná kritéria. Snahou dalších studií by mělo být nalezení cytokinových profilů umožňujících jejich odlišení a také upřesnění funkcí jednotlivých cytokinů u MM i WM, jak při jejich vývoji, tak i např. při vzniku lékové rezistence.
Tato práce byla podpořena výzkumným záměrem Ministerstva školství, mládeže a tělovýchovy MSM0021622434, grantem IGA Ministerstva zdravotnictví NT14575 a NT12130 a interním grantem MUNI/11/InGA17/2012. Dále podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 5. 9. 2013
Přijato: 7. 11. 2013
RNDr. Sabina Ševčíková, Ph.D.
Babákova myelomová skupina
Ústav patologické fyziologie
LF MU
Kamenice 5, A3
625 00 Brno
e-mail: sevcik@med.muni.cz
Zdroje
1. Hájek R, Krejčí M, Pour L et al. Multiple myeloma. Klin Onkol 2011; 24 (Suppl 1): S10 – S13.
2. Adam Z, Smardová J, Scudla V. Waldenströmova makroglobulinemie: klinické projevy a diferenciální diagnostika a prognóza nemoci. Vnitr Lek 2007; 53(12): 1325 – 1337.
3. Balakumaran A, Robey PG, Fedarko N et al. Bone marrow microenvironment in myelomagenesis: its potential role in early diagnosis. Expert Rev Mol Diagn 2010; 10(4): 465 – 480.
4. Haas HS, Schauenstein K. Neuroimmunomodulation via limbic structures – the neuroanatomy of psychoimmunology. Prog Neurobiol 1997; 51(2): 195 – 222.
5. Negus RP, Balkwill FR. Cytokines in tumour growth, migration and metastasis. World J Urol 1996; 14(3): 157 – 165.
6. Naugler WE, Karin M. The wolf in sheep‘s clothing: the role of interleukin‑6 in immunity, inflammation and cancer. Trends Mol Med 2008; 14(3): 109 – 119.
7. Mitsiades CS, Mitsiades N, Munshi NC et al. Focus on multiple myeloma. Cancer Cell 2004; 6(5): 439 – 444.
8. Chng, WJ, Schop RF, Price ‑ Troska T et al. Gene ‑ expression profiling of Waldenström macroglobulinemia reveals a phenotype more similar to chronic lymphocytic leukemia than multiple myeloma. Blood 2006; 108(8): 2755 – 2763.
9. Uchiyama H, Barut BA, Mohrbacher AF et al. Adhesion of human myeloma ‑ derived cell lines to bone marrow stromal cells stimulates interleukin‑6 secretion. Blood 1993; 82(12): 3712 – 3720.
10. Dankbar B, Padró T, Leo R et al. Vascular endothelial growth factor and interleukin‑6 in paracrine tumor ‑ stromal cell interactions in multiple myeloma. Blood 2000; 95(8): 2630 – 2636.
11. Jourdan M, Mahtouk K, Veyrune JL et al. Delineation of the roles of paracrine and autocrine interleukin‑6 (IL‑6) in myeloma cell lines in survival versus cell cycle. A possible model for the cooperation of myeloma cell growth factors. Eur Cytokine Netw 2005; 16(1): 57 – 64.
12. Abildgaard N, Glerup H, Rungby J et al. Biochemical markers of bone metabolism reflect osteoclastic and osteoblastic activity in multiple myeloma. Eur J Haematol 2000; 64(2): 121.
13. Hatzimichael EC, Christou L, Bai M et al. Serum levels of IL‑6 and its soluble receptor (sIL‑6R) in Waldenström‘s macroglobulinemia. Eur J Haematol 2001; 66(1): 1 – 6.
14. Blanchard F, Duplomb L, Baud’huin M et al. The dual role of IL‑6‑type cytokines on bone remodeling and bone tumors. Cytokine Growth Factor Rev 2009; 20(1): 19 – 28.
15. Elsawa SF, Novak AJ, Ziesmer SC et al. Comprehensive analysis of tumor microenvironment cytokines in Waldenstrom macroglobulinemia identifies CCL5 as a novel modulator of IL‑6 activity. Blood 2011; 118(20): 5540 – 5549.
16. Boyce BF, Xing L. The RANKL/ RANK/ OPG pathway. Curr Osteoporos Rep 2007; 5(3): 98 – 104.
17. Corso A, Dovio A, Rusconi C et al. Osteoprotegerin serum levels in multiple myeloma and MGUS patients compared with age ‑ and sex ‑ matched healthy controls. Leukemia 2004; 18(9): 1555 – 1557.
18. Terpos E, Szydlo R, Apperley JF et al. Soluble receptor activator of nuclear factor kappaB ligand ‑ osteoprotegerin ratio predicts survival in multiple myeloma: proposal for a novel prognostic index. Blood 2003; 102(3): 1064 – 1069.
19. Marcelli C, Chappard D, Rossi JF et al. Histologic evidence of an abnormal bone remodeling in B ‑ cell malignancies other than multiple myeloma. Cancer 1988; 62(6): 1163 – 1170.
20. Terpos E, Anagnostopoulos A, Kastritis E et al. Abnormal bone remodelling and increased levels of macrophage inflammatory protein‑1 alpha (MIP‑1alpha) in Waldenström macroglobulinaemia. Br J Haematol 2006; 133(3): 301 – 304.
21. Terpos E, Tasidou A, Eleftherakis ‑ Papaiakovou E et al. Expression of CCL3 by neoplastic cells in patients with Waldenström‘s macroglobulinemia: an immunohistochemical study in bone marrow biopsies of 67 patients. Clin Lymphoma Myeloma Leuk 2011; 11(1): 115 – 117.
22. Miñano FJ, Sancibrian M, Vizcaino M at al. Macrophage inflammatory protein‑1: unique action on the hypothalamus to evoke fever. Brain Res Bull 1990; 24(6): 849 – 852.
23. Kukita T, Nomiyama H, Ohmoto Y et al. Macrophage inflammatory protein‑1α (LD78) expressed in human bone marrow: its role in regulation of hematopoiesis and osteoclast recruitment. Lab Invest 1997; 76(3): 399 – 406.
24. Uneda S, Hata H, Matsuno F et al. Macrophage inflammatory protein‑1 alpha is produced by human multiple myeloma (MM) cells and its expression correlates with bone lesions in patients with MM. Br J Haematol 2003; 120(1): 53 – 55.
25. Michigami T, Shimizu N, Williams PJ et al. Cell ‑ cell contact between marrow stromal cells and myeloma cells via VCAM‑1 and α4β1 - integrin enhances production of osteoclast ‑ stimulating activity. Blood 2000; 96(5): 1953 – 1960.
26. Vallet S, Pozzi S, Patel K et al. A novel role for CCL3 (MIP‑1α) in myeloma‑induced bone disease via osteocalcin downregulation and inhibition of osteoblast function. Leukemia 2011; 25(7): 1174 – 1181. doi: 10.1038/ leu.2011.43.
27. Lentzsch S, Gries M, Janz M et al. Macrophage inflammatory protein 1‑alpha (MIP‑1 alpha) triggers migration and signaling cascades mediating survival and proliferation in multiple myeloma (MM) cells. Blood 2003; 101(9): 3568 – 3573.
28. Neufeld G, Cohen T, Gengrinovitch S et al. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J1999; 13(1): 9 – 22.
29. Okada F, Rak JW, Croix BS et al. Impact of oncogenes in tumor angiogenesis: mutant K ‑ ras upregulation of vascular endothelial growth factor/ vascular permeability factor is necessary, but not sufficient for tumorigenicity of human colorectal carcinoma cells. Proc Natl Acad Sci USA 1998; 95(7): 3609 – 3614.
30. Kumar S, Witzig TE, Timm M et al. Expression of VEGF and its receptors by myeloma cells. Leukemia 2003; 17(10): 2025 – 2031.
31. Rajkumar SV, Mesa RA, Fonseca R et al. Bone marrow angiogenesis in 400 patients with monoclonal gammopathy of undetermined significance, multiple myeloma, and primary amyloidosis. Clin Cancer Res 2002; 8(7): 2210 – 2216.
32. Podar K, Tai YT, Davies FE et al. Vascular endothelial growth factor triggers signaling cascades mediating multiple myeloma cell growth and migration. Blood 2001; 98(2): 428 – 435.
33. Marković O, Marisavljević D, Čemerikić V et al. Expression of VEGF and microvessel density in patients with multiple myeloma: clinical and prognostic significance. Med Oncol 2008; 25(4): 451 – 457.
34. Podar K, Anderson K. The pathophysiologic role of VEGF in hematologic malignancies: therapeutic implication. Blood 2005; 105(4): 1383 – 1395.
35. Nakagawa M, Kaneda T, Arakawa T et al. Vascular endothelial growth factor (VEGF) directly 51 enhances osteoclastic bone resorption and survival of mature osteoclasts. FEBS Lett 2000; 473(2): 161 – 164.
36. Anagnostopoulos A, Eleftherakis ‑ Papaiakovou V, Kastritis E et al. Serum concentrations of angiogenic cytokines in Waldenstrom macroglobulinaemia: the ratio of angiopoietin‑1 to angiopoietin‑2 and angiogenin correlate with disease severity. Br J Haematol 2007; 137(6): 560 – 568.
37. Kumar S, Witzig TE, Timm M et al. Bone marrow angiogenic ability and expression of angiogenic cytokines in myeloma: evidence favoring loss of marrow angiogenesis inhibitory aktivity with disease progression. Blood 2004; 104(4): 1159 – 1165.
38. Rinderknecht E, Humbel RE. The amino acid sequence of human insulin like growth factor I and its structural homology, with proinsulin. J Biol Chem 1978; 253(8): 2769 – 2776.
39. Menu E, van Valckenborgh E, van Camp B et al. The role of the insulin‑like growth factor 1 receptor axis in multiple myeloma. Arch Physiol Biochem 2009; 115(2): 49 – 57.
40. Qiang YW, Yao L, Tosato G et al. Insulin‑like growth factor I induces migration and invasion of human multiple myeloma cells. Blood 2004; 103(1): 301 – 308.
41. Standal T, Borset M, Lenhoff S et al. Serum insulin-like growth factor is not elevated in patients with multiple myeloma but is still a prognostic factor. Blood 2002; 100(12): 3925 – 3929.
42. Leleu X, Jia X, Runnels J et al. The Akt pathway regulates survival and homing in Waldenstrom macroglobulinemia. Blood 2007; 110(13): 4417 – 4426.
43. Schneider P, MacKay F, Steiner V et al. BAFF, a novel ligand of the tumor necrosis factor family, stimulates B cell growth. J Exp Med 1999; 189(11): 1747 – 1756.
44. Mackay F, Schneider P, Rennert P et al. BAFF AND APRIL: a tutorial on B cell survival. Annu Rev Immunol 2003; 21 : 231 – 264.
45. Xu G, Shen XJ, Pu J et al. BLyS expression and JNK activation may form a feedback loop to promote survival and proliferation of multiple myeloma cells. Cytokine 2012; 60(2): 505 – 513.
46. Gross JA, Johnston J, Mudri S et al. TACI and BCMA are receptors for a TNF homologue implicated in B ‑ cell autoimmune disease. Nature 2000; 404(6781): 995 – 999.
47. Thompson JS, Bixler SA, Qian F et al. BAFF ‑ R, a newly identified TNF receptor that specifically interacts with BAFF. Science 2001; 293(5537): 2108 – 2111.
48. Hahne M, Kataoka T, Schröter et al. APRIL, a new ligand of the tumor necrosis factor family, stimulans tumor cell growth. J Exp Med 1998; 188(6): 1185 – 1190.
49. Novak AJ, Darce JR, Arendt BK et al. Expression of BCMA, TACI, and BAFF ‑ R in multiple myeloma: a mechanism for growth and survival. Blood 2004; 103(2): 689 – 694.
50. Hideshima T, Anderson KC. Molecular mechanisms of novel therapeutic approaches for multiple myeloma. Nat Rev Cancer 2002; 2(12): 927 – 937.
51. Elsawa SF, Novak AJ, Grote DM et al. B‑lymphocyte stimulator (BlyS) stimulates immunoglobulin production and malignant B ‑ cell growth in Waldenström macroglobulinemia. Blood 2006; 107 : 2882 – 2888.
52. Cohen S, Shachar I. Cytokines as regulators of proliferation and survival of healthy and malignant peripheral B cells. Cytokine 2012; 60(1): 13 – 22. doi: 10.1016/ j.cyto.2012.06.019.
53. Derksen PW, de Gorter DJ, Meijer HP et al. The hepatocyte growth factor/ Met pathway controls proliferation and apoptosis in multiple myeloma. Leukemia 2003; 17(4): 764 – 774.
54. Mahtouk K, Tjin EP, Spaargaren M et al. The HGF/ MET pathway as target for the treatment of multiple myeloma and B ‑ cell lymphomas. Biochim Biophys Acta 2010; 1806(2): 208 – 219. doi: 10.1016/ j.bbcan.2010.07.006.
55. Hov H, Holt RU, Rø TB et al. A selective c ‑ met inhibitor blocks an autocrine hepatocyte growth factor growth loop in ANBL ‑ 6 cells and prevents migration and adhesion of myeloma cells. Clin Cancer Res 2004; 10(19): 6686 – 6694.
56. Du W, Hattori Y, Yamada T et al. NK4, an antagonist of hepatocyte growth factor (HGF), inhibits growth of multiple myeloma cells: molecular targeting of angiogenic growth factor. Blood 2007; 109(7): 3042 – 3049.
57. Seidel C, Børset M, Turesson I et al. Elevated serum concentrations of hepatocyte growth factor in patients with multiple myeloma. The Nordic Myeloma Study Group. Blood 1998; 91(3): 806 – 812.
58. Alexandrakis MG, Passam FH, Sfiridaki A et al. Elevated serum concentration of hepatocyte growth factor in patients with multiple myeloma: correlation with markers of disease activity. Am J Hematol 2003; 72(4): 229 – 233.
59. Hov H, Tian E, Holien T et al. c ‑ Met signaling promotes IL‑6‑induced myeloma cell proliferation. Eur J Haematol 2009; 82(4): 277 – 287. doi: 10.1111/ j.1600 – 0609.2009.01212.
60. Standal T, Abildgaard N, Fagerli UM et al. HGF inhibits BMP‑induced osteoblastogenesis: possible implications for the bone disease of multiple myeloma. Blood 2007; 109(7): 3024 – 3030.
61. Holt RU, Baykov V, Rø TB et al. Human myeloma cells adhere to fibronectin in response to hepatocyte growth factor. Haematologica 2005; 90(4): 479 – 488.
62. Minarik J, Pika T, Bacovsky J et al. Prognostic value of hepatocyte growth factor, syndecan ‑ 1, and osteopontin in multiple myeloma and monoclonal gammopathy of undetermined significance. ScientificWorldJournal 2012; 2012 : 356128. doi: 10.1100/ 2012/ 356128.
63. Scudla V, Budíková M, Petrová P et al. Analýza sérových hladin vybraných bio logických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu. Klin Onkol 2010; 23(3): 171 – 181.
64. Pour L, Svachova H, Adam Z et al. Levels of angiogenic factors in patients with multiple myeloma correlate with treatment response. Ann Hematol 2010; 89(4): 385 – 389. doi: 10.1007/ s00277 – 009 – 0834 – 3.
65. Pour L, Svachova H, Adam Z et al. Pretreatment hepatocyte growth factor and thrombospondin‑1 levels predict response to high‑dose chemotherapy for multiple myeloma. Neoplasma 2010; 57(1): 29 – 34.
66. Pour L, Svachova H, Adam Z et al. Treatment response to bortezomib in multiple myeloma correlates with plasma hepatocyte growth factor concentration and bone marrow thrombospondin concentration. Eur J Haematol 2010; 84(4): 332 – 336. doi: 10.1111/ j.1600 – 0609.2009.01396.x.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Druhé nádory – příčiny, incidence a budoucnost
- Cytokinové profily mnohočetného myelomu a Waldenströmovy makroglobulinemie
- Lymfomy se dvěma zásahy – přehled literatury a kazuistika
- Interakcia medzi p53 a MDM2 v nádorových bunkách karcinómu pľúc
- Chirurgická liečba metastáz a jej vplyv na prognózu u pacientov s metastatickým kolorektálnym karcinómom
- Na MRI založené 3D plánování brachyradioterapie karcinomů děložního hrdla – naše zkušenosti s použitím uterovaginálního aplikátoru Vienna Ring MR‑ CT
- Editorial
- Významná protinádorová účinnost imatinibu u c-kit negativního gastrointestinálního stromálního tumoru – kazuistika
- Gastrointestinální stromální nádor žaludku s diseminací do kostí – kazuistika a přehled literatury
- Předávání znalostí na letní škole Regionálního centra aplikované molekulární onkologie v roce 2013
- Erratum
- Biosimilars (ne)jen v onkologii – dnešní realita i budoucnost
- Zajímavé případy z nutriční péče v onkologii
- Enzalutamid (Xtandi®) – nová šance pro pacienty s kastračně refrakterním karcinomem prostaty
-
Onkologie v obrazech
Umělecké projevy toxicity protinádorové léčby - V lednu letošního roku zemřel ve vysokém věku doc. MUDr. Václav Bek, DrSc.
- Recenze knihy „Principy systémové protinádorové léčby“
- Informace z České onkologické společnosti
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chirurgická liečba metastáz a jej vplyv na prognózu u pacientov s metastatickým kolorektálnym karcinómom
- Enzalutamid (Xtandi®) – nová šance pro pacienty s kastračně refrakterním karcinomem prostaty
- Druhé nádory – příčiny, incidence a budoucnost
- Interakcia medzi p53 a MDM2 v nádorových bunkách karcinómu pľúc
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



