-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
Therapy of portal hypertension using transjugular intrahepatic portosystemic shunt – first 1,000 procedures in UH Hradec Kralove
Transjugular intrahepatic portosystemic shunt (TIPS) has been available for clinical practice since 1989, and in the Czech Republic since 1992. It is mostly used in patients suffering from liver cirrhosis and related complications such as GI bleeding or large ascites. In fact it is a side-to-side portacaval anastomosis reinforced with a metal stent and created by interventional radiologist without surgery. In the course of the 25 years of its clinical use, some changes have occurred: more than one-third of patients suffer from hepatic encephalopathy, but treatment with rifaximin is successful in most of them. The bare stent used for TIPS in the initial period, having a much higher risk of patency problems, was replaced by a covered stent (stent-graft). Though many indications were specified, some others still await confirmation, e.g. indication of TIPS according to the portacaval gradient. In the latest period, the number of indications for GI bleeding is decreasing, but the number of procedures for ascites and hydrothorax, having more altered liver functions, is rising. TIPS reduces portal pressure but does not improve liver function, so it cannot substitute liver transplantation. TIPS is performed by an interventional radiologist, but cooperation with the hepatologist is a fundamental condition for good treatment of patients. For the time of its existence, TIPS has established a firm position in the therapeutic portfolio of portal hypertension complications.
Key words:
liver cirrhosis – portal hypertension – transjugular intrahepatic – portosystemic shunt
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
24. 2. 2014Accepted:
17. 3. 2014
Autoři: A. Krajina 1; P. Hůlek 2,3; Miroslav Lojík 1
; V. Chovanec 1; O. Renc 1
; J. Raupach 1; T. Fejfar 2; V. Jirkovský 2; V. Šafka 4; Š. Šembera 2; T. Vaňásek 2
Působiště autorů: Radiologická klinika LF UK a FN Hradec Králové 1; II. interní gastroenterologická klinika LF UK a FN Hradec Králové 2; Interní klinika LF OU, Ostrava 3; Ústav fyziologie, LF UK, Hradec Králové 4
Vyšlo v časopise: Gastroent Hepatol 2014; 68(2): 100-107
Kategorie: Hepatologie: přehledová práce
Souhrn
Transjugulární intrahepatální portosystémová spojka (TIPS) existuje v klinické praxi od roku 1989, v České republice od roku 1992. Používá se nejčastěji u nemocných s jaterní cirhózou a jejími komplikacemi jako krvácením do GIT či velkým ascitem. Je v podstatě side-to-side portokavální spojkou vyztuženou kovovým stentem vytvořenou intervenčním radiologem bez nutnosti chirurgického přístupu. V průběhu 25 let došlo v jeho užití k několika změnám. Protože po TIPS vzniká u více než třetiny nemocných jaterní encefalopatie, užívá se v posledních letech k jejímu léčení s úspěchem rifaximin. Zpočátku užívaný nepotažený stent, který měl větší riziko příhod zhoršujících jeho průchodnost, byl nahrazen stentem potaženým (stentgraftem). Přestože se upřesnily některé indikace, jiné na své potvrzení dosud čekají, např. indikace podle výšky portosystémového gradientu. V posledních letech ubývá nemocných indikovaných k TIPS pro krvácení a přibývá nemocných indikovaných k TIPS pro ascites a hydrothorax, kteří mají více postiženou funkci jater. TIPS snižuje portální tlak, ale nezlepšuje funkci jater, proto nemůže nahradit transplantaci jater. TIPS provádí intervenční radiolog, ale spolupráce s hepatologem je základní podmínkou správné péče o nemocné. TIPS si za dobu své existence vydobyl svou pevnou pozici v možnostech péče o nemocné s komplikacemi portální hypertenze.
Klíčová slova:
jaterní cirhóza – portální hypertenze – transjugulární intrahepatální portosystémová spojkaV Evropě a USA je intrahepatální portální hypertenze spojena s jaterní cirhózou ve více než 95 %. Asi v polovině případů je její příčinou nadměrné užívání alkoholu, třetinu případů způsobují virové hepatitidy B a C a zbývající část je důsledkem různých metabolických a idiopatických onemocnění jater.
Historie, princip metody a definice
Transjugulární intrahepatální portosystémová spojka (TIPS) je perkutánní způsob vytvoření portosystémového zkratu ke snížení nebo léčbě portální hypertenze. TIPS je side-to-side typ zkratu s určitelným průměrem. Je navržen tak, aby fungoval jako částečný zkrat, který zachovává tok portální krve do jater.
Koncem 60. let byl TIPS vyvinut v pokusech na zvířatech Josefem Röschem [1]. Po jeho uvedení do klinické praxe Götzem Martinem Richterem et al [2] se stal alternativou chirurgicky vytvořeným spojkám pro dekompresi symptomatické portální hypertenze [3].
TIPS se provádí z katetrizačního přístupu z vnitřní jugulární žíly. Katetr je pak zaveden přes horní dutou žílu, pravou síň a dolní dutou žílu do pravé nebo střední jaterní žíly. Dedikovanou jehlou zavedenou katetrem je provedena punkce nejčastěji z centrální části pravé jaterní žíly směrem na pravou větev portální žíly. Jehlou je pak zaveden vodič, po kterém se balonkovým katetrem pro angioplastiku provede dilatace budoucího intrahepatálního kanálu mezi oběma žilami. Takto připravený kanál je plně otevřen zavedením dedikovaného stentgraftu či kovového stentu. V závislosti na rozdílu tlaku v portální žíle a ve volné jaterní žíle či v pravé srdeční síni je možné kanál vytvořit větší (až 10 mm v průměru) nebo menší (6 mm). Tomu je pak úměrná požadovaná míra dekomprese portálního žilního systému.
TIPS má hlavní výhodu oproti chirurgickým portosystémovým spojkám – je možné jej provést v místní anestezii a v analgosedaci. Je možné jej provést v centrech jako urgentní výkon a u nemocných s pokročilou jaterní chorobou. Hlavní nevýhodou TIPS je nutnost následných kontrol průchodnosti spojky, která se výrazně zlepšila se zavedením pokrytých stentů – dedikovaných stentgraftů v roce 2001 [4,5]. Druhou nevýhodou je buď zhoršení preexistující nebo nově vzniklé jaterní encefalopatie, kterou lze v posledních letech zvládat s pomocí rafaximinu (Normixu).
Počáteční experimenty, které vedly k vývoji této metody, byly zaměřeny na transjugulární portografii, tedy na zobrazení portálního řečiště. Přístup byl stejný jako provedení transjugulární cholangiografie [6]. V druhé polovině 60. let nebyla myšlenka takto provedené portosystémové spojky ještě zcela přijímána a první Röschův článek z roku 1969 prezentující tuto metodu experimentálně byl velmi kritizován a byly vyjádřeny pochybnosti o reálnosti metody. Trvalo dalších 15 let, než byly vyvinuty metody balonkové angioplastiky a implantace stentů a než se tato metoda začala uplatňovat v klinické praxi.
Při prvních experimentech bylo možné spojku vytvořit, ale její průchodnost nebyla trvalá. Kanál byl zpočátku otevřen použitím silikonem potažené pružiny s vnitřním průměrem 4–6 mm. Takový zkrat se udržel průchodný dva týdny [7]. Později byly provedeny pokusy s vytvořením širšího kanálu rotujícím ablačním zařízením, kryosondou a laserem [8,9]. Tyto kanálky se do dvou týdnů rovněž uzavíraly. Až s použitím balonkové angioplastiky bylo možné nejprve experimentálně, později i klinicky dosáhnout vytvoření kanálku, který se sice uzavíral, ale bylo možné jej snadno zprůchodnit [11,12]. Pokud byly balonkové dilatace provedeny jednou týdně, a to až pět týdnů po sobě, zkrat zůstával průchodný až jeden rok. Colapinto [13] použil stejný postup i klinicky a 9mm balonek nechal v intraparenchymovém traktu naplněný 12 hod. Jednalo se o nemocné s akutním krvácením z varixů, u kterých byly nejprve embolizovány krvácející varixy a pak prováděna intrahepatální spojka. Většina nemocných však opětně zakrvácela [14].
Až s příchodem stentu bylo možno experimentálně takto vytvořit trvalou spojku [15–17] a TIPS byla poprvé provedena s použitím stentu v lednu 1988 G. Richterem, J. Palmazem a M. Rösslem ve Freiburgu [2]. V ČR byla tato metoda zavedena 7. září 1992 na základě zkušeností převzatých z Dotterova institutu v Portlandu ve státě Oregon. Na první výkon bylo nutno použít resterilizovanou jehlu, vodiče, balonky a stent vyrobený doma z ocelových drátů a chirurgické niti. Jeho výroba trvala okolo 4 hod. Výkon pak byl proveden za relativně špatné skiaskopické kontroly na přístroji z roku 1963. Kontrolní nástřiky byly dokumentovány na velkoformátové filmy, což výkon prodlužovalo. Nicméně bylo dosaženo úspěchu [19] a tým radiologů a hepatologů tuto metodu definitivně zavedl [20–25]. Do roku 2014 bylo ve Fakultní nemocnici v Hradci Králové léčeno celkem 1 000 nemocných touto metodou.
Obr. 1. Třiapadesátiletá žena s opakovaným krvácením ze subkardiálních varixů, těžko stavitelné endoskopickou léčbou. Současně přítomna významná portální gastropatie. 1A. CT portografie zobrazuje portální žílu a její lokalizaci vzhledem k okolnímu jaternímu parenchymu. 1B. Po punkci pravé větve portální žíly zavedeným katetrem provedena přímá portografie a změřen tlakový gradient. 1C. K výběru délky dedikovaného stentgraftu je nutné změřit délku intraparenchymového kanálu. Portografie v pravé přední šikmé projekci provedená kalibračním katetrem zobrazuje nezkresleně portální bifurkaci a vzdálenost místa punkce od ní, zároveň je zobrazena dolní dutá žíla. Ve vena gastrica brevis je patrna náplň akrylátovým lepidlem. 1D. Stav po implantaci stentgraftu, který zkratuje tok z pravé větve vena portae do pravé síně. Portosystémový gradient klesl z 18 na 10 mmHg. Fig. 1. A 53-year-old female with repeated bleeding from subcardiac varices, which was difficult to stop endoscopically. Also significant portal gastropathy was present. 1A. CT portography shows portal vein and its localisation with a view of the surrounding liver parenchyma. 1B. After the puncture of the right branch of portal vein with the introduced catheter, direct portography was made and pressure gradient measured. 1C. To determine the length of the dedicated stent-graft it is necessary to measure the length of intraparenchymal channel. The portograpy in the right anterior oblique projection carried out by the calibration catheter shows undistorted portal bifurcation and its distance from the puncture site. Also the inferior vena cava is displayed. The filling with acrylate glue is apparent in short gastric vein. 1D. Condition after the implantation of stent-graft which shortens the flow from the right branch of the portal vein to the right atrium. The portosystemic gradient decreased from 18 to 10 mmHg. 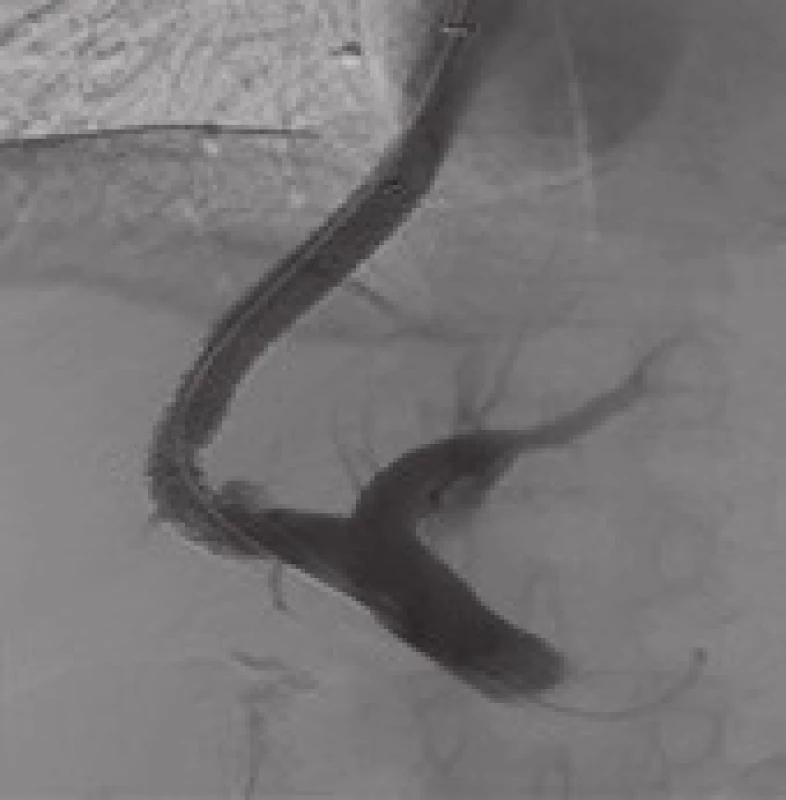
Definice
Portální hypertenze je syndrom způsobený zvýšenou rezistencí v portohepatální cirkulaci a zvýšením splanchnického žilního zásobení. V normálních játrech nepřesahuje tlak mezi portální žilou a volnou jaterní žilou nebo pravou síní obvykle 5 mmHg. Portální hypertenze je definována jako zvýšení gradientu nad 6 mmHg, ale zdá se, že klinické komplikace z portální hypertenze nastávají až při zvýšení tlaku na 10–12 mmHg.
Měření zaklíněného tlaku v jaterní žíle má dvě složky, portální a systémovou. Portální složkou je tlak přenášený z jaterních sinusoidů, systémovou složkou je tlak z centrálních žil. Rozvoj portosystémových kolaterál způsobuje portální komponenta. Termín korigovaný sinusoidální tlak zahrnuje pouze portální komponentu a vypočítá se odečtením středního tlaku v pravé síni nebo dolní duté žíle od zaklíněného tlaku v jaterní žíle. Zaklíněný tlak v jaterní žíle se měří pomocí katetru s konečným otvorem, který se posouvá do jaterní žíly, než se dostatečně zaklíní. Alternativně může být tlak změřen pomocí dvouluminózního balonkového katetru, který se insufluje v centrální části jaterní žíly a tlak se měří kanálem v balonku určeným pro vodič.
Technická úspěšnost TIPS je definována jako pokles tlakového gradientu na 12 mmHg nebo méně nebo jeho pokles o 20 %. Kritériem úspěšně vytvořeného TIPS je srovnání toku krve v TIPS s tokem ve větvích portální žíly a portosystémových kolaterálách (zejména gastrických žilách). Známkou dobrého toku v TIPS je hepatofugální (reverzní) tok ve větvích portální žíly (totální zkrat).
Klinický úspěch je definován zástavou variceálního krvácení, nerecidivujícím krvácením a zmenšením ascitu a jeho konverzí na diuretika citlivý ascites. U nemocných léčených pro masivní trombózu jaterních žil je úspěchem zlepšení jaterních funkcí.
Jaterní encefalopatie je definována jako souhrn všech mozkových dysfunkcí, které se mohou vyskytnout v průběhu vážného jaterního onemocnění. Klinická symptomatologie, která je zpravidla reverzibilní, se pohybuje v rozmezí od dezorientace, somnolence a letargie až po sopor a koma.
Obr. 2. Čtyřiapadesátiletý muž s polycytemia vera. Přichází s krvácením z varixů s hemoragickým šokem. 2A, 2B. CT vyšetření ukazuje chronický uzávěr v. portae s četnými kolaterálami. 2C. Po punkci intrahepatální větve v. portae se podařilo pomocí hydrofilního vodiče proniknout přes chronický uzávěr kmene v. portae do lienální žíly. Přímá portografie prokazuje většinou hepatofugální kolaterály. 2D. Stav po dilataci traktu a zavedení kovového samoexpandibilního stentu. Při vstřiku do v. lienalis je tok krve zkratován do jaterní žíly. Po dobu sledování dvou let nemocný nekrvácel. Fig. 2. A 54-year-old male with polycytemia vera. He came with variceal bleeding with a hemorrhagic shock. 2A, 2B. The CT examination shows a chronic closure of v. portae with numerous collaterals. 2C. After the puncture of intrahepatic branch of v. portae it was possible to penetrate through the chronic closure of the stem of v. portae into the lineal vein using the hydrophilic wire. Direct portography shows mostly hepatofugal collaterals. 2D. Condition after the tract dilatation and introduction of the metal selfexpandable stent. After entering the v. lienalis, the blood flow is short-circuited to the hepatic vein. During the two-year follow-up period the patient had no bleeding. 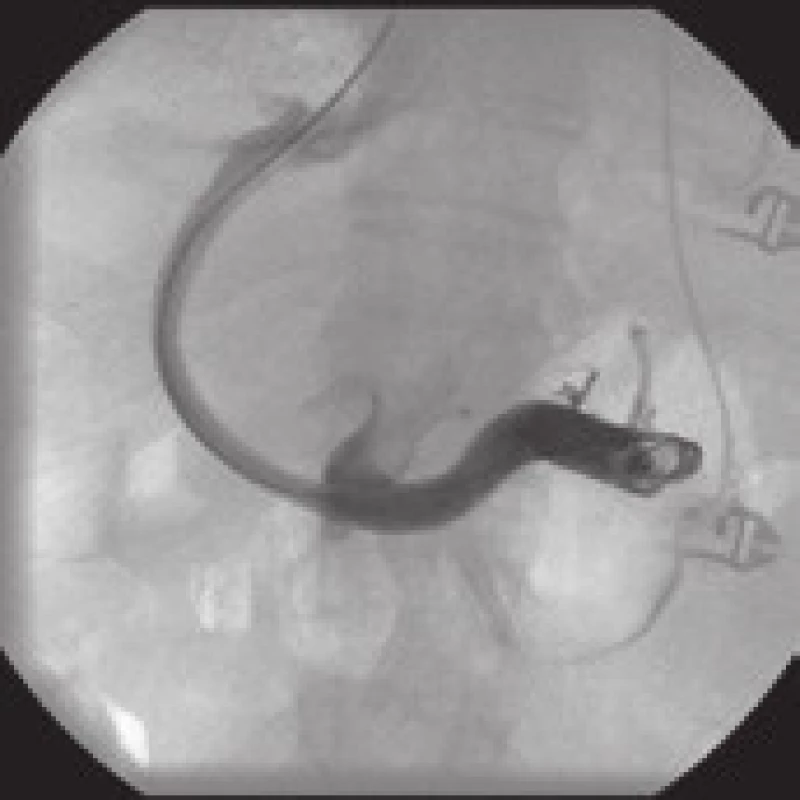
Indikace a kontraindikace léčby
Indikace TIPS
Obecně platí, že u nemocných s Child-Pugh skóre vyšším než 12 je vysoké riziko postprocedurálního úmrtí. Klíčem k úspěšné léčbě pomocí TIPS je proto pečlivá selekce nemocných. Bylo vytvořeno bodové hodnocení nemocných podle modelu konečného stadia onemocnění jater (MELD skóre) s cílem předvídat časnou mortalitu po TIPS. Nemocní s MELD skóre vyšším než 15–18 nebo hladinou bilirubinu nad 60 µmol/l by měli být informováni o své špatné prognóze a TIPS by měl být proveden pouze při vyloučení jiných možností léčby [26].
Refrakterní ascites. V současnosti je nejčastější indikací k TIPS refrakterní ascites. Je definován jako břišní tekutinová kolekce, která nemůže být mobilizována, nebo jako časná recidiva abdominální tekutiny, která není ovlivnitelná adekvátní konzervativní léčbou [27]. Termín refrakterní ascites má dva různé významy: na diuretika rezistentní a na diuretika intraktabilní ascites. Ascites rezistentní na diuretika nereaguje ani na intenzivní diuretickou léčbu až do dávek 400 mg spironolaktonu denně a až 160 mg furosemidu denně a omezení příjmu soli na 5,2 g za den. Intraktabilní ascites nemůže být mobilizován nebo jeho brzkému opakování nemůže být zabráněno díky rozvoji komplikací navozených podáváním diuretik, které vylučují použití efektivních diuretických dávek.
U nemocných s cirhotickým ascitem existují dvě důležité komplikace: spontánní bakteriální peritonitida a hepatorenální syndrom [28,29].
Hepatický hydrothorax se vyskytuje u nemocných s ascitem, když je přímá komunikace mezi peritoneální a pleurální dutinou. U většiny nemocných je defekt v bránici v oblasti kopule jater. Hepatický hydrothorax tak vzniká v důsledku akumulace ascitické tekutiny přecházející přes defekt bránice [30].
Krvácení z varixů. Příčinami gastrointestinálního krvácení u nemocných s portální hypertenzí mohou být prasklé varixy, portální hypertenzní gastropatie, vřed po skleroterapii, vředová choroba gastroduodena, hemoragická gastritida a Mallory-Weiss syndrom. U nemocných s krvácením z gastroezofageálních varixů je TIPS všeobecně přijímána jako terapie druhé volby po selhání endoskopické a medikamentózní léčby [31].
Masivní trombóza jaterních žil. TIPS je indikována při selhání medikamentózní léčby. Je technicky proveditelná u většiny nemocných s trombózou jaterních žil. U pacientů bez pahýlu jaterních žil je možná punkce jaterního parenchymu přímo z dolní duté žíly. Důvodem k vytvoření TIPS je dekomprese jater z venózní kongesce, jako výtokový trakt je využita portální žíla a TIPS [32].
Trombóza portální žíly. U nemocných s trombózou portální žíly by provedení TIPS mělo být zváženo jak u nemocných s kavernózní přestavbou, tak bez ní. TIPS je technicky proveditelná, jsou-li průchodné intrahepatalní větve portální žíly. Tento výkon by měl být prováděn pouze v centrech s rozsáhlými zkušenostmi [33].
Embolizace portosystémových kolaterál. Existují tři hlavní indikace embolizace velkých portosystémových kolaterál. Nejčastější indikací je embolizace v. coronaria ventriculi a vv. gastricae breves u nemocných s nedávnou anamnézou akutního variceálního krvácení, zejména jsou-li zdrojem krvácení varixy žaludku. Další indikací je uzávěr velkých kolaterál, ve kterých po vytvoření TIPS přetrvává kompetitivní tok. Z embolizace velkých portosystémových kolaterál mohou dále profitovat nemocní s anamnézou jaterní encefalopatie nebo s jejím vysokým rizikem [34].
Kontraindikace TIPS
Absolutní kontraindikací provedení TIPS jsou případy s neprokázanou portální hypertenzí (klinicky nebo anatomicky).
Provedení TIPS by mělo být pečlivě zváženo v těchto případech: APACHE II skóre > 20, zejména u nemocných Child C a nevratnou fází hemoragického šoku; Child-Pugh skóre > 12 a MELD skóre > 18; pravostranné srdeční selhávání se zvýšeným tlakem centrálního žilního systému (střední tlak v pravé síni > 15 mmHg); jaterní encefalopatie obtížně kontrolovatelná laktulózou, zejména u nemocných starších 60 let, nemocných s diabetem a na pravidelné hemodialýze; chronická okluze portální žíly s periportálními kolaterálami, hypervaskularizované tumory jater nebo polycystóza a při aktivní infekci, intrahepatální nebo systémové.
K provedení TIPS pro krvácení z varixů jsou požadovány následující laboratorní hodnoty: celkový bilirubin < 60 µmol/l (zvláště u pacientů Child C) a INR < 1,8. U nemocných indikovaných k TIPS pro refrakterní ascites jsou vyžadovány tyto hodnoty: celkový bilirubin < 50 µmol/l a sérový kreatinin do 180 µmol/l (vyjma případů s hepatorenálním syndromem). Celkový bilirubin může být rovněž zvýšen při biliární obstrukci, hemobilii, hemolýze nebo primární biliární cirhóze, v těchto případech není hodnota bilirubinu nad 60 µmol/l kontraindikací k TIPS.
Příprava nemocných
Předoperační zobrazování
Ultrasonografie by měla ověřit průchodnost portálního systému a jaterních žil, vyloučit intrahepatální nádor nebo cystu, určit maximální rychlost toku krve v portální žíle, změřit průměry a index městnání v portální, lienální a horní mezenterické žíle, zhodnotit velikost sleziny a dokumentovat přítomnost a rozsah portosystémových kolaterál a ascitu. Toto hodnocení slouží jako základ pro porovnání v průběhu dalšího sledování [21].
Počítačová tomografie (CT) by měla určit změněnou anatomii jater včetně atrofie laloků a celkové velikosti jater, zhodnotit prostorový vztah mezi játry a pravou ledvinou, jaterními žilami a větvemi portální žíly. Pomocí CT dále hodnotíme průchodnost portálních větví a jejich přítoků, ložiskové léze jater a množství ascitu.
Zobrazení magnetickou rezonancí měří toky v játrech pomocí techniky fázového kontrastu a s použitím specifických kontrastních látek poskytuje přesnější diagnostiku hepatocelulárního karcinomu [35].
Laboratorní vyšetření
Laboratorní testy jsou prováděny k odhalení koagulopatie, jaterního a ledvinného selhání a systémové infekce; dále ke stanovení Child-Pugh klasifikace (protrombinový čas/INR, parciální tromboplastinový čas, kreatinin, urea, elektrolyty, bilirubin, celková bílkovina, krevní obraz a transaminázy). Znalost výsledků těchto laboratorních testů je pro operatéra nezbytná z důvodu minimalizace rizik vyplývajících z podání jodové kontrastní látky, možného strukturálního poranění jater a vytvoření příliš velkého portosystémového zkratu.
Subklinická jaterní encefalopatie může být odhalena pomocí různých testů, podpis nemocného by měl být denně zaznamenáván do dekurzu.
Pro zlepšení klinického stavu nemocných by měly být korigovány zejména tyto laboratorní hodnoty: hematokrit, bílkoviny, poruchy koagulace (podání čerstvě zmražené plazmy při INR nad 1,8; náplavy destiček při trombocytopenii pod 50 × 1012/l – vždy podle standardů příslušného centra). Nemocný s akutním krvácením musí být během výkonu hemodynamicky stabilizován. K dispozici by měly být minimálně dvě vykřížené krevní jednotky.
Případné srdeční onemocnění by mělo odhalit preventivní kardiologické vyšetření. Skrytá cirhotická kardiomyopatie se může projevit až po provedení TIPS [36].
Měla by být podávána širokospektrá antibiotika, léčba se zahajuje v den výkonu a pokračuje minimálně dva dny po něm (antibiotická léčba je zahrnuta v léčbě variceálního krvácení).
Drenáž tenzního ascitu usnadňuje provedení výkonu díky zlepšení skiaskopického zobrazení a snížení úhlu mezi jaterními žilami a dolní dutou žilou. Lékaři si musí být vědomi rizika hepatorenálního syndromu. Monitorovaná drenáž ascitu může usnadnit dýchání nemocných během výkonu.
Měla by být známa anamnéza o alergii na kontrastní látku, protože v případě proběhlé alergické reakce je riziko idiosynkratické reakce 16–44 % (4–8× více než u běžné populace). K prevenci alergoidní reakce je doporučeno podání kortikosteroidů 12 hod před plánovaným výkonem.
Nemocní musí být poučeni o zákazu příjmu potravy nejméně 6–8 hod před výkonem. Musí být zajištěn adekvátní žilní přístup.
Nedílnou součástí výkonu je informovaný souhlas nemocného (nebo jeho rodiny) s vysvětlením důvodu a principu léčby, možných komplikací včetně encefalopatie a zmínkou o dalších možnostech léčby.
Monitorování nemocných během TIPS
U většiny nemocných je TIPS prováděn v lokálním znecitlivění a v analgosedaci. Celková anestezie je nutná u dětí, nespolupracujících nemocných a artificiálně ventilovaných pacientů. V některých centrech je celková anestezie používána rutinně.
Analgosedace vyžaduje pečlivé monitorování nemocných a přítomnost zdravotní sestry. K analgosedaci se běžně užívají midazolam a fentanyl, jejich frakcionované podávání vyžaduje pravidelnou monitoraci krevního tlaku, saturaci krve kyslíkem a podávání kyslíku nosní sondou nebo obličejovou maskou. Tato medikace je doplňková k lokální anestezii kůže v místě punkce jugulární žíly a jejím cílem je zmírnit výraznou bolest při dilataci spojky v játrech balonkovým katetrem. Intenzita vnímání bolesti se liší od pacienta k pacientovi.
Dále je nutná kontinuální monitorace EKG, zejména k registraci arytmií při procházení vodičem z pravé síně do dolní duté žíly a při nechtěné manipulaci v pravé komoře. Kontakt katetru nebo vodiče s vnitřní stěnou síně nebo komory může způsobit závažné poruchy rytmu.
U nemocných se zhoršenými ledvinnými funkcemi je nutné monitorovat množství použité kontrastní látky a její množství adekvátně omezit k prevenci kontrastní nefropatie. Dávku jodové kontrastní látky lze snížit použitím oxidu uhličitého. Tento má výhodu před jodovou kontrastní látkou, a to takovou, že lépe zobrazí portální žílu při vstřiku zaklíněným katetrem v jaterní žíle [22,37].
Sledování nemocných po výkonu
Všichni nemocní po TIPS mají pravidelné ultrasonografické kontroly do 24 hod, dále pak za jeden měsíc, tři měsíce a šest měsíců po výkonu. Poté pak pravidelně každých šest měsíců [21,38].
Nemocní po TIPS jsou pravidelně sledováni hepatologem, u nemocných po krvácení do GIT je po šesti měsících plánovaně provedena gastroskopie.
Antikoagulační léčba není běžně doporučována vyjma nemocných s masivní trombózou jaterních žil (Budd-Chiari syndromem), kde je nutnost udržovat účinnou antikoagulaci s INR vyšším než 2,0.
Přítomnost jaterní encefalopatie nebo její zhoršení je zjišťována přímým dotazem nemocného nebo jeho rodiny, je nutné klást konkrétní otázky ohledně změny osobnosti, pracovních schopností, poruch spánku a schopnosti koncentrace. K dispozici jsou psychometrické testy pro včasnou detekci subklinické encefalopatie včetně rozboru rukopisu a řady specifických testů.
Jaterní encefalopatie je častější při použití potažených stentů než u stentů nekrytých a její výskyt bývá v průběhu sledování stacionární. Nereagující jaterní encefalopatie může být ovlivněna snížením průtoku v TIPS pomocí různých redukčních zařízení zavedených endoluminálně [39,40].
Výsledky
Největším problémem této metody zůstává nepředvídatelná dlouhodobá průchodnost intrahepatické spojky. U běžných kovových stentů je pravděpodobnost dysfunkce TIPS po primárním zavedení 25 % za šest měsíců a 50 % v jednom roce. Hlavní problém s primární průchodností TIPS byl vyřešen díky používání ePTFE (expandovaný polytetrafluoretylen) krytých stentů (stentgraftů). Při použití tohoto stentgraftu je popisována redukce incidence dysfunkce TIPS na 13 % v šesti měsících a 15 % v jednom roce [5,24,41]. Stentgrafty jsou rovněž používány při revizích TIPS, kdy dochází ke zlepšení dlouhodobé průchodnosti [25].
Mnohočetné studie a metaanalýzy dokazují mnohem lepší kontrolu nad refrakterním ascitem pomocí TIPS než při velkoobjemových paracentézách. TIPS může převést ascites rezistentní na diuretika na ascites senzitivní na tyto léky. Pomocí obou metod je však dosaženo stejné doby přežívání bez transplantace a doby celkového přežívání. Výskyt encefalopatie je však vyšší u nemocných s TIPS než po paracentézách. Po TIPS dochází ke zlepšení funkce ledvin a k prokazatelnému snížením hladiny sérového kreatininu a urey [42–44].
TIPS je účinná metoda zástavy akutního krvácení z varixů při selhání medikamentózní a endoskopické léčby a měla by být preferována před léčbou chirurgickou. V rámci prevence variceálního krvácení by měla být TIPS prováděna pouze při selhání farmakologické a endoskopické léčby nebo při opětovném krvácení po předchozí skleroterapii. Dále pak u vysoce rizikových nemocných po první atace krvácení při portosystémovém gradientu nad 20 mmHg nebo u nemocných Child-Pugh C a B klasifikace, kteří aktivně krváceli v průběhu gastroskopie [45].
TIPS je rovněž indikována u nemocných s masivní trombózou jaterních žil, u kterých selhala antikoagulační léčba. Velká retrospektivní studie potvrdila přežívání do transplantace u 88 % nemocných v jednom roce a u 69 % během deseti let. U těchto nemocných s hyperkoagulačním stavem bylo dosaženo lepší průchodnosti TIPS, jestliže byl použit dedikovaný stentgraft [46].
Komplikace
Mortalita a morbidita po TIPS je výrazně nižší než po chirurgicky vytvořených spojkách, fatální komplikace se po TIPS vyskytují v 1,7 % (0,6–4,3 %). Výskyt komplikací je v nepřímé úměře s počtem provedených výkonů v daném centru [47]. Fatální periprocedurální komplikace zahrnují intraperitoneální krvácení v důsledku ruptury portální žíly, laceraci jaterní tepny a porušení jaterního pouzdra při punkci [48].
Mezi postprocedurální komplikace a nežádoucí účinky patří zhoršení jaterních funkcí, jejichž známkou je zvýšení sérového bilirubinu; výskyt jaterní encefalopatie [49]; objemové přetížení srdce, které může u nemocných s jaterní cirhózou a preexistující srdeční nedostatečností vyústit v srdeční selhání.
Závěr
Mnohé technické a medicínské pokroky vedly ke zlepšení dlouhodobé průchodnosti TIPS a zvýšení efektivity léčby jaterní encefalopatie. Tyto pokroky mohou v budoucnosti vést k rozšíření indikací k TIPS [50].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24. 2. 2014
Přijato: 17. 3. 2014
prof. MUDr. Antonín Krajina, CSc.
Radiologická klinika
LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
antonin.krajina@fnhk.cz
Zdroje
1. Rösch J, Hanafee WN, Snow H. Transjugular portal venography and radiologic portacaval shunt: an experimental study. Radiology 1969; 92(5): 1112–1114.
2. Richter GM, Palmaz JC, Nöldge G et al. The transjugular intrahepatic portosystemic stent-shunt. A new nonsurgical percutaneous method. Radiologe 1989; 29(8): 406–411.
3. Hůlek P, Krajina A. Current practice of TIPS. Hradec Králové: Olga Štambergová 2001.
4. Krajina A, Hulek P, Fejfar T et al. Quality improvement guidelines for transjugular intrahepatic portosystemic shunt (TIPS). Cardiovasc Intervent Radiol 2012; 35(6): 1295–1300. doi: 10.1007/s00270-012-0493-y.
5. Bureau C, Garcia-Pagan JC, Otal P et al. Improved clinical outcome using polytetrafluoroethylene-coated stents for TIPS: results of a randomized study. Gastroenterology 2004; 126(2): 469–475.
6. Hanafee W, Weiner M. Transjugular percutaneous cholangiography. Radiology 1967; 88(1): 35–39.
7. Rösch J, Hanafee W, Snow H et al. Transjugular intrahepatic portacaval shunt. An experimental work. Am J Surg 1971; 121(5): 588–592.
8. Gutierrez OH, Burgener FA. Production of nonsurgical portosystemic venous shunts in dogs by transjugular approach. Radiology 1979; 130(2): 507–509.
9. Reich M, Olumide F, Jorgensen E et al. Experimental cryoprobe production of intrahepatic portocaval shunt. J Surg Res 1977; 23 : 14–18.
10. Burgener FA, Gutierrez OH. Production of an intrahepatic portocaval fistula in the dog with liver cirrhosis and portal hypertension. Rofo 1984; 141(3): 327–332.
11. Colapinto RF, Stronell RD, Birch SJ et al. Creation of an intrahepatic portosystemic shunt with a Grüntzig balloon catheter. Can Med Assoc J 1982; 126(3): 267–268.
12. Burgener FA, Gutierrez OH. Experimental intrahepatic portocaval shunts created in portal hypertension by balloon angioplasty catheters. Invest Radiol 1988; 23(1): 24–29.
13. Colapinto RF, Stronell RD, Gildiner M et al. Formation of intrahepatic portosystemic shunts using a balloon dilation catheter: preliminary clinical experience. Am J Roentgenol 1983; 140(4): 709–714.
14. Gordon JD, Colapinto RF, Abecassis M et al. Transjugular intrahepatic portosystemic shunt: a nonoperative approach to life-threatening variceal bleeding. Can J Surg 1987; 30(1): 45–49.
15. Palmaz JC, Sibbitt RR, Reuter SR et al. Expandable intrahepatic portacaval shunt stent: early experience in the dog. Am J Roentgenol 1985; 145(4): 821–825.
16. Palmaz JC, Garcia F, Sibbitt RR et al. Expandable intrahepatic portacaval shunt stents in dogs with chronic portal hypertension. Am J Roentgenol 1986; 147(6): 1251–1254.
17. Rösch J, Uchida BT, Putnam JS et al. Experimental intahepatic portacaval anastomosis: use of expandable Gianturco stents. Radiology 1987; 162(2): 481–485.
18. Krajina A, Hůlek P, Eliáš P et al. Transjugulární intrahepatický portosystémový zkrat. Cor Vasa 1993; 35(4): 157–161.
19. Krajina A. Dvacetiletá historie TIPS v Hradci Králové. Ces Radiol 2013; 67(2): 105–108.
20. Krajina A, Hůlek P, Eliáš P et al. Transjugulární intrahepatální portosystémový zkrat (TIPS) při léčbě symptomatické portální hypertenze. Čas Lék Čes 1996; 135(18): 584–588.
21. Zizka J, Eliás P, Krajina A et al. Value of Doppler sonography in revealing transjugular intrahepatic portosystemic shunt malfunction: a 5-year experience in 216 patients. Am J Roentgenol 2000; 175(1): 141–148.
22. Krajina A, Lojik M, Chovanec V et al. Wedged hepatic venography for targeting the portal vein during TIPS: comparison of carbon dioxide and iodinated contrast agents. Cardiovasc Intervent Radiol 2002; 25(3): 171–175.
23. Pozler O, Krajina A, Vanicek H et al. Transjugular intrahepatic portosystemic shunt in five children with cystic fibrosis: long-term results. Hepatogastroenterology 2003; 50(52): 1111–1114.
24. Krajina A, Lojik M, Chovanec V et al. Stent-grafts in TIPS. Abdom Imaging 2004; 29(1): 53–59.
25. Jirkovsky V, Fejfar T, Safka V et al. Influence of the secondary deployment of expanded polytetrafluoroethylene-covered stent grafts on maintenance of transjugular intrahepatic portosystemic shunt patency. J Vasc Interv Radiol 2011; 22(1): 55–60. doi: 10.1016/j.jvir.2010.09.016.
26. Fejfar T, Šafka V, Hůlek P et al. MELD skóre v predikci časné mortality u nemocných s refrakterním ascitem léčených pomocí TIPS. Vnitř Lék 2006; 52(9): 771–776.
27. Boyer TD, Haskal ZJ. The role of transjugular intrahepatic portosystemic shunt (TIPS) in the management of portal hypertension: update 2009. Hepatology 2010; 51(1): 306. doi: 10.1002/hep.23383.
28. Runyon BA. Management of adult patients with ascites due to cirrhosis: an update. Hepatology 2009; 49(6): 2087–2107. doi: 10.1002/hep.22853.
29. Harrod-Kim P, Saad WE, Waldman D. Predictors of early mortality after transjugular intrahepatic portosystemic shunt creation for the treatment of refractory ascites. J Vasc Interv Radiol 2006; 17(10): 1605–1610.
30. Strauss RM, Boyer TD. Hepatic hydrothorax. Semin Liver Dis 1997; 17(3): 227–232.
31. Rössle M, Haag K, Ochs A et al. The transjugular intrahepatic portosystemic stent-shunt procedure for variceal bleeding. N Engl J Med 1994; 330(3): 165–171.
32. Renc O, Krajina A, Hůlek P et al. Dlouhodobá průchodnost transjugulární intrahepatální portosystémové spojky (TIPS) u nemocných s trombózou jaterních žil. Ces Radiol 2013; 67(2): 109–120.
33. Senzolo M, Cholongitas E, Davies N et al. Transjugular intrahepatic portosystemic shunt (TIPS), the preferred therapeutic option for Budd Chiari syndrome associated with portal vein thrombosis. Am J Gastroenterol 2006; 101(9): 2163–2164.
34. Lojík M, Krajina A, Vaňásek T et al. Embolizace krvácejících varixů při portální hypertenzi u TIPS – vlastní zkušenosti a literární přehled. Čes Radiol 2002; 56(3): 188–192.
35. Stankovic Z, Frydrychowicz A, Csatari Z et al. MR-based visualization and quantification of three-dimensional flow characteristics in the portal venous system. J Magn Reson Imaging 2010; 32(2): 466–475. doi: 10.1002/jmri.22248.
36. Azoulay D, Castaing D, Dennison A et al. Transjugular intrahepatic portosystemic shunt worsens the hyperdynamic circulatory state of the cirrhotic patient: preliminary report of a prospective study. Hepatology 1994; 19(1): 129–132.
37. Maleux G, Nevens F, Heye S et al. The use of carbon dioxide wedged hepatic venography to identify the portal vein: comparison with direct catheter portography with iodinated contrast medium and analysis of predictive factors influencing level of opacification. J Vasc Interv Radiol 2006; 17(11 Pt 1): 1771–1779.
38. Carr CE, Tuite CM, Soulen MC et al. Role of ultrasound surveillance of transjugular intrahepatic portosystemic shunts in the covered stent era. J Vasc Interv Radiol 2006; 17(8): 1297–1305.
39. Riggio O, Angeloni S, Salvatori FM et al. Incidence, natural history, and risk factors of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt with polytetrafluoroethylene-covered stent grafts. Am J Gastroenterol 2008; 103(11): 2738–2746. doi: 10.1111/j.1572-0241.2008.02102.x.
40. Bass NM, Mullen KD, Sanyal A et al. Rifaximin treatment in hepatic encephalopathy. N Engl J Med 2010; 362(12): 1071–1081. doi: 10.1056/NEJMoa0907893.
41. Rössle M, Siegerstetter V, Euringer W et al. The use of a polytetrafluoroethylene-covered stent graft for transjugular intrahepatic portosystemic shunt (TIPS): long-term follow-up of 100 patients. Acta Radiol 2006; 47(7): 660–666.
42. Rössle M, Ochs A, Gülberg V et al. A comparison of paracentesis and transjugular intrahepatic portosystemic shunting in patients with ascites. N Engl J Med 2000; 342(23): 1701–1707.
43. Salerno F, Camma C, Enea M et al. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology 2007; 133(3): 825–834.
44. Michl P, Gülberg V, Bilzer M et al. Transjugular intrahepatic portosystemic shunt for cirrhosis and ascites: effects in patients with organic functional renal failure. Scand J Gastroenterol 2000; 35(6): 654–658.
45. Garcia-Pagán JC, Caca K, Bureau C et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362(25): 2370–2379. doi: 10.1056/NEJMoa0910102.
46. Garcia-Pagán JC, Heydtmann M, Raffa S et al. TIPS for Budd-Chiari syndrome: long-term results and prognostics factors in 124 patients. Gastroenterology 2008; 135(3): 808–815. doi: 10.1053/j.gastro.2008.05.051.
47. Barton RE, Rösch J, Saxon RR et al. TIPS: short - and long-term results: a survey of 1750 patients. Semin Interv Radiol 1995; 12 : 364–367.
48. Krajina A, Hulek P, Ferko A et al. Extrahepatic portal venous laceration in TIPS treated with stent graft placement. Hepatogastroenterology 1997; 44(15): 667–670.
49. Stefánková J, Hůlek P, Babu A et al. Hepatic encephalopathy due to TIPS – retrospective study. Hepatogastroenterology 2007; 54(74): 480–484.
50. Riggio O, Ridola L, Lucidi C, Angeloni S. Emerging issues in the use of transjugular intrahepatic portosystemic shunt (TIPS) for management of portal hypertension: time to update the guidelines? Dig Liver Dis 2010; 42(7): 462–467. doi: 10.1016/j.dld.2009.11.007.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Správná odpověď na kvízČlánek Projekt RISING STARSČlánek MUDr. Boris Pekárek (1978)Článek OznámeníČlánek OmluvaČlánek Kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Když se ve střevech děje něco nepatřičného...
- Geriatrická křehkost a léčba bolesti
-
Všetky články tohto čísla
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- 1 000 TIPS ve FN Hradec Králové: indikace a přežívání nemocných
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Transjugulární intrahepatální portosytémová spojka v terapii refrakterního ascitu: současný pohled jednoho pracoviště
- Dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky – diagnostika dysfunkce zkratu a možnosti intervence
- Transplantace jater pro hepatocelulární karcinom, dlouhodobé přežití a faktory ovlivňující rekurenci tumoru (zkušenosti jednoho centra)
- Využití EUS navigované choledochoduodenostomie v léčbě biliární obstrukce
- Hereditárny angioedém ako príčina bolestí brucha
- Malígny melanóm konečníka – zriedkavá kazuistika a prehľad literatúry
- Moderní diagnostika Lynchova syndromu
- Správná odpověď na kvíz
- Diskusia k príspevku „Moderní diagnostika Lynchova syndromu“
- Projekt RISING STARS
- doc. MUDr. Jan Martínek, Ph.D., AGAF (1969)
- MUDr. Ondřej Ryska, Ph.D. (1981)
- MUDr. Sylvia Dražilová (1972)
- MUDr. Boris Pekárek (1978)
- EUS workshop v Jablonci nad Nisou
- 13th Czech-Slovak IBD symposium
- 9th Congress of ECCO, Copenhagen, Denmark
- Oznámení
- Omluva
- Nový člen výkonné redakční rady
- Remsima™ – první biosimilární infliximab
- Autodidaktický test: hepatologie
- Hepatologie nejen z Hradce Králové
- Kvíz
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- doc. MUDr. Jan Martínek, Ph.D., AGAF (1969)
- MUDr. Sylvia Dražilová (1972)
- MUDr. Ondřej Ryska, Ph.D. (1981)
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy









