-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mikrobiálne sekundárne metabolity ako inhibítory farmaceuticky významných oxidoreduktáz a transferáz
Microbial secondary metabolites as inhibitors of pharmaceutically important transferases and oxidoreductases
Microorganisms are known for their production of an enormous variety of biologically active secondary metabolites including antibiotics, immunosuppressants and anticancer agents. These compounds have many important biological activities used in the clinical practice in drug treatment of cancer, inflammatory, autoimmune diseases and metabolic disorders. The science and medicine research have been yielded hundreds items of useful knowledge in the therapy of many serious human diseases caused by pathophysiological mechanisms of enzymes. Many substances were discovered already in the last century, but the research of their potential and various modifications improving their prospects of therapeutic use still continues. The new knowledge about mechanisms of the action and enzyme inhibitors in the field of enzymology gives space in drug discovery and development of safer and more effective pharmacotherapy.
Keywords:
secondary metabolites, microbial producers, enzyme inhibitors, pathophysiology of enzyme reactions
Autoři: Eva Buchtová; Mária Šturdíková
Působiště autorů: Slovenská technická univerzita, Ústav biotechnológie a potravinárstva, Fakulta chemickej a potravinárskej technológie
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 107-114
Kategorie: Přehledy a odborná sdělení
Souhrn
Mikroorganizmy sú známe svojou schopnosťou produkovať bioaktívne sekundárne metabolity, ktoré sa často využívajú v klinickej praxi nielen ako antibiotiká. Tieto zlúčeniny sa vyznačujú mnohými biologickými aktivitami, dôležitými v terapii nádorových chorôb, zápalových ochorení, autoimunitných a metabolických porúch. Veda a medicínske výskumy priniesli veľa nových a užitočných poznatkov z oblasti terapie závažných chorôb spôsobených patofyziologickou aktivitou niektorých enzýmov, čo sa ako súčasná problematika neustále študuje mnohými výskumnými vedeckými odborníkmi. Veľa látok bolo objavených ešte v minulom storočí, avšak ich potenciál a rôzne modifikácie zlepšujúce ich perspektívu na terapeutické využitie neustále pokračuje. Nové poznatky v oblasti enzymológie o enzýmových inhibítoroch a mechanizmoch účinkov dávajú priestor na objavy nových farmakoterapeutík, ktoré budú účinnejšie a menej toxické.
Kľúčové slová:
sekundárne metabolity, mikrobiálni producenti, enzýmové inhibítory, patofyziológia enzýmových reakciíÚvod
Mikroorganizmy tvoria antibiotiká ako takzvané sekundárne metabolity. Sú to produkty ich metabolizmu, ktoré nie sú nepostrádateľné pre rast a reprodukciu bunky, zato môžu potláčať rast konkurenčných mikroorganizmov. Sekundárne metabolity sú prírodné látky rastlinného alebo mikrobiálneho pôvodu. Majú komplexnú chemickú štruktúru (alkaloidy, pigmenty, toxíny), sú špecifické pre jednotlivé druhy organizmov a na rozdiel od primárnych metabolitov sa syntetizujú len v určitej fáze životného cyklu bunky po vytvorení signálnych molekúl, ktoré špecificky regulujú ich tvorbu. Významnou aplikáciou niektorých sekundárnych metabolitov je inhibícia enzýmových aktivít, ktorá má značný praktický význam. Použitie inhibítorov patrí medzi najdôležitejšie diagnostické metódy enzymológie. Poskytuje nielen dôležité údaje o špecificite enzýmov, architektúre aktívneho miesta a mechanizme účinku, ale zohráva aj významnú úlohu pri identifikácii intermediátov rôznych metabolických dráh. Inhibítory ďalej umožňujú zasahovať do látkovej premeny organizmov, preto nachádzajú široké uplatnenie v medicíne a hygiene v boji proti infekciám (sulfónamidy), zhubnému bujneniu buniek (cytostatiká), pri transplantáciach (imunosupresíva tlmiace imunitný systém) i v poľnohospodárstve (herbicídy, insekticídy). Veda a vývoj nových liečiv umožnili objav nových terapeutických cieľov, biologických mechanizmov účinku liekov a chemických látok, ktoré sú vhodné na klinické použitie. Poruchy regulácie enzýmových aktivít kináz, fosfatáz, peptidáz a mnohých ďalších enzýmov vyvolávajú veľa závažných chorôb, a preto je dôležitý neustály výskum, hlbšie pochopenie enzymológie a jej praktické aplikácie v medicíne. V tomto článku sme sa zamerali na mikrobiálne produkované inhibítory vybraných medicínsky dôležitých oxidoreduktáz a transferáz.
Mikrobiálne produkované inhibítory oxidoreduktáz
Oxidoreduktázy zabezpečujú v ľudskom organizme mnohé významné reakcie, ich nesprávne funkcie môžu spôsobiť poruchy metabolizmu a následné závažné zdravotné komplikácie. Medzi medicínsky významné oxidoreduktázy patria lipoxygenázy, hydroxymetylglutaryl-koenzým A-reduktáza, aldózareduktáza a i., ktorých nesprávne regulácie aktivít zapríčiňujú vznik závažných humánnych chorôb, ako sú napríklad ateroskleróza, kardiovaskulárne a cerebrovaskulárne choroby, alergie či metabolické poruchy1, 2 ).
Inhibítory aldózareduktázy
Väčšina pacientov s diabetom trpí dlhodobými komplikáciami ako sú neuropatia, nefropatia, retinopatia a šedý zákal3). Tieto komplikácie sú zapríčinené chronickou hyperglykémiou, ktorá spôsobuje poškodenie ciev, periférnych nervov a tým značne zvyšuje riziko srdcového infarktu. Vedci nachádzajú stále viac súvislostí medzi polyolovou glukózovou metabolickou dráhou a vyššie uvedenými dlhodobými komplikáciami. Aldózareduktáza (EC 1.1.1.21) je prvým enzýmom polyolovej dráhy a katalyzuje premenu glukózy na sorbitol za prítomnosti kofaktorového systému NADP/NADPH (nikotínamidadeníndinukleotidfosfát a jeho redukovaná forma). Sorbitol sa môže akumulovať v bunkách a následne aj fruktóza prostredníctvom sorbitoldehydrogenázy (EC 1.1.1.14)4). Hladina myoinozitolu v periférnych nervoch naopak klesá, a dochádza tak k disbalancii NADP/NADPH systému. Preto sa v posledných desaťročiach dostávajú do pozornosti farmaceutických spoločností špecifické enzýmy tejto metabolickej dráhy a vývoj nových inhibítorov2). 8-Hydroxydaidzeín (obr. 1) bol purifikovaný z metanolického extraktu kultúry Aspergillus sp. HK-388 izolovanej z pôdy v blízkosti japonského mesta Osaka. Tento izoflavonoid má disociačnú konštantu (Ki) 7 μmol.l-1 a je to nekompetitívny inhibítor enzýmu aldózareduktázy5). Testy na bunkovej línii myšacieho myelómu (B16) potvrdili, že tento inhibítor účinne blokuje aj aktivitu tyrozinázy (EC 1.14.18.1) IC50 10,54 μmol.l-1 a melanogenézu IC50 6,17 μmol.l-1. Depigmentácia bola 10-krát účinnejšia než pri použití štandardnej látky (kyselina kójová) v bunkovom systéme6). Citrinín (obr. 1) bol izolovaný z kultivačného média kultúr vláknitých húb rodov Penicillium, Aspergillus a Monascus7). Tento fungálny mykotoxín a jeho hydroxyderiváty mali významné inhibičné aktivity na enzým aldózareduktázu IC50 < 10 μmol.l-1. Kinetické štúdie vyvrátili predpoklad, že citrinín je ireverzibilný inhibítor, čo sa usudzovalo na základe jeho chemickej štruktúry, avšak kvôli jeho vysokej nefrotoxicite nebol nikdy uvedený do klinickej praxe8, 9). Devi a spol.10) izolovali citrinín z kultúry Penicillium chrysogenum MTCC 5108 a testovali jeho antimikrobiálnu aktivitu. Spektrum antimikrobiálnych účinkov citrinínu zahŕňalo niektoré gram-pozitívne (Staphylococcus aureus), gram-negatívne baktérie (Pseudomonas aeruginosa, Shigella flexneri, Vibrio cholerae) a aj vláknité huby (najmä Fusarium sp.). Aktinomycéty Streptomyces diannanensis izolavané z pôdy v čínskej provincii Yunnan produkovali dva ramnopyranozidy N99-596 A a N99-596 B (obr. 1) s inhibičnými účinkami na enzým aldózareduktázu (IC50 (N99-596 A) 170 μmol.l-1, IC50 (N99-596 B) 165 μmol.l-1)11). Prehľad vybraných mikrobiálnych metabolitov vyznačujúcich sa inhibičným účinkom na aldózareduktázu a ich hodnoty IC50 sú sumarizované v tabuľke 1.
Obr. 1. Chemické štruktúry mikrobiálne produkovaných inhibítorov oxidoreduktáz 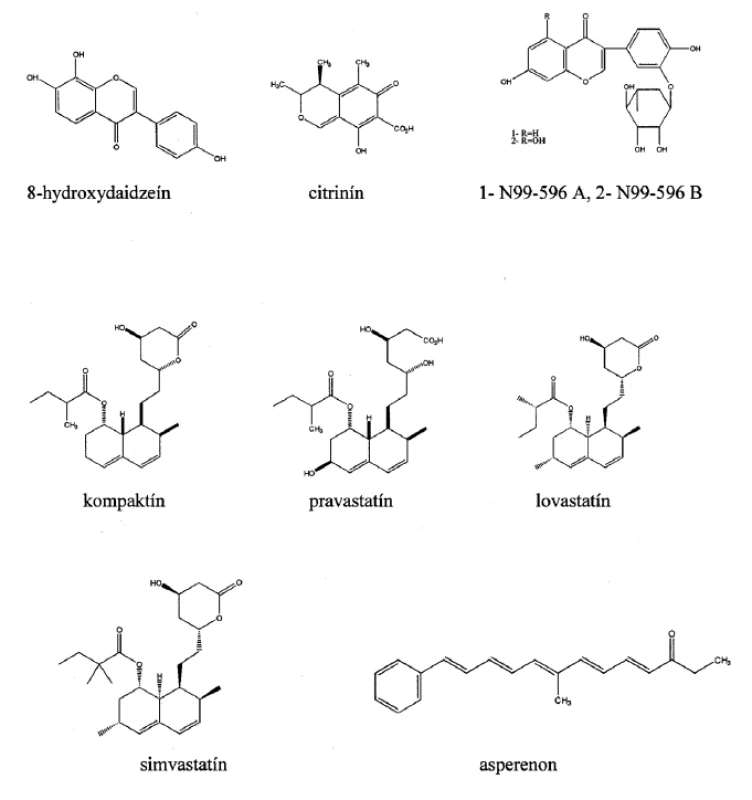
Tab. 1. Mikrobiálne metabolity s inhibičným účinkom na aldózareduktázu 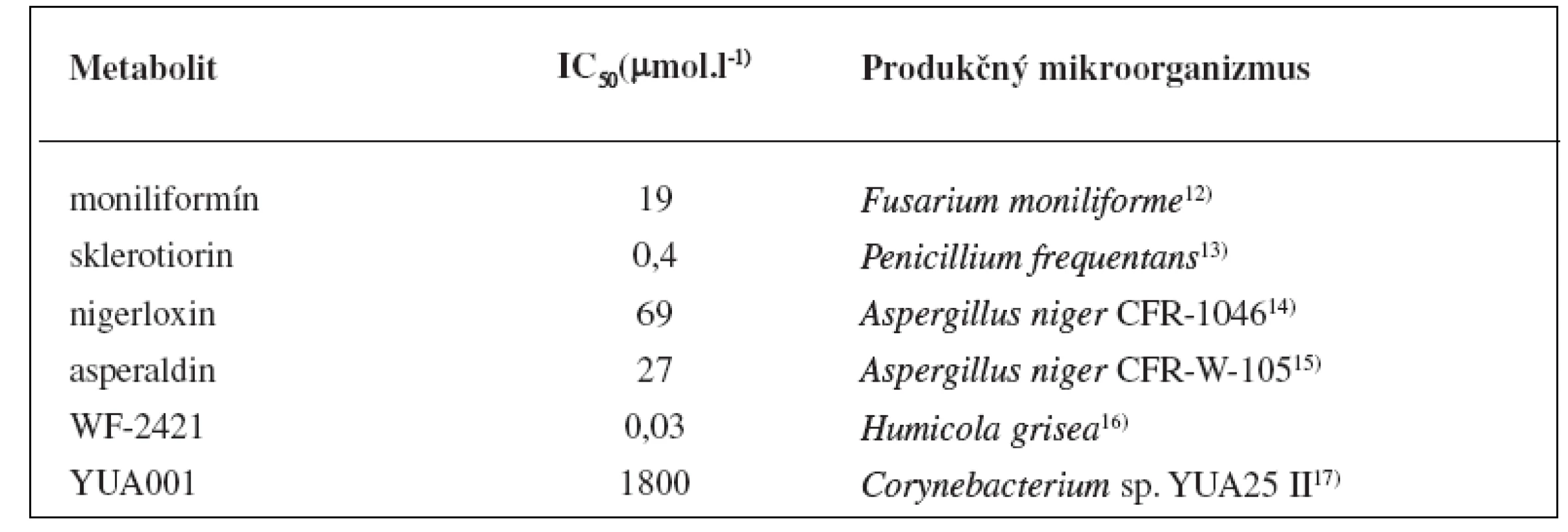
Inhibítory hydroxymetylglutaryl-koenzým A - reduktázy
Hydroxymetylglutaryl-koenzým A-reduktáza (HMG-CoA-reduktáza) (EC 1.1.1.34) katalyzuje premenu hydroxymetylglutaryl-koenzýmu A na kyselinu mevalónovú, ktorá je intermediátom de novo biosyntézy cholesterolu, koenzýmu Q10 a dolicholu, ktorej predchádza mnoho ďalších enzymatických reakcií a medziproduktov ako sú napríklad farnezylpyrofosfát a geranylgeranylpyrofosfát18). Okrem fyziologickej funkcie regulovať hladinu cholesterolu v krvi sa HMG-CoA-reduktáza stala terčovým enzýmom vo vývoji nových liečiv na terapiu niektorých civilizačných chorôb. Nízkomolekulové zlúčeniny zahŕňajúce mikrobiálne sekundárne metabolity, ale aj syntetické inhibítory HMG-CoA-reduktázy sa súhrnne nazývajú statíny. Statíny efektívne redukujú hladinu LDL cholesterolu v krvnej plazme a vykazujú pleiotropný efekt na cievny systém, preto majú široké využitie v prevencii a liečbe hypercholesterolémie, aterosklerózy, kardiovaskulárnych a cerebrovaskulárnych chorôb19). Súčasné štúdie poukazujú aj na súvislosť medzi statínmi a znižovaním úrovne proliferácie určitých typov nádorových buniek v dôsledku inhibície syntézy geranylgeranylpyrofosfátu a farnezylpyrofosfátu, ktorá narúša metabolické dráhy potrebné na prežitie nádorových buniek a spôsobí ich apoptózu20). Kompaktín (mevastatín) (obr. 1) bol izolovaný z kultúry Penicillium brevicompactum v priebehu submerznej fermentácie a ako kompetitívny inhibítor HMG-CoA-reduktázy ovplyvňuje biosyntézu cholesterolu. Štruktúrne patrí kompaktín do skupiny polyketidov a jeho hydroxylový derivát pravastatín (obr. 1), ktorý sa indikuje na liečbu aterosklerózy, je získavaný biotransformáciou mikroorganizmom Streptomyces carbophilus21). Komerčne sa tento fungálny metabolit syntetizuje použitím kmeňov Penicillium citrinum, Penicillium cyclopium a Aspergillus terreus, prípadne ich geneticky upravených mutantov22). Lovastatín (mevinolín) (obr. 1) je reverzibilný kompetitívny inhibítor enzýmu hydroxymetylglutaryl-koenzým A-reduktázy, ktorý má medicínske využitie nielen u pacientov s vysokými hladinami cholesterolu. Medzi aplikácie tohto inhibítora v klinickej praxi patrí aj liečba fraktúr, obličkových a malígnych chorôb23–25). Pre jeho protizápalové a imunomodulačné účinky bol testovaný ako liečivo neurologických chorôb, zapríčinených nekompetentnou imunitnou odpoveďou organizmu26). Komerčne sa lovastatín syntetizuje prostredníctvom fermentácií kultúr Penicillium species, Monascus ruber, Aspergillus terreus27) a je distribuovaný pod obchodným názvom Mevacor® (Merck & Co., Inc). Deacetyláciou mevinolínu prostredníctvom esterovej hydrolýzy a reesterifikácie sa vyrába simvastatín (obr. 1), semi-syntetický statín, známy pod obchodným názvom Zocor™ (Merck & Co., Inc), ktorý má okrem znižovania hladiny cholesterolu aj neuroprotektívne účinky28, 29).
Inhibítory lipoxygenáz
Lipoxygenázy (LOX) (EC 1.13.11) sú predmetom intenzívneho výskumu predovšetkým v živočíšnych systémoch. Premenou kyseliny arachidónovej na kyselinu hydroperoxyeikozatetraénovú katalyzujú živočíšne LOX prvý krok v syntéze regulačných molekúl – lipoxínov a leukotriénov dôležitých v niekoľkých fyziologických procesoch, napr. v zápalovej odpovedi charakteristickej pre alergické prejavy, ako sú astma, artritída, v chemotaktickej a mitogénnej odpovedi v bunkách hladkých svalov obehového systému1). Inhibítory 5 lipoxygenázy (EC 1.13.11.34) sú potenciálne liečivá astmatických a zápalových chorôb. Enzýmy 12-LOX (EC 1.13.11.31) a 15-LOX (EC 1.13.11.33) sú terapeutickým cieľom pre inhibítory v súvislosti s liečbou aterosklerózy a nádorových chorôb30, 31). Asperenon (obr. 1) bol prvýkrát izolovaný Jeffersonom32) a nezávisle druhým výskumným tímom Yu a spol.33) z kultúry Aspergillus niger, neskôr sa extrahoval aj z rastliny Phellinus pini ako metabolit s preukázanou antifungálnou aktivitou proti patogénnym hubám Ophiostoma crassivaginatum a Ophiostoma piliferum34). Rao a spol.35) izoloval tento mikrobiálny metabolit z kultúry Aspergillus niger CFTRI 1105, ktorý vykazoval inhibičnú aktivitu proti 15-lipoxygenáze izolovanej zo sóje s hodnotou IC50 0,3 μmol.l-1 a proti agregácii ľudských krvných doštičiek IC50 0,23 μmol.l-1. Tieto hodnoty boli porovnané s hodnotami inhibičnej aktivity štandardného inhibítora LOX-1 (kyselina kávová, IC50 0,2 μmol.l 1) a agregácie trombocytov (kyselina acetylsalicylová, IC50 0,19 μmol.l-1). Chidananda a spol.36) uskutočnili aj ďalšie experimenty zamerané na zvýšenie produkcie asperenonu pomocou kmeňa Aspergillus niger CFTRI 1105. Vláknitú hubu vystavili ultrafialovému žiareniu a pôsobeniu kyseliny dusitej. Maximálny výťažok 60,3 mg/g biomasy produkoval mutant II N 31, ktorý zvýšil produkciu až 670-krát oproti kontrolnému kmeňu bez mutácie.
Sklerotiorin bol získaný z kultivačného média vláknitej huby Penicillium frequentans ako účinný reverzibilný akompetitívny inhibítor lipoxygenázy-1 (EC 1.13.11.12) izolovanej zo sóje, s hodnotou strednej inhibičnej koncentrácie IC50 4,2 μmol.l-1. Táto zlúčenina vykazovala aj antioxidačné aktivity, takže sklerotiorin mohol inhibovať LOX dvomi spôsobmi. Prvým spôsobom bola interakcia s komplexom enzým-substrát a druhým ako antioxidant mohol vychytávať voľné radikály medziproduktov vznikajúcich pri enzýmovej reakcii37). Optimalizáciou zloženia fermentačných médii sa dosiahlo výrazné zvýšenie (54-krát) produkcie sklerotiorinu kmeňom Penicillium sclerotiorum. Maximálny výťažok 313 mg.l-1 kultivačného média sa dosiahol v dextrózopeptónovom médiu obohatenom minerálnymi soľami38).
Nigerloxin bol izolovaný z kultúry Aspergillus niger ako metabolit s inhibičnými aktivitami proti lipoxygenáze-1 (IC50 79 μmol.l-1) a aldózareduktáze so schopnosťou vychytávať voľné radikály39). V rokoch 2007 a 2009 sa uskutočnili úspešné experimenty zamerané na optimalizáciu kultivačných polosuchých médií kultúry Aspergillus niger Van Thieghem40, 41).
Mikrobiálne produkované inhibítory transferáz
Medzi najznámejšie transferázy študované v súvislosti s ich nežiadúcimi aktivitami patria reverzné transkriptázy vírusov, ktoré sa spájajú so vznikom vírusových a onkogénnych chorôb42) a kinázy, regulujúce aktivitu ďalších bielkovín, čím nepriamo ovplyvňujú aj činnosť buniek. Kinázy hrajú dôležitú úlohu v mnohých vnútrobunkových signálnych dráhach, vrátane tých, ktoré riadia rast a delenie buniek, preto sú dôležitými cieľovými molekulami vo vývoji nových protinádorových liečiv43).
Inhibítory reverznej transkriptázy
Správna funkcia reverznej transkriptázy (RT) (EC 2.7.7.49) je nepostrádateľná pre životný cyklus retrovírusov. Reverzné transkriptázy vtáčieho myeloblastického vírusu (AMV) a vírusu ľudskej imunodeficiencie (HIV-1) sú heterodiméry zložené z dvoch neidentických monomérnych podjednotiek. Sú to multifunkčné enzýmy, ktoré majú aktivity RNA - a DNA-dependentnej DNA polymerázy a ribonukleázy H44). V súčasnej dobe sa na terapiu HIV-1 infekcie používajú dve triedy syntetických RT inhibítorov: nukleozidové inhibítory RT (napr. zidovudín, lamivudín), ktoré sa viažu priamo na aktívne miesto enzýmu a po inkorporácii do novosyntetizovanej DNA ukončia ďalšiu syntézu a nenukleozidové inhibítory RT (napr. efavirenz, nevirapín), ktoré sa viažu na alosterické miesto polymerázy45). Špecifické blokátory týchto enzýmov predstavujú sľubných kandidátov na terapiu retrovírusových chorôb, avšak kvôli jeho genetickej diverzite, spôsobenej vysokou frekvenciou chýb pri transkripcii vírusového genómu je potrebný neustály výskum a vývoj nových účinných inhibítorov42).
Paromomycín (obr. 2) s pôvodným názvom aminocidín bol prvýkrát izolovaný z filtrátov Streptomyces krestomuceticus. Patrí do skupiny aminoglykozidových antibiotík a jeho spektrum účinku zahŕňa väčšinu gram-negatívnych a mnoho gram-pozitívnych baktérií. Neobvyklosťou je, že je účinný aj proti protozoám a pásomniciam. Jeho inhibičné účinky na reverznú transkriptázu vtáčieho myeloblastického vírusu popísal ako prvý Demain a spol.46). Vo forme masti sa používa na liečbu kožnej leišmaniózy, ale jeho užívanie sa môže spájať s viacerými nežiadúcimi účinkami, medzi ktoré často patria napríklad poruchy obličiek, dehydratácia alebo ototoxicita47).
Obr. 2. Chemické štruktúry mikrobiálne produkovaných inhibítorov transferáz 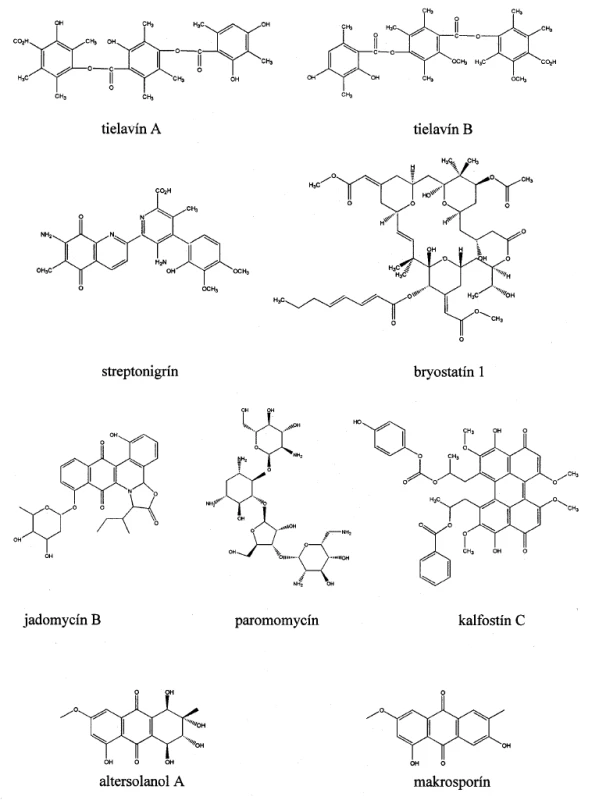
Thielavíny sú fungálne metabolity izolované z neidentifikovanej vláknitej huby MST-FP188848) a inhibujú AMV-RT46). Thielavín A (obr. 2) bol pôvodne izolovaný ako inhibítor biosyntézy prostaglandínov a sú preukázané aj jeho inhibičné účinky na enzým glukózo-6-fosfatázu (EC 3.1.3.9)49). Štruktúrne veľmi podobný thielavín B (obr. 2) pôsobí inhibične na membránovú transglykozyláciu50) a telomerázu51).
História objavu streptonigrínu (obr. 2) siaha do roku 1959, kedy bola popísaná izolácia tmavohnedého kryštalického metabolitu z kultúry Streptomyces flocculus52). Neskôr sa identická látka získala z kultúr Streptomyces rufochromogenes, Streptomyces chinatues53), Actinomyces albus var. Bruneomycini54) a bola pomenovaná ako rufochromomycín a bruneomycín. Spoločný názov týchto metabolitov - streptonigrín sa zjednotil v roku 196855). Vzhľadom na jeho široké antivírusové a antibakteriálne účinky sa čoskoro streptonigrín dostal do pozornosti farmaceutického priemyslu. Okrem toho sa zistila aj jeho vysoká protinádorová aktivita na niektoré zvieracie a ľudské bunkové línie, avšak kvôli jeho vysokej toxicite spôsobujúcej závažné nežiaduce účinky má len veľmi obmedzené použitie v klinickej praxi56). Napriek tomu toto antibiotikum inšpirovalo svojím mechanizmom účinku a chemickou štruktúrou mnoho organických chemikov, farmakológov a fyzikov. V posledných rokoch sa podarilo streptonigrín izolovať aj z ďalších aktinomycét rodu Kitasatospora57).
Inibítory proteín-kinázy C
Proteín-kináza C (PKC) (EC 2.7.11.13) patrí do skupiny serín/treonín-proteínových kináz, ktoré sa podieľajú na riadení funkcií ďalších proteínov prostredníctvom fosforylácie hydroxylových skupín serínových a treonínových zvyškov. Aktivácia sa realizuje pomocou zvýšenej koncentrácie diacylglycerolu a vápnikových katiónov. Izoenzýmy proteín-kinázy C regulujú signálne dráhy proliferácie buniek, metastáz a rezistencie nádorových buniek proti cytostatikám. Zvýšené aktivity PKC boli popísané v súvislosti s nádorovými chorobami prsníkov, žalúdka a mozgového tkaniva58, 59). Veľa súčasných štúdií inhibítorov týchto transferáz bolo zameraných na bližšiu charakterizáciu a mechanizmy účinku indolkarbazolov (napr. staurosporín), ktorých cieľovým miestom na PKC je väzbové miesto pre ATP. Preštudované boli aj mechanizmy makrocyklických laktónov (napr. bryostatín) – antagonistov PKC, ktoré stimulujú degradáciu PKC sprostredkovanú ubiqitínom. Avšak napriek povzbudivým predklinickým testom boli zatiaľ výsledky klinických štúdií sklamaním pravdepodobne kvôli vysokému počtu funkčne odlišných izoenzýmov PKC a nedostatočnej špecificite skúmaných inhibítorov60, 61).
Fungálny metabolit s preukázanou inhibičnou aktivitou na PKC – kalfostín C (obr. 2) bol izolovaný japonským výskumným tímom Kobayashi a spol.62) z kultúry kmeňa Cladosporium cladosporioides. Inhibičná aktivita striktne závisí na fotoexcitácii, ktorá zapríčiní ireverzibilné modifikácie špecifických oblastí PKC. Tieto zistenia vyvolali nádej, že kalfostín C by mohol byť užitočným prostriedkom na fotodynamickú terapiu nádorových chorôb. Zatiaľ sú však dostupné len výsledky predklinických štúdií, ktoré preukázali, že tento inhibítor môže vyvolať apoptózu v širokom spektre ľudských línií nádorových buniek vrátane gliómu, karcinómu krčka maternice, nosohltanu, prostaty a lymfatickej leukémie63, 64). V odbornej literatúre je popísaný aj iný mechanizmus účinku tejto látky, ktorý nezávisí na inhibícii PKC. Napríklad kalfostín C inhibuje fosfolipázu D (EC 3.1.4.4) a v koncentráciách, ktoré spúšťajú apoptózu, môže zapríčiniť zvýšenie reaktívnych foriem kyslíka, oxidáciu a degradáciu lamínu B (po rozdelení bunky, ukotvuje chromozómy v jadrovej membráne a udržiava s ostatnými proteínmi celkový tvar jadra), poškodenie Golgiho membrán, inhibíciu endocytózy a mobilizáciu vápnika z vnútrobunkových zásob. Ďalšie štúdie na nádorovej bunkovej línii z prsníkov (MCF-7) naznačujú, že inhibítor môže ničiť nádorové bunky iným, novým mechanizmom v súvislosti s akumuláciou cytoplazmatických vakuol neznámeho pôvodu61, 65).
Bryostatíny sú skupinou štruktúrne podobných cyklických polyketidov, pôvodne izolovaných z morskej machovky Bugula neritina. Pretože výťažky týchto bioaktívnych metabolitov boli veľmi nízke, Trindade-Silva a spol.66) sa zamerali na štúdium symbiotických mikroorganizmov Candidatus Endobugula sertula, ktoré obsahujú skupinu génov produkujúcich bryostatíny s ochranným účinkom na larvy machovky pred predátormi. V súčasnosti prebiehajú genetické štúdie symbiotických baktérií a kultivácie týchto zaujímavých morských mikroorganizmov pre ich biotechnologické využitie, zatiaľ však neúspešne. Najviac preskúmaný je bryostatín 1 (obr. 2), ktorý má unikátne spektrum biologických účinkov na niekoľko druhov nádorových chorôb vrátane modulácie apoptických procesov a stimulácie imunitného systému. Na základe predbežných výsledkov prebiehajúcich klinických štúdií bryostatín a jeho analógy sú sľubnými kandidátmi na liečivá proti nádorovým chorobám, pričom nezanedbateľným faktom je aj mimoriadne nízka dávka (cca 50 μg/m2) potrebná na osemtýždňový klinický cyklus. Jeho aktivity majú významný potenciál aj ako liečivá vírusových a neurodegeneratívnych chorôb67).
Inhibítory aurora B-kinázy
Aurora B-kináza (EC 2.7.11.1) je súčasťou skupiny serín/treonín-proteínových kináz, ktoré sa vyskytujú v živočíšnych bunkách a reguluje presun chromozomálneho komplexu počas mitózy fosforyláciou H3 histónu na serínovom zvyšku proteínov za účasti ostatných regulačných molekúl. Zvýšená hladina aurora B-kinázy bola pozorovaná v širšom spektre nádoroých buniek vrátane nádorov prsníka, pankreasu, vaječníkov a tráviaceho traktu. Táto kináza je zodpovedná za správnu funkciu mikrotubulov, vyrovnanie, segregáciu chromozómov a je aktívna len počas mitózy, čím sa stala perspektívnou cieľovou molekulou vo vývoji nových protinádorových liečiv68).
Ayer a spol.69) izoloval sekundárny metabolit jadomycín B (obr. 2) z kultúry kmeňa Streptomyces venezuelae ISP5230. Táto polyketidová zlúčenina obsahovala nezvyčaný atóm dusíka začlenený do pentacyklickej štruktúry pravdepodobne pochádzajúci z izoleucínu. Jadomycín B indukoval apoptózu už pri koncentrácii 5 μg.ml-1 bez zjavného zásahu do bunkového cyklu a bez tvorby polyploidných buniek. Výsledky testov potvrdili inhibíciu proliferácie v týchto nádorových bunových líniách: HepG2 (z pečene), H460 (z pľúc), IM-9 a IM 9/Bcl-2 (z lymfoblastov). Hodnota disociačnej konštanty (Ki) tejto látky pre aurora B-kinázu je 6,8 μmol.l 1 a zaraďuje sa medzi nezvyčajné angucyklínové antibiotiká s antibakteriálnymi účinkami na kmene Staphylococcus epidermidis C621 a Staphylococcus aureus C623 (MRSA - Staphylococcus aureus rezistentný na meticilín)70, 71).
Altersolanol A (obr. 2) a makrosporín (obr. 2) sú sekundárne metabolity endofytickej huby Stemphylium botryosum izolovanej z listov farmaceutickej rastliny Chenopodium album. Tieto inhibítory aurora B-kinázy majú hodnotu EC50 2,2 μmol.l-1. Aly a spol.72) testovali ich cytotoxické aktivity na bunkovej línii myšacieho lymfómu L5178Y, pričom altersolanol A mal účinnejší inhibičný efekt na proliferáciu týchto buniek (EC50 0,6 μmol.l-1) než makrosporín.
Záver
Príroda je od nepamäti nepostrádateľným zdrojom liečivých prostriedkov a látok s pozitívnym účinkom na ľudský organizmus. Mikroorganizmy a rastliny sú známe svojou produkciou sekundárnych metabolitov, často využívaných v medicíne, farmaceutickom priemysle a poľnohospodárstve. Mikrobiálna produkcia metabolitov je efektívnejší a ekologickejší spôsob získavania týchto terapeuticky zaujímavých produktov ako je ich izolácia z rastlinných zdrojov. Bioaktívne zlúčeniny sa zvyčajne tvoria v zmesi štruktúrne podobných nízkomolekulových látok v procese sekundárneho metabolizmu a často sa vyznačujú antibakteriálnymi, antifungálnymi, imunosupresívnymi, protizápalovými alebo cytotoxickými aktivitami. Nezanedbateľným účinkom je aj enzým-inhibičná aktivita, ktorá sa uplatňuje v terapii závažných humánnych chorôb a metabolických porúch. Praktický výskum, hlbšie pochopenie enzymológie a štúdium mechanizmov účinku inhibítorov umožní objav nových účinných farmakoterapeutík s významnými aplikáciami v klinickej praxi.
Konflikt záujmu: žiadny.
Došlo 13. apríla 2012 / Prijato 9. mája 2012
Ing. Eva Buchtová, M. Šturdíková
Slovenská technická univerzita, Ústav biotechnológie a potravinárstva, Fakulta chemickej a potravinárskej technológie
Radlinského 9, 812 37 Bratislava, Slovenská republika
e-mail: eva.buchtova@gmail.com
Zdroje
1. Holková I., Bezáková L., Vanko M., Bilka F., Obložinský M.: Lipoxygenázy a ich význam v biochemických procesoch v rastlinných organizmoch. Chem. Listy 2009; 103, 475–495.
2. Chen X., Yang Y., Ma B., Zhang S., He M., Gui D., Hussain S., Jing Ch., Zhu Ch., Yu Q., Liu Y.: Design and synthesis of potent and selective aldose reductase inhibitors based on pyridylthiadiazine scaffold. Eur. J. Med. Chem. 2011; 46, 1536–1544.
3. Alexiou P., Pegklidou K., Chatzopoulou M., Nicolaou I., Demopoulos V. J.: Aldose reductase enzyme and its implication to major health problems of the 21(st. century. Curr. Med. Chem. 2009; 16, 734–752.
4. Oyama T., Miyasita Y., Watanabe H., Shirai K.: The role of polyol pathway in high glucose-induced endothelial cell damages. Diabetes Res. Clin. Pract. 2006; 73, 227–234.
5. Fujita T., Funako T., Hayashi H.: 8-Hydroxydaidzein, an Aldose Reductase Inhibitor form Okara Fermented with Aspergillus sp. HK-388. Biosci. Biotechnol. Biochem. 2004; 68, 1588–1590.
6. Tai S. S.-K., Lin Ch.-G. , Wu M.-H., Chang T.-S.: Evaluation of Depigmenting Activity by 8-Hydroxydaidzein in Mouse B16 Melanoma Cells and Human Volunteers. Int. J. Mol. Sci. 2009; 10, 4257–4266.
7. Xu B.-J., Jia X.-Q., Gu L.-J., Sung Ch.-K.: Review on the qualitative and quantitative analysis of the mycotoxin citrinin. Food Contr. 2006; 17, 271–285.
8. Sankawa, U., Ebizuka, Y., Noguchi, H., Isikawa, Y., Kitaghawa, S., Yamamoto, Y., Kobayashi, T., Iitak, Y.: Biosynthesis of citrinin in Aspergillus terreus. Tetrahedron 1983; 39, 3583–3591.
9. Hajjaj H., Klaebe A., Loret M., Goma G., Blanc, P. J., Francois J.: Biosynthetic Pathway of Citrinin in the Filamentous Fungus Monascus ruber as Revealed by 13C Nuclear Magnetic Resonance. Appl. Environ. Microbiol. 1999; 65, 311–314.
10. Devi P., D`Souza, L., Kamat, T., Rodrigues, C., Naik, Ch. G.: Batch culture fermentation of Penicillium chrysogenum and a report on the isolation, purification and antibiotic activity of citrinin. Indian J. Mar. Sci. 2009; 38, 38–44.
11. Dong Y., Yang J., Ren X., Zhang H., He J.: New aldose reductase inhibitors N99-596 A and B from Streptomyces. J. Antibiot. 2005; 58, 737–739.
12. Deruiter J., Jacyno J. M., Cutler H. G., Davis R. A.: Studies on aldose reductase inhibitors from fungi. 2. Moniliformin and small ring analogs. J. Enzym. Inhib. 1993; 7, 249–256.
13. Chidananda C., Rao L. J. M., Sattur A. P.: Sclerotiorin, from Penicillium frequentans, a potent inhibitor of aldose reductase. Biotechnol. Lett. 2006; 28, 1633–1636.
14. Rao S. K. C., Divakar S., Naveen Babu K., Appu Rao A. G., Karanth N. G., Sattur A. P.: Nigerloxin, a novel inhibitor of aldose reductase and lipoxygenase with free radical scavenging activity from Aspergillus niger CFR-W-105. J. Antibiot. 2003; 56, 789–793.
15. Rao K. C. S., Divakar S., Srinivas M., Babu K. N., Karanth N. G., Sattur A. P.: Asperaldin, a new aldose reductase inhibitor from Aspergillus niger CFR-1046. I. Fermentation, isolation and characterization. J. Antibiot. 2003; 56, 173–176.
16. Nishikawa M., Tsurumi Y., Murai H., Yoshida K., Okamoto M., Takase S., Tanaka H., Hirota H., Hashimoto M., Kohsaka M.: WF-2421, a new aldose reductase inhibitor produced from a fungus, Humicola grisea. J. Antibiot. 1991; 44, 130–135.
17. Sun W. S., Lee H. S., Park J. M., Kim S. H., Yu J. H., Kim J. H.: YUA001, a novel aldose reductase inhibitor isolated from alkalophilic Corynebacterium sp. YUA25 II. Chemical modification and biological activity. J. Antibiot. 2001; 54, 827–830.
18. McTaggert S. J.: Isoprenylated proteins. Cell. Mol. Life Sci. 2006, 63, 255-267.
19. Wang C. Y., Liu P. Y., Liao J. K.: Pleiotropic effects of statin therapy: molecular mechanisms and clinical results. Trends. Mol. Med. 2008; 14, 37–44.
20. Dudakovic A., Wiemer A. J., Lamb K. M., Vonnahme L. A., Dietz S. E., Hohl R. J.: Inhibition of geranylgeranyl diphosphate synthase induces apoptosis through multiple mechanisms and displays synergy with inhibition of other isoprenoid biosynthetic enzymes. J. Pharmacol. Exp. Therapeut. 2008; 324, 1028–1036.
21. Konya A., Jekkel A., Sutö J., Salat J.: Optimization of compactin fermentation. J. Ind. Microbiol. Biotechnol. 1998; 20, 150–152.
22. Shaligram N. S., Singh S. K., Singhal R. S., Szakacs G., Pandey A.: Effect of precultural and nutritional parameters on compactin production by solid-state fermentation. J. Microbiol. Biotechnol. 2009; 19, 690–697.
23. Garrett I. R., Gutierrez G. E., Rossini G., Nyman J., McCluskey B., Flores A., Mundy, G. R.: Locally delivered lovastatin nanoparticles enhance fracture healing in rats. J. Orthop. Res. 2007; 25, 1351–1357.
24. Crick D. C., Andres D. A., Danesi R., Macchia M., Waechter C. J.: Geranylgeraniol overcomes the block of cell proliferation by lovastatin in C6 glioma cells. J. Neurochem. 1998; 70, 2397–2404.
25. Xia Z., Tan M. M., Wong W. W. L., Dimitroulakos J., Minden M. D., Penn L. Z.: Blocking protein geranylgeranylation is essential for lovastatin-induced apoptosis of human acute myeloid leukemia cells. Leukemia 2001; 15, 1398–1407.
26. Seenivasan A., Subhagar S., Aravindan R., Viruthagiri T.: Microbial production and biomedical applications of lovastatin. Indian J. Pharmaceut. Sci. 2008, 70, 701–709.
27. Manzoni M., Rollini M.: Biosynthesis and biotechnological production of statins by filamentous fungi. Appl. Microbiol. Biotechnol. 2002; 58, 555–564.
28. Alberts A. W., Chen J., Kuron G., Hunt V., Huff J., Hoffman C., Rothrock J., Lopez M., Joshua H., Harris E., Patchett A., Monaghan R., Currie S., Stapley E., Albers-Schonberg G, Hensens O., Hirshfield J., Hoogsteen K., Liesch J., Springer J.: Mevinolin: A Highly Competitive Inhibitor of Hydroxymethylglutaryl-Coenzyme A Reductase and a Cholesterol Lowering Agent. Proc. Natl. Acad. Sci. USA 1980; 77, 3957–3961.
29. Yan J., Xu Y., Zhu C., Zhang L., Wu A., Yang Y., Xiong Z., Deng C., Huang X. F., Yenari M. A., Yang Y. G., Ying W., Wang Q.: Simvastatin Prevents Dopaminergic Neurodegeneration in Experimental Parkinsonian Models: The Association with Anti-Inflammatory Responses. PLoS ONE 2011, 6, e20945. http://www.plosone.org.
30. Kűhn H., Belkner J., Zaiss S., Fährenklemper T., Wohlfeil S.: Involvement of 15-lipoxygenase in early stages of atherogenesis. J. Exp. Med. 1994; 179, 1903–1911.
31. Kelavkar U. P., Nixon J. B., Cohen C., Dillehay D., Eling T. E., Badr K. F.: Overexpression of 15-lipoxygenase-1 in PC-3 human prostate cancer cells increases tumorigenesis. Carcinogenesis 2002; 22, 1765–1773.
32. Jefferson Jr. W. E.: The isolation and characterization of asperenone, a new phenylpolyene from Aspergillus niger. Biochemistry 1967; 6, 3479–3484.
33. Yu J., Tamura G., Takahashi N., Arima K.: Asperyellone, a new yellow pigment of Aspergillus awamori and Aspergillus niger. Agr. Biol. Chem. 1967; 31, 831–836.
34. Ayer W. A., Muir D. J., Chakravarty P.: Phenolic and other metabolites of Phellinus pini, a fungus pathogenic to pine. Phytochemistry 1996; 42, 1321–1324.
35. Rao K. C., Divakar S., Appu Rao A. G., Karanth N. G., Suneetha W. J., Krishnakantha T. P., Sattur A. P.: Asperenone: an inhibitor of 15-lipoxygenase and of human platelet aggregation from Aspergillus niger. Biotechnol. Lett. 2002; 24, 1967–1970.
36. Chidananda C., Kumar C. M., Sattur A. P.: Strain improvement of Aspergillus niger for the enhanced production of asperenone. Indian. J. Microbiol. 2008; 48, 274–278.
37. Chidananda C., Sattur A. P.: Sclerotiorin, a novel inhibitor of lipoxygenase from Penicillium frequentans. J. Agr. Food Chem. 2007; 55, 2879–2883.
38. Lucas E. M. F., Machado Y., Ferreira A. A., Dolabella L. M. P., Takahashi J. A.: Improved production of pharmacologically-active sclerotiorin by Penicillium sclerotiorum. Trop. J. Pharmaceut. Res. 2010; 9, 365–371.
39. Rao S. K. C., Divakar S., Naveen Babu K., Appu Rao A. G., Karanth N. G., Sattur A. P.: Nigerloxin, a novel inhibitor of aldose reductase and lipoxygenase with free radical scavenging activity from Aspergillus niger CFR-W-105. J. Antibiot. 2003; 56, 789–793.
40. Hasan H. A. H.: Production and Determination of Nigerloxin by Aspergillus niger. Int. J. Agr. Biol. 2007; 9, 315–318.
41. Chakradhar D., Javeed S., Sattur P. A.: Studies on the production of nigerloxin using agro-industrial residues by solid-state fermentation. J. Ind. Microbiol. Biotechnol. 2009; 36, 1179–1187.
42. Esposito F., Kharlamova T., Distinto S., Zinzula L., Cheng Y. C., Dutschman G., Floris G., Markt P., Corona A., Tramontano E.: Alizarine derivatives as new dual inhibitors of the HIV-1 reverse transcriptase-associated DNA polymerase and RNase H activities effective also on the RNase H activity of non-nucleoside resistant reverse transcriptases. FEBS J. 2011; 278, 1444–1457.
43. Kaul A., Maltese W. A.: Killing of Cancer Cells by the Photoactivatable Protein Kinase C Inhibitor, Calphostin C, Involves Induction of Endoplasmic Reticulum Stress. Neoplasia 2009; 11, 823–834.
44. Isel C., Ehresmann Ch., Marquet R.: Initiation of HIV Reverse Transcription. Viruses 2010; 2, 213–243.
45. Lai M. T., Munshi V., Touch S., Tynebor R. M., Tucker T. J., McKenna P. M., Williams T. M., DiStefano D. J.: Antiviral Activity of MK-4965, a Novel Nonnucleoside Reverse Transcriptase Inhibitor. Antimicrob. Agents Chemother. 2009; 53, 2424–2431.
46. Demain A. L., Somkuti G. A., Hunter-Cavera J. C., Rossmoore H. W.: Novel microbial products for medicine and agriculture. Netherlands: Elsevier, 1989.
47. Davidson R. N., Boerb M., Ritmeijerb K.: Paromomycin. Trans. Roy. Soc. Trop. Med. Hyg. 2009; 103, 653–660.
48. Kitahara N., Haruyama H., Hata T., Takahashi S.: The structures of thielavins A, B and C. Prostaglandin synthetase inhibitors from fungi. J. Antibiot. 1983; 36, 599–600.
49. Sakemi S., Hirai H., Ichiba T., Inagaki T., Kato Y., Kojima N., Nishida H., Parker J. C., Saito T., Tonai-Kachi H., Volkenburg M. A., Yoshikawa N., Kojima Y.: Thielavins as glucose-6-phosphatase (G6Pase. inhibitors: producing strain, fermentation, isolation, structural elucidation and biological activities. J. Antibiot. 2002; 55, 941–951.
50. Mani N., Sanchet P., Jiang Z. D., McNaney C., DeCenzo M., Knighti B., Stankis M., Kuranda M., Rothenstein D. M.: Screening systems for detecting inhibitors of cell wall transglycosylation in Enterococcus. J. Antibiot. 1998; 51, 471–479.
51. Chen J. L.-Y., Sperry J., Ip, N. Y., Brimble M. A.: Natural products targeting telomere maintenance. Med. Chem. Commun. 2011; 2, 229–245.
52. Rao K. V., Cullen W. P.: Streptonigrin, an antitumour substance. I. Isolation and characterization. Antibiot. Annu. 1959; 7, 950–953.
53. Société des usines chimiques de Rhône-Poulenc, GB Patent 872261, 1961, Chem. Abstr. 1961; 55, 25158a.
54. Kudrina E. S., Ol’khovatova O. L., Murav’eva L. I., Gauze G. F.: Systematic position and variability of the producent of antitumor antibiotic bruneomycin. Antibiotiki 1966; 11, 400–405.
55. Brazhnikova M. G., Ponomarenko I. N., Kovsharova E. B., Kruglyak E. B., Proshlyakova V. V.: Study of bruneomycin formed by Actinomyces albus var. bruneomycini and its identification with streptonigrin. Antibiotiki 1968; 13, 99–102.
56. Bolzán A. D., Bianchi M. S.: Genotoxicity of streptonigrin: a review. Mutat. Res. Rev. Mutat. Res. 2001; 488, 25–37.
57. Mesak L. R., Qi S., Villanueva I., Miao V., Davies J.: Staphylococcus aureus promoter-lux reporters for drug discovery. J. Antibiot. (Tokyo) 2010; 63, 492–498.
58. Serova M., Ghoul A., Benhadji K. A., Cvitkovic E., Faivre S., Calvo F., Lokiec F., Raymond E.: Preclinical and clinical development of novel agents that target the protein kinase C family. Semin. Oncol. 2006; 33, 466–478.
59. Martiny-Baron G., Fabbro D.: Classical PKC isoforms in cancer. Pharmacol. Res. 2007; 55, 477–486.
60. Mackay H. J., Twelves C. J.: Targeting the protein kinase C family: are we there yet? Nat. Rev. Canc. 2007; 7, 554–562.
61. Kaul A., Maltese W. A.: Killing of Cancer Cells by the Photoactivatable Protein Kinase C Inhibitor, Calphostin C, Involves Induction of Endoplasmic Reticulum Stress. Neoplasia 2009; 11, 823–834.
62. Kobayashi E., Ando K., Nakano H., Iida T., Ohno H., Morimotot M., Tamaoki T.: Calphostins (UCN - 1028., novel and specific inhibitors of protein kinase C. I. Fermentation, isolation, physico-chemical properties and biological activities. J. Antibiot. 1989; 42, 1470–1474.
63. Olivo M., Ali-Seyed M.: Apoptosis signalling mechanisms in human cancer cells induced by calphostin-PDT. Int. J. Oncol. 2007; 30, 537–548.
64. Chiarini A., Whitfield J. F., Pacchiana R., Armato U., Dal Pra I.: Photoexcited calphostin C selectively destroys nuclear lamin B1 in neoplastic human and rat cells – a novel mechanism of action of a photodynamic tumor therapy agent. Biochim. Biophys. Acta 2008; 1783, 1642–1653.
65. Guo B., Hembruff S. L., Villeneuve D. J., Kirwan A. F, Parissenti A. M.: Potent killing of paclitaxel - and doxorubicin-resistant breast cancer cells by calphostin C accompanied by cytoplasmic vacuolization. Breast Canc. Res. Treat. 2003; 82, 125–141.
66. Trindade-Silva A. E., Lim-Fong G. E., Sharp K. H., Haygood M. G.: Bryostatins: biological context and biotechnological prospects. Curr. Opin. Biotechnol. 2010; 21, 834–842.
67. Wender P. A., Baryza J. L., Brenner S. E., DeChristopher B. A., Loy B. A., Schrier A. J., Verma V. A.: Design, synthesis, and evaluation of potent bryostatin analogs that modulate PKC translocation selectivity. Proc. Natl. Acad. Sci. 2011; 108, 6721–6726 (http://www.pnas.org).
68. Gully Ch. P., Zhang F., Chen J., Yeung J. A., Velazquez-Torres G., Wang E., Yeung S.-Ch. J., Lee M.-H.: Antineoplastic effects of an Aurora B kinase inhibitor in breast cancer. Mol. Canc. 2010; 9(42). http://www.molecular-cancer.com)
69. Ayer S. W., McInnes A. G., Thibault P., Walter J. A., J. L. Doull Parnell, T., Vining L. C.: Jadomycin, a novel 8i/-benz[6]oxazolo[3,2-/]phenanthridine antibiotic from Streptomyces venezuelaeISP5230. Tetrahedron Lett. 1991; 32, 6301–6304.
70. Fu D.-H., Jiang W., Zheng J.-T., Zhao G.-Y., Li Y., Yi H., Li Z.-R., Jiang J.-D., Yang K.-Q., Wang Y., Si S.-Y.: Jadomycin B, an Aurora-B kinase inhibitor discovered through virtual screening. Mol. Canc. Therapeut. 2008; 7, 2386–2393.
71. Jakeman D. L., Bandi S., Graham C. L., Reid T. R., Wentzell J. R., Douglas S. E.: Antimicrobial Activities of Jadomycin B and Structurally Related Analogues. Antimicrob. Agents Chemother. 2009; 53, 1245–1247.
72. Aly A. H., Debbab A., Edrada-Ebel R. A., Müller W. E. G., Kubbutat M. H. G., Wray V., Ebel R., Proksch P.: Protein kinase inhibitors and other cytotoxic metabolites from the fungal endophyte Stemphylium botryosum isolated from Chenopodium album. Mycosphere 2010; 1, 153–162.
Štítky
Farmácia Farmakológia
Článek SOLUTIO 2011Článek Extruze tavenin
Článok vyšiel v časopiseČeská a slovenská farmacie

2012 Číslo 3-
Všetky články tohto čísla
- Pod ochranou sv. Dymphny – LIV. sympozium z historie farmacie a veterinární medicíny
- Modulácia leukotriénovej cesty – potenciálne ciele
- Mikrobiálne sekundárne metabolity ako inhibítory farmaceuticky významných oxidoreduktáz a transferáz
- Fenotypizace enzymů podílejících se na metabolismu léčiv
- SOLUTIO 2011
- Vysoce účinné potenciální antimykobakteriální látky proti Mycobacterium avium
-
Štúdium lokálnych anestetík – časť 197*
Vplyv xylitolu na farmaceutickú dostupnosť lidokaínu a tokové vlastnosti hydrogélov - Prof. RNDr. J. Čižmárik, PhD. – doctor honoris causa
- Doc. RNDr. Ingrid Tumová, CSc., jubiluje
- Životné jubileum docenta RNDr. Jozefa Sokolíka, CSc.
- Polyméry s molekulovými odtlačkami
- Extruze tavenin
- Inhibítory gamma-sekretázy v terapii Alzheimerovej choroby
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fenotypizace enzymů podílejících se na metabolismu léčiv
- Extruze tavenin
- Modulácia leukotriénovej cesty – potenciálne ciele
- Doc. RNDr. Ingrid Tumová, CSc., jubiluje
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



