-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fekální inkontinence – závažný medicínský a společenský problém
Faecal incontinence – serious medical and social issue
Faecal incontinence presents gastrointestinal disorder with high prevalence (more than 2% of population) and serious impact on the quality of life. General practitioners, gastroenterologists and colorectal surgeons play the principal role in screening, diagnostics and providing health care to patients who suffer from faecal incontinence. Insufficient knowledge about faecal incontinence and minimal training aimed at its diagnostics and therapy lead to the low quality of provided health care.
Authors offer comprehensive up-to-date review focused on faecal incontinence – its definition, prevalence, seriousness, consequences, pathophysiology, diagnostics and management. Detailed anatomical and physiological assessment of each patient is fundamental in determining correct cause of faecal incontinence and consequent selection of the most appropriate therapeutic modality.
Broad spectrum of available therapeutic options comprises conservative management (lifestyle modification, diet, medications, and absorbent tools), biofeedback and surgical interventions (sphincter augmentation, sphincter reconstruction, sacral nerve stimulation, sphincter substitution and stools diversion). Application of the most appropriate treatment can lead in majority of patients to significant improvement in faecal incontinence and quality of life. Early diagnosis prevents possible complications, which would possibly deteriorate patient’s quality of life.Keywords:
anal incontinence – definition, prevalence, pathophysiology, diagnostics, therapeutic modalities; quality of life; risk factors
Autoři: MUDr. Ph.D. Peter Ihnát; Mba; RNDr. Ph.D. Radka Kozáková; MUDr. Ph.D. Petr Vávra; prof. MUDr. DrSc. Anton Pelikán; doc. MUDr. Ph. D. Pavel Zonča; Frcs
Působiště autorů: Chirurgická klinika LF OU a FN Ostrava 1; Katedra ošetřovatelství a porodní asistence, Lékařská fakulta Ostravské univerzity 2
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 135-140
Kategorie: Přehledový článek
Souhrn
Fekální inkontinence představuje onemocnění s vysokou prevalencí (> 2 % celkové populace) a velmi závažným dopadem na kvalitu života postiženého jedince i lidí v jeho okolí. Principiální roli při diagnostice fekální inkontinence a při poskytování léčebné péče pacientům postiženým inkontinencí hrají praktičtí lékaři, gastroenterologové i chirurgové. Poměrně nízká úroveň poskytované péče je však mimo jiné důsledkem nedostatečné znalosti problematiky fekální inkontinence a minimálního tréninku lékařů zaměřeného na její diagnostiku a léčení.
Autoři překládají ucelený up-to-date přehled problematiky fekální inkontinence se zaměřením se na definici, prevalenci, závažnost, důsledky onemocnění, patofyziologii, diagnostiku a léčbu. Detailní zhodnocení anatomického a fyziologického stavu pacienta je nezbytným předpokladem pro stanovení správné příčiny vzniku inkontinence a pro následný výběr nejvhodnějšího terapeutického postupu.
Široké spektrum dostupných léčebných modalit v léčbě fekální inkontinence zahrnuje konzervativní léčbu (úprava životního stylu, dietní režim, farmakologické přípravky, absorpční pomůcky), biofeedback i chirurgické intervence (augmentace svěračů, rekonstrukce svěračů, stimulace sakrálního nervu, náhrada svěračů a diverse stolice). Prostřednictvím aplikace vhodného léčebného postupu může mnoho pacientů dosáhnout výrazného zlepšení symptomů inkontinence a zlepšení kvality života. Včasná diagnóza fekální inkontinence navíc vede k prevenci vzniku komplikací, které by dále zhoršovaly kvalitu života nemocného.Klíčová slova:
anální inkontinence – definice, prevalence, patofyziologie, diagnostika, léčebný management; kvalita života; rizikové faktoryÚvod
V rámci nemocí gastrointestinálního traktu patří fekální inkontinence (FI) mezi nejvíce opomíjená a nejhůře léčená onemocnění, a to nejen ze strany praktických lékařů, ale i specialistů zaměřených na gastroenterologii (1, 2). FI přitom představuje poruchu s doslova devastujícím efektem na kvalitu života postiženého, což obvykle vede k jeho sociální izolaci, případně umístění do domova pro seniory (2−4).
FI je často nepoznaným onemocněním, protože většina postižených se cítí být zahanbena a svému lékaři se s problémem nesvěří. Léčebný management FI, resp. jeho kvalita, je obecně na velmi nízké úrovni – obvykle se omezuje na předpis hygienických pomůcek (pleny, vložky, tampony). Mezi hlavní důvody nízké úrovně poskytované léčebné péče patří nedostatečná znalost problematiky inkontinence a minimální trénink lékařů zaměřený na její diagnostiku a léčbu (4).
Jaký je tedy současný stav medicínských poznatků o FI, její prevalenci, závažnosti, etiopatogenezi a vlivu na kvalitu života postižených osob?
Definice
Pod pojmem inkontinence rozumíme ztrátu kontroly nad procesem defekace (schopnost vnímat, zadržovat a evakuovat střevní obsah), což vede k nechtěnému nebo předčasnému odchodu stolice (5). Pro exaktní vymezení problematiky je třeba rozlišovat mezi anální a fekální inkontinencí. Anální inkontinence představuje obecnější pojem, který zahrnuje mimovolný únik stolice či plynů přes řitní otvor (anus). Fekální inkontinence je užší pojem vymezený jenom pro mimovolný únik stolice přes anus (6).
Je zřejmé, že i samotný nekontrolovaný únik plynů může být poměrně stresujícím symptomem. Únik plynů by však neměl být považován za inkontinenci, protože je velmi obtížné určit, kdy je únik plynů již „abnormální“ (7). Fekální inkontinence je proto definována jako opakovaný nekontrolovaný únik tekuté či formované stolice u osob starších 3 let objevující se jednou za měsíc nebo častěji (2).
Podle závažnosti fekální inkontinence jsou obvykle rozlišovány tři stupně inkontinence: 1. stupeň (lehká inkontinence se špiněním prádla); 2. stupeň (mimovolný únik tekuté stolice); 3. stupeň (těžká inkontinence, kdy dochází k úniku tekuté i tuhé stolice).
Z patofyziologického hlediska je rozlišována primární FI (idiopatická inkontinence pravděpodobně na podkladě denervace svalstva pánevního dna) a sekundární FI (inkontinence jako důsledek jiné patologie – viz níže, stať Patofyziologie). FI představuje syndrom, který může mít mnoho různých příčin. Je proto vždy potřeba pečlivě zhodnotit nemocného na základě anamnézy, klinického vyšetření a výsledků jednotlivých diagnostických modalit (viz níže, stať Diagnostika), abychom identifikovali kauzální příčinu FI a na tuto následně zaměřili léčebné úsilí.
Prevalence
Podle dostupných epidemiologických studií se odhady prevalence FI pohybují v rozmezí od 2,2 do 16,8 % (8–14). Variabilita údajů v jednotlivých epidemiologických studiích může být způsobena rozdílnými definicemi inkontinence, odlišnými způsoby zjišťování inkontinence a různými technikami výběrů populačních vzorků ke zkoumání (3, 15). Navíc je třeba vzít do úvahy skutečnost, že jen asi 10–20 % postižených osob se se svojí poruchou svěří ošetřujícímu lékaři (4, 5).
V Evropě a Severní Americe je prevalence FI odhadována minimálně na 2 % populace, přičemž výskyt syndromu stoupá na cca 10 % u osob starších 65 let (14, 16–18), a dokonce na 50 % u obyvatel domovů pro seniory (19–21). Vyšší výskyt inkontinence bývá pozorován u některých nemocí – pacienti s neurologickými poruchami (sclerosis multiplex, Parkinsonova nemoc, cévní mozkové příhody), míšním poraněním, systémovou sklerózou, amyloidózou, syndromem dráždivého tračníku ad. (1, 4, 22). Tato onemocnění obvykle negativně ovlivňují mobilitu pacientů, schopnost vykonávat běžné aktivity nebo způsobují chronický průjem (23). Pro kontinenci je podstatné, aby byl každý jedinec motivován „udržovat“ ji. Proto je FI velmi častá u geriatrických pacientů trpících pokročilým poškozením kognitivních funkcí (demencí).
Mnoho osob postižených inkontinencí věří, že FI je prostým důsledkem procesu stárnutí, a proto musí být tolerována. Experti se však shodují v názoru, že v žádném věku nelze považovat příznaky FI za normální, resp. adekvátní stáří pacienta (23, 24).
Závažnost a důsledky FI
FI představuje devastující nefatální onemocnění, které vede ke známkám těžkého zahanbení, anxiozity, depresí, emočního strádání a sociální izolace. Pacienti s FI popisují svůj stav jako život v ohraničeném světě připomínajícím pobyt ve vězení (25, 26). FI má obvykle navíc devastující efekt nejen na kvalitu života postiženého, ale i příbuzných a osob, které o postiženého pečují.
Většina postižených své příznaky disimiluje, snaží se onemocnění utajit a nehlásí je ošetřujícímu lékaři. Z těchto důvodů označil Johanson FI velmi výstižně jako silent affliction (tiché utrpení) (4). FI je obvykle asociována s vyšší morbiditou a celkově horší zdravotní kondicí. Pacienti v domovech pro seniory trpící FI mají prokazatelně vyšší výskyt infekcí močových cest, dekubitů a zvýšenou mortalitu (22).
Symptomatologie může u jednotlivých pacientů dosahovat různé intenzity, resp. stupně závažnosti. Z toho vyplývá potřeba klasifikace a standardizace závažnosti postižení. Nejčastěji využívaným skórovacím systémem je Cleveland Clinic Incontinence Score (viz tab. 1), který prostřednictvím 5 jednoduchých dotazů klasifikuje závažnost FI (0 bodů znamená perfektní kontinenci, 20 bodů totální inkontinenci).
Tab. 1. Cleveland Clinic Incontinence Score 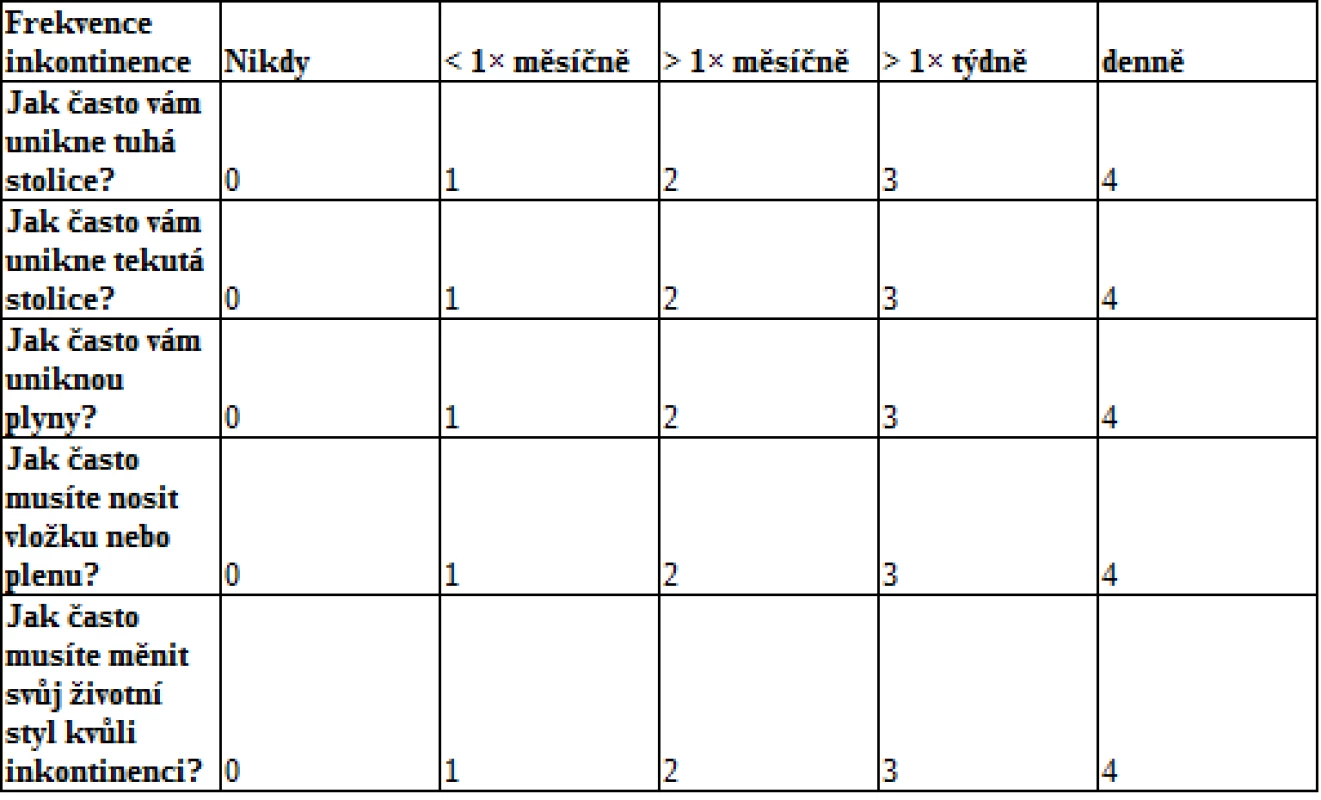
Vliv FI na kvalitu života postiženého je objektivně měřen a hodnocen pomocí standardizovaných dotazníků. Je možné použít obecné dotazníky kvality života (např. Medical Outcomes Survey Short-Form SF-36, Quality of Well-Being Scale či Sickness-Impact Profile) nebo specifické dotazníky zaměřené na kvalitu života pacientů s FI. Ze specifických dotazníků je nejznámější a nejčastěji využívaná tzv. Rockwoodova škála (Fecal Incontinence Quality of Life Scale: www.fascrs.org/physicians/Fecal Incontinence_Quality_of_Life_Scale). Měření kvality života představuje nejen možnost objektivního měření negativního vlivu FI na kvalitu života, ale i hodnocení efektu jednotlivých terapeutických modalit v léčbě FI (25, 26).
Zdravotní péče o pacienty s FI je velmi nákladná vzhledem k potřebě velkého množství ošetřovatelských pomůcek a obvykle mnohaletému trvání postižení. Náklady na zdravotní péči o pacienty s FI jsou přibližně o 55 % vyšší než náklady na kontinentní pacienty (6, 15). Vysoké náklady jsou navíc navýšeny zvýšenou morbiditou pacientů a častými opakovanými hospitalizacemi, resp. nutností umístnění pacientů do ošetřovatelských ústavů. Celkové roční náklady na nemocné s FI jsou v USA odhadovány na cca 11 miliard dolarů (6, 15). Dodatečné náklady na zdravotní péči byly vyčísleny na více než 9000 USD ročně na jednoho inkontinentního pacienta (22).
Patofyziologie
Pro udržení kontinence je potřebná funkčnost a neuromuskulární integrita jednotlivých komponent anorekta i pánevního dna. K narušení kontinentního mechanismu může dojít v důsledku širokého spektra různých obtíží: poruch oslabujících muskulaturu pánevního dna nebo análních svěračů, zhoršujících senzitivitu a compliance rekta, alterujících objem či konzistenci stolice; eventuálně se může jednat o poruchy kognitivních funkcí (24, 27).
Mezi prokázané rizikové faktory vzniku FI patří tekutá konzistence stolice, ženské pohlaví, pokročilý věk, multiparita, neurologické poranění, trauma a celkově špatná zdravotní kondice. Mezi rizikové faktory je možné zařadit i chronickou obstrukční plicní nemoc, obezitu, kouření, močovou inkontinenci nebo bariatrický chirurgický zákrok (6, 7, 28).
Pokročilý věk představuje jeden z nejvíce signifikantních rizikových faktorů pro vznik FI. Korelace stoupajícího výskytu inkontinence s narůstajícím věkem je připisována především ochabování svaloviny pánevního dna a snižujícímu se klidovému tonu vnitřního svěrače. (4, 24, 28). Boyle et al. ve své studii publikovali pokles klidového tonu análního svěrače ročně o 0,5 mmHg a pokles o 3 mmHg s každým porodem (29).
I když je kontinence udržována především funkčním anorektálním neuromuskulárním aparátem, poměrně často je FI diagnostikována u pacientů s dobře fungujícím anorektem. Urychlený kolonický transit time, resp. chronický průjem představuje velmi významný rizikový faktor vzniku inkontinence. Onemocnění, jež ovlivňují konzistenci stolice a rychlost přísunu stolice do rekta, proto mohou vést k závažné FI (28, 30). Pacienti se syndromem dráždivého tračníku mají rovněž větší pravděpodobnost vzniku FI. Management pacientů s chronickými průjmy je proto potřeba v první řadě zaměřit na korekci konzistence stolice (2, 3).
U seniorů se závažnými komorbiditami (zejména pokud jsou imobilní a mají zhoršené kognitivní funkce), jsou často pozorovány známky tzv. paradoxní inkontinence (inkontinence z přetékání). U těchto osob dochází v důsledku úporné obstipace (rektum je vyplněno velkým objemem impaktované stolice) k obtékání tekuté stolice kolem impaktované stolice. To se klinicky projevuje jako pseudoprůjem se známkami inkontinence. Impaktovaná stolice v rektu totiž snižuje tonus vnitřního análního svěrače a umožňuje tak únik stolice přes anální kanál (24).
Obezita představuje další rizikový faktor působící pravděpodobně prostřednictvím zvýšeného intraabdominálního tlaku a ochabování pánevního dna. Prevalence FI u obézních jedinců je udávána o 50 % vyšší než u neobézních. Redukce hmotnosti prokazatelně vede k redukci četnosti a závažnosti FI (4, 23, 28).
Negativní efekt na kontinenci stolice má i kouření, jak prokázali Bharucha et al. Pravděpodobným mechanismem je přímé působení nikotinu na kolonický transit time (jeho urychlení) a ovlivnění (snížení) rektální compliance (30).
Parita, resp. těhotenství je jedním z nejčastěji udávaných rizikových faktorů FI v odborné literatuře. Nejsou však dostupná relevantní data o tom, které ženy (s jakým typem porodu) mají vyšší riziko vzniku FI. I když lze logicky očekávat vyšší prevalenci inkontinence u žen po vaginálním porodu (předpokládaná etiopatogeneze prostřednictvím evokované neuropatie nervus pudendalis s následným ochabnutím pánevního dna), nebyl doposud prokázán benefit císařského řezu oproti vaginálnímu porodu z hlediska rizika vzniku inkontinence (6, 23, 28). Provedení epiziotomie je prokázaným rizikovým faktorem vzniku FI v důsledku poranění análních sfinkterů (1, 29).
Sekundární FI se poměrně často vyskytuje jako důsledek poškození análních svěračů (např. u Crohnovy choroby), neurologických poruch (úrazy míchy, cévní mozkové příhody, Parkinsonova choroba), viscerální neuropatie (diabetes mellitus) nebo u dysfunkcí pánevního dna (prolaps rekta, rektokéla).
Často je popisován vznik FI v souvislosti s chirurgickými zákroky. Dostupné studie udávají vznik FI u 8−10 % pacientů po laterální sfinkterotomii v léčbě análních fisurací a u 18−52 % pacientů po fistulotomiích v léčbě hlubokých chronických perianálních píštělí. Zřídka je však zaregistrována FI (v důsledku poranění sfinkterů) i po radikálních operacích hemeroidů nebo po jiných drobných anorektálních operacích (23, 27, 32). Nízké resekční výkony na rektu pro karcinom rekta se zachováním svěračů mají velmi často (u 50–80 % pacientů) závažné funkční důsledky, které se souhrnně označují jako LARS (low anterior resection syndrome). Tento syndrom zahrnuje problémy s evakuací stolice, časté vyprazdňování, urgence a především FI. Velmi signifikantní rizikovým faktorem vzniku LARS a FI je také proběhlá radioterapie malé pánve pro karcinom rekta, prostaty či cervixu uteru (33, 34).
Diagnostika
Detailní zhodnocení anatomického a fyziologického stavu pánve a tlustého střeva je nezbytným předpokladem pro stanovení správné příčiny vzniku inkontinence a následný výběr nejvhodnějšího terapeutického postupu (32). V atmosféře vzájemné důvěry musejí být pacienti detailně dotazováni na jednotlivé aspekty FI (frekvence, množství a typ úniku stolice, příznaky urgence, vliv na kvalitu života, resp. nutnost alterace životního stylu). Je potřeba prozkoumat chronickou medikaci pacienta i jeho dietní zvyky. Na základě detailní anamnézy je potom stanovena diagnóza a závažnost FI (7).
Při fyzikálním vyšetření perinea je vyhodnocována přítomnost stolice, známky kožní iritace, resp. perianální dermatitídy, přítomnost jizev, deformit, marisků, hemeroidů nebo fisury. Při zapnutí břišního lisu je sledován případný pokles perinea, prolaps rekta, descensus, resp. prolaps vagíny a uteru. Digitální vyšetření per rectum nabízí cenné informace o síle (tlakovém tonu) análních svěračů v klidu i při úsilném zapnutí svěračů. Digitální vyšetření rovněž umožňuje verifikovat přítomnost análního spasmu, fisurace, nádoru, solitárního vředu nebo rektokély (22, 27, 35). U starších pacientů je na začátku vyšetřovacího algoritmu potřeba vyloučit těžkou chronickou obstipaci, kdy je tlusté střevo a rektum vyplněno tuhou stolicí a pacient má známky tzv. inkontinence z přetékání. Rektum přeplněné stolicí lze vyloučit pomocí digitálního vyšetření a nativního snímku břicha (22, 35).
V rámci komplexního vyšetření pacientů s FI je doporučováno provedení endoskopického vyšetření kolorekta (rektoskopie, kolonoskopie), endoanálního ultrazvuku, anorektální manometrie, defekografie a neurofyziologických vyšetření (elektromyografie pánevního dna a testování terminální motorické latence pudendálního nervu). Není však nutné vykonávat všechna tato vyšetření u všech pacientů s FI. Racionálním kritériem pro výše uvedená vyšetření je FI nereagující na konzervativní terapii (2, 27).
Endoskopické vyšetření (rektoskopie a kolonoskopie) by mělo být provedeno k vyšetření sliznic kolorekta a pro identifikaci případných nálezů kolitidy, proktitidy, nádorů, střevní ischemie či jiných střevních abnormalit (22, 35).
Anorektální manometrie poskytuje informace o funkčnosti anorekta a také potvrzuje diagnózu FI. Je prováděna s cílem objektivního vyhodnocení síly a funkce análních svěračů, rektální senzitivity a anorektálních reflexů. Objektivně měří sílu análních svěračů v klidovém stavu (podmíněno funkcí vnitřního sfinkteru), při usilovném zapnutí (podmíněno funkcí zevního sfinkteru a m. puborectalis) nebo při defekačním manévru (27, 36). Měření rektální senzitivity a compliance umožňuje diagnostikovat např. inkontinenci z přetékání při snížené compliance rekta (zvýšená tuhost stěn rekta v důsledku idiopatických střevních zánětů nebo po ozařování pánve) (5, 35, 36).
Endoanální ultrazvuk představuje zlatý standard pro posouzení morfologie vnitřního i zevního análního svěrače. Umožňuje identifikovat poranění sfinkterů ve formě trhlin, jizev nebo atrofie a tím i stanovit indikaci případného chirurgického řešení např. formou sfinkteroplastiky (5, 6, 27). Kvalita a výtěžnost ultrazvukového vyšetření je však vysoce závislá na zkušenostech lékaře.
Defekografie (standardní nebo s využitím magnetické rezonance) umožňuje dynamické zobrazení procesu defekace. Pomocí defekografie lze identifikovat vnitřní rektální prolaps (rektální intususcepci), rektokélu či enterokélu, které mohou vést k vývoji sekundární FI. Vyšetření je však u pacientů s FI využíváno jen poměrně zřídka, protože je obtížné, resp. často nemožné, aby inkontinentní pacient zadržel kontrastní kaši v rektu (5, 6, 35).
Neurofyziologické vyšetření (elektromyografie pánevního dna a testování terminální motorické latence pudendálního nervu) měří funkčnost a neuromuskulární integritu anorekta; umožňuje odlišení neurogenní léze od svalové. Využití těchto vyšetření v diagnostickém algoritmu FI je však velmi kontroverzní – nedávné studie nepotvrdily jejich přínos, proto je Americká gastroenterologická asociace nedoporučuje používat při vyšetřování pacientů s FI (2, 6, 35, 37).
Jelikož je FI velmi často (u 25–50 % pacientů) asociována s močovou inkontinencí a gynekologickým prolapsem, mělo by být u všech pacientů provedeno rovněž vyšetření urologické i gynekologické. Při nálezu kombinovaných vad pánevního dna je pak ideální multidisciplinární přístup k pacientům (5, 27).
Management léčby fekální inkontinence a její možnosti
V průběhu posledních 20 let bylo vyvinuto několik nových léčebných modalit, které představují pokrok v léčbě pacientů s FI. I když doposud neexistuje žádná „zázračná léčba“, v současnosti dostupné metody mohou signifikantně zlepšit příznaky u většiny pacientů. Léčebné modality variují od konzervativního postupu přes biofeedback až po chirurgickou intervenci. Iniciální přístup je však u všech typů FI stejný – konzervativní terapie zahrnuje úpravu životního stylu, dietní režim, používání farmakologických přípravků a absorpčních pomůcek.
Konzervativní terapie
Již zavedení jednoduchých režimových opatření často vede k významnému zmírnění příznaků FI. Cílem konzervativní terapie je upravit konzistenci stolice, kolonický transit time, funkci svěračů a senzitivitu anorekta. Pacientům je doporučováno zanechat kouření a snížit hmotnost v případě, že trpí obezitou či nadváhou (4, 6, 24). Dietní režim musí být upraven tak, aby byl redukován obsah alkoholu, kofeinu a rafinovaných cukrů. Je doporučována dieta bohatá na obsah vlákniny, vhodné je podávání doplňků obsahujících fermentovatelnou vlákninu – např. psyllium (3, 5).
Pohybová terapie a cvičení se jeví jako přínosné v redukci epizod FI. Zvýšená fyzická aktivita totiž zlepšuje mobilitu pacientů, zlepšuje dostupnost a využívaní toalet a může vést k redukci hmotnosti (6, 38). Studie provedená v pečovatelských domovech potvrdila, že zavedením strukturovaného programu denních fyzických aktivit u seniorů, společně se zvýšeným příjmem tekutin, došlo k významné redukci epizod a závažnosti FI (38).
Průjmy jsou často nežádoucím efektem různých léků. Polypragmazie je navíc velmi běžným jevem zejména u starších pacientů. Je proto nutná důkladná revize a úprava chronické medikace se snahou o identifikaci léčiv, jež by mohla přispívat ke zhoršování FI (výčet léků, u kterých průjem patří k možným vedlejším účinkům, ovšem přesahuje rámec tohoto přehledového článku) (3, 27).
Nevyhnutelnou součástí konzervativního managementu FI je i péče o perineální kůži prostřednictvím zvýšené anální hygieny, aplikace ochranných mastí a krémů. Používání absorpčních pomůcek (pleny, vložky) je běžnou a nedílnou součástí péče (4, 5). Nevýhodou absorpčních pomůcek typu plen či vložek je ovšem často přítomný nepříjemný zápach a dráždění kůže stolicí.
Anální tampony se v konzervativním managementu FI jeví jako velmi efektivní řešení. Jsou dostupné v různých tvarech a velikostech, limitem jejich použití je však cena (nejsou hrazeny zdravotními pojišťovnami v ČR). Další limitací používání anální tamponů je skutečnost, že je řada pacientů špatně toleruje (3, 5). Nedávné systémové review z Cochraneovy databáze konstatovalo, že tolerance análních tamponů limituje jejich využití, pokud však jsou tolerovány, jsou velmi efektivní v managementu FI (39).
Pro každého jedince je jednodušší kontrolovat formovanou stolici než průjmovitou. Proto jsou v rámci konzervativního terapie podávány různé léčivé přípravky modifikující stolici (např. loperamid, kodein, lomotil). U nejčastěji využívaného léčiva – loperamidu – je jeho pozitivní efekt na zmírnění FI připisován nejen zahušťováním stolice, ale i účinku na zvyšování klidového tonu análního svěrače (3, 27, 32).
Biofeedback
Biofeedback je tréninková psychofyzioterapeutická metoda, která pomocí zpětné vazby pomáhá efektivně trénovat svaly pánevního dna. S biofeedbackovým přístrojem, za pomoci zkušeného fyzioterapeuta a pod vědomou kontrolou pacienti zlepšují koordinaci svalů, posilují délku a sílu svalové kontrakce. Mnoho autorů (včetně doporučení Americké gastroenterologické asociace) použití biofeedbacku v léčbě FI doporučuje, i když nejsou dostupné přesvědčivé důkazy o nadřazenosti biofeedbacku nad konzervativní léčbou (toto bylo i závěrem systémového review z Cochraneovy databáze) (40).
Vzhledem k faktu, že biofeedback představuje bezpečnou a finančně nenáročnou terapii, většina autorů doporučuje jeho využití u všech pacientů, kteří neodpovídají na konzervativní terapii (2, 7, 24, 32). Úspěšnost terapie biofeedbackem vyžaduje dobrou motivaci pacienta, aby byl ochoten věnovat svůj čas a úsilí absolvování kompletní baterie léčebných sezení. V některých studiích byl pozitivní efekt biofeedbacku na FI pozorován až u 60–92 % pacientů (2, 5, 32, 41).
Chirurgické intervence
Indikace k chirurgické intervenci by měla být založena na důsledném klinickém vyšetření s cílem anatomické rekonstrukce a obnovení funkce anorekta. Chirurgické techniky pro léčbu FI je možné přehledně rozdělit do 5 kategorií: augmentace, rekonstrukce, stimulace, náhrada svěračů a diverze stolice.
Augmentace svěračů
Do análního kanálu jsou injekčně aplikovány biologické materiály s cílem augmentace vnitřního análního svěrače a zlepšení kontinence. Výhodou těchto chirurgických postupů je jejich poměrně jednoduchá technická proveditelnost a zatíženost minimální morbiditou. Mezi používané materiály patří silikon, kolagen, syntetický hydrogel, teflon, autologní tuk a dextranomer-hyaluronová kyselina (NASHA Dx). Augmentační efekt nemusí být trvalý, proto je někdy nutná opakovaná aplikace (2, 24, 41, 42).
Speciální možností augmentace svěračů je lokální aplikace radiofrekvenční energie do vnitřního análního svěrače (tzv. metoda SECCA). Aplikovaná energie vede k remodelaci kolagenu, zvýšení tuhosti tkání a augmentaci svěrače (32, 43). Nedávné review z Cochraneovy databáze konstatovalo, že není k dispozici dostatek kvalitních dlouhodobých studií zaměřených na aplikaci biologických materiálů, tudíž není možné stanovit definitivní závěry a doporučení týkající se augmentace svěračů (42).
Rekonstrukce
Rekonstrukce svěračů představuje tradiční chirurgický přístup k FI s prokázaným defektem sfinkterů. Nejčastěji používanou metodou je sfinkteroplastika provedena overlap technikou (konce dehiscentního svalu jsou uvolněny, překlopeny přes sebe a suturovány). Rekonstrukce svěračů může být doplněna o plikaci levátorů (5, 32, 41).
Z krátkodobého hlediska jsou výsledky rekonstrukčních výkonů na svěračích velmi dobré (zlepšení FI u více než 70 % pacientů), avšak dlouhodobé funkční výsledky nejsou ideální. U většiny nemocných totiž dochází k postupnému zhoršování počátečního léčebného efektu (k trvalému/dlouhodobému zlepšení FI dochází cca v 15–60 % případů). Experti se ovšem shodují v tom, že sfinkteroplastika představuje dobrou modalitu v léčebném managementu inkontinentních pacientů s defektem svěračů (5, 44).
Stimulace
Stimulace sakrálního nervu nabízí posílení reziduální funkce anorekta bez přímé intervence do sfinkterového análního mechanismu. Do blízkosti nervových sakrálních kořenů S2−S4 je implantována stimulační elektroda, která je spojena s pulzním generátorem. Mechanismus účinku stimulace sakrálního nervu na zlepšení anální kontinence je multifaktoriální a není zatím přesně vysvětlen (2, 5, 41).
Stimulace sakrálního nervu je vhodná pro nemocné s těžkou neurogenní inkontinencí a reziduální funkcí svěračů. Výsledky stimulace sakrálního nervu jsou velmi povzbudivé – je dosahováno terapeutického úspěchu u 85–90 % pacientů (5, 32, 45). Velkou nevýhodou této modality v ČR je její cena a skutečnost, že není standardně hrazena zdravotními pojišťovnami (zatím bylo v Česku aplikováno jen několik málo desítek přístrojů, které byly hrazeny z grantových prostředků).
Náhrada svěračů
Efektivním způsobem chirurgické léčby pacientů s těžkou FI je možnost náhrady svěračů – transpozicí vhodných svalů (m. gracilis či m. gluteus maximus) nebo implantací umělého svěrače. Samotná náhrada svěračů transpozicí svalů kolem řitního kanálu nedosahuje dostatečného dlouhodobého efektu, proto je nutná kontinuální nízkofrekvenční elektrická stimulace nervu transponovaného svalu (tzv. dynamická graciloplastika) (5, 41, 45). Umělý anální svěrač je tvořen okluzivní manžetou implantovanou kolem análního kanálu a regulujícím balónkem umístěným prevezikálně, mezi nimiž je tekutina přemísťována pumpou.
Úspěšnost náhrady svěračů v léčbě FI se dle publikovaných studií pohybuje mezi 50 a 85 %. Nevýhodami metody jsou její technická náročnost a vysoké finanční náklady. Navíc je náhrada svěračů zatížena vysokou morbiditou (infekce a technické selhání bylo pozorováno u 30–50 % pacientů), což je obvykle řešitelné jen explantací cizorodého materiálu (umělého svěrače, resp. stimulátoru) (32, 46, 47).
Diverze stolice
Derivace stolice prostřednictvím vytvoření stomie představuje definitivní způsob zvládnutí těžké FI. Obecně je možnost diverze stolice nabízená jen pacientům, u kterých selhaly jiné, výše uvedené způsoby léčby. Pacienti sice obvykle mají negativní postoj k myšlence trvalého střevního vývodu (ze zřejmých estetických, ošetřovatelských a sociálních důvodů), studie však ukazují, že kvalita života pacientů se stomií je mnohem vyšší než u pacientů s těžkou FI (48).
Závěr
Praktičtí lékaři, gastroenterologové i chirurgové hrají principiální roli při diagnostice FI a při poskytování léčebné péče pacientům postiženým FI. Vhodným léčebným postupem může mnoho pacientů dosáhnout výrazného zlepšení symptomů FI a zlepšení kvality života. Časná diagnóza FI navíc vede k prevenci komplikací, které by dále zhoršovaly kvalitu života nemocného.
Korespondenční adresa
MUDr. Peter Ihnát, Ph.D., MBA
Chirurgická klinika Lékařské fakulty OU a Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava
Tel.: 777 571 880
e-mail: peterihnat@yahoo.com
Zdroje
1. Wald A. Fecal incontinence. Curr Treat Options Gastroenterol 2005; 8(4): 319–324.
2. Halland M, Talley NJ. Fecal incontinence: mechanisms and management. Curr Opin Gastroenterol 2012; 28 : 57–62.
3. Norton C, Whitehead WE, Bliss DZ et al. Management of fecal incontinence in adults. Neurourol Urodyn 2010; 29 : 199–206.
4. Johanson JF, Lafferty J. Epidemiology of fecal incontinence: the silent affliction. Am J Gastroenterology 1996; 91(1): 33–36.
5. Herold A. Incontinence. In: Herold A, Lehur PA, Matzel KE, O’Connel PR. European Manual of Medicine: Coloproctology. Springer 2008 : 83–92.
6. Costilla VC, Foxx-Orenstein AE, Mayer AP, Crowell MD. Office-based management of fecal incontinence. Gastroenterol Hepatol 2013; 9(7): 423–433.
7. Bharucha AE, Wald AM. Anorectal disorders. Am J Gastroenterol 2010; 105(4): 786–794.
8. Whitehead WE, Borrud L, Goode PS et al. Fecal incontinence in US adults: epidemiology and risk factors. Gastroenterology 2009; 137 : 512–517.
9. Brown HW, Wexner SD, Segall MM et al. Accidental bowel leakage in the mature women’s health study: prevalence and predictors. Int J Clin Pract 2012; 66 : 1101–1108.
10. Santos VL, Domansky RC, Hanate C et al. Self-reported fecal incontinence in a community-dwelling, urban population in southern Brazil. J Wound Ostomy Continence Nurs 2014; 41(1): 77–83.
11. Damon H, Guye O, Seigneurin A et al. Prevalence of anal incontinence in adults and impact on quality of life. Gastroenterol Clin Biol 2006; 30 : 37–43.
12. Siproudhis L, Pigot F, Godeberge P et al. Defecation disorders: a French population surgery. Dis Colon Rectum 2006; 49 : 219–227.
13. Bharucha AE, Zinsmeister AR, Locke GR et al. Prevalence and burden of fecal incontinence: a population-based study in women. Gastroenterology 2005; 129(1): 42–49.
14. Varma MG, Brown JS, Creasman JM et al. Fecal incontinence in females older than aged 40 years: who is at risk? Dis Colon Rectum 2006;49 : 841–851.
15. Dunivan GC, Heymen S, Palsson OS et al. Fecal incontinence in primary care: prevalence, diagnosis, and health care utilization. Am J Obstet Gynecol 2010; 202 : 493.e1–6.
16. Quander CR, Morris MC, Melson J et al. Prevalence of and factors associated with fecal incontinence in a large community study of older individuals. Am J Gastroenterol 2005; 100 : 908–909.
17. Goode PS, Burgio KL, Halli AD et al. Prevalence and correlates of fecal incontinence in community-dwelling older adults. J Am Geriatr Soc 2005; 53 : 629–635.
18. Joh HK, Seaong MK, Oh SW. Fecal incontinence in elderly Koreans. JAGS 2010; 58 : 116–121.
19. Saga S, Winsnes AG, Morkved S et al. Prevalence and correlates of fecal incontinence among nursing home residents: a population-based cross-sectional study. BMC Geriatrics 2013; 13 : 87.
20. Chassagne P, Landrin I, Neveu C et al. Fecal incontinence in the institutionalized elderly: incidence, risk factors, and prognosis. Am J Med 1999; 106(2): 185–190.
21. Nelson R, Furner S, Jesudason V. Fecal incontinence in Wisconsin nursing homes: prevalence and associations. Dis Colon Rectum 1998; 41(10):1226–1229.
22. Tariq SH, Morley JE, Prather CM. Fecal incontinence in the elderly patient. Am J Med 2003; 15 : 217–227.
23. Nelson RL. Epidemiology of fecal incontinence. Gastroenterology 2004; 126: S3–S7.
24. Wald A. Fecal incontinence in the elderly: epidemiology and management. Drugs Aging 2005; 22(2): 131–139.
25. Parés D, Vial M, Bohle B et al. Prevalence of faecal incontinence and analysis of its impact on quality of life and mental health. Colorectal Dis 2011; 13(8): 899–905.
26. Rockwood TH, Church JM, Fleshman JW et al. Fecal incontinence quality of life scale. Quality of life instrument for patients with fecal incontinence. Dis Colon Rectum 2000; 43 : 9–17.
27. Rao SS. Diagnosis and management of fecal incontinence. American College of Gastroenterology Practice Parameters Committee. Am J Gastroenterol 2004; 99(8): 1585–1604.
28. Markland AD, Goode PS, Burgio KL et al. Incidence and risk factors for fecal incontinence in black and white adults: a population based study. J Am Geriatr Soc 2010; 58 : 1341–1346.
29. Boyle DJ, Knowles CH, Murphy J et al. The effects of age and childbirth on anal sphincter function and morphology in 999 symptomatic female patients with colorectal dysfuncion. Dis Colon Recum 2012; 55 : 286–293.
30. Bharucha AE, Zinsmeister AR, Schleck CD et al. Bowel disturbances are the most important risk factors for late onset fecal incontinence: a population based case-control study in women. Gastroenterology 2010; 139 : 1559–1566.
31. Robertson EN, Gould JC, Wald A. Urinary and fecal incontinence after bariatric surgery. Dig Dis Sci 2010; 55 : 2606–2613.
32. Van Koughnett JA, Wexner SD. Current management of fecal incontinence: choosing amongst treatment options to optimize outcomes. World J Gastroenterol 2013; 19(48): 9216–9230.
33. Bregendahl S, Emmertsen KJ, Lous J, Laurberg S. Bowel dysfunction after low anterior resection with and without neoadjuvant therapy for rectal cancer: a population-based cross-sectional study. Colorectal Disease 2013; 15 : 1130–1139.
34. Bryant CL, Junniss PJ, Knowles CH et al. Anterior resection syndrome. Lancet Oncol 2012; 13: e403–08.
35. Scott SM, Gladman MA. Manometric, sensorimotor, and neurophysiologic evaluation of anorectal function. Gastroenterol Clin N Am 2008; 37 : 511–538.
36. Ihnát P, Vávra P, Guňková P et al. 3D high resolution anorectal manometry in functional anorectal evaluation. Rozhl Chir 2014; 93(11): 524–529.
37. Barnett JL, Hasler WL, Camilleri M. American Gastroenterological Asociation medical position statement on anorectal testing techniques. Gastroenterology 1999; 116 : 732–760.
38. Schnelle JF, Alessi C, Simmons SF et al. Translating clinical research into practice: a randomized controlled trial of exercise and incontinence care with nursing home residents. J Am Geriatr Soc 2002; 50 : 1476–1483.
39. Deutekom M, Dobben A. Plugs for containing fecal incontinence. Cochrane Database Syst Rev 2005: CD005086. Update in: Cochrane Database Syst Rev 2012: CD005086.
40. Norton C, Cody J, Hosker G. Biofeedback and/or sphincter exercises in the treatment of faecal incontinence in adults. Cochrane Database Syst Rev 2006: CD002111.
41. Meurette G, Duchalais E, Lehur PA. Surgical approaches to fecal incontinence in the adult. J Visc Surg 2014; 151 : 29–39.
42. Maeda Y, Laurberg S, Norton C. Perianal injectable bulking agents as treatment for faecal incontinence in adults. Cochrane Database Syst Rev 2013; 2: CD007959.
43. Muller C, Belyaev O, Deska T et al. Fecal incontinence: an up-to-date critical overview of surgical treatment options. Langenbecks Arch Surg 2005; 390 : 544–552.
44. Altomare DF, De Fazio M, Giuliani RT et al. Sphincteroplasty for fecal incontinence in the era of sacral nerve modulation. World J Gastroenterol 2010; 16 : 5267–5271.
45. Maeda Y, Matzel K, Lundby L et al. Postoperative issues of sacral nerve stimulation for fecal incontinence and constipation: a systematic literature review and treatment guideline. Dis Colon Rectum 2011; 54 : 1443–1460.
46. Ruiz Carmona MD, Alos Company R, Roig Vila JV et al. Long-term results of artificial bowel sphincter for the treatment of severe faecal incontinence. Are they what we hoped for? Colorectal Dis 2009; 11 : 831–837.
47. Wong WD, Congliosi SM, Spencer MP et al. The safety and efficacy of the artificial bowel sphincter for fecal incontinence: results from a multicenter cohort study. Dis Colon Rectum 2002; 45 : 1139–1153.
48. Colquhoun P, Kaiser R, Efron J et al. Is the quality of life better in patients with colostomy than patients with fecal incontinence? World J Surg 2006; 30 : 1925–1928.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Jubilanti duben 2016Článek Jubilanti květen 2016Článek Slovo úvodemČlánek Genetika v klinické praxi II
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Slovo úvodem
- Trendy v indikaci vybraných laboratorních metod všeobecnými praktickými lékaři
- Potenciální zdroje ftalátů a bisfenolu A a jejich význam u metabolických onemocnění
- Chirurgická léčba poranění nervů dolních končetin
- Moderní farmakoterapie autoimunitních chorob
- Ambulantní parenterální antibiotická terapie (OPAT)
- Fekální inkontinence – závažný medicínský a společenský problém
- Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
- Hyponatremie u dětí: od patofyziologie k léčbě
- Role inkretinů v energetickém metabolismu a změnách hmotnosti po zanechání kouření
- Biobanky − evropská infrastruktura
- Mezinárodní kongres HandsOn: Biobanks 2015
- Chirurgové a neurochirurgové jako laureáti Nobelovy ceny
- Příspěvek do diskuse – Plénies
- Genetika v klinické praxi II
- Zlatá pamětní medaile ČLS JEP udělena docentu Zdeňku Wünschovi
- K životnímu jubileu prof. MUDr. Jany Pařízkové, DrSc.
- Jubilanti duben 2016
- Jubilanti květen 2016
- Kalendář odborných akcí – květen/červen 2016
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
- Chirurgická léčba poranění nervů dolních končetin
- Hyponatremie u dětí: od patofyziologie k léčbě
- Fekální inkontinence – závažný medicínský a společenský problém
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



