-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aktuální postavení a používání intravenózních imunoglobulinů nejen v intenzivní medicíně
Current position and use of intravenous immunoglobulins not only in intensive care medicine
Antibodies, or immunoglobulins, are one of the corner stones of innate immunity. Their main role is to maintain homeostasis: defence against infection and prevention of cancer and autoimmune diseases. Identification of the physiological role of antibodies stimulated the efforts to use them in therapy, which resulted in their use as intravenous immunoglobulins i.e. IVIG. There are two mechanisms of the therapeutic effects of IVIG: substitution and immunomodulation. The substitution effect takes place in primary immunodeficiencieswhich show impairment of antibody forming capacity. Their immunomodulatory properties are effective in autoimmune and tumor diseases. We present an overview of current knowledge of mechanisms of action of IVIG, their recognized indications in clinical practice, as well as their role and the ongoing debate about their benefits in the treatment of sepsis.
Keywords:
immunoglobulins – antibodies – innate imunity – IVIG – infection – autoimmunity
Autoři: Průcha Miroslav 1; Zazula Roman 2; Sedláčková Lenka 1
Působiště autorů: Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha 1; Anesteziologicko-resuscitační klinika 1. LF UK v Praze a Thomayerovy nemocnice, Praha 2
Vyšlo v časopise: Anest. intenziv. Med., 23, 2012, č. 6, s. 300-306
Kategorie: Přehledový článek
Souhrn
Protilátky, imunoglobuliny, jsou jedním ze základních kamenů vrozené imunity. Jejich hlavní úlohou je zabezpečení homeostázy – obrana proti infekci, ochrana proti vzniku autoimunitních a nádorových onemocnění. Z poznání fyziologické role protilátek se odvíjela snaha o jejich terapeutické využití, jejímž výsledkem je používání intravenózních imunoglobulinů – IVIG. Mechanismy terapeutického účinku IVIG jsou dva – substituční a imunomodulační. Substituční účinek se uplatňuje v případě primárních imunodeficiencí spojených s poruchou tvorby protilátek. Účinek imunomodulační u onemocnění infekční a autoimunitní etiologie a nádorových chorob. Je podán přehled aktuálního stavu vědomostí o mechanismech účinku působení IVIG, doporučených indikací k jejich klinickému použití i diskutované názorové kontroverze na jejich podání v léčbě sepse.
Klíčová slova:
imunoglobuliny – protilátky – vrozená imunita – IVIG – infekce – autoimunitaÚvod
Imunoglobuliny, protilátky, jsou základním kamenem vrozené humorální imunity. Jejich historie sahá do 19. století, kdy Paul Ehrlich poprvé použil tento termín [1]. V průběhu dalších desetiletí se dále prohlubovaly poznatky o tomto nástroji přirozené imunity, a v roce 1972 R. R. Porter společně s G. M. Edelmanem obdrželi Nobelovu cenu za objevení kompletní struktury izotypu imunoglobulinu – IgG. Příprava imunoglobulinů k intravenóznímu podání (IVIG) byla umožněna moderními technologiemi, které izolují IgG z krevní plazmy při zachování jejich biologických vlastností. První i. v. aplikace byla provedena v roce 1980. Imunoglobuliny představují základní nástroj přirozené i získané adaptivní imunity, pokud je posuzujeme v kontextu jejich produkce na přítomnost nových antigenů v organismu.
Článek předkládá přehled používání IVIG, jak jej v současné době hodnotí a doporučuje FDA (Food and Drug Administration) a národní lékařské odborné autority Austrálie. Uvedená doporučení jsme vybrali pro jejich vysokou odbornou a metodologickou úroveň. K podrobnostem k hodnocení užitečnosti podání IVIG v uvedených indikacích odkazujeme na originální texty, kde jsou rozebrány jednotlivé studie a jejich odborná kompetence. Cílem našeho přehledu není ukázat všechna doporučení odborných společností napříč kontinenty, která se mohou lišit (CIGNA, American Academy of Allergy, Asthma and Immunology aj). Problematika podání IVIG se řeší v současnosti a bude zcela jistě řešit i v průběhu následujících let cestou randomizovaných klinických studií (www.clinicaltrials.gov). V ČR v současné době neexistuje konsenzuální doporučení odborných společností k podávání IVIG. Dílčí doporučení byla vydána pro léčbu autoimunitních nervosvalových onemocnění [2].
Struktura a funkce imunoglobulinů
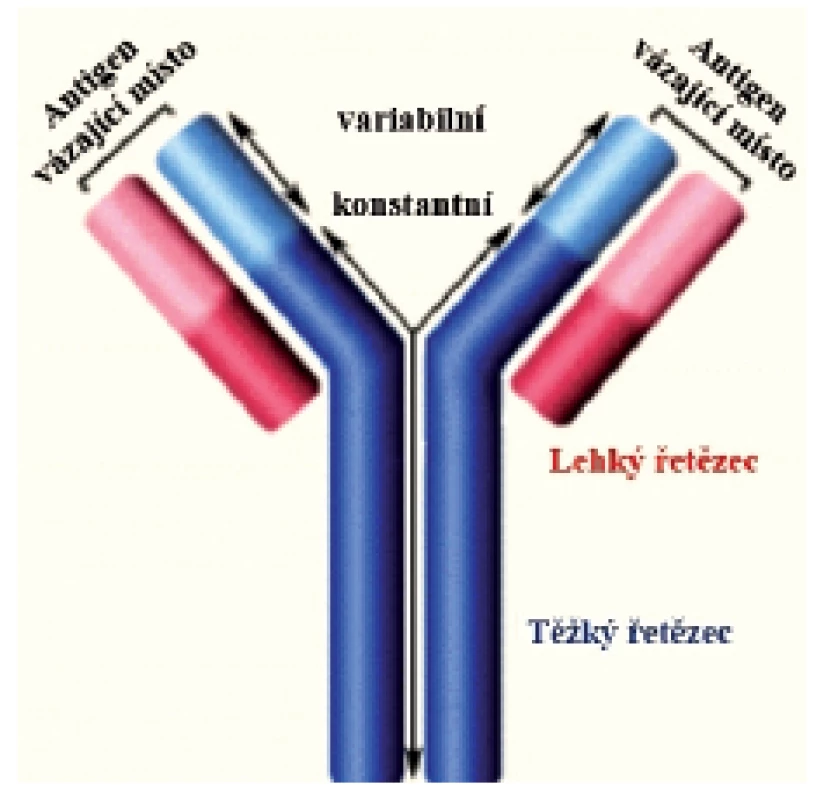
Imunoglobuliny jsou produkovány B lymfocyty. Jsou to látky glykoproteinové povahy. U člověka známe celkem 5 tříd – izotypů imunoglobulinů – označovaných IgG, IgA, IgM, IgE a IgD. IgG obsahuje 4 podtřídy (Ig1–IgG4) a IgA dvě podtřídy (IgA1–IgA2).Každý izotyp Ig je tvořen strukturou rozdílných těžkých a identických lehkých řetězců. Na molekule Ig s charakteristickým tvarem písmene Y (obr. 1) rozeznáváme Fab (fragment, antigen binding) oblasti a Fc (fragment, crystallizable) oblast. Tyto dvě oblasti jsou jedinečné z funčního hlediska. Zatímco Fab oblasti váží antigen, Fc oblast se váže ke specifickým Fc receptorům, které jsou přítomny na imunokompetentních buňkách – neutrofilech, makrofázích, žírných a NK buňkách. Protilátka se tak dostává do kontaktu s patogenem nebo infikovanou buňkou. Aktivita Fc receptorů následně stimuluje makrofágy a cytotoxické buňky k likvidaci mikrobů. Děje se tak mechanismem fagocytózy nebo cytotoxickým mechanismem, v obou případech s účastí protilátek.
Imunoglobuliny k intravenóznímu podání – IVIG – jsou připravovány z plazmy od několika tisíců dárců. IVIG obsahují kompletní IgG molekuly všech čtyř podtříd – IgG1 až IgG4. Ve většině preparátů je přítomno stopové množství IgA, které může senzibilizovat osoby s deficiencí IgA. U opakovaného podání to pak může vést k alergickým reakcím. Imunoglobuliny také obsahují značné množství proteinů přítomných v plazmě – např. antiidiotypové protilátky proti DNA, proti receptoru buněčné smrti – Fas receptoru, acetylcholinovému receptoru. Kromě toho jsou zde přítomny protilátky proti T buněčnému receptoru (TcR), receptoru vázajícímu protilátky (FcγR), metaloproteináze 9 aj. Zvláštní typ IVIG představuje preparát Pentaglobin, IVIG obohacený o IgM, který se používá v terapii sepse.
Přehled jednotlivých tříd protilátek s popisem jejich biologických vlastností a funkcí uvádí tabulky 1 a 2.
Tab. 1. Imunoglobulinové třídy a podtřídy 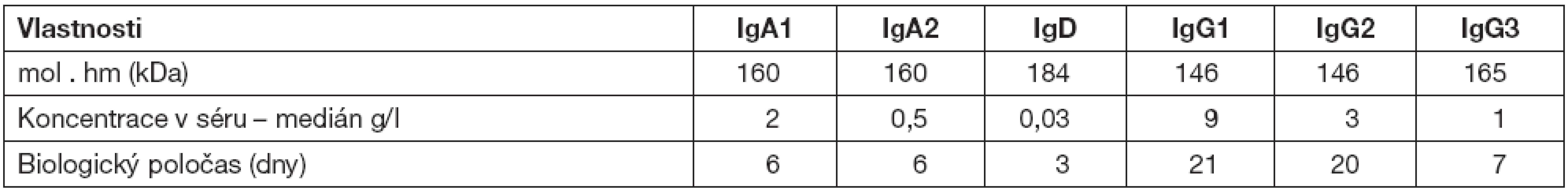
Mechanismy působení IVIG
Substituční efekt
Substituční efekt podání IVIG se uplatňuje u pacientů s primárními imunodeficity a poruchou tvorby protilátek. V roce 2011 byl novelizován seznam primárních imunodeficitů, jejichž počet v současné době dosahuje několika set [3]. IVIG podáváme pouze u onemocnění, která postihují zásadním způsobem tvorbu protilátek. V tomto případě se uplatňuje prostý substituční efekt. Prostřednictvím IVIG jsou dodávány protilátky, které chybí v důsledku úplného nebo částečného deficitu produkce imunoglobulinů.
Imunomodulační efekt
Podrobné mechanismy imunomodulačního působení IVIG dosud nejsou plně objasněny. V experimentálních pracech byly prokázány tyto mechanismy imunomodulačního působení IVIG:
- Inhibice vazby a aktivace komplementu
- Neutralizace autoprotilátek
- Neutralizace superantigenů
- Imunomodulační efekt zprostředkovaný přes Fc receptor
- Suprese produkce cytokinů
Jedním z nejdůležitějších mechanismů je účinek IVIG zprostředkovaný interakcí IVIG s buněčnými Fcγ receptory (FcγR). V experimentu bylo prokázáno, že chybění Fcγ receptorů vede k absenci fagocytózy, ztrátě buněčné cytotoxicity závislé na protilátkách a zabránění produkce prozánětlivých cytokinů. Tento prozánětlivý mechanismus hraje důležitou roli v obraně proti infekci. Vedle prozánětlivého mechanismu účinku mají IVIG významnou protizánětlivou aktivitu opět zprostředkovanou přes Fcγ receptor. Tento efekt se uplatňuje při léčbě autoimunitních zánětlivých onemocnění [4].
Pokud se týká klinického použití IVIG, je jejich potencionální použití značně široké a v jednotlivých zemích se liší doporučení vydaná národními autoritami.
Doporučení k terapeutickému použití IVIG podle FDA a NBA
FDA schválilo používání IVIG u sedmi indikací (tab. 3). Vycházelo přitom z hodnocení Americké akademie pro alergie, astma a imunologii [5].
Tab. 3. FDA doporučení pro léčbu IVIG 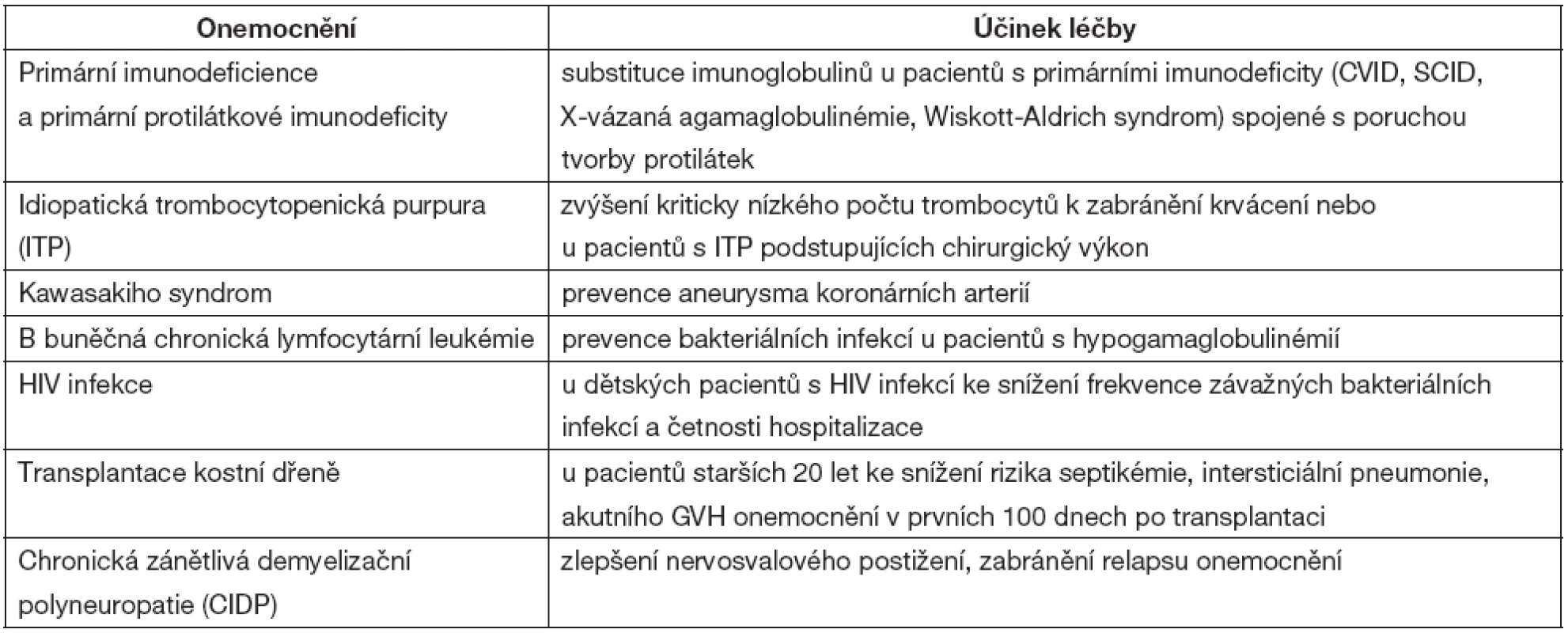
Zemí, kde je velmi sofistikovaným způsobem zpracováno indikace podání IVIG, je Austrálie.
S rozšířeným spektrem použití IVIG se setkáme v materiálech australského ministerstva zdravotnictví s poslední aktualizací v roce 2011 (National Blood Authority – www.nba.gov.au). V letošním roce na základě těchto odborných doporučení vláda rozhodovala o finančním pokrytí nákladů léčby.
V australském modelu jsou indikace rozděleny podle mechanismů účinku – aplikace IVIG s účinkem převážně substitučním a aplikace IVIG s účinkem převážně imunomodulačním.
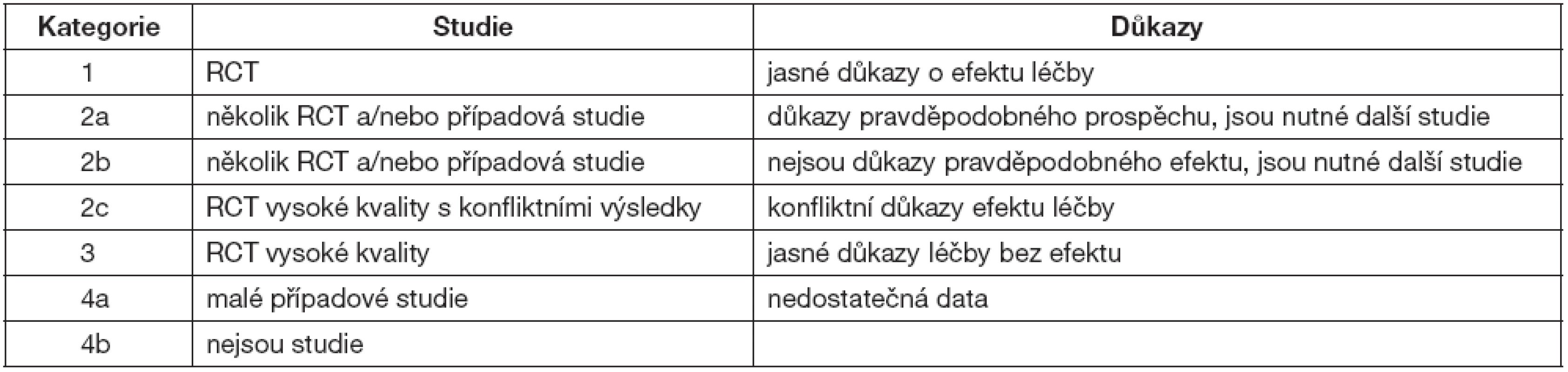
Studie a důkazy o účinnosti IVIG jsou rozděleny podle EBM do několika kategorií – tabulka 4.
RCT – randomizované kontrolované studie
Do kategorie s prokázaným substitučním efektem léčby jsou zařazeny diagnózy uvedené v tabulce 5.
Tab. 5. Onemocnění s podáním IVIG a substitučním efektem 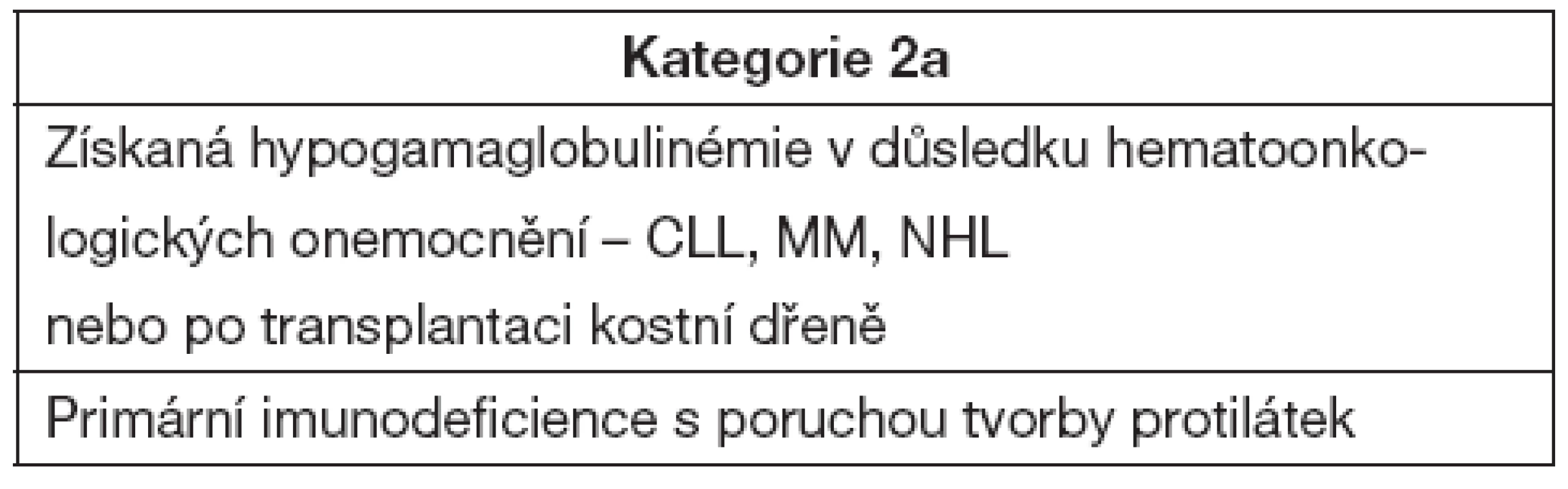
Imunoglobulinová léčba je indikována u nemocných s X-vázanou agamaglobulinémií, běžnou variabilní imunodeficiencí (CVID), deficitem podtříd IgG, hyper-IgM syndromem, Wiskottovým-Aldrichovým syndromem a s různými formami kombinovaných T + Bimunodeficiencí. Ve všech těchto případech se jedná o léčbu substituční s hlavním efektem IVIG jako ochrany proti infekci. Dávkování vychází z biologického poločasu imunoglobulinů a substituční dávka činí 200–800 mg na kg hmotnosti a měsíc. Cílem je dosažení koncentrace 5–6 g/l. V posledních letech se rozšiřuje významným způsobem subkutánní podání, přičemž účinnost je srovnatelná s klasickými IVIG [6]. Podání IVIG není doporučeno u pacientů s deficiencí specifických protilátek.
Ve druhé, početnější skupině onemocnění jsou diagnózy, u kterých je terapeutický efekt dán imunomodulačním působením IVIG – tabulky 6 a 7.
Tab. 6. Onemocnění s prokázaným modulačním efektem léčby IVIG 
Tab. 7. Onemocnění se zkoumáním efektu léčby IVIG 
Komentář
Jak je z uvedeného přehledu patrné, podstatnou část diagnóz, kde se využívá imunomodulačního působení IVIG, jsou onemocnění s účastí autoimunitní složky. Mechanismy terapeutického účinku IVIG jsou stále objasněny jen částečně. Některé z nich byly zmíněny v úvodu tohoto článku. Není nadsázkou říci, že imunoglobuliny představují velmi významný prvek vrozené imunity, který se podílí na zachování homeostázy. Jejich funkcí je obrana proti infekci a imunomodulační aktivita při probíhajícím zánětu [7]. Zajímavou podmnožinu imunoglobulinů-protilátek představují tzv. přirozené protilátky, které jsou produkovány B lymfocyty bez antigenní stimulace a jsou obsaženy také v IVIG. Tyto přirozené protilátky představují první obrannou linii proti infekčním agens. Rovněž byla prokázána jejich role v nádorovém dohledu, protizánětlivém působení a ochraně proti autoimunitním onemocněním [8]. Protizánětlivé působení a ochrana proti vzniku autoimunitních onemocnění je zprostředkovaná interakcemi IVIG s imunokompetentními buňkami – zvláště populací antigen prezentujících buněk, dendritických buněk a T lymfocytů [9, 10, 11]. Ve zcela recentní studii na modelu transgenních myší autoři prokázali, že protizánětlivý účinek IVIG spočívá ve zvýšené produkci IL-33 a IL-4 s následným ovlivněním exprese FcγRIIB receptoru. Výsledkem je potlačení autoprotilátkami zprostředkovaného zánětu [12]. Jde tedy o ovlivnění zánětu cestou Th2 imunitní odpovědi, což přináší zajímavé konsekvence do oblasti imunomodulačního působení IVIG u sepse.
Z hlediska mechanismů imunomodulačního působení hraje zásadní roli receptor pro Fc oblast IgG. V současnosti známe u člověka tři typy Fcγ receptorů – FcγRIII(CD16), FcγRII(CD32) a FcγRI(CD64). Tyto receptory jsou exprimovány na imunokompetentních buňkách a jsou dnes považovány za jednoho z nejdůležitějších regulátorů imunitní odpovědi. Z hlediska imunitních regulací je z uvedené skupiny dominantní FcγRII. Byly nalezeny různé formy FcγRII receptoru s rozdílnými funkcemi – FcγRIIA, FcγRIIB a FcγRIIC, z nichž jediným inhibičně působícím receptorem je FcγRIIB. Tato imunomodulační funkce se uplatňuje v případě infekcí, stejně jako v případě zánětlivých autoimunitních onemocnění. V případě infekce vazba mezi protilátkou IgG vázanou na patogenu a aktivovaným Fcγ receptorem vede k odstranění patogenu mechanismem ADCC (antibody dependent cell mediated cytotoxicity). Fcγ receptory se také účastní v neutralizaci toxinů vazbou s IgG protilátkou. U infekčních onemocnění jsou důkazy, že FcγRIIb ovlivňuje nejen clearance patogenů, ale také intenzitu zánětlivé odpovědi, respektive přechod od kontroly infekce k nekontrolovanému SIRS a septickému šoku [13].
V případě autoimunitních onemocnění se používají IVIG ve vysokých dávkách. Předpokládá se jejich působení prostřednictvím neutralizace patogenních autoprotilátek anti-idiotypovými protilátkami, ovlivněním produkce cytokinů nebo neutralizací C3a C5a složek komplementu. Ukázalo se však, že Fc receptor samotný má stejně důležitou roli, protože jeho nepřítomnost zablokuje účinek IVIG při léčbě ITP nebo jiných autoimunitních onemocnění [14]. Recentní studie prokázala efekt IVIG na produkci IL-17 ovlivněním intracelulárních signálů. IL-17 hraje významnou roli při vzniku autoimunitních onemocnění [15].
Dávkování IVIG
Z hlediska doporučené terapeutické dávky rozlišujeme několik skupin onemocnění. V případě podání IVIG u pacientů s primárními imunodeficity dávka vychází z biologického poločasu IgG. Jde o dávku substituční, která se pohybuje u individuálních pacientů v rozmezí 300–800 mg/kg a měsíc. Doporučuje se dosažení koncentrace 5–6 g/l, při které byl prokázán pokles infekčních komplikací.
U onemocnění s autoimunitní etiologií se podává imunomodulační/imunosupresivní dávka. V podrobnostech se může lišit, ale základní imunomodulační/imunosupresivní dávka jsou 2 g/kg podané ve 2–5 rozdělených dávkách (při kontinuálním způsobu podání – dnech) s eventuálním opakováním v dávce 1 g/kg v dalších měsících.
Nežádoucí účinky při podání IVIG
Podání IVIG může způsobit nežádoucí vedlejší účinky, které souvisí jednak s přítomností IgA agregátů v podaných preparátech, eventuálně se na nich mohou podílet jiné látky obsažené v IVIG. Přibližně u 30 % pacientů, kteří dostanou IVIG, se vyvinou vedlejší reakce po jejich podání – horečka, zimnice, bolesti hlavy, bolesti beder. Tyto obtíže jsou různé intenzity a různé doby trvání. Je proto zbytečné paušální podání profylaxe těchto reakcí u všech pacientů, ale pro podání se rozhodujeme na základě anamnézy a individuální zkušenosti s konkrétním pacientem. Doporučena jsou nesteroidní antiflogistika nebo antihistaminikum před podáním infuze IVIG. Další možností je podání menšího bolusu kortikosteroidů.
U onemocnění, kde se využívá potenciál substituční terapie IVIG, je mechanismus působení prostý – nahrazení nedostatku produkovaných protilátek B lymfocyty. Zvláštním příkladem onemocnění, kde se prolíná efekt substituční a imunomodulační, je sepse. Vzhledem k rozdílným názorům na použití IVIG v léčbě sepse předkládáme podrobnější rozbor této problematiky.
Mechanismy účinků IVIG v procesu infekce
- a) Substituční a inaktivační – neutralizace endotoxinů a exotoxinů, zvýšení clearance endotoxinu, redukce adherence bakterií, jejich migrace a invazivnosti.
- b) Imunomodulační – stimulace leukocytů a baktericidie, zvýšení oxidativního vzplanutí při použití7S-IVIG nebo intaktního IgG, redukce endotoxinem indukovaného oxidativního vzplanutí při použití 5S-IVIG nebo Fab IgG fragmentu a IgM, zvýšení opsonizační aktivity séra.
- c) Imunomodulační efekt na produkci cytokinů – snížení produkce prozánětlivých mediátorů, zvýšení produkce protizánětlivých mediátorů, neutralizace cytokinů anti-cytokinovými protilátkami.
V nedávné době byly prezentovány tři metaanalýzy k podání IVIG u pacientů se sepsí. Metaanalýza Lauplanda [16] hodnotila 14 randomizovaných klinických studií z let 1988–2006. Ve studiích byli zařazeni pacienti s těžkou sepsí nebo septickým šokem, a byl testován efekt IVIG na mortalitu. Metaanalýza prokázala významnou redukci mortality u pacientů, kteří dostali IVIG (odds ratio 0,66; 95% CI 0,53–0,83, p < 0,0005). Větší terapeutický efekt byl zaznamenán u studií s menší metodologickou kvalitou a ve studiích s vyšší podanou dávkou IVIG. Turgeon et al. [17] hodnotili publikované práce od roku 1996 do roku 2006. Ze 4 096 studií bylo vybráno 20 s 2 621 pacienty. Byl prokázán příznivý efekt podání IVIG na mortalitu pacientů (RR ratio 0,74, 95% CI 0,62–0,89, p = 0,001).Metaanalýza Kreymanna prokázala rovněž příznivý efekt podání IVIG u dospělých pacientů (RR 0,79; CI 0,69–0,90 p < 0,0003), stejně jako v populaci dětí a novorozenců (RR 0,56; 95% CI 0,42–0,74,p < 0,0001) [18]. Naproti tomu v loňském roce prezentované výsledky multicentrické studie nepodpořily benefit podání IVIG u novorozenců [19].
V populaci dospělých multicentrická studie SBTIS (Score-based immunoglobulin G therapy of patients with sepsis) neprokázala pozitivní účinek podání IVIG na mortalitu v dávce 0,9 g/kg hmotnosti [20].
Jsou přesto pracoviště, kde podávají IVIG rutinně. Italská studie prokazuje benefit podání IVIG obsahující IgM v časné fázi těžké sepse a septického šoku [21], Rankinova studie obhajuje příznivý efekt IVIG u pacientů po kardiochirurgickém výkonu [22]. V obou studiích se jedná spíše o imunomodulační efekt IVIG, ne substituční.
Zvláštní skupinu infekčních onemocnění, respektive sepse, představuje streptokokový a stafylokokový septický šok a nekrotizující stafylokoková plicní infekce s průkazem Panton-Valentinova leukocidinu. U těchto pacientů se doporučuje podání 1–2 g/kghmotnosti po dobu 3 dnů. Je nutné zmínit, že experimentálně se prokázal nižší efekt polyklonálních imunoglobulinů na inhibici stafylokokového superantigenu ve srovnání se streptokokovým [23]. Doporučuje se proto podání vyšší dávky v případě stafylokokového septického šoku. Neexistují velké randomizované studie, nicméně jednotlivé kazuistiky dokazují užitečnost léčby IVIG [24].
V poslední době se opět významným způsobem diskutuje o otázce srovnání účinnosti preparátu obohaceného o IgM (Pentaglobin). Podle některých studií je tento způsob terapie účinnější ve srovnání s použitím klasických polyvalentních IgG preparátů. Zajímavý výsledek k tomuto tématu nabídla experimentální studie se srovnáním IVIG, kde byly selektivně vyřazeny protilátky izotypu IgG nebo naopak IgM. Vyšší mortalita byla ve skupině zvířat, kde byly selektivně vyřazeny protilátky izotypu IgG [25].
Jak je vidět z uvedeného přehledu, existuje rozpor mezi výsledky jednotlivých studií, i mezi závěry provedených metaanalýz a aktuálním doporučením expertů pro léčbu sepse. V posledních doporučeních „Surviving Sepsis Campaigne“ (www.survivingsepsis.org) není podání IVIG doporučeno v léčbě sepse a septického šoku.
Osobní přístup autorů je následující: za racionální indikaci pro podání IVIG považujeme zjištění hypogamaglobulinémie u pacientů s těžkou sepsí nebo septickým šokem. Z osobních zkušeností autorů s léčbou pacientů s primárními imunodeficity vyplývá, že kritickou hodnotou IgG, při které se objevují závažné infekční komplikace, je hodnota nižší než 4 g/l. Důležitým aspektem podání IVIG je cílová skupina pacientů. Bude se lišit strategie podání u pacientů po akutním chirurgickém výkonu nebo pacientů dlouhodobě ležících na jednotkách intenzivní péče s prokázaným imunodeficitem v buněčné a protilátkové imunitě. Z praktického hlediska je důležité posouzení dostatečné dávky podaných IVIG. U pacientů v sepsi je snížena jednak produkce specifických protilátek proti infekčním agens, jednak dochází k redistribuci imunoglobulinů v krevním řečišti, čímž se snižuje jejich praktická využitelnost k likvidaci infekce. Jednoduché měření dynamiky koncentrace protilátek po podání IVIG poskytuje užitečnou pomůckuk orientaci, zda poskytnutá dávka je dostatečná. Přístup autorů je takový, že substituci u pacientů s těžkou sepsí nebo septickým šokem a prokázanou hypogamaglobulinémií ukončují po dosažení koncentrace minimálně 5–6 g/l, respektive zvýšení koncentrace IgG po podání IVIG o 1–2 g/l.
Samostatnou kapitolu přesahující rámec tohoto článku představuje terapeutické využití imunoglobulinů vytvořených rekombinantně a používaných v léčbě nádorových onemocnění.
Preparáty registrované v ČR
V tabulce 8 jsou uvedeny preparáty registrované v ČR. Pro úplnost uvádíme jak preparáty pro intravaskulární, tak extravaskulární podání – tabulka 8.
Tab. 8. Preparáty registrované v ČR 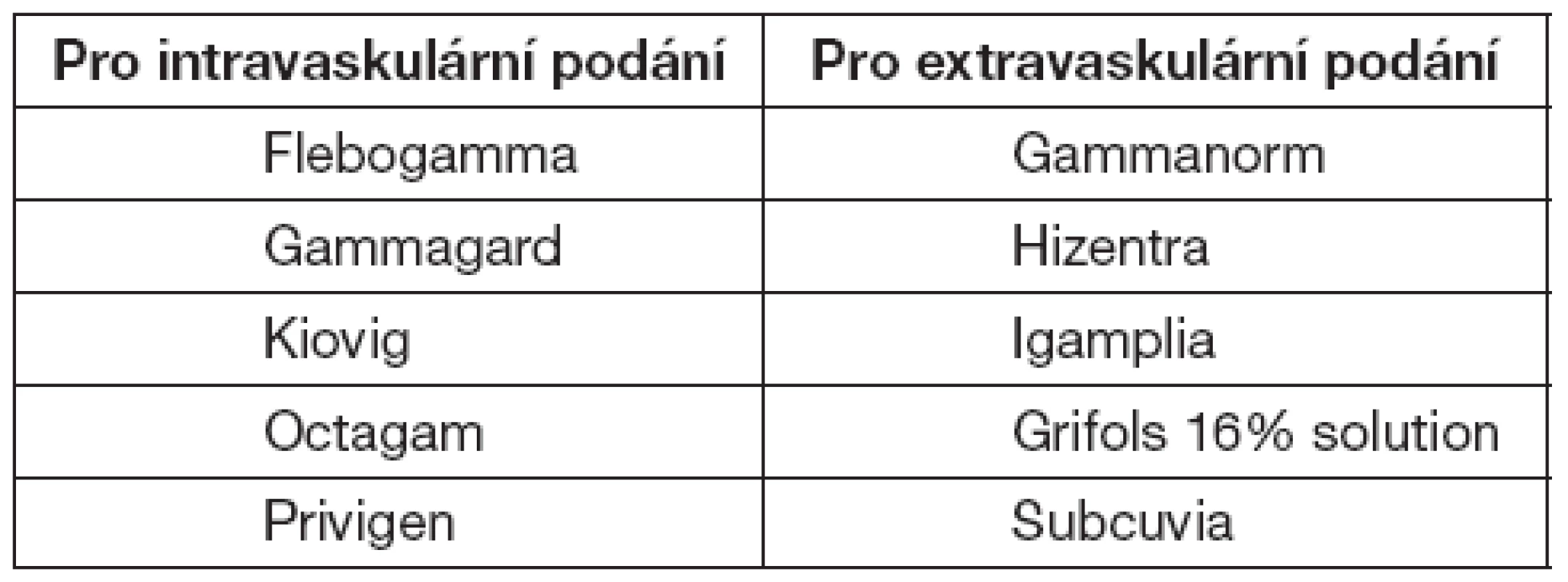
Závěr
Imunoglobuliny, protilátky, představují účinný nástroj systému vrozené imunity. Jejich aplikační forma v lidské medicíně – intravenózní imunoglobuliny – představuje v řadě případů účinný a dosud nenahraditelný terapeutický nástroj jak v případě onemocnění s defektem tvorby protilátek, tak u onemocnění autoimunitních nebo nádorových.
Za technickou spolupráci děkujeme p. Petru Šiklovi.
Do redakce došlo dne 27. 7. 2012.
Do tisku přijato dne 1. 10. 2012.
Adresa pro korespondenci:
Doc. MUDr. Miroslav Průcha, Ph.D.
Oddělení klinické biochemie, hematologie a imunologie
Nemocnice Na HomolceRoentgenova 2150 30 Praha 5
e-mail: miroslav.prucha@homolka.cz
Zdroje
1. Lindenmann, J. Origin of the Terms ‚Antibody‘ and Antigen. Scand. J. Immunol., 1984, 19, p. 281–5.
2. Bednařik, J., Voháňka, S., Ehler, E., Amber, Z., Piťha, J., Vencovský, J., Litzman, J., Kořistek, Z., Suchý, M., Pata, M., Kožený, P. Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenoznim lidským imunoglobulinem a plazmaferézou. Česk. Slov. Neurol., 2010, 73, 106, s. 579–589.
3. Al-Herz, W., Bousfiha, A., Casanova, J. L., Chapel, H., Conley, M. E., Cunningham – Rundles, C., Etzioni, A., Fischer, A., Franco, J. L., Geha, R. S., Hammarström, L., Nonoyama, S., Notarangelo, L. D., Ochs, H. D., Puck, J. M.,Roifman, C. M., Seger, R., Tang, M. L. Primary immunodeficiency diseases: an update on the classification from the international union of immunological societies expert committee for primary immunodeficiency. Front. Immunol., 2001, 2, p. 54–58.
4. Nimmerjahn, F., Ravetch, J. V. Fc gamma receptors as regulators of immune responses. Nat. Rev. Immunol., 2008, 8, p.34–47.
5. Orange, J. S., Hossny, E. M., Weiler, C. R., Ballow, M., Berger, M., Bonilla, F. A., Buckley, R., Chinen, J., El-Gamal, Y., Mazer, B. D., Nelson, R. P. Jr, Patel, D. D., Secord, E., Sorensen, R. U., Wasserman, R. L., Cunningham-Rundles, C. Use of intravenous immunoglobulin in human disease: a review of evidence by members of the Primary Immunodeficiency Committee of the American Academy of Allergy, Asthma, and Immunology. J. Allergy Clin. Immunol., 2006, 117, S525–S553.
6. Berger, M. Choices in IgG replacement therapy for primary immune deficiency diseases: subcutaneous IgG vs. intravenous IgG and selecting an optimal dose. Curr. Opin. Allergy Clin. Immunol., 2011, 11, p. 532–538.
7. Casadevall, A., Pirofski, L. A. A new synthesis for antibody-mediated immunity. Nat. Immunol., 2011, 13, p. 21–28.
8. Schwartz-Albiez, R., Monteiro, R. C., Rodriguez, M., Binder, C. J., Shoenfeld, Y. Natural antibodies, intravenous immunoglobulin and their role in autoimmunity, cancer and inflammation. Clin. Exp. Immunol., 2009, 158, Suppl 1, p. 43–50.
9. Negi, V. S., Elluru, S., Sibéril, S., Graff-Dubois, S., Mouthon, L., Kazatchkine, M. D., Lacroix-Desmazes, S., Bayry, J., Kaveri, S. V. Intravenous immunoglobulin: an update on the clinical use and mechanisms of action. J. Clin.Immunol., 2007, 27, p. 233–245.
10. Tha-In, T., Metselaar, H. J., Tilanus, H. W. Intravenous immunoglobulins suppress T celll priming by modulating the bi-directional interaction between dendritic cells and natural killer cells. Blood, 2007, 110, p. 3253–3262.
11. Chong, B. H., Chong, J. J. H. IVIG immune inhibitory aktivity: APC is key. Blood, 2010, 115, p. 1663–1664.
12. Anthony, R. M., Kobayashi, T., Wermeling, F., Ravetch, J. V. Intravenous gammaglobulin suppresses inflammation through a novel T(H)2 pathway. Nature, 2011, 475, p. 110–113.
13. Smith, K. G., Clatworthy, M. R. FcgammaRIIB in autoimmunity and infection: evolutionary and therapeutic implications. Nat. Rev. Immunol., 2010, 10, p. 328–343.
14. Kaneko, Y., Nimmerjahn, F., Ravetch, J. V. Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation. Science, 2006, 313, p. 670–673.
15. Maddur, M. S., Sharma, M., Hegde, P., Lacroix-Desmazes, S., Kaveri, S. V., Bayry, J. Inhibitory Effect of IVIG on IL-17 Production by Th17 Cells is Independent of Anti-IL-17 Antibodies in the Immunoglobulin Preparations. J. Clin.Immunol., 2012, DOI: 10.1007/s10875-012-9752-6.
16. Laupland, K. B., Kirkpatrick, A. W., Delaney, A. Polyclonal intravenous immunoglobulin for the treatment of severe sepsis and septic shock in critically ill adults: A systematic review and meta-analysis. Crit. Care Med., 2007, 35, p. 2686–2692.
17. Turgeon, A. F., Hutton, B., Fergusson, D. A., McIntyre, L., Tinmouth, A. A., Cameron, D. W., Hébert, P. C. Meta-analysis: intravenous immunoglobulin in critically ill adult patients with sepsis. Ann. Intern. Med., 2007, 146, p. 193–201.
18. Kreymann, K. G., de Heer, G., Nierhaus, A., Kluge, S. Use of polyclonal immunoglobulins as adjunctive therapy for sepsis or septic shock. Crit. Care Med., 2007, 35, p. 2677–2685.
19. INIS Collaborative Group, Brocklehurst, P., Farrell, B., King, A., Juszczak, E., Darlow, B., Haque, K., Salt, A., Stenson, B., Tarnow-Mordi, W. Treatment of neonatal sepsis with intravenous immune globulin. N. Engl. J. Med., 2011, 365, p. 1201–1211.
20. Werdan, K., Pilz, G., Bujdoso, O., Fraunberger, P., Neeser, G., Schmieder, R.E., Viell, B., Marget, W., Seewald, M., Walger, P., Stuttmann, R., Speichermann, N., Peckelsen, C.,Kurowski, V., Osterhues, H.H., Verner, L., Neumann, R., Müller-Werdan, U. Score-Based Immunoglobulin Therapy of Sepsis (SBITS) Study Group: Score-based immunoglobulin G therapy of patients with sepsis: the SBITS study. Crit. Care Med., 2007, 35, p. 2693–2701.
21. Berlot, G., Vassallo, M. C., Busetto, N., Bianchi, M., Zornada, F., Rosato, I., Tartamella, F., Prisco, L., Bigotto, F., Bigolin, T., Ferluga, M., Batticci, I., Michelone, E.,Borelli, M., Viviani, M., Tomasini, A. Relationship between the timing of administration of IgM and IgA enriched immunoglobulins in patients with severe sepsis and septic shock and the outcome: a retrospective analysis. J. Crit. Care, 2012, 27, p. 167–171.
22. Darenberg, J., Söderquist, B., Normark, B. H., Norrby-Teglund, A. Differences in potency of intravenous polyspecific immunoglobulin G against streptococcal and staphylococcal superantigens: implications for therapy of toxic shock syndrome. Clin. Infect. Dis., 2004, 38, p. 836–842.
23. Rankin, J. S., Oguntolu, O., Binford, R. S., Trochtenberg, D. S., Muhlbaier, L. H., Stratton, C. W. Management of immune dysfunction after adult cardiac surgery. J. Thorac. Cardiovasc. Surg., 2011, 142, p. 575–580.
24. Raithatha, A. H., Bryden, D. C. Use of intravenous immunoglobulin therapy in the treatment of septic shock, in particular severe invasive group A streptococcal disease. Indian J. Crit. Care Med., 2012, 16, p. 37–40.
25. Moitra, R., Beal, D. R., Belikoff, B. G., Remick, D. G. Presence of preexisting antibodies mediates survival in sepsis. Shock, 2012, 37, p. 56–62.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2012 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Historie a vývoj oboru anesteziologie, resuscitace a intenzivní medicína v České republice z pohledu časových milníků a statistických čísel
- Urgentní antagonizace warfarinu a použití subarachnoidální anestezie
- Identifikace potenciálních dárců orgánů po nevratné zástavě oběhu na pracovišti intenzivní medicíny
- Aktuální postavení a používání intravenózních imunoglobulinů nejen v intenzivní medicíně
- Arytmie a jejich léčba (v prostředí JIP)
- Co to je Windkessel efekt?
-
Red Blood Cell Transfusion: A Clinical Practice Guideline from the AABB
(American Association of Blood Banks) - VI. kongres intenzivní medicíny v Plzni a 15. Minářovy dny
- K editorialu Černý V.: „Houston, we have a problem“ aneb kde máme hledat příčiny neúspěchu u atestací našeho oboru?
- XIX. kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny
- Statistika oboru anesteziologie a resuscitace ARO, KAR
- Výborová schůze ČSARIM
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Statistika oboru anesteziologie a resuscitace ARO, KAR
- Arytmie a jejich léčba (v prostředí JIP)
- Historie a vývoj oboru anesteziologie, resuscitace a intenzivní medicína v České republice z pohledu časových milníků a statistických čísel
- Aktuální postavení a používání intravenózních imunoglobulinů nejen v intenzivní medicíně
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy