-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tromboprofylaxe a neuroaxiální anestezie v porodnictví
Thromboprophylaxis and neuroaxial anaesthesia in obstetrics
Spinal hematoma (SH) after neuraxial puncture is considered the most serious complication of regional anaesthesia. The risk is further significantly increased by co-administration of thromboprophylaxis with low molecular weight heparins (LMWH). In the 1990s, the risk of SH on the basis of published case reports was estimated as 1 : 1 000 000. These estimates are now closer to 1 : 3 000. Concomitant application of LMWH is responsible for such a dramatic increase of the risk of SH, especially in orthopaedics. Therefore, a number of anaesthesiology societies have adopted a recommendation concerning the time relation between the administration of neuraxial anaesthesia and LMWH applications. Generally, the risks are only approximated for the low incidence of SH, and for pregnant women this risk is estimated between 1 : 200 000 and 1 : 400 000. If there is an increased risk of SH with concomitant LMWH in orthopaedic patients, in the case of obstetric anaesthesia this increased risk is very questionable. So far there has not been a single published case report giving the context of SH and LMWH use in pregnancy, which, in addition to the physiological hypercoagulable state, differs in altered pharmacokinetics and pharmacodynamics of LMWH. The following text attempts to summarize the current information available regarding the relation of thromboprophylaxis and the risk of spinal hematoma in obstetrics.
Keywords:
LMWH – thromboprophylaxis – regional anaesthesia – spinal haematoma – pregnancy
Autoři: Bláha Jan 1; Nosková Pavlína 1; Kolníková Ivana 1; Bláhová Kateřina 2
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF UK a VFN v Praze 1; Gynekologicko-porodnická klinika VFN v Praze 2
Vyšlo v časopise: Anest. intenziv. Med., 23, 2012, č. 1, s. 42-49
Kategorie: Anesteziologie - Přehledový článek
Souhrn
Vznik spinálního hematomu (SH) při neuroaxiální punkci je považován za nejzávažnější komplikaci regionální anestezie, jejíž riziko významně stoupá při současné aplikaci tromboprofylaxe nízkomolekulárními hepariny (LMWH). Jestliže v 90. letech minulého století se riziko SH na podkladě publikovaných kazuistik odhadovalo na 1 : 1 000 000, dnes se tyto odhady blíží až hranici 1 : 3 000. Za takto dramatický vzestup rizika SH, především v ortopedii, jsou zodpovědné právě současně aplikované LMWH. Řadou odborných společností proto byla přijata doporučení, týkající se časových souvislostí mezi podáním neuroaxiální anestezie a aplikací LMWH. Pro nízkou četnost výskytu jsou obecně rizika SH pouze odvozena, přičemž pro těhotné ženy se toto riziko odhaduje mezi 1 : 200 000 až 1 : 400 000. Jestliže u ortopedických či chirurgických pacientů existuje zvýšené riziko vzniku SH při současné aplikaci LMWH, tak v případě porodnické anestezie je toto zvýšené riziko velmi nepravděpodobné. Doposud nebyla publikována ani jediná kazuistika dávající do souvislosti SH a aplikaci LMWH v těhotenství, které se vedle fyziologického hyperkoagulačního stavu liší i změněnou farmakokinetikou a farmakodynamikou LMWH. Následující text se proto snaží podat souhrn dnes dostupných informací týkajících se vztahu tromboprofylaxe a rizika vzniku spinálního hematomu v porodnictví.
Klíčová slova:
LMWH – tromboprofylaxe – regionální anestezie – spinální hematom – těhotenstvíÚvod
Z pohledu anesteziologa charakterizuje těhotenství asi nejlépe termín „jiný stav“. Fyziologické změny související s těhotenstvím a přítomnost plodu zcela zásadně ovlivňují anesteziologické postupy. Jedním z nejproblematičtějších momentů porodnické anestezie je pak vysoké, proti normální populaci 10krát zvýšené riziko obtížné intubace [1–4]. Vedle sociálně-emocionálních důvodů je toto riziko hlavním důvodem, proč dnes v porodnictví jednoznačně dominuje regionální anestezie nad anestezií celkovou. Současně ale v posledních letech stoupá počet rodiček, kterým je pro zvýšené riziko trombembolické nemoci (TEN) již v prepartálním období nasazena profylaktická antikoagulační léčba, nejčastěji nízkomolekulární hepariny (low molecular weight heparins; LMWH). Podle obecných chirurgických dat tato tromboprofylaxe může zvyšovat riziko vzniku spinálního hematomu, pro svou fatálnost nejzávažnější komplikace regionální anestezie. Do přímého střetu se tak v porodnické praxi relativně často dostává riziko obtížné intubace a riziko spinálního hematomu. Zatímco zvýšené riziko obtížné intubace je u těhotných žen nezpochybnitelné, vliv tromboprofylaxe na riziko vzniku spinálního hematomu je u těhotných, na rozdíl např. od ortopedických pacientů, minimálně velmi diskutabilní. Následující text si proto klade za cíl poskytnout současný přehled evidence a expertních názorů na tuto problematiku.
Trombembolická nemoc v těhotenství
Trombembolická nemoc patří ve vyspělých zemích k nejčastější příčině mateřské mortality a tvoří okolo 10 % všech úmrtí [5–7]. Hlavní příčinou 3–4krát zvýšeného rizika trombembolie v těhotenství a v postpartálním období oproti netěhotným [8] je fyziologický hyperkoagulační stav, který má chránit ženu při porodu či potratu proti nadměrné krevní ztrátě. Prokoagulační změny nastupují od počátku těhotenství, maxima dosahují v období okolo porodu a především v šestinedělí, k výchozímu stavu se pak vrací přibližně 8 týdnů po porodu – výskyt TEN v šestinedělí je proto až 5krát vyšší než v období vlastního těhotenství [9, 10]. Incidence TEN se v Evropě a USA odhaduje na 0,76–1,72 případů/1000 těhotenství, s mortalitou 1,1–1,5/100 000 porodů [11–13]. Hlavními rizikovými faktory, vedle vlastního těhotenství, jsou případné trombofilie, vyšší věk, vícečetné těhotenství, obezita či císařský řez (SC). I přes to, že v těhotenství je riziko TEN 5–10krát vyšší [14], naprostá většina těhotných žen preventivní antikoagulaci nepotřebuje. Výjimkou jsou těhotné ženy s deficitem proteinu C, proteinu S a antitrombinu, získané mateřské trombofilie (např. syndrom antifosfolipidových protilátek) a především homozygotní formy mutace faktoru II a V (Leiden), které až 10násobně zvyšují v těhotenství riziko TEN, při kombinaci obou je riziko dokonce až 70násobně vyšší! Naopak mutace metylentetrahydrofolátreduktázy (MTHFR) není dnes již dávána do souvislostí se zvýšeným rizikem TEN, a to ani její homozygotní forma [14–17].
Paušálně je tromboprofylaxe v těhotenství dnes doporučována především u císařského řezu, tak jako u jiného chirurgického výkonu, přičemž aplikace nízkomolekulárního heparinu je v těhotenství preferována před aplikací nefrakcionovaného heparinu (UFH) [16, 18]. V porovnání s UFH vykazují LMWH významné farmakokinetické a farmakodynamické odlišnosti. Asi nejpodstatnějšími přednostmi LMWH jsou až 90% biologická dostupnost po subkutánní aplikaci a relativně standardní antikoagulační aktivita, dosahující vrcholu 3–4 hodiny po podání a jejíž rutinní monitorování není nutné. Biologický poločas LMWH je v porovnání s heparinem prodloužen 3–4krát. Na rozdíl od standardního heparinu mají nízkomolekulární hepariny i fibrinolytické účinky a ovlivňují funkci trombocytů. Jsou schopny až 4krát účinněji inhibovat faktor Xa než faktor II. Předpokládá se, že ve srovnání s nefrakcionovaným heparinem účinněji brání vzniku trombu bez rizika zvýšené krvácivosti. Standardní evropské doporučované dávkovací schéma LMWH v těhotenství je uvedeno v tabulce 1. K tomuto dávkování je ale nutno uvést, že toto schéma je vlastně pouze převzato od chirurgických/ortopedických pacientů, tj. není přizpůsobeno fyziologicky odlišnému těhotenství. Těhotné ženy se přitom od ostatních pacientů podstatně liší nejen svým věkem a výskytem komorbidit či ostatních komplikací, ale především se odlišují fyziologickým posunem koagulační rovnováhy na stranu hyperkoagulace.
Tab. 1. Dávkování nízkomolekulárních heparinů v těhotenství podle doporučení Royal College of Obstetrics and Gynaecologists (UK) [19, 20] T ![Dávkování nízkomolekulárních heparinů v těhotenství podle doporučení Royal College of Obstetrics and Gynaecologists (UK) [19, 20] T](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/92e438282d0954025eccbf89bff20c02.png)
*Může být aplikováno ve dvou rozdělených dávkách. Spinální hematom po neuroaxiální punkci
Krvácení do páteřního kanálu po neuroaxiální (epidurální nebo subarachnoidální) punkci se vznikem klinicky významného hematomu je nepochybně jednou z nejzávažnějších komplikací, které mohou anesteziologa v jeho profesionální kariéře potkat [21]. Ke vzniku spinálního hematomu dochází především při poranění epidurálního žilního plexu. Klinicky probíhá zpočátku krvácení do epidurálního prostoru nepozorovaně, ale jeho důsledky bývají fatální. Narůstající hematom v uzavřeném prostoru páteřního kanálu může způsobit míšní kompresi s ischémií, a nedojde-li k jeho evakuaci do 6–8 hodin od vzniku prvních příznaků, hrozí vznik trvalé paraplegie [22, 23]. Krvácení do subarachnoidálního prostoru je vzácné a vzniká následkem poranění radikulárních cév, které provázejí míšní kořeny. Protože krvácení je v tomto případě do mozkomíšního moku, netvoří se hematom a poranění je tak méně závažné [21].
Spinální hematom se klinicky manifestuje v časovém odstupu několika hodin až dnů (0–12 dnů) po neuroaxiální punkci. Prvními projevy bývá motorický a senzitivní deficit, případně bolesti v zádech kořenového charakteru. Tyto příznaky se mohou ale pochopitelně projevit až v době, kdy neuroaxiální blokáda částečně nebo úplně odezní. Diagnóza spinálního hematomu se proto stanovuje poměrně obtížně, často s výraznou latencí. Kritická paraplegie se přitom vyvíjí poměrně rychle, zpravidla během 12–14 hodin [24–26]. Neurologické příznaky závisí od lokalizace hematomu – léze v oblasti dolní hrudní páteře je spojena se slabostí dolních končetin až paraplegií, lumbální léze se syndromem cauda equina včetně retence moči a inkontinence. Bolest zad, často vyzařující do končetin, je častým společným příznakem. Základní diagnostickou metodou je magnetická rezonance (případně CT), jediným řešením urgentní laminektomie.
Není jasné, jak velké množství krve je nutné k vytvoření kritického hematomu. Při krevní zátce se aplikuje do epidurálního prostoru až 20 ml autologní krve, aniž by vzniklé koagulum vyvolalo neurologické příznaky. Absorpce takovéhoto koagula je podle všeho otázkou poměrně krátkého času v řádu několika hodin. Vliv na to mohou mít i na věku závislé změny páteře. S věkem klesá poddajnost páteřního kanálu na vpravený objem, a to jak krve, tak ale například i lokálního anestetika. Vyšetření pomocí magnetické rezonance (MR) ukázalo rychlé vymizení krevní zátky z páteřního kanálu skrze intervertebrální foramina u mladých jedinců, ale MR také ukázala kompresi míchy u starší ženy v průběhu kontinuální infuze lokálního anestetika do epidurálního prostoru s příznaky odpovídajícími spinálnímu hematomu [22, 27]. I to může být dalším z důvodů, proč je v těhotenství, tj. u mladých žen, výskyt spinálního hematomu, přesněji řečeno spinálního hematomu s klinickými příznaky, tak extrémně vzácný. A to bez ohledu na to, že v těhotenství je vlivem gestagenů rozšířený venózní epidurální plexus a je zvýšená fragilita kapilár [28–30], tudíž k poranění venózního plexus dochází relativně často (až v 18 % všech punkcí) [21]. Přesto nejsou dostupné žádné známky vyššího rizika vzniku spinálního hematomu v porodnictví. Jednotlivé popsané případy souvisely buď s koagulační poruchou, nebo dokonce byly i bez souvislosti s neuroaxiální anestezií [16, 23, 31, 32].
Obecně je výskyt významného spinálního hematomu po neuroaxiálních blokádách natolik vzácný, že jej nelze sledovat v klinických studiích. Hlavní rizikové faktory, které byly identifikovány na základě analýz jednotlivých kazuistik spinálního hematomu, uvádí tabulka 2.
Tab. 2. Rizikové faktory vzniku spinálního hematomu po neuroaxiální blokádě 
Vztah tromboprofylaxe a rizika spinálního hematomu
Nízkomolekulární hepariny
Podstatou problému vztahu tromboprofylaxe a neuroaxiální punkce je potenciálně zvýšené riziko vzniku spinálního hematomu. Problém se týká především aplikace nízkomolekulárních heparinů (LMWH). Kombinace neuroaxiální blokády a profylaxe LMWH byla v obecné anesteziologické praxi považována dlouhou dobu za zcela bezpečnou a výskyt spinálního hematomu v této souvislosti se odhadoval na 1 ku1 000 000 [33]. Poté, co byla ve Spojených státech zavedena rutinní tromboprofylaxe 30 mg enoxaparinu po 12 hodinách, došlo ke znatelnému nárůstu počtu spinálních epidurálních hematomů, přičemž některé z nich skončily trvalou paraplegií [24, 34–36]. Sloučením těchto případů dohromady bylo riziko spinálního hematomu při současném podávání nízkomolekulárních heparinů vypočteno na 1 : 40 800 pro spinální (subarachnoidální) anestezii, 1 : 6600 pro jednorázovou epidurální anestezii a 1 : 3100 pro epidurální anestezii s katétrem [37]. Důvodem tohoto relativně vysokého nárůstu spinálních hematomů byla právě aplikace LMWH ve 12hodinovém dávkovacím schématu a absence doporučení ohledně bezpečného časového intervalu mezi tromboprofylaxí a neuroaxiální punkcí nebo manipulací s epidurálním katétrem. Oproti tomu v Evropě přijaté a rozšířené dávkování v jedné denní dávce 40 mg enoxaparinu se tak významným vzestupem výskytu komplikací neprojevilo. Retrospektivní švédská analýza odhadla toto riziko na 1 ku 156 000 po spinální anestezii a 1 : 18 000 po epidurální anestezii, přičemž riziko hematomu je daleko vzácnější v porodnictví (1 : 200 000) než u žen podstupujících artroplastiku kolenního kloubu (1 : 3 600), u kterých byl zaznamenán výrazně vyšší výskyt spinálních hematomů v souvislosti s LMWH než u jakékoli jiné skupiny pacientů [23]. Relativně nedávné série kazuistik naznačují, že obecné riziko spinálního epidurálního hematomu je možná vyšší, než se předpokládalo, s četností 1 : 2 700 až 1 : 20 000 pacientů [38–41], přičemž vznik hematomu by mohl být častější po epidurální punkci v lumbální než hrudní oblasti [40].
V návaznosti na zvýšený výskyt spinálních hematomů bylo německou anesteziologickou společností Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin v roce 1997 publikováno první národní doporučení pro neuroaxiální anestezii a současné podání antitrombotických léků [42], následovala American Society of Regional Anesthesia and Pain Medicine (ASRA) v roce 1998 [35] a v roce 2000 Société Belge d’Anesthésie et de Réanimation [43]. Aktuální česká doporučení nejsou v současné době k dispozici. V našich podmínkách se tak můžeme řídit pouze údaji uvedenými v Souhrnu údajů o léčivém přípravku (SPC; Summary of Product Characteristics), které v případě enoxaparinu uvádějí, že „zavedení či vynětí katétru by mělo následovat 10–12 hodin po podání profylaktické dávky enoxaparinu, v případě podání vyšší dávky (100 anti-Xa IU/kg (1 mg/kg) 2xd. či 150 anti-Xa IU/kg (1,5 mg/kg) 1xd.) by tento interval měl být 24 hodin. Následující dávku enoxaparinu je možno podat nejdříve za 2 hodiny po odstranění katetru“ [44].
Vzhledem k vzácnosti výskytu spinálního epidurálního hematomu nejsou doporučení týkající se vztahu regionální neuroaxiální anestezie a současné tromboprofylaxe postaveny na základě prospektivních randomizovaných studií, ale na jednotlivých kazuistikách a názorech expertů (tab. 3). Pravidlo přijaté většinou národních společností vyžaduje mezi podáním antikoagulancií a aplikací neuroaxiální blokády dvojnásobný časový interval, než je eliminační poločas daného preparátu [45]. Obecně je dnes proto doporučovaný interval mezi aplikací LMWH a neuroaxiální punkcí 10–12 hod po podání tromboprofylaktické dávky LMWH, a naopak LMWH lze aplikovat 2–4 hod po neuroaxiální punkci [46–54].
Tab. 3. Doporučené odstupy neuroaxiální punkce či vytažení katétru od aplikace LMWH 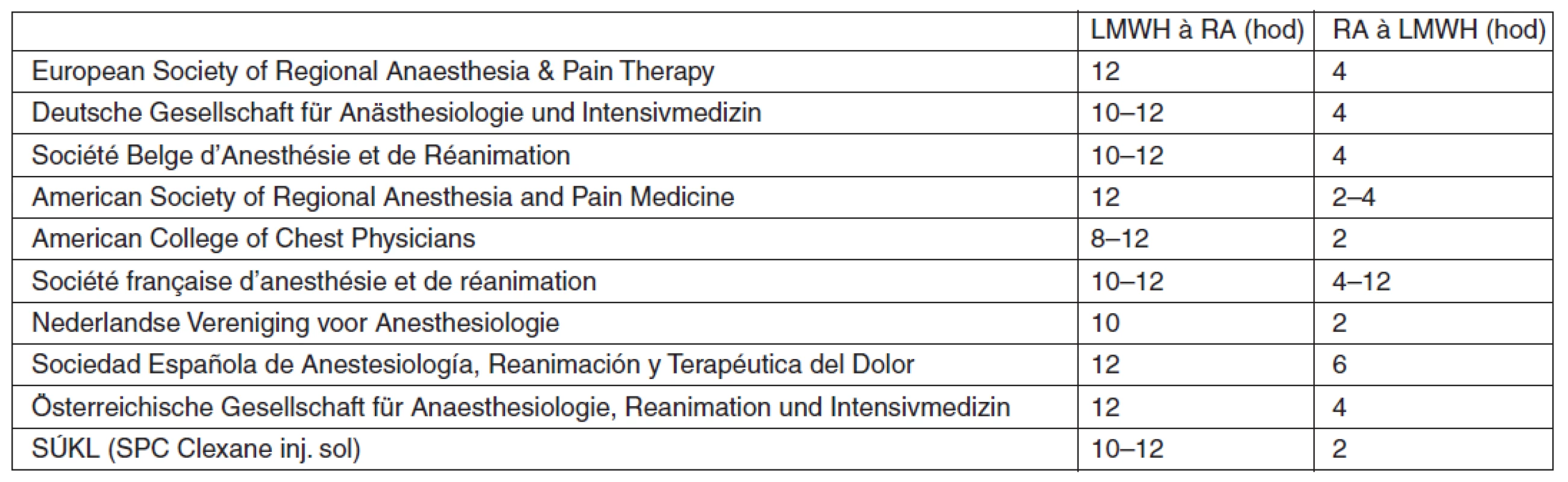
Incidence spinálního hematomu po neuroaxiální punkci u těhotných se současnou tromboprofylaxí není známa. V retrospektivní švédské studii, do které bylo zařazeno 50 000 spinálních a 205 000 epidurálních blokád u těhotných, byly zaznamenány pouze dva případy spinálního hematomu – jeden po vytažení epidurálního katétru a jeden po spinálním bloku. Oba případy nastaly u pacientek s HELLP syndromem [23]. Také další studie (metaanalýza/národní audit) sledující výskyt komplikací po epidurálních blokádách v porodnictví uvádějí incidenci spinálního hematomu 0, respektive 0,5 : 100 000 [41, 55]. Nebyla dosud ani publikována kazuistika, která by dávala v těhotenství do souvislosti podání LMWH a vznik spinálního hematomu. Přesto žádná doporučení nerozlišují rodičku s fyziologicky významným hyperkoagulačním stavem od jiných pacientů podstupujících neuroaxiální blokádu. Vedle hyperkoagulace je ale z hlediska vlivu tromboprofylaxe nízkomolekulárními hepariny na riziko vzniku spinálního hematomu podstatná i jejich rozdílná farmakokinetika a farmakodynamika významně snižující účinek i délku účinku LMWH. V těhotenství je až o 60 % zvětšen objem krevní plasmy, čímž je zvětšen i intravaskulární distribuční prostor pro LMWH (vzhledem k své velikosti nepronikají LMWH extravaskulárně). Od konce I. trimestru stoupá až o 50 % glomerulární filtrace a clearance, což vede ke zkrácení poločasu LMWH. Významná je i existence placentární heparinázy a zmnožení „heparin binding proteinu“ [56–60]. Výsledkem je signifikantně nižší antikoagulační aktivita LMWH v těhotenství ve srovnání s ostatní populací. Dokládá to i několik studií monitorujících hladiny antiXa po podání LMWH (enoxaparinu), které ukazují, že hladina antiXa po aplikaci dávky LMWH s pokračujícím těhotenstvím postupně klesá [10, 60–66]. V 36. týdnu těhotenství je už asi jen poloviční proti již normalizovanému koagulačnímu stavu v postpartálním období [57]. Je ale nutno i poznamenat, že neexistují ani žádné údaje, na jakou konkrétní hladinu antiXa byla měla být tromboprofylaxe v těhotenství cílena. Nezodpovězenou otázkou rovněž zůstává, zda změny při fyziologickém hyperkoagulačním stavu jsou natolik významné, že vyžadují jinou dávkovací strategii ve srovnání s populací netěhotných. Dostupná data jsou v tomto směru bohužel nedostatečná. Stejně tak je nutno poznamenat, že naprostá většina dostupných údajů i zkušeností s LMWH v porodnictví se týká především enoxaparinu. Přenositelnost těchto údajů (dávky, jejich četnost či časové intervaly mezi jejich aplikací a neuroaxiální blokádou) na ostatní nízkomolekulární hepariny, u nás především na dalteparin a nandroparin, je v současné době především otázkou individuální zkušenosti a odhadu, protože srovnávací data u těhotných chybí.
Nefrakcionovaný heparin
Nefrakcionovaný heparin (unfractionated heparin – UFH) je v standardním režimu tromboprofylaxe podáván v subkutánní dávce 5000 j. heparinu v 12hodinových intervalech. Toto dávkování většinou nevede k prodloužení aktivovaného parciálního tromboplastinového času (aPTT) a není za standardních podmínek nutno jeho vliv na koagulaci monitorovat. Pouze při jeho podávání 5 a více dní je nutno sledovat počet trombocytů k vyloučení heparinem indukované trombocytopenie (HIT) [16, 50]. Vzhledem k prakticky se nevyskytujícím krvácivým komplikacím je riziko vzniku spinálního hematomu při podávání heparinové tromboprofylaxe zcela minimální. Prokazují to i publikované studie z Evropy i USA s celkem více než 9000 pacienty, kdy se u této profylaxe nevyskytly žádné komplikace [16, 67]. Široce je proto akceptován názor, že tromboprofylaxe nízkými dávkami subkutánního heparinu nezvyšuje riziko krvácení do páteřního kanálu, a tudíž ani riziko vzniku spinálního hematomu [68, 69]. Tomu odpovídají i současná doporučení American Society of Regional Anesthesia and Pain Medicine (ASRA) [16], která za standardních podmínek již nevyžadují časový odstup mezi aplikací UFH a neuroaxiální punkcí či manipulací s epidurálním katétrem. Evropa je z tohoto hlediska překvapivě konzervativní a stále tento časový interval v délce 4 hodin doporučuje. Shoda naopak panuje v požadavku na odklad další aplikace profylaktických dávek heparinu, a sice nejméně o 1 hodinu po aplikaci bloku (doporučení úrovně 2C). Zvýšené riziko krvácení během profylaxe nefrakcionovaným heparinem je pouze při současném užívání dalších antikoagulancií a antiagregancií (především potencující se účinek heparinu s antiagregačními účinky kyseliny acetylsalicylové) a v přítomnosti jaterního selhávání.
Ostatní antikoagulancia a antiagregancia
Warfarin je v těhotenství pro svůj teratogenní vliv na plod absolutně kontraindikován. U nesteroidních antiflogistik (NSAID), včetně kyseliny acetylsalicylové, není známo, že by, pokud jsou podávány samostatně a v běžných dávkách, zvyšovaly riziko vzniku spinálního hematomu a nejsou tedy kontraindikací podání neuroaxiální blokády (doporučení úrovně 1A) [16, 50]. Existují ale kazuistiky vzniku spinálního hematomu při současné antiagregační léčbě aspirinem a profylaxe heparinem. Při současné aplikaci NSAID a heparinu (UFH i LMWH) proto není neuroaxiální blokáda doporučována [16, 45, 50]. Ostatní běžně užívané látky potenciálně ovlivňující koagulaci svým antiagregačním účinkem (především dnes relativně široce užívané přírodní léčivé látky česnek, brusinky, ginkgo a ginseng) nejsou kontraindikací neuroaxiální punkce, jejich užívání není spojeno se zvýšeným rizikem krvácení či vzniku spinálního hematomu a jejich vysazení není proto vyžadováno [16]. Je nutno nicméně poznamenat, že o jejich interakci s ostatními látkami ovlivňujícími koagulaci není nic známo.
Tromboprofylaxe u císařského řezu
Z hlediska porodnické anestezie se problém vztahu tromboprofylaxe a neuroaxiální anestezie/analgezie týká rodiček jak s již prepartálně podávanou tromboprofylaxí, tak standardního perioperačního vedení císařského řezu. Situace, kdy se původně plánovaný císařský řez změní krátce po podání profylaktické dávky LMWH na akutní, není nijak výjimečná. Při striktním dodržování pravidel by pak v tomto intervalu neměla být podána neuroaxiální anestezie, a to ani v případě předpokládané nebo dokonce anamnesticky známé obtížné intubace, či u rodičky s plným žaludkem. A to i přesto, že rizika spojená s celkovou anestezií v těchto situacích výrazně převažují nad rizikem vzniku spinálního hematomu. Těmto situacím lze jednoduše předejít změnou režimu perioperační tromboprofylaxe, konkrétně zahájením profylaxe až po císařském řezu, nikoli již předoperačně. Ve většině evropských zemí je obecně perioperační tromboprofylaxe většinou zahajována právě předoperačně (s výjimkou neurochirurgie), nejčastěji 12 hodin před začátkem vlastního výkonu. Důvodem je předpoklad, že tromby se začínají formovat již peroperačně, a proto by pacienti měli být chráněni již v tomto období. Aby se současně snížilo riziko peroperačního krvácení a bylo umožněno použití neuroaxiálních anesteziologických technik, jsou LMWH obvykle aplikovány večer před operačním výkonem. Přitom má tento přístup dnes obecně poměrně diskutabilní faktické opodstatnění. Dokládá to např. kanadská studie, do které bylo zařazeno 1472 pacientů podstupujících náhradu kyčelního kloubu, která neprokázala žádný rozdíl ve výskytu TEN při aplikaci LMWH (dalteparin) 2 hodiny před výkonem ve srovnání s aplikací 4 hodiny po výkonu [70]. Stejně tak metaanalýza aplikace LMWH 12 hod před operací ve srovnání s pooperační ukázala, že předoperační aplikace LMWH nesnižuje riziko TEN proti pooperační aplikaci [71]. Tomu odpovídají i některá současná doporučení [72–74]. Guidelines americké ACCP (American College of Chest Physicians) již nepožadují předoperační tromboprofylaktické podání LMWH, ale uvádějí je vedle až pooperační aplikace jako jednu z variant. Pro pacienty podstupující velké ortopedické výkony je toto doporučení dokonce úrovně 1A [72], tj. nejvyšší možné významnosti. Stejně tak i současná německá multioborová doporučení týkající se tromboprofylaxe, na kterých se podílelo celkem 25 německých odborných společností včetně anesteziologické a intenzivistické, gynekologicko-porodnické, hematologické a společnosti pro trombózu a hemostázu, odkazují na předoperační aplikaci LMWH pouze jako na možnost, nikoli na požadavek [74]. S pooperační aplikací LMWH jsou navíc spojeny i výhody nižšího rizika peroperačního krvácení a především právě snížení rizika vzniku spinálního hematomu při aplikaci neuroaxiální blokády [72]. Jaký je v porodnictví skutečně vztah rizika TEN při předoperačním versus až pooperačním zahájení podávání LMWH není známo. Nicméně na základě dostupných dat a klinických zkušeností lze předpokládat, že to samé jako pro chirurgické pacienty platí i pro ženy podstupující císařský řez. Navíc při zkráceném účinku LMWH v těhotenství je úvodní dávka LMWH, aplikovaná 12 hodin před císařským řezem, v době začátku výkonu již zcela eliminována a na profylaxi TEN tak ani nemůže mít významný vliv. Na vlastní tromboprofylaxi se tak každopádně podílí až dávka následující, tj. pooperační. Odpovídají tomu i klinické zkušenosti, kdy není zaznamenán zvýšený výskyt TEN u akutních SC, u nichž profylaxe je – na rozdíl od elektivních SC – aplikována právě až po výkonu.
V současné době se diskutuje i o samotné univerzální nutnosti farmakologické profylaxe u všech žen podstupujících císařský řez. Recentní data ukazují, že pravděpodobně díky dnes časné mobilizaci pacientek je výskyt TEN po císařském řezu asi výrazně nižší, než se předpokládá. Ve studii sledující výskyt žilní trombózy po císařském řezu byly sonografické známky hluboké žilní trombózy zaznamenány pouze u 0,5 % žen [75], tj. méně než u chirurgických pacientů. Císařský řez, včetně předtermínového, u jinak nekomplikovaně probíhajícího těhotenství je dnes řadou expertů řazen mezi výkony s nízkým rizikem TEN, tj. při časné mobilizaci bez nutné farmakologické profylaxe. Tomu odpovídají i současná doporučení Royal College of Obstetricians and Gynecologists (RCOG) a American College of Chest Physicians (ACCP) [17, 59, 76]. Příklad současné stratifikace rizika a podávání profylaxe TEN v porodnictví, vycházející právě z doporučení RCOG a ACCP, ukazuje tabulka 4.
Tab. 4. Hodnocení rizika tromboembolismu u císařského řezu 
Vezmeme-li současně v úvahu všechna dostupná data srovnávající riziko TEN při předoperační a pooperační aplikaci LMWH spolu s farmakokinetickými a farmakodynamickými změnami LMWH v těhotenství, je předoperační profylaxe LMWH v případě císařského řezu zbytečná. A zbytečně jen komplikuje situace, v nichž je jinak (např. pro riziko obtížné intubace) jasná preference neuroaxiálních anesteziologických metod.
Závěr
Hlavní příčinou problematického vztahu tromboprofylaxe a rizika spinálního hematomu v těhotenství je nedostatek validních dat. Při nedostatku specifické evidence v porodnictví proto byla odbornými společnostmi převzata doporučení vytvořená pro jiné skupiny pacientů, zcela fyziologicky i patofyziologicky odlišných od těhotných žen. Přestože dostupná a logická fakta i klinické zkušenosti říkají, že riziko spinálního hematomu je v porodnictví extrémně nízké, jsme zatím nuceni z forenzních důvodů doporučení týkající se vztahu podání LMWH a neuroaxiální punkce pokud možno dodržovat. Žádná praktická doporučení nelze ale brát jako striktní návod. Představují pouze základní rámec pro výchozí úvahu o volbě vhodného postupu u každého pacienta. Rozhodující význam pro zvážení vhodnosti či rizika neuroaxiální blokády v souvislosti s tromboprofylaxí v porodnictví by mělo mít vždy pečlivé zhodnocení anamnézy a konkrétní klinické situace. Stejně tak má pro posuzování sice minimálního, nicméně existujícího rizika spinálního hematomu a výhod regionální anestezie zcela nenahraditelný význam zkušenost anesteziologa. Zkušenost a dovednost anesteziologa i celého pracoviště nepochybně ovlivňují volbu vhodného postupu v těchto obtížných situacích určujícím způsobem [16, 65, 77].
Do redakce došlo dne 28. 11. 2011.
Přijato do tisku dne 15. 1. 2011.
Adresa pro korespondenci:
MUDr. Jan Bláha, Ph.D.
KARIM 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.blaha@lf1.cuni.cz
Zdroje
1. Rahman, K., Jenkins, J. G. Failed tracheal intubation in obstetrics: no more frequent but still managed badly. Anaesthesia, 2005, 60, 2, p. 168–171.
2. McDonnell, N. J., Paech, M. J., Clavisi, O. M., Scott, K. L. Difficult and failed intubation in obstetric anaesthesia: an observational study of airway management and complications associated with general anaesthesia for caesarean section. Int. J. Obstet. Anesth., 2009, 17, 4, p. 292–297.
3. Lyons, G., Akerman, N. Problems with general anaesthesia for Caesarean section. Minerva Anestesiol., 2005, 71, 1–2, p. 27–38.
4. Barnardo, P. D., Jenkins, J. G. Failed tracheal intubation in obstetrics: a 6-year review in a UK region. Anaesthesia, 2000, 55, 7, p. 690–694.
5. Lyons, G. Saving mothers’ lives: confidential enquiry into maternal and child health 2003–5. Int. J. Obstet. Anesth., 2008, 17, 2, p. 103–105.
6. James, A. H. Prevention and management of venous thromboembolism in pregnancy. Am. J. Med., 2007, 120, 10 Suppl 2, S26–34.
7. Kujovich, J. L. Hormones and pregnancy: thromboembolic risks for women. Br. J. Haematol., 2004, 126, 4, p. 443–454.
8. James, A. H. Pregnancy and thrombotic risk. Crit. Care Med., 2010, 38, 2, Suppl, S57–63.
9. Bremme, K. A. Haemostatic changes in pregnancy. Best Pract. Res. Clin. Haematol., 2003, 16, 2, p. 153–168.
10. Roeters van Lennep, J. E., Meijer, E., Klumper, F. J., Middeldorp, J. M., Bloemenkamp, K. W., Middeldorp, S. Prophylaxis with low-dose low-molecular-weight heparin during pregnancy and postpartum: is it effective? Journal of Thrombosis and Haemostasis, 2011, 9, 3, p. 473–480.
11. Heit, J. A., Kobbervig, C. E., James, A. H., Petterson, T. M., Bailey, K. R., Melton, L. J. 3rd: Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Annals Inter. Med., 2005, 143, 10, p. 697–706.
12. James, A. H., Jamison, M. G., Brancazio, L. R., Myers, E. R. Venous thromboembolism during pregnancy and the postpartum period: incidence, risk factors, and mortality. Am. J. Obstet. Gynec., 2006, 194, 5, p. 1311–1315.
13. James, A. H. Pregnancy-associated thrombosis. Hematology Am. Soc. Hematol. Educ. Program, 2009, p. 277–285.
14. Rosenberg, V. A., Lockwood, C. J. Thromboembolism in pregnancy. Obstet. Gynec. Clin. North America, 2007, 34, 3, p. 481–500.
15. Widimský, J., Malý, J., Eliáš, P., Lang, O., Franc, P., Roztočil, K. Doporučení diagnostiky, léčby a prevence plicní embolie. Vnitr. Lek., 2008, 54, Suppl 1, S25–S72.
16. Horlocker, T. T., Wedel, D. J., Rowlingson, J. C., Enneking, F. K., Kopp, S. L., Benzon, H. T., Brown, D. L., Heit, J. A., Mulroy, M. F., Rosenquist, R. W. et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg. Anesth. Pain Med., 2010, 35, 1, p. 64–101.
17. Marik, P. E. Venous thromboembolism in pregnancy. Clinics in Chest Medicine, 2010, 31, 4, p. 731–740.
18. Bates, S. M., Greer, I. A., Hirsh, J., Ginsberg, J. S. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest, 2004, 126, 3, Suppl, p. 627S–644S.
19. Patel, J. P., Patel, R. K., Davies, J. G., Arya, R. Prophylaxis with low-dose low molecular weight heparin during pregnancy and the puerperium: is it effective? A rebuttal. Journal of Thrombosis and Haemostasis, 2011, 9, 6, p. 1269–1271; author reply 1272-1263.
20. Patel, J. P., Hunt, B. J. Where do we go now with low molecular weight heparin use in obstetric care? Journal of Thrombosis and Haemostasis, 2008, 6, 9, p. 1461–1467.
21. Herold, I. Antikoagulační terapie a neuroaxiální analgezie/anestezie. In Pařízek A. Porodnická anestezie a analgezie. Praha: Grada 2002.
22. Beards, S. C., Jackson, A., Griffiths, A. G., Horsman, E. L. Magnetic resonance imaging of extradural blood patches: appearances from 30 min to 18 h. Brit. J. Anaesth., 1993, 71, 2, p. 182–188.
23. Moen, V., Dahlgren, N., Irestedt, L. Severe neurological complications after central neuraxial blockades in Sweden 1990–1999. Anesthesiology, 2004, 101, 4, p. 950–959.
24. Checketts, M. R., Wildsmith, J. A. Central nerve block and thromboprophylaxis – is there a problem? Brit. J. Anaesth., 1999, 82, 2, p. 164–167.
25. Checketts, M. R., Wildsmith, J. A. Epidural haematoma following anticoagulant treatment in a patient with an indwelling epidural catheter. Anaesthesia, 1999, 54, 1, p. 87–88.
26. Vandermeulen, E. P., Van Aken, H., Vermylen, J. Anticoagulants and spinal-epidural anesthesia. Anesth. Analg., 1994, 79, 6, p. 1165–1177.
27. Jacob, A. K., Borowiec, J. C., Long, T. R., Brown, M. J., Rydberg, C. H., Wass, C. T. Transient profound neurologic deficit associated with thoracic epidural analgesia in an elderly patient. Anesthesiology, 2004, 101, 6, p. 1470–1471.
28. Scott, D. B., Tunstall, M. E. Serious complications associated with epidural/spinal blockade in obstetrics: a two-year prospective study. Int. J. Obst. Anesth., 1995, 4, 3, p. 133–139.
29. Palot, M., Visseaux, H., Botmans, C., Pire, J. C. [Epidemiology of complications of obstetrical epidural analgesia]. Cah. Anesthesiol., 1994, 42, 2, p. 229–233.
30. Paech, M. J., Godkin, R., Webster, S. Complications of obstetric epidural analgesia and anaesthesia: a prospective analysis of 10,995 cases. Int. J. Obst. Anesth., 1998, 7, 1, p. 5–11.
31. Loo, C. C., Dahlgren, G., Irestedt, L. Neurological complications in obstetric regional anaesthesia. Int. J. Obst. Anesth., 2000, 9, 2, p. 99–124.
32. Bose, S., Ali, Z., Rath, G. P., Prabhakar, H. Spontaneous spinal epidural haematoma: a rare cause of quadriplegia in the post-partum period. Brit. J. Anaesth., 2007, 99, 6, p. 855–857.
33. Tryba, M., Wedel, D. J. Central neuraxial block and low molecular weight heparin (enoxaparine): lessons learned from different dosage regimes in two continents. Acta Anaesth. Scan. Supplementum, 1997, 111, p. 100–104.
34. Horlocker, T. T., Wedel, D. J. Neuraxial block and low-molecular-weight heparin: balancing perioperative analgesia and thromboprophylaxis. Reg. Anesth. Pain Med., 1998, 23, 6, Suppl 2, p. 164–177.
35. Horlocker, T. T., Wedel, D. J. Anticoagulation and neuraxial block: historical perspective, anesthetic implications, and risk management. Reg. Anesth. Pain Med., 1998, 23, 6, Suppl 2, p. 129–134.
36. Tryba, M. European practice guidelines: thromboembolism prophylaxis and regional anesthesia. Reg. Anesth. Pain Med., 1998, 23, 6, Suppl 2, p. 178–182.
37. Schroeder, D. R. Statistics: detecting a rare adverse drug reaction using spontaneous reports. Reg. Anesth. Pain Med., 1998, 23, 6, Suppl 2, p. 183–189.
38. Cameron, C. M., Scott, D. A., McDonald, W. M., Davies, M. J. A review of neuraxial epidural morbidity: experience of more than 8,000 cases at a single teaching hospital. Anesthesiology, 2007, 106, 5, p. 997–1002.
39. Christie, I. W., McCabe, S. Major complications of epidural analgesia after surgery: results of a six-year survey. Anaesthesia, 2007, 62, 4, p. 335–341.
40. Popping, D. M., Zahn, P. K., Van Aken, H. K., Dasch, B., Boche, R., Pogatzki-Zahn, E. M. Effectiveness and safety of postoperative pain management: a survey of 18 925 consecutive patients between 1998 and 2006 (2nd revision): a database analysis of prospectively raised data. Brit. J. Anaesth., 2008, 101, 6, p. 832–840.
41. Cook, T. M., Counsell, D., Wildsmith, J. A. Major complications of central neuraxial block: report on the Third National Audit Project of the Royal College of Anaesthetists. Brit. J. Anaesth., 2009, 102, 2, p. 179–190.
42. Gogarten, W., Van Aken, H., Wulf, H., Klose, R., Vandermeulen, E., Harenberg, J. Rückenmarksnahe Regionalanästhesien und Thromboemboliepropyhlaxe/Antikoagulation. Anaesth. Intensivmed., 1997, 38, 3, p. 623–628.
43. Belgian guidelines concerning drug induced alteration of coagulation and central neuraxial anesthesia. Belgian Society for Anesthesia and Resuscitation. Acta Anaesth. Belgica, 2000, 51, 2, p. 101–104.
44. CLEXANE INJ SOL 2X0.4ML/4KU, dostupné na [http: //www.sukl.cz/modules/medication/detail.php?kod=0115406]
45. Green, L., Machin, S. J. Managing anticoagulated patients during neuraxial anaesthesia. Br. J. Haematol., 2010, 149, 2, p. 195–208.
46. Vandermeulen, E., Singelyn, F., Vercauteren, M., Brichant, J. F., Ickx, B. E., Gautier, P. Belgian guidelines concerning central neural blockade in patients with drug-induced alteration of coagulation: an update. Acta Anaesth. Belgica, 2005, 56, 2, p. 139–146.
47. Chestnut, D. H. (ed.) Obstetric Anesthesia: Principles and Practice. 4 edn. Philadelphia: Mosby, Elsevier Inc. 2009.
48. Breivik, H., Bang, U., Jalonen, J., Vigfusson, G., Alahuhta, S., Lagerkranser, M. Nordic guidelines for neuraxial blocks in disturbed haemostasis from the Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesth. Scand., 2010, 54, 1, p. 16–41.
49. Moen, V. Scandinavian guidelines for neuraxial block and disturbed haemostasis: replacing wishful thinking with evidence based caution. Acta Anaesth. Scand., 2010, 54, 1, p. 6–8.
50. Gogarten, W., Vandermeulen, E., Van Aken, H., Kozek, S., Llau, J. V., Samama, C. M. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Europ. J. Anaesth., 2010, 27, 12, p. 999–1015.
51. Kozek-Langenecker, S. A., Fries, D., Gutl, M., Hofmann, N., Innerhofer, P., Kneifl, W., Neuner, L., Perger, P., Pernerstorfer, T., Pfanner, G. et al. [Locoregional anesthesia and coagulation inhibitors. Recommendations of the Task Force on Perioperative Coagulation of the Austrian Society for Anesthesiology and Intensive Care Medicine]. Der Anaesthesist, 2005, 54, 5, p. 476–484.
52. [Clinical guidelines for inhibitors of hemostasis and locoregional neuraxial anesthesia. Spanish Society of Anesthesiology-Resuscitation and Pain Therapy, Division of Hemostasis, Transfusion Medicine, and Perioperative Fluid Therapy]. Revista espanola de anestesiologia y reanimacion, 2005, 52, 7, p. 413–420.
53. Neuraxisblokkade en antistolling, dostupné na www: [http: //www.anesthesiologie.nl/uploads/118/29/Richtlijn_antistolling_DEF.pdf]
54. Les blocs périmédullaires chez l’adulte. Recommandations pour la pratique clinique. 2006.
55. Ruppen, W., Derry, S., McQuay, H., Moore, R. A. Incidence of epidural hematoma, infection, and neurologic injury in obstetric patients with epidural analgesia/anesthesia. Anesthesiology, 2006, 105, 2, p. 394–399.
56. Lebaudy, C., Hulot, J. S., Amoura, Z., Costedoat-Chalumeau, N., Serreau, R., Ankri, A., Conard, J., Cornet, A., Dommergues, M., Piette, J. C. et al. Changes in enoxaparin pharmacokinetics during pregnancy and implications for antithrombotic therapeutic strategy. Clin. Pharm. Ther., 2008, 84, 3, p. 370–377.
57. Sephton, V., Farquharson, R. G., Topping, J., Quenby, S. M., Cowan, C., Back, D. J., Toh, C. H. A longitudinal study of maternal dose response to low molecular weight heparin in pregnancy. Obst. Gynec., 2003, 101, 6, p. 1307–1311.
58. Anderson, G. D. Pregnancy-induced changes in pharmacokinetics: a mechanistic-based approach. Clin. Pharmacokinetics, 2005, 44, 10, p. 989–1008.
59. Bates, S. M., Greer, I. A., Pabinger, I., Sofaer, S., Hirsh, J. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, 6, Suppl, p. 844S–886S.
60. Kaiser, P., Harenberg, J., Walenga, J. M., Huhle, G., Giese, C., Prechel, M., Hoppensteadt, D., Fareed, J. Effects of a heparin-binding protein on blood coagulation and platelet function. Seminars in thrombosis and hemostasis, 2001, 27, 5, p. 495–502.
61. Stock, S. J., Walker, M. C., Edelshain, B. T., Horn, L., Norman, J. E., Denison, F. C. Fixed dosing regimes of enoxaparin for thromboprophylaxis do not reliably achieve target anti-Xa levels in women of normal weight during pregnancy. European journal of obstetrics, gynecology, and reproductive biology 2011, 158, 1, p. 112–113.
62. Fox, N. S., Laughon, S. K., Bender, S. D., Saltzman, D. H., Rebarber, A. Anti-factor Xa plasma levels in pregnant women receiving low molecular weight heparin thromboprophylaxis. Obst. Gynecol., 2008, 112, 4, p. 884–889.
63. Yoneda, M., Brosnan, J. F., Norris, L. A., Bonnar, J. The effect of LMWH (tinzaparin) on coagulation and fibrinolytic activation in pregnant women at risk of thrombosis. Thrombosis research, 2006, 117, 3, p. 283–290.
64. Shapiro, N. L., Kominiarek, M. A., Nutescu, E. A., Chevalier, A. B., Hibbard, J. U. Dosing and monitoring of low-molecular-weight heparin in high-risk pregnancy: single-center experience. Pharmacotherapy, 2011, 31, 7, p. 678–685.
65. Butwick, A. J., Carvalho, B. Neuraxial anesthesia in obstetric patients receiving anticoagulant and antithrombotic drugs. Inter. J. Obstet. Anesth., 2010, 19, 2, p. 193–201.
66. Norris, L. A., Bonnar, J., Smith, M. P., Steer, P. J., Savidge, G. Low molecular weight heparin (tinzaparin) therapy for moderate risk thromboprophylaxis during pregnancy. A pharmacokinetic study. Thromb. Haemost., 2004, 92, 4, p. 791–796.
67. Liu, S. S., Mulroy, M. F. Neuraxial anesthesia and analgesia in the presence of standard heparin. Reg. Anesth. Pain Med., 1998, 23, 6, Suppl 2, p. 157–163.
68. Millar, F. A., Mackenzie, A., Hutchison, G., Bannister, J. Hemostasis-altering drugs and central neural block. A survey of anesthetic practice in Scotland and the United Kingdom. Regional anesthesia 1996, 21(6):529-533.
69. Rodgers, A., Sage, D., Futter, M., MacMahon, S. Attitudes and practices of New Zealand anaesthetists with regard to epidural and subarachnoid anaesthesia. Anaesth. Inten. Care, 1996, 24, 1, p. 79–86.
70. Hull, R. D., Pineo, G. F., MacIsaac, S. Low-molecular-weight heparin prophylaxis: preoperative versus postoperative initiation in patients undergoing elective hip surgery. Thrombosis Research, 2001, 101, 1, V155–162.
71. Strebel, N., Prins, M., Agnelli, G., Buller, H. R. Preoperative or postoperative start of prophylaxis for venous thromboembolism with low-molecular-weight heparin in elective hip surgery? Arch. Int. Med., 2002, 162, 13, p. 1451–1456.
72. Geerts, W. H., Bergqvist, D., Pineo, G. F., Heit, J. A., Samama, C. M., Lassen, M. R., Colwell, C. W. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, 6 Suppl, 381S–453S.
73. Huo, M. H., Spyropoulos, A. C. The eighth American college of chest physicians guidelines on venous thromboembolism prevention: implications for hospital prophylaxis strategies. J. Thromb. Thrombolysis, 2011, 31, 2, p. 196–208.
74. AWMF-Leitlinie Prophylaxe der venösen Thromboembolie (VTE) [http://www.awmf.org/leitlinien/detail/ll/003-001.html]
75. Sia, W. W., Powrie, R. O., Cooper, A. B., Larson, L., Phipps, M., Spencer, P., Sauve, N., Rosene-Montella, K. The incidence of deep vein thrombosis in women undergoing cesarean delivery. Thromb. Research, 2009, 123, 3, p. 550–555.
76. RCOG: Thrombosis and Embolism during Pregnancy and the Puerperium, Reducing the Risk. (Green-top 37a), 2009.
77. Horlocker, T. T., Wedel, D. J., Benzon, H., Brown, D. L., Enneking, F. K., Heit, J. A., Mulroy, M. F., Rosenquist, R. W., Rowlingson, J., Tryba, M. et al. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation). Reg. Anesth. Pain Med., 2003, 28, 3, p. 172–197.
78. Horlocker, T. T. Thromboprophylaxis and neuraxial anesthesia. Orthopedics, 2003, 26, 2 Suppl, p. 243–249.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Errata
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2012 Číslo 1- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Kardiorelax 2011 – pětidenní dotazníková studie svalové relaxace během kardiochirurgických výkonů v České republice
- Errata
- Vliv věku a pohlaví na farmakodynamické vlastnosti rokuronia během totální intravenózní anestezie – prospektivní studie
- Propofol vs. sevofluran jako hlavní anestetikum u pacientů podstupujících coiling mozkového aneurysmatu – randomizovaná prospektivní studie
- Quo vadis, porodnická analgezie a anestezie v České republice?
- Kvalita a včasné komplikace pooperační epidurální analgezie po rozsáhlých výkonech
- Tromboprofylaxe a neuroaxiální anestezie v porodnictví
- Zásady bezpečné anesteziologické péče
- Doporučení pro léčbu toxické reakce po podání lokálních anestetik
- Peripartální život ohrožující krvácení
- Nejbližší oborové konference a setkání
- Současné členství v ČSIM a Evropské společnosti intenzivní medicíny
- Zápis z jednání výboru č. 5/2011
- Použití svalových relaxancií při celkové anestezii v operačních oborech – tříměsíční unicentrická studie v české regionální nemocnici
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kvalita a včasné komplikace pooperační epidurální analgezie po rozsáhlých výkonech
- Tromboprofylaxe a neuroaxiální anestezie v porodnictví
- Doporučení pro léčbu toxické reakce po podání lokálních anestetik
- Použití svalových relaxancií při celkové anestezii v operačních oborech – tříměsíční unicentrická studie v české regionální nemocnici
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



