-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
Recommendations for safe collection of venous blood by a closed collection system
In recent years, data have been repeatedly published stating that most errors in the process of obtaining a laboratory result occur in the pre-analytical phase (46 % to 68.2 %). This is an area that is usually out of direct control of the laboratory, involving venous blood collection (phlebotomy). The detection of these errors is considered to be quite difficult and can therefore easily lead to a misinterpretation of laboratory results with a consequent adverse effect for the patient and even in unintended injury. The most effective way to prevent them is to have a good knowledge of the current blood collection recommendations, which were recently (2018) revised by the European Federation for Clinical Chemistry and Laboratory Medicine (EFLM) and are offered in this review.
Keywords:
recommendations – closed blood collection system – patient preparation – venous blood collection
Autori: Beáta Bolerázska 1; Anna Birková 2; Beáta Čižmárová 2
Pôsobisko autorov: Univerzita Pavla Jozefa Šafárika v Košiciach, Lekárska fakulta, 1. stomatologická klinika LF UPJŠ 1; Univerzita Pavla Jozefa Šafárika v Košiciach, Lekárska fakulta, Ústav lekárskej a klinickej biochémie LF UPJŠ 2
Vyšlo v časopise: Vnitř Lék 2021; 67(E-7): 8-12
Kategória:
Súhrn
V posledných rokoch boli opakovane publikované údaje o tom, že väčšina chýb v procese získavania laboratórneho výsledku sa vyskytuje v predanalytickej fáze (46 % až 68,2 %). Ide o oblasť, ktorá je zvyčajne mimo priamej kontroly laboratória, najčastejšie zahŕňajúca odber venóznej krvi (flebotómiu). Odhalenie týchto chýb sa pokladá za značne obťažné, a preto môžu ľahko viesť k nesprávnej interpretácii laboratórnych výsledkov s následným nepriaznivým dosahom na pacienta až jeho poškodeniu. K najúčinnejším spôsobom ako im predísť patrí dobrá znalosť súčasných odporúčaní pre odber krvi, ktoré boli nedávno (2018) revidované Európskou federáciou pre klinickú chémiu a laboratórnu medicínu (EFLM, European Federation for Clinical Chemistry and Laboratory Medicine) a sú ponúknuté v tomto prehľade.
Klíčová slova:
odporúčania – odber venóznej krvi – príprava pacienta – uzavretý odberový systém
Úvod
Výsledky laboratórnych testov sú základom veľkej časti lekárskych rozhodnutí najmä v odboroch vnútorného lekárstva (60 – 80 %), preto akákoľvek chyba v procese získavania laboratórneho výsledku môže mať vážne dôsledky (1, 2). Stanovenie jednotlivých biochemických parametrov z krvi pacienta prebieha počas analytickej fázy laboratórneho vyšetrenia a bolo výrazne zdokonalené automatizáciou celého procesu. Moderné analyzátory pracujú s tzv. mikrometódami, ktoré umožňujú z malého množstva vzorky vykonať celý rad vyšetrení. Vďaka certifikácii a akreditácii laboratórií je kvalita analytickej fázy vyšetrovacieho cyklu prísne kontrolovaná. Výsledkom je, že hlavným zdrojom laboratórnych chýb sa stala predanalytická fáza, čiže obdobie zahŕňajúce ordináciu laboratórnych parametrov, výber vhodných materiálov a pomôcok, prípravu pacienta k odberu, identifikáciu pacienta a kontrolu jeho prípravy, samotný odber materiálu, jeho uchovávanie a transport.
Snaha o štandardizáciu postupov aj mimo laboratória viedla v roku 2013 EFLM k založeniu pracovnej skupiny pre predanalytickú fázu (EFLM WG‑PRE – EFLM Working Group for Preanalytical Phase). Jedným z jej výstupov je aj návrh postupu odberu venóznej krvi, ktorý v októbri 2017 dostali všetci členovia EFLM k verejnej konzultácii. Podnetom na vytvorenie dokumentu boli výsledky prieskumu vykonaného v 28 európskych krajinách, ktoré odhalili, že iba 7 z nich malo vlastné písomne schválené protokoly (usmernenia, odporúčania) pre odber vzoriek žilovej krvi (3), a skutočnosť, že existujúce medzinárodné usmernenia a odporúčania neposkytovali jasné a jednoznačné usmernenie pre všetky kroky počas odberu a taktiež odôvodnenia, ktoré sa v niektorých odporúčaniach uvádzali, nehodnotili kvalitu dôkazu alebo dôkazy preň úplne chýbali. V poradí prvá verzia odporúčania pre odber venóznej krvi bola od 13. 7. 2018 voľne sprístupnená v elektronickej forme (4) a s jej obsahom súhlasilo 33 zo 40 členov zastupujúcich jednotlivé európske štáty, vrátane Českej spoločnosti klinickej biochémie (ČSKB) a Slovenskej spoločnosti klinickej biochémie (SSKB).
Zverejnené odporúčanie sa vzťahuje na použitie uzavretého odberového systému a neposkytuje usmernenie pre odber s otvorenou ihlou alebo pomocou kanýl a katétrov. Každý krok bol klasifikovaný pomocou systému, ktorý hodnotí kvalitu dôkazu a silu odporúčania. Súčasťou revízie sú aj postupy pre implementáciu odporúčaní do klinickej praxe, pretože v európskych krajinách je tento výkon častokrát vykonávaný aj zdravotníckymi zamestnancami bez vyššieho odborného vzdelania a skúseností. Odporúčanie je rozdelené na 4 hlavné časti: I) Postupy pred odberom krvi, II) Odber krvi, III) Postupy po odbere krvi, IV) Implementácia, pričom je zadefinované aj poradie jednotlivých krokov počas týchto postupov od 1 – 20 (4).
V tejto zostručnenej správe sú uvedené najdôležitejšie informácie o postupe odberu venóznej krvi pre klinickú prax, ktoré boli vypracované na základe vyššie uvedeného dokumentu.
Zabezpečenie podmienok k odberu
Miestnosť, v ktorej sú realizované odbery, by mala poskytovať dostatočné súkromie, čistotu a tichosť. Výber zariadenia a doplnkov (napr. relaxačných obrázkov na stenách) by mal vytvárať pohodlné prostredie pre pacienta aj personál. K základnému vybaveniu odberovej miestnosti patrí odberové kreslo s nastaviteľnými opierkami na ruky, posteľ, kreslo pre odoberateľa, umývadlo, tečúca voda, mydlo, papierové obrúsky a samozrejme dostatočné množstvo ochranných prostriedkov a vhodné odberové súpravy.
Pracovné miesto má byť prispôsobené tak, aby všetok potrebný materiál bol v dosahu ruky. Materiálové zabezpečenie tvoria dobre nasadzovateľné nesterilné rukavice, odberový systém (ihla, držiak, skúmavka), škrtidlo, antiseptikum, bandáž, kôš, miešač vzoriek, a transportná nepriepustná taška. Odberový systém (ihla, držiak, skúmavka) by mal pochádzať od jedného výrobcu kvôli kompatibilite. Podľa pokynov výrobcu by mal byť všetok materiál aj vhodne uchovávaný (svetlo, teplota, vlhkosť).
Všeobecné zásady pred odberom venóznej krvi
Príprava pacienta pred vyšetrením
Všeobecne sa odporúča realizovať odber venóznej krvi ráno medzi 7.00 – 9.00 hod., 12 hodín po poslednom jedle, pričom pacient na min. 24 hod. vylúči príjem alkoholu, fajčenie, kofeínové nápoje a fyzickú námahu. V prípade monitorovania hladín liečiv je nutné dodržať odporúčaný časový interval od posledného podania daného liečiva. Nedostatočnú prípravu je potrebné dokumentovať na žiadanke. Poloha pacienta by sa minimálne 15 minút pred odberom nemala meniť, sem ale nepatrí potrebný presun pacienta z čakárne do odberovej miestnosti.
Identifikácia pacienta a označenie vzorky
V prípade hospitalizovaných pacientov preukázalo zavedenie identifikačných náramkov významnú redukciu nesprávnej identifikácie pacienta. Kontrolované by mali byť najmenej dva identifikačné údaje, pričom odporúčaná je kontrola troch identifikačných údajov (celé meno, dátum narodenia, poisťovňa), a to položením cielenej otázky pred odberom. Pacientom predkladáme otvorené otázky bez variantov odpovedí, nie uzavreté. Správne položená otázka je napr. „Ako sa voláte?“ a nie „Ste pán Novák?“.
Čo sa týka samotného označovania vzorky, realizované by malo byť v prítomnosti pacienta, priamo pred ním, pričom odporúčanie neurčuje, či by malo byť realizované pred, alebo až po odbere. Takýto postup významne znižuje riziko neoznačenia alebo nesprávneho označenia vzorky. Žiadanka na laboratórne vyšetrenie by mala obsahovať identifikačné údaje ordinujúceho lekára, celé meno pacienta, dátum narodenia, adresu pacienta (ev. údaje oddelenia v nemocnici), dátum a čas odberu, jedinečné identifikačné číslo vzorky a taktiež identifikačné údaje odoberajúceho. Skúmavka by mala byť označená minimálne dvoma, avšak radšej troma na sebe nezávislými identifikačnými údajmi (celé meno pacienta, dátum narodenia, jedinečné identifikačné číslo vzorky).
Postup odberu venóznej krvi
Odber krvi je stále najbežnejším invazívnym zdravotníckym výkonom. Každý krok v procese odberu môže ovplyvniť kvalitu odobranej vzorky. Samozrejmosťou je empatická komunikácia, ktorej súčasťou je predstavenie sa zdravotníckeho pracovníka, vysvetlenie výkonu a taktiež zistenie miery pacientovho strachu.
Prvým krokom je umytie rúk pred pacientom, po ktorom nasleduje nasadenie rukavíc (ochrana pacienta, odoberajúceho, aj zamedzenie kontaminácie vzorky). Preferovaný je odber bez použitia škrtidla, ktorého aplikácia by mala byť vyhradená len na nevyhnutné situácie, pričom trvanie aplikácie by malo byť < 1 minúta. V takých prípadoch škrtidlo nasadzujeme v rukaviciach, pretože nasadzovanie rukavíc až po aplikácii škrtidla významne zvyšuje riziko predĺženia tohto intervalu. Bolo preukázané, že použitie škrtidla na dlhšie ako 1 minútu spôsobuje venostázu s extravazáciou vody a iónov zo žily do subendoteliálneho priestoru, a to má za následok progresívne stúpanie koncentrácie lipoproteínov, proteínov, krvných buniek a koagulačných faktorov vo venóznej krvi (5, 6).
Miesto aplikácie škrtidla by malo byť vzdialené približne 7,5 cm (šírka dlane) nad predpokladaným miestom vpichu a jeho úlohou je obmedziť tok venóznej, ale nie arteriálnej krvi. Podobne ako odberová súprava (ihla, držiak, skúmavka) aj škrtidlo by malo byť na 1 použitie, alebo by sa nemalo zabúdať na jeho dezinfekciu. Dôvodom je skutočnosť, že škrtidlo predstavuje rezervoár multirezistentných kmeňov, dokonca aj kmeňov Staphyloccocus aureus rezistentných na meticilín (MRSA – methicillin‑resistant Staphylococcus auresus), ktoré predstavujú veľké riziko pre pacientov aj zdravotnícky personál (7, 8, 9). Pacienti, u ktorých predpokladáme sťažený odber (malé deti, obézni, prítomné edémy, výrazné ochlpenie alebo tetovanie, popáleniny, tmavá pleť, ordinovaný viacnásobný odber) môžu profitovať z moderných prístrojov, ktoré slúžia na vizualizáciu periférneho venózneho systému. Vizualizátor využíva dva bezpečné lasery: neviditeľný infračervený a viditeľný farebný (farba závisí od výrobcu). Lasery pracujú v tandeme, aby poskytli skutočný obraz priebehu žíl až do hĺbky 10 mm. Hemoglobín v krvi pacienta absorbuje infračervené svetlo, takže z povrchových žíl je odraz svetla znížený. Detekčný systém používa túto zmenu odrazu na určenie polohy a štruktúry žily, ktorú digitálne premieta na povrch kože – farebný laser ukáže priebeh žíl. Výsledkom je vizuálna projekcia s presnosťou určenia stredovej čiary žily menšou ako je šírka ľudského vlasu. Nezávislé štúdie ukazujú, že zariadenie na detekciu vén zvyšuje úspech prvého odberu až na 98 %! (10, 11, 12) (Obr. 1)
Obr. 1. Vizuálna projekcia detekcie vén zvyšuje úspech prvého odberu až na 98 %, upravené podľa zdroja AccuVein Learning Center (13) 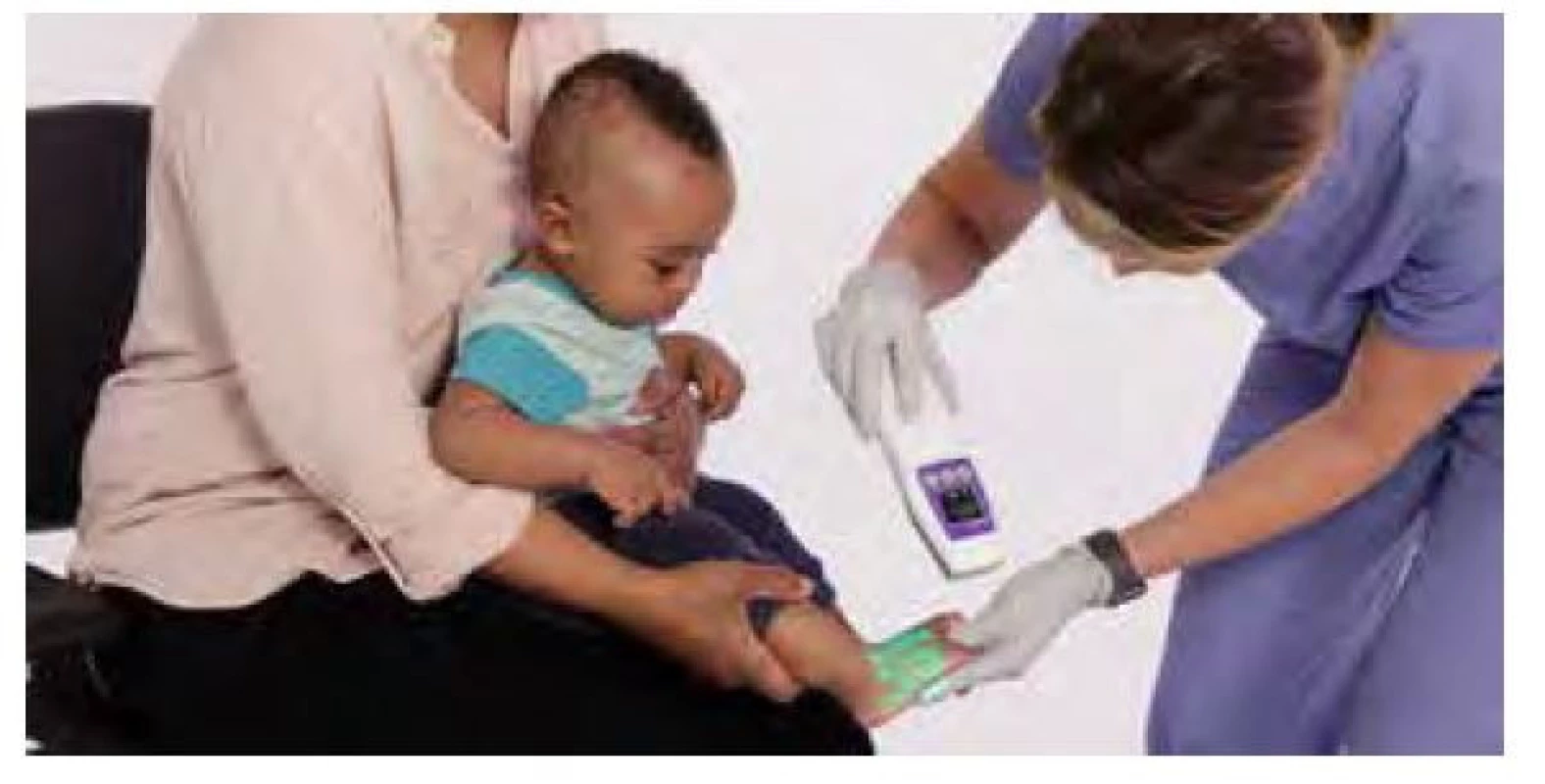
Preferovaným miestom vpichu je kubitálna jamka, iba ak v tejto oblasti zlyhá odber, alebo nie je možný, môžu byť použité žily z chrbta ruky. Vybrané miesto vpichu dezinfikujeme 1x vertikálnym zotretím napr. 70 % alkoholom, ponecháme uschnúť cca 60 sekúnd. Ak ide o odber hemokultúry, vykonáme dezinfekciu 2x po sebe 2 samostatnými tampónmi. Po dezinfekcii sa budúceho miesta vpichu už nedotýkame. Punkciu žily vykonávame ihlou so skoseným hrotom pod približne 5 – 30° uhlom, vpich do kože je rázny, ihla smeruje pozdĺžne s predpokladaným priebehom žily a vsúva sa na minimálne ¼ jej dĺžky. V prípade neúspešného pokusu sa repozíciou snažíme nájsť žilu. Práve v takýchto prípadoch je veľmi nápomocný vizualizátor, zvlášť u detského pacienta. Škrtidlo uvoľňujeme hneď ako sa zjaví krv v prvej skúmavke. Ak sa 1. pokus nepodarí, taktiež škrtidlo uvoľňujeme a použijeme alternatívne miesto.
Po odbere krvi do 1. skúmavky ju okamžite úplne otáčame spravidla nedominantnou rukou, dominantná drží ihlu v správnej polohe. Vykonáva sa otočenie o 180° a vrátenie do pôvodnej polohy (Obr. 2). V tomto kroku je výhodou použite miešacieho zariadenia, ktoré tento pohyb po vložení skúmavky vykonáva namiesto odoberajúceho.
Obr. 2. Po odbere krvi do 1. skúmavky ju okamžite úplne otáčame spravidla nedominantnou rukou, dominantná drží ihlu v správnej polohe. Vykonáva sa otočenie o 180° a vrátenie do pôvodnej polohy, upravené podľa zdroja Simundic et al. 2018 (4) 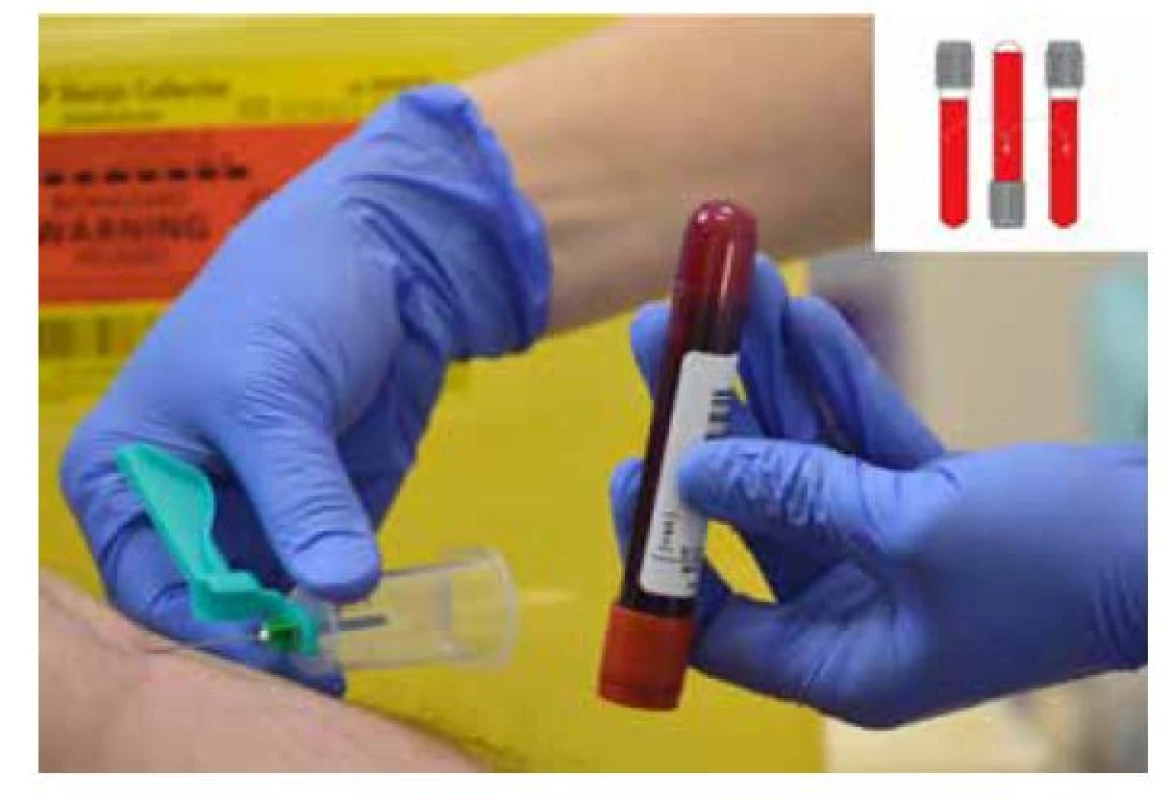
Ďalšie odbery prebiehajú podľa odporúčaného poradia (Tab. 1) vrátane jedného úplného otočenia každej skúmavky.
Tab. 1. Odporúčané poradie skúmaviek počas odberu venóznej krvi podľa EFLM 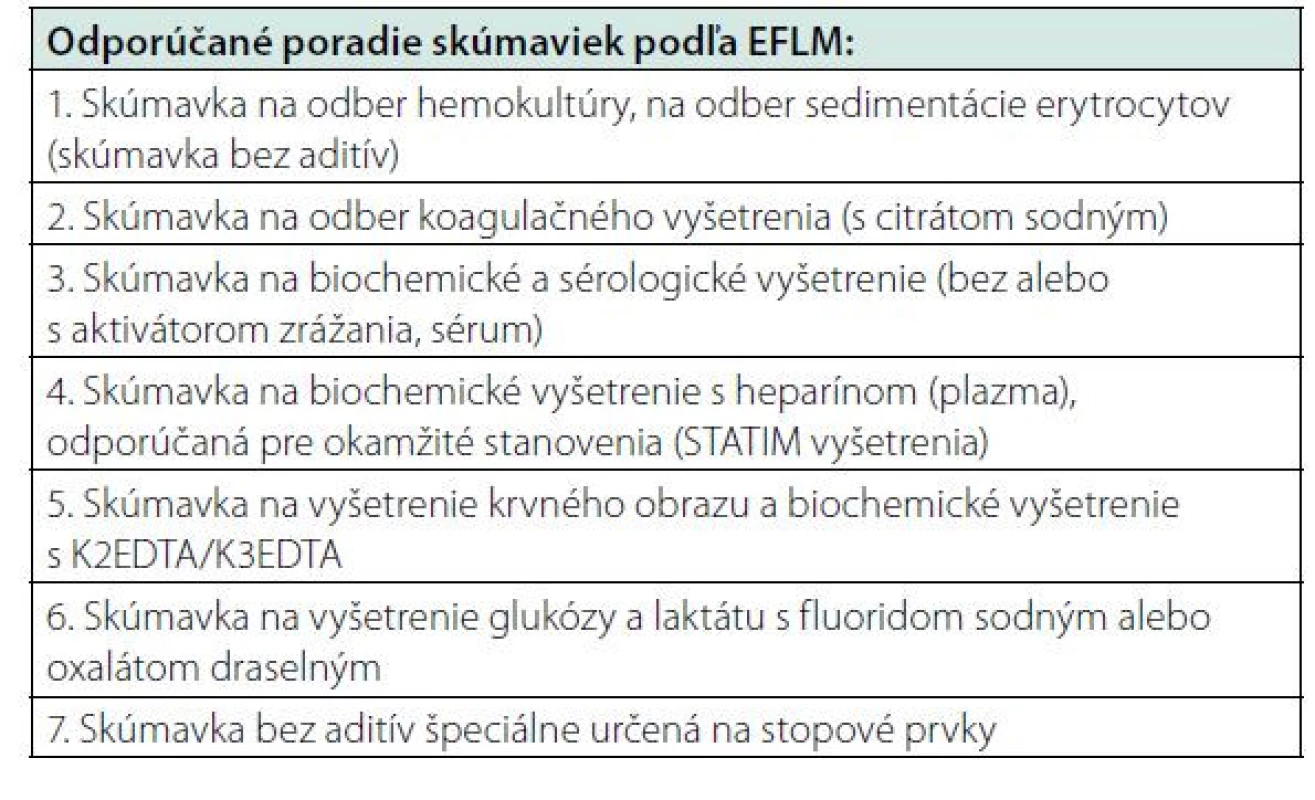
Po odstránení poslednej skúmavky položíme na miesto vpichu gázový tampón bez tlaku, ihlu jemne vytiahneme a potom tampón pritlačíme. Ihlu oddelíme od držiaka a vhodíme do kontajnera odolného voči prepichnutiu, ktorý je na dosah ruky. Prenášanie ihly ku kontajneru je neprípustné! Pacienta poučíme, aby na podporu urýchlenia zastavenia krvácania na miesto vpichu mierne tlačil cez tampón, ale neohýbal ruku v lakti. Zastavenie krvácania urýchľuje aj zdvihnutie ruky. Krvácanie by malo ustať do 2 minút, v prípade pacientov užívajúcich antikoagulačnú liečbu do 10 minút. Po kontrole zastavenia krvácania možno miesto vpichu ošetriť bandážou (suchý tampón alebo štvorček, leukoplast). Následne každú odobratú skúmavku otočíme o 180°, najmenej 4× po sebe. Ak bola odoberaná len 1 skúmavka, otáčame ju ihneď po odbere 5krát. Ochranné rukavice skladáme z rúk otočením naopak za vsunutia jednej rukavice do druhej (Obr. 3). Výmena rukavíc je nevyhnutná po každom pacientovi. Nasleduje opätovné umytie rúk. Pacient po odbere zotrváva v pokoji cca 5 minút, sledujeme vznik možnej synkopy. Empatický prístup, záverečné vyjadrenie vďaky za spoluprácu a ubezpečenie o vykonaní vyšetrení čo v najkratšom čase, by mali byť prirodzenou súčasťou celej procedúry.
Obr. 3. Ochranné rukavice skladáme z rúk otočením naopak za vsunutia jednej rukavice do druhej, upravené podľa zdroja Simundic et al. 2018 (4) 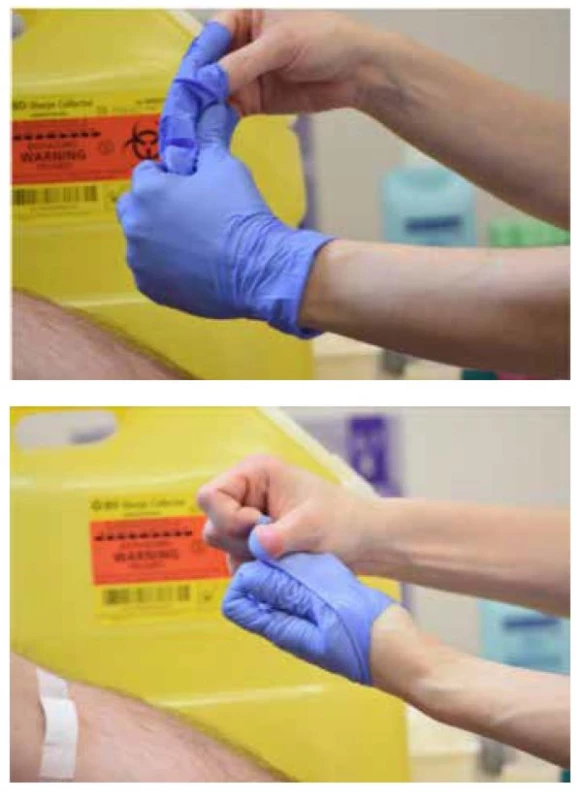
Poradie skúmaviek počas odberu venóznej krvi
Mnohé národné a medzinárodné smernice (WHO – World Health Organisation, CLSI – The Clinical & Laboratory Standards Institute) vo všeobecnosti odporúčajú, aby poradie skúmaviek počas odberu venóznej krvi bolo nasledovné: hemokultúra (sterilné skúmavky), potom skúmavky bez aditív/s gélom, po nich skúmavky obsahujúce aditíva. Tým sa zabráni kontaminácii krvi v skúmavkách bez aditív z predchádzajúcich skúmaviek, ktoré ich obsahujú a mohli by tak spôsobiť chybné výsledky. V poslednom období sa uskutočnilo množstvo štúdií sledujúcich to, či poradie skúmaviek pri odbere zostáva problémom aj s použitím moderných techník a materiálov z oblasti flebotómie, alebo je to už zastaraná prax, ktorá sa používa iba z historických dôvodov. Reakciou na to je aj tu uvádzaná publikácia (2017) pracovnej skupiny pre preanalytickú fázu Európskej federácie pre klinickú chémiu a laboratórnu medicínu (EFLM WG‑PRE), ktorá poskytuje prehľad a súhrn literatúry so zameraním na poradie pri odbere žilovej krvi (14). Vzhľadom na opísané dôkazy uvedené v tejto publikácii, EFLM WG‑PRE z toho vyvodzuje závery: významná frekvencia kontaminácie vzorky sa vyskytuje vtedy, ak sa počas odberu krvi nedodrží poradie odberu a ak nie sú uplatnené všeobecné odporúčania pre odber krvi, čím sa ohrozuje bezpečnosť pacienta. Keďže nie je zložité dodržiavať poradie počas odberu a je všeobecne známe, že zabezpečenie ideálnych podmienok a dodržanie odporúčaní týkajúcich sa flebotómie nie je vždy úplne splnené alebo možné, EFLM WG‑PRE podporuje trvalé odporúčanie dodržať správne poradie pre odber venóznej krvi.
Výnimky z poradia skúmaviek počas odberu venóznej krvi
Ak odoberateľ krvi odoberá viacero druhov skúmaviek a z jedného druhu potrebuje odobrať viac kusov (napr. 1x skúmavka na odber koagulačného vyšetrenia, 1x KO, 3x skúmavka na biochemické vyšetrenie), mal by najprv odobrať z každého po jednej skúmavke, a potom vykonať viacnásobný odber z príslušného druhu.
Ak je odber na koaguláciu ako jediný
V bežných ambulantných podmienkach patrí odber na hemokultúru k extrémne výnimočným. Podľa posledných odporúčaní (EFLM WG‑PRE) možno po jeho vynechaní za určitých podmienok pokračovať v odbere krvi ďalej podľa poradia. Bolo preukázané, že pre rutinné koagulačné testovanie nie je nevyhnutné použitie skúmavky odobratej až 2. v poradí a 1. skúmavku s odobratou krvou znehodnotiť (pokiaľ 1. skúmavkou nebol odber na hemokultúru), pretože významný rozdiel medzi výsledkami stanovenia aktivovaného parciálneho tromboplastínového času (aPTT) a protrombínového času (PT) medzi odobratou v poradí prvou a druhou skúmavkou sa nepotvrdil (14, 15, 16, 17, 18, 19). Takýto postup je aj v zhode so súčasným odporúčaním laboratórnej sekcie Českej hematologickej spoločnosti pre odber na vyšetrenie PT a medzinárodného normalizovaného pomeru PT (PT INR) (15). Vysvetlenie poskytuje samotný princíp stanovenia PT, ktoré je vykonávané v nadbytku tromboplastínu (tkanivového faktora), a preto jeho malá prímes pri tomto vyšetrení neprekáža. Avšak v prípade analýzy ostatných koagulačných parametrov je naďalej nutné zachovať tento odber ako druhý v poradí a predradiť ktorúkoľvek zo skúmaviek bez aditív alebo prvú odobratú skúmavku znehodnotiť. Týka sa to koagulačných parametrov ako fibrinogén, D‑diméry, faktory II, V, VII, VIII, IX, X, XI, proteíny C a S a AT, a tiež špeciálnych koagulačných vyšetrení (napr. vyšetrenie funkcie krvných doštičiek), pretože zatiaľ nemáme dostatok dôkazov o tom, že pri odbere niektorého z nich by postačovalo vyšetrenie už z 1. odberu (16, 17, 18, 19, 20).
Vzorky krvi na vyšetrenie koagulácie by mali byť odoberané pred skúmavkami s obsahom účinnejších antikoagulačných činidiel, ako je napríklad kyselina etyléndiamíntetraoctová (EDTA) (pre krvný obraz), lítium‑heparín (na testovanie biochémie), ako aj pred aktivátormi zrážania (trombín), pretože tieto aditíva môžu kontaminovať a tým ovplyvniť následné koagulačné testy. Podmienkou je naďalej naplnenie objemu skúmavky na viac ako 90 % objemu. Nedostatočné naplnenie má za následok značné zriedenie vzorky antikoagulačným činidlom a tým spôsobuje falošne predĺžené zrážanie kvôli prítomnosti prebytočného citrátu viažuceho vápnik. Tento účinok závisí od koncentrácie citrátu, veľkosti skúmavky a typu vykonaného testu a prejavuje sa výraznejšie pri použití 3,8% citrátových skúmaviek a pri skúmavkách s malým objemom (pediatrických) (21, 22). Zriedenie vzorky tiež vedie k podhodnoteniu výsledkov kvantitatívnych testov (napr. hladiny faktorov zrážanlivosti).
Záver
Odber venóznej krvi sa často označuje ako kľúčový proces predanalytickej fázy laboratórneho vyšetrenia, v ktorom môžu nastať mnohé chyby s potenciálom ovplyvniť laboratórne výsledky a následne lekárske rozhodnutia. Dodržaním štandardizácie prípravy pacienta a postupu odberu krvi získaných na základe dôkazov a osvedčených postupov je možné minimalizovať ich vplyv na kvalitu odobratého biologického materiálu, zaručiť pretrvávanie chemických a fyzikálnych vlastností analytov v priebehu času, a tak zabezpečiť spoľahlivosť testovania. Implementácia týchto odporúčaní by mala byť prirodzenou súčasťou každej ambulancie vykonávajúcej odbery krvi, aby sa predišlo nesprávnej interpretácii laboratórnych výsledkov s možnými vážnymi následkami pre pacienta.
KORESPONDENČNÍ ADRESA AUTORA:
Ing. Beáta Hubková, PhD.
Univerzita Pavla Jozefa Šafárika v Košiciach, Lekárska fakulta, Ústav lekárskej a klinickej biochémie LF UPJŠ Trieda SNP 1, 040 11 Košice
Cit. zkr: Vnitř Lék 2021; 67(7): E8–E12
Článek přijat redakcí: 7. 8. 2021
Článek přijat po recenzích: 11. 10. 2021
Zdroje
1. Hallworth MJ. The ’70% Claim’: What is the evidence base? Ann Clin Biochem. 2011; 48(6): 487–8. PMID: 22045648.
2. Ngo A, Gandhi P, Miller WG. Frequency that Laboratory Tests Influences Medical Decisions. J App Lab Med. Accessed 9/19/17.
3. Simundic AM, Bolenius K, Cadamuro J et al. On behalf of the Working Group for Preanalytical Phase (WG‑PRE), European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). EFLM recommendation of venous blood sampling v 1.1, October 2017.
4. Simundic AM, Bölenius K, Cadamuro J et al. Joint EFLM‑COLABIOCLI recommendation for venous blood sampling. Clin Chem Lab Med 2018; 56 : 2015–2038.
5. Lippi G, Salvagno GL, Montagnana M et al. Influence of short‑term venous stasis on clinical chemistry testing. Clin Chem Lab Med 2005; 43 : 869–75. Lippi G, Salvagno GL, Montagnana M, Franchini M, Guidi GC. Venous stasis and routine hematologic testing. Clin Lab Haematol 2006; 28 : 332–337.
6. Mehmood Z, Muhammad Mubeen S, Shehzad Afzal M et al. Potential Risk of Cross‑Infection by Tourniquets: A Need for Effective Control Practices in Pakistan. Int J Prev Med. 2014; 5(9): 1119–1124.
7. Pinto AN, Phan T, Sala G et al. Reusable venesection tourniquets: a potential source of hospital transmission of multiresistant organisms. Med J Aust. 2011; 195(5): 276–279.
8. Culjak M, Gveric Grginic A, Simundic AM. Bacterial contamination of reusable venipuncture tourniquets in tertiary‑care hospital. Clin Chem Lab Med 2018; 56: e201–e203.
9. Lima‑Oliveira G, Lippi G, Salvagno GL et al. New ways to deal with known preanalytical issues use of transilluminator instead of tourniquet for easing vein access and eliminating stasis on clinical biochemistry. Biochem Med 2011; 21(2): 152–159.
10. Lima‑Oliveira G, Lippi G, Salvagno GL et al. Transillumination: a new tool to eliminate the impact of venous stasis during the procedure for the collection of diagnostic blood specimens for routine haematological testing. Int J Lab Hematol. 2011; 33(5): 457–462.
11. Lima‑Oliveira G, Salvagno GL, Lippi G et al. Elimination of the venous stasis error for routine coagulation testing by transillumination. Clin Chim Acta. 2011; 412(15–16): 1482–1484.
12. Cornes M, van Dongen‑Lases E, Grankvist K et al. Order of blood draw: Opinion Paper by the European Federation for Clinical Chemistry and Laboratory Medicine (EFLM) Working Group for the Preanalytical Phase (WG‑PRE). Clinical Chemistry and Laboratory Medicine (CCLM), 2017; 55(1): 27–31.
13. AccuVein Learning Center. (n.d.). Considerations When Selecting an IV Needle. Retrieved July 22, 2021, from https://learn.accuvein.com/article/selecting‑an ‑ iv‑needle‑size/
14. Mock KJ, Crist RA, Hansen SJ et al. Discard tubes are not necessary when drawing samples for specialized coagulation testing. Blood Coagul Fibrinolysis 2010; 21 : 279–282.
15. Loeffen R, Kleinegris MC, Loubele ST, Pluijmen PH, Fens D, van Oerle R, ten Cate H, Spronk HM. Preanalytic variables of thrombin generation: towards a standard procedure and validation of the method. J Thromb Haemost. 2012; 10 : 2544–2554.
16. Šigutová ZP, Fátorová I, Hrachovinová I et al. (n.d.). Doporučení laboratorní sekce České hematologické společnosti ČLS JEP Preanalytika v hematologické laboratoři. Retrieved July 22, 2021, from http://www.hematology.cz/doporuceni/laboratorni_ sekce/files/obecna/Doporuceni_LS_CHS_CLS_JEP‑Preanalytika_ v_hematologicke_ laboratori_v01.pdf
17. Kitchen S, Olson JD, Preston FE. Quality in Laboratory Hemostasis and Thrombosis. Bognor Regis: Wiley‑Blackwell, 2nd Edition. 2013; 22–44.
18. Smock KJ, Crist RA, Hansen SJ et al. Discard tubes are not necessary when drawing samples for specialized coagulation testing. Blood Coagul Fibrinolysis. 2010; 21 : 279–82.
19. Loeffen R, Kleinegris MC, Loubele ST et al. Preanalytic variables of thrombin generation: towards a standard procedure and validation of the method. J Thromb Haemost. 2012; 10 : 2544–54.
20. Guder WG, Narayanan S. Pre ‑ Examination Procedures in Laboratory Diagnostics: Preanalytical Aspects and Their Impact on the Quality of Medical Laboratory Results. De Gruyter; 2015.
21. Harrison P, Mackie I, Mumford A et al. British committee for standards in H. Guidelines for the laboratory investigation of heritable disorders of platelet function. Br J Haematol. 2011; 155 : 30–44.
22. Adcock DM, Kressin DC, Marlar RA. Minimum specimen volume requirements for routine coagulation testing: Dependence on citrate concentration. Am J Clin Pathol. 1998; 109 : 595–599.
23. Chuang J, Sadler MA, Witt DM. Impact of evacuated collection tube fill volume and mixing on routine coagulation testing using 2.5 mL (pediatric) tubes. Chest. 2004;126 : 1262–1266.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo E-7- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Monitoring a analýza rizikových faktorů pádů pacientů hospitalizovaných v nemocnicích
- Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
- Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
- Amiodaronem indukované postižení plic u pacienta s fibrilací síní
- Úskalí diagnostiky autoimunitní pankreatitidy
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
- Amiodaronem indukované postižení plic u pacienta s fibrilací síní
- Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
- Úskalí diagnostiky autoimunitní pankreatitidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



