-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mimotělní eliminační metody v toxikologii: 2. část
Extracorporeal removal techniques in toxicology: part 2
The second part of the review deals in detail with the diagnostics and treatment of toxic alcohols poisoning and management and indication of extracorporeal removal techniques in intoxication with other drugs, theophylline, valproic acid, metformin and metformin associated lactic acidosis, respectively. The extracorporeal treatment enhances the clearance of the toxin and corrects patient’s metabolic disturbances as well. It is necessary to use this treatment in severe intoxications. Indication of this invasive procedure falls within clinician’s and nephrologist’s competence being advised by a toxicologist. This review could help make fast decisions.
Keywords:
intoxication – overdose – poisoning – extracorporeal treatment
Autoři: Jaroslav Raděj 1,2; Jan Horák 1,2; Martin Harazim 1,2; Martin Matějovič 1,2
Působiště autorů: I. interní klinika LF UK a FN Plzeň 1; Biomedicínské centrum LF UK, Plzeň 2
Vyšlo v časopise: Vnitř Lék 2019; 65(6): 425-432
Kategorie: Přehledný referát
Souhrn
Druhá část přehledového textu se šířeji věnuje problematice diagnostiky a léčby otrav toxickými alkoholy a managementu a indikace extrakorporální eliminace u intoxikace dalšími léčivy, konkrétně teofylinem, valproátem a metforminem a s ním asociované laktátové acidózy. Mimotělní eliminační metoda zde přináší vedle zvýšení clearance noxy současně kontrolu vnitřního prostředí pacienta a je nutnou součástí léčby závažně probíhající intoxikace. Indikace této invazivní procedury je kompetencí klinika a nefrologa s poradentstvím toxikologa, tento článek by mohl být v rychlém rozhodování nápomocen.
Klíčová slova:
intoxikace – mimotělní eliminace – otrava – předávkování – hemodialýza
Úvod
Tento text navazuje na předchozí přehled uvádějící obecné indikace extrakorporální eliminační léčby a představující jednotlivé mimotělní eliminační metody využitelné v toxikologii a jejich konkrétní nasazení v případech otravy lithiem, salicyláty nebo předávkování dabigatranem.
Alkoholové intoxikace
Etylalkohol a nonetanolové alkoholy jsou ryzím typem dialyzovatelné toxické látky s nízkou molekulovou hmotností 30–80 Da, vysokou rozpustností ve vodě, bez vazby na plazmatickou bílkovinu či tkáně, s nízkým distribučním objemem 0,5–0,8 l/kg odpovídajícím množství tělesné vody. Díky malé a neionizované molekule hrají roli v S/P osmolalitě a ještě nemetabolizované mateřské alkoholy jsou detekovatelné v rutinním laboratorním vyšetření elevací osmolálního gapu (OG), tj. rozdílu mezi měřenou osmolalitou [mOsmol/kg, mmol/kg] a osmolalitou vypočtenou: 2 × Na + glykemie + urea [vše v mmol/l, jde vlastně o osmolaritu, hustota plazmy je 1,01 kg/l, proto veličiny a jednotky sjednocujeme]. Za pozitivní je považován OG > 10 mOsmol/kg a signalizuje přítomnost běžně biochemicky nedetekovatelné osmoticky aktivní látky v krvi. S teoretickou znalostí koncentrace konkrétního alkoholu odpovídající 1 mOsmol/kg můžeme ze zjištěného osmolálního gapu zhruba odhadnout S/P hladinu toxického alkoholu či odlišit podíl běžně stanovitelného etanolu (tab). Hraniční elevace OG k hodnotě 10 mOsmol/kg intoxikaci již škodlivým množstvím toxického alkoholu nevylučuje. Všechny alkoholy jsou metabolizovány a vylučování ledvinami je pouze z menší či malé části (snad kromě dietylenglykolu). Oxidací mateřských alkoholů převážně alkoholdehydrogenázou (ADH) vznikají aldehydy nebo aceton (také zvyšují OG) a následně aldehyddehydrogenázou organické kyseliny. Tyto kyseliny disociují (zpravidla jako sodné soli již nezvyšují OG) a jsou příčinou metabolické acidózy se zvýšeným anion gapem. Anion gap (AG) kvantifikuje přítomnost rutině nestanovovaných anionů v séru nebo plazmě, vycházíme z rozdílu: Na+ – (Cl- + HCO3-), za patologickou považujeme hodnotu > 12 mmol/l. Významná hypoalbuminemie AG snižuje a k upřesnění hodnoty je potřeba korekce: AGkorig = AG + 0,25 × (44 – albumin měřený). V průběhu intoxikace a metabolizmu alkoholů vysokou hodnotu OG v řádu hodin zpravidla střídá metabolická acidóza se zvýšeným AG (výjimkou je etanol a izopropylalkohol, tab). Nemetabolizované alkoholy jsou málo toxické, ale v extrémních S/P koncentracích působí svou hyperosmolalitou i dalšími dosud nejasnými mechanizmy nežádoucí až život ohrožující projevy CNS toxicity, a odpovídající sedativně-hypnotickému toxidromu, až po hluboké kóma s neprůchodností dýchacích cest a útlumem dechového centra, může dojít ke kardiovaskulárnímu selhání, poruchám vnitřního prostředí (zejména hypoglykemii) nebo intravaskulární hemolýze. Naopak organické kyseliny metanolu, etylenglykolu či dietylenglykolu jsou svým cytotoxickým efektem zodpovědné za specifická tkáňová a orgánová postižení, nespecifickou multiorgánovou dysfunkci či generalizovanou mitochondriální dysfunkci s laktátovou metabolickou acidózou. Současná původní koingesce toxického alkoholu spolu s etanolem, která je velmi častá, oddaluje nástup orgánově specifických projevů toxického alkoholu, stejně jako oddaluje vývoj metabolické acidózy se zvýšeným anion gapem. Vysoké podezření na intoxikaci alkoholy by mělo vyvstat v případě pacienta s hyperosmolalitou a zvýšeným OG, nevysvětlenou metabolickou acidózou se zvýšeným AG (diferenciální diagnóza – tab. 1, 1. část článku, s. 417), nejasnými neurologickými příznaky či selháním ledvin. Předpokladem úspěchu léčby intoxikace je monitorace a zajištění životně důležitých funkcí. Alkoholy se vstřebávají rychle sliznicemi gastrointestinálního traktu, vzácně dochází k intoxikaci inhalačně či transdermálně. S/P hladina dosahuje vrcholu již za 30–90 min po požití. Odsátí žaludečního obsahu silnou sondou má tedy smysl ihned, nejpozději do 1 hod po požití velkého množství alkoholu, výjimečně jej lze nahradit vyvoláním zvracení. Na aktivní uhlí se alkoholy neadsorbují.
Tab. 1. Metabolizmus alkoholů 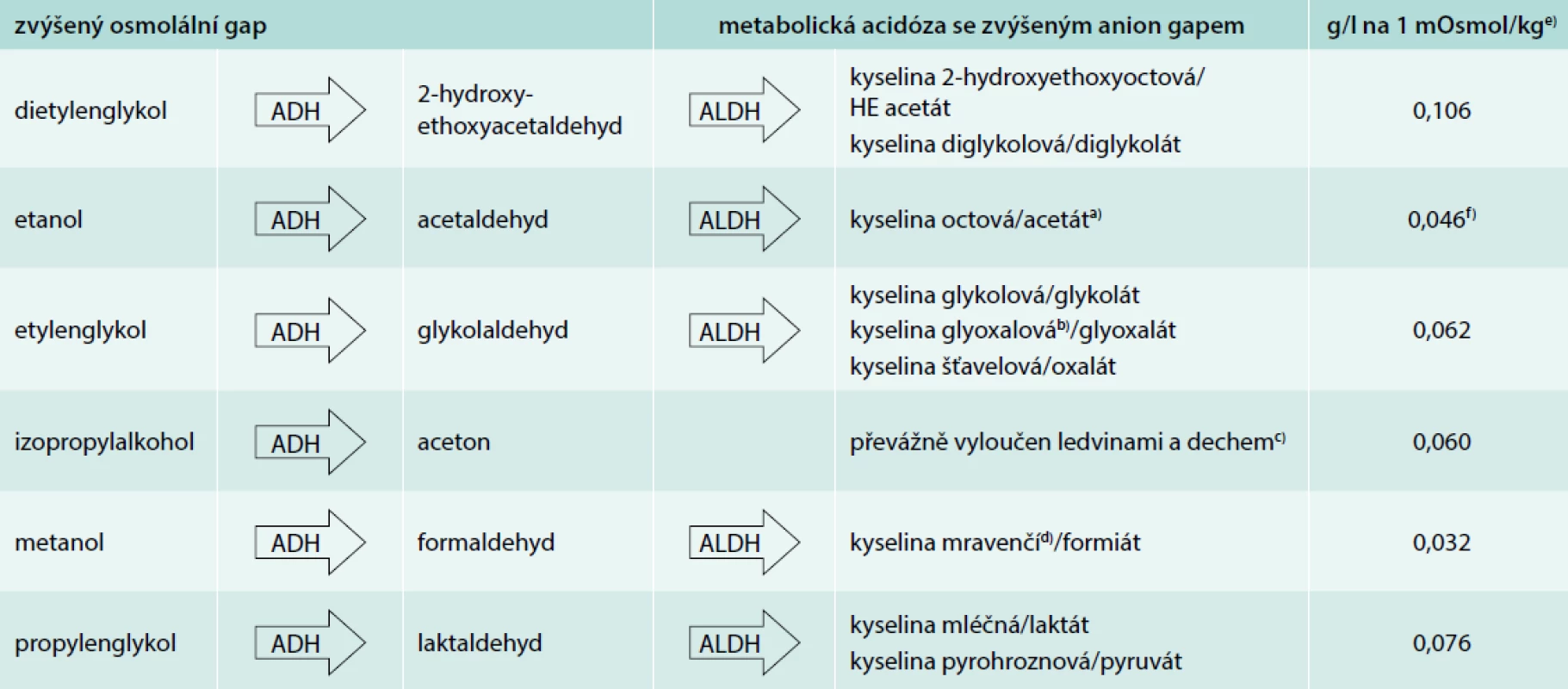
ADH – alkoholdehydrogenáza ALDH – aldehyddehydrogenáza
a) přirozeně účinně metabolizován nepůsobí metabolickou acidózu se zvýšeným anion gapem b) tiamin a pyridoxin jsou kofaktory alternativního metabolizmu kyseliny glyoxalové na netoxické produkty c) nepůsobí metabolickou acidózu se zvýšeným anion gapem d) kyselina folinová, popř. kyselina listová je kofaktorem metabolizmu kyseliny mravenčí na CO2 a H2O e) sérová/plazmatická koncentrace mateřského alkoholu odpovídající 1 mOsmol/kg sérové/plazmatické osmolality (odvozeno z molekulové hmotnosti alkoholu/1 000) f) nehledě na molekulovou hmotnost k přesnějšímu odhadu podílu etanolu na osmolálním gapu podle některé studie lépe odpovídá 0,040 nebo dokonce 0,037 g/l na 1 mOsmol/kg [12,13]Etanol je v extrémních případech toxický díky svému osmotickému působení a za včasných a adekvátních podpůrných opatření je intoxikace výjimečně smrtelná. Jeho metabolity jsou netoxické, tělu vlastní sloučeniny vstupující do metabolizmu Krebsova cyklu. Pokud není akutní toxické požití natolik masivní, že nezvýší hladinu ketolátek nebo kyseliny mléčné, nezaznamenáváme během utilizace etanolu vývoj metabolické acidózy se zvýšeným anion gapem. V souvislosti s otravou etanolem je třeba předejít hypoglykemii (u dětí již při S/P hladině vyšší než 0,5 g/l, tj. 0,5 ‰), dehydrataci, hypotenzi při současné vazodilataci, iontovým poruchám, hypotermii, v některých případech je nutné thiaminem (nejméně 100 mg parenterálně) předejít nebo léčit Wernickeho encefalopatii. Akutní intoxikace může být vzácně příčinou alkoholické ketoacidózy, typické především pro chronickou expozici. Etanol se eliminuje kinetikou nultého řádu asi 0,2 ‰/hod, u chronických etyliků až 2krát rychleji.
Hemodialýza může být indikována zcela výjimečně v případech požití extrémního množství etanolu provázených vážným klinickým zhoršením a těžkou hemodynamickou nestabilitou nebo u pacientů s chronickým postižením jater a sníženou schopností metabolizmu, v pediatrii. Hlavním benefitem IHD je 3–4násobné urychlení eliminace a zkrácení doby nutných podpůrných opatření.
Metanol (M) je přísadou konzervačních roztoků, rozpouštědel, alternativních paliv či vedlejším produktem nedostatečné destilace při výrobě etanolu. Je zdrojem vysoce toxického metabolitu kyseliny mravenčí, která je zodpovědná za orgánová postižení již při S/P hladině metanolu > 0,2 g/l. Za letální dávku bez terapie bývá uváděna dávka 1 ml/kg plně koncentrovaného metanolu, toxická dávka je mnohem nižší, uvádí se již > 0,1 ml/kg čistě koncentrovaného alkoholu. Působením kyseliny mravenčí dochází k selektivnímu překrvení a edému až trvalému poškození papily zrakového nervu a sítnice (trvalá slepota až ve 30 % případů), ischemii a krvácení v oblasti bazálních ganglií mozku. Patofyziologie je založena na cytotoxickém poškození a mitochondriální dysfunkci, generalizované metanolové trauma proto provází těžká laktátová acidóza. Metanol je bez léčby eliminován kinetikou nultého řádu asi 0,085 ‰/hod, toxické projevy nastupují za 6–12 hod a vrchol S/P hladiny kyseliny mravenčí se objevuje za 1–2 dny, symptomy orgánové toxicity se zpravidla projevují do 72 hod. Pokud je ADH pro metanol blokována, nevznikají toxické metabolity a metanol se vylučuje dechem a močí kinetikou prvého řádu s dlouhým biologickým poločasem (t1/2) až 50 hod. Kyselina listová nebo její aktivní redukovaná forma kyselina folinová jsou významnými kofaktory metabolizmu kyseliny mravenčí na H2O a CO2. Přednost má kyselina folinová (leukovorin), dávkování je pro oba léky jednotné, 50 mg (či 1 mg/kg do výše 50 mg jednotlivé dávky) intravenózně, popř. perorálně po 6 hodinách do ústupu metabolické acidózy. Smysl má alkalizace bikarbonátem sodným s cílem udržení pH krve > 7,3, která zvyšuje disociaci kyseliny mravenčí, ionizovaný formiát hůře proniká přes buněčnou membránu buněk cílových orgánů a je snadněji vylučován ledvinami principem alkalizace moči. Dávkování bikarbonátu je obdobné (viz 1. část článku, s. 417). Delší biologický poločas byl zaznamenán u více acidotických pacientů i na eliminačních metodách.
Etylenglykol (EG) je přísadou zejména nemrznoucích směsí a tekutin do automobilových ostřikovačů. Obdobně jako u metanolu toxické projevy jsou patrné již při S/P koncentracích > 0,2 g/l, požití 1,3–1,5 ml/kg neředěného etylenglykolu je považováno bez léčby za letální množství. Cílovým orgánem poškození jsou ledviny a zodpovědnými metabolity jsou pravděpodobně glykolová kyselina působící přímé tubulární poškození a krystaly solí kyseliny šťavelové, zejména oxalát vápenatý, precipitující v tubulech ledvin a působící obstrukci a tubulární nekrózu. Kyselina glykolová svým cytotoxickým působením selhání buněčné energetiky může být příčinou multisystémového poškození a laktátové acidózy, krystaly oxalátu byly sekčně zjišťovány nejen v ledvinách, ale i mozku, srdci, plicích. Otravu provází závažná hypokalcemie. Metabolická acidóza se objevuje již 4–12 hod po požití, šťavelan vápenatý v moči je zaznamenáván po 4–8 hod, renální postižení a selhání po 24–48 hod. Restituce renální funkce je častá, v řádu dnů až měsíců. Etylenglykol se eliminuje kinetikou prvního řádu s poločasem 3–9 hod. Při blokádě ADH je vylučován pouze ledvinami s poločasem 14–18 hod, pokud zůstává činnost ledvin zachována. I u intoxikace EG má význam alkalizace v případě vývoje metabolické acidózy. Kofaktory alternativní metabolické dráhy kyseliny glyoxalové na netoxické sloučeniny jsou thiamin (doporučeno minimálně 100 mg intravenózně) a pyridoxin (minimálně 50 mg intravenózně), přesvědčivé důkazy klinického významu ale chybějí. Glykolát interferuje s analytickým stanovením laktátu v některých analyzátorech a dochází tak k falešnému výsledku hyperlaktatemie, přestože krevní laktát skutečně nemusí být zvýšen (laktátový gap).
Úspěch léčby závisí na inhibici metabolizmu mateřského metanolu a etylenglykolu kompetitivní blokádou ADH, která má smysl včasně, nejpozději do 8–10 hod od požití noxy, ideálně v době přítomného zvýšeného osmolálního gapu a absence metabolické acidózy se zvýšeným anion gapem. Po zmetabolizování alkoholu je již neopodstatněná. K saturaci ADH využíváme fomepizolu (4-metylpyrazolu) nebo etanolu, afinita metanolu je převýšena fomepizolem asi 8 000krát, etanolem asi 15krát a metabolizmus těchto látek je netoxický. Mateřský alkohol je potom vylučován ledvinami a dechem. Etanol je „lékem“ druhé volby, potencionálně prohlubující alteraci vědomí, komplikovaně dávkovatelný pro značně intraindividuální i interindividuální variabilitu farmakokinetiky vyžadující frekventní monitoraci hladiny, vyžadující centrální žilní přístup, rizikový z důvodu hypoglykemie zejména u dětí, je kontraindikován v 1. trimestru těhotenství. V případě vážné intoxikace a dostupnosti je preferován fomepizol. Průběh otravy těmito toxickými alkoholy je variabilní, přístup musí být individuální, nejlépe ve spolupráci s národním toxikologickým centrem, v našem případě Toxikologickým informačním střediskem v Praze (TIS), popř. následujíce tamní platná doporučení.
Blokáda ADH je indikována, adoptujeme-li doporučení The American Academy of Clinical Toxicology (AACT) [14,15], pokud je:
- sérová/plazmatická hladina M + EG > 0,2 g/l
- recentní požití toxické dávky M + EG a osmolální gap > 10 mOsml/kg
- anamnéza nebo silné klinické podezření na požití M + EG a přítomny alespoň 2 okolnosti z následujících:arteriální pH < 7,3; koncentrace bikarbonátu < 20 mmol/l; osmolální gap > 10 mOsml/kg; oxaláty v moči v případě otravy EG
Ukončení blokády ADH je možné, pokud je:
- hladina M + EG < 0,2 g/l (snad i M < 0,3 g/l v případě léčby fomepizolem podle TIS) u asymptomatického pacienta bez acidózy
- nedetekovatelná hladina M + EG v krvi u pacientů se selektivní orgánovou toxicitou
- lze zvážit při normalizaci pH krve a S/P osmolality (nebo ústupu neetanolového osmolálního gapu) při nedostupnosti měření hladin toxických alkoholů
Dávkování fomepizolu: intravenózně 15 mg/kg, dále 10 mg/kg po 12 hod, po 4 podáních je nutné dávku navýšit na 15 mg/kg pro urychlení metabolizmu indukcí cytochromu P450. Podle klinických zkušeností bylo v průměru třeba 3,5 dávky při intoxikaci etylenglykolem, 4 dávky v případě metanolu. Během IHD je nutné dávkovací interval zkrátit na 4 hod. Pokud podání léku předcházelo 6 a více hodin začátku IHD, je nutné předchozí dávkovací interval zkrátit zpravidla dodatečnou dávkou po zahájení metody, podrobná schémata jsou obsažena v doporučení TIS nebo SPC léku.
Dávkování etanolu: sérová/plazmatická hladina by měla dosahovat nejméně třetiny hladiny metanolu či etylenglykolu, průběžné měření hladin M + EG není zpravidla k dispozici, proto se arbitrárně volí cílová hladina etanolu 1–1,5 g/l. U dětí, pokud nelze upřednostnit fomepizol, postačuje hladina etanolu 1 g/l, v těchto případech je zvýšeno riziko hypoglykemie. Nejčastěji se využívá 10% roztok etanolu (v 5% glukóze) k úvodní dávce, která by měla respektovat distribuční objem etanolu u žen 0,55 l/kg a u mužů 0,68 l/kg, zpravidla je to 8–10 ml/kg během 30–60 minutové infuze. Počáteční udržovací dávka je potom 1 ml/kg/hod, v případě pacienta s chronickým etylizmem je často potřeba vyšší dávky 1,5 ml/kg/hod, nezbytná je častá monitorace hladiny etanolu a úprava dávkování. Během IHD je nutné asi 100% navýšení udržovací dávky. Substituce dialyzačního roztoku etanolem na koncentraci 2 g/l je další možností. Etanol lze podávat také cestou perorální či nazogastrickou sondou, je však hůře tolerován, zpravidla se volí iniciálně 20% roztok v ekvivalentních dávkách. Často je potřeba 48 hod až několika dnů blokády.
Hemodialýza je schopna zvýšit eliminaci metanolu a etylenglykolu, jejich metabolitů a kyselin, koriguje vnitřní prostředí, odstraňuje však léčebně podávaný etanol i fomepizol. Není teoreticky nezbytná nebo je odložitelná při včasné blokaci ADH, zejména fomepizolem, ale je nutná v přítomnosti toxických karboxylových kyselin působících metabolickou acidózu se zvýšeným anion gapem. Za těchto okolností snižuje mortalitu a morbiditu a zkracuje délku hospitalizace.
HD je indikována zohledňujíce dřívější doporučení AACT [14,15], pokud je:
- sérová/plazmatická hladina M > 0,5 g/l; sérová/plazmatická hladina EG > 0,5 g/l bez blokády ADH (zejména fomepizolem). Totéž platí pro požití odpovídajícího množství toxického alkoholu bez znalosti hladiny výpočtem dle distribučního objemu. K odhadu množství toxického alkoholu v krvi lze použít výpočet z výše osmolálního gapu (tab). V ČR TIS navrhuje v případě metanolu další laboratorní diagnostickou a indikační eventualitu, kterou je sérová/plazmatická hodnota kyseliny mravenčí > 0,2 g/l
- přítomna metabolická acidóza s pH arteriální krve < 7,3
- známky selektivní orgánové toxicity (zrak, extrapyramidové projevy, renální postižení)
- další deteriorace vitálních funkcí navzdory intenzivní podpůrné terapii
- renální selhání
- iontová porucha nereagující na konzervativní postup
- popř. zkrácení doby nezbytné blokace ADH a monitorace, zejména v případě inhibice etanolem. Platí zpravidla pro případy vysoké hladiny EG jinak nesplňující indikaci k eliminační léčbě
HD je ukončena, pokud je:
- hladina M + EG < 0,2 g/l při odeznění acidózy a bez projevů systémové toxicity
- lze zvážit při normalizaci pH krve a S/P osmolality (nebo ústupu neetanolového osmolálního gapu) při nedostupnosti měření hladin toxických alkoholů
Podle recentnějšího konsenzuálního doporučení The Extracorporeal Treatments In Poisoning (EXTRIP) workgroup pro intoxikaci metanolem na základě dostupných informací je IHD nebo alternativní kontinuální modalita indikována v případě těžké otravy M [20,21], pokud je přítomno jedno z kritérií (Grade 1D): kóma; křeče; nová porucha zraku; pH krve ≤ 7,15; perzistující metabolická acidóza navzdory adekvátní konzervativní léčbě; anion gap > 24 mmol/l; hladina M > 0,7 g/l a léčba fomepizolem; hladina M > 0,6 g/l a léčba etanolem; hladina M > 0,5 g/l bez blokády ADH; odpovídající osmolální gap při nedostupné hladině M; postižení ledvin (od CKD stadia G3b; AKI stadia 2 KDIGO; popř. bez znalosti výchozí hodnoty kreatininu tento ≥ 176 µmol/l, popř. u starších a pacientů s nízkou svalovou hmotou ≥ 132 µmol/l a u dětí > 2násobek horního fyziologického limitu; přítomná oligo/anurie déle než 6 hodin).
Extrakorporální léčba smí být ukončena při hladině M < 0,2 g/l a klinickém zlepšení (Grade 1D).
Trvání IHD v hodinách k dosažení poklesu hladiny toxického alkoholu v krvi přibližně k této hodnotě lze odhadnou podle vzorce D. J. Hirsche: [–V · ln (5/A)]/0,06 · k, kde V je objem tělesné vody podle Watsona v litrech, A je úvodní S/P hladina alkoholu v mmol/l, k je 80 % hodnoty clearance urey dialyzátorem v ml/min pro zvolený průtok krve [21]. Zpravidla je ale zapotřebí minimálně 8hodinová procedura. Měl by být užit high-efficiency dialyzátor (> 1,5 m2), vysoký průtok krve minimálně 300 ml/min, bikarbonátový roztok. Intermitentní hemodialýza poskytuje clearance metanolu asi 200 ml/min, kyseliny mravenčí 220 ml/min, etylenglykolu 200–250 ml/min a glykolové kyseliny 170 ml/min a snižuje její poločas z asi 10 hod na 2,5 hod. Riziko rebound fenoménu je nízké, přesto není vyloučeno a někteří autoři doporučují pokračovat v inhibici ADH ještě několik hodin po IHD nebo bez možnosti stanovení hladiny toxického alkoholu opakovat IHD v následujících 12 hod. Je vhodné sledovat acidobazickou rovnováhu s odstupem po dialýze. Intermitentní metodu lze následovat popř. nahradit CVVHD či CVVHDF, které mají výhodu ve vyšší hemodynamické toleranci. V případě metanolu existují informace svědčící pro vyšší účinnost intermitentní metody (t1/2 metanolu 3,7 hod, kyseliny mravenčí 1,6 hod) proti kontinuálním metodám CVVHD/CVVHDF (t1/2 8,1 hod a 3,6 hod), lepší klinický výsledek již tak jednoznačný není [22,23]. Přesto se stávající doporučení shodují na preferenci intermitentní metody, je nutné vážit mezi přechodným rizikem hemodynamické nestability u IHD a výhodou rychlé eliminace toxinů a kontroly vnitřního prostředí. CRRT zůstává alternativou a i zde navýšení průtoku dialyzátu a větší povrch membrány vedly k navýšení eliminace. Systémová antikoagulace v průběhu procedury v případě metanolové intoxikace by neměla být použita pro zvýšené riziko intraparenchymového nitrolebního krvácení. Zbývají proplachy nebo citrátová regionální antikoagulace mimotělního okruhu, bohužel s rizikem snížené utilizace citrátu v době globální mitochondriální dysfunkce a prohloubení metabolické acidózy.
Izopropylalkohol je rozpouštědlo, příměs nemrznoucích směsí, čisticích prostředků, kosmetiky i dezinfekce. Účinná expozice je možná vedle zažívacího traktu také intaktní kůží či inhalací. Smrtící otravy jsou výjimečné, požitím extrémního množství noxy působící útlum CNS, dechového centra, kardiovaskulární selhání a šok podobně jako u ostatních alkoholů a etanolu. V tomto ohledu je izopropylalkohol asi 2krát potentnější než etanol, účinek trvá 2–4krát déle, toxické projevy začínají na sérové/plazmatické hladině 0,5 g/l. Za letální dávku pro dospělého bývá uváděna ingesce 2–4 ml/kg čistě koncentrovaného alkoholu, ale vzhledem k vysoké variabilitě v reakci na expozici jsou dokumentovány přežití mnohem vyšších dávek pouze díky podpůrné léčbě. Nemá toxické metabolity, neprodukuje organické kyseliny snižující pH a zvyšující anion gap. Jeho metabolitem je aceton, ještě méně toxický, mírně sedativní, působící mírnou ketózu, který je vylučován dechem, ledvinami, v malé míře dále metabolizován. Biologický poločas izopropylalkoholu je 2,5–8 hod, acetonu 10 a více hodin. Aceton v krvi kulminuje již po 4 hod, rovněž zvyšuje osmolalitu, při S/P hladinách > 0,1 g/l falešně zvyšuje stanovení hodnoty kreatininu, zatímco urea zůstává nezvýšena. Tento laboratorní jev spolu s vysokým osmolálním gapem, absencí acidózy a zvýšeného anion gapu, přítomností ketonurie může vést ke stanovení diagnózy. Jsou nutná obecná opatření společná pro všechny alkoholy, není ale nutná inhibice ADH.
Hemodialýza odstraňuje izopropylalkohol i aceton a je indikována výjimečně z důvodu těžké hemodynamické deteriorace nereagující na tekutiny a vazopresory, protrahovaného kómatu, při sérové/plazmatické koncentraci > 4 g/l či odpovídajícím množství požitého alkoholu, v případě renálního selhání s poruchou vnitřního prostředí, u pacientů s chronickou hepatopatií a dětí.
Propylenglykol je rovněž technickou nemrznoucí přísadou, sloučeninou kosmetického průmyslu, vedle toho se užívá jako rozpouštědlo hydrofobních léků jako fenytoinu, diazepamu, lorazepamu a řady dalších; byly popsány intoxikace prolongovanou, vysokodávkovanou infuzí. Toxicita byla sledována častěji při sérové/plazmatické koncentraci > 1 g/l. Poločas eliminace propylenglykolu je 3–5 hod, zhruba třetina je vyloučena ledvinami, většina je metabolizována ADH na kyselinu mléčnou a pyrohroznovou. Intoxikací dochází k vývoji laktátové acidózy, hypotenze a multiorgánové dysfunkce. Obvykle dostačující je vysazení expozice noxou, podpůrná léčba a alkalizace, k ústupu acidózy dochází často do 24 hod.
Hemodialýza byla efektivně použita v případech těžkých intoxikací. Zejména je nutné o ní uvažovat při vážné klinické alteraci, renálním selhání, extrémních S/P hodnotách propylenglykolu více než 4 g/l či těžké metabolické laktátové acidóze. V těchto klinicky závažných případech je na zvážení současná blokáda ADH fomepizolem.
Dietylenglykol je průmyslová kapalina, součást brzdové kapaliny či nelegální příměs konzumního lihu. Letální dávka bez léčby je odhadována na 1–1,5 ml/kg koncentrovaného alkoholu. Molekulová hmotnost je u tohoto alkoholu 106 Da, vyšší proti ostatním alkoholům, proto osmolální gap nemusí být nijak vysoký. Je vylučován z 50–70 % ledvinami v poločase 4–6 hod. Obvykle po 24 hod se objevuje metabolická acidóza, důvodem je metabolit kyselina 2-hydroxyethoxyoctová, která je příčinou oligurického i nonoligurického selhání ledvin, ale i postižení CNS, jater, pankreatu.
Hemodialýza a blokáda ADH jsou doporučeny. Přesná indikační kritéria nejsou formulována, obdobně jako u etylenglykolu se řídíme osmolálním gapem, metabolickou acidózou se zvýšeným anion gapem, renálním selháním či klinickou alterací. Ukončení terapie je možné při normalizaci pH arteriální krve a ústupu osmolálního gapu, klinickém zlepšení.
Metforminová intoxikace a laktátová acidóza asociovaná s metforminem
Metformin je nejčastěji používaným perorálním antidiabetikem, vzácně přinášejícím vážnou zdravotní komplikaci, laktátovou metabolickou acidózu (Metformin Associated Lactic Acidosis – MALA). Metformin má malou molekulu s Mw 129 Da, bez vazby na plazmatickou bílkovinu, distribuční objem je velký, 1–5 l/kg, vrcholové hladiny po požití dosahuje asi za 1–3 hod. Je vylučován výhradně ledvinami glomerulární filtrací a tubulární sekrecí, biologický poločas má multifázický, v plazmě asi 6 hod. K předávkování a laktátové acidóze dochází akutním požitím, bývá některými zdroji odlišována jako MILA (Metformin-Induced Lactic Acidosis), nebo kumulací léku v případě nejdůležitějšího precipitujícího faktoru, poklesu renální funkce a všech případů, které k této okolnosti vedou. K patofyziologii MALA dále přispějí všechny stavy zvyšující produkci laktátu a bránící jeho eliminaci. Gastrointestinální nežádoucí účinky metforminu mohou samy vést k dehydrataci a ke zhoršení funkce ledvin a uzavření bludného kruhu. Sama patofyziologie MALA/MILA je založena na inhibici mitochondriálního respiračního řetězce, dispozice k tomuto generalizovanému traumatu je značně individuální, laboratorně se projevuje těžkou laktátovou acidózou, hypoglykemie není typická. Hladinu metforminu v krvi běžně nestanovujeme, na rozdíl od výšky hyperlaktatemie a tíže metabolické acidózy nekoreluje se závažností intoxikace. Ta je klinicky provázena alterací vědomí, hyperventilací, bolestmi břicha a zvracením, šokem.
V rámci podpůrného a symptomatického postupu často přistupujeme k alkalizaci, byť v řadě ohledů kontraverzní, proto je na místě být rezervovaný až k hodnotám pH arteriální krve < 7,15. Hyperventilace nemocného je kompenzačním mechanizmem, i v případě arteficiální ventilace je toto třeba respektovat. Jednorázové podání aktivního uhlí je indikováno včasně v případě akutní intoxikace. Ostatní dekontaminační a eliminační postupy nejsou doporučeny kromě metod náhrady funkce ledvin.
Hemodialýza je účinná metoda eliminace metforminu, ale zejména kontroly vnitřního prostředí a alkalizace. Je indikována ve stavech:
- cirkulační šok (EXTRIP, 1D)
- selhávání podpůrné léčby a alkalizace (EXTRIP, 1D)
- těžká acidóza s pH krve ≤ 7,0 (EXTRIP, 1D), popř. < 7,1 (EXTRIP, 2D)
- hyperlaktatemie > 20 mmol/l (EXTRIP, 1D), popř. > 15 mmol/l (EXTRIP, 2D)
- renální insuficience (definována při předchozích noxách, EXTRIP, 1D)
- jaterní selhání (EXTRIP, 2D)
- porucha vědomí (EXTRIP, 2D)
Intermitentní metoda hemodialýzy zasluhuje vysoký průtok krve a účinný dialyzátor. Ke kontrole kritického stavu je potřeba často 12–24 hod a kombinace intermitentní a následující kontinuální metody se nabízí. V léčbě je rozhodující účinnost a dávka eliminační metody, iniciální IHD je jasně preferována, byť mohou být kontinuální metody lépe hemodynamicky tolerovány v případech extrémní nestability krevního oběhu. Jsou popisovány případy úspěšné léčby teprve za cenu 2 současně probíhajících mimotělních okruhů a eliminačních metod. Preferenci některé z metod CVVHD, CVVH či CVVHDF nelze nijak odůvodnit klinickými fakty. Podmínkou využití všech kontinuálních metod je vysoká až maximální dávka, tj. nejvyšší míra ultrafiltrace či průtoku dialyzačního roztoku (využíváme bikarbonátových roztoků) vedle vysokého průtoku krve (zejména u dialyzačních procedur), nasazení výkonné membrány. Antikoagulace citrátem není zpravidla tolerována a dochází ke kumulaci citrátu a prohloubení metabolické acidózy, důvodem je selhání buněčného energetického metabolizmu navozené metforminem. Metoda eliminace by měla provázet pacienta v léčbě do klinického zlepšení a dle laboratorních markerů ukončena při laktatemii < 3,0 mmol/l a pH krve > 7,35 (EXTRIP, 1D). Hrozí riziko rebound fenoménu a další sledování pacienta klinicky a biochemicky, zejm. acidobazické rovnováhy a laktátu, je na místě.
Teofylinová intoxikace
Tato není výjimečná ani v dnešní době, kdy lék ustupuje ze své hlavní indikace bronchodilatačního agens. Jde o léčivo s malou molekulovou hmotností 180 Da, malým distribučním objemem 0,5 l/kg i relativně nízkou vazbu na bílkovinu asi 50 %. Téměř úplně se vstřebává ze zažívacího traktu a vrcholové sérové/plazmatické koncentrace dosahuje po 2–3 hod, u retardovaných forem po 3–6 hod. Parenterální ekvivalent aminofylin obsahuje teofylin z 80 %. Teofylin je metabolizován a vylučován kinetikou prvního řádu s poločasem 8 hod u dospělých a 3 hod u malých dětí, pomaleji u novorozenců a kojenců a starších dospělých, při předávkování se eliminace posouvá do nultého řádu a významně se zpožďuje. Metabolizmus je navíc velmi variabilní. Důvodem chronické intoxikace je kromě přílišné dávky také pokles eliminace způsobený orgánovou dysfunkcí, akutní infekcí, interakcí s jinými léčivy nebo také zanecháním kouření, které metabolizmus indukuje. Signifikantní toxicitu lze očekávat již při S/P koncentraci > 25 mg/l. Za toxickou je považována akutně požitá dávka > 15 mg/kg, za letální > 100 mg/kg. Účinek i toxicita teofylinu je zejména založena na inhibici fosfodiesteráz a nepřímém β-adrenergním efektu, stejně tak na přímém adrenergním působení zvýšeným uvolněním endogenních katecholaminů. Život ohrožující toxické projevy jsou křeče, komorové arytmie, vazodilatace a hypotenze, méně závažné příznaky jsou supraventrikulární arytmie, profuzní zvracení a bolest břicha, poruchy elektrolytů s dominující hypokalemií, metabolická acidóza, hyperglykemie. Monitorování S/P hladiny při podezření na intoxikaci je doporučeno frekventně, pokud je dostupné, do zaznamenání jejího poklesu.
Léčba spočívá v protekci a podpoře vitálně důležitých funkcí, symptomatické antikonvulzivní, antiemetické a substituční léčbě. Nežádoucí kardiovaskulární projevy v podmínkách přísné monitorace lze zvládnout titrací selektivního betablokátoru esmololu, lékem volby závažných komorových arytmií je amiodaron. Adsorpce aktivním uhlím je účinná. Teofylin podléhá enterohepatální cirkulaci a opakovaným podáním aktivního uhlí lze dosáhnout významného zvýšení eliminace, a to i u parenterálně podaného léku principem intestinální dialýzy. Metoda opakovaného podání aktivního uhlí by neměla být přerušena ani během mimotělního očišťování. Forsírovaná diuréza a alkalizace moči je neúčinná.
Hemodialýza je metodou volby v případě závažných toxických projevů. High-flux a high-efficiency intermitentní metoda se v dnešní době již vyrovná účinností hemoperfuzi. Ta spolu s CRRT zůstává alternativou při nedostupnosti IHD, v případě CRRT méně účinnou. Indikace k očišťovací metodě jsou tyto:
- sérová/plazmatická koncentrace u akutní intoxikace > 100 mg/l (EXTRIP, 1C)
- křeče (EXTRIP, 1D)
- život ohrožující arytmie (EXTRIP, 1D)
- šok (EXTRIP, 1D)
- stoupající S/P koncentrace navzdory konzervativnímu postupu (EXTRIP, 1D)
- klinické zhoršování navzdory konzervativnímu postupu (EXTRIP, 1D)
- S/P koncentrace > 60 mg/l u chronické intoxikace (EXTRIP, 2D)
- S/P koncentrace u chronické intoxikace > 50 mg/l u dětí mladších 6 měsíců a dospělých starších 60 let (EXTRIP, 2D)
- netolerance gastrointestinální dekontaminace opakovaným podáním aktivního uhlí (EXTRIP, 2D)
Metoda může být zpravidla ukončena při zřejmém klinickém zlepšení nebo poklesu S/P koncentrace teofylinu < 15 mg/l (EXTRIP, 1D). Riziko rebound fenoménu vyplývá z prolongovaného vstřebání nebo uvolňování z retardované formy.
Valproátová intoxikace
Valproová kyselina a její sodná sůl patří mezi nejužívanější antiepileptika, je předepisována jako stabilizér nálady v léčbě bipolární poruchy, v léčbě migrény. V neretardované formě dosahuje vrcholové sérové/plazmatické koncentrace po 2–3 hod, často je ale podávána retardovanou formou s vrcholovou hladinou po 4–5 hod i déle. Molekulová hmotnost valproové kyseliny činí 144 Da (valproátu sodného 166 Da), distribuční objem je malý asi 0,1–0,5 l/kg díky vysoké vazbě na plazmatické bílkoviny 80–90 %. Eliminační poločas činí 8–20 hod, při předávkování déle než 30 hod. Terapeutický index je relativně široký 50–100 mg/l. Kyselina valproová je převážně metabolizována. V závislosti na dávce či idiosynkraticky vznikají toxické produkty zodpovědné za její nežádoucí projevy. Patří mezi ně CNS toxicita v podobě alterace vědomí a paradoxně myoklonií a křečí, hypertermie, hyperamonemie, jaterní postižení, metabolické poruchy, myelotoxicita. Závažný až fatální průběh otravy byl popsán po požití 400 mg/kg valproátu a více, vážnější a vážné příznaky otravy bývají pozorovány při S/P hladině > 450 mg/l, kóma a metabolická acidóza při S/P valproátu > 850 mg/l. Pro těžkou otravu je typická metabolická acidóza se zvýšeným anion gapem, současně zvýšený osmolální gap, důvodem je množství metabolitů s malou molekulovou hmotností. Bývá přítomna hyperlaktatemie vlivem mitochondriální dysfunkce. V extrémních případech dochází ke kómatu, kardiovaskulárnímu a respiračnímu kolapsu. V patofyziologii mozkového edému hraje roli právě hyperamonemie.
Zásadní je podpůrná a symptomatická léčba, poruchu vědomí může zmírnit naloxon, při hyperamonemii či jaterním postižení může protektivně působit karnitin. Jednorázově podané aktivní uhlí je účinné do 1–2 hod od akutního požití, opakované podání aktivního uhlí ani celková střevní laváž není doporučována. Forsírovaná diuréza a alkalizace je neúčinná.
Hemodialýza je účinná u těžkých intoxikací. Její efekt je umožněn saturací vazebné plazmatické bílkovinné kapacity a strmým vzestupem volné účinné látky v krvi. Eliminační poločas valproátu bývá IHD zkrácen na 2–4 hod. Rebound fenomén je přítomný, klinicky pravděpodobně nevýznamný. Současný vysoký efekt na eliminaci amoniaku se rovná clearance urey. Eliminace karnitinu je rovněž pravděpodobná, klinický význam není znám. Hemodialýza je indikována v těchto výjimečných případech:
- S/P hladina valproátu > 1 300 mg/l (EXTRIP, 1D), popř. > 900 mg/l (EXTRIP, 2D)
- šok (EXTRIP, 1D)
- otok mozku (EXTRIP, 1D)
- kóma (EXTRIP, 2D)
- respirační selhání vyžadující umělou plicní ventilaci (EXTRIP, 2D)
- akutní hyperamonemie (EXTRIP, 2D)
- pH krve ≤ 7,1 (EXTRIP, 2D)
Včasné napojení na mimotělní eliminaci hraje významnou roli. IHD je preferována. Obdobně účinnou, ale mnohem rizikovější alternativou podpory eliminace je intermitentní hemoperfuze, méně účinnou, ale akceptovanou alternativou je CRRT. Metoda eliminace je hodna vysazení při klinickém zlepšení (EXTRIP, 1D) nebo S/P valproátu mezi 50–100 mg/l (EXTRIP, 2D).
Závěr
Naděje pacienta na přežití vážné intoxikace bez trvalých následků je vysoká díky širokým možnostem podpory orgánových funkcí i eliminace noxy. Mezery v seznamu konvenčních antidot u některých rizikových léků budou moci být vyplněny díky imunologickým metodám. Vždy bude ale třeba individualizovat reakci lidského organizmu na toxin, vážit mezi přínosem a rizikem invazivní metody, léčit pacienta a ne jed, na prvním místě dbát o vitálně důležité orgánové funkce pacienta. Mnohdy nesejde na přesném naplnění indikačních kritérií hemoeliminační metody jako na dramatičnosti progrese klinických příznaků navzdory konzervativní léčbě. Existují některé noxy, u nichž požití potenciálně vysoce toxického množství nebo extrémní hladinu v krvi je dobré ovlivnit podporou eliminace ještě před vznikem toxických metabolitů nebo život ohrožující saturací cílových tkání. Ve volbě eliminační techniky musí hrát roli i zkušenost pracoviště s metodou. Intermitentní hemodialýza je vzhledem k vysoce účinným moderním membránám, široké dostupnosti, současné rychlé korekci acidobazické rovnováhy a hyperkalemie, nízkým nárokům na antikoagulaci jasně preferována a hemodynamická nestabilita pacienta není jednoznačnou kontraindikací této metody. Absence toxikokinetických předpokladů noxy k účinné eliminaci hemodialýzou v některých případech nevylučuje úspěšné zvýšení eliminace, zejména pokud se jedná o masivní předávkování. O úspěšném překonání těžké intoxikace dialyzovatelným lékem nezřídka rozhodne dávka hemoeliminační léčby, z tohoto důvodu je jasně preferována intermitentní hemodialýza, podmínkou využití alternativních CRRT metod jsou maximální průtoky krve a efluentu, nezbytností je dobře funkční cévní přístup. Intoxikace v suicidálním úmyslu jsou často zneužitím kombinace léčiv, nezřídka ve spojení s etanolem. V těchto nebo jinak nejasných situacích je dobré pomyslet na paracetamol, lék široce dostupný, zrádný svou latentní toxikodynamikou a potenciálně fatálním průběhem intoxikace, hladinu léku v krvi je možné rutinně ověřit. Přibývá nových moderních léků i hrozby jejich toxicity. Incidence otrav jednotlivými látkami není tak vysoká, aby mohly být kvalitně studovány a byly zdrojem jednoznačných klinických zkušeností. Podkladem léčebných doporučení vždy budou jednotlivé klinické případy a informace o nich jsou soustřeďovány v centrálních národních či nadnárodních toxikologických střediscích, s nimiž je vždy možná konzultace. V ČR tuto úlohu plní Toxikologické informační středisko (TIS) Kliniky pracovního lékařství VFN a 1. LF UK v Praze s nepřetržitým telefonním poradenstvím na linkách 224 919 293 a 224 915 402. O přesných indikačních kritériích účinně extrakorporálně eliminovatelných léčiv lze nalézt informace na internetových stránkách EXTRIP, www.extrip-workgroup.org.
Podpořeno Programem rozvoje vědních oborů Univerzity Karlovy (Progres – projekt Q39) a Národním programem udržitelnosti I (NPU I) č. LO1503 poskytovaným Ministerstvem školství, mládeže a tělovýchovy.
Doručeno do redakce 4. 7. 2018
Přijato po recenzi 28. 1. 2019
MUDr. Jaroslav Raděj
I. interní klinika LF UK a FN Plzeň
Zdroje
- Alapat PM, Zimmerman JL. Toxicology in the critical care unit. Chest 2008; 133(4): 1006–1013. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.07–1840>.
- Bayliss G. Dialysis in the poisoned patient. Hemodial Int 2010; 14(2): 158–167. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1542–4758.2009.00427.x>.
- de Pont AC. Extracorporeal treatment of intoxications. Curr Opin Crit Care 2007; 13(6): 668–673. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0b013e3282f0febd>.
- Klímová D. Hemodialýza v terapii intoxikací. In: Sulková S (ed) et al. Hemodialýza. Maxdorf: Praha 2000 : 590–608. ISBN 80–85912–22–8.
- Mirrakhimov AE, Barbaryan A, Gray A et al. The Role of Renal Replacement Therapy in the Management of Pharmacologic Poisonings. Int J Nephrol 2016; 2016 : 3047329. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/3047329>.
- Mokhlesi B, Leikin JB, Murray P et al. Adult toxicology in critical care: Part II: specific poisonings. Chest 2003; 123(3): 897–922. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.123.3.897>.
- Zimmerman JL. Poisonings and overdoses in the intensive care unit: general and specific management issues. Crit Care Med 2003; 31(12): 2794–2801. Dostupné z DOI: <http://dx.doi.org/10.1097/01.CCM.0000100123.50896.F0>.
- Medscape. WebMD: New York City, New York, USA. Dostupné z WWW: <http://www.medscape.com>.
- UpToDate Inc. Evidence-based clinical decision support resource. Wolters Kluwer Health: Waltham, Massachusetts, USA. Dostupné z WWW: <http://www.uptodate.com>.
- Kraut JA, Kurtz I. Toxic alcohol ingestions: clinical features, diagnosis, and management. Clin J Am Soc Nephrol 2008; 3(1): 208–225. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.03220807>.
- Kraut JA, Mullins M.E Toxic Alcohols. N Engl J Med 2018; 378(3): 270–280. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1615295>. Erratum in Toxic Alcohols. [N Engl J Med 2019].
- Garrard A, Sollee DR, Butterfield RC et al. Validation of a pre-existing formula to calculate the contribution of ethanol to the osmolar gap. Clin Toxicol (Phila) 2012; 50(7): 562–566. Dostupné z DOI: <http://dx.doi.org/10.3109/15563650.2012.704039>.
- Purssell RA, Pudek M, Brubacher J et al. Derivation and validation of a formula to calculate the contribution of ethanol to the osmolal gap. Ann Emerg Med 2001; 38(6): 653–659. Dostupné z DOI: <http://dx.doi.org/10.1067/mem.2001.119455>.
- Barceloux DG, Bond GR, Krenzelok EP et al. American Academy of Clinical Toxicology Ad Hoc Committee on the Treatment Guidelines for Methanol Poisoning. American Academy of Clinical Toxicology practice guidelines on the treatment of methanol poisoning. J Toxicol Clin Toxicol 2002; 40(4): 415–446.
- Barceloux DG, Krenzelok EP, Olson K et al. American Academy of Clinical Toxicology Practice Guidelines on the Treatment of Ethylene Glycol Poisoning. Ad Hoc Committee. J Toxicol Clin Toxicol 1999; 37(5): 537–560.
- Brent J Fomepizole for ethylene glycol and methanol poisoning. N Engl J Med 2009; 360(21): 2216–2223. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMct0806112>.
- Mégarbane B, Borron SW, Baud FJ. Current recommendations for treatment of severe toxic alcohol poisonings. Intensive Care Med 2005; 31(2): 189–195. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–004–2521–0>.
- Kraut JA. Approach to the Treatment of Methanol Intoxication. Am J Kidney Dis 2016; 68(1): 161–167. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2016.02.058>.
- Odborné doporučení pro intoxikaci – metanol (methanol, metylalkohol, dřevný líh, CH3OH). Toxikologické informační středisko, Klinika pracovního lékařství VFN a 1. LF UK Praha 2015. Dostupné z WWW: <http://www.tis-cz.cz/images/stories/PDFs/methanol2/METANOL-odborne-doporuceni-TIS-akt-8–2-2015.pdf>.
- Roberts DM, Yates C, Megarbane B et al. [EXTRIP Work Group]. Recommendations for the role of extracorporeal treatments in the management of acute methanol poisoning: a systematic review and consensus statement. Crit Care Med 2015; 43(2): 461–472. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000000708>.
- Hirsch DJ, Jindal KK, Wong P et al. A simple method to estimate the required dialysis time for cases of alcohol poisoning. Kidney Int 2001; 60(5): 2021–2024. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1523–1755.2001.00003.x>.
- Zakharov S, Pelclova D, Navratil T et al. Intermittent hemodialysis is superior to continuous veno-venous hemodialysis/hemodiafiltration to eliminate methanol and formate during treatment for methanol poisoning. Kidney Int 2014; 86(1): 199–207. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2014.60>.
- Zakharov S, Rulisek J, Nurieva O et al. Intermittent versus continuous renal replacement therapy in acute methanol poisoning: comparison of clinical effectiveness in mass poisoning outbreaks. Ann Intensive Care 2017; 7(1): 77. <http://dx.doi.org/10.1186/s13613–017–0300–7>.
- Odborné doporučení pro intoxikaci – izopropylalkohol (isopropanol, 2-propanol, C3H7OH). Toxikologické informační středisko, Klinika pracovního lékařství VFN a 1. LF UK Praha 2012.
- Souhrny údajů o přípravcích. Státní ústav pro kontrolu léčiv: Praha ČR. Dostupné z WWW: <http://www.sukl.cz>.
- Calello DP, Liu KD, Wiegand TJ et al. Extracorporeal Treatment for Metformin Poisoning: Systematic Review and Recommendations From the Extracorporeal Treatments in Poisoning Workgroup. Crit Care Med 2015; 43(8): 1716–1730. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000001002>.
- Regolisti G, Antoniotti R, Fani F et al. Treatment of Metformin Intoxication Complicated by Lactic Acidosis and Acute Kidney Injury: The Role of Prolonged Intermittent Hemodialysis. Am J Kidney Dis 2017; 70(2): 290–296. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2016.12.010>.
- Ghannoum M, Wiegand TJ, Liu KD et al. Extracorporeal treatment for theophylline poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol (Phila) 2015; 53(4): 215–229. Dostupné z DOI: <http://dx.doi.org/10.3109/15563650.2015.1014907>.
- Ghannoum M, Laliberté M, Nolin TD et al. Extracorporeal treatment for valproic acid poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol (Phila) 2015; 53(5): 454–465. Dostupné z DOI: <http://dx.doi.org/10.3109/15563650.2015>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2019 Číslo 6- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Význam hydratace při hojení ran
- Pleiotropní účinky statinů na kardiovaskulární systém
- Myasthenia gravis: kombinace chirurgie a farmakoterapie jako nejefektivnější modalita?
-
Všetky články tohto čísla
- Diagnostika akutních poruch acidobazické rovnováhy
- Vybrané akutní stavy v moderní onkologii
- Mimotělní eliminační metody v toxikologii: 1. část
- Mimotělní eliminační metody v toxikologii: 2. část
- Delirium v intenzivní péči
- Imitátory sepse
- Úloha paliativní medicíny u akutních stavů
- K životnímu jubileu prof. MUDr. Heleny Tlaskalové Hogenové, DrSc.
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diagnostika akutních poruch acidobazické rovnováhy
- Delirium v intenzivní péči
- Mimotělní eliminační metody v toxikologii: 1. část
- Vybrané akutní stavy v moderní onkologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



