-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
Background:
Diabetes mellitus is the most common cause of end stage kidney disease in the developed countries. Chronic kidney disease-mineral and bone disorder (CKD-MBD) develops with deteriorating of the renal functions. Diabetic patients on hemodialysis are characterized by low bone turnover, higher prevalence of severe and progressive vascular calcification with increased cardiovascular morbidity and mortality. The main factor which causes vascular calcification in patients with diabetic kidney disease (DKD) is poor glycemic control. The recent trial findings describe an inverse correlation between intact parathyroid hormone (iPTH) serum levels and glycemic control in a group of diabetic patients on hemodialysis.Aim:
The objective of the proposed project is to access the difference of the laboratory markers MBD in the group of patients with 3rd stage DKD depending on glycemic control. We focused on the relationship between the glycemic compensation of diabetes (HbA1c) and iPTH serum level.Patients and method:
Ninety one patients with 3rd stage DKD were investigated. There were 46 women (50.5 %) and 45 men (49.5 %), average age of patients was 71.2 ± 7.0 years, with creatinine level 128 ± 30 μmol/l and estimated glomerular filtration (eGF, MDRD) 0.82 ± 0.16 ml/s. There were 60 patients with better glycemic control of diabetes (HbA1c < 7 %) vs 29 patients with poorly controlled diabetes (HbA1c > 7 %). MBD markers were compared in both groups. Patients were further stratified into subgroups based on the serum level of iPTH (iPTH < 35 pg/ml vs iPTH > 35 pg/ml) and MBD markers compared. Statistical analysis was performed using and Mann-Whitney test.Results:
We have found the statistical significance in the serum phosphate and proteinuria levels in between groups with HbA1c < 7 % vs patients with HbA1c > 7 %. Diabetics with better glycemic control had significant reduction in serum phosphate level (1.14 ± 0.20 vs 1.23 ± 0.18 mmol/l, p = 0.038) and in 24 hrs proteinuria level (0.56 ± 1.35 vs 1.30 ± 1.61 g/day, p = 0.007). In the group of presumed low bone turnover (iPTH < 35 pg/ml) we have found the trend towards increased serum calcium level (2.49 ± 0.12 vs 2.43 ± 0.10 mmol/l, p = 0.063) and increased HbA1c value (7.5 ± 1.8 vs 6.4 ± 1.6 %, p = 0.023).Conclusion:
Our results suggest the closer relationship between glycemic control of diabetes and mineral-bone disorder in earlier stages of DKD.Key words:
diabetes mellitus type 2 (DM2T) – chronic kidney disease (CKD) – mineral and bone disorder (MBD)
Autori: Adriana Klimentová; Ivana Ságová; Dana Prídavková; Daniela Kantárová; Pavol Makovický; Jurina Sadloňová; Marián Mokáň
Pôsobisko autorov: I. interná klinika Jesseniovej LF UK a UN Martin, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2016; 62(6): 442-448
Kategória: Původní práce
Súhrn
Úvod:
Diabetes mellitus predstavuje najčastejšiu príčinu terminálneho štádia obličkových ochorení vo vyspelých krajinách. Chronické ochorenie obličiek a minerálovo kostné abnormality (chronic kidney disease – mineral and bone disorder – CKD-MBD) sa rozvíjajú s progresiou zhoršovania renálnych funkcií. Pre hemodialyzovaných diabetikov je typický nízky kostný obrat, vysoká prevalencia závažných a progredujúcich cievnych kalcifikácií s rastúcou kardiovaskulárnou morbiditou a mortalitou. Hlavným faktorom pôsobiacim pri tvorbe vaskulárnych kalcifikácií u pacientov s diabetickým ochorením obličiek (diabetic kidney disease – DKD) je zlá glykemická kontrola. Výsledky nedávnych štúdií popisujú vzájomný inverzný vzťah medzi sérovými hladinami intaktného parathormónu (iPTH) a metabolickou kompenzáciou v skupine dialyzovaných diabetikov.Cieľ:
Cieľom predkladaného projektu bolo zhodnotiť rozdiel medzi laboratórnymi markermi MBD v skupine pacientov s DKD 3. štádia v závislosti od glykemickej kompenzácie. Zamerali sme sa na vzťah medzi metabolickou kompenzáciou diabetu (glykozylovaný hemoglobín – HbA1c) a sérovou hladinou iPTH.Pacienti a metodika:
Celkovo sme vyšetrili 91 pacientov s DKD 3. štádia. Vyšetrovaný súbor tvorí 46 žien (50,5 %) a 45 mužov (49,5 %) s vekovým priemerom 71,2 ± 7,0 rokov, s priemernou hodnotou kreatinínu 128 ± 30 μmol/l a priemernou odhadovanou glomerulovou filtráciou (eGF, MDRD) 0,82 ± 0,16 ml/s. 60 pacientov malo lepšie glykemicky kompenzovaný diabetes (HbA1c < 7 %) vs 29 pacientov s nedostatočne kontrolovaným ochorením (HbA1c > 7 %). Porovnali sme markery MBD v oboch skupinách. Našich pacientov sme v ďalšom sledovaní rozdelili do 2 skupín podľa sérovej hladiny iPTH (iPTH < 35 pg/ml vs iPTH > 35 pg/ml) a porovnali sme získané výsledky laboratórnych MBD markerov. Jednotlivé premenné a ich vzájomné vzťahy boli spracované štatisticky Mannov-Whitneyov testom.Výsledky:
Zistili sme štatisticky významné rozdiely v sérovej hladine fosforu a proteinúrie medzi skupinami diabetikov s HbA1c < 7 %) vs diabetici s HbA1c > 7 %. Diabetici 2. typu, ktorí boli lepšie glykemicky kompenzovaní, mali štatisticky významne nižšiu hladinu sérového fosforu (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l, p = 0,038) a nižšiu 24hodinovú proteinúriu (0,56 ± 1,35 vs 1,30 ± 1,61 g/deň, p = 0,007). V skupine s predpokladaným nízkym kostným obratom (iPTH < 35 pg/ml) sme zachytili trend k vyššej hodnote sérového vápnika (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063) a vyššej hodnote HbA1c (7,5 ± 1,8 vs 6,4 ± 1,0 %, p = 0,023).Záver:
Naše výsledky poukazujú na užší vzťah medzi glykemickou kompenzáciou diabetu a minerálovo-kostným abnormalitami už v skorších štádiách CKD.Kľúčové slová:
diabetes mellitus 2. typu (DM2T) – chronické ochorenie obličiek (chronic kidney disease – CKD) – minerálovo kostné abnormality (mineral and bone disorder – MBD)Úvod
S poklesom renálnych funkcií v priebehu vývoja chronického ochorenia obličiek dochádza k systémovej poruche minerálového a kostného metabolizmu s funkčným a morfologickým dopadom na celý organizmus [1]. Porucha fosfokalciového metabolizmu bola v minulosti vnímaná hlavne vo vzťahu ku skeletu. Postupom času sa uhol pohľadu rozšíril a do popredia vystúpila súvislosť medzi minerálovo-kostným metabolizmom a kardiovaskulárnymi komplikáciami [2]. Zdôraznenie prepojenia minerálovo-kostných abnormalít a kardiovaskulárneho systému (KVS) vyústilo do vzniku nového termínu chronické ochorenie obličiek – minerálové a kostné abnormality (chronic kidney disease – mineral and bone disorder, CKD-MBD) [3]. V roku 2003 vznikla nadnárodná iniciatíva v nefrológii KDIGO (Kidney Disease – Improving Global Outcome), ktorá v roku 2009 vydáva odporúčané postupy pre diagnostiku a liečbu CKD-MBD. Spektrum porúch zahŕňa 3 komponenty: laboratórnu, kostnú a cievnu. Pre dennú klinickú prax je dôležitá dostupnosť laboratórnych markerov MBD: sérová koncentrácia vápnika (Ca), fosforu (P), PTH, alkalická fosfatáza (ALP) a vitamín D – 25(OH) D. Jedným zo základných ukazovateľov minerálového a kostného metabolizmu je hladina intaktného parathormónu (iPTH). Jeho hladinu, aj s ostatnými markermi, je odporúčané pravidelne monitorovať a vyhodnocovať u pacientov od CKD 3. štádia s prihliadnutím k dynamike zmien v čase, s následnou aktualizáciou individuálnej terapie [4–6].
Diabetická nefropatia (DN) predstavuje jednu z najzávažnejších neskorých orgánových mikroangiopatických komplikácií diabetu. V súčasnosti sa ako vhodnejší preferuje klinický termín diabetické ochorenie obličiek (Diabetic Kidney Disease – DKD) [7–9], reprezentujúci klinický syndróm, ktorý vzniká na podklade špecifických morfologických a funkčných zmien obličiek u pacientov s diabetes mellitus. Najčastejšou príčinou terminálneho štádia chronického renálneho ochorenia (end stage kidney disease – ESKD) vo vyspelých krajinách je práve diabetické ochorenie obličiek. Terapia diabetikov je sprevádzaná väčším počtom komplikácií a je zaťažená vyššou morbiditou aj mortalitou [10].
Minerálové a kostné abnormality majú u pacientov s DKD svoje špecifiká. Súčasné poznatky naznačujú, že základným mechanizmom minerálových a kostných zmien diabetikov je porucha funkcie osteoblastov s poklesom novotvorby kostí a kostného obratu. Pravdepodobná je aj spoluúčasť tzv. funkčnej hypoparatyreózy, pri dekompenzácii ochorenia aj negatívna kalciová bilancia a zvýšená kostná resorpcia, deficit vitamínu D, vplyv neskorých produktov glykácie v súčinnosti so špecifickými a nešpecifickými komplikáciami diabetu [11,12]. Najviac literárnych údajov k problematike DKD-MBD máme k dispozícií z preddialyzačných a dialyzačných súborov pacientov v ESKD. Pre túto skupinu pacientov je charakteristický nízky kostný obrat (väčšinou ide o adynamickú kostnú chorobu – AKCH), vyššie riziko vzniku fraktúr, vyšší výskyt extraoseálnych kalcifikácií s negatívnym dopadom na KVS s následným zvýšením celkovej morbidity a mortality [13–16].
V našej práci sme sa zamerali na pacientov s diabetickým ochorením obličiek 3. štádia s cieľom porovnať laboratórne markery MBD v závislosti od glykemickej kompenzácie (HbA1c).
Súbor a metodika
91 pacientom s diabetes mellitus 2. typu s DKD 3. štádia sme v zimnom období vyšetrili sérum a stanovili sme hladinu kreatinínu, celkové bielkoviny, sérový Ca, P, ALP, iPTH, vitamín D – 25(OH)D a HbA1c. Pacienti súčasne zozbierali 24hodinový moč, ktorý sme vyšetrili na prítomnosť proteinúrie (kvantitatívna proteinúria – KVUP). Glykozylovaný hemoglobín sme stanovili na základe chromatografickej separácie HbA1c, štandardizovane podľa NGSP/IFCC (National Glycohemoglobin Standardization Program/International Federation of Clinical Chemistry and Laboratory Medicine). Hodnoty HbA1c sú uvedené v % IFCC. Pri posudzovaní glykemickej kompenzácie diabetikov sa riadime podľa referenčného rozmedzia IFCC: kompenzácia diabetu výborná pre hodnotu HbA1c do 4,8 %, uspokojivá v rozmedzí HbA1c 4,8–5,3 %. Stanovenie koncentrácie iPTH bolo realizované chemiluminiscenčným imunoanalytickým stanovením využívajúcim paramagnetických častíc pre kvantitatívne určenie hladiny intaktného iPTH v ľudskom sére. Referenčné rozmedzie je 12–88 pg/ml (1,3–9,3 pmol/l). Do súboru neboli zaradení pacienti, ktorí v čase odberu užívali preparáty ovplyvňujúce sledované laboratórne parametre MBD (vitamín D, aktívny vitamín D a jeho analógy, kalcimimetiká a kalciové preparáty), odbery boli realizované v zimných mesiacoch s cieľom minimalizácie vplyvu slnečného žiarenia na hladinu vitamínu D. Do súboru neboli zaradení pacienti, ktorí mali anémiu stredne ťažkého a ťažkého stupňa. Veľkosť odhadovanej glomerulovej filtrácie (eGF) sme vypočítali podľa MDRD vzorca. Hladina eGF podľa jednotlivých štádií CKD (KDIGO 2012) je znázornená v tab. 1.
Tab. 1. Klasifikácia chronického ochorenia obličiek KDIGO 2012 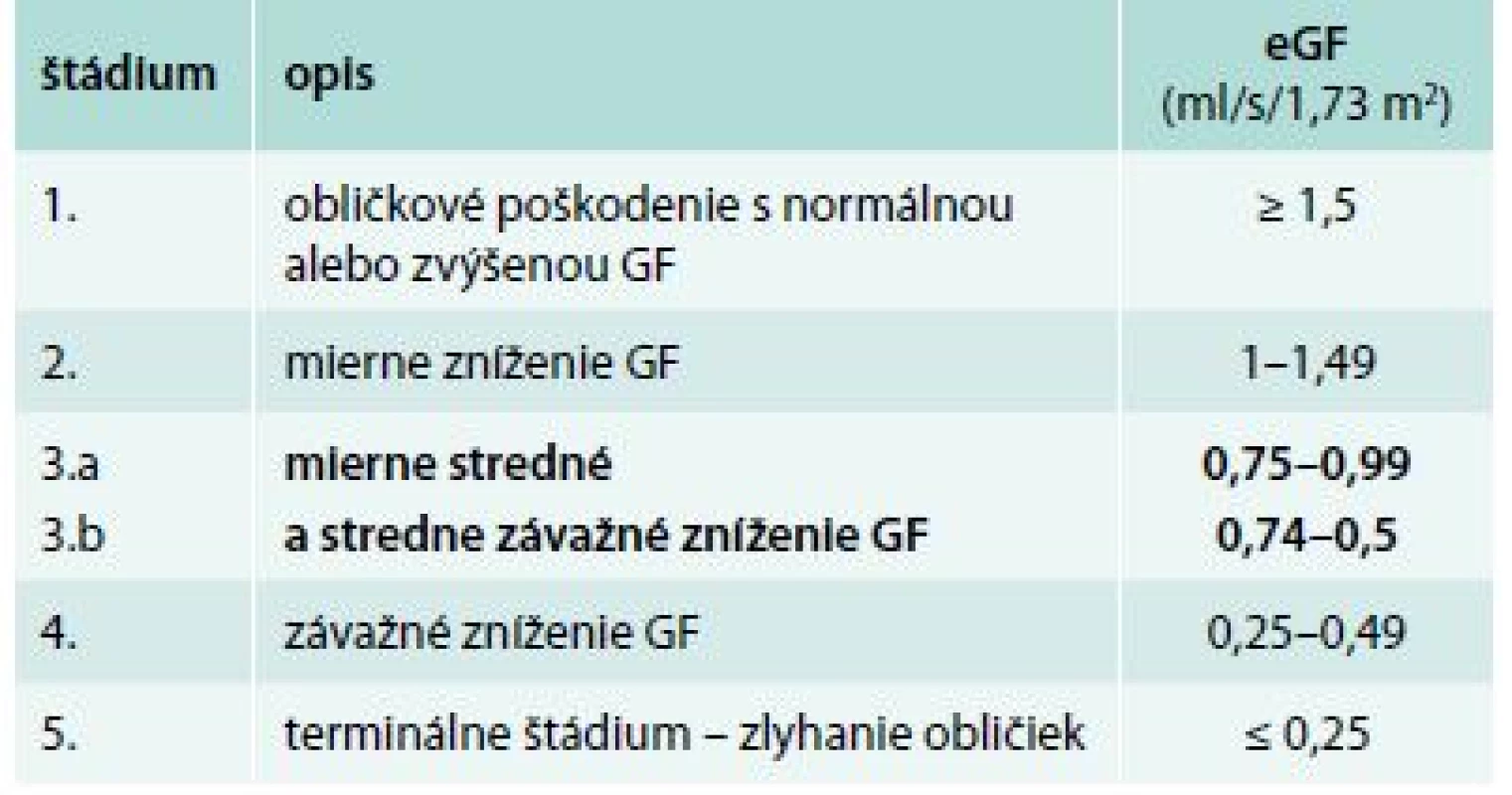
Vyšetrovaný súbor tvorí 46 žien (50,5 %) a 45 mužov (49,5 %) od 55 do 88 rokov, s vekovým priemerom 71,2 ± 7,0 rokov, s priemernou hodnotou kreatinínu 128 ± 30 μmol/l, tomu zodpovedajúcou priemernou odhadovanou glomerulovou filtráciou (MDRD) 0,82 ± 0,16 ml/s. Zloženie súboru je znázornené v tab. 2.
Tab. 2. Pacienti s diabetickým ochorením obličiek 3. štádia 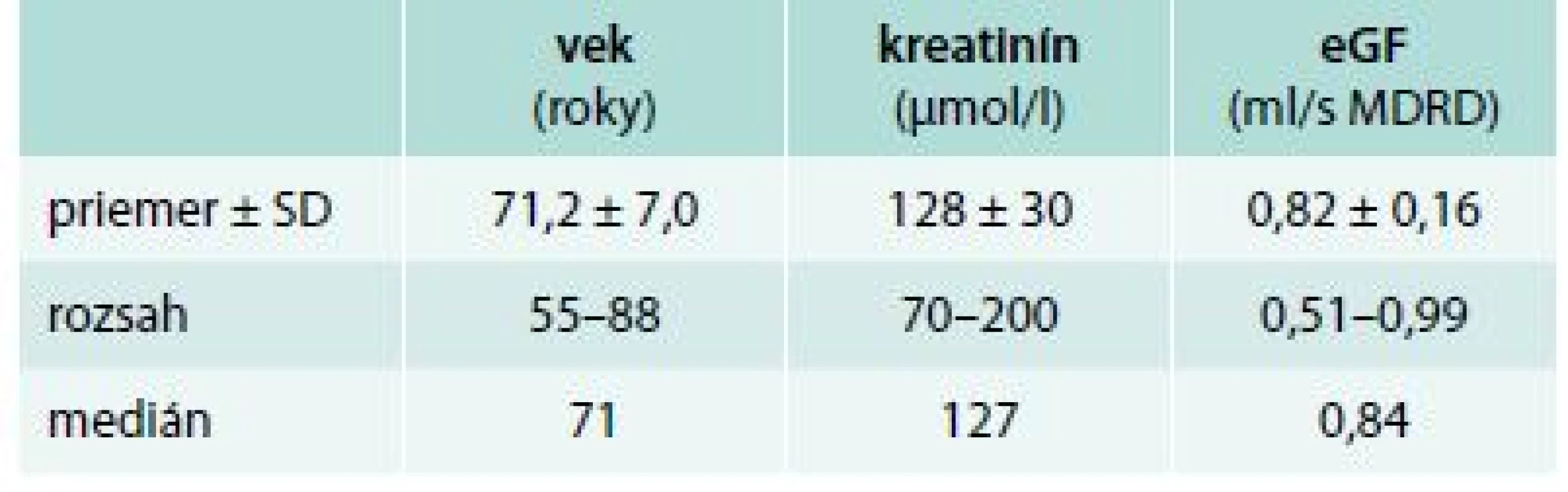
Získané výsledky sme rozdelili do skupín podľa hodnoty sledovaného parametra s koreláciou k postulovanému klinickému výstupu. Sledované kvantitatívne premenné sú uvedené pomocou priemeru, štandardnej odchýlky (SD), prípadne minimálnej a maximálnej hodnoty a mediánu. Rozdiely medzi skupinami pacientov boli testované neparametrickým Mannov-Whitneyov testom (vzhľadom na menší počet pacientov v niektorých podskupinách). Za štatistický významnú považujeme hladinu významnosti p < 0,05.
Výsledky
Glykemická kompenzácia
Analogicky k pacientom v ESKD sme sa zamerali na vzťah medzi glykemickou kompenzáciou a vyšetrovanými premennými. V tejto časti sme pacientov rozdelili na 2 skupiny: 60 diabetikov 2. typu s glykozylovaným hemoglobínom pod 7 % (HbA1c < 7 %) a 29 diabetikov s nedostatočne glykemicky kompenzovaným ochorením (HbA1c > 7 %). Po porovnaní výsledkov sme zistili 2 štatisticky významné rozdiely. Diabetici 2. typu, ktorí boli lepšie metabolicky kompenzovaní, mali nižšiu hladinu sérového fosforu (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l, p = 0,038) a nižšiu 24hodinovú proteinúriu (0,56 ± 1,35 vs 1,30 ± 1,61 g/deň, p = 0,007), ktorá však nebola vo fyziologickom pásme. V ostatných vyšetrovaných premenných neboli zachytené štatisticky významné zmeny. Hodnoty sledovaných parametrov a ich vzťah ku glykemickej kompenzácii zobrazuje tab. 3 a graf 1.
Tab. 3. Hodnoty sledovaných parametrov (priemer ± SD) v závislosti od metabolickej kompenzácie 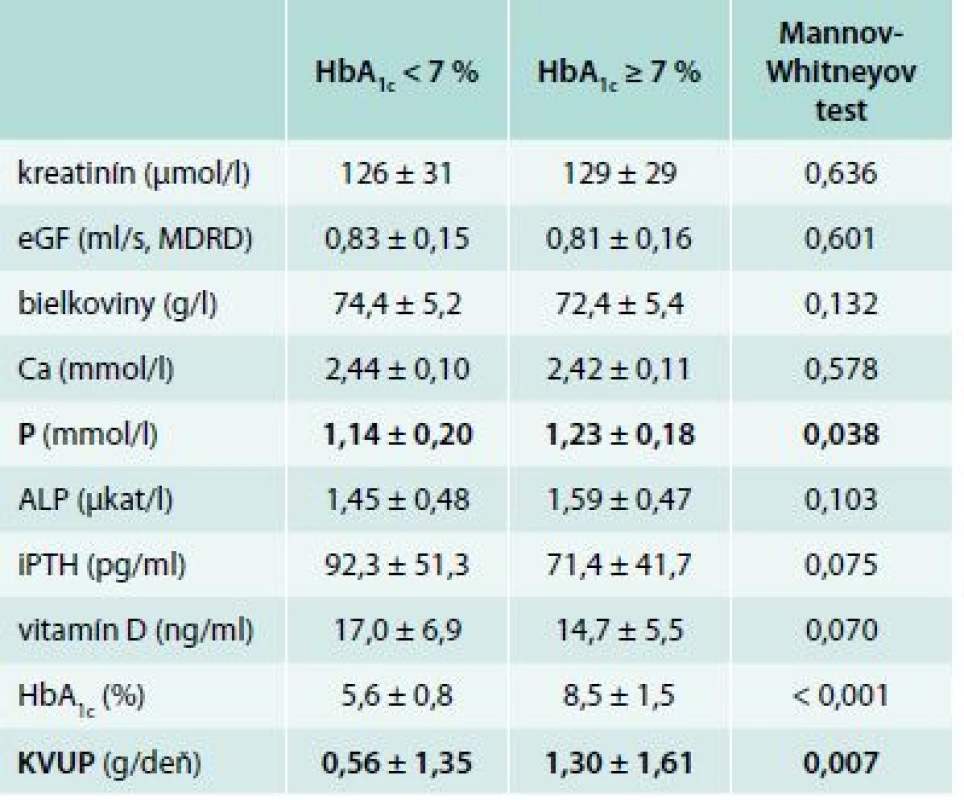
KVUP – kvantitatívna proteinúria P – fosfor Graf 1. Vzťah sérového fosforu a 24-hodinovej proteinúrie ku glykemickej kompenzácii 
Kostný obrat (nepriamo odhadovaný podľa hladiny sérového iPTH)
Nepriamym ukazovateľom kostného obratu u pacientov s CKD je iPTH. Súbor našich pacientov sme rozdelili na skupinu s iPTH < 35 pg/ml a na skupinu s iPTH > 35 pg/ml. Po porovnaní vyšetrovaných premenných sme zistili 2 štatisticky významné rozdiely. V skupine 13 pacientov s predpokladaným nízkym kostným obratom (iPTH < 35 pg/ml) sme zachytili trend k vyššej hodnote sérového vápnika (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063) a vyššej hodnote HbA1c (7,5 ± 1,8 vs 6,4 ± 1,6 %, p = 0,023) resp. horšej glykemickej kompenzácii v porovnaní so skupinou 76 pacientov s hodnotou iPTH > 35 pg/ml. Výsledky sú znázornené v tab. 4, tab. 5 a v grafe 2.
Tab. 4. Hodnoty vybraných parametrov (priemer ± SD) v závislosti od hodnoty iPTH 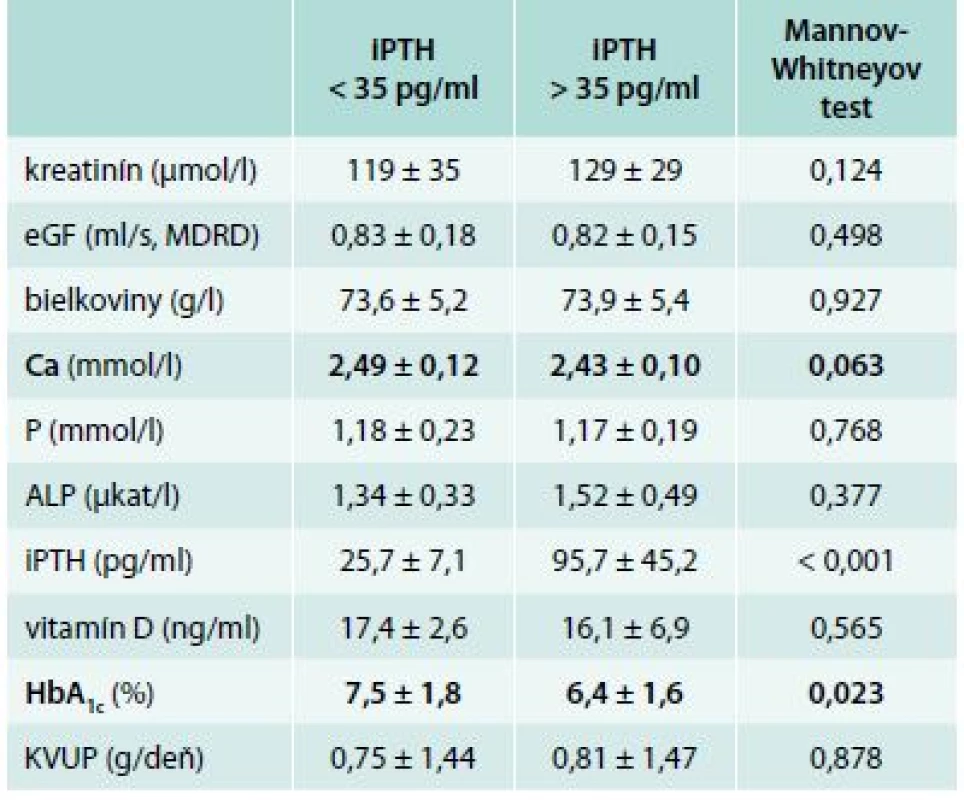
KVUP – kvantitatívna proteinúria P – fosfor Tab. 5. Rozdiely medzi odporúčaniami KDOQI a KDIGO pre CKD 3. štádia 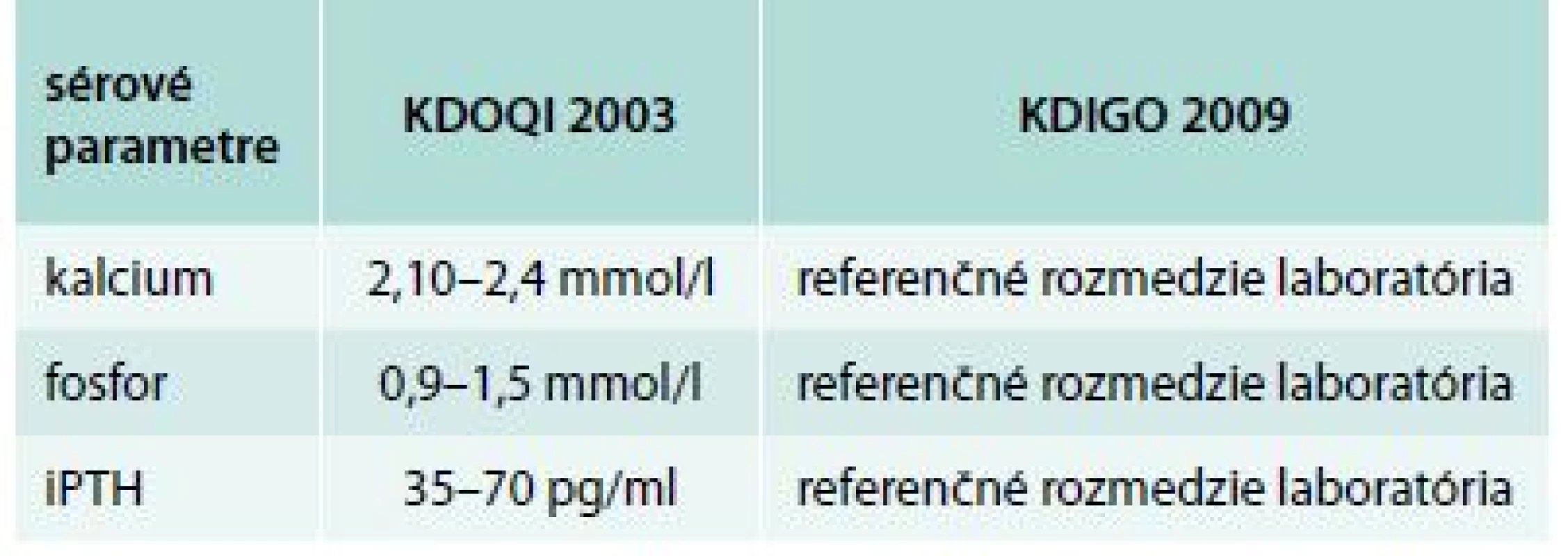
KDOQI – Kidney Disease Outcomes Quality Initiative KDIGO – Kidney Disease – Improving Global Outcome Graf 2. Vzťah metabolickej kompenzácie a sérového kalcia k iPTH 
Kardiovaskulárne riziko
V odbornej literatúre je spájaná vyššia hodnota sérového fosforu (P > 1,13 mmol/l) u pacientov s CKD s vyšším kardiovaskulárnym rizikom [17]. Pacientov v našom súbore sme rozdelili do 2 skupín podľa hladiny sérového fosforu (P > 1,13 vs P < 1,13 mmol/l). Po porovnaní a štatistickom zhodnotení jednotlivých vyšetrovaných premenných sme nezachytili žiadny signifikantne významný rozdiel medzi skupinami.
Diskusia
O minerálových a kostných abnormalitách v populácii pacientov s DKD 3. štádia existuje v literatúre len limitované množstvo štúdií, zväčša s malým počtom pacientov. Pre diabetika v terminálnom štádiu renálneho ochorenia je charakteristický suprimovaný kostný obrat zo zníženej sekrécie parathormónu a dysfunkcia osteoblastov [18,19]. Z in vitro štúdií na tkanivových kultúrach prištítných teliesok vyplýva, že vysoká koncentrácia glukózy a nízka hladina inzulínu znižujú sekréciu parathormónu, spoluúčasť sa pripisuje aj negatívnemu vplyvu neskorých produktov glykácie. Klinické dôsledky nízkeho kostného obratu v terminálnom štádiu zahŕňajú algický kostný syndróm, vyššie riziko fraktúr, najmä však vyšší výskyt extraoseálnych (najmä kardiovaskulárnych) kalcifikácií [20–24]. Keďže najviac informácií o problematike DKD-MBD máme k dispozícii zo súborov pacientov v ESKD, naším predmetom záujmu sa stali pacienti s DKD 3. štádia, kde podobné analýzy chýbajú.
Analogicky k prácam s dialyzovanými diabetikmi, v ktorých bol analyzovaný vzťah medzi glykemickou kompenzáciou a laboratórnymi markermi kostného metabolizmu, sme skúmali identický vzťah na pacientoch s DKD 3. štádia. Pacienti boli rozdelení do 2 skupín podľa hodnoty glykozylovaného hemoglobínu, pričom hladina HbA1c bola zvolená na základe literárnych zdrojov analogicky k dialyzovanej populácii diabetikov [10,24,25].
Cut off pre HbA1c pre náš súbor pacientov sme stanovili na vyššiu hodnotu, pretože ide o starších pacientov, s chronickým ochorením obličiek s diabetom s vyšším kardiovaskulárnym rizikom v porovnaní s bežnou populáciou pacientov bez diabetu a CKD. Keďže sme vychádzali z prác, ktoré analyzovali dialyzovaných diabetikov, hodnota optimálneho HbA1c pre túto skupinu pacientov bola nastavená na vyššie hodnoty (v literatúre popisovaná vyššia mortalita dialyzovaných diabetikov pri hodnotách HbA1c < 6 % a > 8 %). Preto sa odporúča v tejto špecifickej skupine pacientov stanoviť „optimálnu hodnotu“ HbA1c % v rozmedzí 6–8 % (v niektorých odporúčaniach 7–9 %) [26,27].
Naše výsledky potvrdili, že 60 diabetikov 2. typu s HbA1c < 7 % malo nižšiu hladinu sérového fosforu 1,14 ± 0,20 mmol/l (p = 0,038) a nižšiu 24hodinovú proteinúriu 0,56 ± 1,35 g/deň (p = 0,007) oproti pacientom s nedostatočnou glykemickou kompenzáciou. 29 pacientov s neadekvátnou glykemickou kompenzáciou diabetu (HbA1c ≥ 7 %) malo hladinu sérového fosforu signifikantne vyššiu 1,23 ± 0,18 mmol/l oproti kontrole. 24hodinový moč bol zozbieraný v 27 prípadoch zle kompenzovaných diabetikov s nálezom štatisticky významne vyššej proteinúrie 1,30 ± 1,61 d/deň oproti glykemicky kompenzovanejšej skupine. Prehľadné údaje sú znázornené v tab. 3 a v grafe 1.
Kestenbaum et al v roku 2005 publikovali retrospektívnu populačnú štúdiu, realizovanú na veľkom súbore 3 490 amerických veteránov, v ktorej poukázali na zvýšenú mortalitu pacientov s CKD v závislosti na sérovej koncentrácii fosforu. Autori v práci zistili, že zvýšenie sérovej koncentrácie fosforu o 0,323 mmol/l zvýši riziko úmrtia o 23 %, pričom zvýšenie mortality sa preukázalo aj vo fyziologickom rozmedzí koncentrácie sérového fosforu. Štatisticky významný vzostup mortality bol zaznamenaný pre hladinu fosforu > 1,13 mmol/l [17]. Nálezy hladín sérového fosforu u našich pacientov s DKD 3. štádia boli vyššie ako 1,13 mmol/l v oboch skupinách (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l). Na základe zistenej sérovej hladiny fosforu (analogicky k výsledkom z vyššie popísanej štúdie) predpokladáme, že sú pacienti s DKD 3. štádia v našom súbore nositeľmi vyššieho kardiovaskulárneho rizika, pričom skupina s horšou glykemickou kompenzáciou má riziko kardiovaskulárnej mortality vyššie. Vo vzťahu ku 24hodinovým hodnotám proteinúrie sa potvrdil trend, ktorý je popisovaný i v nedávno publikovanom prehľade a metaanalýze, v ktorých lepšia glykemická kontrola redukuje výskyt mikroalbuminúrie a makroalbuminúrie v populácii CKD pacientov s diabetom 2. typu [26,28].
Výsledný priemer hodnôt iPTH v skupine 60 lepšie glykemicky kompenzovaných pacientov bol 92,3 ± 51,3 vs 71,4 ± 41,7 pg/ml v skupine nedostatočne kompenzovaných diabetikov (29 pacientov). Nález nebol štatisticky významný s hodnotou p = 0,075. Nález odlišných hladín iPTH v závislosti od glykemickej kompenzácie potvrdzuje trend, ktorý koreluje s literárnymi údajmi týkajúcimi sa diabetikov v pokročilých a terminálnych štádiách renálneho ochorenia [25] a tiež so závermi rezultujúcimi z in vitro štúdií. Aj v našej práci potvrdzujeme fakt, že nedostatočná glykemická kontrola je asociovaná s redukovanou hladinou sérového iPTH a lepšia glykemická kompenzácia koreluje s vyššou sérovou hladinou iPTH. Z práce Murakamiho et al vyplýva nutnosť adekvátnej glykemickej kompenzácie, ako nástroja prevencie nízkeho kostného obratu, taktiež redukcie morbidity a mortality v teréne DKD-MBD [29,30].
Ďalšiu analýzu nášho súboru sme zrealizovali po rozdelení pacientov na skupinu s predpokladaným nízkym kostným obratom s iPTH < 35 pg/ml vs skupina s iPTH > 35 pg/ml.
Cut off pre iPTH bol stanovený podľa KDOQI odporúčaní (Kidney Disease Outcomes Quality Initiative), z ktorých vychádza aj stále platné Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky na liečbu porúch minerálového a kostného metabolizmu u pacientov s chronickým ochorením obličiek z 18. 6. 2009. V tomto odporúčaní je pre každé štádium CKD stanovené rozmedzie sérového fosforu, vápnika aj iPTH (pre iPTH u pacientov v CKD 3. štádia je dané ako cieľové rozmedzie medzi 35–70 pg/ml, analogicky k tomuto údaju sme hodnotu iPTH pod 35 pg/ml považovali za nízku) [32].
Po porovnaní vyšetrovaných markerov sme zistili 2 významnejšie rozdiely. V skupine s iPTH < 35 pg/ml sme zachytili vyššiu sérovú hodnotu vápnika a vyššiu hodnotu HbA1c. U pacientov s CKD môžeme nájsť znížené, fyziologické, tak i zvýšené koncentrácie kalcia v závislosti na poškodení funkcie obličiek a na MBD [32]. Hodnoty sérového vápnika boli v oboch našich súboroch vo fyziologickom pásme, ale v skupine s iPTH < 35 pg/ml bola sérová hladina vyššia, i keď len na hranici štatistickej významnosti (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063). Výsledky naznačujú, že nižší kostný obrat koreluje s vyššou hladinou sérového kalcia, aj keď v rámci fyziologického rozmedzia.
Normálne nálezy koncentrácie sérového kalcia aj fosforu až do poklesu glomerulovej filtrácie pod 0,67 ml/s potvrdila štúdia Levina et al na 1 814 neselektovaných, neliečených pacientoch s CKD s vekovým priemerom totožným s našim súborom (71,1 roka) a 48% zastúpením diabetikov [33].
V skupine pacientov s predpokladaným nízkym kostným obratom s iPTH < 35 pg/ml sme tiež zachytili štatisticky vyššiu hodnotu HbA1c (7,5 ± 1,8 vs 6,4 ± 1,6 %, p = 0,023), čo sme nepotvrdili pri nastavení hranice pre HbA1c na hodnotu 7 %. Vzťah medzi nedostatočnou glykemickou kontrolou a zníženou hladinou parathormónu bol opakovane potvrdený v štúdiách na pacientoch s ESKD (citované v diskusii vyššie). Limitom pre nami zistené nálezy zostáva malý počet pacientov s iPTH < 35 pg/ml, ktorý pozostáva z 13 probandov.
V našom súbore je celkovo zahrnutý malý počet pacientov, čo limituje interpretáciu a validitu výsledkov. Súčasne ide o široký záber v CKD 3. štádia. Podľa poslednej úpravy aktuálnej KDIGO klasifikácie je 3. štádium CKD rozdelené na 2 podskupiny podľa hodnôt glomerulovej filtrácie (tab. 1). V novej klasifikácii sa tiež zohľadňuje prítomnosť a závažnosť proteinúrie ako rizikového faktora progresie renálneho ochorenia [34]. Pacienti v nami analyzovanom súbore zodpovedali úrovňou glomerulovej filtrácie skôr k 3a štádiu CKD podľa klasifikácie KDIGO. Odlišnosť CKD 3a od 3b s ohľadom na minerálové abnormality dokladuje aj Levinova štúdia, v ktorej boli zaznamenané normálne nálezy koncentrácie sérového kalcia aj fosforu až do poklesu glomerulovej filtrácie pod 0,67 ml/s. K limitom nášho súboru patrí aj vyšší vek pacientov (71,2 ± 7,0), keďže vyšší vek je posudzovaný ako samostatný rizikový faktor vo vzťahu k vývoju minerálovo kostných abnormalít s nízkou hladinou iPTH [35].
Záver
Záverom by sme zhrnuli výsledky našej analýzy. Pacienti s DKD 3. štádia, ktorí boli lepšie glykemicky kompenzovaní (HbA1c < 7 %), mali nižšiu hladinu sérového fosforu (1,14 ± 0,20 vs 1,23 ± 0,18 mmol/l, p = 0,038) a nižšiu 24hodinovú proteinúriu (0,56 ± 1,35 vs 1,30 ± 1,61 g/deň, p = 0,007). V skupine pacientov s predpokladaným nízkym kostným obratom (iPTH < 35 pg/ml) sme zachytili trend k vyššej hodnote sérového vápnika (2,49 ± 0,12 vs 2,43 ± 0,10 mmol/l, p = 0,063) a sklon k horšej glykemickej kompenzácii (HbA1c 7,5 ± 1,8 vs 6,4 ± 1,6 %, p = 0,023). Z nálezov vyplýva potreba zlepšenia glykemickej kompenzácie pacientov s DKD 3. štádia ako nástroj prevencie vývoja MBD s nízkym kostným obratom a tiež ako nástroj prevencie nárastu kardiovaskulárnej morbidity a mortality. V našej práci sme sa zamerali na 3. štádium DKD, pretože práve v týchto štádiách majú preventívne opatrenia – glykemická kompenzácia (ako aj korekcia hypertenzie) najväčší význam vzhľadom k zastaveniu ev. spomaleniu progresie samotného renálneho ochorenia. U pacientov s DKD 3. štádia by mali byť odporúčané markery kostného metabolizmu (KDIGO) pravidelne vyšetrované a vyhodnocované s dôrazom vývoja zmien v čase, na čo by mala nadväzovať individuálna liečba so sledovaním spätnej laboratórnej a klinickej odozvy [4–8,31,34].
MUDr. Adriana Klimentová
adamorava@hotmail.com
I. interná klinika Jesseniovej LF UK a UN Martin, Slovenská republika
www.unm.sk
Doručeno do redakce 18. 1. 2016
Přijato po recenzi 25. 4. 2016
Zdroje
1. Dusilová Sulková S, Opatrná S, Ryšavá R et al. KDIGO doporučení pro diagnostiku a léčbu CKD-MBD: komentovaný návod pro klinickou praxi. Aktuality v nefrologii 2010; 16(4): 113–126.
2. Dusilová Sulková S. Renální osteopatie. Maxdorf: Praha 2007 : 20 -21. ISBN 978–80–7345–119–6.
3. Moe SM, Druek T, Cunningham J et al. Definition, evaluation and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes. Kidney Int 2006; 69(11): 1945–1953.
4. Dusilová Sulková S. Co prinášejí nová KDIGO doporučení zamĕřená na CKD-MBD? 1. část. Aktuality v nefrologii 2009; 15(4): 159–165.
5. KDIGO Clinical Practice Guideline for the diagnosis, evaluation, prevention and treatment of chronic kidney disease – mineral bone disorder (CKD-MBD). Kidney Int Suppl 2009; (113): S1-S130.
6. Sotorník I, Kutílek Š et al. Kostní minerály a skelet pri chronickém onemocnení ledvin. Galén: Praha 2011 : 103–106. ISBN 978–80–7262–769–1.
7. Bouček P, Kvapil M, Monhart V et al. Doporučené postupy při diabetickém onemocnění ledvin. Aktuality v nefrologii 2012;18,(1):18–26.
8. Okša A, Spústová V. Nefropatia pri diabetes mellitus – skríning, prevencia a liečba v spolupráci diabetológa a nefrológa. Diabetes a Obezita 2007; 7(Suppl): 6–13.
9. Alicic RZ, Tuttle KR. Management of the diabetic patient with advanced chronic kidney disease. Semin Dial 2010; 23(2): 140–147.
10. Tuttle KR, Bakris GL, Bilous RW et al. Diabetic Kidney Disease: A Report From an ADA Consensus Conference. Diabetes Care 2014; 37(10): 2864–2883.
11. Sotorník I, Kutílek Š et al. Kostní minerály a skelet pri chronickém onemocnení ledvin. Galén: Praha 2011 : 337–349. ISBN 978–80–7262–769–1.
12. Sun YM, Su Y, Li J et al. Recent advances in understanding the biochemical and molecular mechanism of diabetic nephropaty. Biochem Biophys Res Commun 2013; 433(4): 359–361.
13. Inaba M. Chronic kidney disease (CKD) and bone. Impact of diabetes mellitus on the development of CKD-MBD. Clin Calcium 2009; 19(4): 502–507.
14. Inaba M, Okuno S, Nagasue K et al. Impaired secretion of parathyroid hormone is coherent to diabetic hemodialyzed patients. Am J Kidney Dis 2001; 38(4 Suppl. 1): S139-S142.
15. Nasri H, Kheiri S. Effect of diabetes mellitus, age, and duration of dialysis on parathormone in chronic hemodialysis patients. Saudi J Kidney Dis Transpl 2008; 19(4): 608–613.
16. Dusilová Sulková S. Renální osteopatie. Maxdorf: Praha 2007. ISBN 978–80–7345–119–6.
17. Kestenbaum B, Sampson JN, Rudser KD et al. Serum Phosphate Levels and Mortality Risk among People with Chronic Kidney Disease. J Am Soc Nephrol 2005; 16(2): 520–528.
18. Sotorník I, Kutílek Š et al. Kostní minerály a skelet pri chronickém onemocnení ledvin. Galén: Praha 2011 : 344–345. ISBN 978–80–7262–769–1.
19. Spasovski GB, Bervoets AR, Behets GJS et al. Spectrum of renal bone disease in end-stage renal failure patients not yet on dialysis. Nephrol Dial Transplant 2003; 18(6): 1159–1166.
20. Dusilová Sulková S. Kostní choroba u chronického selhání ledvin a její moderní terapie. Vnitř Lék 2011; 57(7–8): 620–625.
21. Inaba M Chronic kidney disease (CKD) and bone. Impact of diabetes of mellitus on the development of CKD-MBD. Clin Calcium 2009; 19(4): 502–507.
22. Žamboch K, Zahálková J, Kosatíkova Z Minerálová a kostní nemoc při chronickém onemocnění ledvin. Interní Med 2010; 12(7–8): 357–360.
23. London GM, Marchais SJ, Guérin AP et al. Association of bone activity, calcium load, aortic stiffness, and calcifications in ESRD. J Am Soc Nephrol 2008; 19(9): 1827–1835.
24. Blahoš J, Sotorník I. Změny kalcium-fosfátového metabolizmu při chronických nefropatiách. Vnitř Lék 2012; 58(7–8): 12–18.
25. Park J, Lertdumrongluk P, Molnar MZ et al. Glycemic control in diabetic dialysis patients and the burnt-out diabetes phenomenon. Curr Diab Rep 2012; 12(4): 432–439.
26. Dan S, Aditya P, Samanta M et al. Effect of glycemic control on intact parathyroid hormone level in end stage renal disease patients on maintenance hemodialysis. Diabetes Res Clin Pract 2014; 105(3): 352–355.
27. Error in Text in: Role of Intensive Glucose Control in Development of Renal End Points in Type 2 Diabetes Mellitus: Systematic Review and Meta-analysis. Arch Intern Med 2012; 172(14): 1095.
28. Rhee MC, Leung AM, Kovesdy PC et al. Updates on the Management of Diabetes in Dialysis Patients. Semin Dial 2014; 27(2): 135–145.
29. Perkovic V, Heerspink HL, Chalmers J et al. Intensive glucose control improves kidney outcomes in patients with type 2 diabetes. Kidney Int 2013; 83(3): 517–523.
30. Murakami R, Murakami S, Tsushima R et al. Glycaemic control and serum intact parathyroid hormone levels in diabetic patients on haemodialysis therapy. Nephrol Dial Transplant 2008; 23(1): 315–320.
31. Gnudi L Serum Intact Parathyroid Hormone in Diabetic Patients on Haemodialysis: What is the Treatment Goal? Nephrol Dial Transplant 2008; 23(1): 24–26.
32. Odborné usmernenie Ministerstva zdravotníctva Slovenskej republiky na liečbu porúch minerálového a kostného metabolizmu u pacientov s chronickým ochorením obličiek. Aktuality v nefrologii 2009; 15(3): 121–126.
33. Dusilová Sulková S. Renální osteopatie. Maxdorf: Praha 2007. ISBN 978–80–7345–119–6.
34. Levin A, Bakris GL, Molitch M et al. Prevalence of abnormal serum vitamin D, PTH, calcium and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease. Kidney Int 2007; 71(1): 31–38.
35. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease‘. Kidney Int Suppl 2013; 3(1): 136–150.
36. Bover J, Urena P, Brandenburg V et al. Adynamic bone disease: from bone to vessels in chronic kidney disease. Semin Nephrol 2014; 34(6): 626–640.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetem 2. typu – editorialČlánek Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péčeČlánek Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typuČlánek Kardiomyopatie v MR obrazeČlánek Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetem 2. typu – editorial
- Kardiomyopatie v MR obraze – editorial
- Neinfekční a nenádorové lymfadenopatie – editorial
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
- Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
- Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typu
- Akútne príčiny náhlych úmrtí u pacientov so závažnou hypoglykémiou
- Kardiomyopatie v MR obraze
- Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
- mikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
-
Odešel prof. MUDr. Bořivoj Semrád, CSc.
*7. 11. 1938 †19. 6. 2016 -
Bolest v diabetologické ambulanci
Zpráva z IX. mezioborového setkání diabetologických týmů, tentokrát s algeziology, psychiatry, psychology a psychoterapeuty - Symposium of the International Atherosclerosis Society – Anitschkow Days
- Debora Karetová, Jan Bultas. Farmakoterapie tromboembolických stavů
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Neinfekční a nenádorové lymfadenopatie – editorial
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Kardiomyopatie v MR obraze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



