-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam endoskopické cytoskopie u vyšetření trávicího traktu
Endoscopic cytoscopy
A number of new endoscopic methods have been developed recently, which aim to allow the most accurate possible viewing of the mucosa of the digestive tract. These procedures include endoscopic cytoscopy, which together with confocal endoscopy is a technique of so-called endoscopic microscopy. By means of enodcytoscopy it is possible to view „in vivo“ the morphological details of the surface of the mucosa of the digestive tract. The mucosa must, however, be thoroughly cleaned and stained with methylene blue. The paper presents our own initial experience of this method, which may lead to faster and more accurate diagnosis of pre-tumorous or tumourous inflammation processes in the mucosa of the digestive tract.
Key words:
endoscopic microscopy – endocytoscopy – morphological changes of mucosa
Autoři: Z. Beneš 1; O. Daum 2; G. Puškárová 1; P. Kohout 1; Z. Antoš 1; M. Černík 1
Působiště autorů: II. interní klinika Fakultní Thomayerovy nemocnice Praha, přednosta MUDr. Zdeněk Beneš, CSc. 1; Oddělení patologie FN Plzeň, přednosta prof. MUDr. Michal Michal, DrSc. 2
Vyšlo v časopise: Vnitř Lék 2007; 53(11): 1215-1219
Kategorie: Přehledné referáty
Souhrn
V poslední době jsou vyvíjeny nové endoskopické metody, které se snaží zobrazit sliznici trávicího traktu co nejpřesněji. Mezi tyto postupy patří také endoskopická cytoskopie, které se vedle konfokální endoskopie řadí mezi tzv. endoskopickou mikroskopii. Pomocí endocytoskopie lze zobrazit „in vivo“ morfologické detaily povrchu sliznice zažívacího ústrojí. Sliznice se však musí dobře očistit a obarvit nejlépe methylenovou modří. Jsou předloženy první vlastní zkušenosti s touto metodou, která může vést k velkému zpřesnění a urychlení diagnostiky zánětlivých přednádorových či nádorových procesů sliznice trávicí trubice.
Klíčová slova:
endoskopická mikroskopie - endocytoskopie - morfologické změny slizniceÚvod
Při endoskopickém vyšetření gastrointestinálního traktu (GIT) bylo vždy snahou zobrazit sliznici vyšetřované oblasti co nejpřesněji. V poslední době se objevily různé techniky, které nám umožňují vyšetřit danou oblast velmi detailně. Jsou to např. chromoendoskopie, zvětšovací endoskopie, optická koherentní tomografická spektroskopie (EOCT), případně kombinace těchto vyšetření [1,4,9]. Nově jsou vyvíjeny postupy jak zobrazit sliznici až do morfologických struktur, při nichž můžeme provádět prakticky mikroskopické vyšetření „in vivo“ přímo při endoskopickém zásahu. Mluvíme pak o tzv. endoskopické mikroskopii či kontaktní endoskopii. Sem řadíme tzv. konfokální mikroskopii a endoskopickou cytoskopii [2,5,8].
Endoskopická cytoskopie
Novou endoskopickou metodou, která se nyní rozvíjí a umožňuje vyšetření povrchové vrstvy sliznice GIT, je tzv. endoskopická cytoskopie - endoscopic cytoscopy (ECS), někdy zkráceně nazývaná endocytoskopie. Toto vyšetření je známé z oblasti otolaryngologie, kdy pomocí rigidního „kontaktního“ endoskopu lze zobrazit vyšetřovanou oblast až do strukturálních mikroskopických změn.
Endocytoskopie je metodou, která je založena na principu světelné silně kontaktní mikroskopie. Pomocí speciální sondy, kterou lze protáhnout kanálem endoskopu, lze zvětšit vyšetřovanou plochu sliznice v rozmezí 450-1 200krát. Nutnou podmínkou však je, aby kanál endoskopu byl v průměru alespoň 3,7 mm, protože průměr vlastní sondy měří 3,4 mm. Délka sondy je 250 cm, což nám umožňuje provést vyšetření pomocí gastroskopu a kolonoskopu. Je však nutné neprovádět s endoskopy větší ohyby, aby cytoskopická sonda šla vysunout z dolní části přístroje. Endocytoskopickou detekci můžeme tedy provádět při rutinním endoskopickém vyšetření a při podezření na nějakou povrchovou lézi. Důležitý předpoklad kvalitního vyšetření je, aby kontakt vyšetřovací endocytoskopické sondy se sliznicí byl co nejtěsnější. Proto je velmi výhodné používat na konci endoskopu kroužek, který na něj pevně umístíme, podobně jako se to provádí u techniky endoskopické mukosektomie. Konec kroužku, který se dotýká sliznice, může být rovný nebo šikmý. Šikmý konec kroužku je výhodný hlavně při vyšetření jícnu. Nasátím sliznice do kroužku pak můžeme zajistit velmi těsný dotyk endocytoskopické sondy se sliznicí. K technice endocytoskopie a zobrazení morfologických struktur vyšetřované oblasti je nutné, aby byla sliznice jícnu, žaludku a tlustého střeva zcela čistá, prostá obsahu. K tomu je velmi nutné, aby se před vyšetřením odstranil hlen. Hlen nám totiž brání v kvalitní vizualizaci buněčných struktur a správnému obarvení buněk. K odstranění hlenu se používají různé proteolytické působky, které se smíchají s vodou, a ty ve formě roztoku může nemocný před endoskopií vypít nebo se aplikují, nejlépe sprejovým katétrem, přímo na sliznici [7]. Někdy se k odstranění lyzovaného hlenu může použít kyselina octová. Tato procedura je nejdůležitější při endoskopickém vyšetřování žaludku tenkého a tlustého střeva.
K tomu, aby se dobře zobrazily detaily buněk superficiální sliznice včetně jejich jader, jadérek, cytoplazmy a buněčných membrán, je nutné sliznici během vyšetření obarvit. Nejčastěji se k tomuto účelu používá roztok 1% methylenové modři. K tomuto barvení se dá také užít sprejový katétr k rovnoměrnějšímu rozložení barvy na sliznici.
V takto připraveném slizničním povrchu můžeme pozorovat jak změny architektury, tak cytologické atypie. V jícnu je normální nález charakterizován pravidelným uspořádáním povrchových dlaždicových buněk s objemnou cytoplazmou a malým nenápadným jádrem. V dlaždicobuněčné neoplazii jícnu dochází k narušení tohoto pravidelného uspořádání a zvýšení nukleocytoplazmatického poměru s jadernými iregularitami. V případě low-grade neoplastických změn však může být obtížné tyto změny odlišit od reparativních změn v terénu erozivní ezofagitidy různé etiologie. Endocytoskopicky lze sledovat i přítomnost žlázových buněk ve sliznici jícnu při gastroezofageálním refluxu. V žaludku jsou opět dysplastické změny i adenokarcinom charakterizovány iregulárním uspořádáním žlázových buněk, zvýšením nukleocytoplazmatického poměru a jadernými atypiemi. V rámci idiopatického střevního zánětu by mohla endocytoskopie hrát roli spíše při detekci nádorových a prekancerózních změn než při samotné diagnóze nespecifických střevních zánětů, ačkoli i touto metodou by mohl nález granulomů přispět k diagnóze Crohnovy choroby. Rozpoznání invazivního karcinomu v jícnu, žaludku i střevech oproti standardnímu cytologickému vyšetření může též napomáhat sledování patologické vaskularizace léze.
Vlastní zkušenosti
I my jsme si udělali své první zkušenosti s metodou ECS. Při odstraňování hlenu ze žaludku a střeva jsme používali proteolytický roztok a bezbarvý vinný ocet, který je běžně dostupný v obchodním řetězci. Aby se dobře obarvily buněčné struktury, používali jsme 1% methylenovou modř, kterou jsme aplikovali na sliznici pomocí sprejového katétru. Po obarvení sliznice jícnu a žaludku jsme cystoskopickou sondou vyšetřovali až za 2-3 min. Tato doba se nám zdála dostatečná k obarvení buněk. Ve střevě je vhodná k obarvení buněčných struktur delší doba, a to 10-15 min. Postupně se nám podařilo endocytoskopické zobrazení jícnu, žaludku a tlustého střeva. Vyšetřovali jsme prototypy přístrojů Olympus (Olympus Medical System Co., Tokyo, Japan) s označením XEC-300-2 a XEC-120.
Pozorovali jsme normální epitel jícnu a také terminální jícnové kapiláry a některé buněčné abnormity. In vivo jsme pozorovali normální sliznici žaludku a tlustého střeva. Vždy jsme používali na konci gastroskopu či kolonoskopu kroužek z umělé hmoty (cap). Pak jsme nasáli sliznici do kroužku a endocytoskopickou sondou jsme vyšetřovali povrchovou lézi na sliznici. Tímto způsobem jsme docílili velmi těsný kontakt sondy se sliznicí, což je nezbytně nutná podmínka k úspěšnému vyšetření.
I endocytoskopie má však svá úskalí. Před vyšetřením je nezbytné odstranit všechny zbytky na sliznici. Nejdůležitějším faktorem k dobrému vyšetření je odstranění hlenu z povrchu. Další obtíže nám mohou způsobit kardiální a respirační pohyby či škytavka. Je také nutné zacházet s endocytoskopickou sondou velmi jemně a trpělivě, protože rychlé a zbrklé pohyby nám nedovolují pečlivé sledování buněčných struktur a mohlo by dojít k přehlédnutí důležitých zánětlivých či nádorových změn v místě vyšetření.
Obr. 1. Endocytoskopická sonda v endoskopu. 
Obr. 2. Endocytoskopické vyšetření sliznice jícnu. 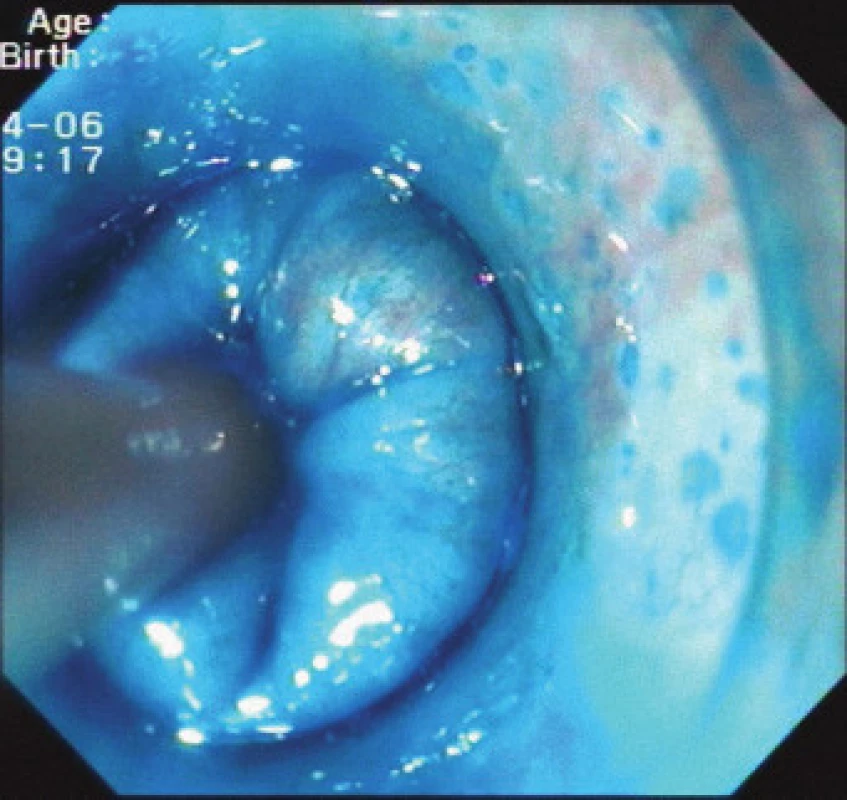
Obr. 3. Endocytoskopie jícnu bez odstranění hlenu. 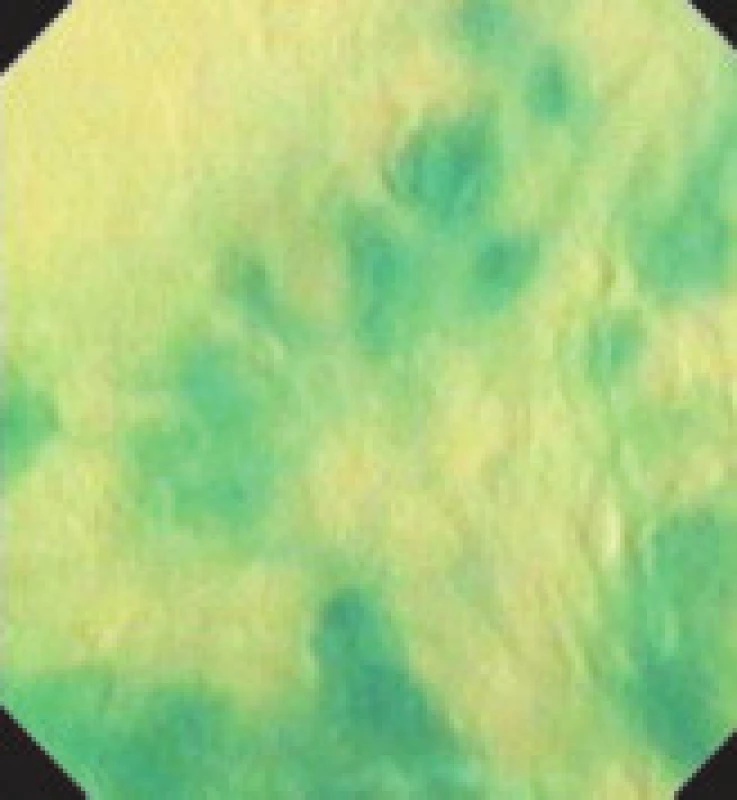
Obr. 4. Endocytoskopický obraz buněk sliznice jícnu s odstraněním hlenu 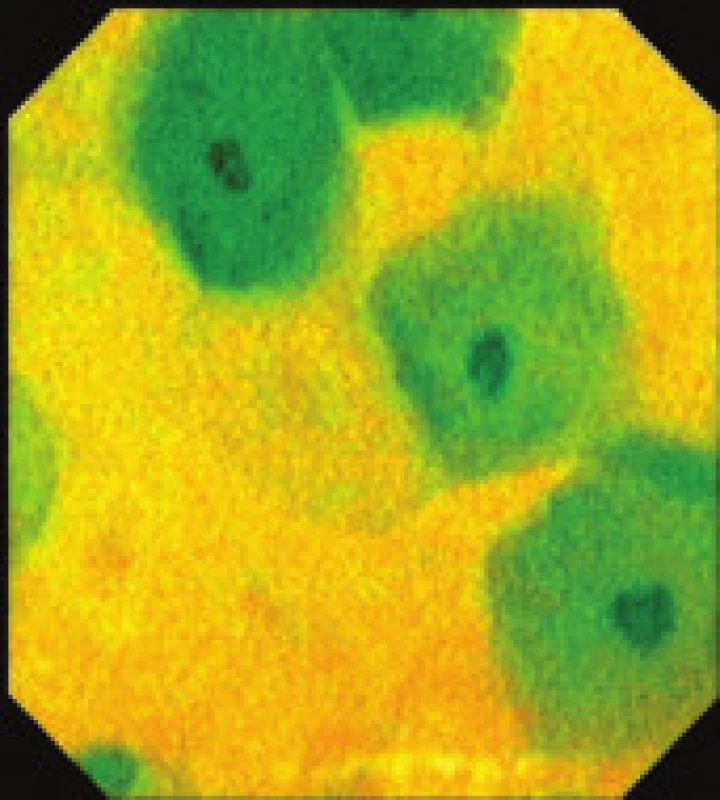
Obr. 5. Endocytoskopický obraz Barretova jícnu. 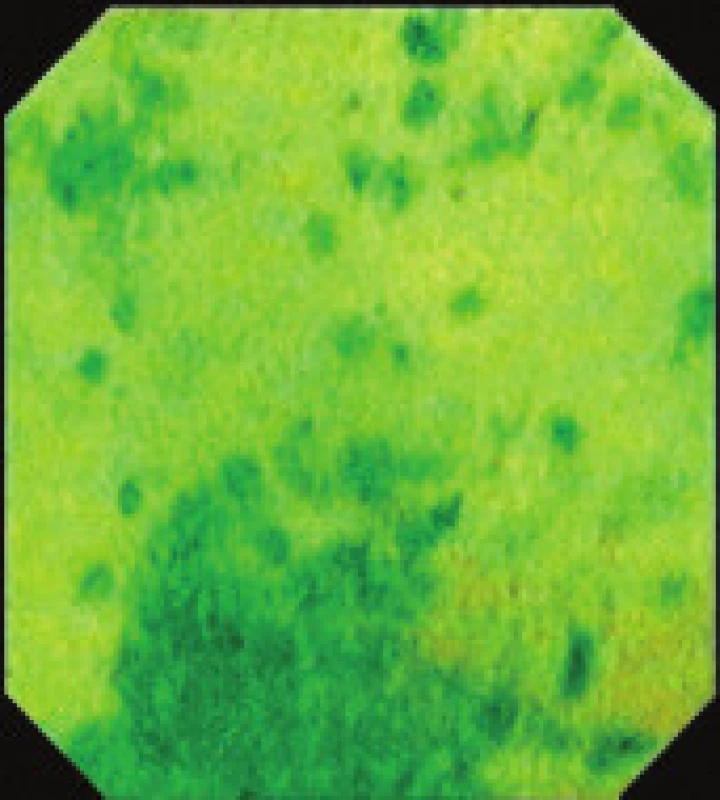
Obr. 6. Endocytoskopický nález karcinomu jícnu. 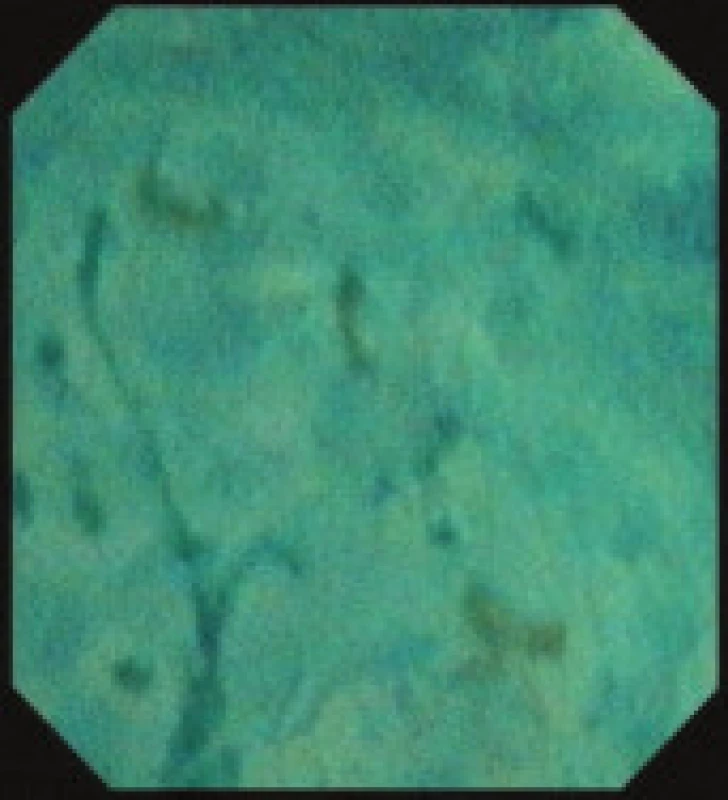
Obr. 7. Endocytoskopický obraz normální sliznice kolon. 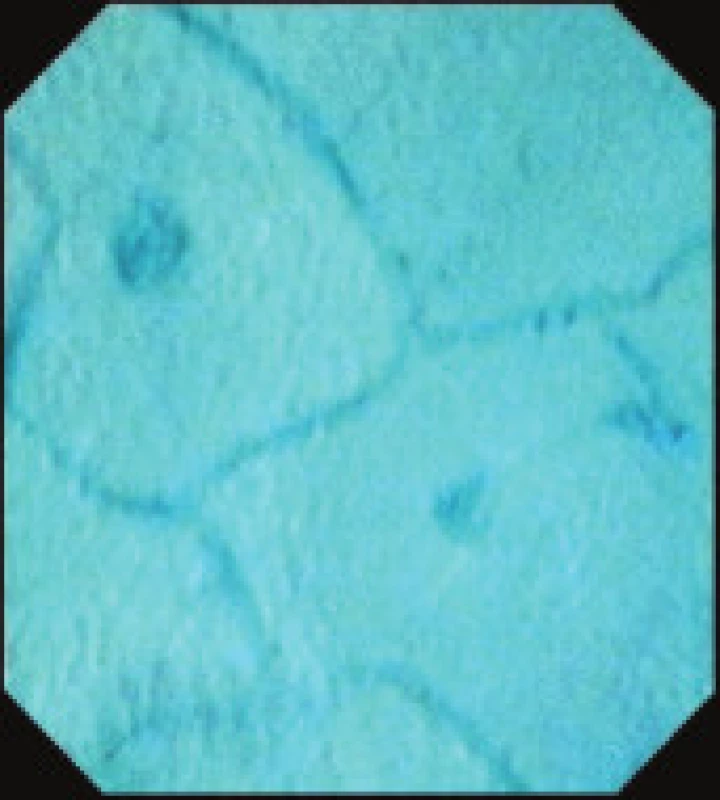
Obr. 8. Endocytoskopický nález karcinomu kolon. 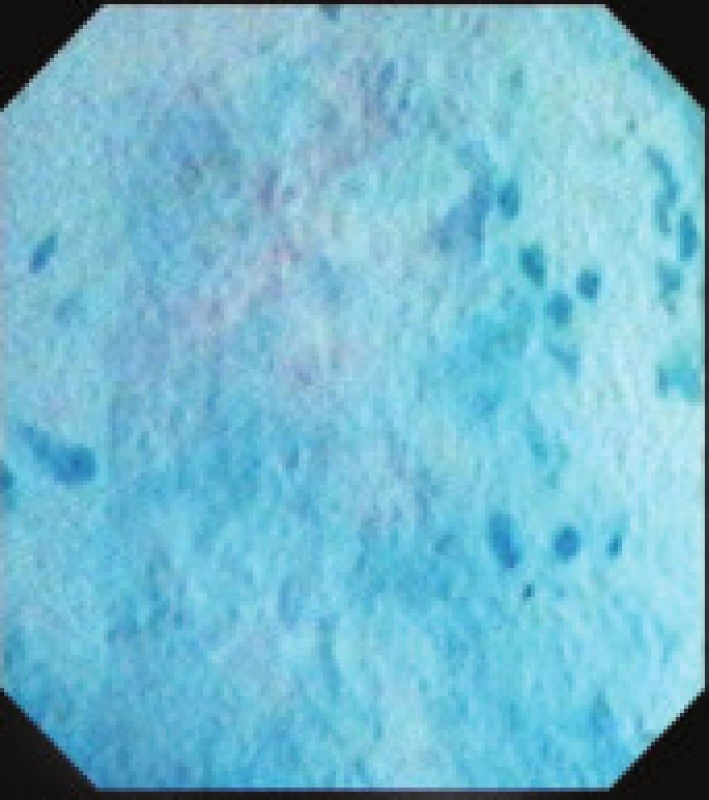
Diskuse
Rozvoj různých endoskopických metod vede ke snaze zobrazit sliznici trávicí trubice velmi detailně. I když došlo ke zkvalitnění této diagnostiky pomocí např. chromoendoskopie, techniky NBI apod, přesto se zatím nepodařilo zobrazit mukózu GIT na úroveň morfologických struktur a k upřesnění diagnostiky je zatím stále nezbytné provést biopsii. Jednou z metod, která by umožnila histologickou verifikaci přímo při endoskopickém vyšetření, je endocytoskopie. Tato metoda dokáže zobrazit buněčné struktury sliznice včetně jader, jadérek, buněčných membrán, lze u ní pozorovat morfologickou architekturu, a dokonce i vaskularizaci [6]. Lze rozlišit přímo při endoskopickém vyšetření normální morfologický nález či patologickou abnormitu včetně zánětu, malignity apod. Kumagai et al např. velmi hezky referoval o použití endocytoskopie při detekci karcinomu jícnu přímo in vivo. Velmi dobré zkušenosti s ECS kolorektálních lézí předložil ve své práci Sasajima. Tento autor ve své sestavě 75 ECS případů deklaroval velmi dobrý výsledek korelace mezi bioptickým vyšetřením a ECS. Dále pomocí ECS dokázal velmi dobře in vivo rozlišit mezi neoplastickou a nonneoplastickou lézí, včetně rozlišení mezi adenomem a invazivním karcinomem. Ze 13 popisovaných případů invazivního karcinomu diagnostikovaného pomocí ECS jich bylo biopticky potvrzeno 12 [10].
Metoda se zdá velmi perspektivní u zobrazení superficiální části sliznice žaludku, tenkého a tlustého střeva. Výhodou je i to, že optický obraz lze digitalizovat, a tak se diagnostika může provádět ihned při vyšetření či se může archivovat na digitální nosiče. Endocytoskopie může zobrazit morfologické struktury, avšak je nutné oblast, kterou chceme takto vyšetřovat, velmi pečlivě připravit a odstranit z ní zbytky obsahu - hlavně hlenu, zvláště v žaludku, tenkém a tlustém střevě, což je někdy velmi obtížné. Také je nutné sliznici obarvit tak, aby se dobře zobrazily buněčné elementy. Tyto podmínky považujeme pro úspěšné vyšetření z vlastní zkušenosti za velmi podstatné. Je zjevné, že v budoucnosti nám toto vyšetření pravděpodobně umožní snížit počet nutných biopsií a snížit časovou náročnost diagnostiky některých onemocnění GIT. Další předností ECS je možnost provádět tuto proceduru u nemocných, kteří užívají antikoagulancia či nemocní s trombocytopenií, u nichž je biopsie nemožná. To si jistě v budoucnu vyžádá mnoho srovnávacích studií. Výhodou endocytoskopie je to, že umožní provést diagnostiku ihned in vivo při endoskopických vyšetřeních, protože mnoho patologických procesů začíná právě na povrchu sliznice. Na druhé straně endocytoskopie není schopna provést analýzu tkáně v hloubce, a tak bude dle potřeby nutno tuto metodu doplnit dalšími diagnostickými postupy. Obtížně se ECS provádí při větších respiračních či kardiálních pohybech, při přítomnosti hlenu na sliznici či jejím větším krvácení.
Závěr
Endoskopická cytoskopie představuje kvalitativně novou endoskopickou metodu, která nám umožňuje provést morfologickou verifikaci slizničního povrchu GIT. Lze s její pomocí zobrazit buňku, její jádro a další buněčné struktury. Dokáže rozeznat normální slizniční mikrostrukturu od zánětu, karcinomu apod. Tato nová kontaktní endoskopická technika umožňuje provést histologickou verifikaci přímo při vyšetření in vivo.
prim. MUDr. Zdeněk Beneš, CSc.
II. interní klinika Fakultní Thomayerovy nemocnice
Vídeňská 800
140 21 Praha 4 – Krč
e-mail: beneszdenek@atlas.cz
Doručeno do redakce: 10. 6. 2007
Přijato po recenzi: 25. 6. 2007
Zdroje
1. Fuji T, Lishi H, Tatsuta M et al. Effectiveness of premedication with pronase for improving visibility during gastroendoscopy a randomized controlled trial. Gastrointest Endosc 1998; 47 : 382-387.
2. Chiu PWY, Inoue H, Satodate H et al. Validation of the quality of histological images obtained of fresh and formalin-fixed specimen of esophageal and Bystric mucosa by laser-scanning confocal microscopy. Endoskopy 2006; 38 : 236-240.
3. Inoue H, Kudo S, Shiokawa A. Novel Endoscopic Imaging Techniques toward in vivo Observation of Libiny Cancor Cells in the Gastrointestinal tract. Dig Dis 2004; 22 : 334-337.
4. Inoue H, Sasajima K, Kaga M et al. Endoscopic in vivo evaluation of tissue atypia in the esophagus using a newly designed integrated endocytoscope: a pilot trial. Endoscopy 2006; 38 : 891-895.
5. Kakeji Y, Yamaguchi S, Yoshida D et al. Development and assesment of morphologic criteria for diagnosing Bystric cancer using confocal endomicroscopy: an ex vivo and in vivo study. Endoscopy 2006; 38 : 886-890.
6. Kumagai Y, Monma K, Kawada K. Magnifying chromoendoscopy of the esopghagus: In vivo pathological diagnosis using an endocytoscopy system. Endoscopy 2004; 36 : 590-594.
7. Saito N, Sato F, Oda A et al. Removal of mucus for ultrastructural observation of the surfaře of human epithelium using pronase. Helicobacter 2002; 7 : 12-115.
8. Sakashita M, Inoue H, Kashida H et al. Virtual histology of colorectal lesions using laser-scanning confocal microscopy. Endoscopy 2003; 35 : 1033-1038.
9. Sano Y, Saito Y, Fu K et al. Efficacy of magnifying chromoendoscopy for the differential diagnosis of colorectal lesions. Digestive Endoscopy 2005; 17 : 105-116.
10. Sasajima K, Kudo S, Inoue H et al. Real-time in vivo virtual histology of Colorectal lesions when using the endocytoscopy system. Gastrointest Endosc 2006; 63 : 1010-1017.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 11- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Význam hydratace při hojení ran
- Myasthenia gravis: kombinace chirurgie a farmakoterapie jako nejefektivnější modalita?
-
Všetky články tohto čísla
- Využití implantabilních monitorovacích zařízení v diagnostice synkop nejasné etiologie - editorial
- N-terminální peptid pro-BNP a endotelin u hemodialyzovaných nemocných - editorial
- Adiponektin a inzulinová rezistence - editorial
- Vplyv obezity na genovú expresiu adiponektínu a jeho receptoru v subkutánnom tukovom tkanive - editorial
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Dlouhodobé výsledky srdeční resynchronizační léčby u pacientů s těžkým srdečním selháním
- Využití stanovení glykogenfosforylázy BB v diagnostice algické formy akutních koronárních syndromů
- Bazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin
- Variabilita plazmatických hladin big endotelinu a NT-proBNP u nemocných se srdečním selháním v chronickém hemodialyzačním programu
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
- Vliv obezity na genovou expresi adiponektinu a jeho receptorů v subkutánní tukové tkáni
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Význam endoskopické cytoskopie u vyšetření trávicího traktu
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti České lékařské společnosti J. E. Purkyně a Společnosti infekčního lékařství České lékařské společnosti J.E. Purkyně - Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



