-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza variantních nálezů počtu signálů při určení translokace t(4;14)(p16.3;q32.3) metodou FICTION u nemocných s mnohočetným myelomem
Analysis of variant number of signals in the determination of translocation t(4;14)(p16.3;q32.3) using FICTION method in patients with multiple myeloma
Multiple myeloma (MM) is characterized by numerous chromosomal changes of prognostic importance. One of them, associated with adverse prognosis, is translocation t(4;14)(p16.3;q32.3) resulting in deregulation of the genes MMSET and FGFR3.
The aims of the present study were to analyse IGH, FGFR3 and MMSET genes using the FICTION method in cohort of MM patients, to evaluate the frequency of translocation t(4;14) and its variant findings, clonal evolution assessment in repeatedly examined patients and assess the prognostic importance of our findings.
Using the FICTION method, we detected t(4;14) in 66 out of 533 (12.4%) patients; in 21 patients (32%) we detected variant number of t(4;14) signals (already detected in 15 out of 21 (71%) patients during standard examination of IgH gene rearrangement). FGFR3 and MMSET genes analysis proved the variant findings in 12/21 patients (57%). Additional cytogenetic abnormalities were detected in all patients with variant number of t(4;14) signals, the most frequent being 13q deletion and 1q21 gain. Nine patients were repeatedly examined and clonal evolution was observed in 3 patients.
Our results suggest prevailing heterogeneity of FICTION findings of t(4;14) and that the changes in the number of signals of IgH gene, primarily caused by deletions, can mask translocation. Therefore, we believe it as necessary to use the specific translocation probe. Although the variant translocation findings do not confirm the statistical significance of the results in terms of overall patient survival, our results show that given the prognostic significance of translocation t(4;14) overlooked changes can have a significant bearing on the therapeutic approach.KEY WORDS:
multiple myeloma – chromosomal changes – translocation t(4;14)(p16.3;32.3) – FICTION
Autoři: J. Balcárková 1; M. Mlynárčiková 1; P. Mičková 1; V. Ščudla 1,2; T. Pika 1; J. Bačovský 1; J. Minařík 1; M. Jarošová 1
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc 1; III. interní klinika – NRE, LF UP a FN Olomouc 2
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 3, p. 182-188.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Mnohočetný myelom (MM) je charakterizován četnými chromozomovými změnami prognostického významu. Jednou z nich je translokace t(4;14)(p16.3;q32.3), která je spojena s nepříznivou prognózou. Jejím důsledkem je deregulace genů MMSET a FGFR3.
Cílem práce bylo analyzovat geny IgH, FGFR3 a MMSET metodou FICTION v souboru nemocných s MM, určit frekvenci t(4;14) a variantních nálezů počtu signálů této translokace, u opakovaně vyšetřených nemocných studovat klonální vývoj a vyhodnotit význam variantních nálezů.
V souboru 533 nemocných s MM byla t(4;14) potvrzena u 66 nemocných (12,4 %), z toho u 21 nemocných (32 %) byla zjištěna abnormalita v počtu signálů. Abnormalita v počtu signálů při vyšetření přestavby IgH genu byla zjištěna u 15 z 21 nemocných (71 %), zatímco analýza genů FGFR3 a MMSET potvrdila variantní nález u 12/21 nemocných (57 %). Současně s variantním nálezem t(4;14) byly u všech nemocných nalezeny další přídatné chromozomové změny, nejčastěji delece 13q a zmnožení oblasti 1q21. U 3 z 9 opakovaně vyšetřených nemocných byl pozorován klonální vývoj.
Naše výsledky upozorňují na existující heterogenitu FICTION nálezů při určení t(4;14) a na skutečnost, že změny v počtu signálů při vyšetření přestavby genu IgH, způsobené především delecí, mohou maskovat translokaci, a proto je nutné pro určení translokací u MM používat specifické translokační sondy. Přestože nález variantních počtů signálů při určení translokace nepotvrdil statisticky významný vliv na celkové přežití nemocných, vzhledem k prognostické významnosti translokace t(4;14) neurčení změny může také významně ovlivnit terapeutický přístup.KLÍČOVÁ SLOVA:
mnohočetný myelom – chromozomové změny – translokace t(4;14)(p16.3;q32.3) – FICTIONÚVOD
Mnohočetný myelom (MM) je zhoubné onemocnění plazmatických buněk charakterizované jejich proliferací, akumulací v kostní dřeni a produkcí monoklonálního imunoglobulinu. MM je geneticky heterogenní onemocnění, u kterého pozorujeme rekurentní cytogenetické změny v průběhu celého onemocnění od nemaligního stadia monoklonální gamapatie nejasného významu (MGUS) přes doutnající myelom (SMM) až po konečné stadium MM [1, 2]. Některé změny se objevují v době transformace normální plazmatické buňky do stadia MGUS (primární), zatímco sekundární změny se objevují v pozdějším stadiu onemocnění [2, 4].
Na základě primárních změn je dnes MM rozdělován na hyperdiploidní a nonhyperdiploidní. Hyperdiploidní MM je spojen s trizomiemi lichých chromozomů, zejména chromozomů 3, 5, 7, 9, 11, 15, 19 a 21 [5]. Nonhyperdiplodiní MM je charakterizován translokacemi zahrnujícími IgH gen. Delece RB1 genu/monozomie chromozomu 13 je popisována jak u hyperdiploidních, tak nonhyperdiploidních MM stejně jako sekundární cytogenetické změny jako delece genu TP53 (17p13), zmnožení oblasti 1q21 nebo delece oblasti 1p32 [6, 7].
U 30–40 % nemocných jsou zjištěny translokace zahrnující IgH gen (14q32) [6]. Tyto translokace jsou důsledkem nehomologní rekombinace IgH genu a vedou k deregulované expresi partnerských genů tím, že tyto geny jsou přemístěny do blízkosti zesilovačů transkripce IgH genu [8]. Mezi nejčastější translokace zahrnující IgH gen patří t(4;14)(p16;q32), t(11;14)(q13;32), t(14;16)(q32;q23) a t(14;20)(q32;q12). V současné době je přítomnost t(11;14) spojena s příznivou prognózou, t(4;14) se středně nepříznivou prognózou, t(14;16) a t(14;20) s velmi nepříznivou prognózou [9].
Translokace t(4;14)(p16;q32) se vyskytuje u 15–20 % nemocných [10]. Touto translokací dochází k deregulaci dvou genů MMSET na derivovaném chromozomu 4 a FGFR3 na derivovaném chromozomu 14. Gen MMSET (multiple myeloma SET domain) je také známý jako kandidátní gen 1 pro Wolf-Hirschhorn syndrom (WHSC1) nebo NSD2 (nuclear receptor-binding SET domain 2). Protein MMSET je chromatin remodelující protein s histon metyltransferázovou aktivitou [11]. Na tkáňových kulturách bylo prokázáno, že v buňkách, u kterých je zvýšená exprese proteinu MMSET, dochází ke snížení metylace histonu H3 a tím k umlčení exprese cílových genů. Ztráta exprese proteinu MMSET u buněčných linií s t(4;14) vede ke snížené adhezi buněk, zpomalení buněčného růstu a indukci apoptózy [10]. Histon metyltransferázová aktivita proteinu MMSET se stala vhodným cílem pro vytvoření molekul inhibitoru cílového substrátu proteinu MMSET nebo pro vytvoření malé siRNA (small interfering RNA), která vede k sekvenčně specifickému umlčování genů [12].
Druhým genem zahrnutým v translokaci t(4;14) je gen FGFR3 (gen pro receptor fibroblastového růstového faktoru 3). Následkem translokace dochází k ektopické expresi tyrozin kinázového receptoru zapojeného do přenosu signálů regulujících růst a diferenciaci buněk v mnoha tkáních, ale jeho role v patogenezi MM zůstává zatím neznámá [5]. Nedávno bylo zjištěno, že přibližně u 30 % nemocných s t(4;14) dochází ke ztrátě exprese genu FGFR3. Ztráta exprese FGFR3 genu je spojena s různě velkými delecemi, které vznikají na derivovaném chromozomu 14, případně se ztrátou celého derivovaného chromozomu 14. Tyto poznatky ukazují, že zahrnutí genu MMSET má významnější podíl na maligním fenotypu nemocných s t(4;14), než je podíl genu FGFR 3 [13].
Středně nepříznivý prognostický dopad t(4;14) je shodný pro nemocné s klasickou t(4;14) stejně jako pro nemocné, u nichž došlo ke ztrátě exprese FGFR3 genu. Uvádí se, že středně nepříznivý prognostický dopad t(4;14) může být překonán použitím léčebného přístupu s proteazomovým inhibitorem bortezomibem [14].
Cílem této práce bylo analyzovat geny IgH, FGFR3 a MMSET metodou FICTION v souboru nemocných s MM, určit frekvenci variantních nálezů a jejich význam a u opakovaně vyšetřených nemocných studovat klonální vývoj.
SOUBOR NEMOCNÝCH A METODIKA
Soubor nemocných
V souboru 533 nemocných diagnostikovaných a léčených na III. interní klinice a Hemato-onkologické klinice FN a LF UP v Olomouci v období let 2003–2015 byla u 66 nemocných (12,4 %) zjištěna t(4;14). Další klinická data jsou uvedená v tabulce 1.
Tab. 1. Charakteristika souboru 66 nemocných s t(4;14) 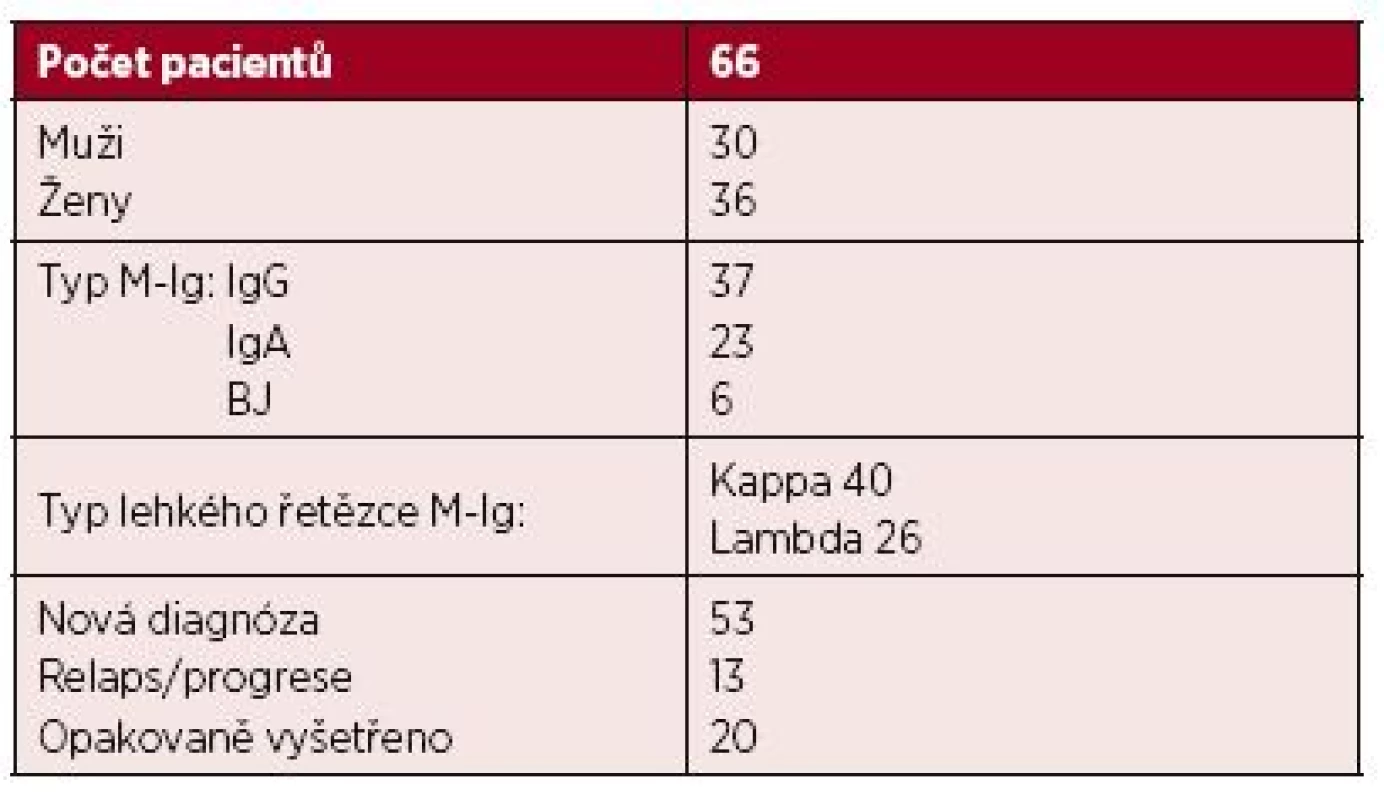
Metody
U všech nemocných byl vyšetřen vzorek kostní dřeně (1–2 ml) s minimálním zastoupením 10 % plazmatických buněk. Vzorky kostní dřeně byly zpracovány podle standardních cytogenetických postupů [15].
K detekci cytogenetických změn byla použita metoda fluorescenční in situ hybridizace v kombinaci s imunofluorescenčním značením plazmatických buněk (FICTION) [16–18]. U všech pacientů byl použit základní panel sond LSI RB1, LSI IgH, ON IgH nebo XL IGH plus, LSI TP53, CEP 15, CEP 17, ON 1q21/1p36 nebo XL 1q21/1q32, (Abbott Molecular, Des Plaines, IL, USA; Kreatech Diagnostics, Amsterdam, Nizo-zemsko; MetaSystems Althusheim, Německo). Pro určení translokace t(4;14) a dalších změn v oblasti 4p16.3 byly použity sondy LSI IGH/FGFR3 DF (Ab-bott Molecular), LSI Wolf-Hirschhorn region WHS so/CEP4 SGn (Abbott Molecular) nebo MD Wolf--Hirschhorn WHSC1(4p16)/SE 4 (Kreatech Diagnostics) a BAC sonda RP11 241P10 (Illumina, San Diego, California, USA), která pokrývá geny FGFR3, TMEN19, TACC3 a LETM1.
Hybridizace byla provedena podle návodu doporučeného výrobci jednotlivých sond. U každého nemocného bylo hodnoceno 100 imunofluorescenčně značených plazmatických buněk. Hraniční hodnota pozitivity použitých sond (cut-off level) byla stanovena na 10 %.
VÝSLEDKY
Z celkem 66 nemocných s t(4;14) byl u 45 nemocných prokázán standardní nález t(4;14) a u 21 nemocných (32 %) s t(4;14) byl pozorován variantní nález počtu signálů při vyšetření translokace metodou FICTION. Ze 45 nemocných se standardní translokací t(4;14) žije 17 nemocných a zemřelo 28 nemocných. Z 21 nemocných s variantním nálezem signálů t(4;14) žije 10 nemocných, 11 nemocných zemřelo.
Všichni nemocní byly vyšetřeni nejprve sondou pro určení přestavby genu IgH, dále pak specifickou sondou pro určení translokace t(4;14) a specifickými sondami pro určení změn genů FGFR3 a MMSET.
Jen u 6 z 21 nemocných byla zjištěna klasická přestavba IgH genu (označeno 1F1R1G), u 15 nemocných (71 %) byla zjištěna abnormalita v počtu signálů při základním vyšetření přestavby IgH genu. Současně s přestavbou IgH genu byly u 9 nemocných zjištěny další změny: parciální duplikace (4 nemocní), parciál-ní delece (3 nemocní) nadbytečná přestavěná kopie (1 nemocný), ztráta druhé kopie IgH genu (1 nemocný).
U 6 nemocných nebyla prokázána klasická přestavba IgH genu, ale byly zjištěny jiné abnormality tohoto genu: parciální delece u 4 nemocných, parciální duplikace u 2 nemocných (tab. 2).
Tab. 2. Klinická data, výsledky přestavby IgH genu, typ variantního nálezu signálů t(4;14) a změny v genech FGFR3 a MMSET u nemocných v době prvního vyšetření 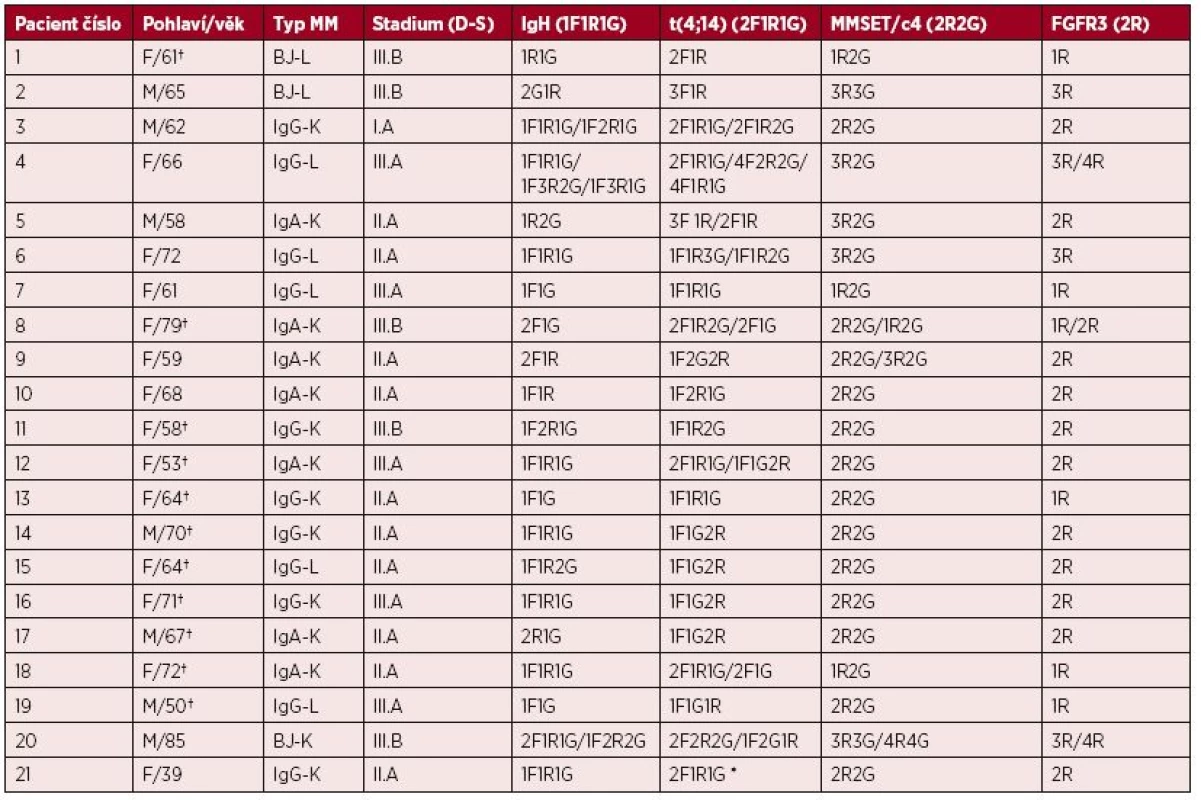
*Nemocná s klonálním vývojem a objevením variantního nálezu v progresi MM. †Nemocný zemřel. V záhlaví tabulky jsou v závorce uvedené standardní nálezy pro jednotlivé sondy, R-červená, G-zelená, F-fúze. Nemocní 8, 12, 13 byli poprvé vyšetřeni v relapsu/progresi MM. Obr. 1. Translokace t(4;14) A – standardní nález (2F1R1G), B – variantní nález (1F1R1G) 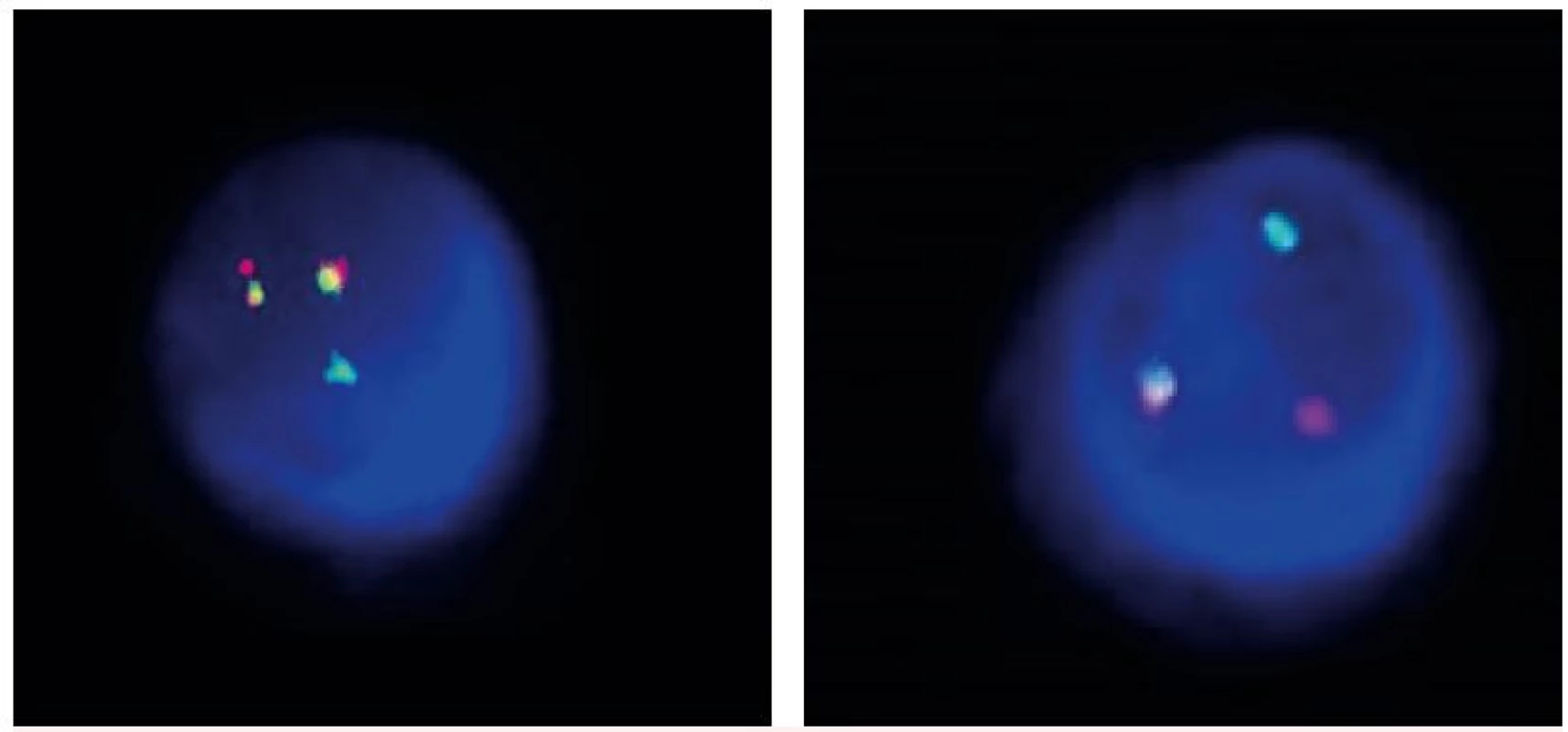
U všech nemocných byla zjištěna abnormalita v počtu signálů se specifickou sondou pro t(4;14). Na obrázku 1 je ukázán standardní (označeno 2F1R1G) a variantní nález t(4;14) metodou FICTION. Jednotlivé variantní nálezy jsou ukázány v tabulce 2. U 7 nemocných byl prokázán výskyt dvou klonů: standardní/variantní u 3 nemocných, variantní/variantní u 4 nemocných. U jedné nemocné byla zjištěna přítomnost 3 klonů (standardní/variantní/variantní). U 12 nemocných byla prokázána přítomnost jen variantního klonu buněk. Jedna nemocná v době diagnózy měla standardní t(4;14), ale v progresi již byla zjištěna přítomnost i variantního klonu. Detailně jsou jednotlivé klony s variantním nálezem signálů při určení translokace t(4;14) popsány v tabulce 2.
U všech nemocných byla provedena analýza genů FGFR3 a MMSET. Nalezené změny v těchto genech a varianta t(4;14) v době prvního vyšetření jsou uvedeny v tabulce 2. Změny v těchto genech byly nalezeny u 12 nemocných. Delece genu FGFR3 byla prokázána u 6 nemocných (u 3 nemocných v kombinaci s delecí genu MMSET). Zmnožení genu MMSET bylo zjištěno u 3 nemocných; u 1 nemocné společně se zmnožením genu FGFR3. Početní změny chromozomu 4 byly prokázány u 3 nemocných. Normální nálezy v genech FGFR3 a MMSET byly prokázány u 9 nemocných.
Současně s t(4;14) byly u všech nemocných nalezeny metodou FICTION další abnormality. Nejčastěji se jednalo o deleci RB1 genu (16 nemocných) a zmnožení oblasti 1q21 (14 nemocných). Dále byla prokázána delece genu TP53 u 4 nemocných a početní změny chromozomu 15 (5 nemocných), chromozomu 17 (2 nemocní) a chromozomu 1 (2 nemocní). Přehled dalších chromozomálních abnormalit zjištěných metodou FICTION je shrnutý v grafu 1.
Graf 1. Přídatné chromozomové změny u nemocných s variantním nálezem signálů t(4;14) 
Opakovaně bylo v relapsu/progresi MM vyšetřeno 9/21 nemocných. U 6 nemocných byly nalezené změny v relapsu/progresi shodné se změnami v době prvního vyšetření. Jeden variantní klon byl prokázán u 3 nemocných, u dalších 3 nemocných byly v době diagnózy i v době relapsu/progrese nalezeny 2 klony: variantní a standardní.
U 3 nemocných byl zaznamenán klonální vývoj (nemocní č. 4, 11 a 21). U nemocné č. 4 byly nalezeny v době diagnózy 3 různé klony (tab. 3) a v době relapsu byla zjištěna přítomnost jen dvou variantních klonů s přídatnými změnami. U nemocné č. 11 byl zjištěn vývoj jednoho nového klonu s variantní t(4;14) – tabulka 4. U nemocné č. 21 se v první progresi objevil k původnímu standardnímu klonu i klon variantní, který byl detekován i v druhé progresi onemocnění (tab. 4).
Tab. 3. Přehled klonálního vývoje a dalších cytogenetických změn u nemocné č. 4. 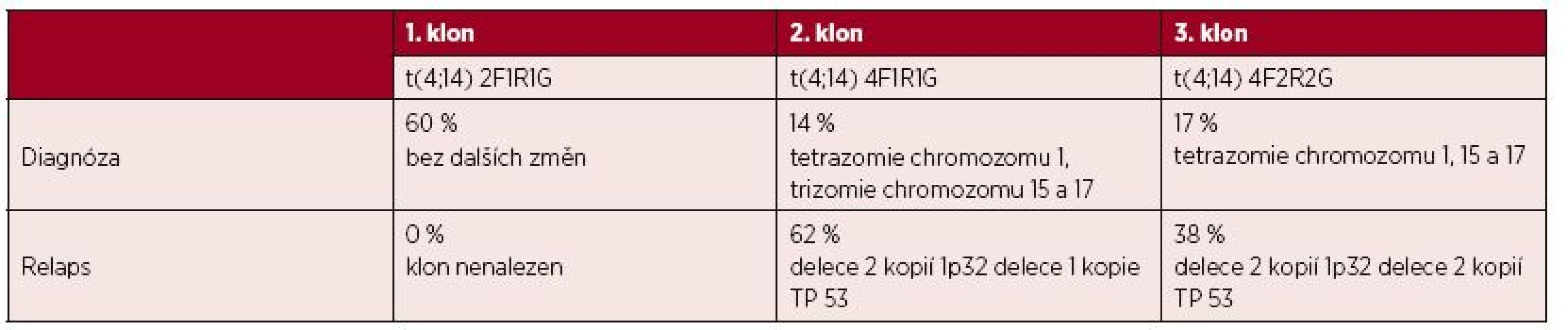
Tab. 4. Přehled klonálního vývoje u nemocných č. 11 a č. 21 
DISKUSE
Translokace zahrnující IgH gen patří k prvním identifikovaným prognostickým změnám u MM. Jedna z nejčastějších translokací je t(4;14), která je spojována s horší prognózou [9] a s nižší frekvencí se vyskytuje u nemocných MGUS než u nemocných s MM. Tento rozdíl ve frekvenci výskytu t(4;14) u MM a MGUS je zdůvodňován nestabilitou genomu plazmatických buněk s t(4;14), kdy tato nestabilita vede k rychlejšímu vývoji MM z MGUS a časnějším relapsům [11]. U nemocných s t(4;14) byla dále zjištěna klonální heterogenita a bylo pozorováno, že k relapsu může docházet následkem pomnožení minoritního klonu [19].
V našem souboru nemocných jsme zjistili t(4;14) u 12,4 % nemocných (66 z 533 vyšetřených nemocných). Výsledky uvedené v této práci jsou ve shodě s výsledky dalších autorů, kteří detekovali t(4;14) u 11–20 % nemocných s MM [10, 20]. Z 66 nemocných jsme potvrdili variantní počet signálů t(4;14) u 21 nemocných (32 %).
U 88 % našich nemocných byla zjištěna abnormalita v počtu signálů již při vyšetření přestavby IgH genu. Nejčastěji se jednalo a parciální delece nebo duplikace 3´ a 5´konce tohoto genu. Delece v IgH genu jsou často pozorované změny nejen u MM, ale i chronické lymfatické leukemie (CLL) a lymfomů [21, 22]. Delece v IgH genu mohou mít různý rozsah co do velikosti, ale mohou být jak monoalelické s delecí celého genu IgH přes monoalelické a bialelické s delecí pouze 3´ a 5´konce až po kombinované delece. Biologický význam IgH delecí zůstává stále nejasný, ale předpokládá se, že se jedná o časnou událost při vzniku MM [23].
Delece v IgH genu se mohou vyskytovat samostatně nebo mohou být spojeny s výskytem translokací, zejména jejich variantních forem. Někteří autoři uvádějí korelaci delecí v IgH genu s delecí RB1 genu a t(11;14), ale nebyla potvrzena korelace s t(4;14) [23]. V našem souboru jsme pozorovali, že změny v IgH genu byly spojeny s variantní t(4;14) a u 73 % nemocných jsme prokázali deleci RB1 genu společně se změnou v IgH genu. Odlišné výsledky mohou být způsobeny odlišným hodnocením změn v IgH genu, kdy jsme do změn zahrnuli jak delece, tak také různé formy duplikace části nebo celého IgH genu. Na těchto výsledcích jsme potvrdili, že nálezy abnormálních signálů IgH genu často maskují přítomnost translokace, často s variantním počtem signálů, proto je nutné, aby kromě vyšetření genu IgH byla použita i translokační sonda (např. pro t(4;14)) k odhalení maskovaných translokací s variantním počtem signálů.
Analýza genů FGFR3 a MMSET potvrdila změny u 12/21 nemocných s variantním nálezem počtu signálů při vyšetření t(4;14). Jednalo se o samostatnou deleci genu FGFR3 (3 nemocní), deleci genu FGFR3 i deleci genu MMSET (3 nemocní), zmnožení počtu signálů genu MMSET i FGFR3 (1 nemocný) nebo zmnožení počtu signálů jen samostatného genu MMSET (2 nemocní), z toho u jedné nemocné byla prokázána duplikace 3´konce IgH genu a zmnožení genu MMSET. Tento nález odpovídá inzerci 3´konce IgH genu do genu MMSET a tím vzniku t(4;14) s variantním počtem signálů. U 3 nemocných byly pozorovány početní změny chromozomu 4 společně se zvýšením počtu fúzních signálů potvrzující t(4;14). Současné literární údaje v souvislosti se změnami genů FGFR3 a MMSET nejčastěji zmiňují deleci genu FGFR3, která je důsledkem různě velkých delecí až monozomií derivovaného chromozomu 14, která je pozorována až u 30 % nemocných [24, 25]. Naopak u všech nemocných s t(4;14) je popisována zvýšená exprese genu MMSET, a proto se předpokládá klíčová role genu MMSET v patogenezi tohoto subtypu MM [24]. Normální nálezy v genech FGFR3 a MMSET byly pozorovány u 9 nemocných, u těchto nemocných je vznik variantní t(4;14) je spojen s delecí v IgH genu, zejména jeho 5´konce.
U 3 z 9 nemocných vyšetřených opakovaně v době relapsu/progrese onemocnění byl pozorován klonální vývoj. U dvou nemocných došlo ke klonálnímu vývoji z původního variantního nebo standardního klonu s t(4;14). U těchto nemocných lze považovat tento vývoj za lineární vývoj původního klonu nalezeného v době diagnózy, stejně jako je uvedeno v literatuře [26, 27]. Naopak u poslední nemocné s klonálním vývojem se jedná o intraklonální heterogenitu [28, 29].
Vzhledem k velikosti souboru pacientů s variantním nálezem translokace t(4;14) a délce sledování souboru není možné se jednoznačně vyjádřit ke klinickému významu variantních nálezů translokace t(4;14). Na základě literárních údajů je přítomnost více klonů odrazem nestability genomu, která je spojena s nepříznivou prognózou [11, 26].
ZÁVĚR
V souboru 533 nemocných s MM byla t(4;14) potvrzena u 66 (12,4 %) nemocných, z toho u 21 (32 %) nemocných byla zjištěna abnormalita v počtu signálů. Naše výsledky souboru 21 nemocných s MM s variantním nálezem počtu signálů při určení prognosticky středně nepříznivé translokace t(4;14) upozorňují na existující heterogenitu nálezů při použití interfázní metody FICTION. Translokace t(4;14) je spojena nejen se změnami počtu signálů, které jsou odrazem i parciálních delecí genu IgH, ale i se změnami, jako jsou delece nebo zmnožení genů FGFR3 i MMSET při vzniku translokace. Práce upozorňuje na úskalí vyšetření pouze sondou pro určení přestavby genu IgH, kde delece nebo parciální delece mohou maskovat přítomnost translokace a tím její určení. Přesný klinický význam variantních nálezů zůstává nejasný, ale upozorňuje na genetickou heterogenitu, která může přispívat ke klinické heterogenitě nemocných. Ukázali jsme, že v našem souboru měli všichni nemocní přídatné chromozomové změny, nejčastěji deleci RB1 genu (76 % nemocných). Další analýzy velkých souborů nemocných mohou přispět k přesnému učení biologického i klinického významu těchto změn.
Podíl autorů na rukopisu
J. Balcárková a MJ – napsání rukopisu.
J. Balcárková, MM a PM – provádění vyšetření.
VŠ, JM, TP a J. Bačovský – diagnostika, léčba a odběry materiálu.
Poděkování
Práce byla podporovaná grantem IGA MZČR NT/14400-3, IGA_LF_2016_001.
Čestné prohlášení autorů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 16. 3. 2016.
Přijato po recenzi dne 14. 7. 2016.
Mgr. Jana Balcárková, Ph.D.
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
e-mail: jana.balcarkova@fnol.cz
Zdroje
1. Fonseca R. Many and multiple myeloma(s). Leukemia 2003; 17 : 1943–1944.
2. Fonseca R, Barlogie B, Bataille R, et al. Genetics and cytogenetics of multiple myeloma: a workshop report. Cancer Res 2004; 64 : 1546–1558.
3. Avet-Loiseau H, Facon T, Daviet A, et al. 14q32 translocations and monosomy 13 observed in monoclonal gammopathy of undetermined significance delineate a multistep process for the oncogenesis of multiple myeloma. Intergroupe Francophone du Myelome. Cancer Res 1999; 59 : 4546–4550.
4. Bergsagel PL, Mateos MV, Gutierrez NC, Rajkumar SV, San Miguel JF. Improving overall survival and overcoming adverse prognosis in the treatment of cytogenetically high-risk multiple myeloma. Blood 2013; 121 : 884–892.
5. Prideaux SM, Conway O‘Brien E, Chevassut TJ. The genetic architecture of multiple myeloma. Adv Hematol 2014; 2014 : 864058.
6. Boyle EM, Proszek PZ, Kaiser MF, et al. A molecular diagnostic approach able to detect the recurrent genetic prognostic factors typical of presenting myeloma. Genes Chromosomes Cancer 2014; 54 : 91–98.
7. Rajan AM, Rajkumar SV. Interpretation of cytogenetic results in multiple myeloma for clinical practice. Blood Cancer J 2015; 5: e365.
8. Hideshima T, Bergsagel PL, Kuehl WM, Anderson KC. Advances in biology of multiple myeloma: clinical applications. Blood 2004; 104 : 607–618.
9. Mikhael JR, Dingli D, Roy V, et al. Management of newly diagno-sed symptomatic multiple myeloma: updated Mayo Stratification of Myeloma and Risk-Adapted Therapy (mSMART) consensus guidelines 2013. Mayo Clin Proc 2013; 88 : 360–376.
10. Martinez-Garcia E, Popovic R, Min DJ, et al. The MMSET histone methyl transferase switches global histone methylation and alters gene expression in t(4;14) multiple myeloma cells. Blood 2011; 117 : 211–220.
11. Walker BA, Wardell CP, Melchor L, et al. Intraclonal heterogeneity and distinct molecular mechanisms characterize the development of t(4;14) and t(11;14) myeloma. Blood 2012; 120 : 1077–1086.
12. Xie Z, Chng WJ. MMSET: role and therapeutic opportunities in multiple myeloma. Biomed Res Int; 2014 : 636514.
13. Kalff A, Spencer A. The t(4;14) translocation and FGFR3 overexpression in multiple myeloma: prognostic implications and current clinical strategies. Blood Cancer J 2012; 2: e89.
14. Avet-Loiseau H. Ultra high-risk myeloma. Hematology Am Soc Hematol Educ Program; 2010 : 489–493.
15. Jarosova M, Holzerova M, Mihal V, et al. Complex karyotypes in childhood acute lymphoblastic leukemia: cytogenetic and molecular cytogenetic study of 21 cases. Cancer Genet Cytogenet 2003; 145 : 161–168.
16. Fonseca R, Bailey RJ, Ahmann GJ, et al. Genomic abnormalities in monoclonal gammopathy of undetermined significance. Blood 2002; 100 : 1417–1424.
17. Ahmann GJ, Jalal SM, Juneau AL, et al. A novel three-color, clone-specific fluorescence in situ hybridization procedure for monoclonal gammopathies. Cancer Genet Cytogenet 1998; 101 : 7–11.
18. Balcárková J, Procházková K, Ščudla V, et al. Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem. Tranfuze a Hematologie dnes 2007; 4 : 176–182.
19. Hebraud B, Caillot D, Corre J, et al. The translocation t(4;14) can be present only in minor subclones in multiple myeloma. Clin Cancer Res 2013; 19 : 4634–4637.
20. Neben K, Jauch A, Bertsch U, et al. Combining information regarding chromosomal aberrations t(4;14) and del(17p13) with the International Staging System classification allows stratification of myeloma patients undergoing autologous stem cell transplantation. Haematologica 2009; 95 : 1150–1157.
21. Wlodarska I, Matthews C, Veyt E, et al. Telomeric IGH losses detectable by fluorescence in situ hybridization in chronic lymphocytic leukemia reflect somatic VH recombination events. J Mol Diagn 2007; 9 : 47–54.
22. Pospisilova H, Baens M, Michaux L, et al. Interstitial del(14)(q) involving IGH: a novel recurrent aberration in B-NHL. Leukemia 2007; 21 : 2079–2083.
23. He H, Fu W, Jiang H, et al. The clinical characteristics and prognosis of IGH deletion in multiple myeloma. Leuk Res 2015; 39 : 515–519.
24. Mirabella F, Wu P, Wardell CP, et al. MMSET is the key molecular target in t(4;14) myeloma. Blood Cancer J 2013; 3: e114.
25. Nahi H, Sutlu T, Jansson M, Alici E, Gahrton G. Clinical impact of chromosomal aberrations in multiple myeloma. J Intern Med 2011; 269 : 137–147.
26. Keats JJ, Chesi M, Egan JB, et al. Clonal competition with alternating dominance in multiple myeloma. Blood 2012; 120 : 1067–1076.
27. Bianchi G, Munshi NC. Pathogenesis beyond the cancer clone(s) in multiple myeloma. Blood 2015; 125 : 3049–3058.
28. Brioli A, Melchor L, Cavo M, Morgan GJ. The impact of intra-clonal heterogeneity on the treatment of multiple myeloma. Br J Haematol 2014; 165 : 441–454.
29. Magrangeas F, Avet-Loiseau H, Gouraud W, et al. Minor clone provides a reservoir for relapse in multiple myeloma. Leukemia 2013; 27 : 473–481.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo 3- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
- Rutinné používanie tromboelastometrie (ROTEM) k hodnoteniu koagulácie (adopcia ,,novej“ paradigmy hodnotenia koagulácie) na jednotke intenzívnej starostlivosti vedie k značnému zníženiu podávania krvnej plazmy
- Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
- Analýza variantních nálezů počtu signálů při určení translokace t(4;14)(p16.3;q32.3) metodou FICTION u nemocných s mnohočetným myelomem
- Diagnostika a prognostické faktory lymfomu z buněk pláště
- Alfa-talasemie u 45 českých rodin a 37 rodin cizinců žijících v České republice: přehled literatury a molekulárně-genetická diagnostika
- Současnost a budoucnost alternativních zdrojů hematopoetických buněk včetně pupečníkové krve. Perspektivy bank pupečníkové krve. Závěry Panelu expertů
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Alfa-talasemie u 45 českých rodin a 37 rodin cizinců žijících v České republice: přehled literatury a molekulárně-genetická diagnostika
- Diagnostika a prognostické faktory lymfomu z buněk pláště
- Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
- Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



