-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Markery buněčného poškození trombocytů u směsných trombocytových transfuzních přípravků v aditivních roztocích
Markers of cell damage of buffy-coat derived platelet concentrates in additive solutions
Background:
The aim of the study was to compare markers of cell damage and platelet activation of buffy-coat derived platelet concentrates (PCs) during storage in two types of additive solutions (PASs) in two different storage bags. PASs reduce plasma-associated transfusion reactions and conserve plasma for transfusion or fractionation.Materials and Methods:
PCs were prepared from leukocyte-depleted pools of four buffy-coats (BCPs) suspended in one of 70% PASs: 30% plasma (Composol, Fresenius - Kabi; T-Sol, Baxter Corp.). Two different storage bags were used (R4R7036, Fenwal; Autostop, Pall Corp.). On the days 0 and 5 of storage samples were tested for PLT concentration, pH, glucose, lactate and sP-Selectin. Data were analyzed by analysis with two-sample t-tests, paired test and Pearson correlation coefficient. Statistical significance was assessed at p <0.05.Results:
PLT yields were higher then 2x1011platelets/unit in all of PCs. There was the significant decrease of platelet concentration during storage for 5 days in all bags or media. The pH of all PCs was 6.8 on the 5th day of storage. Glucose consumption and lactate production in all types of bags and media were significantly different during storage. Lactate production and glucose consumption in T-Sol were higher than those items in Composol and they resulted in lower pH values. We showed the influence of storage bags for platelet activation, too.Conclusion:
The development of markers of cell damage in PCs was influenced mainly by used platelet storage solution, platelet storage bags affected the status of platelet activation.Key words:
platelet additive solution, platelet, platelet function, platelet activation, platelet storage
Autoři: L. Řehořová 1,2; R. Procházková 1,2
Působiště autorů: Transfuzní oddělení, Krajská nemocnice Liberec, a. s. 1; Ústav zdravotnických studií, Technická univerzita v Liberci 2
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 2, p. 85-91.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Cílem studie bylo porovnat markery buněčného poškození a aktivace trombocytů směsných trombocytových transfuzních přípravků vyrobených z buffy-coatu během skladování ve dvou aditivních roztocích a připravených do dvou různých souprav. Aditivní roztoky snižují riziko potransfuzních reakcí způsobených plazmou a zachovávají plazmu pro klinické použití nebo frakcionaci.Materiál a metoda:
Trombocytové transfuzní přípravky byly vyrobeny smísením čtyř buffy-coatů a resuspendovány v jednom ze dvou aditivních roztoků (Composol, Fresenius – Kabi; T-Sol, Baxter Corp.) v poměru 70 % aditivní roztok a 30 % plazma. Pro smísení byly použity dvě různé soupravy (R4R7036, Fenwal; Autostop, Pall Corp.). V den skladování 0 a 5 byly odebírány vzorky pro laboratorní vyšetření a testován počet trombocytů v přípravcích, hodnota pH, obsah glukózy, laktátu a sP-selektinu. K hodnocení jsme použili dvouvýběrový t-test, párový test, Pearsonův korelační koeficient. Statistická významnost byla posouzena na hladině p < 0,05.Výsledky:
Počet trombocytů byl vyšší než 2 x 1011/T.U. ve všech přípravcích. Během pětidenního skladování byl prokázán statisticky významný pokles obsahu trombocytů u všech typů směsí. Na konci skladování byla hodnota pH byla vyšší než 6,8 u všech typů přípravků. Konsumpce glukózy a produkce laktátu byla statisticky významná u všech porovnávaných přípravků, přičemž produkce laktátu a konsumpce glukózy byla vyšší u trombocytových transfuzních přípravků v roztoku T-Sol než v roztoku Composol a odpovídala poklesu pH. Byl prokázán i vliv použité soupravy na aktivaci trombocytů.Závěr:
Vývoj markerů buněčného poškození trombocytů v transfuzních přípravcích byl ovlivněn zejména použitým skladovacím roztokem, použité soupravy ovlivňovaly stav aktivace trombocytu.Klíčová slova:
aditivní roztok, trombocyty, funkce trombocytu, aktivace trombocytu, skladování trombocytůÚvod
Moderním způsobem přípravy trombocytových transfuzních přípravků je výroba deleukotizovaných přípravků z plné krve, které se získávají smísením a následným zpracováním 4–5 buffy-coatů. Tento způsob zpracování umožňuje použít jako skladovací media pro trombocyty náhradní roztoky místo plazmy (1). Tyto roztoky jsou schopny zajistit pro skladování trombocytů in vitro podobné podmínky jako plazma (1, 2). V současné době existuje řada syntetických skladovacích roztoků, které se liší obsahem citrátu, acetátu, fosfátů, glukonátu a iontů K+ a Mg++ (tab. 1). Je prokázáno, že ionty K+ a Mg++ mají schopnost snížit anaerobní glykolýzu a ochránit membránu trombocytu. Tyto ionty jsou obsaženy v roztocích III. generace (1, 2, 3, 4).
Tab. 1. Složení náhradních roztoků pro skladování trombocytů. 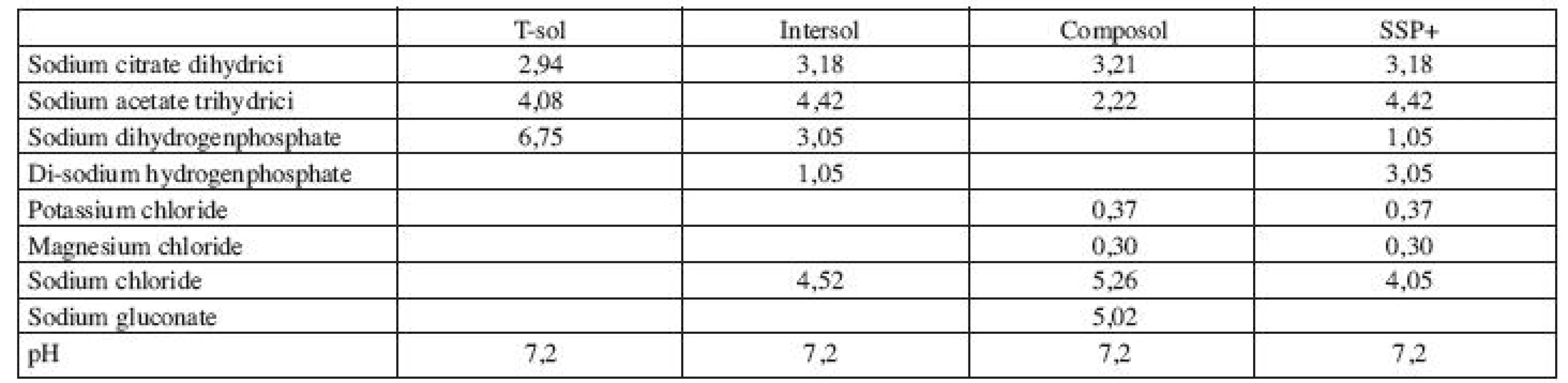
Legenda: Tabulka udává složení roztoků v g/l. Výhodou použití aditivních roztoků při přípravě trombocytových transfuzních přípravků je snížení obsahu plazmy v přípravku o 70–80 %. Tím lze snížit možnost výskytu TRALI a dalších potransfuzních reakcí způsobených plazmou, včetně možného rizika AB0 inkompatibility (5, 6, 7, 8). Přínosem je i využití získané plazmy pro frakcionaci (7, 8) a možnost skladování trombocytových transfuzních přípravků 7 i více dnů (3, 9, 10). Snížený obsah plazmy v přípravcích je jedním z předpokladů pro ošetření koncentrátů metodami patogenní inaktivace (7). Praktické je i zjednodušení výroby, protože buffy-coaty se zpracovávají až následující den po odběru (5).
Struktura a funkce trombocytů jsou během procesu přípravy a skladování ovlivněny řadou faktorů, například technikou odběru, složením antikoagulačního roztoku, kontaktem s povrchem odběrového vaku, metodou zpracování a obsahem leukocytů v produktu či způsobem deleukotizace (11, 12, 13). Trombocyty podléhají morfologickým a metabolickým alteracím („platelet storage lesion“), které limitují jejich skladovatelnost a dle některých autorů mohou asociovat se snížením potransfuzního výtěžku (recovery) in vivo (14, 15, 16). Metabolické alterace během skladování se odrážejí ve změnách pH, zvýšení LDH v supernatantu (11, 15), v konsumpci glukózy a produkci laktátu. Současně se rozvíjí aktivace trombocytu. Tento proces je doprovázen degranulací vnitřních granulárních struktur trombocytu, které vedou k povrchové expresi makromolekul lokalizovaných původně intracelulárně v granulích destiček. Jednou z nich je P-selektin CD62P, integrální membránový glykoprotein alfa-granulí, který se na povrchu klidové destičky nenachází. Stanovení exprese CD62P na povrchu trombocytů nebo jeho solubilní formy (sP-selektin) v supernatantu přípravku je používáno k posouzení aktivace trombocytů v přípravku (14, 15).
Na výše uvedené metabolické změny u trombocytových transfuzních přípravků mají vliv i další faktory, např. změny v koncentraci CO2, skladovací podmínky, jako jsou třepání (1, 17, 18), délka a teplota skladování, a obsah trombocytů v přípravcích.
Při porovnání uvedených změn literatura uvádí rozdíly nejen mezi aferetickými přípravky a přípravky z plné krve, ale i mezi produkty z různých typů separátorů a také mezi trombocyty připravenými z plné krve odlišnými technikami (19).
Cílem prospektivní studie bylo zhodnotit markery buněčného poškození a aktivace trombocytů v transfuzních přípravcích získaných smísením buffy-coatů s použitím aditivního roztoku a posoudit vliv dvou odlišných směšovacích souprav a dvou odlišných náhradních roztoků.
Materiál a metodika
Odběr plné krve a příprava buffy-coatů
Buffy-coaty (BC) byly připraveny z odběrů plné krve, získané odběrem 450 ml 10 % krve do čtyřvaků Optipack (kat. č. JGR 6461B Baxter Healthcare Corp., USA), obsahujících antikoagulant CPD v poměru 1 : 7, následnou diferenciální centrifugací na centrifuze Heraeus (3400 g, 10 min., teplota 22 °C, akcelerace 6, brzda 1) a zpracováním na automatických lisech Optipress II (Baxter Healthcare Corporation, USA). Buffy-coaty byly skladovány do druhého dne při teplotě 22–24 °C v horizontální poloze bez třepání. Před zpracováním byly třepány na horizontálním agitátoru RL-45B umístěném v termoboxu TB-80N (TOOL s.r.o., ČR) minimálně 30 min.
Příprava trombocytových transfuzních přípravků z buffy-coatů
Směsný buffy-coat o průměrném objemu 531 ml (Fenwal) a 543 ml (Pall) byl připraven ze čtyř AB0 shodných BC. BC byly sterilně připojeny pomocí svářečky Terumo (Terumo Europe N.V., Leuven, Belgie) ke směšovací soupravě typu chobotnice s integrovaným trombocytovým deleukotizačním filtrem (R4R7036, Fenwal, Inc., Three Corporate Drive, Lake Zurich IL, 60D47, USA) nebo AutoStop BC (ATSBC1PSB, Pall Corporation, Porthsmouth, UK). Stejným způsobem byl připojen aditivní roztok Composol ® PS 300 ml (E 2083, Fresenius Cabi, Bad Homburg, SRN) nebo T-Sol (AZDB 7846, Baxter Healthcare Corp., USA) v množství 300 ml.
BC byly přepuštěny do směšovacího vaku a následně přidán aditivní roztok (300 ml). Poměr aditivního roztoku a plazmy byl 70 : 30. Směsný BC byl centrifugován na centrifuze Heraeus (1360 RPM, 8 min, teplota 22 °C, akcelerace 5, brzda 4), trombocyty byly separovány na manuálním lisu Baxter R4R4460 (Baxter Healthcare Corporation Deerfield, IL 60015 USA).
Pro hodnocení byly vyrobeny čtyři typy koncentrátů, každý soubor tvořilo 20 jednotek, TBSD 1: set Fenwal + Composol, TBSD 2: set Pall + Composol, TBSD 3: set Pall + T-Sol, TBSD 4: set Fenwal + T-Sol.
Odběry vzorků
Pro laboratorní vyšetření přípravků byly odebírány vzorky na začátku a konci exspirace, tj. v den 0 a den 5. V den 0 bylo odebráno 15 ml přípravku bezprostředně po přípravě, centrifugováno 5 min. při 5000 ot. na laboratorní centrifuze Jouan C 3.12 (Jouan S.A., Francie). Supernatant byl rozplněn do alikvotů po 0,75 ml. Vyšetření pH, laktátu, glukózy proběhlo týž den do 4 hodin po odběru vzorků. Materiál pro vyšetření solubilního P-selektinu CD62P byl zamražen a skladován při - 30 °C. Pro vyšetření markerů na konci exspirace bylo 15 ml transfuzního přípravku sterilně přemístěno do skladovacího váčku (Grifols transfer vak 150 ml, kat. č. 720430, Laboratorios Grifols, S.A., Španělsko), který byl skladován při teplotě 20 ± 2 °C. Následné zpracování bylo identické jako u vzorků v den 0.
Laboratorní analýza
Počet trombocytů v přípravcích byl stanoven na analyzátoru Celltac F, MEK-8222K (Nihon Kohden Corporation Tokio, Japan). Biochemická vyšetření byla provedena na Oddělení klinické biochemie Krajské nemocnice Liberec na analyzátoru Modular EVO. Hodnota laktátu byla vyšetřena reakcí s LOX (kat. č. 1822837, Roche Diagnostics), pH přímou potenciometrií na radiometru ABL 625 GL, stanovení glukózy bylo provedeno glukózooxidázovou reakcí GOP-PAP (kat. č. 11929526, Roche Diagnostics). Solubilní P-selektin byl stanoven pomocí vyšetřovací soupravy Human Soluble P-Selectin Immunoassay, kat. č. BBE 6 (R & D Systems Inc., Minneapolis, USA) na ÚKIA Fakultní nemocnice Hradec Králové.
Hodnocení: Hodnotili jsme vývoj uvedených parametrů během skladování u jednotlivých typů přípravků a mezi přípravky navzájem. Data byla hodnocena pomocí průměru, mediánu a směrodatné odchylky. K porovnání výběrů jsme použili dvouvýběrový t-test, párový test, Pearsonův korelační koeficient. Statistická významnost byla posouzena na hladině p < 0,05.
Výsledky
Základní parametry jakosti získaných přípravků uvádíme v tabulce 2. Hodnocení bylo provedeno u 20 směsí Fenwal + Composol (TBSD1), 20 směsí Pall + Composol (TBSD2), 20 směsí Pall + T-Sol (TBSD3) a 20 směsí Fenwal + T-Sol (TBSD4). Všechny směsi vyhověly doporučeným požadavkům na obsah trombocytů ve směsných trombocytových transfuzních přípravcích dle Vyhl. 143/2008 Sb. ( 2 x 1011/T.U.), kontaminace leukocyty byla u všech směsí nižší než 1 x 106/T.U. Během pětidenního skladování přípravků došlo u všech porovnávaných směsí ke statisticky významnému snížení obsahu trombocytů (tab. 2). Výsledky stanovení hodnoty pH, hladiny laktátu, glukózy a sP-selektinu přehledně uvádí tabulka 3.
Tab. 2. Základní parametry jakosti trombocytových směsí. 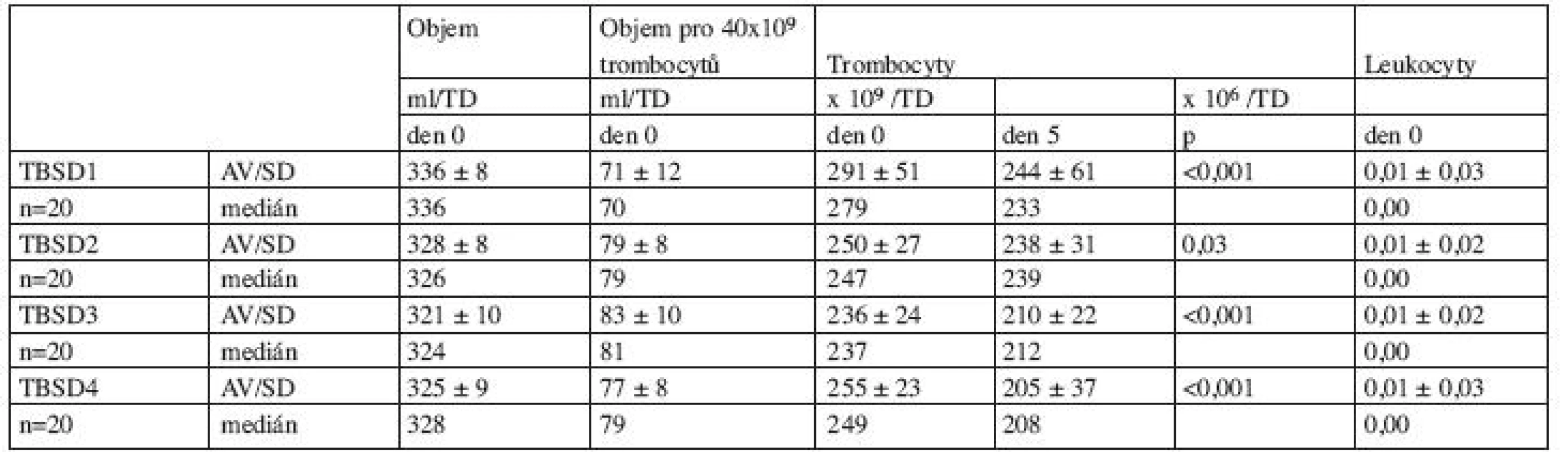
Legenda: p: statistická významnost změn hodnot den 0 a 5, TBSD: trombocyty z buffy-coatu směsné deleukotizované, TBSD1: Fenwal + Composol, TBSD2: Pall + Composol, TBSD3: Pall + T-Sol, TBSD4: Fenwal + T-Sol, n: počet jednotek, TD: terapeutická dávka Tab. 3. Vývoj parametrů poškození trombocytů v přípravku během skladování. 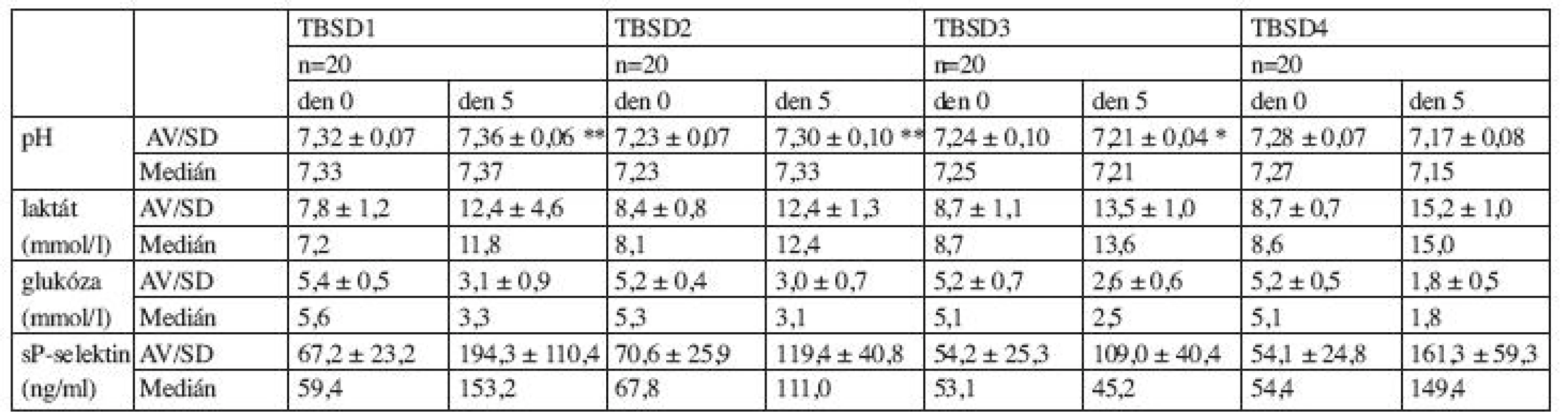
Legenda: p: statistická významnost změn hodnot den 0 a 5, * p>0,05 (NS); ** p<0,05; ostatní: p<0,001, TBSD: trombocyty z buffy-coatu směsné deleukotizované, TBSD1: Fenwal + Composol, TBSD2: Pall + Composol, TBSD3: Pall + T-Sol, TBSD4: Fenwal + T-Sol, n: počet jednotek Hodnota pH v den 0 byla vyšší u směsí TBSD1 než u směsí TBSD2 (p < 0,001) a TBSD3 (p = 0,008), nižší u směsí TBSD2 než u směsí TBSD4 (p = 0,02), srovnatelná u směsí TBSD1 a TBSD4 (p = 0,069), TBSD2 a TBSD3 (p = 0,46) a TBSD3 a TBSD4 (p = 0,22). V průběhu skladování došlo k statisticky významnému zvýšení pH u TBSD1 (p = 0,018) a TBSD2 (p = 0,028). U TBSD3 nebyl prokázán statisticky významný rozdíl hodnot pH v den 0 a 5 (p = 0,10). U TBSD 4 byl prokázán statisticky významný pokles pH (p < 0,001). Srovnatelný vzestup jsme zaznamenali u TBSD1 a TBSD2 (p = 0,60), který byl statisticky významně vyšší v porovnání s vývojem pH u TBSD 3 (TBSD1 x TBSD3: p = 0,0053, TBSD2 x TBSD3: p = 0,0059) (graf 1).
Graf 1. Změny hodnot pH během skladování. 
Legenda: TBSD: trombocyty z buffy-coatu směsné deleukotizované, TBSD1: Fenwal + Composol, TBSD2: Pall + Composol, TBSD3: Pall + T-Sol, TBSD4: Fenwal + T-Sol. Hodnota glukózy (mmol/l) v den 0 byla srovnatelná u směsí TBSD1 a TBSD2 (p = 0,08), TBSD1 a TBSD 3 (p = 0,27), TBSD1 a TBSD4 (p = 0,07), TBSD2 a TBSD3 (p = 0,85), TBSD2 a TBSD4 (p = 0,82) a TBSD3 a TBSD4 (p= 0,74). V průběhu skladování došlo ke statisticky významnému poklesu hodnot u všech směsí (p < 0,001).
Hladina laktátu (mmol/l) byla v den 0 srovnatelná u směsí TBSD1 a TBSD2 (p = 0,06), TBSD2 a TBSD 3 (p = 0,45), TBSD2 a TBSD4 (p = 0,21) a TBSD3 a TBSD4 (p = 0,79). Hladina laktátu byla nižší u směsi TBSD1 v porovnání s TBSD2 (p = 0,02) a TBSD4 (p = 0,004). Během skladování došlo ke statisticky významnému zvýšení obsahu laktátu u všech směsí (p < 0,001).
Hodnoty solubilního P-selektinu stanovené v den výroby směsí byly srovnatelné u TBSD1 a TBSD2 (p = 0,66), TBSD1 a TBSD3 (p = 0,09), TBSD1 a TBSD4 (p = 0,08) a TBSD3 a TBSD4 (p = 0,99). Hodnoty sP-selektinu v den 0 byly nižší u směsí TBSD2 v porovnání s TBSD3 a TBSD4 (obojí: p = 0,04). K vzestupu hodnot sP-selektinu během skladování došlo u všech typů směsí (p < 0,001). K nejvýraznějším vzestupům došlo u směsí TBSD2 a TBSD 4 (p < 0,001), u TBSD1 x TBSD2 (p = 0,01), u TBSD1 x TBSD3 (p = 0,01) a TBSD3 a TBSD4 (p = 0,01). Vzestup hodnot byl srovnatelný u směsí TBSD1 a TBSD4 (p = 0,47) a TBSD2 a TBSD3 (p = 0,62) (graf 4). Hodnoty sP-selektinu na konci uchovávání nekorelovaly s hodnotou pH na konci skladování u směsí TBSD2 (r = -0,24), TBSD3 (r = 0,15) a TBSD4 (r = -0,14), slabou korelaci jsme prokázali u směsi TBSD1 (r = 0,45).
Diskuse
Cílem studie bylo zhodnotit parametry jakosti, zejména markery buněčného poškození a markery aktivace destiček, u přípravků připravených smíšením buffy-coatů odebraných do dvou různých typů směšovacích souprav a dvou různých aditivních roztoků.
Při hodnocení základních parametrů jakosti (objem přípravku, obsah trombocytů, kontaminace leukocyty) všechny směsi vykázaly v souladu s jinými autory vysoký standard obsahu trombocytů a nízkou kontaminaci leukocyty (3, 4, 8) (tab. 2). Ve shodě s dřívějšími pozorováními (1) jsme prokázali statisticky významný pokles obsahu trombocytů u všech typů směsí během 5denního skladování, i když v jedné studii pokles trombocytů nebyl zaznamenán ani během 9denního skladování (4). Pokles trombocytů během skladování v aditivních roztocích je přisuzován aktivaci trombocytů projevující se tvorbou mikroagregátů, fragmentací nebo ztrátou destičkové integrity (1). Dle našich vlastních zkušeností (20) i v souladu s literaturou (1, 4, 8) při skladování v plazmě k poklesu trombocytů v transfuzních přípravcích nedochází.
Trombocytové transfuzní přípravky z plné krve, které se získávají smísením a následným zpracováním buffy-coatů, jsou stále více používány v klinické praxi, zejména u hematoonkologických pacientů. Aplikace aferetických destiček je doporučována u pacientů refrakterních, aloimunizovaných proti HLA antigenům a/nebo specifickým HPA antigenům. V době možnosti trombocytové přípravky protivirově ošetřit se ztrácí výhoda expozice jednomu dárci s ohledem na přenos infekčních onemocnění u aferetických přípravků (21). Pro úspěch transfuze trombocytů je důležitá schopnost transfundovaných destiček setrvat v cirkulaci a plnit hemostatickou funkci, která může být ovlivněna metabolickým stavem trombocytu, tzv. skladovacími lézemi (12, 22).
Za kritický pro viabilitu a funkci trombocytu je považován pokles pH pod hodnotu 6,2, kdy dle řady autorů dochází k ireversibilnímu poškození trombocytu, reprezentovanému ireversibilní expresí P-selektinu (22, 23, 24). Při hodnotách pH mezi 6,2–6,8 dochází také k expresi P-selektinu, která je však po inkubaci trombocytu v plazmě reversibilní. Hodnoty pH u všech hodnocených směsí v naší studii splnily požadavek pH 6,4 dle Vyhl. 143/2008 Sb. (25). Ani v jednom případě jsme nezaznamenali kritický pokles hodnoty pH pod 6,2. V den 0 jsme nalezli srovnatelné hodnoty pH u směsí odebraných do souprav Fenwal (TBSD1 x TBSD4: p = 0,069), do souprav Pall (TBSD2 x TBSD3: p = 0,46) a do roztoku T-sol (TBSD3 x TBSD4: p = 0,22). Z dalšího porovnání hodnot pH u směsí (TBSD1 x TBSD2: p < 0,001, TBSD 1 x TBSD3: p = 0,008, TBSD2 x TBSD4: p = 0,02) nelze na vliv použitých odběrových souprav a náhradních roztoků v den výroby v rozporu s literaturou jednoznačně usoudit (1, 4, 8).
Během 5denního skladování směsí došlo ke statisticky významnému vzestupu pH u směsí TBSD1 (p = 0,02) a TBSD2 (p = 0,03) skladovaných v roztoku Composol. U směsí skladovaných v roztoku T-Sol u směsí TBSD3 ke změně hodnot pH nedošlo (p = 0,10), u směsí TBSD4 došlo k významnému poklesu pH (p < 0,001) (1, 8, 10). U přípravků skladovaných v roztoku T-Sol došlo v souladu s literaturou v porovnání s přípravky skladovanými v roztoku Composol k statisticky významnému poklesu pH (TBSD1 x TBSD3: p = 0,005, TBSD1 x TBSD4: p < 0,001, TBSD2 x TBSD3: p = 0,006) (1, 4, 8) (graf 1). Vzhledem k tomu, že jsme nezaznamenali pokles hodnot pH pod 6,4, se domníváme, že viabilita trombocytů v přípravcích nebyla ovlivněna.
U hodnot glukózy jsme v den výroby směsí neprokázali statisticky významný rozdíl, neprokázali jsme tedy vliv použitých aditivních roztoků ani souprav. Ke konsumpci glukózy došlo u všech typů směsí (vše: p < 0,001). Při hodnocení konsumpce glukózy byl pokles obsahu glukózy nejvyšší u směsí TBSD4 (x TBSD1, x TBSD2, x TBSD3: vše: p < 0,001), nižší pokles jsme zaznamenali u směsí TBSD3 (x TBSD2: p = 0,03). Srovnatelné byly poklesy u směsí TBSD1 a TBSD2 (p = 0,39) a TBSD 1 a TBSD3 (p = 0,28) (graf 2). Zjištěné rozdíly tedy ukazují vyšší konsumpci glukózy u směsí TBSD3 a TBSD4, skladovaných v roztoku T-Sol.
Graf 2. Pokles hodnot glukózy během skladování. 
Legenda: TBSD: trombocyty z buffy-coatu směsné deleukotizované, TBSD1: Fenwal + Composol, TBSD2: Pall + Composol, TBSD3: Pall + T-Sol, TBSD4: Fenwal + T-Sol. V den přípravy směsí byla hladina laktátu nižší u směsí TBSD1 (x TBSD4: p = 0,004, x TBSD3: p = 0,02), ostatní hodnoty byly srovnatelné. Během skladování došlo u všech typů směsí k vzestupu hladiny laktátu (p < 0,001), u všech typů směsí v naší studii produkce laktátu odpovídala konsumpci glukózy v poměru 2 : 1 (tab. 3) a kopírovala stupeň konsumpce glukózy. Nejvyšší vzestup hladiny laktátu jsme zaznamenali u směsí TBSD 4 (x TBSD1, x TBSD2, x TBSD4: vše p < 0,001). Nižší vzestup laktátu jsme pozorovali u směsí TBSD3 proti TBSD2 (p = 0,01), Srovnatelné bylo zvýšení u směsi TBSD1 proti TBSD2 (p = 0,16) a TBSD3 (p = 0,48) (graf 3). Z těchto výsledků můžeme usuzovat spíše na vliv použitého roztoku než vliv použité soupravy, přičemž produkce laktátu byla vyšší v souladu s literaturou u směsí skladovaných v roztoku T-Sol a korespondovala s poklesem pH během uchovávání (1, 4, 8) (graf 1).
Graf 3. Vzestup hodnot laktátu během skladování. 
Legenda: TBSD: trombocyty z buffy-coatu směsné deleukotizované, TBSD1: Fenwal + Composol, TBSD2: Pall + Composol, TBSD3: Pall + T-Sol, TBSD4: Fenwal + T-Sol. Stanovení exprese P-selektinu na povrchu trombocytů, resp. jeho solubilní formy, je považováno za predikátor viability trombocytu. Přestože jeho definitivní role nebyla zatím jasně stanovena, má se za to, že degranulace CD62P z vnitřních destičkových granulí může znamenat částečnou ztrátu destičkových funkcí (24, 26, 27). Některé studie prokázaly jen nízkou korelaci mezi expresí CD62P a přežitím destičky in vivo (28, 29). Lze však najít korelaci zvýšení exprese P-selektinu, resp. jeho hladiny, snížení pH a ztráty vířivého (swirling) fenoménu (12, 23).
V naší studii byly hladiny sP-selektinu v den výroby v souladu s jinými autory srovnatelné u všech typů směsí (1, 8), neprokázali jsme tedy vliv použitých aditivních roztoků ani souprav. Vzestup hladin sP-selektinu během skladování jsme pozorovali u všech typů přípravků (p < 0,001). Vzestup hodnot byl srovnatelný u směsí odebraných do souprav Fenwal, tj. TBSD1 a TBSD4 (p = 0,47) a do souprav Pall, tj. TBSD2 a TBSD3 (p = 0,62). U směsí TBSD1 a TBSD4 došlo v souladu s literaturou k vyššímu vzestupu hodnot než u směsí TBSD2 a TBSD3 (TBSD1 x TBSD2: p = 0,005, x TBSD3: p = 0,009 a TBSD 4 x TBSD2: p <0,001, x TBSD3: p = 0,002) (graf 4). Z uvedených výsledků lze usoudit na vyšší vliv použité soupravy než vliv skladovacího roztoku (4) (graf 4).
Graf 4. Vývoj hodnot sP-selektinu během skladování. 
Legenda: TBSD: trombocyty z buffy-coatu směsné deleukotizované, TBSD1: Fenwal + Composol, TBSD2: Pall + Composol, TBSD3: Pall + T-Sol, TBSD4: Fenwal + T-Sol. Předpokládá se, že produkce kyselin snižuje viabilitu a funkci trombocytu a že snížení metabolické aktivity trombocytu je spojeno s expresí P-selektinu, resp. zvýšení jeho plazmatické hladiny. Ta je v korelaci s hodnotou pH, hladinou LDH a laktátu (24). Prokázali jsme jen slabou korelaci sP-selektinu s pH na konci uchovávání u směsí TBSD1. U ostatních směsí se nám tuto korelaci prokázat nepodařilo, pravděpodobně proto, že hodnota pH v supernatantu se ve většině stanovení pohybovala ve fyziologickém rozmezí. To může znamenat, že nedošlo k významné změně viability buněk.
Udržení destičkových funkcí in vitro během skladování v aditivních roztocích je závislé na kombinaci typů roztoků a typů použitých souprav ke smísení (4). Pro obě použité soupravy v naší studii znamenalo skladování v roztoku Composol nižší glykolýzu během skladování. Naopak k vyšší aktivaci destiček došlo u směsí odebraných do souprav Fenwal bez ohledu na použitý roztok, což lze vysvětlit rozdílným složením filtrů použitých k odstranění leukocytů po smísení (11, 12, 13). Výsledky týkající se metabolických parametrů v naší studii byly v souladu s dřívějšími výsledky, které ukazují na pozitivní vliv draslíku a hořčíku v aditivních roztocích III. generace (Composol, SSP+ apod.) na metabolismus trombocytů v porovnání s roztoky II. generace (např. T-Sol). Obecně aditivní roztoky III. generace zlepšují destičkové funkce a redukují aktivaci trombocytů během skladování (4). Tyto rozdíly se odrážejí ve snížené glykolýze, o čemž svědčí nižší konsumpce glukózy a nižší produkce laktátu u směsí odebraných do Composolu (2, 3, 4, 8). Dle našich výsledků stanovení sP-selektinu byl ale zřejmý i vliv použitých souprav a nelze vyloučit ani vliv zpracování (antikoagulační roztoky, centrifugace během přípravy, kontakt s povrchem leukocytových filtrů a plastikových obalů) (30).
Nicméně vztah mezi destičkovou aktivací během přípravy a skladování a funkcí trombocytů po transfuzi in vivo s ohledem na potransfuzní výtěžek a přežití trombocytů nebyl zcela objasněn a je předmětem dalšího výzkumu.
Lze tedy konstatovat, že směsné trombocytové transfuzní přípravky s aditivními roztoky III. generace představují moderní trend v hemoterapii, zejména díky snížení rizika výskytu TRALI a dalších potransfuzních reakcí způsobených plazmou, včetně možného rizika z AB0 inkompatibility.
Poděkování: Autoři děkují RNDr. I. Ouhrabkové z OKB KN Liberec a doc. RNDr. C. Andrýsovi z UKIA FN Hradec Králové za spolupráci při vyšetření laboratorních parametrů.
RNDr. Lenka Řehořová
Transfuzní oddělení
Krajská nemocnice Liberec, a. s.
Baarova 15
460 63 Liberec
lenka.rehorova@nemlib.czDoručeno do redakce: 18. 2. 2011
Přijato po recenzi: 26. 4. 2011
Zdroje
1. Zhang JG, Carter JC, Culibrk B, et al. Buffy coat platelet variables and meatabolism during storage in additive solutions or plasma. Transfusion 2008; 48 : 847-856.
2. Gullikson H, AuBuchon JP, Vesterinen M, et al. Storage of platelets in additive solutions: a pilot in vitro study of the effects of potassium and magnesium. Vox Sanq 2002; 82 : 131–136.
3. Diedrich B, Sandgren P, Jansson B, et al. In vitro and in vivo effects of potassium and magnesium on storage up to 7 days of apheresis platelet concentrates in platelet additive solutions. Vox Sanq 2008; 94 : 96-102.
4. Cardigan R, Sutherland J, Garwood M, et al. In vitro function of buffy coat – derived platelet concentrates stored for 9 days in CompoSol, PAS II or 100% plasma in three different storage bags. Vox Sanq 2008; 94 : 103-112.
5. Murphy S. Platelelets from pooled buffy coats: an update. Transfusion 2005; 45 : 634 – 639.
6. Azuma H, Hirayama J, Akino M, et. al. Reduction in adverse reactions to platelets by removal of plasma supernatant and resuspension in a new additive solution (M-sol). Transfusion 2009; 49 : 214-218.
7. Vetlesen A, Mirlashari MR, Torshein IA, Kjeldsen – Kragh J. Plaletet activation and residual activation potential during storage of hyperconcentrated platelet products in two different platelet additive solutions. Transfusion 2005; 45 : 1349-1355.
8. Van der Meer PF, Kerkhofs JL, Curvers J, et al. In vitro comparison of platelet storage in plasma and in four platelet additive solutions, and the effect of pathogen reduction: a proposal for an in vitro rating system. Vox Sanq 2010; 98 : 517-524.
9. Sweeney J, Kouthab N, Holme S, Kurtis J, Cheves T, Nelson E. Storage of platelet rich plasma-derived platelet concentrate pools in plasma and additive solution. Transfusion 2006; 46 : 835-840.
10. Hornsey VS, McColl K, Drummond O, et al. Extended storage of platelets in SSP+ platelet additive solution. Vox Sanq 2006; 91 : 41-46.
11. Seghatchian J, Krailadsiri P. The Platelet storage lession. Transf Med Rev 1997; 11 : 130-144.
12. Solheim BG, Flesland O, Seghatchian J, et al. Clinical implications of red blood cell and platelet storage lessions: an overview. Transfus Apher Sci 2004; 31(3): 185-189.
13. Vetlesen A, Mirlashari MR, Ezligini F, Kjeldsen – Kragh J. Evaluation of platelets activation and cytokine release during storage of platelet concentrates processed from buffy coats either manually or by the automated OrbiSac system. Transfusion 2007; 47 : 126-132.
14. Curvers J, van Pampus ECM, Feijge MAH, et al. Decreased responsiveness and development of activation markers of PLTs stored in plasma. Transfusion 2004; 44, 49-58.
15. Perrotta PL, Perrotta ChL, Snyder EL. Apoptotic activity in stored human platelets. Transfusion 2003; 43 : 526-535.
16. Krailadsiri P, Seghatchian J, Zmíral J, Vissac A, Contreras M. Annexin V, a new marker of platelet storage lession: correlaton with dMPV. Transfus Sci 1997; 18 (2): 223-226.
17. Ringwald J, Haager B, Krex D, et al. Impact of different hold time before addition of platelet additive solution on the vitro quality of apheresis platelets. Transfusion 2006; 46 : 942-948.
18. van der Meer PF, Liefting LAE, Pietersz RNI. The effect of interruption of agitation on the in vitro measures of platelet concentrates in additive solutions. Transfusion 2007; 47 : 955-959.
19. Krailadsiri P, Seghatchian J. Are all platelet concentrates equivalent? Vox Sanq 2000; 78 : 171-175.
20. Procházková R, Andrýs C, Hubáčková L Krejsek J. Markers of apoptosis and platelet activation in platelet concentrates collected by apheresis. Transfus Apher Sci 2007; 37 : 115-123.
21. Sweeney J, Kouttab N, Holme S, Kurtis J, Cheves T, Nelson E. Storage of platelet-rich plasma-derived platelet concentrate pools in plasma and additive solutions. Transfusion 2006; 46 : 835-840.
22. Krailadsiri P, Seghatchian J, Williamson LM. Platelet storage lession of WBC-reduced, pooled buffy coat –derived platelet concentrates prepared in three in-process filter/storage bag combinations. Transfusion 2001; 41 : 243-250.
23. Dijkstra-Tiekstra MJ, Pietersz RNI, Huijgens PC. Correlation between the extent of platelet activation in platelet concentrates and in vitro and in vivo parameters. Vox Sanquinis 2004; 87 : 257-263.
24. Holme S, Sweeney JD, Sawyer S, Elfath MD. The expression of P-selectin during collection, processing, and storage of platelet concentrates: Relationship to loss in vivo viability. Transfusion 1997; 37(1): 12-17.
25. Vyhl. 143/2008 Sb. o stanovení bližších požadavků o zajištění jakosti a bezpečnosti lidské krve a jejích složek (vyhláška o lidské krvi).
26. Gutensohn K, Alisch A, Geidel K, Crespeigne N, Kuehnl P. Annexin V and platelet antigen expression is not altered during storage of platelet concentrates obtained with AMICUS cell separator. Transf Sci 1999; 20 : 113-119.
27. Lai M, Rumi C, D Onofrio G, et al. Phosphatidylserine exposure in platelet concentrates during the storage period: differences between the platelets collected with different cell separators. Transfus Apher Sci 2002; 27 : 239-245.
28. Gutensohn K, Geidel K, Kroeger N, et al. Platelet function testing in apheresis products: flow cytometric, resonance thrombographic /RTG) and rotational thrombelastographic (roTEG) analyses. Transfusion Apher Sci 2002; 26 : 147-155.
29. Cardigan R, Turner C, Harrison P. Current methods of assessing platelet function: relevance to transfusion medicine. Vox Sanq 2005; 88 : 153-163.
30. Solheim BG, Flesland O, Seghatchian J, et al. Clinical Implications of red blood cell and platelet storage lessions: an overview. Transf Apher Sci 2004, 31 : 185-189.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2011 Číslo 2- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Když se ve střevech děje něco nepatřičného...
- Jak naučit dítě s hemofilií aplikovat injekci? V Motole pomáhají sestrám i umělé ruce
-
Všetky články tohto čísla
-
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu) - Životní jubileum MUDr. Vladimír Kulich
- Iron chelation therapy with deferasirox in patiens with aplastic anemia: a subgroup analysis of 116 patients from the EPIC trial
- Pharmacokinetic, pharmacodynamic and pharmacogenetic determinants of osteonecrosis in children with acute lymphoblastic leukemia
- Randomized, double-blind trial of fluconazole versus variconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Klinický význam génových mutácií u akútnych myeloidných leukémií s normálnym karyotypom
- Kazuistika: sekundární trombocytopenie a diseminovaná intravaskulární koagulace u pacienta s generalizovaným adenokarcinomem colon descendens
- Markery buněčného poškození trombocytů u směsných trombocytových transfuzních přípravků v aditivních roztocích
- „Stanovení rezistence na clopidogrel pomocí vícenásobné impedanční a optické transmisní agregometrie“
- Does microgranular variant morphology of acute promyelocytic leukemia independently predict a less favorable outcome compared with classical M3 APL? A joint study of the North American Intergroup and the PETHEMA Group
- Chronobiologické aspekty v hematológii
-
Chronická myeloidní leukemie
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle-
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu) - Klinický význam génových mutácií u akútnych myeloidných leukémií s normálnym karyotypom
- Kazuistika: sekundární trombocytopenie a diseminovaná intravaskulární koagulace u pacienta s generalizovaným adenokarcinomem colon descendens
- „Stanovení rezistence na clopidogrel pomocí vícenásobné impedanční a optické transmisní agregometrie“
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



