-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
Daratumumab – Hope for Myeloma Patients, a Challenge for Clinical Laboratories
Monoclonal antibodies represent a standard part in the treatment of oncologic patients, but their efficacy in multiple myeloma used to be unsatisfactory. Daratumumab monotherapy was approved by the American FDA in 2015, after unprecedented results were obtained in a heavily pre-treated group of patients. In 2016 daratumumab was approved in combination with lenalidomide and dexamethasone, or bortezomib and dexamethasone, for the treatment of myeloma patients who have received at least one prior therapy.The toxicity of the drug is low, and is dominated by infusion-related reactions in more or less half of patients. The development as well as the management of these sometimes urgent reactions is described in depth in this review. As multiple myeloma is characterized by the presence of paraprotein (monoclonal antibody) and CD38 is a ubiquitous antigen, several unexpected complications have been reported during the administration of the drug. In this review, we aim to describe and offer some solutions for the complications that may be encountered during daratumumab treatment, such as interference with serum protein electrophoresis and immunofixation assays that may confuse the assessment of the hematological response, interference with blood compatibility testing that may cause a delay in the delivery of compatible transfusions, and difficulties that may occur in flow cytometric analysis of minimal residual disease. Because of the high activity of daratumumab and its expected widespread use, clinicians should be aware of its side effects and their management. It is also very important to inform colleagues in clinical laboratories about the initiation of daratumumab treatment in particular patient.
Key words:
multiple myeloma – daratumumab – infusion related reaction – flow cytometry – transfusion
This work was supported by the Czech Ministry of Education, Youth and Sports (project no. IRP - 201550) and by the Czech Ministry of Health (15-29667A).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Accepted:
22. 8. 2016Submitted:
12. 5. 2016
Autoři: T. Jelínek 1,2; M. Kořístka 3; Z. Čermáková 3; R. Hájek 1
Působiště autorů: Klinika hematoonkologie LF OU a FN Ostrava 1; Přírodovědecká fakulta OU v Ostravě 2; Krevní centrum, FN Ostrava 3
Vyšlo v časopise: Klin Onkol 2017; 30(1): 13-19
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko201713Souhrn
Monoklonální protilátky jsou standardní součástí léčby celé řady onkologických onemocnění, u mnohočetného myelomu byly však po dlouhou dobu neúspěšné. Daratumumab v monoterapii byl schválen v roce 2015 americkou FDA na základě bezprecedentních výsledků u značně předléčené skupiny pacientů, a stal se tak novou nadějí pro tyto nemocné. Následně byl v roce 2016 schválen i v kombinaci s lenalidomidem a dexametazonem nebo s bortezomibem a dexametazonem v prvním relapsu onemocnění. Jako prakticky jediný nežádoucí účinek byly pozorovány tzv. reakce spojené s infuzí, které se objevily u cca poloviny léčených. Vzhledem k tomu, že mnohočetný myelom je typický přítomností paraproteinu (monoklonální protilátky) a že CD38 je všudypřítomný antigen, vyvstaly nečekané potíže, a to zejména pro pracovníky klinických laboratoří. V tomto souhrnném sdělení jsou rozebrány situace, které lze očekávat při podání daratumumabu, stejně jako jejich řešení. Interference s elektroforézou a imunofixací může komplikovat hodnocení léčebné odpovědi, interference v transfuzním lékařství může způsobit potíže s včasným výdejem kompatibilních transfuzních přípravků a problémy lze rovněž očekávat při hodnocení minimální reziduální nemoci pomocí flow cytometrie. Vzhledem k potenciálu daratumumabu lze předpokládat jeho široké použití, a je proto nutné počítat s jeho specifickými efekty. Rovněž je zásadní informovat své kolegy z klinických laboratoří o léčbě daratumumabem u konkrétního pacienta.
Klíčová slova:
mnohočetný myelom – daratumumab – reakce spojené s infuzí – flow cytometrie – transfuzeÚvod
Mnohočetný myelom (multiple myeloma – MM) s incidencí cca 6 případů na 100 000 obyvatel patří mezi nejčastější hematologické malignity spolu s chronickou lymfocytární leukemií a difuzním velkobuněčným B lymfomem [1,2]. Léčba tohoto onemocnění patří k jedné z nejdynamičtěji se rozvíjejících oblastem klinické onkologie. Celkové přežití (overall survival – OS) nemocných s MM se neustále prodlužuje, medián OS u pacientů schopných podstoupit ASCT je 6–8 let [3]. V případě nejintenzivnější možné léčby – tzv. Total Therapy 3 žije až polovina nemocných s příznivými prognostickými faktory více než 10 let [4].
K již standardně používaným lékům (proteazomový inhibitor – PI: bortezomib a imunomodulační látky – IMiD: thalidomid, lenalidomid) se přidaly novější generace těchto látek – carfilzomib a pomalidomid, které jsou již dostupné i v ČR [5,6]. A jen v roce 2015 byly schváleny americkou FDA hned čtyři nové molekuly: 1. perorální inhibitor proteazomu ixazomib; 2. inhibitor histon deacetyláz panobinostat a 3. dvě monoklonální protilátky elotuzumab (anti-CS1) a daratumumab (anti-CD38). Jak panobinostat, tak monoklonální protilátky představují látky se zcela odlišným mechanizmem účinku než látky standardně užívané.
Daratumumab byl první monoklonální protilátkou schválenou k léčbě MM. Tato anti-CD38 protilátka představuje jednu z nejslibnějších molekul u MM a lze očekávat, že bude schválena i v dalších indikacích. Vzhledem k minimální toxicitě je ideální do kombinace se standardně užívanými léky [7]. Během testování v rámci klinických studií vyšly najevo i nečekané vedlejší efekty, které představují výzvu hlavně pro pracovníky v klinických laboratořích [8,9]. V tomto souhrnném sdělení bude stručně popsán mechanizmus účinku i dosavadní klinické výsledky daratumumabu. Pozornost bude věnována praktickému řešení situací vzniklých v souvislosti s užitím této látky, zejména z klinického hlediska nejdůležitější řešení s infuzí spojených reakcí a interference s testem kompatibility před podáním krevní transfuze. Dále interference s imunofixačním a elektroforetickým vyšetřením při hodnocení hematologické odpovědi či problematika flow cytometrické analýzy zejména při stanovení minimální reziduální nemoci (minimal residual disease – MRD).
Antigen CD38 a mechanizmus účinku daratumumabu
Daratumumab (Genmab/Janssen) je lidská IgG1κ monoklonální protilátka cílená proti CD38, což je membránový glykoprotein o molekulární hmotnosti 46 kDa [10]. Kromě daratumumabu jsou ve vývoji i další anti-CD38 cílené protilátky. Nejdále z nich a s velmi podobnými výsledky jako daratumumab je isatuximab (SAR650984, Sanofi), poté MOR202 (Morhosys) a Ab79 (Takeda).
CD38 je fylogeneticky nevšedně zakonzervovaný antigen, který byl v prakticky nezměněné podobě nalezen rovněž u 700 milionů let starého měkkýše (rod Aplysia) a jeho absence je neslučitelná s lidským životem [11]. Tento antigen se ubikvitně nachází na buňkách imunitního systému, ale i na erytrocytech, trombocytech a rovněž na celé řadě dalších tkání, jako jsou epiteliální buňky prostaty, β buňky pankreatu, osteoklasty, buňky hladkého i příčně pruhovaného svalstva či Purkyňovy buňky [12]. Exprese CD38 je spojována s celou řadou patologických stavů, jako je HIV infekce, diabetes mellitus 2. typu, autoimunitní onemocnění, ale zejména s hematologickými malignitami (chronická lymfocytární leukemie, lymfom z plášťových buněk, akutní lymfoblastická leukemie, Waldenstromova makroglobulinemie) [13–15]. Míra exprese tohoto antigenu je však zdaleka nejvyšší na plazmatických buňkách, což z něj dělá ideální cíl pro terapii monoklonálními protilátkami.
CD38 antigen má dvě základní funkce: 1. receptor účastnící se mezibuněčných interakcí a transmembránové signalizace; 2. ektoenzym regulující cytoplazmatickou koncentraci kalcia [16], nicméně jeho kompletní role není zcela prozkoumána. Mimo jiné může představovat jakýsi most mezi vrozenou a adaptivní imunitou [11].
Daratumumab, podobně jako další monoklonální protilátky, zabíjí cílové buňky pomocí několika mechanizmů účinku. ADCC (antibody-dependent cell-mediated cytotoxicity) je v zásadě zabití protilátkou označené buňky pomocí cytotoxických efektorových buněk, nejčastěji uvolněním obsahu cytotoxických granul. Efektorové buňky podílející se na ADCC jsou nejčastěji NK buňky, monocyty, makrofágy a neutrofily. ADCP (antibody-dependent cellular phagocytosis), tedy makrofágy zprostředkovaná fagocytóza, se zdá být velmi rychlý, potentní a rovněž klinicky významný mechanizmus akce daratumumabu [17]. CDC (complement-dependent cytotoxicity) představuje další mechanizmus účinku, kdy po navázání protilátky na cílovou buňku dojde k aktivaci komplementového systému. Celá komplementová kaskáda končí vytvořením tzv. membránu atakujícího komplexu – doslova vytvořením děr v membráně a lýze cílové buňky [18]. Mezi další mechanizmy účinku daratumumabu patří přímá indukce apoptózy v protilátkami označených buňkách a ovlivnění aktivity cílového proteinu na povrchu buněk [19].
Vzhledem k tomu, že NK buňkami zprostředkovaná ADCC představuje důležitý mechanizmus účinku, lze očekávat synergizmus s látkami, které ovlivňují imunitní systém zejména ve smyslu aktivace NK a T buněk. Lenalidomid se zdá být výhodnějším partnerem do kombinace než bortezomib, což vyplývá zatím zejména z preklinických dat [20]. Potenciálně vhodnými partnery jsou i anti-KIR monoklonální protilátky jako IPH2102 či PD-1/PD-L1 inhibitory [21,22].
Klinické výsledky
Monoterapie
Na rozdíl od elotuzumabu prokázal daratumumab výjimečnou účinnost i v monoterapii [23]. První klinická studie fáze I/II byla provedena u pacientů s relabovaným/refrakterním MM (RRMM), přičemž do její druhé části bylo zařazeno 72 značně předléčených pacientů s mediánem 4 předchozích linií léčby. Při dávce daratumumabu 16 mg/kg bylo dosaženo celkové hematologické odpovědi (objective response rate – ORR) u 36 % pacientů, medián přežití bez progrese (progression-free survival – PFS) byl 5,7 měsíce, 1leté OS 77 %. S infuzí spojené reakce se objevily u 71 % nemocných, v naprosté většině byly velmi mírné (grade 1, 2; 1 % případů grade 3) [24].
Studie Sirius zkoumala rovněž účinnost daratumumabu (16 mg/kg) v monoterapii u 106 pacientů s mediánem 5 předchozích linií léčby (80 % nemocných s předchozí ASCT, 95 % dvojitě refrakterních k PIs i IMiDs). ORR byla pozorována u 29 % pacientů, medián PFS byl 3,7 měsíce a 1leté OS 65 %. S infuzí spojené reakce se objevily u 42 % pacientů a byly dobře zvladatelné (většina grade 1, 2; 5 % grade 3). Toxicita daratumumabu byla minimální, dobře zvladatelná, většina ostatních nežádoucích účinků byla očekávatelná u takto předléčené skupiny pacientů [25].
Na základě těchto výsledků byl v listopadu 2015 daratumumab schválen americkou FDA k léčbě MM pacientů, kteří prodělali min. 3 léčebné linie obsahující jak proteazomový inhibitor, tak imunomodulační látku, anebo dvojitě refrakterních pacientů k PIs a IMiDs.
Kombinovaná léčba
První studie testující kombinaci daratumumabu s lenalidomidem a dexametazonem byla studie fáze I/II (GEN 503), v jejíž druhé části bylo léčeno 32 RRMM pacientů s mediánem 2 předchozích léčebných linií. ORR byla 81 % (26/32), přičemž 25 % (8/32) pacientů dosáhlo stringentní kompletní remise (sCR), 9 % (2/32) kompletní remise (CR) a 28 % (9/32) dosáhlo velmi dobré parciální remise (VGPR). PFS a OS v 18 měsících byl 72, resp. 90 %. S infuzí spojené reakce se objevily u 56 % pacientů (většina grade 1, 2; 6 % grade 3), jeden pacient byl vyřazen ze studie pro laryngeální edém. Přidání daratumumabu bylo spojeno se zvýšením kvality léčebných odpovědí, přičemž toxicita této kombinace zůstává velmi dobře zvladatelná [26].
Průběžné výsledky kombinace daratumumabu s pomalidomidem a dexametazonem byly zveřejněny na konferenci Americké hematologické společnosti (ASH) v roce 2015. Do této studie fáze Ib bylo zatím zařazeno 77 pacientů s mediánem 3,5 předchozích léčebných linií. ORR byla 58,5 % u 53 evaluovatelných pacientů se 7,5 % CR. Přidání daratumumabu neznamenalo zvýšení toxicity režimu kromě specifických, s infuzí spojených reakcí, které se objevily u 61 % nemocných [27].
Recentně byly publikovány výsledky dvou velkých randomizovaných studií fáze III (CASTOR a POLLUX), které potvrdily vynikající účinnost daratumumabu. První z nich zkoumala přidání daratumumabu ke kombinaci bortezomibu s dexametazonem u pacientů s RRMM. Do studie bylo zařazeno 498 pacientů s mediánem 2 předchozích linií léčby, přičemž daratumumab signifikantně zvýšil jak ORR (83 vs. 63 %; p < 0,0001), tak prakticky zdvojnásobil množství VGPR (59 vs. 29 %; p < 0,0001) i ≥ CR (19 vs. 9 %; p = 0,0012) ve prospěch DVd vs. Vd. Daratumumab rovněž signifikantně prodloužil medián PFS (61% snížení rizika progrese či smrti; HR 0,39). Reakce spojené s infuzí se objevily u 45 % pacientů, v 91 % byly grade 1/2 [28].
Druhá studie srovnávala kombinaci lenalidomid + dexametazon s nebo bez daratumumabu. Celkem bylo zařazeno 569 pacientů s mediánem 1 předchozí linie. Přidání daratumumabu signifikantně zvedlo ORR (93 vs. 76 %; p < 0,0001), stejně tak množství VGPR (76 vs. 44 %; p < 0,0001) a CR (43 vs. 19 %; p < 0,0001) a znamenalo přibližně stejné zlepšení mediánu PFS jako předchozí studie (HR 0,37). Rovněž množství reakcí spojených s infuzí (infusion-related reactions – IRRs) bylo srovnatelné [29].
Zmíněné výsledky jsou přehledně zobrazeny v tab. 1.
Tab. 1. Dosavadní výsledky klinických hodnocení. 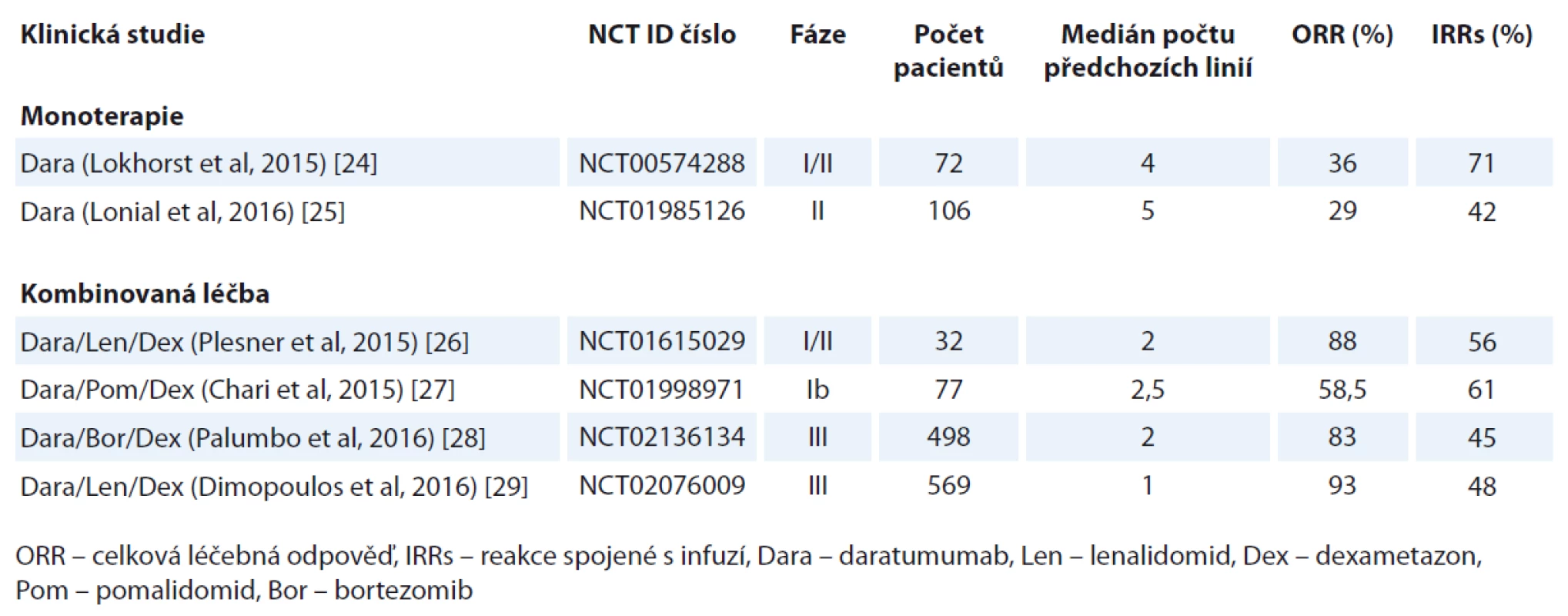
Na základě těchto výsledků v listopadu 2016 americká FDA schválila daratumumab v kombinaci s lenalidomidem a dexametazonem nebo s bortezomibem a dexametazonem u MM pacientů, kteří absolvovali alespoň jednu předchozí léčebnou linii.
Nežádoucí účinky a jejich řešení
Klasické nežádoucí účinky jsou při podání daratumumabu minimální. Z vážnějších grade 3/4 nežádoucích účinků byly nejčastěji pozorovány neutropenie, trombocytopenie, anémie a infekční komplikace (pneumonie), jejichž výskyt je dán spíše pokročilostí základního onemocnění než přímou toxicitou daratumumabu [24,25]. Vedle relativně očekávatelných nežádoucích reakcí spojených s podáním monoklonální protilátky, stejně jako v případě rituximabu či obinutuzumabu znamenalo podání daratumumabu i nečekané a specifické vedlejší efekty, jež mohou interferovat s mnohými laboratorními technikami a tak negativně ovlivňovat celý léčebný proces.
Reakce spojené s infuzí (IRRs)
Ačkoliv je CD38 velmi promiskuitní antigen nacházející se na celé řadě buněk různých tkání, toxicita daratumumabu je minimální, a to jak v monoterapii, tak v kombinaci s lenalidomidem a dexametazonem. Starší pacienti snášejí podávání daratumumabu bez větších potíží, tedy vyšší věk myelomových pacientů neznamená překážku v léčbě. Renální insuficience by neměla být důvodem redukce dávky farmaka, nicméně výsledky klinických studií u této skupiny nemocných zatím nejsou k dispozici [9]. Podobně jako u rituximabu či výrazněji obinutuzumabu (obě anti-CD20) je podání této anti-CD38 monoklonální protilátky poměrně často spojeno s výskytem nežádoucí reakce (IRR). Nejčastějšími projevy jsou teplota, zimnice, rinitida, faryngitida, kašel či zvracení, z vážnějších přechodný bronchospazmus a laryngospazmus s projevy dušnosti. V publikovaných studiích s daratumumabem v monoterapii se vyskytly u 42, resp. u 71 % pacientů, a to v naprosté většině v průběhu první infuze. Dominantně byly mírného grade 1–2, v ojedinělých případech vážnější grade 3, nikdy však nebyly důvodem pro ukončení léčby [24,25]. Pro srovnání se známými anti-CD20 monoklonálními protilátkami, ve studii CLL 11 byl výskyt IRRs u rituximabu 27 % (3 % grade ≥ 3) a u obinutuzumubu 65 % (20 % grade ≥ 3) [29]. Patofyziologickým podkladem těchto reakcí bude pravděpodobně, stejně jako v případě anti-CD20 protilátek, náhlé uvolnění velkého množství prozánětlivých cytokinů jako IL-6, IL-8, TNF-α a IFN-γ [30].
Vzhledem k tomu, že rychlost podání infuze je jedním z důležitých rizikových faktorů, první aplikace daratumumabu by měla být velmi pomalá (v průběhu klinického hodnocení průměrně 6–7 hod). Při dalších podáních je možno infuzi zrychlit dle individuálních možností pacienta na cca 3 hod [24]. V rámci prevence IRR jsou rutinně podávány kortikoidy, antihistaminika a paracetamol 30–60 min před zahájením infuze, podobně jako u rituximabu. U pacientů s astma bronchiale či chronickou obstrukční plicní nemocí (CHOPN) s FEV1 (sekundová vitální kapacita) ≤ 80 % lze zvážit preventivní inhalaci β2-mimetik či kortikoidů po dokapání infuze daratumumabu. Pacienti s CHOPN a FEV1 ≤ 50 % a pacienti se střední a těžkou formou perzistentního astma bronchiale byli vyřazeni z registračních studií, proto je nutno pečlivě zvážit podání daratumumabu takto fragilním nemocným.
Pokud dojde k reakci spojené s infuzí, je nutno přerušit infuzi daratumumabu, dle závažnosti reakce podat další kortikoidy, antihistaminika či antipyretika. V případě hypotenze podat intravenózně tekutiny. Po překonání této reakce obnovit infuzi daratumumabu rychlostí nižší (cca poloviční), než při které došlo ke komplikacím. Pokud dojde k respiračním potížím, lze podat inhalačně bronchodilatancia, event. pacienta promptně hospitalizovat a zajistit intenzivní monitoraci vitálních funkcí [9,25]. V již zmíněných studiích nebylo nutno ani v jednom případě ukončit léčbu z důvodu IRR, nicméně jejich četnost je vysoká, a proto je nutná adekvátní erudice ošetřujícího personálu.
Interference s ELFO a imunofixací
Elektroforéza bílkovin séra (ELFO, SPEP) a imunofixace (IFE) jsou rutinně používané metody ke zjištění přítomnosti monoklonálního proteinu (M-protein, MIg, paraprotein) a ke konfirmaci CR po vymizení paraproteinu v rámci hodnocení léčebné odpovědi [30]. Je nutné si uvědomit, že daratumumab je monoklonální imunoglobulin IgGκ, který může: 1. komigrovat s pacientovým paraproteinem, a vést tak k artificiálnímu nadhodnocení množství MIg (sérové koncentrace daratumumabu dosahují až 1 g/l), a 2. mimikovat přítomnost patologického paraproteinu, který již ve skutečnosti přítomen není, a tak falešně podhodnocovat množství kompletních odpovědí na léčbu [24,31,32].
Ve snaze o adekvátní zhodnocení množství CR byla vyvinuta nová esej – tzv. DIRA (daratumumab IFE reflex assay). V principu je v průběhu imunofixace séra přidána myší anti-dara protilátka, která po navázání posune daratumumab mimo oblast, kde migruje patologický pacientův paraprotein, tak aby bylo možné tyto dva monoklonální proteiny odlišit. DIRA by měla být provedena u všech pacientů s IgGκ paraproteinem, kteří dosáhli hluboké odpovědi a u nichž klesla hladina MIg pod 2 g/l [33]. Velmi důležité je rovněž informovat laboratorního specialistu o léčbě daratumumabem u konkrétního pacienta.
Interference s flow cytometrickým hodnocením
Imunofenotypizační vyšetření má u MM poměrně silnou pozici, a to jak v rámci diagnostiky, tak v poslední době zejména při hodnocení léčebné odpovědi, tzv. MRD. Pacienti, kteří dosáhnou MRD negativity, mají signifikantně delší OS, než ti, kteří zůstanou pozitivní po ukončení léčby [34–36]. Hodnocení MRD pomocí průtokové cytometrie má celou řadu výhod oproti molekulárně-genetickým metodám (dostupnost, jednoduchost, cena, rychlost i použitelnost prakticky u všech pacientů) a postupně se stává standardní součástí léčebného postupu [37].
Vzhledem k tomu, že exprese CD38 na plazmatických buňkách je daleko vyšší než na ostatních leukocytech, je tento antigen rutinně používán k identifikaci a kvantifikaci této buněčné populace [38]. Daratumumab přetrvává v těle pacienta až 6 měsíců po ukončení léčby, což komplikuje zejména hodnocení MRD, a to dvěma základními mechanizmy: 1. vazbou na CD38 antigen na povrchu plazmocytů brání navázání diagnostické anti-CD38 protilátky, pokud sdílejí tentýž epitop; 2. způsobuje tzv. shedding – tedy snížení exprese tohoto antigenu. Bylo vynaloženo mnoho úsilí, jak obejít tento problém. Jednou z možností je najít jiný důvěryhodný marker, pomocí něhož lze bezpečně identifikovat plazmocyty. Jako adekvátní se osvědčil pouze CD229 [39]. Nicméně jeho inkorporace do MRD panelu nebyla možná, protože v pozici pro FITC místo CD38 nefungoval adekvátně (osobní komunikace, dr. Bruno Paiva, 15. březen 2016). Další cestou byl vývoj multi-epitopové diagnostické anti-CD38 protilátky, což je v podstatě směs protilátek proti různým epitopům na povrchu CD38 antigenu. Tato protilátka je již komerčně dostupná (Cytognos) [40]. Postup, kterým se bude ubírat diagnostika MRD, je použití této protilátky v rámci povrchového barvení v kombinaci s cytoplazmatickým barvením CD38 dohromady v kanálu pro FITC (osobní komunikace, dr. Bruno Paiva, 15. březen 2016). Tímto způsobem by měly být event. reziduální maligní plazmocyty bezpečně identifikovány a hodnocení MRD proveditelné u pacientů léčených daratumumabem.
Interference v transfuzním lékařství
Komplexní předtransfuzní vyšetření (AB0, RhD, screening nepravidelných protilátek proti erytrocytům, zkouška kompatibility) je nezbytné pro zajištění kompatibilních erytrocytových transfuzních přípravků (TP). U vzorků pacientů léčených daratumumabem byla pozorována významná interference pouze v nepřímém antiglobulinovém testu (NAT), který v nejsenzitivnější podobě jako LISS-NAT (NAT s použitím erytrocytů v roztoku o nízké iontové síle) představuje standardní referenční techniku pro vyšetření screeningu protilátek a zkoušky kompatibility [41].
Daratumumab se váže na CD38 diagnostických a dárcovských erytrocytů (z TP), na kterých je exprimován v individuálně malém množství a způsobuje v LISS-NAT polymorfní obraz panreaktivity. Takto zabrzdí jak včasnou přípravu kompatibilních erytrocytových TP, tak zkomplikuje následnou identifikaci protilátek, kde imituje pestrou škálu imunohematologických nálezů a současně maskuje zejména slabé erytrocytové protilátky. Většina pacientů má pozitivní přímý antiglobulinový test (PAT) s průkazem senzibilizace jen IgG a pozitivní test autokontroly (reakce plazmy či séra pacienta a jeho erytrocytů v LISS-NAT) (obr. 1). Pozitivita NAT zprostředkovaného daratumumabem přetrvává po dobu až 6 měsíců od ukončení léčby [8,42].
Obr. 1. Identifikace erytrocytových protilátek na gelové kartě DG Gel (Grifols) – nediagnostický nález příčinou daratumumabu interferujícího v LISS-NAT. 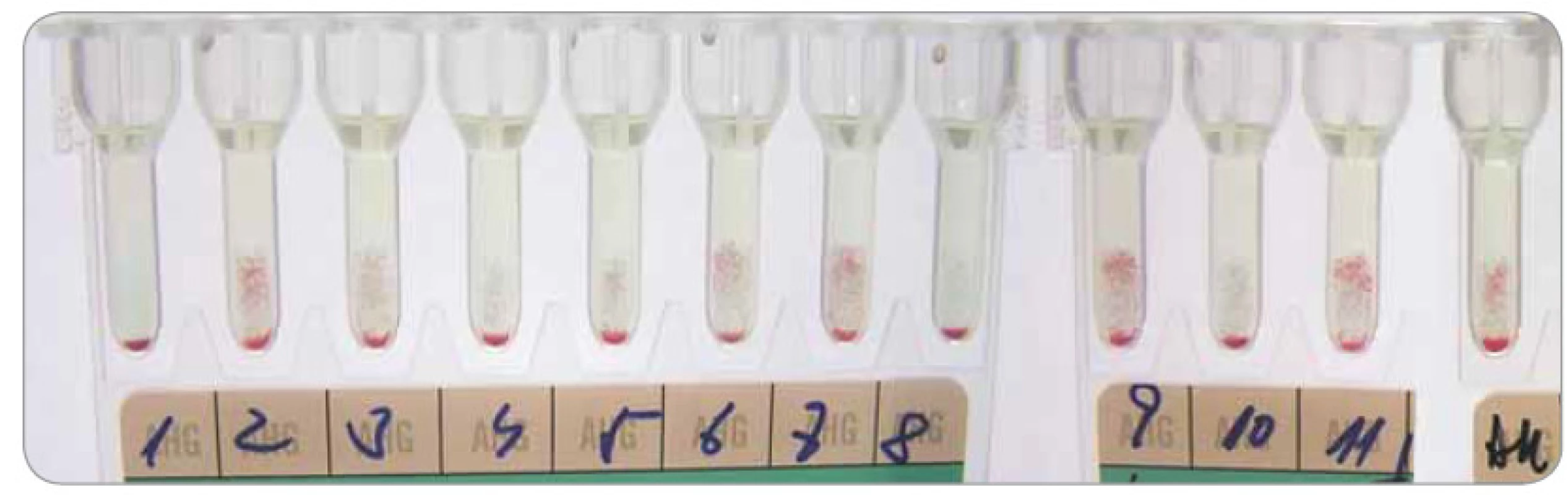
Vzhledem k výše uvedenému je nejlepší provést vstupní imunohematologická vyšetření (AB0, RhD a screening/event. identifikace protilátek, PAT, fenotypizace/event. genotypizace antigenů systémů Rh a Kell, případně Jk, Fy, MNS) ještě před zahájením léčby daratumumabem, a tím si dopředu zajistit dostupnost antigenně kompatibilních erytrocytových TP.
V nouzových situacích, kdy je nutné zjistit, co se skrývá za clonou daratumumabu, je k dispozici pouze jediná cesta – tzv. DTT protokol (zrušení interference daratumumabu pomocí dithiothreitolu). Tato metoda však není běžně dostupná, je časově i technicky náročná, navíc DTT destruuje antigeny Kell, což může být nevýhodné pro příjemce s fenotypem KK (riziko aloimunizace erytrocyty kk, Kk).
Faktem je, že u žádného z pacientů léčených daratumumabem a erytrocytovými TP nebyly pozorovány laboratorní nebo klinické známky klinicky významné potransfuzní hemolýzy [42,43].
Závěr
Daratumumab se stal první monoklonální protilátkou schválenou k léčbě MM, a to jak v monoterapii, tak v rámci kombinovaných režimů. V současné době probíhá celá řada klinických hodnocení fáze III (tab. 2) a nejnovější bezprecedentní výsledky kombinační terapie nasvědčují tomu, že bude daratumumab schválen i v dalších indikacích. Toxicita léku je minimální, nejčastější jsou reakce spojené s infuzí, které jsou však dobře zvladatelné, vyskytující se cca u poloviny pacientů, téměř vždy během prvního podání a zcela sporadicky vedoucí k přerušení léčby. Dalším klinicky významným vedlejším efektem daratumumabu je interference v rámci předtransfuzního vyšetření, což může způsobit potíže s vydáním kompatibilního TP. Zvláště zde jakožto i u dalších projevů interference platí důležitost informovat pracovníky klinické laboratoře o podávání daratumumabu příslušnému pacientovi. Vzhledem k očekávanému širokému použití této monoklonální protilátky pravděpodobně dojde ke změně v panelu protilátek používaného při flow cytometrické analýze MRD. Daratumumab se tak stává novou nadějí pro nemocné s MM, ale také přináší mnohé výzvy jak pro lékaře a sestry, tak pro pracovníky klinických laboratoří.
Tab. 2. Probíhající klinické studie fáze III s daratumumabem. 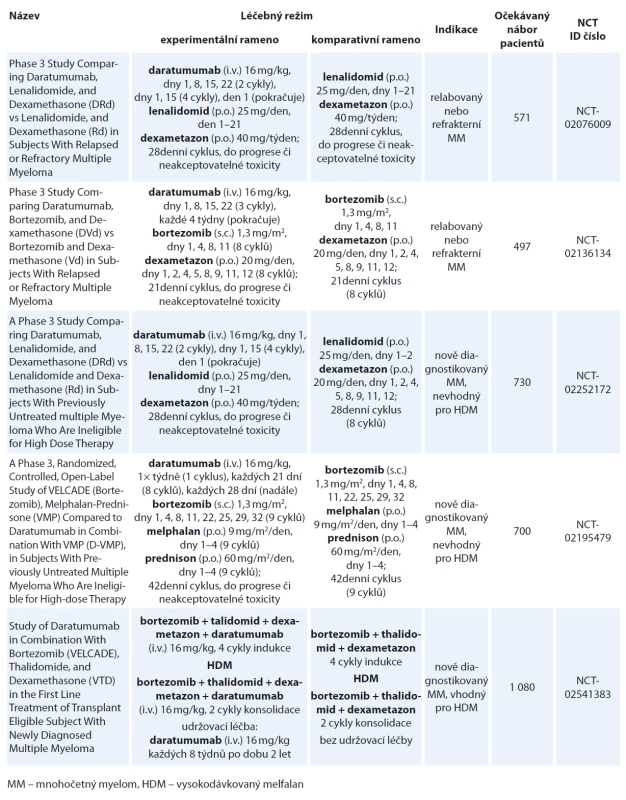
Práce vznikla za podpory Institucionálního rozvojového plánu OU v Ostravě, finanční prostředky přiděluje MŠMT (projekt č. IRP201550), a dále za finanční podpory Ministerstva zdravotnictví ČR (15-29667A).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 12. 5. 2016
Přijato: 22. 8. 2016
MUDr. Tomáš Jelínek
Klinika hematoonkologie
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: tomas.jelinek@fno.cz
Zdroje
1. Sant M, Allemani C, Tereanu C et al. Incidence of hematologic malignancies in Europe by morphologic subtype: results of the HAEMACARE project. Blood 2010; 116 (19): 3724–3734. doi: 10.1182/blood-2010-05-282632.
2. Hájek R, Krejcí M, Pour L et al. Multiple myeloma. Klin Onkol 2011; 24 (Suppl): S10–S13.
3. San-Miguel JF, Mateos MV. Can multiple myeloma become a curable disease? Haematologica 2011; 96 (9): 1246–1248. doi: 10.3324/haematol.2011.051169.
4. Barlogie B, Mitchell A, van Rhee F et al. Curing myeloma at last: defining criteria and providing the evidence. Blood 2014; 124 (20): 3043–3051. doi: 10.1182/blood-2014-07-552059.
5. Sedlarikova L, Kubiczkova L, Sevcikova S et al. Mechanism of immunomodulatory drugs in multiple myeloma. Leuk Res 2012; 36 (10): 1218–1224. doi: 10.1016/j.leukres.2012.05.010.
6. Kubiczková L, Matějíková J, Sedlaříková L et al. Proteasome inhibitors in treatment of multiple myeloma. Klin Onkol 2013; 26 (1): 11–18. doi: 10.14735/amko201311.
7. Jelinek T, Hajek R. Monoclonal antibodies – a new era in the treatment of multiple myeloma. Blood Rev 2016; 30 (2): 101–110. doi: 10.1016/j.blre.2015.08.004.
8. Hannon JL, Clarke G. Transfusion management of patients receiving daratumumab therapy for advanced plasma cell myeloma. Transfusion 2015; 55 (11): 2770. doi: 10.1111/trf.13267.
9. van de Donk NW, Moreau P, Plesner T et al. Clinical efficacy and management of monoclonal antibodies targeting CD38 and SLAMF7 in multiple myeloma. Blood 2016; 127 (6): 681–695. doi: 10.1182/blood-2015-10-646810.
10. Malavasi F, Funaro A, Roggero S et al. Human CD38: a glycoprotein in search of a function. Immunol Today 1994; 15 (3): 95–97.
11. Malavasi F, Deaglio S, Funaro A et al. Evolution and function of the ADP ribosyl cyclase/CD38 gene family in physiology and pathology. Physiol Rev 2008; 88 (3): 841–886. doi: 10.1152/physrev.00035.2007.
12. Deaglio S, Mehta K, Malavasi F. Human CD38: a (r) evolutionary story of enzymes and receptors. Leuk Res 2001; 25 (1): 1–12.
13. Lin P, Owens R, Tricot G et al. Flow cytometric immunophenotypic analysis of 306 cases of multiple myeloma. Am J Clin Pathol 2004; 121 (4): 482–488.
14. Damle RN, Wasil T, Fais F et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94 (6): 1840–1847.
15. Marinov J, Koubek K, Starý J. Immunophenotypic significance of the “lymphoid” CD38 antigen in myeloid blood malignancies. Neoplasma 1993; 40 (6): 355–358.
16. Deaglio S, Zubiaur M, Gregorini A et al. Human CD38 and CD16 are functionally dependent and physically associated in natural killer cells. Blood 2002; 99 (7): 2490–2498.
17. Overdijk MB, Verploegen S, Bögels M et al. Antibody-mediated phagocytosis contributes to the anti-tumor activity of the therapeutic antibody daratumumab in lymphoma and multiple myeloma. MAbs 2015; 7 (2): 311–321. doi: 10.1080/19420862.2015.1007813.
18. de Weers M, Tai YT, van der Veer MS et al. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol Baltim Md 1950; 186 (3): 1840–1848.
19. van de Donk NW, Janmaat ML, Mutis T et al. Monoclonal antibodies targeting CD38 in hematological malignancies and beyond. Immunol Rev 2016; 270 (1): 95–112.
20. Nijhof IS, Groen RW, Noort WA et al. Preclinical evidence for the therapeutic potential of CD38-targeted immuno-chemotherapy in multiple myeloma patients refractory to lenalidomide and bortezomib. Clin Cancer Res 2015; 21 (12): 2802–2810. doi: 10.1158/1078-0432.CCR-14-1813.
21. Nijhof IS, Lammerts van Bueren JJ, van Kessel B et al. Daratumumab-mediated lysis of primary multiple myeloma cells is enhanced in combination with the human anti-KIR antibody IPH2102 and lenalidomide. Haematologica 2015; 100 (2): 263–268. doi: 10.3324/haematol.2014.117531.
22. Jelinek T, Hajek R. Monoclonal antibodies – a new era in the treatment of multiple myeloma. Blood Rev [online]. [cited 2015 Dec 9]. Available from: www.bloodreviews.com/article/S0268960X1500065X/abstract.
23. Zonder JA, Mohrbacher AF, Singhal S et al. A phase 1, multicenter, open-label, dose escalation study of elotuzumab in patients with advanced multiple myeloma. Blood 2012; 120 (3): 552–559. doi: 10.1182/blood-2011-06-360552.
24. Lokhorst HM, Plesner T, Laubach JP et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015; 373 (13): 1207–1219. doi: 10.1056/NEJMoa1506348.
25. Lonial S, Weiss BM, Usmani SZ et al. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet 2016; 387 (10027): 1551–1560. doi: 10.1016/S0140-6736 (15) 01120-4.
26. Plesner T, Arkenau HT, Gimsing P et al. Phase 1/2 study of daratumumab, lenalidomide, and dexamethasone for relapsed multiple myeloma. Blood 2016; 128 : 1821–1828. doi: 10.1182/blood-2016-07-726729.
27. Chari A, Lonial S, Suvannasankha A et al. Open-label, multicenter, phase 1b study of daratumumab in combination with pomalidomide and dexamethasone in patients with at least 2 lines of prior therapy and relapsed or relapsed and refractory multiple myeloma. Blood 2015; 126 (23): 508.
28. Palumbo A, Chanan-Khan A, Weisel K et al. Daratumumab, bortezomib, and dexamethasone for multiple myeloma. N Engl J Med 2016; 375 (8): 754–766. doi: 10.1056/NEJMoa1606038.
29. Dimopoulos MA, Oriol A, Nahi H et al. Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016; 375 (14): 1319–1331. doi: 10.1056/NEJMoa1607751.
30. Durie BG, Harousseau JL, Miguel JS et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20 (9): 1467–1473.
31. McCudden CR, Voorhees PM, Hainsworth SA et al. Interference of monoclonal antibody therapies with serum protein electrophoresis tests. Clin Chem 2010; 56 (12): 1897–1899. doi: 10.1373/clinchem.2010.152116.
32. Ruinemans-Koerts J, Verkroost C, Schmidt-Hieltjes Y et al. Interference of therapeutic monoclonal immunoglobulins in the investigation of M-proteins. Clin Chem Lab Med 2014; 52 (11): e235–e237. doi: 10.1515/cclm-2013-0898.
33. van de Donk NW, Otten HG, El Haddad O et al. Interference of daratumumab in monitoring multiple myeloma patients using serum immunofixation electrophoresis can be abrogated using the daratumumab IFE reflex assay (DIRA). Clin Chem Lab Med 2016; 54 (6): 1005–1109. doi: 10.1515/cclm-2015-0888.
34. Paiva B, van Dongen JJ, Orfao A. New criteria for response assessment: role of minimal residual disease in multiple myeloma. Blood 2015; 125 (20): 3059–3068. doi: 10.1182/blood-2014-11-568907.
35. Paiva B, Vidriales MB, Cerveró J et al. Multiparameter flow cytometric remission is the most relevant prognostic factor for multiple myeloma patients who undergo autologous stem cell transplantation. Blood 2008; 112 (10): 4017–4023. doi: 10.1182/blood-2008-05-159 624.
36. Arroz M, Came N, Lin P et al. Consensus guidelines on plasma cell myeloma minimal residual disease analysis and reporting. Cytometry B Clin Cytom 2016; 90 (1): 31–39. doi: 10.1002/cyto.b.21228.
37. Paiva B, Puig N, García-Sanz R et al. Is this the time to introduce minimal residual disease in multiple myeloma clinical practice? Clin Cancer Res 2015; 21 (9): 2001–2008. doi: 10.1158/1078-0432.CCR-14-2841.
38. Rawstron AC, Orfao A, Beksac M et al. Report of the European Myeloma Network on multiparametric flow cytometry in multiple myeloma and related disorders. Haematologica 2008; 93 (3): 431–438. doi: 10.3324/haematol.11080.
39. Pojero F, Flores-Montero J, Sanoja L et al. Utility of CD54, CD229, and CD319 for the identification of plasma cells in patients with clonal plasma cell diseases. Cytometry B Clin Cytom 2016; 90 (1): 91–100. doi: 10.1002/cyto.b.21269.
40. Anti-human CD38 multi-epitope reagent [Internet]. [cited 2016 Mar 19]. Available from: www.cytognos.com/index.php/en/reagents/antibodies/1446-anti-human-cd38-multiepitope-reagent.
41. Oostendorp M, Lammerts van Bueren JJ, Doshi P et al. When blood transfusion medicine becomes complicated due to interference by monoclonal antibody therapy. Transfusion 2015; 55 (6 Pt 2): 1555–1562. doi: 10.1111/trf.13150.
42. Chapuy CI, Nicholson RT, Aguad MD et al. Resolving the daratumumab interference with blood compatibility testing. Transfusion 2015; 55 (6 Pt 2): 1545–1554. doi: 10.1111/trf.13069.
43. De Vooght KM, Oostendorp M, van Solinge WW. Dealing with anti-CD38 (daratumumab) interference in blood compatibility testing. Transfusion 2016; 56 (3): 778–779. doi: 10.1111/trf.13474.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
- Epitelo-mezenchymální tranzice v nádorové tkáni a její role při metastatickém šíření karcinomů
- Možnosti chemoterapie v léčbě karcinomu prostaty
- Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
- Rozdiely vo vekovej distribúcii, onkologických diagnózach a štádiu ochorenia medzi rómskymi a nerómskymi onkologickými pacientmi registrovanými na ambulantnom onkologickom oddelení v Poprade v rokoch 2014 a 2015 – retrospektívna štúdia
- Rozdiely v incidencii a biologických charakteristikách karcinómu prsníka medzi rómskymi a nerómskymi pacientkami na Slovensku
- Editorial
- Analytická interference může vést k diagnostice lymfoproliferativního onemocnění
- Vhodný pacient pro léčbu abirateron acetátem
- Studie NOR-SWITCH – další důkaz noninferiority biosimilárního infliximabu vůči originálu
- Aktuality z odborného tisku
- Vzpomínka na prof. Umberta Veronesiho
- Spomienka na doc. MUDr. Ivana Pleška, DrSc.
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Profesor MUDr. Jiří Zámečník, CSc. – významné životní jubileum
- Fotonová radioterapie kraniospinální osy s využitím dávkových gradientů
- VÝSLEDKY SOUTĚŽE O NEJLEPŠÍ PRÁCI V ROCE 2016
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
- Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
- Epitelo-mezenchymální tranzice v nádorové tkáni a její role při metastatickém šíření karcinomů
- Vhodný pacient pro léčbu abirateron acetátem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



