-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky v klasifikaci adenokarcinomů plic a potenciální prognostické a prediktivní faktory u nemalobuněčných plicních karcinomů
News in the classification of pulmonary adenocarcinomas and potential prognostic and predictive factors in non-small lung cancer
Lung cancers are still divided into two major subgroups:
small-cell and non-small cell lung cancer (NSCLC) irrespective of biological heterogeneity of NSCLC. It is a key task of the pathologist to provide an accurate classification of tumorous lesions to avoid the term NSCLC and to use it only in the vast minority of cases. Moreover, the most recent reclassification of pulmonary adenocarcinomas should be reflected in the standard biopsy protocol reporting. There is also an increasingly urgent need to provide high quality material for testing of the genetic characteristics of NSCLC, especially the presence and functional status of the EGFR receptor (epidermal growth factor receptor), as well as other potential prognostic markers. The requirement for the quality and swiftness of diagnosis puts major emphasis on the close multidisciplinary collaboration with the central role of a specialized pathologist, who coordinates the differential-diagnostic procedure. This in turn implies the necessity of accounting for the increasing financial burden of diagnostic departments.Keywords:
lung cancer – adenocarcinoma – classification – prognostic factors – EGFR
Autoři: Škarda J.ihash2ihash4ihash6 1 1 1 2
Působiště autorů: Ústav klinické a molekulární patologie a Laboratoř molekulární patologie LF UP a FN Olomouc, Oddělení patologie a molekulární medicíny, Fakultní Thomayerova nemocnice s poliklinikou, Praha 1
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 4, p. 168-172
Kategorie: Přehledový článek
Souhrn
Vzhledem ke stále ještě používanému dělení karcinomů plic na malobuněčné a nemalobuněčné (NSCLC, non-small cell lung cancer) je klíčovou úlohou patologa přesnější zařazení nádorové léze tak, aby termín NSCLC byl užíván pouze v naprosté minoritě případů. Recentně došlo k reklasifikaci plicních adenokarcinomů a tyto nové trendy by měly být zohledněny ve standardních výsledkových protokolech bioptických vyšetření. Naléhavě stoupá potřeba zajištění dostatečného množství kvalitního materiálu pro testování genetických vlastností NSCLC, v první řadě přítomnosti a funkčního stavu receptoru pro EGFR (epidermal growth factor receptor), a také jiných potenciálních prognostických a prediktivních markerů. Požadavek na kvalitní diagnózu a rychlost testování klade zásadní důraz na úzkou multioborovou spolupráci, v jejímž centru je specializovaný patolog koordinující celý diferenciálně-diagnostický postup. Z toho ovšem plyne i nutnost zohlednění nárůstu finančního zatížení diagnostikujících pracovišť.
Klíčová slova:
karcinom plic – adenokarcinom – klasifikace – prognostické faktory – EGFRDůvody ke změně klasifikace plicních adenokarcinomů
Karcinomy plic jsou celosvětově nejčastější příčinou mortality na nádorová onemocnění (1,2). Kromě malobuněčného karcinomu je rozeznávána heterogenní skupina plicních karcinomů nazývaných nemalobuněčné (NSCLC – non-small cell lung cancer). Adenokarcinom je nejčastějším histologickým subtypem NSCLC a reprezentuje téměř polovinu všech plicních nádorů. Adenokarcinomy plic představují širokou skupinu vysoce odlišných nádorových entit. Přes významný pokrok ve studiu těchto nádorů v uplynulém desetiletí přetrvává potřeba sjednocení všeobecně uznávaných kritérií pro jednotlivé subtypy adenokarcinomů. Nejvýraznější je tato změna v případě nádorů dříve klasifikovaných jako bronchioloalveolární karcinom (BAC) (3,4).
Základem nejnovější klasifikace jsou sice histologická kritéria, avšak výsledná verze byla vyvinuta konsenzuálně ve spolupráci s klinickými pneumoonkology, radiology, molekulárními biology a chirurgy. Komplexní úsilí a multidisciplinární přístup vedly k vývoji terminologie a klasifikace, která nejen definuje jednotlivé patologické entity, ale poskytuje současně potřebné informace důležité pro léčbu pacienta. Součástí klasifikace jsou zároveň doporučení pro strategickou manipulaci se vzorky a návrhy vyšetřovacích postupů s ohledem na rozšiřující se spektrum nových biologických léčiv. Navíc obsahuje doporučení, jak zacházet s malými bioptickými vzorky a cytologiemi v managementu diagnostického procesu plicních nádorů. Přibližně 70 % karcinomů plic je totiž v současnosti diagnostikováno z malé biopsie nebo cytologie (5), kde podrobnější zařazení NSCLC bývá mnohdy svízelné. Vzhledem k novým diagnostickým a léčebným modalitám je však nutné bližší určení subtypu NSCLC provést, protože například v rámci odhadu reakce na léčbu tyrozinkinázovými inhibitory EGFR (epidermal growth factor receptor) je důležité rozlišení karcinomu se skvamocelulární diferenciací od adenokarcinomu a nemalobuněčného karcinomu blíže nespecifikovaného (NOS) u pacientů v pokročilém stádiu nádorového onemocnění. Pro zkušeného patologa je relativně snadné odlišit dobře nebo středně diferencovaný skvamocelulární karcinom od adenokarcinomu již ze standardního barvení, diagnóza však může být problematická až nemožná u hůře diferencovaných nádorů. V malých biopsiích a/nebo cytologických vzorcích je stále 10–30 % vzorků diagnostikováno jako NSCLC-NOS (6). Právě v těchto případech je indikováno užití speciálních histochemických a imunohistochemických metod, které bližší zařazení subtypu NSCLC umožní. Na druhou stranu je nutné zdůraznit, že zachování co možná největšího množství nádorové tkáně pro následné molekulárně-patologické vyšetření má prioritu před dokonalou subtypizací. Je právě nejdůležitějším a nejnáročnějším úkolem pneumopatologa najít kompromis, kolik vyšetřovacích metod zvolit a kolik jich užívat, aby molekulárnímu biologovi dodal co možná nejvíce nádorové tkáně co nejlépe subtypizovaného karcinomu.
Z recentních údajů vyplývá, že více než 90 % plicních adenokarcinomů spadá do kategorie smíšených subtypů podle klasifikace WHO z roku 2004. Proto bylo konsenzuálně navrženo provádět procentuální semikvantitativní hodnocení různých histologických komponent: acinární, papilární, mikropapilární, lepidické a solidní, a klasifikovat nádory podle převládajícího histologického subtypu (11). Uvedený přístup umožní zohlednit histologickou heterogenitu adenokarcinomů plic a pomůže zlepšit korelaci molekulárních a prognostických markerů (11).
Zásadním problémem se ukázal termín bronchioloalveolární karcinom (BAC). Ve WHO klasifikaci z roku 1999 a 2004 (3,4) se termín BAC používal pro široké spektrum nádorů, včetně solitárních neinvazivních periferních plicních nádorů se 100% 5-letým přežitím (8), invazivních adenokarcinomů s minimální invazí, který má rovněž téměř 100% 5-tileté přežití (9,10), ale i u smíšených invazivních adenokarcinomů mucinózního a nemucinózního subtypu (12–15), což jsou nádorová onemocnění s velmi špatnou prognózou (3,4,16). Předešlé studie prokázaly, že pacienti s malými solitárními periferními adenokarcinomy s histologickým obrazem BAC můžou mít 5-leté přežití až 100 % (7,8), rovněž pacienti s tímto typem adenokarcinomů s minimální invazí mají velice příznivé přežití na rozdíl od jiných typů (9,10). Proto je v nové klasifikaci doporučení termín „BAC“ nadále vůbec nepoužívat, aby nedocházelo k záměně různých subtypů nádorů s diametrálně odlišnou prognózou a termín BAC nahradit nově vytvořeným názvem „adenokarcinom s predominantně lepidickým typem růstu (LPA)“.
Klasifikace plicních adenokarcinomů dle doporučení IASLC/ATS/ERS
Souhrn doporučení vyplývající z nového návrhu klasifikace karcinomů plic dle doporučení IASLC (International Association for the Study of Lung Cancer), ATS (American Thoracic Society) a ERS (European Respiratory Society) (17) je následovný (viz tab.1):
- Doporučuje se zcela opustit používání termínu “BAC”. Pro malé (≤3 cm) solitární adenokarcinomy s čistě lepidickým typem růstu bez jednoznačného invazivního růstu používat termín “adenokarcinom in situ (AIS)“. Jde o nádory s excelentní prognózou, které mají po kompletní chirurgické resekci 100% přežití.
- Pro malé (≤3 cm) solitární adenokarcinomy s převažujícím lepidickým růstem a malými ohnisky invaze s menšími než 0,5 cm se doporučuje použít termín “minimálně invazivní adenokarcinom (MIA)”. Ten by měl definovat nádory s velmi dobrou prognózou, u nichž po radikálním chirurgické resekci přežití může dosáhnout až 100 %.
- Pro invazivní adenokarcinomy se doporučuje použít komplexní histologickou subtypizaci založenou na stanovení dominantního histologického obrazu ze všech zastoupených subtypů s tím, že každý další subtyp vyskytující se ve více než 5 % nádorové masy by měl být uveden a mělo by být definováno jeho procentuální zastoupení.
- U pacientů s vícečetnými ložisky plicních adenokarcinomů se rovněž doporučuje použít výše uvedenou komplexní histologickou subtypizaci, která napomůže odlišení histohomologní metastázy od synchronních nebo metachronních primárních tumorů.
- Pro nemucinózní adenokarcinomy dříve klasifikované jako smíšené subtypy s převahou nemucinózního BAC se doporučuje použití termínu LPA bez dalšího upřesnění a termín “smíšený podtyp” nadále nepoužívat.
- Adenokarcinomy dříve klasifikované jako mucinózní BAC by měly být odděleny od adenokarcinomů dříve klasifikoványch jako nemucinózní BAC a v závislosti na rozsahu lepidického nebo invazivního růstu by měly být nadále klasifikovány jako “mucinózní adenokarcinom in situ” nebo “invazivní mucinózní adenokarcinom”.
Tab. 1. Klasifikace plicních adenokarcinomÛ ve vzorcích plicních resekátů navržená dle doporuãení IASLC/ATS/ERS (17). 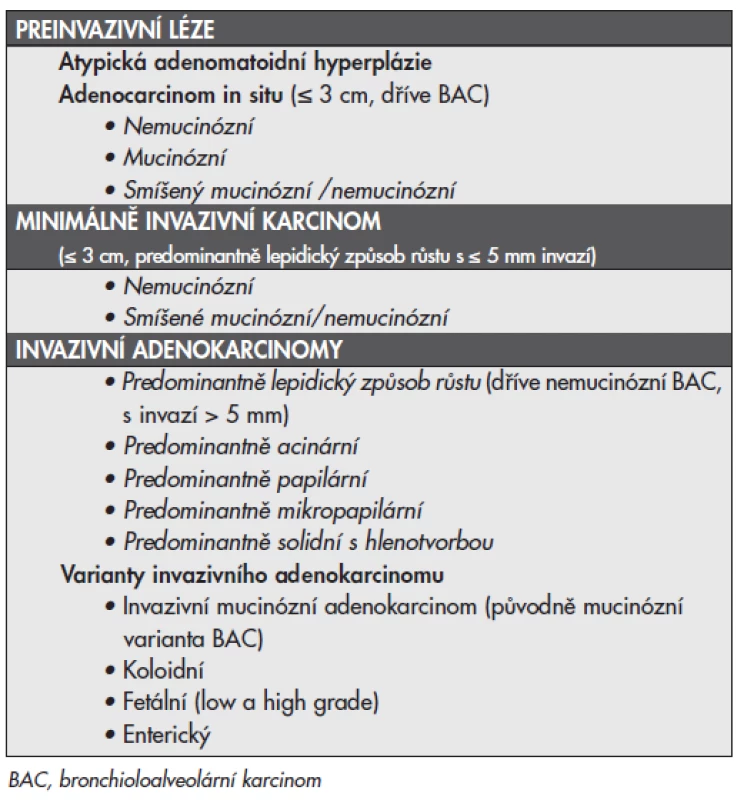
Praktická doporučení pro správné nakládání s malými bioptickými vzorky (17)
Nejdůležitějším doporučením pro malé biopsie a cytologie je, aby se NSCLC dále dělil na konkrétní typ (adenokarcinom či skvamocelulární karcinom), kdykoli je to možné, a aby se termín NSCLC blíže nespecifikovaný (NOS) používal co nejméně. Termín NSCLC-NOS by měl být vyhrazen pouze pro nádory, kdy není možné stanovit přesnější diagnózu ze základní morfologie a/nebo ani s pomocí imunohistochemických metod. Neuroendokrinní imunohistochemické markery by měly být aplikovány pouze v případě, že existuje podezření na neuroendokrinní diferenciaci ze základního morfologického obrazu. Zásadní je rovněž doporučení, aby byly bioptické a cytologické vzorky ze stejné léze optimálně vyšetřovány společně, což může napomoci co nejpřesnější diagnóze. Důležité je také doporučení, aby z veškerého cytologického materiálu včetně pleurálních punkcí byly vždy připraveny cytobloky. V tomto ohledu se bude jednoznačně zvyšovat zásadní potřeba bližší spolupráce mezi diagnostikujícím histopatologem a plicním cytologem.
Pokud je diagnóza stanovena z malé biopsie a/nebo cytologie, měla by být součástí výsledkového protokolu informace, zda byla finální diagnóza stanovena ze základního barvení, nebo zda byly použité speciální metody. Znovu je však potřeba zdůraznit, že vzorky tkáně by měly být k dispozici nejen pro diagnostiku (ta je zásadní), ale také v maximální možné míře pro účely molekulárně-biologického vyšetřování.
Další změny zohledňuje nová klasifikace v terminologii NSCLC, protože má mnohdy zásadní terapeutické konsekvence. Termíny AIS (adenokarcinom in situ) a MIA (minimálně invazivní adenokarcinom) by se neměly používat u malých biopsií nebo v cytologických vzorcích. Pokud je neinvazivní typ nádoru přítomen v malé biopsii, je třeba jej označit jako adenokarcinom s lepidickým typem růstu (LPA) bez další specifikace ohledně invazivního růstu. Termín velkobuněčný karcinom by se neměl používat v případě malých biopsií nebo cytologických vzorků, protože je vyhrazen pouze pro případy, kde byl proveden dostatečný sampling celého resekátu a byla vyloučena původní diferencovaná komponenta nádoru. Termín nonskvamózní karcinom plic by v rutinních diagnostických závěrech neměl být používán, protože se jedná se o klinický termín. Nádory, které vykazují sarkomatoidní charakteristiky, jako např. výraznou jadernou polymorfii, přítomnost obrovských nebo vřetenitých buněk, by měly být zařazeny do kategorie adenokarcinomů nebo skvamocelulárních karcinomů, pokud jsou přítomny morfologické charakteristiky dlaždicobuněčné nebo glandulární diferenciace. Termín špatně diferencovaný nemalobuněčný karcinom s obrovskými a/nebo vřetenitými buňkami (v závislosti na přítomné komponentě) by se měl používat pouze v případě, že nebyly v dostatečném množství vzorků nádoru nalezeny jednoznačné morfologické charakteristiky skvamózní či žlázové diferenciace.
PROGNOSTICKÉ A PREDIKTIVNÍ FAKTORY U NSCLC
Plicní karcinomy a receptor pro epidermální růstový faktor (EGFR)
EGFR (známý také jako ErbB-1 nebo HER1) patří do rodiny receptorů epidermálních růstových faktorů. Tato skupina receptorů hraje významnou úlohu jak v homeostáze normálních tkání, tak v regulaci fetálního vývoje u mnoha druhů organismů, včetně člověka. Gen kódující receptor epidermálního růstového faktoru je lokalizován na chromozomu 7. Aktivace tohoto genu může být způsobena genovou amplifikací, genovou mutací nebo nadprodukcí růstových faktorů, popř. jiných molekul se schopností vazby na receptor. EGFR je protein, který se podílí na ochraně buňky před apoptózou, stimulaci proliferace, angiogenezi, buněčné diferenciaci a migraci. Blokáda EGFR vede naopak ke snížení proliferace, angiogeneze, metastazování a k indukci apoptózy. Změny exprese receptoru EGFR doprovází často vznik a rozvoj řady karcinomů. Jeho ovlivnění je klíčovým cílem biologické léčby u mnoha nádorových onemocnění. Zvýšená exprese EGFR v nádorové tkáni má u četných typů nádorů negativní prognostický význam.
EGFR je aktivován růstovými faktory (ligandy), které se váží na jeho extracelulární část. Intracelulární část receptoru je po aktivaci vnější části autofosforylována a zároveň může docházet k dimerizaci receptorů. Tím je zahájena transdukční dráha, při které dochází k přenosu signálu z povrchu buňky do jejího jádra. Výsledkem tohoto procesu je aktivace transkripce cílových genů, které buď přímo kódují proteiny, nebo ovlivňují jejich transkripci (transkripční faktory), translaci, popř. ovlivňují posttranslační úpravy.
V současné době je známo několik typů mutantních forem EGFR, které se zřejmě podílejí přímo na procesu vzniku a rozvoje nádoru a které jsou zřejmě významné pro rezistenci nádorových buněk k některým typům protinádorové terapie. Poznatky o těchto specifických mutacích se proto velmi rychle dostávají do klinické praxe a jejich rutinní testování se jeví u většiny případů plicních adenokarcinomů jako zcela nezbytné vzhledem k rozšiřujícímu se spektru nových cílených léčiv. Nasazení mnohých léčiv je již nyní často (a bude stále více) přímo podmíněno zjištěním mutačního stavu EGFR.
Plicní karcinomy s ALK translokacemi
U minoritní části plicních nádorů byla zjištěná malá inverze chromozomu 2p, která vede ke vzniku fúzního genu EML4-ALK. Výsledkem dimerizace je vznik fúzního proteinu s určitou aktivitou. Uvedené změny se vyskytují u 5 % plicních adenokarcinomů, častěji u mužů, nekuřáků v mladším věku, bez ohledu na histologický subtyp (18–21). Zůstává zatím otázkou, zda skvamocelulární karcinomy také obsahují EML4-ALK translokaci. Detekce EML4-ALK translokace může být provedená pomocí několika metod včetně imunohistochemie, FISH, a RT-PCR (20–23). Většina nádorů s EML4-ALK translokací je pozitivních v reakci s TTF-1, avšak může být také p63 pozitivní (20,24). Nádory s EML4-ALK translokací nemají povětšinou EGFR a KRAS mutace a mají nižší frekvence mutací p53 (18,20,24,25). Nedávno byla zjištěna de novo mutace v oblasti EML4-ALK, která je odpovědná za rezistenci na léčbu inhibitory ALK (26).
Další potenciální molekulárně biologické prognostické faktory u NSCLC
Studiu prognostického významu imunohistochemické detekce potenciálních prediktivních markerů jako jsou EGFR (27), TTF-1 (28), p21ras (29), HER2 (30), p53 (27,31), Ki-67 (32), Bcl-2 (33) a cyklooxygenázy 2 (34) byly věnované rozsáhlé metaanalýzy. Doposud však nebyl jednoznačné prokázaný jejich význam (17).
MET proteinový produkt protoonkogenu c-met je transmembránový tyrozinkinázový receptor, jehož ligandem je hepatocytární růstový faktor. U NSCLC je MET zvýšeně exprimován a tato exprese je spojena s častými recidivami a krátkodobým přežíváním. Před nedávnem byla jako důsledek amplifikace c-met popsána rezistence na gefitinib. Preklinické údaje prokázaly, že inhibice MET může citlivost ke gefitinibu obnovit.
KRAS je protein, jehož hlavním významem je přenos signálů v rámci dráhy EGFR. Mutace genů KRAS jsou detekovány u 20–30 % případů NSCLC. Otázky vztahu mutací genu pro KRAS a predikcí k chemorezistenci nejsou dostatečně objasněny. Některé studie však korelaci mutačního statutu KRAS a rezistencí k tyrozinkinázovým inhibitorům receptorů EGFR, resp. k neúčinnosti léčby těmito inhibitory potvrdily.
Již delší dobu jsou popisovány vztahy autofagie a tumorigeneze (35). V nedávné době byla publikována řada prací popisujících autofagické proteiny jako prognostické markery (36,37). Byly potvrzeny předpoklady, že by proteiny, podílející se na autofagii, mohly mít u některých nádorových onemocnění prognostický význam. U NSCLC byl tento význam potvrzen pro protein LC3A, který je důležitou součástí autofagozomálních membrán, a je využíván jako marker autofagie. Karpathiou et al. v roce 2010 popsali silnou korelaci mezi zastoupením tzv. „stone-like“ struktur a nízkým přežíváním pacientů ve stadiích I a II NSCLC (38).
Dalším proteinem s prognostickým významem u NSCLC je BNIP3. Jedná se o proapoptotický mitochondriální protein, který je nadměrně exprimován v hypoxických oblastech nádorů. V těchto oblastech bývá často aktivována autofagie, proto se předpokládá jeho zapojení v těchto procesech. U raných stádií operabilních nemalobuněčných karcinomů plic (T1,2 - N0,1 - M0) byla prokázána silná korelace mezi expresí BNIP3 a nízkým celkovým přežíváním (39). U pokročilejších stádií NSCLC se tento prognostický význam neprokázal (40).
INHIBICE BUNĚČNÉHO RECEPTORU – MODERNÍ TERAPEUTICKÁ STRATEGIE
V klinické praxi se u NSCLC uplatňují zejména inhibitory tyrozinkináz (TKI), které blokují fosforylaci intracelulární domény EGFR receptoru. V lidském genomu je kolem 500 proteinových kináz, z nichž je 90 tyrozinkináz. Inhibitory těchto kináz mohou blokovat buď jediný typ receptoru, nebo více receptorů současně. V současné době jsou testovány desítky molekul, ale v praxi se u NSCLC používají jen léky blokující signální dráhu receptoru EGFR a léky inhibující růstový faktor cévního endotelu (vascular endothelial growth factor – VEGF).
EGFR je exprimován nejen u >80 % případů NSCLC, ale je také exprimován u řady dalších karcinomů. Proto je receptor pro epidermální růstový faktor a možnosti jeho ovlivnění jedním ze stěžejních cílů výzkumu.
Praktické aspekty testování mutačního statusu EGFR z hlediska patologa
Při setkání pneumoonkologů, patologů a molekulárních biologů 25. 6. 2010 v Čestlicích u Prahy byl navržen konsenzus testovat všechny pacienty, kteří jsou potenciálními kandidáty léčby TKI. Testování mutací EGFR by měla provádět molekulárně-biologická laboratoř, která je schopna provést vyšetření pomocí nejméně dvou na sobě nezávislých metod (např. sekvenováním a RT-PCR) v úzké spolupráci s diagnostikujícím pneumopatologem a pneumoonkologem. Souhrn nejdůležitějších praktických aspektů pro patology, na kterých se účastnící shodli, je následující:
Vhodným materiálem pro molekulárně-genetické vyšetření je jakýkoliv materiál vhodný pro morfologickou diagnózu. Bez kvalitní morfologické diagnózy NSCLC však nelze testovat molekulárně geneticky. Cytologie je ve srovnání s bioptickým vzorkem vhodnější pro molekulárně-genetickou diagnózu, a to jak z hlediska času stanovení diagnózy, tak výtěžnosti kvalitní DNA. Tento aspekt je však třeba porovnat s výrazně nižší diagnostickou výtěžností subtypizace NSCLC, která je z cytologického vyšetření jen omezeně možná zejména v porovnání s bioptickými parafinovými vzorky, proto je optimální kombinovat diagnózu cytologickou a histomorfologickou. Testování lze provést pouze po potvrzení přítomnosti nádorových buněk NSCLC, ideálně po subtypizování NSCLC a určení adenokarcinomu jako převládajícího histologického subtypu. Vyšetřovaný materiál by měl obsahovat nejméně 200–400 nádorových buněk.
ZÁVĚR
Vzhledem k současnému dělení karcinomů plic na malobuněčné a nemalobuněčné je klíčovou úlohou patologa přesnější zařazení nádorové léze tak, aby termín NSCLC byl užíván pouze v naprosté minoritě případů. Kromě toho však naléhavě stoupá potřeba zajištění dostatečného množství kvalitního materiálu pro testování genetických vlastností NSCLC, v první řadě přítomnosti a funkčního stavu receptoru pro EGFR, ale také jiných potenciálních prognostických markerů. Požadavek na kvalitní diagnózu a rychlost testování klade zásadní důraz na úzkou multioborovou spolupráci všech zúčastněných odborníků, v jejímž centru je specializovaný patolog koordinující celý diferenciálně-diagnostický postup. Z toho ovšem plyne i nutnost zohlednění nárůstu finančního zatížení diagnostikujících pracovišť.
Adresa pro korespondenci:
MUDr. et MVDr. Jozef Škarda, Ph.D.
Ústav klinické a molekulární patologie LF UP a FN Olomouc
Hněvotínska 3, 77200 Olomouc
e-mail: jojos@email.cz
Zdroje
1. Boyle P, Levin B. World Cancer Report 2008. Lyon: International Agency for Research on Cancer, 2008.
2. Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin 2005; 55 : 74–108.
3. Travis WD, Colby TV, Corrin B, et al. Histological Typing of Lung and Pleural Tumors. Berlin: Springer, 1999.
4. Travis WD, Brambilla E, Muller-Hermelink HK, et al. Pathology and Genetics. Tumours of the Lung, Pleura, Thymus and Heart. Lyon, France: IARC Press, 2004.
5. Shah PL, Singh S, Bower M, et al. The role of transbronchial fine needle aspiration in an integrated care pathway for the assessment of patients with suspected lung cancer. J Thorac Oncol 2006; 1 : 324–327.
6. Cataluna JJ, Perpina M, Greses JV, et al. Cell type accuracy of bronchial biopsy specimens in primary lung cancer. Chest 1996; 109 : 1199–1203.
7. Koike T, Togashi K, Shirato T, et al. Limited resection for noninvasive bronchioloalveolar carcinoma diagnosed by intraoperative pathologic examination. Ann Thorac Surg 2009; 88 : 1106–1111.
8. Noguchi M, Morikawa A, Kawasaki M, et al. Small adenocarcinoma of the lung. Histologic characteristics and prognosis. Cancer 1995; 75 : 2844–2852.
9. Borczuk AC, Qian F, Kazeros A, et al. Invasive size is an independent predictor of survival in pulmonary adenocarcinoma. Am J Surg Pathol 2009; 33 : 462–469.
10. Yim J, Zhu LC, Chiriboga L, et al. Histologic features are importantprognostic indicators in early stages lung adenocarcinomas. Mod Pathol 2007; 20 : 233–241.
11. Motoi N, Szoke J, Riely GJ, et al. Lung adenocarcinoma: modification of the 2004 WHO mixed subtype to include the major histologic subtype suggests correlations between papillary and micropapillary adenocarcinoma subtypes, EGFR mutations and gene expression analysis. Am J Surg Pathol 2008; 32 : 810–827.
12. Goldstein NS, Mani A, Chmielewski G, et al. Prognostic factors in T1 NO MO adenocarcinomas and bronchioloalveolar carcinomas of thelung. Am J Clin Pathol 1999; 112 : 391–402.
13. Clayton F. Bronchioloalveolar carcinomas. Cell types, patterns of growth, and prognostic correlates. Cancer 1986; 57 : 1555–1564.
14. Manning JT Jr, Spjut HJ, Tschen JA. Bronchioloalveolar carcinoma Br J Cancer: the significance of two histopathologic types. Cancer 1984; 54 : 525–534.
15. Goldstein NS, Thomas M. Mucinous and nonmucinous bronchioloalveolar adenocarcinomas have distinct staining patterns with toroid transcription factor and cytokeratin 20 antibodies. Am J Clin Pathol 2001; 116 : 319–325.
16. Travis WD, Rekhtman N, Riley GJ, et al. Pathologic diagnosis of advanced lung cancer based on small biopsies and cytology: a paradigma shift. J Thorac Oncol 2010; 5 : 411–414.
17. Travis WD et al. International association for the study of lung cancer/american thoracic society/European respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011; 6(2): 244–288.
18. Rodig SJ, Mino-Kenudson M, Dacic S, et al. Unique clinicopathologic features characterize ALK-rearranged lung adenocarcinoma in the western population. Clin Cancer Res 2009; 15 : 5216–5223.
19. Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4 - ALK. J Clin Oncol 2009; 27 : 4247–4253.
20. Takahashi T, Sonobe M, Kobayashi M, et al. Clinicopathologic features of non-small-cell lung cancer with EML4-ALK fusion gene. Ann Surg Oncol 2010; 17 : 889–897.
21. Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK lung cancers are characterized by rare other mutations, a TTF-1 cell lineage, an acinar histology, and young onset. Mod Pathol 2009; 22 : 508–515.
22. Nakatani Y, Kitamura H, Inayama Y, et al. Pulmonary adenocarcinomas of the fetal lung type: a clinicopathologic study indicating differences in histology, epidemiology, and natural history of low -grade and high-grade forms. Am J Surg Pathol 1998; 22 : 399–411.
23. Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers. J Thorac Oncol 2008; 3 : 13–17.
24. Yoshida A, Tsuta K, Watanabe SI, et al. Frequent ALK rearrangement and TTF-1/p63 co-expression in lung adenocarcinoma with signet-ring cell component. Lung Cancer. In press 2011.
25. Wong DW, Leung EL, So KK, et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS. Cancer 2009; 115 : 1723–1733.
26. Choi YL, Soda M, Yamashita Y, et al. EML4-ALK mutations in lung cancer that confer resistance to ALK inhibitors. N Engl J Med 2010; 363 : 1734–1739.
27. Meert AP, Martin B, Mitsudomi T, et al. Prognostic significance of p53 alterations in patients with non-small cell lung cancer: a metaanalysis. Clin Cancer Res 2000; 6 : 4055–4063.
28. Berghmans T, Paesmans M, Mascaux C, et al. Thyroid transcription factor 1 - a new prognostic factor in lung cancer: a meta-analysis. Ann Oncol 2006; 17 : 1673–1676.
29. Mascaux C, Iannino N, Martin B, et al. The role of RAS oncogene in survival of patients with lung cancer: a systematic review of the literature with meta-analysis. Br J Cancer 2005; 92 : 131–139.
30. Nakamura H, Kawasaki N, Taguchi M, et al. Association of HER-2 overexpression with prognosis in nonsmall cell lung carcinoma: a metaanalysis. Cancer 2005; 103 : 1865–1873.
31. Steels E, Paesmans M, Berghmans T, et al. Role of p53 as a prognostic factor for survival in lung cancer: a systematic review of the literature with a meta-analysis. Eur Respir J 2001; 18 : 705–719.
32. Martin B, Paesmans M, Mascaux C, et al. Ki-67 expression and patients survival in lung cancer: systematic review of the literature with meta-analysis. Br J Cancer 2004; 91 : 2018–2025.
33. Martin B, Paesmans M, Berghmans T, et al. Role of Bcl-2 as a prognostic factor for survival in lung cancer: a systematic review of the literature with meta-analysis. Br J Cancer 2003; 89 : 55–64.
34. Mascaux C, Martin B, Paesmans M, et al. Has Cox-2 a prognostic role in non-small-cell lung cancer? A systematic review of the literature with meta-analysis of the survival results. Br J Cancer 2006; 95 : 139–145.
35. Kondo Y, Kanzawa T, Sawaya R, Kondo S. The role of autophagy in cancer development in response to therapy. Nature Cancer 2005; 5 : 726–733.
36. Sivridis E, Koukourakis MI, Zois CE, et al. LC3A-positive light microscopy detected patterns of autophagy and prognosis in operable breast carcinomas. Am J Pathol 2010; 176 : 2477–2489.
37. Giatromanolaki A, Koukourakis MI, Harris AL, Polychronidis A, Gatter KC, Sivridis E. Prognostic relevance of light chain 3 (LC3A) autophagy pattern in colorectal adenocarcinomas. J Clin Pathol 2010; 63 : 867–872.
38. Karpathiou G, Sivridis E, Koukourakis M, Mikroulis M, Bouros D, Froudarakis, et al. LC3SA autophagic activity and prognostic signifikance in non-small cell lung carcinomas. Chest 2011. In press.
39. Giatromanolaki A, Koukourakis MI, Sowter HM, Sivridis E, Gibbson S, Gatter KC, et al. BNIP3 expression In Linked with hypoxia-Regulated protein Expression and with Poor Prognosis in Non-Small Cell Lung Cancer. Clin Canc Res 2004; 10 : 5566–5571.
40. Überall I, Kolek V, Klein J, et al. The immunohistochemical expression of BNIP3 protein in non-small-cell lung cancer: a tissue microarray study. APMIS 2010; 118 : 565–570.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek PATOLOGIE MAMMYČlánek CYTODIAGNOSTIKAČlánek PATOLOGIE GITČlánek HEPATOPATOLOGIEČlánek PATOLOGIE GITČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek PATOLOGIE ORL OBLASTIČlánek DERMATOPATOLOGIEČlánek Carneyho komplex
Článok vyšiel v časopiseČesko-slovenská patologie

2011 Číslo 4-
Všetky články tohto čísla
- Terapeuticko-indikační patologie – “from bench to bedside”
- Karcinom pankreatu je zatím smutnou kapitolou medicíny
- HEMATOPATOLOGIE, ENDOKRINOPATOLOGIE, GYNEKOPATOLOGIE...
- Zjednodušené schéma receptorových mechanismů a intracelulárních signálních drah v nádorové buňce s možnými cíli biologické léčby
- Prediktivní diagnostika u karcinomu prsu
- Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu
- PATOLOGIE MAMMY
- Molekulární prediktory cílené anti-EGFR terapie u metastatického kolorektálního karcinomu
- CYTODIAGNOSTIKA
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- PATOLOGIE GIT
- Cielená liečba melanómu: fakt alebo fikcia?
- HEPATOPATOLOGIE
- Novinky v klasifikaci adenokarcinomů plic a potenciální prognostické a prediktivní faktory u nemalobuněčných plicních karcinomů
- PATOLOGIE GIT
- Klinické registry jako nezbytná podpora personalizované medicíny
- JAKÁ JE VAŠE DIAGNÓZA?
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- JAKÁ JE VAŠE DIAGNÓZA? - ODPOVĚĎ
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
- PATOLOGIE ORL OBLASTI
- Intraperikardiální teratom jako příčina intrauterinního odumření – kazuistika
- DERMATOPATOLOGIE
- Carneyho komplex
- Primárna sklerozujúca cholangitída
- UROPATOLOGIE, GYNEKOPATOLOGIE, HEMATOPATOLOGIE, NEUROPATOLOGIE, ORTOPEDICKÁ PATOLOGIE
- Profesor Habanec osmdesátiletý
- K životnému jubileu prof. MUDr. Štefana Galbavého, DrSc.
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Carneyho komplex
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- Prediktivní diagnostika u karcinomu prsu
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



