-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a v kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek II*
Advances in the use of instrumental measurement of colour in the development, production and quality control of drugs, medicinal preparations and pharmaceutical auxiliary substances II*
The paper summarizes the use of instrumental colour measurement in the field of pharmaceuticals of natural origin and other substances of natural origin beneficial for health in recent 10 years. Colour measurement in this field was most frequently employed in the monitoring of various aspects of the process of drying of medicinal plants and their parts.
Keywords:
colour measurement • colour spaces • medicinal plants
Autoři: Jan Šubert; Jozef Čižmárik
Vyšlo v časopise: Čes. slov. Farm., 2014; 63, 107-112
Kategorie: Přehledy a odborná sdělení
*Část I: Čes. slov. Farm. 2013; 62, 65–70.
Souhrn
Příspěvek shrnuje využití instrumentálního měření barevnosti v oblasti přírodních léčiv a dalších zdraví prospěšných látek přírodního původu v posledních 10 letech. Nejčastěji se měření barevnosti v této oblasti uplatnilo při sledování různých aspektů procesu sušení léčivých rostlin a jejich částí.
Klíčová slova:
měření barevnosti • barevné prostory • léčivé rostlinyÚvod
Instrumentální měření v trichromatickém systému významně zvyšuje možnosti objektivního posuzování barevnosti a jejích změn. Přesto dosud není ani v oblasti léčiv, léčivých přípravků a dalších zdraví prospěšných látek přírodního původu instrumentální měření barevnosti běžně používanou metodou. Výjimkou je sledování procesů sušení léčivých a dalších rostlin a přípravků obsahujících zdraví prospěšné látky přírodního původu, výsledky z této oblasti však většinou byly publikovány v jiném než farmaceutickém odborném tisku. Příspěvek navazuje na předchozí zpracování problematiky1) a shrnuje vývojové trendy a aplikace od roku 2004. I v této oblasti převládalo ve sledovaném období využití parametrů barevného prostoru CIE L*a*b*, CIELAB (v polárních souřadnicích CIE L*C*h, CIELCH). Často používán je i zde barevný prostor podle Huntera (Hunter L, a, b). Barevné prostory RGB a CIE XYZ nebyly využívány v aplikacích z dané oblasti často a další barevné prostory, jako ANLAB2), HSV3), YIQ3), CIEDE20004) a YCbCr3, 5) jen ojediněle. Barevné prostory RGB, HSV, YIQ, CIELAB a YCbCr (charakterizace včelích medů)3), CIELCH a CIELAB (identifikace některých typů medů)6), RGB a CIE XYZ (hodnocení jakosti tradičních čínských léčiv)7) či RGB a YCbCr (identifikace rostlin používaných k léčbě revmatoidní artritidy)5) byly v kombinaci s dalšími postupy východiskem k novým klasifikačním a kontrolním postupům. Souběžně ale nejsou různé barevné prostory používány velmi často (jako další příklady kdy ano, mohou být prostory CIE XYZ, CIELAB, Hunter L, a, b, ANLAB, CIELCH v práci2) RGB, HSV, YIQ, CIELAB, YCbCr3), CIE XYZ, Yxy, CIELAB, CIELCH, Hunter8) nebo RGB, CIE XYZ, CIELAB, CIELCH)9). Kolorimetrické parametry byly získávány téměř výlučně přímým měřením specializovanými měřidly, výpočtem ze spekter odrazu či prostupu získaných spektrofotometricky jen výjimečně. I v oblasti přírodnin jsou rozvíjeny aplikace založené na obrazové analýze, příklady mohou být práce3, 4, 7, 9–11).
Číselný popis barvy léčivých a zdraví prospěšných přírodních produktů a jejích změn v důsledku technologických procesů
Souřadnice barevného prostoru CIELAB a parametr C* byly použity v rámci snahy o standardizaci propolisu k číselnému popisu barvy většího počtu vzorků a jejich rozdělení na dva základní typy lišící se mimo barvu antioxidační aktivitou a obsahem některých důležitých látek12). Několik další prací bylo věnováno kolorimetrickému popisu a charakterizaci různých typů včelího medu pocházejícího z odlišných zdrojů a lokalit. Uplatnily se přitom parametry barevných prostorů CIELAB3, 13, 14) CIELAB/CIELCH6), anebo CIE XYZ a CIELAB/CIELCH15). Většina aplikací z dané oblasti však byla při popisu a hodnocení barvy plodů či semen léčivých a dalších zdraví prospěšných rostlin. Příkladem mohou být plody bezu černého, jejichž barva byla popsána kolorimetrickými parametry v barevných prostorech CIE XYZ, CIELAB, Hunter L, a, b, ANLAB, CIELCH v práci2), plody 10 genotypů dřínu obecného (popis v prostoru CIELAB hodnotami souřadnic L*, a*, b*)16), dvou druhů dřišťálu popsaných souřadnicemi v barevném prostoru Hunter L, a, b17) anebo plody šesti kultivarů brusnic v prostorech CIELAB a CIEDE20004). V práci18) popisují autoři barvy plodů dvou kultivarů zimolezu modrého v průběhu jejich dozrávání hodnotami souřadnic L*, a*, b* v barevném prostoru CIELAB, v další pak barvu plodů a listů čtyř kultivarů temnoplodce černoplodého19). Zbarvení plodů rakytníku řešetlákového sklizených v různých fázích zralosti je v barevném prostoru CIELAB (hodnoty souřadnic L*, a*, b*) popsáno autory20).
Další skupina prací byla zaměřena na sledování změn zbarvení v průběhu uchovávání plodů či jiného materiálu rostlinného původu. Změny barvy plodů různých kultivarů brusnic při jejich třítýdenním uchovávání popisují v práci4) hodnoty L* a ∆E00. Podstatně dlouhodobější bylo sledování změn barvy a dalších ukazatelů u kořenů křenu selského uchovávaného 10 měsíců při teplotě 0–1 °C, které popisují autoři21) hodnotami souřadnic v barevném prostoru Hunter L, a, b a indexu žlutosti. Změny zbarvení a dalších ukazatelů jakosti potočnice lékařské byly sledovány po jejím blanšírování, zmrazení a uchovávání při teplotách –7 až –30 °C porovnáváním hodnot souřadnic a parametru C v barevném prostoru Hunter L, a, b22). Další práce byly věnovány sledování barevných změn sušeného rostlinného materiálu v závislosti na podmínkách jeho uchovávání. U práškovaných plodů papriky roční byly zjišťovány barevné změny po zvýšení obsahu vlhkosti o 1 – 5 % a sledovány v barevných prostorech CIELAB/CIELCH se závěrem, že až +3 % vlhkosti způsobí signifikantní změny hodnot kolorimetrických parametrů23). U sušeného česneku setého byla sledována kinetika barevných změn při jeho uchovávání v podmínkách teploty 20–50 °C a relativní vlhkosti 30–90 % a popisována souřadnicemi v barevném prostoru Hunter L, a, b, a hodnotami barevného rozdílu ∆E24). Vliv dlouhodobého (24 týdnů) působení vlhkosti (až 75 %) na důležité obsahové látky, mikrobiologickou čistotu a barvu sušených listů jitrocele kopinatého byl sledován s využitím parametrů barevného prostoru CIELAB v práci25). Ve stejném barevném prostoru autoři26) v rámci studia složení a fyzikálně chemických charakteristik popsali hodnotami souřadnic L*, a*, b* barvu oleje ze semen černuchy seté dvojího původu. Vliv stupně fermentace na obsahové látky a další ukazatele byl sledován u čajů z pupečníku asijského, barva vodného výluhu z nefermentovaného, částečně fermentovaného a plně fermentovaného čaje byla popsána hodnotami souřadnic barevného prostoru CIELAB L*, a*, b* a je světlejší než vodné výluhy z čajovníku čínského sledované souběžně27). Obdobný výzkum byl proveden u nálevu z listů čajovníku čínského fermentovaných z 0–80 %, barva vodných výluhů popisovaná hodnotami souřadnic v barevném prostoru CIELAB byla ovlivněna více koncentrací teaflavinu než koncentrací tearubiginu28). V jiné studii kvality nefermentovaných, částečně fermentovaných a fermentovaných čajů z čajovníku čínského (celkem 58 vzorků) byly sledovány hodnoty ∆a, ∆b a ∆L vodných výluhů sledovaných vzorků čajů se závěrem, že jsou dobře použitelnými ukazateli jakosti čajů a hodnoty ∆a výluhů umožňují rozlišení mezi zelenými a černými čaji29). Autoři30) sledovali vliv teploty vody v rozmezí 20–100 °C při extrakci usušené a rozdrobněné kopretiny řimbaby na obsah fenolických látek, parthenolidů a barvu extraktů, k tomu použili kolorimetrické parametry L*, a*, b*, C*, h. Zjistili výraznou změnu barvy extraktů v závislosti na teplotě, při teplotách vody 20–70 °C byly hnědavě zbarvené, při teplotách 80–100 °C byly žlutě zbarvené a světlejší, současně se měnil obsah důležitých účinných látek. Studie31) byla zaměřena na hledání optimálních podmínek (teplota a čas) pro extrakci květů ibišku súdánského vodou a pro koncentrování extraktu. Hodnoty souřadnic L*, a*, b* v barevném prostoru CIELAB se měnily více s teplotou než s dobou extrakce.
Jiným typem prací využívajících instrumentálního měření barevnosti je sledování vlivu různých energetických polí, aplikovaných při mikrobiologické dekontaminaci přírodnin či z jiných důvodů, na barvu vzorku. Paprika roční byla po tepelné sterilizaci uchovávána 3 měsíce při 18–20 °C a v chladničce při 4–6 °C, sledovány byly parametry barevného prostoru CIELAB/CIELCH L*, a*, b*, h32). Kozinec blanitý byl dekontaminován elektronovým paprskem 2–16 kGy, barva vzorků popsaná hodnotami souřadnic v barevném prostoru Hunter L, a, b se v dalším tříměsíčním sledování měnila v zanedbatelné míře33). Ozáření vodných extraktů z usušené a rozdrobněné houby rezavce šikmého gama zářením 3–10 kGy zlepšovalo v míře závislé na dávce záření jejich barevné vlastnosti (nárůst hodnot souřadnic L a b a pokles hodnot souřadnice a v barevném prostoru podle Huntera), mimoto ozáření příznivě ovlivňovalo antioxidační vlastnosti extraktů34). Gama záření (1–50 kGy) bylo použito také k částečné depolymeraci kyseliny hyaluronové, jejíž zbarvení se ozářením měnilo v hodnotách souřadnic barevného prostoru Hunter L, a, b jen mírně35). V další studii byla kyselina hyaluronová depolymerována ozářením elektronovým paprskem, gama zářením, mikrovlnným zářením a teplem a byl sledován vliv těchto zásahů na její zbarvení (Hunter L, a, b) se závěrem, že největší změny (zejména v hodnotě souřadnice b) způsobilo záření mikrovlnné36). Při sledování kinetiky změn barvy ve vodě rozpustných barevných obsahových látek šafránu za zvýšené teploty působením denního světla byly použity parametry barevného prostoru CIELAB/CIELCH a některé další méně běžné kolorimetrické parametry37).
Studium průběhu dehydratace rostlin a jejich částí
Hlavní oblast využití instrumentálního měření barevnosti v oblasti léčiv přírodního původu a jiných zdraví prospěšných přírodnin ve sledovaném období bylo sledování procesů sušení a jiných způsobů dehydratace rostlin a jejich částí. Příklady jsou uvedeny v tabulce 1. Specifickým ukazatelem používaným v některých aplikacích tohoto typu je kolorimetrický index hnědosti BI, který charakterizuje čistotu hnědé barvy jako důležitého ukazatele spojeného s hnědnutím rostlinného materiálu v průběhu jeho sušení. Vyčísluje se jako BI = [(100(x – 0,31)] / 0,17 kde x = (a* + 1,75L*) / 5,645L* + a* – 3,012b* 9, 38–40).
Tab. 1. Využití instrumentálního měření barevnosti při řešení problémů souvisejících se sušením léčivých a dalších zdraví prospěšných rostlin 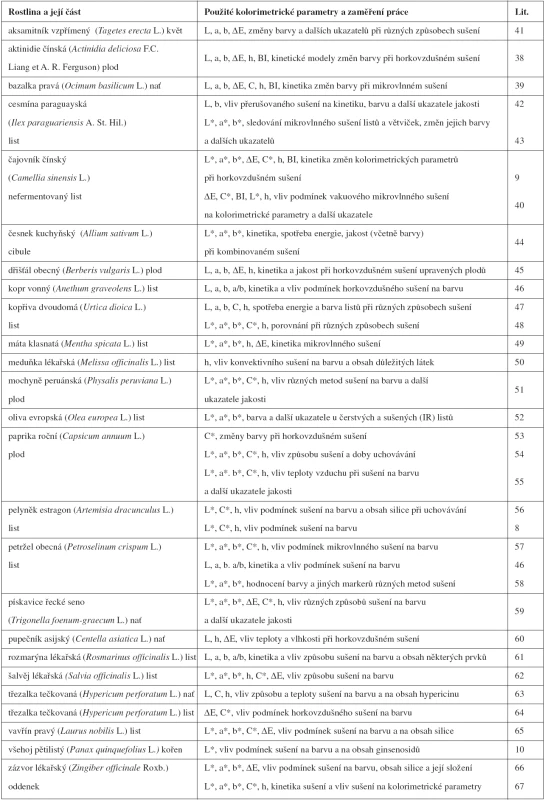
Mimo aplikace uvedené v tabulce 1 bylo instrumentální měření barevnosti použito v četných dalších pracech obdobného zaměření, např. u rakytníku řešetlákového (L*, a*, b*, ∆E)68), tužebníku jilmového a vrby bílé Hunter (L, a, b, C, h)69) a jiných léčivých a zdraví prospěšných rostlin a jejich částí70–72), anebo z nich připravených přípravků73, 74).
Analytické aplikace a korelace barevnosti s obsahem důležitých přírodních látek
Dosavadní využití instrumentálního měření barevnosti v oblasti analytiky léčivých rostlin a dalších přírodnin není vzhledem k jejich komplikovanému složení a dalším faktorům srovnatelné s využitím této metody v oblasti analytiky syntetických léčiv a tato léčiva obsahujících léčivých přípravků. Do oblasti kvalitativní analytiky přírodnin lze zařadit všechny aplikace popisující číselně barevnost. Pouze v ojedinělých případech5, 13, 75) však autoři zmiňují identifikaci vzorků, častěji je vzhledem k variabilitě složení a vlastností zkoumaného materiálu popsáno pouze typové odlišení a zařazení mezi vzorky obdobného složení či původu, jako např. u včelího medu3, 6, 14, 84) nebo propolisu12), účinnou pomůckou je přitom často chemometrie. Např. autoři6) popisují použití kolorimetrických parametrů L*, C*, h v kombinaci s chemometrií k rozlišení 17 typů jednodruhových medů z různých částí Evropy a ve studii14) s použitím kolorimetrických parametrů L*, a*b* a HPLC totéž u šesti typů jednodruhových medů z převážně jiné části Evropy. V kvantitativní analytice klasické analytické aplikace instrumentálního měření barevnosti vzhledem ke složitosti a proměnlivosti složení většiny v úvahu přicházejících přírodnin nejsou dosud rozvinuty. Situace je tedy odlišná než u léčiv syntetického původu a z nich odvozených léčivých přípravků. Východiskem pro analytické aplikace v praxi v oblasti rostlin a jejich částí a dalších přírodnin mohou být výsledky studia korelace mezi kolorimetrickými parametry a obsahem důležitých přírodních látek či jejich skupin. Analytickým signálem je v těchto případech vhodně volený kolorimetrický parametr, analytem pak stanovované obsahové látky nebo jejich skupiny a často se jedná o korelace lineární. V řadě případů však hodnoty korelačních koeficientů naznačují možnost nanejvýš jen rychlého semikvantitativního stanovení než cestu pro kvantitativní analýzu. Příklady analyticky využitelných korelací mohou být korelace hodnot b* nebo C* s obsahem karotenoidů a β-karotenu v květech tykve obrovské76), korelace hodnot souřadnice x s obsahem β-karotenu ve včelím medu15), korelace hodnot a*4 anebo (a*/b*)2, 5 s obsahem lykopenu v rajčatech77), korelace hodnot a* s obsahem karotenoidů a hodnot b* anebo C* s obsahem luteinu v jiném rostlinném materiálu (tykve a dýně Cucurbita ssp.)78), korelace hodnot souřadnice a* s obsahem anthokyaninů v plodech bobkovišně lékařské79), korelace hodnot C* s obsahem fenolických látek a flavonoidů v propolisu12). U včelích medů s obsahem fenolických látek podle80) korelovaly s vyšší hodnotou korelačního koeficientu než hodnoty parametru ∆E hodnoty souřadnice b*, u medů z jiné části světa korelovaly s obsahem fenolických látek nejlépe hodnoty souřadnice L* a a*3), ve studii81) pak hodnoty souřadnice a* a podle14) souřadnice a* a L*, přičemž i v případě souřadnice b* byla hodnota korelačního koeficientu statisticky významná (p < 0,05)14). Pro orientační stanovení obsahu polyfenolů v nati kakostu Thumbergova by mohla být užitečná lineární korelace hodnot L* naměřených po barevné reakci vodného extraktu vzorku s roztokem chloridu železitého82). Korelace kolorimetrických parametrů s antioxidační aktivitou lze využít k rychlému stanovení tohoto důležitého ukazatele. Příkladem v tomto směru může být korelace hodnot L*, a*, b* s antioxidační aktivitou (FRAP) rajčat83) anebo hodnot b* s antioxidační aktivitou (TEAC) včelího medu80). U medů z jiné části světa korelovaly s antioxidační aktivitou (FRAP) nejlépe hodnoty souřadnice L*3). Ve studii81) korelovaly s antioxidační aktivitou (FRAP, DPPH) nejlépe hodnoty souřadnice a*, podle14) korelovaly s antioxidační aktivitou (FRAP, DPPH) lépe než souřadnice b* hodnoty souřadnic a* a L*, resp. L* a a*. Zajímavá je také korelace hodnot souřadnice L* s koncentrací As, Cd, Fe, Pb, S a Ca u tmavých typů včelího medu, zatímco u světlejších medů je situace odlišná84).
Střet zájmů: žádný.
Autoři děkují PharmDr. M. Potužákovi za korekturu botanických názvů rostlin a za další připomínky k textu příspěvku.
Došlo 17. dubna 2014 / Přijato 15. května 2014
prof. RNDr. Jan Šubert, CSc.
Dušínova 1512, 664 34 Kuřim
e-mail: jan.subert@gmail.com
Dr.h.c., prof. RNDr. Jozef Čižmárik, PhD.
Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra farmaceutickej chémie, SR
Zdroje
1. Šubert J., Čižmárik J. Application of instrumental colour measurement in development and quality control of drugs and pharmaceutical excipients. Pharmazie 2008; 63, 331–336.
2. Vulič J. J., Vračar L. O., Šumič Z. M. Chemical characteristics of cultivated elderberry fruit. APTEFF 2008; 39, 85–90.
3. Shafiee S., Minaei S., Moghaddam-Charkari N., Barzegar M. Honey characterization using computer vision system and artificial neural networks. Food Chem. 2014; 159, 143–150.
4. Matiacevich S., Cofré D. C., Silva P., Enrione J., Osorio F. Quality parameters of six cultivars of blueberry using computer vision.Int. J. Food Sci. 2013; Article ID 419535, 8 pages. http://dx.doi.org/10.1155/2013/419535 (12. 4. 2014).
5. Nandyal S., Bagewadi S. Automated identification of plant species from images of leaves and flowers used in the diagnosis of arthritis. IJREAT 2013; 1(5), 1–10. www.ijreat.org (12. 4. 2014).
6. Tuberoso C. I. G., Jerković I., Sarais G., Congiu F., Marijanović Z., Kuś P. M. Color evaluation of seventeen European unifloral honey types by means of spectrophotometrically determined CIEL* C*ab h°ab chromaticity coordinates. Food Chem. 2014; 145, 284–291.
7. Wang J., Zeng L., Zang Q., Gong Q., Li B., Zhang X., Chu X., Zhang P., Zhao Y., Xiao X. Colorimetric grading scale can promote the standardization of experiential and sensory evaluation in quality control of traditional Chinese medicines. PLoS ONE 2012; 7(11), e48887. doi:10.1371/journal.pone.0048887 (12. 4. 2014).
8. Arabhosseini A., Padhye S., Huisman W., van Boxtel A., Müller J. Effect of drying on the color of tarragon (Artemisia dracunculus L.) leaves. Food Bioprocess Technol. 2011; 4, 1281–1287.
9. Shahabi M., Rafiee S., Mohtasebi S. S., Hosseinpour S. Image analysis and green tea color change kinetics during thin-layer drying. Food Sci. Technol. Int. 2013; June 10, doi:10.1177/1082013213492524.http://fst.sagepub.com/ (12. 4. 2014).
10. Davidson, V. J., Li, X., Brown, R. B. Forced-air drying of ginseng root: 1. Effects of air temperature on quality. J. Food Eng. 2004; 63, 361–367.
11. Fathi M., Mohebbi M., Razavi S. M. A. Application of image analysis and artificial neural network to predict mass transfer kinetics and color changes of osmotically dehydrated kiwifruit. Food Bioprocess Technol. 2011; 4, 1357–1366.
12. Falcão S. I., Freire C., Vilas-Boas M. A proposal for physicochemical standards and antioxidant activity of Portuguese propolis. J. Am. Oil Chem. Soc. 2013; 90, 1729–1741.
13. Kasperová J., Nagy J., Popelka P., Dičáková Z., Nagyová A., Maľa P. Physico-chemical indicators and identification of selected Slovak honeys based on colour measurement. Acta Vet. Brno 2012; 81 : 057–061; doi:10.2754/avb201281010057 (12. 4. 2014).
14. Kuś P. M., Congiu F., Teper D., Sroka Z., Jerković I.,Tuberoso C. I. G. Antioxidant activity, color characteristics, total phenol content and general HPLC fingerprints of six Polish unifloral honey types. LWT Food Sci. Technol. 2014; 55, 124–130.
15. Nikolova K., Gentscheva G., Ivanova E. Survey of the mineral content and some physico-chemical parameters of Bulgarian bee honeys. Bulg. Chem. Commun. 2013; 45, 244–249.
16. Vidrih R., Čejić Ž., Hribar J. Content of certain food components in flesh and stones of the cornelian cherry (Cornus mas L.) genotypes. Croat. J. Food Sci. Technol. 2012; 4, 64–70.
17. Ardestani S. B., Sahari M. A., Barzegar M., Abbasi, S. Some physicochemical properties of Iranian native barberry fruits (abi and poloei): Berberis integerrima and Berberis vulgaris. J. Food Pharm. Sci. 2013; 1, 60–67.
18. Ochmian I., Skupien K., Grajkowski J., Smolik M., Ostrowska K. Chemical composition and physical characteristics of fruits of two cultivars of blue honeysuckle (Lonicera caerulea L.) in relation to their degree of maturity and harvest date. Not. Bot. Horti Agrobo. Cluj-Napoca 2012; 40, 155–162.
19. Ochmian I., Grajkowski J., Smolik M. Comparison of some morphological features, quality and chemical content of four cultivars of chokeberry fruits (Aronia melanocarpa). Not. Bot. Horti Agrobo. Cluj-Napoca 2012; 40, 253–260.
20. St. George S. D., Cenkowski S. Influence of harvest time on the quality of oil-based compounds in sea buckthorn (Hippophae rhamnoides L. ssp. sinensis) seed and fruit. J. Agric. Food Chem. 2007; 55, 8054–8061.
21. Kosson R., Horbowicz M. Effect of long term storage on some nutritive components and isothiocyanates content in roots of two horseradish types. Veget. Crops Res. Bull. 2008; 69, 155–164. doi:10.2478/v10032-008-0030-3 (12. 4. 2014).
22. Gonçalves E. M., Cruz R. M. S., Abreu M., Brandão T. R. S., Silva C. L. Biochemical and colour changes of watercress ( Nasturtium officinale R. Br.) during freezing and frozen storage. J. Food Eng. 2009; 93, 32–39.
23. Horvath Z. H., Hodur C. Colour of paprika powders with different moisture content. Int. Agrophys. 2007; 21, 67–72.
24. Prachayawarakorn S., Sawangduanpen S., Saynampheung S., Poolpatarachewin T., Soponronnarit S., Nathakarakule A. Kinetics of colour change during storage of dried garlic slices as affected by relative humidity and temperature. J. Food Eng. 2004; 62, 1–7.
25. Gonda S., Tóth L., Gyémánt G., Braun M., Emri T., Vasas G. Effect of high relative humidity on dried Plantago lanceolata L. leaves during long-term storage: Effects on chemical composition, colour and microbiological quality. Phytochem. Anal. 2012; 23, 88–93.
26. Cheikh-Rouhou S., Besbes S., Hentati B., Blecker C., Deroanne C., Attia H. Nigella sativa L.: Chemical composition and physicochemical characteristics of lipid fraction. Food Chem. 2007; 101, 673–681.
27. Kaur C. S. H., Huda B. N., Karim A. A., Fazilah A. Effect of fermentation on the composition of Centella asiatica teas. Am. J. Food Technol. 2011; 6, 581–593. doi:10.3923/aft.2011.561.593 (12. 4. 2014).
28. Kim Y., Goodner K. L., Park J. D., Choi J., Talcott S. T. Changes in antioxidant phytochemicals and volatile composition of Camellia sinensis by oxidation during tea fermentation. Food Chem. 2011; 129, 1331–1342.
29. Liang Y., Lu J., Zhang L., Wu S., Wu Y. Estimation of tea quality by infusion colour difference analysis. J. Sci. Food Agric. 2005; 85, 286–292.
30. Marete E. N., Jacquier J. C., O’Riordan D. Effects of extraction temperature on the phenolic and parthenolide contents, and colour of aqueous feverfew (Tanacetum parthenium) extracts. Food Chem. 2009; 117, 226–231.
31. Chumsri P., Sirichote A., Itharat A. Studies on the optimum conditions for the extraction and concentration of roselle (Hibiscus sabdariffa Linn.) extract. Songklanakarin J. Sci. Technol. 2008; 30 (Suppl. I), 133–139.
32. Vračar L. O., Tepić A. N., Vujičić B. L., Šolaja S. Influence of the heat treatment on the color of ground pepper (Capsicum annuum). APTEFF 2007; 38, 53–58.
33. Jin Y. Y., Shin H., Ku K., Song K. B. Effect of electron beam irradiation on microbial growth and qualities in Astragalus membranaceus. Agric. Chem. Biotechnol. 2006; 49, 176–179.
34. Kim J. H., Sung N. Y., Kwon S. K., Srinivasan P., Song B. S., Choi J. I., Lee J. W. γ-Irradiation improves the color and antioxidant properties of chaga mushroom (Inonotus obliquus) extract. J. Med. Food 2009; 12, 1343–1347.
35. Kim J. K., Srinivasan P., Kim J. H., Choi J. I., Park H. J., Byun M. W., Lee J. W. Structural and antioxidant properties of gamma irradiated hyaluronic acid. Food Chem. 2008; 109, 763–770.
36. Choi J. I., Kim J. K., Kim J. H., Kweon D. K., Lee J. W. Degradation of hyaluronic acid powder by electron beam irradiation, gamma ray irradiation, microwave irradiation and thermal treatment: A comparative study. Carbohydr. Polym. 2010; 79, 1080–1085.
37. Haro M. D. R., Escolar D., Bueno C., Ayuso J. Kinetic study of the photodecoloration of the saffron.Acta Hortic. 2004; 650, 313–319.
38. Mohammadi A., Rafiee S., Emam-Djomeh Z.,Keyhani A. Kinetic models for colour changes in kiwifruit slices during hot air drying. World J. Agric. Sci. 2008; 4, 376–383.
39. Demirhan E., Özbek B. Color change kinetics of microwave-dried basil. Drying Technol. 2009; 27, 156–166.
40. Hirun S., Utama-ang N., Vuong Q. V., Scarlett C. J. Investigating the commercial microwave vacuum drying conditions on physicochemical properties and radical scavenging ability of Thai green tea. Drying Technol. 2014; 32, 47–54.
41. Siriamornpun S., Kaisoon O., Meeso N. Changes in colour, antioxidant activities and carotenoids (lycopene, β-carotene, lutein) of marigold flower (Tagetes erecta L.) resulting from different drying processes. J. Funct. Foods 2012; 4, 757–766.
42. Ramallo L. A., Lovera N. N., Schmalko M. E. Effect of the application of intermittent drying on Ilex paraguariensis quality and drying kinetics. J. Food Eng. 2010; 97, 188–193.
43. Passardi R. L., Schvezov C. E., Schmalko M. E., Gonzalez A. D. Drying of Ilex paraguariensis Saint Hilaire by microwave radiation. Drying Technol. 2006; 24, 1437–1442.
44. Calín-Sánchez Á., Figiel A., Wojdyło A., Szarycz M., Carbonell-Barrachina Á. A. Drying of garlic slices using convective pre-drying and vacuum-microwave finishing drying: Kinetics, energy consumption, and quality studies. Food Bioprocess Technol. 2014; 7, 398–408.
45. Gorjian S., Tavakkoli Hashjin T., Khoshtaghaza M. H., Nikbakht A. M. Drying kinetics and quality of barberry in a thin layer dryer. J. Agr. Sci. Tech. 2011; 13, 303–314.
46. Doymaz Iİ., Tugrul N., Pala M. Drying characteristics of dill and parsley leaves. J. Food Eng. 2006; 77, 559–565.
47. Alibas I. Energy consumption and colour characteristics of nettle leaves during microwave, vacuum and convective drying. Biosystems Eng. 2007; 96, 495–502.
48. Alibas I. Determination of drying parameters, ascorbic acid contents and color characteristics of nettle leaves during microwave-, air-and combined microwave-air drying. J. Food Process Eng. 2010; 33, 213–233.
49. Soysal Y. Mathematical modeling and evaluation of microwave drying kinetics of mint (Mentha spicata L.). J. Applied Sci. 2005; 5, 1266–1274.
50. Argyropoulos D., Müller J. Effect of convective drying on quality of lemon balm (Melissa officinalis L.). Procedia Food Sci. 2011; 1, 1932–1939.
51. Īzli N., Yıldız G., Ünal H., Işik E., Uylaşer V. Effect of different drying methods on drying characteristics, colour, total phenolic content and antioxidant capacity of goldenberry (Physalis peruviana L.). Int. J. Food Sci.Technol. 2014; 49, 9–17.
52. Boudhrioua N., Bahloul N., Ben Slimen I., Kechaou N. Comparison on the total phenol contents and the color of fresh and infrared dried olive leaves. Ind. Crops Prod. 2009; 29, 412–419.
53. Simal S., Garau C., Femenia A., Rosselló, C. Drying of red pepper (Capsicum annuum): Water desorption and quality. Int. J. Food Eng. 2005; 1(4), 1022. doi:10.2202/1556–3758.1022 (12. 4. 2014).
54. Topuz A., Feng H., Kushad, M. The effect of drying method and storage on color characteristics of paprika. LWT Food Sci. Technol. 2009; 42, 1667–1673.
55. Vega-Gálvez A., Di Scala K., Rodríguez K., Lemus-Mondaca R., Miranda M., López J., Perez-Won M. Effect of air-drying temperature on physico-chemical properties, antioxidant capacity, colour and total phenolic content of red pepper (Capsicum annuum L. var. Hungarian). Food Chem. 2009; 117, 647–653.
56. Arabhosseini A., Huisman W., Van Boxtel A., Müller, J. Long-term effects of drying conditions on the essential oil and color of tarragon leaves during storage. J. Food Eng. 2007; 79, 561–566.
57. Soysal Y. Microwave drying characteristics of parsley. Biosystems Eng. 2004; 89, 167–173.
58. Lechtenberg M., Zumdick S., Gerhards C., Schmidt T. J., Hensel A. Evaluation of analytical markers characterising different drying methods of parsley leaves (Petroselinum crispum L.). Pharmazie 2007; 62, 949–954.
59. Naidu M. M., Khanum H., Sulochanamma G., Sowbhagya H. B., Hebbar U. H., Prakash M., Srinivas P. Effect of drying methods on the quality characteristics of fenugreek (Trigonella foenum-graecum) greens. Drying Technol. 2012; 30, 808–816.
60. Yahya M. Effect of air drying temperatures on the quality of Centella asiatica L. dried products. Jurnal Teknik. Mesin. 2012; 1(2), 15–23. http://ejournal.itp.ac.id/index.php/tmesin/article/view/53/50 (12. 4. 2014).
61. Arslan D., Musa Özcan M. Evaluation of drying methods with respect to drying kinetics, mineral content and colour characteristics of rosemary leaves. Energy Convers. Manage 2008; 49, 1258–1264.
62. Esturk O. Intermittent and continuous microwave-convective air-drying characteristics of sage (Salvia officinalis) leaves. Food Bioprocess Technol. 2012; 5, 1664–1673.
63. Martinov M., Mujic I., Müller J. Impact of drying air temperature on course of drying and quality of Hypericum perforatum L. Z. Arznei.-Gewürzpfla. 2007; 12, 136–140.
64. Chenarbon H. A., Minaei S., Bassiri A. R., Almassi M., Arabhosseini A., Motevali A. Effect of drying on the color of St. John’s wort (Hypericum perforatum L.) leaves. Int. J. Food Eng. 2012; 8(4), 1556–3758, doi:10.1515/1556–3758.2545 (12. 4. 2014).
65. Demir V., Gunhan T., Yagcioglu A. K., Degirmencioglu A. Mathematical modelling and the determination of some quality parameters of air–dried bay leaves. Biosystems Eng. 2004; 88, 325–335.
66. Kubra I. R., Rao L. J. Effect of microwave drying on the phytochemical composition of volatiles of ginger. Int. J. Food Sci. Technol. 2012; 47, 53–60.
67. Hoque M. A., Bala B. K., Hossain M. A., Uddin M. B. Drying kinetics of ginger rhizome (Zingiber officinale). Bangladesh J. Agril. Res. 2013; 38, 301–319.
68. Kyriakopoulou K., Pappa A., Krokida M., Detsi A., Kefalas P. Effects of drying and extraction methods on the quality and antioxidant activity of sea buckthorn (Hippophae rhamnoides) berries and leaves. Drying Technol. 2013; 31, 1063–1076.
69. Harbourne N., Marete E., Jacquier J. C., O’Riordan D. Effect of drying methods on the phenolic constituents of meadowsweet (Filipendula ulmaria) and willow (Salix alba). LWT Food Sci. Technol. 2009; 42, 1468–1473.
70. Müller J., Heindl A. Drying of medicinal plants. In: Bogers R. J., Craker L. E., Lange D. (eds.) Medicinal and aromatic plants. Heidelberg: Springer Verlag 2006; 237–252.
71. Puranik V., Chauhan D. K., Mishra V., Rai G. K. Effect of drying techniques on the physicochemical and bioactive components of selected medicinal herbs. Ann. Phytomedicine 2012; 1(2), 23–29.
72. Sledz M., Witrowa-Rajchert D. Influence of microwave-convective drying of chlorophyll content and colour of herbs. Acta Agrophys. 2012; 19, 865–876.
73. Harbourne N., Jacquier J. C., O’Riordan D. Optimisation of the extraction and processing conditions of chamomile (Matricaria chamomilla L.) for incorporation into a beverage. Food Chem. 2009; 115, 15–19.
74. Miranda M., Maureira H., Rodriguez K., Vega-Gálvez A. Influence of temperature on the drying kinetics, physicochemical properties, and antioxidant capacity of aloe vera (Aloe barbadensis Miller) gel. J. Food Eng. 2009; 91, 297–304.
75. Beceanu D., Niculaua M., Anghel R. M. Valorization technologies of some horticultural plants with medicinal usage. Cercetari Agronomice in Moldova 2007; 40(4/132), 43–58. http://www. uaiasi.ro/CERCET_AGROMOLD/en – V4 2007 (12. 4. 2014).
76. Seroczyńska A., Korzeniewska A., Sztangret-Wiśniewska J., Niemirowicz-Szczytt K., Gajewski M. Relationship between carotenoids content and flower or fruit flesh colour of winter squash (Cucurbita maxima Duch.). Folia Horticulturae 2006; 18(1), 51–61.
77. Hyman J. R., Gaus J., Foolad M. R. A rapid and accurate method for estimating tomato lycopene content by measuring chromaticity values of fruit puree. J. Amer. Soc. Hort. Sci. 2004; 129, 717–723.
78. Itle R. A., Kabelka E. A. Correlation between L* a* b* color space values and carotenoid content in pumpkins and squash (Cucurbita spp.). HortScience 2009; 44, 633–637.
79. Kasim R., Sülüșoḡlu M., Kasim M. U. Relationship between total anthocyanin level and colour of natural cherry laurel (Prunus laurocerasus L.) fruits. Afr. J. Plant Sci. 2011; 5, 323–328.
80. Zalibera M., Staško A., Šlebodová A., Jančovičová V., Čermáková T., Brezová V. Antioxidant and radical-scavenging activities of Slovak honeys. An electron paramagnetic resonance study. Food Chem. 2008; 110, 512–521.
81. Perna A., Simonetti A., Intaglietta I., Gambacorta E. Antioxidant properties, polyphenol content and colorimetric characteristics of different floral origin honeys from different areas of southern Italy. J. Life Sci. 2013; 7, 428–436.
82. Anjiki N., Togashi M., Yoshimatsu M., Kawahara N., Mikage M. Evaluation of the crude drugs by means of colorimeter. Part 6.: Correlation between the color and total polyphenol content of Geranium Herb. J. Trad. Med. 2007; 24, 67–71.
83. Wold A. B., Rosenfeld H. J., Holte K., Baugerød H., Blomhoff R., Haffner K. Colour of post‐harvest ripened and vine ripened tomatoes (Lycopersicon esculentum Mill.) as related to total antioxidant capacity and chemical composition. Int. J. Food Sci. Technol. 2004; 39, 295–302.
84. González-Miret M. L., Terrab A., Hernanz D., Fernandez-Recamales M. A., Heredia F. J. Multivariate correlation between color and mineral composition of honeys and by their botanical origin. J. Agric. Food Chem. 2005; 53, 2574–2580.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2014 Číslo 3-
Všetky články tohto čísla
- Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a v kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek II*
- Příprava a hodnocení orálního gelu obsahujícího silici z jedle sibiřské (Abies sibirica Ledeb.)
- Hradec Králové hostil mladé farmaceutické chemiky z celé Evropy
- Flavonoidy – hlavné obsahové látky listov Philadelphus tenuifolius Rupr. et Maxim.
- Formulácia benzetóniumchloridu do gélov
- 9th World Meeting on Pharmaceutics, Biopharmaceutics and Pharmaceutical Technology – PBP Meeting
- Vliv formulačních a procesních proměnných na vlastnosti chitosanových mikrosfér připravených vnější iontovou gelací
- Lekárne a lekárnici v okrese Žilina pred rokom 1990
- Jandoušova česká lékopisná terminologie z roku 1864
- Racionalizace v československém lékárenství ve 20. století – farmaceutická sekce Komise pro racionalisaci a normalisaci v lékařství, zvěrolékařství a lékárnictví – 1. část
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Jandoušova česká lékopisná terminologie z roku 1864
- Příprava a hodnocení orálního gelu obsahujícího silici z jedle sibiřské (Abies sibirica Ledeb.)
- Vliv formulačních a procesních proměnných na vlastnosti chitosanových mikrosfér připravených vnější iontovou gelací
- Racionalizace v československém lékárenství ve 20. století – farmaceutická sekce Komise pro racionalisaci a normalisaci v lékařství, zvěrolékařství a lékárnictví – 1. část
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



