-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť II. Cytochróm P450 2C9
Clinical significance of cytochrome P450 genetic polymorphism – part II. Cytochrome P450 2C9
Cytochrome P450 2C9 is the major enzyme of the cytochrome P450 2C subfamily and metabolizes approximately 10 % of commonly used drugs. Several studies have demonstrated that the CYP2C9 polymorphism is important for several drugs and may be associated with the occurrence of clinically relevant side effects. Part II of this paper focuses on the influence of genetic polymorphism of cytochrome P450 2C9 on drug effect.
Key words:
cytochrome P450 – genetic polymorphism – CYP2C9
Autoři: Jana Ďuricová; Milan Grundmann
Působiště autorů: Ostravska Univerzita v Ostravě, Ustav klinicke farmakologie LF OU a FN
Vyšlo v časopise: Čes. slov. Farm., 2011; 60, 165-170
Kategorie: Přehledy a odborná sdělení
Souhrn
Enzým cytochróm P450 2C9 je hlavný enzým podrodiny cytochrómu P450 2C9, ktorý sa podieľa z 10 % na metabolizme bežne užívaných liečiv. Niekoľko štúdií poukázalo na významný vplyv polymorfizmu enzýmu P450 2C9 s možným výskytom klinicky závažných nežiadúcich účinkov. Cieľom druhej časti tohoto článku je popísať vplyv genetického polymorfizmu cytochrómu P450 2C9 na účinok liečiv.
Kľúčové slová:
cytochróm P450 – genetický polymorfizmus – CYP2C9Podrodina CYP2C
Enzýmy subrodiny cytochrómu P450 2C patria medzi dôležité enzýmy, ktoré metabolizujú približne 20 % klinicky užívaných liečiv. Táto subrodina je u človeka zložená zo 4 členov, z ktorých CYP2C8, CYP2C9, CYP2C19 majú klinicky význam1). Napriek tomu, že tieto enzýmy zdieľajú > 82% identitu v aminokyselinovej sekvencii, majú relatívne malú prekrývajúcu sa substrátovú špecificitu2).
CYP2C9
CYP2C9 je druhým najčastejšie sa vyskytujúcim enzýmom z rodiny cytochrómu P450 v pečeni. Podieľa sa na metabolizme približne 10 % užívaných liečiv3, 4). Bolo popísaných viac než 50 polymorfizmov (SNP) v regulačných a kódujúcich oblastiach génu CYP2C9. Alelické varianty CYP2C9 vykazujú nielen variabilitu výskytu medzi etnikami ale i v rámci jednej etnickej skupiny5) (tab. 1). V Belošskej populácii majú klinický význam dve alelické varianty CYP2C9*2 a CYP2C9*3 s frekvenciou výskytu okolo 11 % a 7 %3). Ide o alely so zníženou enzymatickou aktivitou, kde variantná alela CYP2C9*3 vykazuje na rozdiel od CYP2C9*2 významný pokles enzymatickej funkcie6).
Tab. 1. Aktivita variantných aleliel CYP2C9 in vivo a výskyt v populácii<sup>3, 4)</sup> 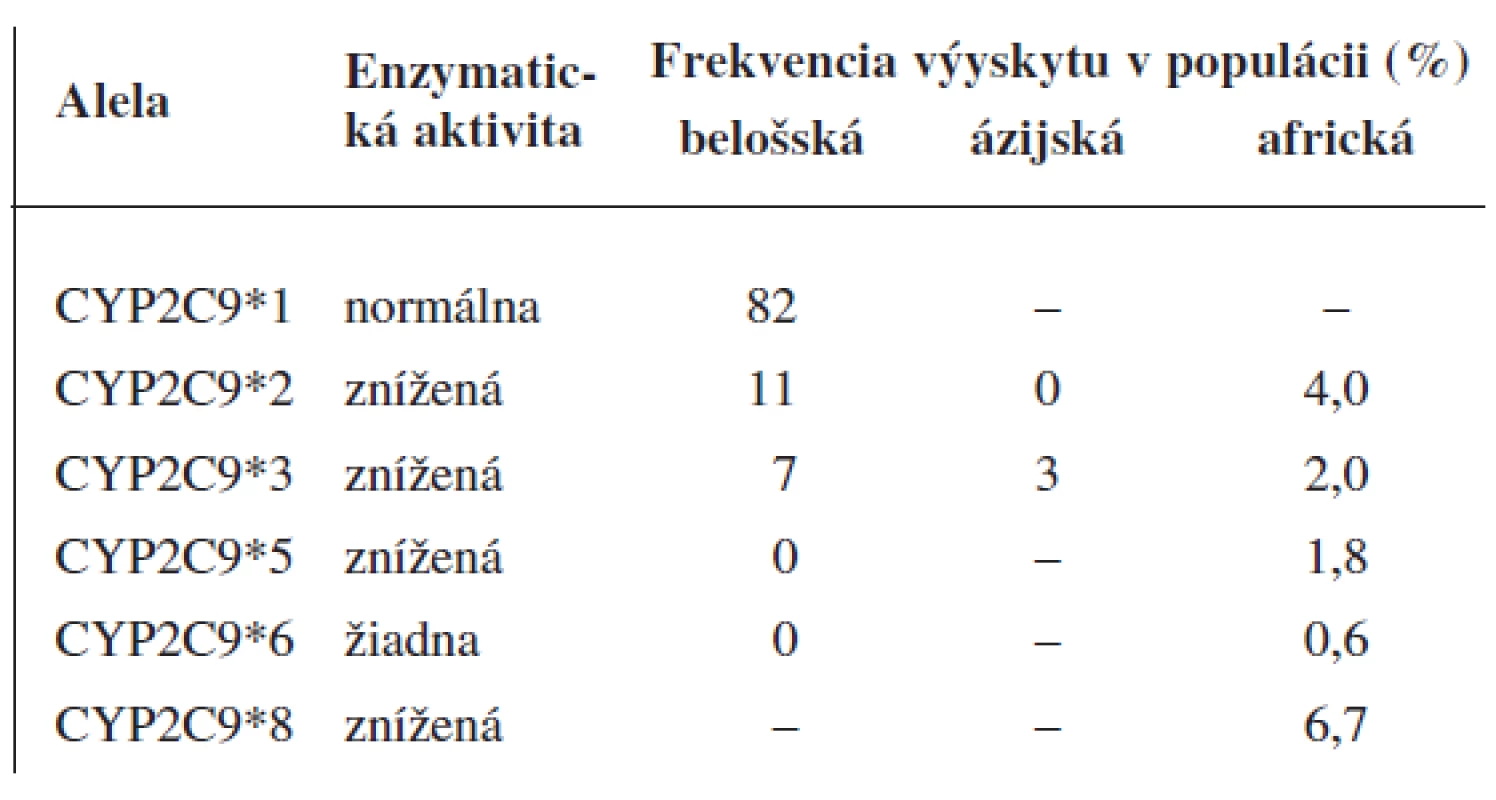
Warfarín
CYP2C9 polymorfizmus môže mať významné klinické dôsledky, pokiaľ sa podieľa na metabolizme liečiv s úzkym terapeutickým indexom. CYP2C9 je hlavným enzýmom v metabolizme aktívnej formy warfarínu (S‑warfarín). Dosiaľ bolo publikovaných množstvo prací zaoberajúcich sa významom CYP2C9 polymorfizmu a rizika krvácavých komplikácií a optimálnej dávky warfarínu vzhľadom na genotyp. V roku 1999 bola publikovaná prvá správa, ktorá potvrdila významný vzťah medzi CYP2C9 genotypom a dávkou warfarínu. U pacientov v skupine s nízkou dávkou warfarínu majúcich častejší výskyt CYP2C9 variantnej alely sa častějšie vyskytovali problémy pri nastavení optimálnej dávky warfarínu pri jeho nasadzovaní a bol u nich zaznamenaný signifikantne vyšší výskyt závažných krvácavých komplikácií v porovnaní s pacientskými kontrolami7). Podobné závery priniesli i výsledky neskorších prác8–11) a meta-analýza12). Následne pribudli práce, ktoré navrhovali dávkovacie algoritmy pre warfarín na základe použitých prediktorov13–17). Aký benefit má využitie genetiky pre zoptimalizovanie dávkovania a bezpečnosti terapie warfarínom, by mala v krátkej budúcnosti zodpovedať práve prebiehajúca jednoducho-zaslepená randomizovaná kontrolovaná štúdia (EU-PACT)18).
Antidiabetika
Prítomnosť variantnej alely CYP2C9*3 koreluje so zvýšenými hladinami perorálnych antidiabetik zo skupiny derivátov sulfonylurey, ako demonštrujú farmakokinetické štúdie na zdravých dobrovoľníkoch19–21). V týchto prácach ďalej sledovali dopad CYP2C9 genotypu na farmakodynamický účinok. U jedincoch majúcich variantnú alelu CYP2C9*3 (väčšinou heterozygoti) dochádzalo po užití antidiabetika k väčšiemu poklesu hladiny glukózy v krvi, prípadne vyššej sekrécii inzulínu v porovnaní s dobrovoľníkmi bez variantnej alely. Naopak v iných štúdiách na zdravých jedincoch významná zmena vo farmakokinetike antidiabetik v závisloti na genotype nemala dopad na účinok derivátov sulfonylmočoviny22, 23). Kirchheiner et al. vo svojej práci uvádza, že celková orálna clearance derivátov sulfonylurey je len 20% u jedincov homozygotov pre variatnú alelu CYP2C9*3/*3 v porovnaní s nositeľmi s „wild type“ genotypom, u heterozygotov pre variantnú alelu sa clearance pohybovala medzi 50–80 % oproti „wild type“ genotypu24). V prácach, ktoré zahrňovali pacientov diabetikov, bola prítomnosť CYP2C9 variantnej alely spojená s výraznějším účinkom derivátov sulfonylmočoviny a vyšším rizikom výskytu hypoglykémií25–28). Okrem derivátov sulfonylmočoviny sa CYP2C9 vo výzanmnej miere podieľa i na eliminácii ďalšieho antidiabetika nateglinidu. Jediná známá práca, ktorá skúmala vplyv genotypu, pozorovala významné zníženie orálnej clearance nateglinidu u nositeľov CYP2C9*3 variantnej alely, avšak bez významnej zmeny na hladinu glukózy, inzulínu a glukagónu29).
Blokátory angiotenzinu II
Enzým CYP2C9 je významným enzýmom i v metabolizme 2 blokátorov angiotenzinu II, losartanu a irbesartanu. Losartan je enzýmom CYP2C9 oxidovaný na metabolit E-3174, ktorý je prevážně zodpovedný za antihypertenzívny účinok. Farmakokinetické štúdie uskutočnené na normotenzných dobrovoľníkoch pozorovali zníženú tvorbu aktívneho metabolitu po jednorázovom užití losartanu u nositeľov variantnej alely30, 31). Uvedené výsledky viedli následne k prácam, ktoré skúmali dopad zníženej tvorby aktívneho metabolitu na krvný tlak. Nižší hypotenzívny efekt losartanu bol pozorovaný u nositeľov variantnej alely sledovaný v skupine zdravých dobrovoľníkov31), u hypertenzných pacientov s diabetes mellitus 1. typu s diabetickou nefropatiou32), tak i u pacientov so sekundárnym renálnym ochorením33). V poslednej uvedenej práci bol u pacientov s primárnym renálným ochorením a prítomnosťou variantnej alely pozorovaný menej priaznivý efekt losartanu na proteinuriu33). V iných štúdiách na zdravých dobrovoľníkoch i na pacientoch s esenciálnou hypertenziou nebol vplyv CYP2C9 genotypu na pokles krvného tlaku pozorovaný34, 35). Irbesartan je na rozdiel od losartanu aktívnou látkou. V štúdii s hypertenzívnymi pacientami mali nositelia CYP2C9 variatnej alely významne vyššie plazmatické koncentrácie irbesartanu a väčší pokles diastolického tlaku v porovnaní s pacientami bez variantnej alely36). Podobné výsledky týkajúce sa poklesu krvného tlaku a genotypu priniesla i ďalšia práca zo Švédska37), iná práca tento efekt nepozorovala38).
Nesteroidné antiflogisitka, analgetika
Enzým CYP2C9 sa podieľa i na biotransformácii mnohých nesteroidných antiflogistík (NSAIDs)39). Viac než dvojnásobné zníženie clearance celekoxibu bolo pozorované u zdravých dobrovoľníkoch nesúcich 2 variantné alely CYP2C9*3 po podání 1-rázovej dávky40). Oveľa výraznějšie zmeny v clearance celekoxibu (až 7-násobné zníženie) boli pozorované u CYP2C9*3 homozygotov po opakovanom užití celekoxibu41). Ku zníženému metabolizmu u nositeľov CYP2C9*3 variantnej alely v heterozygotnom či homozygotnom stave dochádzá i u ibuprofenu42, 43). Znížená clearance S-ibuprofenu (aktívna forma) viedla i ku zvýšeniu farmakodynamickej aktivity meranej inhibíciou tvorby tromboxanu B2 a prostaglandínu E44). Efekt ibuprofenu v prítomnosti CYP2C9 variantných aliel bol sledovaný i v spojitosti s výskytom kolorektálneho nádoru. Protektívny účinok ibuprofenu sa zvyšoval s počtom variantných aliel45). Podobne bol vplyv CYP2C9 polymorfizmu pozorovaný i u lornoxikamu, tenoxikamu a piroxikamu46, 47). U posledného z nich prítomnosť variantnej alely viedla ku zvýšeniu inhibičného účinku na tvorbu tromboxanu B248). Čo sa týka diklofenaku, práce väčšinou nepotvrdili vplyv CYP2C9 polymorfizmu na jeho metabolizmus49, 50). Niekoľko prací sa zaoberalo i vzťahom medzi genetikou a výskytom gastrointestinálneho krvácnia spôsobeného užívaním NSAIDs. Jednoznačný záver však zatiaľ nemožno z týchto štúdií vyvodiť i napriek pozitívnemu vzťahu medzi prítomnosťou CYP2C9 variantnej alely a rizikom krvácania preukázaný v niektorých prácach51–54).
Fenytoín
Antiepileptikum fenytoín podlieha extenzívnej biotransformácii, na ktorej sa podieľa predovšetkým enzým CYP2C9. Z populačných štúdií vyplýva, že genetický polymorfizmus CYP2C9 génu zohráva významnú úlohu v metabolizme fenytoinu a jedinci majúci vriantnú alelu CYP2C9*3 sú vystavený vyšším hladinám fenytoinu oproti normálným metabolizátorom55–58). Autori jednej práce uvádzajú, že CYP2C9 genotyp je zodpovedný z 31 % za variabilitu hladín fenytoinu59), výsledky inej práce uvádzajú len 6,5% podiel60). V práci van der Weide et al. skúmali efekt polymorfizmu CYP2C9 na dávku fenytoinu potrebnú k dosiahnutiu terapeutických koncentrácií. Pacienti majúci aspoň jednu variantnú alelu potrebovali v priemere o 37 % nižšiu dávku než normálni metabolizátori61). Aký vplyv má CYP2C9 polymorfizmus na výskyt neurologických nežiadúcich účinkov u epileptikov užívajúcich fenytoín, sa snažila objasniť nasledujúca práca. Do tejto práce bolo zaradených 292 pacientov užívajúcich fenytoín, z toho u 58 z nich bol zaznamený výskyt nežiadúcich účinkov. Prítomnosť variantnej alely bola významne vyššia u pacientov s výskytom toxicity než u kontrol62). Ďalej je výskyt intoxikácie fenytoínom u pacientov hetero - a homozygotov pre CYP2C9 variantnú alelu popísaný hlavne v kazuistikách63–66). A aká je úloha CYP2C9 polymorfizmu na výskyt ďalších nežiadúcich účinkov vyvolaných fenytoínom, ako je hyperplázia gingiv a kožná toxicita, je zatiaľ otázne67, 68).
Tab. 2. Príklady substrátov, inhibítorov a induktorov enzýmu CYP2C9 <sup>69–71)</sup> 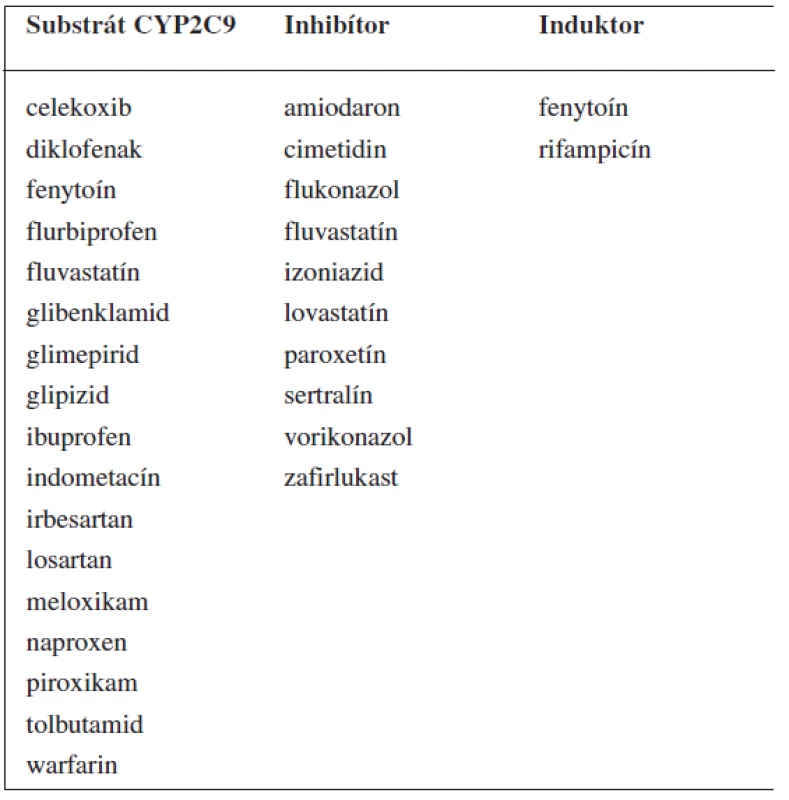
ZÁVER
Enzým CYP2C9 je druhým najčastejšie sa vyskytujúcim enzýmom z rodiny cytochrómu P450 v pečeni. Medzi substráty tohoto enzýmu patria i liečivá s úzkou terapeutickou šírkou. Pomerne častý výskyt CYP2C9 polymorfných aliel, obzvlášť v homozygotnom stave, môže viesť k významným zmenám u liečiv. Väčšina uskutočnených štúdií však sledovala prevážne farmakokinetické zmeny, u mnohých liečiv tak chýbajú jasné dôkazy o dopade polymorfizmu enzýmu CYP2C9 na účinok liečiv.
Došlo 31. ledna 2011
Přijato 11. dubna 2011
Adresa pro korespondenci:
Mgr. Jana Ďuricová
Ústav klinické farmakologie LF OU
17. listopadu 1790, 708 52 Ostrava
e-mail: jana.duricova@fno.cz
Zdroje
1. Goldstein, J. A.: Clinical relevance of genetic polymorphisms in the human CYP2C subfamily. Br. J. Clin. Pharmacol. 2001; 52, 349–355.
2. Miners, J. O., Birkett, D. J.: Cytochrome P450 2C9: an enzyme of major importance in human drug metabolism. Br. J. Clin. Pharmacol. 1998; 45, 525–538.
3. Kirchheiner, J., Tsahuridu, M., Jabrane, W., Roots, I., Brockmöller, J.: The CYP2C9 polymorphism: from enzyme kinetics to clinical dose recommendations. Personalized Med. 2004; 1, 63–84.
4. Schwarz, U. I.: Clinical relevance of genetic polymorphisms in the human CYP2C9. Eur. J. Clin. Invest. 2003; 33, 23–30.
5. García-Martín, E., Martínez, C., Ladero, J. M., Agúndez, J. A.: Interethnic and intraethnic variability of CYP2C8 and CYP2C9 polymorphisms in healthy individuals. Mol. Diag. Ther. 2006; 10, 29–40.
6. Rettie, A. E., Jones, J. P.: Clinical and toxicological relevance of CYP2C9: Drug-drug interactions and pharmacogenetics. Annu. Rev. Pharmacol. Toxicol. 2005; 45, 477–494.
7. Aithal, G. P., Day, C .P., Kesteven, P. J., Daly, A. K.: Association of polymorphisms in the cytochrome P450 CYP2C9 with warfarin dose requirement and risk of bleeding complications. Lancet 1999; 353, 717–719.
8. Linder, M. W., Looney, S., Adams, J. E., Johnson, N., Antonino-Green, D., Lacefield, N., Bukaveckas, B. L., Valdes R.: Warfarin dose adjustments based on CYP2C9 genetic polymorphisms. J. Thromb. Thrombolysis. 2002; 14, 227–232.
9. Scordo, M. G., Pengo, V., Spina, E., Dahl, M. L., Gusella, M., Padrini, R.: Influence of CYP2C9 and CYP2C19 genetic polymorphisms on warfarin maintenance dose and metabolic clearance. Clin. Pharmacol. Ther. 2002; 72, 702–710.
10. Peyvandi, F., Spreafico, M., Siboni, S. M., Moia, M., Mannucci, P. M.: CYP2C9 genotypes and dose requirements during the induction phase of oral anticoagulant therapy. Clin. Pharmacol. Ther. 2004; 75, 198–203.
11. Higashi, M. K., Veenstra, D. L., Kondo, L. M, Wittkowsky, A. K., Srinouanprachanh, S. L., Farin, F. M., Rettie, A. E.: Association between CYP2C9 genetic variants and anticoagulation-related outcomes during warfarin therapy. JAMA 2002; 287, 1690–1698.
12. Sanderson, S., Emery, J., Higgins, J.: CYP2C9 gene variants, drug dose, and bleeding risk in warfarin-treated patients: a HuGEnet systematic review and meta-analysis. Genet. Med. 2005; 7, 97–104.
13. Sconce, E. A., Khan, T. I., Wynne, H. A., Avery, P., Monkhouse, L., King, B. P., Wood, P., Kesteven, P., Daly, A. K., Kamali, F.: The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements: proposal for a new dosing regimen. Blood 2005; 106, 2329–2333.
14. Caldwell, M. D., Berg, R. L., Zhang, K. Q., Glurich, I., Schmelzer, J. R., Yale, S. H., Vidaillet, H. J., Burmester, J. K.: Evaluation of genetic factors for warfarin dose prediction. Clin. Med. Res. 2006; 5, 8–16.
15. Wadelius M., Chen L. Y., Lindh J. D., Eriksson, N., Ghori, M. J., Bumpstead, S., Holm, L., McGinnis, R., Rane, A., Deloukas, P.: The largest prospective warfarin-treated cohort supports genetic forecasting. Blood. 2009; 113, 784–792.
16. Ferder, N. S., Eby, C. S., Deych, E., Harris, J. K., Ridker, P. M. Milligan, P. E ., Goldhaber, S. Z., King, C. R., Giri, T., McLeod, H. L., Glynn, R. J., Gage, B. F.: Ability of VKORC1 and CYP2C9 to predict therapeutic warfarin dose during the initial weeks of therapy. J. Thromb. Haemost. 2010; 8, 95–100.
17. Roper, N., Storer, B., Bona, R., Fang, M.: Validation and comparison of pharmacogenetics-based warfarin dosing algorithms for application of pharmacogenetic testing. J. Mol. Diagn. 2010; 12, 283–291.
18. van Schie, R. M., Wadelius, M. I., Kamali, F., Daly, A. K., Manolopoulos, V. G., de Boer, A., Verhoef, T. I., Kirchheiner, J., Haschke-Becher, E., Briz, M., Rosendaal, F. R., Redekop, W. K., Pirmohamed, M., Maitland van der Zee A. H.: Genotype-guided dosing of coumarin derivatives: the European pharmacogenetics of anticoagulant therapy (EU-PACT) trial design. Pharmacogenomics 2009; 10, 1687–1695.
19. Shon, J. H., Yoon, Y. R., Kim, K. A., Lim, Y. C., Lee, K. J., Park, J. Y., Cha, I. J., Flockhart, D. A., Shin, J. G.: Effects of CYP2C19 and CYP2C9 genetic polymorphisms on the disposition of and blood glucose lowering response to tolbutamide in humans. Pharmacogenetics 2002; 12, 111–119.
20. Yin, O. Q., Tomlinson, B., Chow, M. S.: CYP2C9, but not CYP2C19, polymorphisms affect the pharmacokinetics and pharmacodynamics of glyburide in Chinese subjects. Clin. Pharmacol. Ther. 2005; 78, 370–377.
21. Kirchheiner, J., Brockmöller, J., Meineke, I., Bauer, S., Rohde, W., Meisel, C., Roots, I.: Impact of CYP2C9 amino acid polymorphisms on glyburide kinetics and on the insulin and glucose response in healthy volunteers. Clin. Pharmacol. Ther. 2002; 71, 286–296.
22. Niemi, M., Cascorbi, I., Timm, R., Kroemer, H. K., Neuvonen, P. J., Kivistö, K. T.: Glyburide and glimepiride pharmacokinetics in subjects with different CYP2C9 genotypes. Clin. Pharmacol. Ther. 2002; 72, 32–332.
23. Kirchheiner, J., Bauer, S., Meineke, I., Rohde, W., Prang, V., Meisel, C., Roots, I., Brockmöller, J.: Impact of CYP2C9 and CYP2C19 polymorphisms on tolbutamide kinetics and the insulin and glucose response in helathy volunteers. Pharmacogenetics 2002; 12, 101–109.
24. Kirchheiner, J., Roots, I., Goldammer, M., Rosenkranz, B., Brockmöller, J.: Effect of genetic polymorphisms in cytochrome p450 (CYP) 2C9 and CYP2C8 on the pharmacokinetics of oral antidiabetic drugs: clinical relevance. Clin. Pharmacokinet. 2005; 44, 1209–1225.
25. Suzuki, K., Yanagawa, T., Shibasaki, T., Kaniwa, N., Hasegawa, R., Tohkin, M.: Effect of CYP2C9 genetic polymorphisms on the efficacy and pharmacokinetics of glimepirid in subjects with type 2 diabetes. Diabetes Res. Clin. Pract. 2006; 72, 148–154.
26. Becker, M. L., Visser, L. E., Trienekens, P. H., Hofman, A., van Schaik, R. H., Stricker, B. H.: Cytochrome P450 2C9*2 and *3 polymorphisms and the dose and effect of sulfonylurea in type II diabetes mellitus. Clin. Pharmacol. Ther. 2008; 83, 288–292.
27. Holstein A., Plaschke A., Ptak M., Egberts, E. H., El-Din, J., Brockmöller, J., Kirchheiner, J.: Association between CYP2C9 slow mwtabolizer gynotypes and severe hypoglycaemia on medication with sulphonylurea hypoglycaemic agents. Br. J. Clin. Pharmacol. 2005; 60, 103–106.
28. Ragia, G., Petridis, I., Tavridou, A., Christakidis, D., Manolopoulous, V. G.: Presence of CYP2C9*3 allele increases risk for hypoglycemia in Type 2 diabetic patients treated with sulfonylureas. Pharmacogenomics 2009; 10, 1781–1787.
29. Kirchheiner J., Meineke I., Müller G., Bauer, S., Rohde, W., Meisel, C., Roots, I., Brockmöller, J.: Influence of CYP2C9 and CYP2D6 polymorphisms on the pharmacokinetics of nateglinide in genotyped healthy volunteers. Clin. Pharmacokinet. 2004; 43, 267–278.
30. Yasar, U., Forslund-Bergengren, C., Tybring, G., Dorado, P., Llerena, A., Sjöqvist, F., Eliasson, E., Dahl, M. L.: Pharmacokinetics of losartan and its metabolite E-3174 in relation to the CYP2C9 genotype. Clin. Pharmacol. Ther. 2002; 71, 89–98.
31. Sekino, K., Kubota, T., Okada, Y., Yamada, Y., Yamamoto, K., Horiuchi, R., Kimura, K., Iga, T.: Effect of the single CYP2C9*3 allele on pharmacokinetics and pharmacodynamics of losartan in healthy Japanese subjects. Eur. J. Clin. Pharmacol. 2003; 59, 589–592.
32. Lajer, M., Tarnow, S., Andersen, S., Parving, H. H.: CYP2C9 variant modifies blood pressure-lowering response to losartan in Type 1 diabetic patients with nephropathy. Diabet. Med. 2007; 24, 322–328.
33. Joy, M. S., Dornbrook-Lavender, K., Blaisdell, J., Hilliard, T., Boyette, T., Hu, Y., Hogan, S. L., Candiani, C., Falk, R. J., Goldstein, J. A.: CYP2C9 genotype and pharmacodynamic responses to losartan in patients with primary and secondary kidney diseases. Eur. J. Clin. Pharmacol. 2009; 65, 947–953.
34. Lee, C. R., Pieper, J. A., Hinderliter, A. L., Blaisdell, J. A., Goldstein, J. A.: Losartan and E3174 pharmacokinetics in cytochrome P450 2C9*1/*1, *1/*2, and *1/*3 individuals. Pharmacotherapy 2003; 23, 720–725.
35. Donner, K. M., Hiltunen, T. P., Suonsyrjä, T., Hannila-Handelberg, T., Tikkanen, I., Antikainen, M., Hirvonen, A., Kontula, K.: CYP2C9 genotype modifies activity of the renin-angiotensin-aldosterone system in hypertensive men. J. Hypertens. 2009; 27, 2001–2009.
36. Chen, G., Jiang, S., Mao, G., Zhang, S., Hong, X., Tang, G., Li, Z., Liu, X., Zhang, Y., Xing, H., Wang, B., Yu, Y, Xu, X.: CYP2C9 Ile359Leu polymorphism, plasma irbesartan concentration and acute blood pressure reductions in response to irbesartan treatment in Chinese hypertensive patients. Methods. Find. Exp. Clin. Pharmacol. 2006; 28, 19–24.
37. Hallberg, P., Karlsson, J., Kurland, L., Lind, L., Kahan, T., Malmqvist, K., Ohman, K. P., Nyström, F., Melhus, H.: The CYP2C9 genotype predicts the blood pressure response to irbesartan: results from the Swedish Irbesartan Left Ventricular Hypertrophy Investigation vs Atenolol (SILVHIA) trial. J. Hypertens. 2002; 20, 2089–2093.
38. Hong, X., Zhang, S., Mao, G., Jiang, S., Zhang, Y., Yu, Y., Tang, G., Xing, H., Xu, X.: CYP2C9*3 allelic variant is associated with netabolism of irbesartan in Chinese population. Eur. J. Clin. Pharmacol. 2005; 61, 627–634.
39. Blanco, G., Martínez, C., García-Martín, E., Agúndez, J. A.: Cytochrome P450 gene polymorphisms and variability in response to NSAIDS. Clin. Res. Reg. Affairs 2005; 22, 57–81.
40. Kirchheiner, J., Störmer, E., Meisel, C., Steinbach, N., Roots, I., Brockmöller, J.: Influence of CYP2C9 genetic polymorphisms on pharmacokinetics of celecoxib and its metabolites. Pharmacogenetics 2003; 13, 473–480.
41. Lundblad, M. S., Ohlsson, S., Johansson, P., Lafolie, P., Eliasson, E.: Accumulation of celekoxib with a 7-fold higher drug exposure in individuals homozygous for CYP2C9*3. Clin. Pharmacol. Ther. 2006; 79, 287–288.
42. López-Rodríguez, R., Novalbos, J., Gallego-Sandín, S., Román-Martínez, M., Torrado, J., Gisbert, J. P., Abad-Santos, F.: Influence of CYP2C8 and CYP2C9 polymorphisms on pharmacokinetic and pharmacodynamic parameters of racemic and enantiomeric forms of ibuprofen in healthy volunteers. Pharmacol. Res. 2008; 58, 77–84.
43. García-Martín, E., Martínez, C., Tabarés, B., Frías, J., Agúndez, J. A.: Interindividual variability in ibuprofen pharmacokinetics is related to interaction of cytochrome P450 2C8 and 2C9 amino acid polymorphisms. Clin. Pharmacol. Ther. 2004; 76, 119–127.
44. Kirchheiner, J., Meineke, I., Freytag, G., Meisel, C., Roots, I., Brockmöller, J.: Enantiospecific effects of cytochrome P450 2C9 amino acid variants on ibuprofen pharmacokinetics and on the inhibition of cyclooxygenase 1 and 2. Clin. Pharmacol. Ther. 2002; 72, 62–75.
45. Samowitz, W. S., Wolff, R. K., Curtin, K., Sweeney, C., Ma, K. N., Andersen, K., Levin, T. R., Slattery, M. L.: Interactions between CYP2C9 and UGT1A6 polymorphisms and nonsteroidal anti-inflammatory drugs in colorectal prevention. Clin. Gastroenterol. Hepatol. 2006; 4, 894–901.
46. Zhang, Y., Zhong, D., Si, D., Guo, Y., Chen, X., Zhou, H.: Lornoxicam pharmacokinetics in relation to cytochrome P450 2C9 genotype. Br. J. Clin. Pharmacol. 2005; 59, 14–17.
47. Vianna-Jorge, R., Perini, J. A., Rondinelli, E., Suarez-Kurtz, G.: CYP2C9 genotypes and pharmacokinetics of tenoxicam in Brazilians. Clin. Pharmacol. Ther. 2004; 76, 18–26.
48. Perini, J. A., Vianna-Jorge, R., Brogliato, A. R., Suarez-Kurtz, G.: Influence of CYP2C9 genotypes on the pharmacokinetics and pharmacodynamics of piroxicam. Clin. Pharmacol. Ther. 2005; 78, 362–369.
49. Shimamoto, J., Ieiri, I., Urae, A., Kimura, M., Irie, S., Kubota, T., Chiba, K., Ishizaki, T., Otsubo, K., Higuchi, S.: Lack of differences in diclofenac (a substrate for CYP2C9) pharmacokinetics in healthy volunteers with respect to the single CYP2C9*3 allele. Eur. J. Clin. Pharmacol. 2000; 56, 65–68.
50. Yasar, Ü., Eliasson, E., Forslund-Bergengren, C., Tybring, G., Gadd, M., Sjöqvist, F., Dahl, M. L.: The role of CYP2C9 genotype in the metabolism of diclofenac in vivo and in vitro. Eur. J. Clin. Pharmacol. 2001; 57, 729–735.
51. Martin, J. H., Begg, E. J., Kennedy, M. A., Roberts, R., Barclay, M. L.: Is cytochrome P450 2C9 genotype associated with NSAID gastric ulceration? Br. J. Clin. Pharmacol. 2001; 51, 627–630.
52. Martínez, C., Blanco, G., Ladero, J. M., García-Martín, E., Taxonera, C., Gamito, F. G., Diaz-Rubio, M., Agúndez, J. A.: Genetic predisposition to acute gastrointestinal bleeding after NSAIDs use. Br. J. Pharmacol. 2004; 141, 205–208.
53. Scarcelli, C., Colaizzo, D., Grandone, E., Nir,o V., Andriulli, A., Leandro, G., Di Mario, F., Dallapiccola, B.: Genetic susceptibility to nonsteroidal anti-inflammatory drug-related gastroduodenal bleeding: role of cytochrome P450 2C9 polymorphisms. Gastronenterology 2007; 133, 465–471.
54. Carbonell, N., Verstuyft, C., Massard, J., Letierce, A., Cellier, C., Deforges, L., Saliba, F., Delchier, J. C., Becquemont, L.: CYP2C9*3 loss-of-function allele is associated with acute upper gastrointestinal bleeding related to the use of NSAIDs other than aspirin. Clin. Pharmacol. Ther. 2010; 87, 693–698.
55. Tassaneeyakul, W., Veronese, M. E., Birkett, D. J., Doecke, C. J., McManus, M. E., Sansom, L. N., Miners, J. O.: Co-regulation of phenytoin and tolbutamide metabolism in humans. Br. J. Clin. Pharmac. 1992; 34, 494–498.
56. Taguchi, M., Hongou, K., Yagi, S., Miyawaki, T., Takizawa, M., Aiba, T., Hashimoto, Y.: Evaluation of phenytoin dosage regimens based on genotyping of CYP2C subfamily in routinely treated Japanese patients. Drug. Metab. Pharmacokinet. 2005; 20, 107–112.
57. Kerb, R., Aynacioglu, A. S., Brockmöller, J., Schlagenhaufer, R., Bauer, S., Szekeres, T., Hamwi, A., Fritzer-Szekeres, M., Baumgartner, C., Ongen, H. Z., Güzelbey, P., Roots, I., Brinkmann, U.: The predictive value of MDR1, CYP2C9, and CYP2C19 polymorphisms for phenytoin plasma levels. Pharmacogenomics 2001; 1, 204–210.
58. Lee, S. Y., Lee, S. T., Kim, J. W.: Contributions of CYP2C9/CYP2C19 genotypes and drug interaction to the phenytoin treatment in the Korean epileptic patients in the clinical setting. J. Biochem. Mol. Biol. 2007; 40, 448–452.
59. Aynacioglu, A. S., Brockmöller, J., Bauer, S., Sachse, C., Güzelbey, P., Ongen, Z., Nacak, M., Roots, I.: Frequency of cytochrome P4502C9 variants in a Turkish population and functional relevance for phenytoin. Br. J. Clin. Pharmacol. 1999; 48 : 409–415.
60. Tate, S. K., Depondt, C., Sisodiya, S. M., Cavalleri, G. L., Schorge, S., Soranzo, N., Thom, M., Sen, A., Shorvon, S. D., Sander, J. W., Wood, N. W., Goldstein, D. B.: Genetic predictors of the maximum doses patients receive during clinical use of the anti-epileptic drugs carbamazepine and phenytoin. Proc. Natl. Acad. Sci. 2005; 102, 5507–5512.
61. van der Weide, J., Steijns, L. S., van Weelden, M. J., de Haan, K.: The effect of genetic polymorphisms of cytochrome P450 CYP2C9 on phenytoin dose requirement. Pharmacogenetics 2001; 11, 287–291.
62. Kesavan, R., Narayan, S. K., Adithan, C.: Influence of CYP2C9 and Cyp2C19 genetic polymorphisms on phenytoin-induced neurological toxicity in Indian epileptic patients. Eur. J. Clin. Pharmacol. 2010; 66, 689–696.
63. Ninomiya, H., Mamiya, K., Matsuo, S., Leiri, I., Higuchi, S., Tashiro, N.: Genetic polymorphism of the CYP2C subfamily and excessive serum phenytoin concentration with central nervous system intoxication. Ther. Drug. Monit. 2000; 22, 230–232.
64. Kidd, R. S., Curry, T. B., Gallagher, S., Edeki, T., Blaisdell, J., Goldstein, J. A.: Identification of a null allele of CYP2C9 in an African-american exhibiting toxicity to phenytoin. Pharmacogenetics 2001; 11, 803–808.
65. Brandolese, R., Scordo, M. G., Spina, E., Gusella, M., Padrini, R.: Severe phenytoin intoxication in a subject homozygous for CYP2C9*3. Clin. Pharmacol. Ther. 2001; 70, 391–394.
66. McCluggage, L. K., Voils, S. A., Bullock, M. R.: Phenytoin toxicity due to genetic polymorphism. Neurocrit. Care 2009; 10, 222–224.
67. Soga, Y., Nishimura, F., Ohtsuka, Y., Araki, H., Iwamoto, Y., Naruishi, H., Shiomi, N., Kobayashi, Y., Takashiba, S., Shimizu, K., Gomita, Y., Oka, E.: CYP2C polymorphisms, phenytoin metabolism and gingival overgrowth in epileptic subjects. Life Sci. 2004; 74, 827–834.
68. Lee, A. Y., Kim, M. J., Chey, W. Y., Choi, J., Kim, B. G.: Genetic polymorphism of cytochrome P450 2C9 in diphenylhydantoin-induced cutaneous adverse drug reactions. Eur. J. Clin. Pharmacol. 2004; 60, 155–159.
69. P450 Drug Interaction Table. http://medicine.iupui.edu/ clinpharm/ddis/table.aspx (17. 5. 2011).
70. Suchopár, J., Buršík, J., Mach, R., Prokeš, M.: Kompendium lékových interakcí. 1. vyd. InfoPharm 2005.
71. Baxter, K., Davis, M., Driver, S. (eds.): Stockley’s drug interactions, 8th ed. Suffolk: Pharmaceuticals Press, 2008.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2011 Číslo 4-
Všetky články tohto čísla
- Zlepšení kvality léčby depresí a efektivity nákladů s tím spojených
- Nové knihy
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť II. Cytochróm P450 2C9
- Antagonisty angiotenzínových AT1 receptorov
- Prosolv® Easytab as a new multifunctional co-processed dry binder: a study of the properties of tablets and energy evaluation of the compaction process
- Antiflogistické hydrogély na báze ľalie bielej
- Vliv koncentrace polyvinylalkoholu na velikost oligoesterových polymerních nanočástic připravených metodou odpařování a rozdělování rozpouštědla
- Nové knihy
- K dějinám farmaceutického průmyslu v Českých zemích. Interpharma
- Zprávy
- Sympozium z historie farmacie a veterinární medicíny
- Kniha
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- K dějinám farmaceutického průmyslu v Českých zemích. Interpharma
- Antagonisty angiotenzínových AT1 receptorov
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť II. Cytochróm P450 2C9
- Nové knihy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



