-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Screening preeklampsie v I. trimestru těhotenství
First-trimester screening for preeclampsia
Design: Review article.
Setting: Department of Clinical Biochemistry, University Hospital Olomouc; Department of Obstetrics and Gynecology, Palacky University Olomouc, Faculty of Medicine and Dentistry, University Hospital Olomouc; The Institute for the Care of Mother and Child and 3rd Faculty of Medicine Charles University, Prague; G-CENTRUM Olomouc, Olomouc; Genetika Plzeň, Pilsen.
Methods, results: Preeclampsia (PE) is a multisystem disorder complicating pregnancy. It is the leading cause of maternal and perinatal mortality and morbidity worldwide. Recent studies have shown that high-risk pregnant women may benefit from low-dose acetylsalicylic acid early therapy in prevention of the development of severe forms of the disease. The risk group of pregnant women should be identified in 11–13 gestational week for effective prevention. The only procedure validated in many studies for performing PE screening with sufficient diagnostic accuracy in the first trimester of pregnancy is given by The Fetal Medicine Foundation (FMF) and has been adopted and published in a new recommendation by The International Federation of Gynecology and Obstetrics (FIGO).
Conclusion: This article summarizes the recent findings and recommendation for performing screening of preeclampsia in 1st trimester of pregnancy and how to prevent the development of severe forms of PE by low-dose acetylsalicylic acid therapy.
Keywords:
cervical length measurement – preeclampsia – maternal risk factors – mean arterial pressure – Uterine artery Pulsatility Index – Placental Growth Factor – acetylsalicylic acid – parameters
Autoři: L. Roubalová 1,2
; J. Vojtěch 3; J. Feyereisl 3; L. Krofta 3; A. Skřivánek 4; I. Marková 4; P. Lošan 5; R. Pilka 2; M. Lubušký 2
Působiště autorů: Oddělení klinické biochemie Fakultní nemocnice, Olomouc 1; Porodnicko-gynekologická klinika, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice, Olomouc 2; Ústav pro péči o matku a dítě a 3. lékařská fakulta Univerzity Karlovy, Praha 3; G-CENTRUM Olomouc, Olomouc 4; Genetika Plzeň, Plzeň 5
Vyšlo v časopise: Ceska Gynekol 2019; 84(5): 361-370
Kategorie: Přehledový článek
Souhrn
Typ studie: Systematický přehledový článek.
Název a sídlo pracoviště: Oddělení klinické biochemie, Fakultní nemocnice Olomouc; Porodnicko-gynekologická klinika, Lékařská fakulta Univerzity Palackého v Olomouci, Fakultní nemocnice Olomouc; Ústav pro péči o matku a dítě a 3. lékařská fakulta Univerzity Karlovy, Praha; G-CENTRUM Olomouc, Olomouc; Genetika Plzeň, Plzeň.
Metodika, výsledky: Preeklampsie (Preeclampsia, PE) je závažné multiorgánové onemocnění komplikující těhotenství. Je celosvětově hlavní příčinou mateřské a perinatální mortality a morbidity. Z provedených studií vyplynulo, že u těhotných žen se zvýšeným rizikem je možná prevence rozvoje závažných forem onemocnění včasným zahájením léčby kyselinou acetylsalicylovou. Aby byla prevence účinná, měla by být riziková skupina těhotných žen identifikována v 11.–13. gestačním týdnu. Jediná, v mnoha studiích validovaná metodika pro provádění screeningu PE s dostatečnou diagnostickou účinností v I. trimestru těhotenství je dána The Fetal Medicine Foundation (FMF) a byla přijata a publikována v novém doporučení The International Federation of Gynecology and Obstetrics (FIGO).
Závěr: Tento článek shrnuje nejnovější poznatky a postupy pro provádění screeningu preeklampsie v rámci kombinovaného screeningu v I. trimestru těhotenství a způsob prevence rozvoje závažných forem PE podáváním nízkých dávek kyseliny acetylsalicylové.
Klíčová slova:
predikce – preeklampsie – maternální – parametry – střední arteriální tlak – pulzatilní index v děložních tepnách – placentární růstový faktor – kyselina acetylsalicylová
PREDIKCE
Kombinovaný screening v I. trimestru těhotenství (v 11.–13. týdnu) by ve své optimální podobě měl být zaměřený na predikci a vyhledávání nejčastějších závažných porodnických komplikací, mezi které patří především velké porodnické syndromy (preeklampsie, růstová restrikce plodu, předčasný porod, nitroděložní úmrtí plodu) a vrozené vady plodu (především chromozomální a morfologické vady plodu) [3, 37].
Incidence uvedených porodnických komplikací je následující: preeklampsie (cca 1–5 %), růstová restrikce plodu (cca 5–10 %), předčasný porod (cca 8 %), úmrtí plodu v děloze (cca 0,5 %) a vrozené vady plodu (cca 2–3 %) [1, 13, 45].
Vzhledem k incidenci uvedených komplikací by měl být preferován komplexní screening nejen nejčastějších vrozených vad plodu (morfologických a chromozomálních), ale i těhotenství s rizikem rozvoje preeklampsie a růstové restrikce plodu. U žen se zvýšeným rizikem je možná účinná prevence rozvoje závažných forem onemocnění včasným zahájením léčby kyselinou acetylsalicylovou [9].
Etiologie a patogeneze preeklampsie
Preeklampsie (preeclampsia, PE) je závažné multiorgánové onemocnění komplikující těhotenství, které je charakterizováno placentární a kardiovaskulární dysfunkcí. Je celosvětově hlavní příčinou mateřské a perinatální mortality a morbidity. Odhaduje se, že následkem PE zemře každoročně více než 50 000 žen a 500 000 dětí [15].
Ačkoli patogeneze onemocnění ještě není zcela objasněna, všechny důkazy nasvědčují tomu, že příčina je spojená s poruchou infiltrace trofoblastických buněk do spirálních artérií, což vede k jejich nedostatečné remodelaci. Endotel nedostatečně remodelovaných artérií produkuje velké množství látek, které způsobují patologickou aktivaci koagulační kaskády v trombocytech a nerovnováhu v proangiogenních a antiangiogenních faktorech. Důsledkem špatného procesu placentace je snížený přísun krve do placenty, což způsobuje hypoxii s patologickými následky pro těhotnou ženu a plod. U plodu může dojít k rozvoji růstové restrikce (Fetal Growth Restriction, FGR) event. nitroděložnímu úmrtí a u těhotné ženy hrozí rozvoj multiorgánového postižení. V nejzávažnějších případech vyžaduje stav těhotné ženy a/nebo plodu iatrogenní předčasný porod, protože jediným kauzálním řešením patologického stavu je odstranění placenty. PE však neohrožuje ženu/plod pouze v těhotenství, ale významně zvyšuje riziko závažných kardiovaskulárních onemocnění v dalším životě [11, 18, 39].
PE není jedno onemocnění, ale zahrnuje dvě fenotypově odlišné jednotky. Patofyziologie těchto dvou stavů je odlišná, i když se mohou překrývat. Časná PE (early-onset PE) je definována jako porod s PE do 34. gestačního týdne a rozvíjí se jako důsledek především abnormální placentace a placentární dysfunkce. Pozdní PE (late-onset PE) je definována jako porod s PE od 34. týdne a vzniká především v důsledku kardiovaskulární dysfunkce těhotné ženy [40, 46]. Pro úplnost terminologie uvádíme i dělení na PE před termínem (porod s PE před 37. týdnem) a PE v termínu (porod s PE od 37. týdne) [24].
Tím, že patofyziologie pozdní PE převážně nesouvisí s placentou, je spojena s nižší mírou postižení plodu a příznivějšími perinatálními výsledky. Tato klasifikace má i prognostickou hodnotu, protože časná PE s sebou nese výrazně vyšší riziko komplikací jak pro těhotnou ženu, tak i pro plod [19, 28, 38, 44]. Hlavním úkolem predikce časné PE již v I. trimestru spočívá v identifikaci skupiny žen s rizikem rozvoje časné PE, u kterých lze zlepšit proces placentace včasným zahájením léčby kyselinou acetylsalicylovou.
Definice preeklampsie
V definici PE existují velké rozdíly nejen mezi zeměmi, ale i mezi jednotlivými profesními organizacemi. Mezinárodně dohodnutá definice PE byla stanovena The International Society for the Study of Hypertension in Pregnancy (ISSHP) [4] a byla přijata The International Federation of Gynecology and Obstetrics (FIGO) [24].
Podle tohoto doporučení je gestační hypertenze definována jako systolický tlak ≥ 140 mm Hg a/nebo diastolický tlak ≥ 90 mm Hg, naměřený dvakrát po čtyřech hodinách po 20. gestačním týdnu u dříve normotenzních žen. V návaznosti na zjištěnou gestační hypertenzi je PE definována jako přítomnost ≥ 1 z následujících, nově se objevujících symptomů:
- Proteinurie – Protein/Creatinine Ratio (PCR) > 30 g/mmol, odpad bílkoviny v moči dUCB ≥ 300 mg/24 hod nebo chemické vyšetření moči proužkem ≥ 2+, v souladu s doporučením odborné společnosti lze v České republice pro stanovení proteinurie použít i parametr Albumin/Creatinine Ratio (ACR) > 30 mg/mmol [8];
- Orgánová dysfunkce u těhotné ženy zahrnující akutní poškození ledvin (kreatinin ≥ 90 μmol/l), jater (elevace alaninaminotransferázy nebo aspartátaminotransferázy > 0,68 μkal/l) s nebo bez epigastrické bolesti nebo bolesti v pravém hypochondriu, neurologické komplikace (např. eklampsie, změna psychického stavu, cévní mozková příhoda, křeče, těžké bolesti hlavy a poruchy vizu) nebo hematologické komplikace (trombocytopenie – počet krevních destiček < 150×109/l, diseminovaná intravaskulární koagulace, hemolýza);
- Uteroplacentální dysfunkce – růstová restrikce plodu, zvýšená pulzatilita v pupečníkové tepně nebo mrtvý plod.
V České republice je – podle doporučeného postupu odborné společnosti (Česká gynekologická a porodnická společnost České lékařské společnosti Jana Evangelisty Purkyně, ČGPS ČLS JEP) – PE definována jako hypertenze s proteinurií vznikající po 20. týdnu těhotenství [8].
Doporučení k provádění screeningu PE
Jednotná metodika predikce PE při provádění kombinovaného screeningu v I. trimestru těhotenství není v České republice (ČR) definována žádnou z institucí, které zodpovídají za organizaci péče o těhotnou ženu (Ministerstvo zdravotnictví ČR – MZ ČR, odborná společnost ČGPS ČLS JEP).
V jiných zemích, pokud doporučení existuje, je riziko PE hodnoceno pouze na základě maternálních charakteristik a anamnestických rizikových faktorů [2, 12]. Diagnostická účinnost takto provedeného screeningu byla publikována až v roce 2018 na základě výsledků studie SPREE a výsledky ukázaly, že je velmi nízká. Při 10% falešné pozitivitě byla diagnostická účinnost pro PE před termínem 40 % a pro PE v termínu pouze 26 % [35].
Jediná, v mnoha studiích validovaná metodika pro provádění screeningu PE s dostatečnou diagnostickou účinností je dána The Fetal Medicine Foundation (FMF). K výpočtu rizika je využíván Bayesův theorém, který je založen na kombinování řady parametrů. Hodnoty jsou převáděny na násobky mediánu a vzájemnou kombinací všech parametrů je kalkulováno individuální riziko pro těhotnou ženu a dané gestační stáří. Riziko lze stanovit pouze validovaným software (SW), který je schopen kombinovat všechny požadované parametry [49].
Jak bylo uvedeno, účinnost takto provedeného screeningu byla validovaná v mnoha studiích. První validační studie O´Gormana a kol z roku 2016 ukázala, že při 10% falešné pozitivitě byla diagnostická účinnost časné PE 90 %, PE před termínem 75 % a PE v termínu 47 % [21] (graf 1).
Graf 1. Účinnost kombinovaného screeningu preeklampsie (PE) v I. trimestru těhotenství podle algoritmu The Fetal Medicine Foundation (FMF) Časná PE (< 34. gestační týden), PE před termínem (< 37. gestační týden) a PE v termínu (≥ 37. gestační týden); FPR – false positivity rate (falešná pozitivita).
Upraveno podle: O‘Gorman N et al. Competing risks model in screening for preeclampsia by maternal factors and biomarkers at 11-13 weeks gestation. Am J Obstet Gynecol, 2016, 214(1), p. 103.e1–103.e12.
Tan a kol analyzovali výsledky 61 174 screeningů jednočetných těhotenství provedených v 11. až 13. gestačním týdnu a stanovili diagnostickou účinnost pro kombinace jednotlivých parametrů. Z výsledků jednoznačně vyplynulo, že pro predikci vzniku PE před termínem je nejúčinnější kombinace maternálních parametrů (maternální charakteristiky a anamnestické rizikové faktory) a biofyzikálních (pulzatilní index v děložních tepnách) a biochemických parametrů (sérová hodnota placentárního růstového faktoru) [36] (tab. 1).
Tab. 1. Účinnost kombinovaného screeningu preeklampsie (PE) v I. trimestru těhotenství při hodnocení jednotlivých parametrů 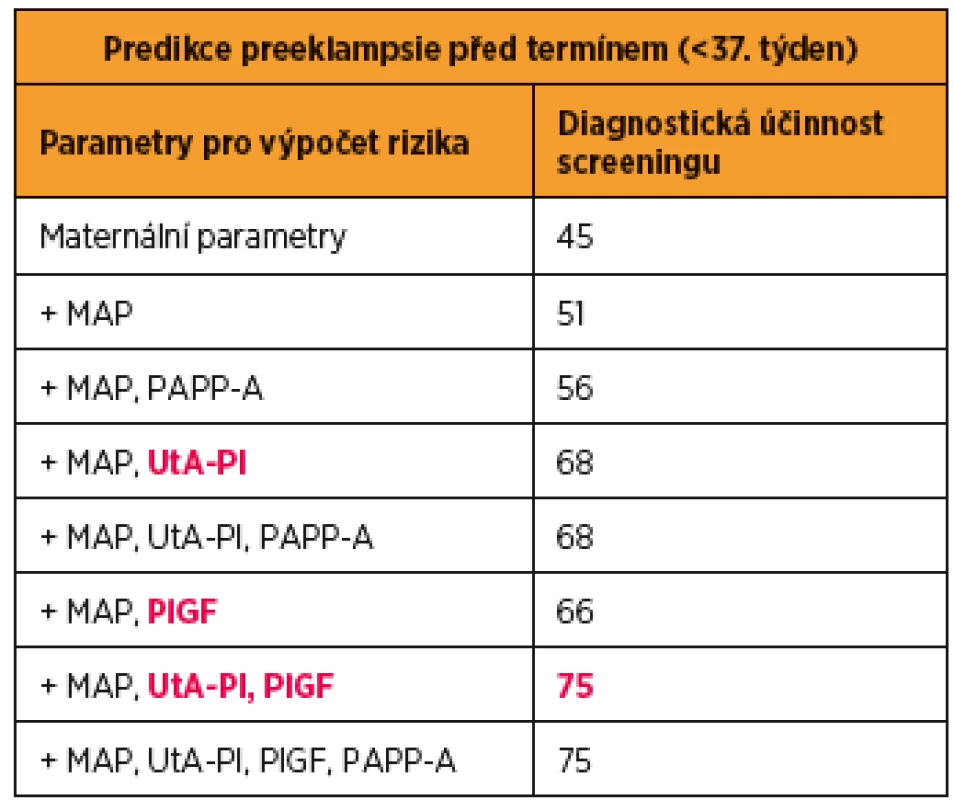
MAP – Middle Arterial Pressure (střední arteriální tlak), PAPP-A – Pregnancy Associated Plasma Protein-A (s těhotenstvím asociovaný plazmatický protein-A), UtA-PI – Uterine Artery Pulsatility Index (pulzatilní index v děložní tepně), PlGF – Placental Growth Factor (placentární růstový faktor).
Upraveno podle: Tan MY et al. Screening for pre-eclampsia by maternal factors and biomarkers at 11-13 weeks‘ gestation. Ultrasound Obstet Gynecol. 2018 Aug;52(2):186-195.Kombinovaný screening PE v I. trimestru těhotenství
Provedené validační studie vykazovaly tak vysokou diagnostickou účinnost, že tato metodika byla přijata a publikována v novém doporučení FIGO: A pragmatic giude for first-trimester screening and prevention [25].
V tomto dokumentu je jednoznačně uvedeno následující:
- všem těhotným ženám by měl být proveden Kombinovaný screening PE v I. trimestru těhotenství (schéma 1), kombinující parametry
- maternální – věk, výška, váha, rasa, chronická hypertenze, systémový lupus erythematodes a antifosfolipidový syndrom, způsob koncepce, PE v rodinné anamnéze (matka), diabetes mellitus (1. i 2. typu, užívání inzulinu), předchozí porodnická anamnéza (nullipara, předchozí porod bez PE a s PE), interval mezi předchozím a současným těhotenstvím (v letech, počítáno od data porodu posledního dítěte), gestační stáří v době předchozího porodu (v týdnech) a hmotnost novorozence narozeného po 24. gestačním týdnu (tab. 2);
- biofyzikální - hodnota středního arteriálního tlaku u těhotné ženy (Mean Arterial Pressure, MAP) a hodnota pulzatilního indexu v děložních tepnách při dopplerovském ultrazvukovém vyšetření (Uterine artery Pulsatility Index, UtA-PI);
- biochemické – hodnota placentárního růstového faktoru (Placental Growth Factor, PlGF);
- pro stanovení individuálního rizika by měla být použita metodika FMF viz https://fetalmedicine.org/research/assess/preeclampsia/first-trimester;
- u žen se zvýšeným rizikem by měla být zahájena léčba kyselinou acetylsalicylovou v dávce 150 mg perorálně večer denně od 11. až 14. týdne do 36. týdne těhotenství.
Tab. 2. Maternální parametry při kombinovaném screeningu preeklampsie (PE) v I. trimestru těhotenství 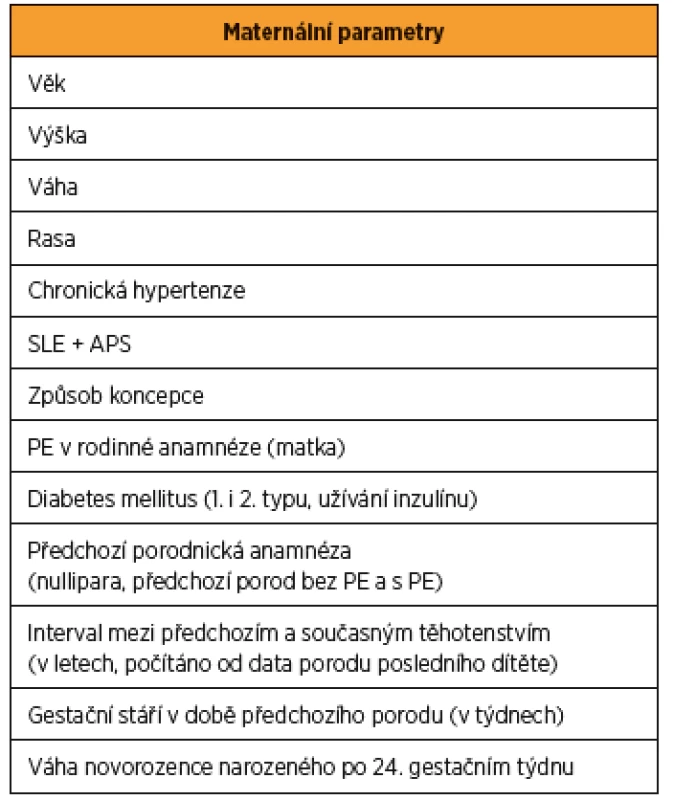
Systémový lupus erythematodes (SLE), Antifosfolipidový syndrom (APS). Upraveno podle: Poon LC et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. Int J Gynaecol Obstet. 2019 May;145 Suppl 1:1-33. Schéma 1 Kombinovaný screening preeklampsie (PE) v I. trimestru těhotenství
Pro stanovení individuálního rizika by měla být použita metodika The Fetal Medicine Foundation (FMF) viz https://fetalmedicine.org/ research/assess/preeclampsia/first-trimester. MAP (střední arteriální tlak, Mean Arterial Pressure), UtA-PI (pulzatilní index v děložních tepnách, Uterine artery Pulsatility Index), PlGF (placentární růstový faktor, Placental Growth Factor). Upraveno podle: Poon LC et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. Int J Gynaecol Obstet. 2019 May;145 Suppl 1:1-33.
Základní parametry podle metodiky FMF a doporučení FIGO
Maternální parametry: věk, výška, váha, rasa, chronická hypertenze, systémový lupus erythematodes a antifosfolipidový syndrom, způsob koncepce, PE v rodinné anamnéze (matka), diabetes mellitus (1. i 2. typu, užívání inzulinu), předchozí porodnická anamnéza (nullipara, předchozí porod bez PE a s PE), interval mezi předchozím a současným těhotenstvím (v letech, počítáno od data porodu posledního dítěte), gestační stáří v době předchozího porodu (v týdnech) a váha novorozence narozeného po 24. gestačním týdnu (tab. 2).
Biofyzikální parametry: hodnota středního arteriálního tlaku u těhotné ženy (Mean Arterial Pressure, MAP) a hodnota pulzatilního indexu v děložních tepnách při dopplerovském ultrazvukovém vyšetření (Uterine artery Pulsatility Index, UtA-PI)
Střední arteriální tlak (Mean Arterial Pressure, MAP) je průměrný (střední) tlak v průběhu jedné srdeční periody. Význam stanovení MAP v rámci screeningu v 11. až 13. týdnu při predikci PE poprvé popsali v roce 2008 Poon a kol. [25]. Podle Tana a kol. se diagnostická účinnost screeningu po přidání MAP k maternálním parametrům zvýšila na 51 % [36]. Nejedná se tedy o klíčový parametr, ale přispívá významným způsobem k lepší diagnostické účinnosti screeningu, zejména v kombinaci s PlGF a UtA-PI.
Postup pro správné měření krevního tlaku vychází z doporučení National Heart Foundation of Australia (NHFA) [20]. Poon a kol publikovali v roce 2011 zjednodušený protokol měření krevního tlaku pro výpočet MAP u těhotných žen, který byl přijat FIGO [24, 26].
Doporučený postup měření
Měření se má odehrávat v klidné místnosti a za příjemné teploty. Těhotná žena sedí uvolněně opřená o opěradlo židle a její paže spočívají na podložce. Manžety vhodné velikosti (malá < 22 cm, normální 22–32 cm nebo velká 33–42 cm) musí být umístěny na pažích ve výši srdce. Před měřením je nutné, aby těhotná žena seděla v klidu v pohodlné pozici s nezkříženýma nohama, s podepřenými pažemi nejméně pět, lépe deset minut. Po odpočinku se v obou pažích současně měří krevní tlak, a to dvakrát s odstupem jedné minuty. Výpočet MAP je prováděn ze čtyř hodnot systolického tlaku (systolic Blood Pressure, sBP) a diastolického tlaku (diastolic Blood Pressure, dBP) podle následujícího vzorce.
MAP=dBP+(sBP−dBP)/3
Pro měření se smí používat pouze ověřená automatizovaná a poloautomatizovaná zařízení. Seznam validovaných přístrojů je k dispozici na www.dableducational.org/sphygmomanometers/devices_1_clinical.
Pulzatilní index v děložních tepnách (Uterine artery Pulsatility Index, UtA-PI)
Jedná se o ultrazvukový parametr, který je stanoven při dopplerovském ultrazvukovém vyšetření. Hodnotí se průtok v děložních tepnách, které reagují na změny odporu periferních tkání. Zvýšená hodnota pulzatilního indexu v děložních tepnách koreluje s histologickými nálezy i s klinickou závažností PE. Tento neinvazivní parametr umožňuje posoudit hemodynamiku v uteroplacentární cirkulaci [17, 24].
V průběhu normálního těhotenství se hodnoty UtA-PI snižují a až před termínem porodu se mohou nepatrně zvýšit [6, 7]. Abnormální placentace u PE vede ke zvýšení odporu v uteroplacentární cirkulaci, jehož následkem je zvýšená hodnota UtA-PI [22].
Z rozsáhlé metaanalýzy 17 studií zabývajících možností využití UtA-PI při predikci PE vyplynulo, že hodnoty nad 90. centil mají jako samostatný parametr diagnostickou účinnost pro časnou PE 48 %, při falešné pozitivně 8 % a pro pozdní PE 26 %, při falešné pozitivitě 7 % [43].
Doporučený postup měření
Ultrazvukové vyšetření by mělo být provedeno transabdominální sondou v týdnu těhotenství 11+0 až 13+6. Gestační stáří musí být stanoveno podle biometrického parametru CRL 42–84 mm (Crown-Rump Length, temeno-kostrční délka plodu). Děložní hrdlo se zobrazí v sagitální rovině a stanovení UtA-PI se provádí v paracervikální oblasti u vstupu děložní tepny do dělohy. Děložní tepna se zobrazí pomocí barevné dopplerometrie, oblast měření „sample volume“ by měla být 2 mm a úhel snímání menší než 30°. Má-li křivka optimální kvalitu po nejméně 3 cykly, je možno stanovit hodnotu UtA-PI na obou stranách a vypočítat průměrnou hodnotu.
Podrobný postup je uveden v doporučení The International Society of Ultrasound in Obstetrics and Gynecology (ISUOG) [32].
Podle doporučení FIGO [24] musí být stanovení UtA-PI prováděno vyšetřujícím certifikovaným FMF (37).
Mezi biochemické parametry, které se započítávají do výsledného rizika, řadíme sérovou hodnotu placentárního růstového faktoru (Placental Growth Factor, PlGF) a s těhotenstvím asociovaného plazmatického proteinu A (Pregnancy Asscociated Plasma Protein-A, PAPP-A). Vzhledem k nedostatečné standardizaci jednotlivých parametrů existují významné rozdíly mezi naměřenými hodnotami v závislosti na zvoleném systému [16, 30, 34, 41]. Používaný SW by měl být schopen přepočítat absolutní hodnoty na násobky mediánu v závislosti na použitém měřicím systému. Doporučenými systémy jsou systémy Roche, ThermoFisher a Perkin Elmer [24].
Základní analytické požadavky biochemických parametrů screeningu jsou uvedeny ve společném doporučení odborných společností (Česká společnost klinické biochemie – ČSKB ČLS JEP, Společnost lékařské genetiky a genomiky – SLG ČSL JEP [33].
Placentární růstový faktor (Placental Growth Factor, PlGF)
Jedná se nejdůležitější proangiogenní faktor, který patří do rodiny vaskulárních endoteliálních růstových faktorů (Vascular Endothelial Growth Factor, VEGF). Je produkován především buňkami endotelu a trofoblastu. Působí na buňky endotelu cév, stimuluje jejich proliferaci, spolu s dalšími mediátory zvyšuje permeabilitu a indukuje angiogenezi. Bylo prokázáno, že změny v koncentraci PlGF souvisí s rozvojem PE. Snížená hladina v prvním trimestru odráží míru placentární insuficience. Je jednoznačně nejvýznamnějším biochemickým parametrem pro predikci vzniku PE [45].
S těhotenstvím asociovaný plazmatický protein A (Pregnancy Associated Plasma Protein A, PAPP-A)
Patří do rodiny plazmatických proteinů asociovaných s těhotenstvím. Tento enzym, metaloproteináza závislá na zinku, štěpí IGFBP-4, 2 a 5 (Inzulin like Grow Factor Binding Protein). Štěpením vznikají volné IGF (Inzulin like Growth Factors), které se uplatňují při lokálních proliferačních reakcích. Tím se PAPP-A aktivně zapojuje do procesu růstu, diferenciace a reparace, což je pravděpodobně jeho hlavní úloha během těhotenství. Jeho skutečná biologická funkce zatím není úplně jasná. Během těhotenství je produkován buňkami syncytiotrofoblastu ve formě dimerického tetrameru. Dvě molekuly PAPP-A jsou spojeny disulfidickými můstky se dvěma molekulami glykosilované proformy hlavního bazického eozinofilního proteinu (pro Major Basic Protein, pro MBP). Syntéza PAPP-A byla prokázána i u mužů a netěhotných žen, ale pouze v homodimerické formě, nevázané s pro MBP [48].
Syntéza v těhotenství byla prokázána již během 7. týdne a pokračuje až do porodu. Snížené hodnoty svědčí pro aneuploidie u plodu, a to pouze během I. trimestru těhotenství, po 14. týdnu je snížení hodnot již nevýznamné. Hodnota PAPP-A jako samostatný parametr však nemá dostatečnou diagnostickou účinnost pro predikci PE, protože pouze 8–23 % žen s PE má hodnoty nižší než 0,4 MoM [10, 31]. Je-li při screeningu PE k dispozici biochemický parametr PlGF, tak přidáním parametru PAPP-A se diagnostická účinnost již nezvýší [36].
Optimální hodnota cut-off
Při výběru optimální cut-off hodnoty individuálního rizika pro rozvoj PE, která identifikuje „těhotenství se zvýšeným rizikem rozvoje PE“, je nutné zamyslet se nad vstupními rizikovými faktory, které tuto hodnotu ovlivňují. U screeningu PE se ocitáme ve zcela stejné situaci jako u rizika Downova syndromu. Ani tady nelze použít individuální hodnotu cut-off, ale hodnota musí být stanovena s ohledem na nejrizikovější faktor a tím je, v případě Downova syndromu, věk těhotné ženy. Riziko vzniku PE ovlivňuje celá řada parametrů a není možné používat hodnoty cut-off v závislosti na jednotlivých parametrech. Optimální hodnota cut-off pro multietnickou populaci byla stanovena na 1 : 100 [36]. Nicméně v závislosti na rase může být falešná pozitivita vyšší než 10 %. U screeningu Downova syndromu se snažíme falešnou pozitivitu co nejvíce snižovat, protože následně indikované invazivní výkony jsou spojeny s rizikem spontánního potratu zdravého plodu. V případě těhotenství se zvýšeným rizikem rozvoje PE je těhotné ženě nabídnuta léčba kyselinou acetylsalicylovou, která nemá žádné závažné nežádoucí účinky na těhotnou ženu nebo plod a zvýšená falešná pozitivita screeningu je tudíž akceptovatelná [1].
PREVENCE
Prevence velkých porodnických syndromů způsobených poruchou placentace je složitá. Je známo, že odpočinek v posteli a různé dietní manipulace riziko vzniku PE nesnižují. Účinné je podávání vápníku u populace žen s jeho nízkým příjmem, čímž se riziko PE může snížit až na polovinu. Odpočinek na lůžku, omezení příjmu soli a suplementace různými vitaminy však účinné nejsou. V mnoha studiích bylo prokázáno, že podávání nízkých dávek kyseliny acetylsalicylové v těhotenství významným způsobem snižuje výskyt PE [1, 14].
Mechanismus účinku kyseliny acetylsalicylové (Aspirin, Anopyrin)
Kyselina acetylsalicylová ireverzibilně (nevratně) inaktivuje enzym cyklooxygenázu (COX), který je v organismu odpovědný za syntézu prostaglandinů a tromboxanů z kyseliny arachidonové. Díky tomu má výrazné protizánětlivé a antitrombotické účinky. Pro prevenci placentární insuficience je nejdůležitějším mechanismem selektivní inhibice syntézy tromboxanu bez ovlivnění syntézy prostacyklinu. Tím se snižuje riziko zvýšené vazokonstrikce cév, agregace krevních destiček a tvorby trombů v placentě. Kromě toho zlepšuje nedostatečnou trofoblastickou invazi produkcí specifických cytokinů, snížením apoptózy a změnou buněčné agregace a fúze. V hypoxických podmínkách vykazuje i proangiogenní účinky tím, že inhibuje expresi sFlt-1 v lidských trofoblastech [42]. Podávání antitrombotických léků založených na jiném principu (např. léky z řady nízkomolekulárních heparinů) nemá na prevenci placentárních onemocnění žádný vliv.
Studie ASPRE
Účinek Aspirinu byl validován v mezinárodní multicentrické studii ASPRE (Combined Multimarker Screening and Randomized Patient Treatment with Aspirin for Evidence-Based Preeclampsia Prevention). Těhotným ženám v této studii byl proveden kombinovaný screening v 11.–13. týdnu těhotenství a podle metodiky FMF byla identifikována skupina žen se zvýšeným rizikem rozvoje PE. Těmto ženám byl podáván Aspirin v dávce 150 mg perorálně, jedenkrát denně, večer. Léčba byla zahájena asi ve 12. týdnu, vždy však před 16. týdnem. Jak již bylo uvedeno, Aspirin pomáhá při zlepšování procesu placentace. Pokud je vývoj placenty dokončen v 16. týdnu, měla by léčba začít v době, kdy proces placentace probíhá a nikoli po jeho ukončení. Z tohoto důvodu je stanovení rizika rozvoje PE po 16. týdnu (např. v rámci screeningu vrozených vad plodu ve II. trimestru) zavádějící, protože účinnost preventivního podávání Aspirinu po 16. týdnu je nízká. Léčba byla ukončena před 36. týdnem z důvodů obav, že by Aspirin mohl způsobit krvácení do mozku nebo jiné hemoragické poruchy u plodu a novorozence [5, 29].
Aspirin podávaný od 12. do 36. týdne, snížil výskyt PE před termínem o 62 %, časné PE před 34. týdnem o 82 % a PE před 32. týdnem téměř o 90 %. Podle očekávání podávání Aspirinu nemělo významný vliv na výskyt pozdní PE. Naopak největší účinek má Aspirin na rozvoj časné PE a téměř eliminuje její nejzávažnější formy (HELLP syndrom a formy rozvíjející se před 32. týdnem) [29] (graf 2).
Graf 2. Účinnost preventivního podávání Aspirinu na jednotlivé typy preeklampsie (PE) Závažné formy časné PE (< 32. gestační týden), časná PE (< 34. gestační týden), PE před termínem (< 37. gestační týden) a PE v termínu (≥ 37. gestační týden). Upraveno podle: Rolnik DL et al. Aspirin versus placebo in pregnancies at high risk for preterm preeclampsia. N Engl J Med, 2017, 377(7), p. 613–622. 
Ekonomická efektivita screeningu a prevence PE
Nejdůležitějším cílem screeningového programu je bezpochyby předejít výskytu těžkých porodnických komplikací a prevence narození dítěte s těžkými poruchami tělesného a duševního vývoje. Jedním z dalších cílů je minimalizovat finanční zátěž veřejného zdravotního systému. Náklady na péči o komplikovaná těhotenství a následně o předčasně narozené děti jsou vysoké. Jediným prostředkem na snížení těchto nákladů je účinná prevence resp. predikce. V České republice informace o nákladech na péči o těhotnou ženu s PE a předčasně narozené děti v důsledku PE zatím nejsou dostupné.
V Kalifornii byly náklady na nekomplikovaný vaginální porod v roce 2014 vyčísleny na 4 500 USD, zatímco náklady na těhotenství komplikované hypertenzním onemocněním činily 12 700 USD. Detailní analýza ukázala, že největší část nákladů připadala na ženy, jejichž stav vyžadoval ukončení těhotenství před 34. gestačním týdnem [27].
Ještě mnohem větší část tvořily náklady spojené s péčí o předčasně narozeného novorozence na jednotce neonatální intenzivní péče (Neonatal Intensive Care Unit, NICU). Zatímco náklady na péči o těhotnou ženu, která porodila před 32. gestačním týdnem, se zvýšily 2,7krát, náklady na péči o novorozence narozeného před 32. gestačním týdnem se zvýšily 35krát [23].
Jedním z vedlejších cílů studie ASPRE byla analýza ekonomické efektivity prevence při podávání Aspirinu vysoce rizikovým ženám. Analýza sice neprokázala významné snížení počtu novorozenců přijatých na jednotku NICU (6,8 % kontrolní skupina vs. 6,2 % vysoce riziková skupina), ale prokázala snížení délky hospitalizace těchto novorozenců na NICU o 68 % (31,4 dnů vs. 11,1 resp.) [47]. Jestliže náklady na péči o novorozence jsou dominantní položkou, snížení doby hospitalizace představuje významné množství ušetřených prostředků z veřejného zdravotního pojištění. Náklady na predikci a prevenci PE jsou ve srovnání s výše uvedenými náklady okrajové.
ZÁVĚR
Preeklampsie představuje závažnou porodnickou komplikaci, jejíž jedinou účinnou léčbou je ukončení těhotenství, v mnoha případech iatrogenním předčasným porodem. Výsledky studie ASPRE jednoznačně prokázaly protektivní účinek podávání nízkých dávek kyseliny acetylsalicylové na rozvoj časné PE a jejích nezávažnějších forem. Predikce PE v rámci kombinovaném screeningu v I. trimestru těhotenství (v 11. až 13. týdnu) umožní identifikovat rizikové skupiny těhotných žen, které by mohly profitovat z profylaktického prodávání kyseliny acetylsalicylové. Největší diagnostickou účinnost vykazuje screening provedený podle metodiky FMF, založený na kombinaci mateřských, biofyzikálních a biochemických parametrů.
Korespondující autor:
prof. MUDr. Marek Ľubušký, Ph.D., MHA
Centrum fetální medicíny
Porodnicko-gynekologická klinika
Univerzita Palackého v Olomouci, Lékařská fakulta
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
Zdroje
1. A transcript of Professor Kypros Nicolaides‘s webcast, broadcast on April 24th 2018, First Trimester Prediction and Prevention of Pre-term Pre-eclampsia.
2. ACOG Practice Bulletin No. 202: Gestational Hypertension and Preeclampsia. Obstet Gynecol, 2019, 133(1), p. e1–e25.
3. Brosens, I., Pijnenborg, R., Vercruysse, L., Romero, R. The „Great Obstetrical Syndromes“ are associated with disorders of deep placentation. Am J Obstet Gynecol, 2011, 204(3), p. 193–201.
4. Brown, MA., Magee, LA., Kenny, LC., et al. The hypertensive disorders of pregnancy: ISSHP classification, diagnosis & management recommendations for international practice. Pregnancy Hypertens, 2018, 13, p. 291–310.
5. Bujold, E., Roberge, S., Nicolaides, KH. Low-dose aspirin for prevention of adverse outcomes related to abnormal placentation. Prenat Diagn, 2014, 34, p. 642–648.
6. Carbillon, L., Challier, JC., Alouini, S., et al. Uteroplacental circulation development: Doppler assessment and clinical importance. Placenta, 2001, 22, p. 795–799.
7. Carbillon, L., Perrot, N., Uzan, M., Uzan, S. Doppler ultrasonography and implantation: A critical review. Fetal Diagn Ther, 2001, 16, p. 327–332.
8. Doporučený postup ČGPS ČLS JEP č.6/2019 sb. Management hypertenzních onemocnění v těhotenství, http://www.gynultrazvuk.cz/data/clanky/6/dokumenty/2019–06-management-hypertenznich-onemocneni-v-tehotenstvi-dp-cgps-cls-jep-revize.pdf
9. Doporučený postup ČGPS ČLS JEP č.1/2019 sb.: Zásady dispenzární péče v těhotenství, http://www.gynultrazvuk.cz/data/clanky/6/dokumenty/2019-01-zasady-dispenzarni-pece-v-tehotenstvi-dp-cgps-cls-jep-revize.pdf
10. Dugoff, L., Hobbins, JC., Malone, FD., et al. First-trimester maternal serum PAPP-A and free-beta subunit human chorionic gonadotropin concentrations and nuchal translucency are associated with obstetric complications: a population-based screening study (the FASTER Trial). Am J Obstet Gynecol, 2004, 191, p. 1446–1451.
11. Duhig, K., Vandermolen, B., Shennan, A. Recent advances in the diagnosis and management of pre-eclampsia. F1000Res. 2018, 7, p. 242.
12. Excellence. NIfHaC. CG107 NICE Guideline: Hypertension in Pregnancy, 2012.
13. Figueras, F., Gratacos, E., Rial, M., et al. Revealed versus concealed criteria for placental insufficiency in an unselected obstetric population in late pregnancy (RATIO37): randomized controlled trial study protocol. BMJ Open, 2017, 15.
14. Hofmeyr, GJ., Lawrie, TA., Atallah, AN., et al. Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems. Cochrane Database Syst Rev, 2014, 6: CD001059.
15. Högberg, U. The World Health Report 2005: „make every mother and child count“ – including Africans. Scand J Public Health, 2005, 33(6), p. 409–411.
16. Chan, SL., et al. Analytical validation of soluble fms-like tyrosine and placental growth factor assays on B·R·A·H·M·S KRYPTOR Compact Plus automated immunoassay platform. Pregnancy Hypertens, 2018, 11, p. 66–70.
17. Ľubušký, M., Machač, Š. Prenatální dopplerometrie. Lék Listy, 2003, 41, s. 11–13.
18. Magee, LA., Pels, A., Helewa, M., Rey, E., von Dadelszen, P. Canadian Hypertensive Disorders of Pregnancy (HDP) Working Group. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy. Pregnancy Hypertens, 2014, 4(2), p. 105–145.
19. Melchiorre, K., Wormald, B., Leslie, K., et al. First-trimester uterine artery doppler indices interm and preterm pre-eclampsia. Ultrasound Obstet Gynecol, 2008, 32, p. 133–137.
20. National Heart Foundation of Australia. Hypertension Management Guide for Doctors. 2004. [website] www.heartfoundation.org.au. Accessed April 1, 2006.
21. O‘Gorman, N., et al. Competing risks model in screening for preeclampsia by maternal factors and biomarkers at 11–13 weeks gestation. Am J Obstet Gynecol, 2016, 214(1), p. 103.e1–103.e12
22. Olofsson, P., Laurini, RN., Marsal, K. A high uterine artery pulsatility index reflects a defective development of placental bed spiral arteries in pregnancies complicated by hypertension and fetal growth retardation. Eur J Obstet Gynecol Reprod Biol, 1993, 49, p. 161–168.
23. Phibbs, CS., Schmitt, SK., Cooper, M., et al. Birth hospitalization costs and days of care for mothers and neonates in California, 2009–2011. J Pediatr. 2019, 204, p. 118–125.e14.
24. Poon, LC., et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. Int J Gynaecol Obstet, 2019, 145, Suppl. 1, p. 1–33.
25. Poon, LC., Kametas, NA., Pandeva, I., et al. Mean arterial pressure at 11(+0) to 13(+6) weeks in the prediction of preeclampsia. Hypertension, 2008, 51, p. 1027–1033.
26. Poon, LC., Kametas, NA., Valencia, C., et al. Hypertensive disorders in pregnancy: Screening by systolic diastolic and mean arterial pressure at 11–13 weeks. Hypertens Pregnancy, 2011, 30, p. 93–107.
27. Pourat, N., Martinez, AE., Jones, JM., et al. Costs of gestational hypertensive disorders in California: hypertension, preeclampsia, and eclampsia. Los Angeles, CA: UCLA Center for Health Policy Research, 2013.
28. Raymond, D., Peterson, E. A critical review of early-onset and late-onset preeclampsia. Obstet Gynecol Surv, 2011, 66, p. 497–506.
29. Rolnik, DL., et al. Aspirin versus placebo in pregnancies at high risk for preterm preeclampsia. N Engl J Med, 2017, 377 (7), p. 613–622.
30. Salahuddin, S., et al. KRYPTOR-automated angiogenic factor assays and risk of preeclampsia-related adverse outcomes. Hypertens Pregnancy, 2016, 35(3), p. 330–345.
31. Smith, GC., Stenhouse, EJ., Crossley, JA., et al. Early pregnancy levels of pregnancy-associated plasma protein a and the risk of intrauterine growth restriction, premature birth, preeclampsia, and stillbirth. J Clin Endocrinol Metab, 2002, 87, p. 1762–1767.
32. Sotiriadis, A., Hernandez-Andrade, E., da Silva Costa, F., et al. ISUOG Practice Guidelines: Role of ultrasound in screening for and follow-up of pre-eclampsia. Ultrasound Obstet Gynecol, 2019, 53, p. 7–22.
33. Společný doporučený postup ČSKB ČLS JEP a SLG ČLS JEP: Doporučení o laboratorním screeningu vrozených vývojových vad v prvním a druhém trimestru těhotenství. http://www.cskb.cz/res/file/doporuceni/2018/doporuceni-7-5-2018-vidiSLG.pdf
34. Stepan, H., et al. Elecsys® and Kryptor immunoassays for the measurement of sFlt-1 and PlGF to aid preeclampsia diagnosis: are they comparable? Clin Chem Lab Med, 2019, 57(9), p. 1339–1348.
35. Tan, MY., et al. Comparison of diagnostic accuracy of early screening for pre-eclampsia by NICE guidelines and a method combining maternal factors and biomarkers: results of SPREE. Ultrasound Obstet Gynecol, 2018, 51(6), p. 743–750.
36. Tan, MY., et al. Screening for pre-eclampsia by maternal factors and biomarkers at 11–13 weeks‘ gestation. Ultrasound Obstet Gynecol, 2018, 52(2), p. 186–195.
37. The Fetal Medicine Foundation. http://www.fetalmedicine.com
38. Thilaganathan, B. Author‘s reply re: Pre-eclampsia is primarily a placental disorder: AGAINST: Pre-eclampsia: the heart matters. BJOG, 2018, 125(4), p. 512–513.
39. Thilaganathan, B. Placental syndromes: getting to the heart of the matter. Ultrasound Obstet Gynecol,. 2017, 49(1), p. 7–9.
40. Valensise, H., Vasapollo, B., Gagliardi, G., Novelli, GP. Early and late preeclampsia: two different maternal hemodynamic states in the latent phase of the disease. Hypertension, 2008, 52(5), p. 873–880.
41. van Helden, J., Weiskirchen, R. Analytical evaluation of the novel soluble fms-like tyrosine kinase 1 and placental growth factor assays for the diagnosis of preeclampsia. Clin Biochem, 2015, 48(16–17).
42. Vane, JR., Botting, RM. The mechanism of action of aspirin. Thromb Res, 2003, 110(5–6), p. 255–258.
43. Velauthar, L., Plana, MN., Kalidindi, M., et al. First-trimester uterine artery Doppler and adverse pregnancy outcome: A meta-analysis involving 55,974 women. Ultrasound Obstet Gynecol, 2014, 43, p. 500–507.
44. Verlohren, S. Author‘s reply re: Pre-eclampsia is primarily a placental disorder: FOR: Pre-eclampsia is primarily a placental disorder. BJOG, 2018, 125(4), p. 513–514.
45. Vlk, R., Procházka, M., Měchurová, A., et al. Preeklampsie – od patofyziologie ke klinické praxi, 1. vyd. Praha: Maxdorf, 2015.
46. Von Dadelszen, P., Magee, LA., Roberts, JM. Subclassification of preeclampsia. Hypertens Pregnancy, 2003, 22, p. 143–148.
47. Wright, D., Rolnik, DL., Syngelaki, A., et al. Aspirin for Evidence-Based Preeclampsia Prevention trial: Effect of Aspirin on length of stay in the neonatal intensive care unit. Am J Obstet Gynecol, 2018, 218, p. 612. e1–612.e6.
48. Wright, D., Silva, M., Papadopoulos, S., et al. Serum pregnancy-associated plasma protein –A in the three trimesters of pregnancy: Effects of maternal characteristics and medical history. Ultrasound Obstet Gynecol, 2015, 46, p. 42–50.
49. Wright, D., Akolekar, R., Syngelaki, A., et al. A competing risks model in early screening for preeclampsia. Fetal Diagn Ther, 2012, 32(3), p. 171–178.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2019 Číslo 5- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Deložní leiomyomy s bizarními jádry: analýza 37 prípadu po laparoskopické ci otevrené myomektomii
- Účinnost dienogestu v terapii klinických symptomů endometriózy rektovaginálního septa
- Profylaktická oboustranná balonková okluze ilických arterií během císařského řezu u Svědkyně Jehovovy
- Akutní apendicitida v šestinedělí
- Ruptura dělohy v graviditě
- Heterotopická gravidita Vitální intrauterinní gravidita týden 12+4, vitální tubární gravidita týden 11+4
- Současné možnosti predikce předčasného porodu
- Screening preeklampsie v I. trimestru těhotenství
- Přeměna mezenchymálních a epiteliálních buněk – vliv na funkci a receptivitu endometria
- ERAS protokol u onkogynekologických operací
- Syndrom Mayer-Rokitansky-Küster-Hauser – ageneze dělohy a pochvy: aktuální znalosti a terapeutické možnosti
- Anatomie a biomechanika musculus levator ani
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom Mayer-Rokitansky-Küster-Hauser – ageneze dělohy a pochvy: aktuální znalosti a terapeutické možnosti
- ERAS protokol u onkogynekologických operací
- Screening preeklampsie v I. trimestru těhotenství
- Ruptura dělohy v graviditě
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



