-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Matrix Gla protein jako přirozený inhibitor vaskulárních kalcifikací a potenciální léčebný cíl
Matrix Gla protein as natural inhibitor of vascular calcification and potential treatment target
Vascular calcification was once regarded as an advanced stage of atherosclerosis only. However, calcification is currently considered as highly regulated and potentially reversible process.
Matrix Gla protein (MGP) represents natural inhibitor of vascular calcification, whereas vitamin K is key co-factor of its maturation to the active form. There is accumulating evidence that vitamin K status and corresponding MGP activity may influence cardiovascular risk. This review summarizes pathophysiological mechanism and recent evidence relative to MGP. Moreover, available data concerning vitamin K supplementation are depicted.Keywords:
matrix Gla protein, vitamin K, vascular calcifications, cardiovascular diseases
Autori: doc. MUDr. CSc. Otto Mayer jr.
Pôsobisko autorov: Biomedicinské centrum LF UK Plzeň: E. Beneše ; II. interní klinika LF UK a FN Plzeň
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 179-182
Kategória: Přehledový článek
Súhrn
Vaskulární kalcifikace byly dlouho považovány pouze za pokročilé stadium aterosklerózy. Recentně však bylo prokázáno, že se jedná o vysoce regulovaný a potenciálně reverzibilní proces.
Matrix Gla protein představuje přirozený inhibitor tkáňové kalcifikace a vitamin K je klíčovým faktorem biotransformace tohoto proteinu do aktivní formy. V poslední době přibývá důkazů, že biologická dostupnost vitaminu K a související aktivita MGP může významně ovlivňovat kardiovaskulární riziko. Článek shrnuje recentní poznatky o MGP, zmíněn je i možný přínos suplementace vitaminem K.Klíčová slova:
matrix Gla protein, vitamin K, vaskulární kalcifikace, kardiovaskulární chorobyÚvod
Základním principem primární i sekundární prevence aterovaskulárních chorob je farmakologické či nefarmakologické ovlivnění rizikových faktorů. Jakkoli základní komponentou kardiovaskulární prevence zůstává kontrola 4 konvenčních faktorů (tj hypertenze, hyperlipidemie, poruchy glukózového metabolismu a kouření) (1), multifaktoriální etiologie aterosklerózy i souvisejícího trombotického procesu připouští přinejmenším spoluúčast dalších (a to alespoň potenciálně ovlivnitelných) patofyziologických procesů. V posledních letech se ukazuje, že příkladem takového procesu by mohla být vaskulární kalcifikace.
Vaskulární kalcifikace a kardiovaskulární riziko
Kalcifikace cévní stěny (někdy nazývaná též kalcifikující vaskulopatie) byla donedávna vnímána jako jednosměrný pasivní proces bez vlastního většího klinického významu. To, že většina aterosklerotických lézí je v pokročilých stadiích kalcifikována, je díky snadné zobrazitelnosti běžnými rentgenovými metodami známo již desítky let. Klinické vnímání vaskulárních kalcifikací však bylo dlouho zúženo převážně na tzv. mediokalcinózu tepen dolních končetin jako projev sice pokročilé ischemické choroby dolních končetin, ale sám o sobě v podstatě benigní proces. Na druhé straně je průkaz vaskulárních kalcifikací u dialyzovaných pacientů paradoxně považován za „terminální stadium vaskulární nemoci“ a jeden z projevů „vaskulární katastrofy“, dialýzu provázející. Tyto dva příklady však představují pouze krajní polohy problematiky a vaskulární kalcifikace je v převážné většině spíše subklinický proces, dlouhou dobu zachytitelný pouze pomocí speciálních vyšetřovacích technik.
Jedním z přístupů ke kvantifikaci kalcifikací koronárního řečiště je tzv. Agatstonovo skóre, získané ultrarychlou (electron beam) či multidetektorovou výpočetní tomografií (2). Jedná se o semiautomatický nástroj kvantifikace tkáňové kalcifikace kalkulovaný na základě denzity tkáně v Hounsfieldových jednotkách a plochy postižení. Metaanalýza 6 prospektivních studií zahrnující 27 622 subjektů doposud asymptomatických z hlediska manifestní kardiovaskulární choroby prokázala, že přítomnost jakéhokoliv detekovatelného Agatstonova skóre (tj. většího než 0) byla spojena s asi 4,3× vyšším rizikem úmrtí či infarktu myokardu ve srovnání se subjekty s Agatstonovým skórem rovným nule (2). Jiná předcházející metaanalýza 4 prospektivních studií nalezla kvantitativní závislost mezi Agatstonovým skóre a kardiovaskulárním rizikem, kdy středně zvýšené skóre (1−100) bylo spojené s asi dvojnásobným rizikem budoucí kardiovaskulární příhody, zatímco skóre přesahující 400 dokonce s více než 10× vyšším rizikem (3).
Patologicko-anatomicky kalcifikace v kardiovaskulárním systému představují převážně diskrétní koncentrické usazování kalcia v hladké svalovině tepenné medie, může k ním však docházet i přímo v myokardu nebo v srdečních chlopních. Teoreticky se předpokládá, že přítomnost kalcifikace ve sklerotických lézích představuje jakýsi kompenzační mechanismus ke zvýšení stability sklerotického plátu, a tedy že její nález paradoxně implikuje též spolupřítomnost naopak „měkkých“ (tj. nekalcifikovaných) nestabilních plátů (4, 5). Z klinického hlediska je však daleko důležitější, že vaskulární (či tkáňová) kalcifikace představuje vysoce regulovaný (z hlediska patofyziologie sdílí mnohé charakteristiky s embryonální mineralizací kosti) a hlavně přinejmenším do určité míry reverzibilní proces (6).
Matrix Gla protein jako inhibitor kalcifikace
MGP (matrix Gla [γ-karboxyglutamát]) protein) je cirkulující přirozený inhibitor kalcifikace secernovaný především chondrocyty a kromě toho též buňkami hladké svaloviny tunica media arteriální stěny (7, 8). Význam MGP poprvé nastínily experimentální studie s transgenní myší, kde byla absence genu pro syntézu MGP provázena masivními cévními kalcifikacemi a předčasným úmrtím na vaskulární příhodu (9). Kruciální roli v syntéze MGP hraje vitamin K, a to jako kofaktor enzymu γ-glutamát karboxylázy, který konvertuje zbytky kyseliny glutamové na γ-karboxylglutamát (Gla) (10). Klíčové místo vitaminu K v prevenci vaskulárních kalcifikací potvrzují poměrně bohaté důkazy o nežádoucím účinku warfarinu (antagonisty vitaminu K) ve smyslu těchto komplikací, kdy warfarinem indukovaná kalcifikace představuje experimentální model tohoto patofyziologického stavu u laboratorních zvířat (11).
Antikalcemické vlastnosti MGP zajišťuje pět γ-karboxylglutamátových (Gla) reziduí, které slouží jako vazebná skupina pro kalcium. Maturace biologicky aktivního MGP však zahrnuje ještě druhý transformační krok, fosforylaci tří serinových zbytků. Biologická role tohoto transformačního kroku není zcela jasná, neboť antikalcemickou aktivitu zajišťuje již ten první. Předpokládá se nicméně, že hraje roli v regulaci sekrece MGP ze syntetizující buňky (12, 13) a dále pak zprostředkovává vazbu cirkulujícího MGP na kalciová depozita (např. v cévní stěně) (14). Účinnost těchto dvou transformačních kroků není vždy kompletní a celkem lze kvantifikovat až 9 různých cirkulujících izoforem MGP s rozdílným stupněm karboxylace a fosforylace (viz obr. 1), navíc s mnohdy velmi obtížně interpretovatelným biologickým chováním z hlediska antikalcemických vlastností.
Obr. 1. Cirkulující kvantifikovatelné izoformy matrix Gla proteinu v závislosti na stupni karboxylace a fosforylace (upraveno dle: Dalmeijer et al., 2013) 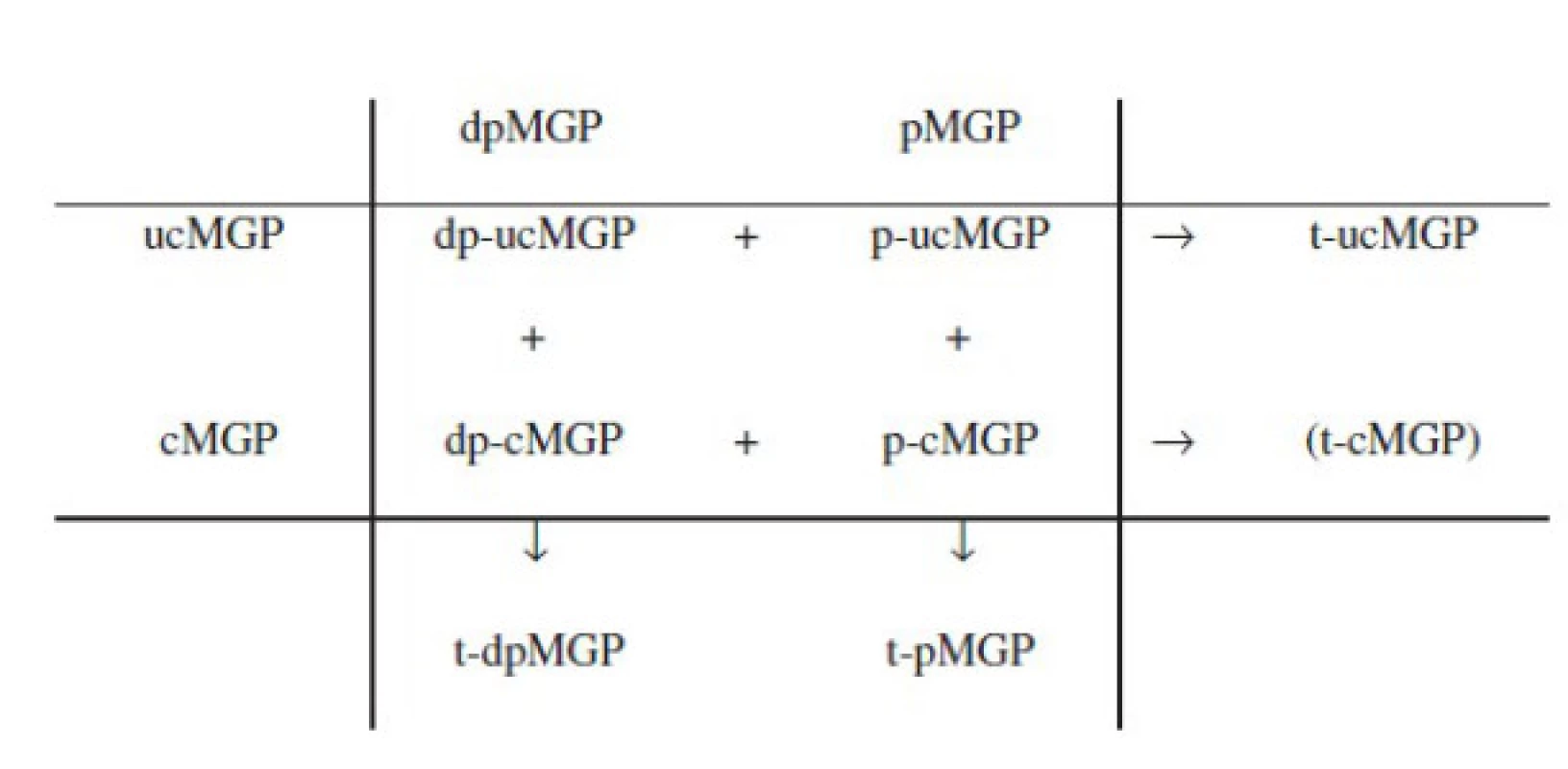
Pozn.: dp = defosforylovaná; p = fosforylovaná; uc = nekarboxylovaná; c = karboxylovaná; t = totální. Karboxylovaná a fosforylovaná izoforma, tj. p-cMGP (phosphoryled-carboxyled-matrix Gla protein) je sice plně biologicky aktivní izoformou, avšak jako biomarker není vhodná, neboť její pokles může být interpretován nejen jako pokles celkové antikalcemické kapacity, ale zároveň i jako její konzumpce při zvýšené přítomnosti kalcifikovaných lézí a naopak akcelerované antikalcemické aktivitě. Izoformy t-ucMGP či p-ucMGP (total uncarboxyled / phoshoryled - uncarboxyled MGP) zase neobsahují karboxylované glutamátové zbytky (a postrádají tedy vlastní antikalcemickou aktivitu), díky přítomnosti fosforylovaných zbytků serinu jsou však schopny adherence na kalciová depozita a jejich sníženou hodnotu lze považovat za surogát zvýšeného výskytu vaskulárních kalcifikací (a následně i zvýšené mortality) (14, 15). Izoforma dp-cMGP naopak karboxylovanou skupinu obsahuje, a měla by tedy být teoreticky schopna antikalcemické aktivity (a její zvýšená hladina teoreticky provázena poklesem mortality). Ve skutečnosti je však její vztah k riziku smrti zcela opačný (je v pozitivní asociaci) − zřejmě kvůli tomu, že není schopna adherovat na kalcifikovanou strukturu, a tedy ani exprimovat antikalcemickou funkci (16).
Jako biomarker antikalcemické aktivity MGP je tedy nakonec nejvhodnější zcela inaktivní izoforma, tj. dp-ucMGP (dephosphoryled-uncarboxyled MGP). Cirkulující koncentrace dp-ucMGP odráží především biologickou dostupnost vitamínu K, která je zase především funkcí příjmu tohoto vitaminu. Nízká biologická dostupnost vitaminu K vede k nedokonalé maturaci MGP a následně k méně účinné inhibici vaskulárních kalcifikací (17). Cirkulující koncentrace izoformy dp-ucMGP tak poměrně těsně korelují nejen s rozsahem koronárních kalcifikací kvantifikovaným pomocí Agatstonova skore (12, 18), ale i přímo s kardiovaskulárním mortalitním a morbiditním rizikem.
Dp-ucMGP izoforma jako prediktor kardiovaskulárního rizika
Roli MGP (resp. koncentrace jeho cirkulující izofomy dp-ucMGP) v globálním kardiovaskulárním riziku potvrzuje poměrně konzistentně řada retrospektivních i prospektivních studií. V obecné populaci (starší osoby bez anamnézy manifestní vaskulární choroby) van den Heuvel et al. (19) zjistili, že osoby v nejvyšším tercilu dp-ucMGP (> 400 pmol/l) vykazovaly v průběhu vice než 5letého sledování asi 2,7× vyšší riziko fatální či nefatální kardiovaskulární příhody než osoby v nejnižším tercilu. Hodnota dp-ucMGP vyšší než median (> 921 pmol/l) byla spojená s vyšším mortalitním rizikem i u pacientů s chronickou renální insuficiencí (kde byla navíc asociována i se stadiem této choroby) (20).
Na našich vlastních datech jsme roli dp-ucMGP jakožto mortalitního prediktoru potvrdili v souboru stabilizovaných pacientů s chronickou ischemickou chorobou srdeční nebo po ischemické cévní mozkové příhodě. Pacienti v nejvyšším kvartilu dp-ucMGP (≥ 977 pmol/l) vykazovali i po komplexní adjustaci asi o 90 % vyšší riziko 5leté celkové či kardiovaskulární mortality než ti s hodnotami nižšími (16).
Specifickou roli zřejmě MGP může hrát při levostranném srdečním selhávání, kde spolupřítomnost nízké aktivity systému MGP pravděpodobně dále zhoršuje závažnost srdečního selhávání i životní vyhlídky těchto pacientů. Ve dvou studiích, jež provedli Ueland et al. (21, 22) u pacientů s manifestním srdečním selháváním (147 se symptomatickou aortální stenózou v jedné studii, 179 s idiopatickou dilatační kardiomyopatii či srdečním selháváním ischemické etiologie ve studii druhé), byly zvýšené koncentrace dp-ucMGP spojené nejen s významně vyšší mortalitou nebo častější indikací transplantace srdce, ale i s některými dynamickými markery srdečního selhávání (hodnoty natriuretických peptidů, ejekční frakce a funkční stav dle NYHA).
V naší vlastní analýze stabilizovaných pacientů s chronickou ischemickou chorobou srdeční jsme zjistili, že pacienti s (třeba ještě asymptomatickým) zvýšeným BNP (mozkový natriuretický peptid; > 100 ng/l) a zároveň elevovaným dp-ucMGP (≥ 977 pmol/l) vykazovali nezávisle asi pětinásobně vyšší riziko úmrtí než ti s „normálními“ hodnotami těchto parametrů (15).
Lze předpokládat, že patofyziologicky hraje nízká aktivita MGP při srdečním selhávání roli nejen ve smyslu vaskulárních (koronárních) kalcifikací, ale též cestou akcelerace kalcifikace i dalších tkání, jako jsou myokard či srdeční chlopně. To dokládá například experimentální studie modelu post-infarktové remodelace u myšího srdce, kde tlakové přetížení levé komory vedlo k rychlé expresi mRNA pro MGP v kardiomyocytu (23). V patofyziologickém mechanismu nízké aktivity MGP u srdečního selhávání jsou však též uvažovány procesy nezávislé na vaskulárních či tkáňových kalcifikací, např. cestou ovlivnění některý růstových faktorů (vaskulární endotelový růstový faktor [VEGF], transformující růstový faktor beta [TGF-β], kostní morfogenetický protein [BMP]) (24,25).
Další mechanismus, který je třeba v kontextu MGP a kardiovaskulárního rizika zmínit, je tepenná tuhost. Progresivní, věkově podmíněné tuhnutí stěny velkých tepen představuje jeden ze základních fenotypů cévního stárnutí. Je přitom celkem jednoznačně prokázáno, že tepenná tuhost sama o sobě (kvantifikovaná jako rychlost pulzové vlny) představuje nezávislý faktor kardiovaskulární mortality i morbidity (26). Kromě „přirozeného“, věkově podmíněného tuhnutí cévní stěny však existuje řada procesů, které mohou dynamiku tuhnutí individuálně urychlovat. Jak již bylo řečeno výše, kalcifikace cévní stěny představuje zejména koncentrické ukládání kalcia v tepenné medii, a je tedy celkem biologicky přijatelné, že antikalcemický účinek MGP by mohl významněji ovlivňovat i tepennou tuhost.
Tuto asociaci jsme potvrdili v naší studii, realizované na náhodném vzorku obecné populace (studie postMONICA). V souboru 1087 subjektů byla nalezena významná lineární asociace mezi dp-ucMGP a aortální rychlostí pulzové vlny (jakožto parametru tepenné tuhosti), kdy osoby v nejvyšším kvartilu dp-ucMGP (≥ 671 pmol/l) vykazovaly zároveň asi o 70 % vyšší riziko zvýšené rychlosti pulzové vlny (16). Podobné výsledky nalezla paralelně i jiná, rovněž populačně zaměřená studie (27).
Má suplementace vitaminem K potenciál ovlivnit kardiovaskulární riziko?
Tuto z klinického hlediska zřejmě nejdůležitější otázku prozatím nelze jednoznačně (alespoň podle principů EBM − evidence-based medicine) zodpovědět, ale určité pozitivní signály z epidemiologických studií jsou k dispozici již nyní. Především je nutno zmínit, že existují dvě izoformy vitaminu K: fylochinon (K1) se zdrojem především v listové zelenině a menachinon (K2) se zdrojem převážně v mase, vejcích, sýru a kvasnicích − ten, jak dosavadní důkazy naznačují, bude zřejmě pro suplementaci vhodnější.
V prospektivní populační studii s kohortou 16 057 žen byl každý vzestup menachinonu ve stravě o 10 mg provázen 9% redukcí incidence kardiovaskulárních příhod (28). Podobný efekt byl pozorován i v jiné populační kohortě 4807 subjektů, kde udávaný příjem menachinonu na úrovni nejvyššího tercilu byl spojen s 57% redukcí kardiovaskulární mortality (a stejný výsledek byl zjištěn pro incidenci těžké aortální stenózy) (29). Podobně bylo pozorováno, že vysoký dietní přísun menachinonu (ale nikoliv již fylochinonu) je spojen i s redukcí koronárních kalcifikací, kvantifikovaných pomocí Agatstonova skore (30).
Velmi limitovaná jsou zatím data z intervenčních studií. Experimentální studie s warfarinem indukovanými aortálními kalcifikacemi u potkanů prokázala, že vysoké dávky menachinonu dokáží navodit regresi těchto změn (31). Intervenční studie s vitaminem K1 a D u postmenopauzálních žen prokázala zlepšení elastických vlastností velkých tepen při srovnání pouze s monoterapii vitaminem D či placebem (32), v jiné studii zase bylo pozorováno zpomalení progrese koronárních kalcifikací (33). Nejnovější tříletá randomizovaná intervenční studie s menachinonem u 244 postmenopauzálních žen prokázala zlepšení tepenné elasticity oproti placebu (34). Definitivní důkaz přínosu v podobě velké randomizované intervenční studie s jednoznačným výstupem však prozatím chybí.
Závěr
Dostupná data celkem konzistentně dokazují, že biologická dostupnost (status) vitaminu K a související antikalcemická aktivita MGP mohou sloužit přinejmenším jako biomarker kardiovaskulárního rizika. Epidemiologické důkazy i první malé intervenční studie dokonce naznačují určitý pozitivní potenciál suplementace vitaminem K2.
Seznam použitých zkratek
BNP mozkový natriuretický peptid
dp-ucMGP dephosphoryled-uncarboxyled matrix Gla protein
Gla γ-carboxyglutamate
MGP matrix γ-carboxyglutamate protein
NYHA New York Heart Association (klasifikace srdečního selhání)
p-cMGP phosphoryled-carboxyled matrix Gla protein
p-ucMGP phosphoryled-uncarboxyled matrix Gla protein
t-ucMGP total uncarboxyled matrix Gla protein
Adresa pro korespondenci:
doc. MUDr. Otto Mayer jr., CSc.
II. nterní klinika LF UK a FN Plzeň
E. Beneše 13
301 00 Plzeň
Tel.: 377 402 797
fax: 377 402 929
e-mail: mayero@fnplzen.cz
Zdroje
1. Yusuf S, Hawken S, Ounpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364 : 937–952.
2. Greenland P et al. ACCF/AHA 2007 clinical expert consensus document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain: a report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). Circulation 2007; 115 : 402–426.
3. Pletcher MJ, Tice JA, Pignone M, Browner WS. Using the coronary artery calcium score to predict coronary heart disease events: a systematic review and meta-analysis. Arch Intern Med 2004; 164 : 1285–1292.
4. Rumberger JA, Simons DB, Fitzpatrick LA et al. Coronary artery calcium area by electron-beam computed tomography and coronary atherosclerotic plaque area. A histopathologic correlative study. Circulation 1995; 92 : 2157–2162.
5. Falk E, Shah PK, Fuster V. Coronary plaque disruption. Circulation 1995; 92 : 657–671.
6. Demer LL, Tintut Y. The leading edge of vascular calcification. Trends Cardiovasc Med 2015; 25 : 275–277.
7. Price PA, Urist MR, Otawara Y. Matrix Gla protein, a new gamma-carboxyglutamic acid-containing protein which is associated with the organic matrix of bone. Biochem Biophys Res Commun 1983; 117 : 765–771.
8. Shanahan CM, Proudfoot D, Farzaneh-Far A, Weissberg PL. The role of Gla proteins in vascular calcification. Crit Rev Eukaryot Gene Expr 1998; 8 : 357–375.
9. Luo G, Ducy P, McKee MD et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix Gla protein. Nature 1997; 386 : 78–81.
10. Schurgers LJ, Cranenburg EC, Vermeer C. Matrix Gla-protein: the calcification inhibitor in need of vitamin k. Thromb Haemost 2008; 100 : 593–603.
11. Kruger T, Oelenberg S, Kaesler N et al. Warfarin induces cardiovascular damage in mice. Arterioscler Thromb Vasc Biol 2013; 33 : 2618–2624.
12. Cranenburg EC, Koos R, Schurgers LJ et al. Characterisation and potential diagnostic value of circulating matrix Gla protein (MGP) species. Thromb Haemost 2010; 104 : 811–822.
13. Schurgers LJ, Spronk HM, Skepper JN et al. Post-translational modifications regulate matrix Gla protein function: Importance for inhibition of vascular smooth muscle cell calcification. J Thromb Haemost 2007; 5 : 2503–2511.
14. Cranenburg EC, Brandenburg VM, Vermeer C et al. Uncarboxylated matrix Gla protein (ucMGP) is associated with coronary artery calcification in haemodialysis patients. Thromb Haemost 2009; 101 : 359–366.
15. Mayer O jr., Seidlerová J, Vaněk J et al. The abnormal status of uncarboxylated matrix Gla protein species represents an additional mortality risk in heart failure patients with vascular disease. Int J Cardiol 2016; 203 : 916–922.
16. Mayer O jr., Seidlerová J, Wohlfahrt P et al. Desphospho-uncarboxylated matrix Gla protein is associated with increased aortic stiffness in a general population. J Hum Hypertens 2016 Jul; 30(7): 418–423.
17. Theuwissen E, Smit E, Vermeer C. The role of vitamin K in soft-tissue calcification. Adv Nutr 2012; 3 : 166–173.
18. Dalmeijer GW, van der Schouw YT, Vermeer C et al. Circulating matrix Gla protein is associated with coronary artery calcification and vitamin K status in healthy women. J Nutr Biochem 2013; 24 : 624–628.
19. van den Heuvel EG, van Schoor NM, Lips P et al. Circulating uncarboxylated matrix Gla protein, a marker of vitamin K status, as a risk factor of cardiovascular disease. Maturitas 2014; 77 : 137–141.
20. Schurgers LJ, Barreto DV, Barreto FC et al. The circulating inactive form of matrix Gla protein is a surrogate marker for vascular calcification in chronic kidney disease: A preliminary report. Clin J Am Soc Nephrol 2010; 5 : 568–575.
21. Ueland T, Gullestad L, Dahl CP et al. Undercarboxylated matrix Gla protein is associated with indices of heart failure and mortality in symptomatic aortic stenosis. J Intern Med 2010; 268 : 483–492.
22. Ueland T, Dahl CP, Gullestad L et al. Circulating levels of non-phosphorylated undercarboxylated matrix gla protein are associated with disease severity in patients with chronic heart failure. Clin Sci (Lond) 2011; 121 : 119–127.
23. Mustonen E, Pohjolainen V, Aro J et al. Upregulation of cardiac matrix Gla protein expression in response to hypertrophic stimuli. Blood Press 2009; 18 : 286–293.
24. Bostrom K, Zebboudj AF, Yao Y et al. Matrix Gla protein stimulates VEGF expression through increased transforming growth factor-beta1 activity in endothelial cells. J Biol Chem 2004; 279 : 52904–52913.
25. Yao Y, Zebboudj AF, Shao E et al. Regulation of bone morphogenetic protein-4 by matrix Gla protein in vascular endothelial cells involves activin-like kinase receptor 1. J Biol Chem 2006; 281 : 33921–33930.
26. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness: A systematic review and meta-analysis. J Am Coll Cardiol 2010; 55 : 1318–1327.
27. Pivin E, Ponte B, Pruijm M et al. Inactive matrix Gla-protein is associated with arterial stiffness in an adult population-based study. Hypertension 2015; 66 : 85–92.
28. Gast GC, de Roos NM, Sluijs I et al. A high menaquinone intake reduces the incidence of coronary heart disease. Nutr Metab Cardiovasc Dis 2009; 19 : 504–510.
29. Geleijnse JM, Vermeer C, Grobbee DE et al. Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: The rotterdam study. J Nutr 2004; 134 : 3100–3105.
30. Beulens JW, Bots ML, Atsma F et al. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis 2009; 203 : 489–493.
31. Schurgers LJ, Spronk HM, Soute BA et al. Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats. Blood 2007; 109 : 2823–2831.
32. Braam LA, Hoeks AP, Brouns F et al. Beneficial effects of vitamins D and K on the elastic properties of the vessel wall in postmenopausal women: a follow-up study. Thromb Haemost 2004; 91 : 373–380.
33. Shea MK, O'Donnell CJ, Hoffmann U et al. Vitamin K supplementation and progression of coronary artery calcium in older men and women. Am J Clin Nutr 2009; 89 : 1799–1807.
34. Knapen MH, Braam LA, Drummen NE et al. Menaquinone-7 supplementation improves arterial stiffness in healthy postmenopausal women. A double-blind randomised clinical trial. Thromb Haemost 2015; 113 : 1135–1144.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Purkyňova cena udělena prof. Soně Nevšímalové
- Angiologie kráčí vpřed
- Studie SPRINT: Kam až snižovat systolický krevní tlak
- Matrix Gla protein jako přirozený inhibitor vaskulárních kalcifikací a potenciální léčebný cíl
- Hodnocení hemodynamické významnosti koronárních stenóz metodou frakční průtokové rezervy
- Prognostické faktory idiopatické plicní fibrózy (IPF) – analýza Českého registru IPF
- Dermatomyozitída
- Význam HPV vakcinace mužů
- Psychiatrie v realitě všedního dne
- K významnému životnímu výročí prof. MUDr. Evy Češkové, CSc.
- Péče na konci života v České republice
- EPMA − 2. světový kongres o personalizované medicíně
- Jan Kotula – Tomáš Doležal: Mediace a další vybrané formy mimosoudního řešení sporů ve zdravotnictví
- Vyšetřování vraždy novorozence v 17. a 18. století
- Roger Wolcott Sperry (1913–1994)
- Zemřel profesor Radomír Čihák
- Jubilanti
- Přednáškové večery Spolku českých lékařů (září − říjen 2016)
- Kalendář odborných akcí – září 2016
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Význam HPV vakcinace mužů
- Dermatomyozitída
- Hodnocení hemodynamické významnosti koronárních stenóz metodou frakční průtokové rezervy
- Matrix Gla protein jako přirozený inhibitor vaskulárních kalcifikací a potenciální léčebný cíl
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



