-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Indolamin 2,3-dioxygenáza v onkologii a psychiatrii
Indoleamine 2,3-dioxygenase in oncology and psychiatry
In the last years an attention has been paid to the indoleamine 2,3-dioxygenase (IDO), an enzyme catabolising L-tryptophan to kynurenine. Growing evidence has been accumulated that kynurenine and other metabolites of tryptophan play an important role in the pathogenesis of malignant tumours and some neurological and psychiatric disorders. The gradual recognition of mechanisms operative in their development may help to identify etiological factors involved and becomes prerequisite for the progress in their diagnostics and therapy. In oncology, great effort is directed to the development and testing of substances inhibiting IDO activity. It is expected that some of them will be utilized in the immunotherapy of cancer. In the field of psychiatric disorders, namely in schizophrenia and depression, the role of IDO is linked to immune dysregulation. In those diseases, IDO represents a potential mediator between immunological reactivity and alterations of the brain function. Changes in the IDO activity may also mediate interaction between the genetic predisposition and environmental factors.
Keywords:
indoleamine 2,3-dioxygenase – interferon γ – tryptophan – kynurenine – quinolinic acid – oncology – psychiatry
Autoři: Vladimír Vonka 1; Jiří Horáček 2
Působiště autorů: Ústav hematologie a krevní transfuze, Praha 1; Národní ústav duševního zdraví a 3. LF UK, Praha 2
Vyšlo v časopise: Čas. Lék. čes. 2015; 154: 3-10
Kategorie: Přehledový článek
Souhrn
V posledních letech se věnuje vzrůstající pozornost enzymu indolamin 2,3-dioxygenáze (IDO), která rozkládá tryptofan. Rychle totiž přibývá poznatků o tom, že kynurenin a další metabolity tryptofanu hrají významnou roli v patogenezi zhoubných nádorů a některých nervových a psychiatrických onemocnění. Postupné poznávání mechanismů, které se při jejich vzniku a průběhu uplatňují, umožňuje bližší poznání etiologických faktorů a tvoří předpoklady pro zlepšení jejich diagnostiky a léčby. V onkologii se nejvíce úsilí soustřeďuje na vývoj a prověrku substancí, které inhibují IDO. Očekává se, že některé z nich se významně uplatní v imunoterapii nádorů. V oblasti duševních poruch, především pak schizofrenie a depresivní poruchy, je role IDO spojována s imunitní dysregulací. IDO u těchto onemocnění přestavuje možný mediátor mezi imunitními změnami a poruchou funkce mozku. Změna aktivity IDO rovněž může zprostředkovat interakci mezi genetickou dispozicí a faktory prostředí v patofyziologii těchto onemocnění.
Klíčová slova:
indolamin 2,3-dioxygenáza – interferon γ – tryptofan – kynurenin – quninolinová kyselina – onkologie – psychiatrieÚVOD
Indolamin 2,3-dioxygenáza (IDO) je monomerní cytosolový enzym, který katalyzuje první krok metabolismu tryptofanu podél kynureninové dráhy. IDO se tvoří v endotelových, ledvinných, jaterních a dalších buňkách, ale jejím hlavním producentem jsou buňky procesující antigeny (APC). Plazmocytoidní dendritické buňky (DB) jsou místem její zvláště silné tvorby (1, 2). U zdravých osob se zjišťují jen v malých množstvích. Jejich tvorba však výrazně stoupá při infekčních a zánětlivých procesech. V místech zánětu je nejmohutnějším iniciátorem jejich tvorby interferon γ (INF-γ) (3, 4), ale produkci IDO výrazně napomáhají i jiné prozánětlivé cytokiny (5–7). Na druhé straně některé jiné cytokiny, jako je např. GM-CSF (granulocyte-macrophage colony stimulating factor), její aktivitu tlumí (8). K potlačení tvorby IDO dochází také po podání některých imunosupresivních látek, jako je cyclosporin A či tacrolimus (9). INF-γ stimuluje rovněž tvorbu tryptofanyl-tRNA syntázy (WRS), která do jisté míry kompenzuje úbytek tryptofanu. Rovnováha mezi IDO a WRS rozhoduje o tom, zda bude přítomné dostatečné množství tryptofanu pro syntézu bílkovin (10, 11).
Kromě IDO existují dva další enzymy, které působí podobně. První z nich se označuje jako IDO-2 (12), druhý jako tryptofan-2-3-dioxygenáza (TDO) (13). Geny pro IDO (označovanou nyní občas jako IDO-1) a IDO-2 jsou lokalizovány na chromozomu 8 a jsou ze 43 % homologní. Aktivita IDO-2 je mnohem nižší než IDO-1 a za fyziologických podmínek je zřejmě většina tryptofanu odbourávána enzymem IDO-1. Ačkoliv promotory obou genů obsahují elementy odpovídající na INF-γ, jejich exprese na úrovní transkripce je regulována odlišně. Enzymy se liší svou vnímavostí k racemickým formám 1-metyl-tryptofanu, který je inhibitorem IDO (12). TDO, který je evolučně daleko starší než IDO, je indukován v jaterních buňkách glukokortikosteroidy, ale nikoliv prozánětlivými cytokiny (14).
Tryptofan patří mezi esenciální aminokyseliny. Je nezbytný pro buněčnou proliferaci a hraje důležitou roli ve fungování imunitního systému a CNS. IDO štěpí pyrrolový kruh tryptofanu, přičemž využívá oxidativní potenciál trivalentního železa (Fe3+) v hemovém kruhu (15). Prvním produktem štěpení je formyl-kynurenin, který se rychle rozkládá působením formamidázy v kynurenin (16). Poměr mezi hladinou kynureninu a tryptofanu se obecně užívá jako měřítko aktivity IDO. Několik dalších enzymů, které jsou specificky vytvářeny v různých typech buněk, se účastní dalšího rozkladu kynureninu (obr. 1) (17). Často se pro produkty rozkladu tryptofanu započatého enzymem IDO užívá společného označení „kynureniny“. Některé z nich mají význačné biologické efekty. Mezi nimi nejdůležitější je regulace imunitního systému, ale modulují i aktivitu mezenchymálních kmenových buněk (11), adhezivitu buněk a tvorbu prostaglandinů (18) a přibývá vědomostí o tom, že se uplatňují při vzniku psychiatrických důkazů (viz dále). Asi nejvýznamnější imunologickou fy-ziologickou funkcí IDO je potlačení imunitních reakcí matky proti plodu (19, 20). Enzym rovněž oslabuje autoimunitní reakce a hraje kladnou roli při transplantacích (21–25). IDO také inhibuje nitrobuněčně se množící infekční činitele, jako jsou Toxoplasma gondii (26), Trypanosoma crusi (27) a další, včetně bakterií a virů. Všeobecně se soudí, že protiinfekční účinky jsou důsledkem deplece tryptofanu, protože minimální koncentrace této aminokyseliny potřebné pro replikaci bakterií a parazitů jsou 10–40krát vyšší než ty, jichž je zapotřebí pro aktivaci T-lymfocytů (28). Z těchto důvodů je IDO považována za důležitý faktor přirozené imunity.
IDO A ZHOUBNÉ NÁDORY
Aktivita IDO u onkologických pacientů
Po nějaký čas byla IDO mylně považována za inhibitor růstu nádorových buněk (29–31). V současné době se však všeobecně přijímá, že je jedním z klíčových faktorů, které umožňují únik nádoru imunitnímu systému (32). Zvýšená aktivita ID0 vyjádřená hladinami kynureninu byla zjištěna u celé řady nádorů, jako jsou kolorektální karcinom (33), melanom (34, 35) hepatocelulární karcinom (36), ovariální, endometriální a vulvární karcinomy (37), karcinom prostaty (38), karcinom plic (39), akutní myeloidní leukémie (40), osteosarkom (41), myelom (42), laryngeální karcinom (43), chronická lymfoblastická leukémie (44) a chronická myeloidní leukémie (45). Proto bylo určitým překvapením, že se u pacientek s karcinomem děložního čípku nalezly snížené hladiny kynureninu ve srovnání s kontrolními zdravými osobami (46). U pacientek však byly významně vyšší hladiny quinolinové kyseliny, což je konečný produkt katabolické dráhy tryptofanu (obr. 1). Zajímavé je rovněž zjištění, že zvýšená aktivita IDO v endoteliálních buňkách renálního karcinomu korelovala s dlouhodobým přežitím pacientů. Pro nečekané pozorování bylo navrženo přijatelné vysvětlení: V endotelových buňkách omezuje IDO přísun tryptofanu nutného pro přežití a proliferaci nádorových buněk (47).
Obr. 1. Schéma katabolismu tryptofanu podél kynureninové dráhy (podle Orabona a Grohmana (17), modifikováno) 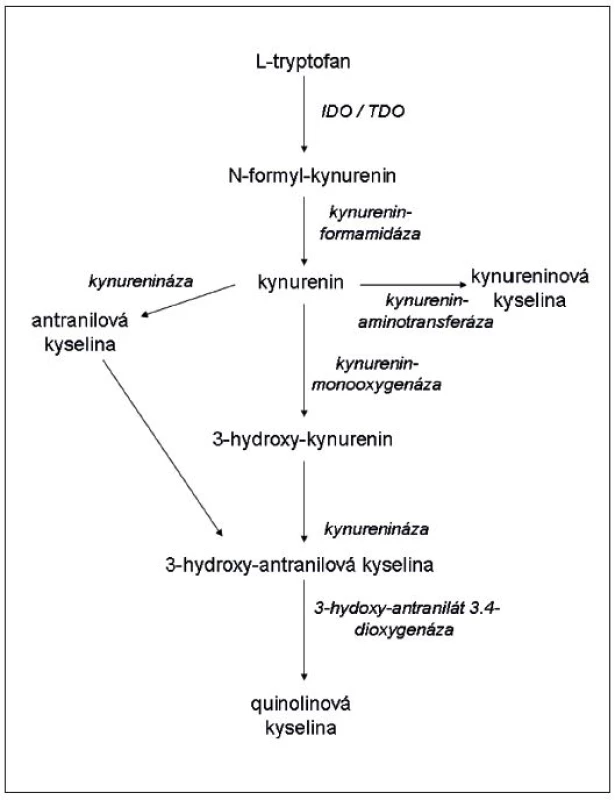
Drtivá většina nádorů zřejmě produkuje IDO konstitutivně (48). Jedinou známou výjimkou je chronická lymfoblastoidní leukémie: U pacientů jsou sice hladiny kynureninu zvýšeny, ale producentem IDO jsou jiné než nádorové buňky (44). V provedených klinických studiích byla opakovaně prokázána korelace mezi zvýšenými hladinami kynureninů a fatálním průběhem nemoci. To podnítilo zájem využívat měření hladin kynureninu jako ukazatele průběhu choroby a léčby.
Přestože v dosud provedených studiích byly nalezeny vysoce významné rozdíly v hladinách kynureninu mezi pacienty a kontrolními skupinami zdravých osob, ne všichni pacienti se chovají stejným způsobem. Tak např. v naší studii, která se týkala chronické myeloidní leukémie, mírná většina pacientů vykazovala normální hodnoty kynureninu. Byl sice patrný významný vztah mezi počtem leukocytů a jeho hladinou, ale neplatilo to pro všechny pacienty (45). To naznačuje, že se nádorové buňky jednotlivých pacientů liší produkcí IDO. V minulosti byla nalezena rozdílná produkce IDO u jednotlivých pacientů s gliomy (50), laryngálním karcinomem (43) a osteosarkomem (41). Nabízí se několik možných vysvětlení. Tak například lze uvažovat o tom, že produkce IDO souvisí s individuální produkcí INF-γ. Je známo, že polymorfismus v prvním intronu lidského genu pro INF-γ úzce souvisí s mírou produkcí tohoto cytokinu (51–53). Jsou však i jiné možnosti. Nedávno se objevily zprávy o tom, že dochází k buněčné imunitní odpovědi k IDO u zdravých osob, ale častěji u onkologických pacientů (54, 55). Její vznik, který představuje jakýsi protiútok imunitního systému, by mohl ovlivnit celkovou tvorbu IDO, potažmo kynureninu, selekcí nádorových buněk s její nízkou produkcí, případně i takových, které vůbec neexprimují antigeny IDO. Je také možné, že nízké hladiny kynureninu u části pacientů jsou výsledkem nadměrné aktivity enzymů, které se účastní jeho rozkladu. Výše zmíněné nízké hladiny kynureninu a vysoká hladina quinolinové kyseliny u pacientek s karcinomem děložního čípku (46) by mohly být toho výrazem.
Mechanismy imunosupresivního vlivu metabolitů tryptofanu u pacientů s nádory
Soudí se, že IDO účinkuje na dvou místech. Prvním je samotný nádor, druhým pak regionální mízní uzliny, v nichž je enzym produkován specifickou podtřídou plazmocytoidních DB. Tyto buňky však nejsou jeho konstitutivním producentem, snad s výjimkou těch, které se nacházejí v mezenteriálních uzlinách (56). K zahájení produkce IDO a k uplatnění jeho pronádorového účinku je třeba dalších událostí. Jedním z klíčových podnětů je interakce kostimulačních molekul B7, které se nacházejí se na povrchu DB, s receptorem pre-existujících T-regulačních buněk (Treg), označovaným jako CTLA-4 (57). Buňky Treg tak působí jako počáteční spouštěč tvorby IDO, zatím co vytvářený enzym podněcuje tvorbu dalších buněk Treg. Ty zřejmě hrají nejdůležitější roli v imunosupresivních procesech vyvolaných IDO. Vytvořený kynurenin aktivuje aryl-hydrokarbonový receptor (AHR), který funguje jako transkripční faktor, a vyvolává diferenciaci buněk T v buňky Treg (58). Následuje proliferace buněk Treg. Při ní se nejspíš uplatňují různé procesy. Jedním z uvažovaných mechanismů je zábrana reprogramování buněk Treg v prozánětlivé buňky T (59). Rovněž je možné, že deplece tryptofanu selektivně inhibuje růst některých populací T-buněk, ale nikoliv buněk Treg. Jiní považují za pravděpodobnější, že katabolity tryptofanu samy přímo podněcují proliferaci buněk Treg (58). Též se objevil názor, že vliv IDO na Treg buňky souvisí s kinázou GCN-2 (60), kterou aktivuje deplece tryptofanu. GCN2 fosforyluje translační iniciační faktor 2α (eIF2α). Zmíněná událost může vést k blokádě proliferace a anergii buněk CD8+ a zbrzdění diferenciace buněk CD4+ v prozánětlivé buňky Th17 (61). Nedávné poznatky však tento předpoklad zpochybnily důkazem, že důležitou roli hraje inhibice kinázy mTOR (62).
Zdá se však být jisté, že imunosupresivní efekt IDO, který napomáhá růstu nádorů, se netýká jen buněk Treg, ale že zahrnuje i jiné buňky imunitního systému. Tak například již zmíněná aktivace kinázy GCN2, ovlivňuje negativně akceschopnost buněk CD8+ potlačením exprese řetěz-ce ζ (zeta) receptoru buněk T (63), snižuje jejich proliferaci (64) a přispívá jejich apoptóze (65). Buňky Th1 se jeví být nejvíce ohroženými. Kynureniny potlačují také buňky NK (66, 67). Děje se tak nejspíš oslabením funkcí receptoru buněk NK, který spouští jejich ničivou akci na cílové buňky. Zatímco deprivace tryptofanu v případě potlačení bakteriálních a některých parazitárních infekcí se zdá být jediným účinným mechanismem, imunoregulační aktivity IDO jsou zřejmě důsledkem jak úbytku této aminokyseliny, tak důsledkem přímého působení kynureninů.
Inhibitory IDO v terapii nádorů
Vzhledem k nepochybné úloze IDO v patogenezi zhoubného bujení se velká pozornost věnuje jejím inhibitorům. Je oprávněná naděje, že se uplatní jako součást chemoterapie a jako významný doplněk specifické imunoterapie nádorů (68–70). K 1-metyl-tryptofanu, který se již několik let zkouší v klinických studiích, přibyly další inhibitory IDO. Jde o deriváty hydroxyamidinu označované jako ICNB 023 843 a INCB 024 360 (71, 72). Výsledkem intenzivního výzkumu jsou nedávné objevy dalších inhibitorů IDO (72–77). Z nich obzvláště nadějné se jeví být deriváty tryptantrinu. Jeden z nich označovaný jako 5c inhiboval IDO v nanomolárních koncentracích a v experimentálním systému potlačoval růst nádoru a redukoval počty buněk Treg (77). Též se podařilo prokázat, že podání shRNA (short hairpin RNA) zaměřené proti IDO způsobilo odklad růstu nádorů či zabránilo jejich vzniku (78–80). Vzhledem k rychle přibývajícím poznatkům o molekulových mechanismech působení inhibitorů IDO se nepochybně v blízké budoucnosti objeví nové sloučeniny, které budou účinnější a budou vykazovat méně nežádoucích vedlejších účinků. Málokdo pochybuje o tom, že inhibitory IDO v blízké budoucnosti významně obohatí současnou terapii nádorů.
IDO A PSYCHICKÉ CHOROBY
IDO v patofyziologii psychiatrických poruch
Role IDO je intenzivně studována rovněž v oblasti duševních poruch, především pak schizofrenie a depresivní poruchy, a její role je spojována s imunitní dysregulací u těchto poruch. Imunitní systém hraje zásadní roli jak v neurovývoji, tak i v regulaci homeostázy v mozku v dospělosti (84). U schizofrenie a deprese je vliv imunitní dysregulace zprostředkován cytokiny, hlavními signalizačními molekulami imunitního systému. Cytokiny mimo své imunitní role v periferii regulují také funkci mikroglií, astrocytů i neuronů (81). Meziprodukty imunitně regulovaných biochemických reakcí jsou pak neuroaktivní či neurotoxické působky, které jsou součástí patofyziologických mechanismů zahrnujících vliv na hladinu neuromediátorů, neuroplasticitu, neurodegeneraci a dendritickou dysfunkci spojenou s měřitelnými změnami šedé hmoty u nemocných (82).
IDO u těchto onemocnění přestavuje možný mediátor mezi imunitními změnami a poruchou funkce mozku. Změna aktivity IDO rovněž může zprostředkovat interakci mezi genetickou dispozicí a faktory prostředí (83, 84). Imunitně mediované vlivy prostředí, které kauzálně modifikují genetickou vulnerabilitu, mohou vzniknout v důsledku časné (intrauterinní či perinatální) nebo pozdní infekce (85).
IDO, TDO a metabolity tryptofanu v mozku
Ačkoliv serotonin (a tedy také melatonin) představují nejznámější produkty metabolismu tryptofanu, naprostá většina (95 %) této aminokyseliny je v mozku katabolizována cestou kynureninoavé metabolické kaskády (obr. 1). Jak bylo uvedeno výše, na začátku této cesty stojí enzymy – IDO a TDO. Zásadní role těchto enzymů v patofyziologii duševních poruch spočívá v tom, že jsou odlišně regulovány imunitním systémem mozku, který se současně podílí na poměru jejich aktivit, a reguluje tak množství a typ finálního produktu katabolismu tryptofanu. Tyto enzymy konvertují tryptofan na kynurenin, IDO je pak exprimována především v mikrogliích (méně v astrocytech), TDO se vyskytuje pouze v astrocytech (81).
Od kynureninu dále se metabolická cesta tryptofanu štěpí do dvou větví. První z nich je zprostředkována kynurenin aminotransferázou, která je rovněž exprimována v astrocytech a mění kynurenin na kynureninovou kyselinu (KYNA). KYNA je vysoce potentní antagonista glutamatergních NMDA (N-metyl-D-aspartátových) receptorů a alfa-7 cholinergních receptorů (81). Druhá cesta začíná kynurenin 3-monooxygenázou (KMO), která konvertuje kynurenin na 3-OH-kunurenin, který vykazuje proapoptotický efekt. 3-OH-kynurenin je následně katabolizován přes 3-OH-antranilovou kyselinu na kyselinu quinolinovou jako finální produkt. Na rozdíl od kyseliny kynureninové je quinolinová kyselina vysoce potentním NMDA agonistou, a tímto mechanismem je pak zprostředkován její výrazný neurotoxický efekt (86).
Imunitní dysbalance u schizofrenie a deprese a role cytokinů v regulaci IDO
V případě schizofrenie i depresivní poruchy se hromadí důkazy pro imunitní dysbalanci mezi dvěma systémy cytokinů produkovaných CD4+ lymfocyty (T-helpers, Th). Imunitní odpověď typu Th1 se podílí především na regulaci imunity buněčné, resp. eliminaci intracelulárních patogenů, a zahrnuje např. interleukiny IL-1β, IL-2, IL-8, IL-12p7 a IFN-γ. Th2 systém je aktivovaný patogeny extracelulárními a reguluje především humorální imunitu cestou IL-6, IL-10, IL-4 a TNF-α (tumor necrosis factor α) (87). U schizofrenie byl opakovaně replikovaný nález snížení hladin cytokinů Th1 osy a naopak hyperaktivovaný systém Th2. Naopak u deprese byla replikována zvýšená aktivita systému Th1 a oslabení Th2 imunitní odpovědi. Tyto nálezy dokonce inspirovaly předpoklad, že Th1/Th2 dysbalance u duševních poruch reflektuje původní koncepci dichotomie mezi afektivními a psychotickými poruchami formulovanou Emilem Kreapelinem na konci 19. století (88). Nicméně recentní metaanalýza imunitních nálezů u schizofrenie nepotvrdila plně zvýšení Th2 v neprospěch Th1 a nejvýznamněji zvýšení bylo identifikováno v případě IL-6 (Th2) a IL-2 (Th1) a jejich solubilních receptorů (9). Nálezy Th1/Th2 dysbalance velmi těsně souvisejí s regulací IDO a jejími zásadními důsledky pro psychopatologii. Th1 cytokiny aktivují současně IDO a KMO v mikrogliích, čímž akcelerují katabolismus kynureninu směrem k neurotoxickému quinolinátu. Th2 cytokiny pak působí opačně a v mikroglii inhibují aktivitu IDO a KMO. Tímto mechanismem pak Th2 cytokiny odklánějí katabolismus kynureninu směrem ke kynureninové kyselině, která je antagonistou nikotinových a NMDA receptorů. I přes kritiku, která se soustředí především na otázku problematické relevance periferních hladin cytokinů pro imunitní stav mozku, představuje koncept Th1/Th2 imunofenotypů i nadále jeden z mimořádně nosných konceptů v současné biologické psychiatrii.
Th1 imunofenotyp u deprese. Fenotyp prozánětlivých Th1 cytokinů je spojován s depresí na základě několika zdrojů. Vyjma zvýšených cytokinů tohoto typu imunitní odpovědi (90) byla v postmortem nálezech u depresivních osob identifikována zvýšená hladina neurotoxické kyseliny quinolinové v mikrogliích v oblasti předního a subgenuálního cingula, tedy regionech klíčových pro patofyziologii deprese (91). S ohledem na roli Th1 cytokinů v regulaci aktivity IDO pak lze předpokládat, že právě tato zvýšená aktivita mitochondriální IDO akceleruje katabolismus Trp a kynureninu cestou, která končí quinolinovou kyselinou. Quinolinová kyselina jako silný agonista NMDA receptoru vede cestou excesivního influxu kalcia do buněk k neurotoxickému efektu a může se významně podílet na zmenšení objemu subgenuální části gyrus cinguli, tedy paradigmatickému nálezu u deprese, který je dnes replikován a potvrzen i na úrovni metaanalýz (92). V případě neurotoxického efektu quinolinátu na úrovni astrocytů může navíc dojít k oslabení Th2 imunitní odpovědi a další potenciaci Th1/Th2 nerovnováhy (90). Konečně akcelerace mitochondriální Th1 imunitní odpovědi se může cestou zvýšeného katabolismu Trp a cestou IDO podílet rovněž také na depleci serotoninu (93), která je pak cílem léčebného působení většiny antidepresív včetně inhibitorů zpětného vychytávání serotoninu (SSRI).
Th2 imunofenotyp u schizofrenie. I přes určité výše zmíněné diskrepance převažují v případě schizofrenie nálezy podporující převahu Th2 odpovědi, která vede ke zvýšení kynureninové kyseliny v séru i mozkomíšním moku (94). Toto zvýšení pak souvisí s útlumem Th1 imunitní odpovědi v důsledku útlumu mikrogliální IDO a KMO. Kynureninová kyselina inhibuje NR1 podjednotku NMDA receptoru a alfa-7 nikotinový cholinergní receptor. NMDA receptor je hlavní excitační ionotropní receptor lidského mozku a oslabení glutamatergního přenosu na tomto kanálu představuje dnes dominující hypotézu příčiny schizofrenie. Pro tuto dysfunkci svědčí nejen nálezy změn exprese a složení jednotlivých podjednotek NMDA receptoru (14), ale také skutečnost, že farmakologická blokáda NMDA antagonisty představuje v současnosti nejlepší model schizofrenie s vysokou fenomenologickou validitou ve smyslu indukce symptomatiky schizofrenie v jejím plném spektru (95). Inhibice alfa-7 nikotinového cholinergního receptoru se pak rovněž podílí na patofyziologii schizofrenie, a to hned dvěma mechanismy. Antagonismus nikotinových receptorů může vysvětlit deficit kognitivních funkcí, který je charakteristický pro významnou subpopulaci nemocných (96). Tento nikotinový receptor rovněž kontroluje výdej extracelulárního glutamátu. Alosterická modulace alfa-7 nikotinového receptoru kyselinou kynureninovou vede ke snížení výdeje a extracelulárních hladin glutamátu (17), čímž pak dochází k potenciaci glutamatergního deficitu charakteristického pro schizofrenní onemocnění.
IDO jako mediátor interakce faktorů prostředí a genetické dispozice.
Nejpravděpodobnější příčinou Th1/Th2 dysbalance u psychických poruch jsou prenatální a časné postnatální infekce, které vedou k časné imunitní stimulaci. Tato stimulace indukuje v hostitelském organismu dlouhodobé změny exprese prozánětlivých cytokinů, které ovlivňují neurovývoj, apoptózu a patologii synapsí (98). V případě infekcí získaných v pozdějším věku hraje v případě schizofrenie významnou roli intracelulární parazit Toxoplasma gondii. Latentní forma toxoplazmózy postihuje cca 30 % světové populace a vede k vytvoření perzistujících cyst v mozku a dalších tkáních. Latentní toxoplazmóza se vyskytuje u nemocných schizofrenií 2,73krát častěji než v obecné populaci a je považována za významný nezávislý rizikový faktor (99).
Ačkoliv kauzální mechanismy interakce mezi infekcí T. gondii a rizikem schizofrenie nejsou dosud uspokojivě vysvětleny, velmi pravděpodobně se na nich významně podílí aktivita IDO. Latentní toxoplazmóza podobně jako časná imunitní stimulace reguluje cestou cytokinů hlavní katabolickou dráhu tryptofanu, resp. kynureninu. Jak bylo uvedeno výše, IFN-γ představuje hlavní obranný faktor, který zabraňuje replikaci tohoto parazita a udržení infekce v latentní podobě. IFN-γ stimuluje produkci IDO (100, 101) čímž urychluje katabolismus tryptofanu (102). Tryptofan je esenciální aminokyselinou nikoliv jen pro člověka, ale také pro T. gondii (100). IFN-γ, tedy cestou zvýšení IDO způsobuje karenci tryptofanu pro T. gondii, čímž zpomaluje replikaci tohoto parazita a udržuje tak toxoplazmózu v latentní formě.
Za normálních okolností je u schizofrenie produkce IFN-γ (součást Th1 odpovědi) snížená (23), ale zvyšuje se právě během toxoplazmové infekce. U schizofrenních nemocných se nacházejí (nezávisle na séropozitivitě T. gondii) zvýšené hladiny KYNA v mozku (104), což je vysvětlováno zvýšenou aktivitou TDO při nezměněné nebo snížené aktivitě IDO (82). Nicméně v případě, že osoba se schizofrenií (nebo s geneticky podmíněnou dispozicí k této nemoci) onemocní toxoplazmózou, dojde k synergii elevace TDO (patří k fenotypu schizofrenie) a IDO (důsledek IFN-γ stimulovaného T. gondii). Výsledkem je potenciace katabolismu tryptofanu směrem ke kynureninu a KYNA. IFN-γ však navíc také zesiluje aktivitu kynurenin hydroxylázy (105), a startuje tak metabolickou dráhu kynureninu směrem k neurotoxickému quinolinátu. Ten může být zodpovědný za redukci šedé hmoty mozku, tedy typický nález u schizofrenie. Tato hypotéza je podporována morfometrickou studií, ve které jsme potvrdili redukci šedé hmoty u T. gondii pozitivních nemocných schizofrenií, nikoliv však u infikovaných kontrol (83). Lokalizace redukce šedé hmoty v našem souboru T. gondii pozitivních nemocných schizofrenií navíc korespondovala s morfologickým deficitem ve frontotemporálních oblastech, který byl u schizofrenie opakovaně replikovaný nezávisle na přítomnosti či nepřítomnosti latentní toxoplazmózy (106). Podle těchto našich nálezů tedy může být morfologický deficit u schizofrenie sycený do značené míry právě nemocnými s komorbiditou schizofrenie a toxoplazmózy.
Latentní toxoplazmóza tak představuje příklad nezávislého faktoru prostředí zprostředkovaného IDO, který u disponovaných jedinců zvyšuje riziko vzniku schizofrenie nebo mění fenotyp této nemoci ve smyslu indukce morfologických změn v oblasti šedé hmoty. Pro úplnost je nutné dodat, že T. gondii v latentním stadiu navíc exprimuje dva analogy lidského genu pro tyrosin hydroxylázu (107), a zvyšuje tak v okolní mozkové tkáni hladiny dopaminu. Dopamin se může rovněž podílet na zvýšení rizika propuknutí psychózy, ale nevysvětluje výše uvedené morfologické změny.
Závěrem lze říci, že IDO a tímto enzymem regulovaná katabolická kaskáda tryptofanu představuje novou a nadějnou oblast výzkumu patofyziologie psychických onemocnění. Výzkum regulace této kaskády může v budoucnu otevřít nové možnosti léčebných intervencí afektivních poruch a schizofrenie.
Výzkumná práce autorů byla podpořena grantovými projekty NT-12363-4/2011, NT13843, IGA MZ ČR a MZ UHKT 00023736.
Seznam použitých zkratek
AHR arylhydrokarbonátový receptor
CTLA-4 cytotoxic T-lymphocyte antigen 4
eIF2α translační iniciační faktor 2α
GCN-2 general control nonexpressed 2(jedna ze serin/threonin protein kináz)
GM-CSF granulocyte-macrophage colony forming factor
IDO indolamin 2,3-dioxygenáza
INF-γ interferon γ
KMO kynurenin monooxydáza
KYNA kynureninová kyselina
mTOR mammalian target of rapamycin
NMDA receptor N-metyl-D-aspartátový receptor
shRNA short hairpin RNA
TDO tryptofan 2,3-dioxygenáza
Th helper (pomocné) buňky T
Treg regulační buňky T
WRS tryptofanyl-tRNA syntáza
Konflikt zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Vladimír Vonka, DrSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1, 128 20 Praha 2
e-mail: vonka@uhkt.cz
Zdroje
1. Nikolic T, Weltzen-Coppens JM, Leene PJ, et al. Plasmocytoid dendritic cells in autoimmune diabetes. Immunobiology 2009; 21 : 791–799.
2. Wang Y, Yang BH, Li H, et al. IDO(+) DCs and signalling pathways. Curr. Cancer Drug Targets 2013; 13: 278–288.
3. Brown RR, Ozaki Y, Datta SP, et al. Implications of interferon-induced tryptophan catabolism in cancer, autoimmune diseases and AIDS. Adv Exp Med Biol 1991; 294: 425–435.
4. Carlin JM, Borden JC, Sondet PM, et al. Interferon-induced indol-amine 2,3-dioxygenase in human mononuclear phagocytes. J Leukocyt Biol 1989; 45 : 425–435.
5. Oxenkrug G. Interferon-gamma – inducible inflammation: Contribution to aging and aging associated psychiatric disorders. Aging Dis 2011; 2 : 474–486.
6. Belladonna ML, Orabona C, Grohmann U, et al. TGF-beta and kynurenines as the key to infections tolerance. Trends Mol Med 2009; 15 : 41–49.
7. Zunszain PA, Anacker C, Cattaneo A, et al. Interleukin-1β: a new regulator of the kynurenine pathway affecting hippocampal neurogenesis. Neuropsychopharmacology 2012; 37 : 939–949.
8. Schefold JC, Zeden JP, Pschowski R, et al. Treatment with granulocyte-macrophage colony stimulating factor is associated with reduced indoleamine 2,3-dioxygenase activity and kynurenine pathway catabolites in patients with severe sepsis and septic shock. Scand J Inf Dis 2000; 42 : 164–171.
9. Stroecknadel S, Sucher R, Kurz K, et al. Influence of immunosuppressive agents on tryptophan degradation and neopterin production in human peripheral blood mononuclear cells. Transplan Immunol 2011; 25 : 119–123.
10. Yadav MC, Burudi EM, Alirezaei M, et al. INFγ induced IDO and WRS expression in microglia is differentially regulated by IL-4. Glia 2007; 55 : 1385–1396.
11. Croituru-Lamoury J, Lamoury FM, Caristo M, et al. Interferon γ regulates the proliferation and differentiation of mesenchymal stem cells via activation of indoleamine 2,3-dioxygenase (IDO). PLoS One 2011; 6: e14698.
12. Qian F, Liao, J, Villella J, et al. Effects of 1-methyltryptophan stereoisomers on IDO2 enzyme aktivity and IDO2-mediated arrest of human T cell proliferation. Cancer Immunol Immunother 2012; 61 : 2013–2020.
13. Capece L, Arrar M, Roitberg AE, et al. Substrate sterospecificity in tryptophan dioxygenase and indolamine 2,3-dioxygenase. Proteins 2010; 78 : 2961–2972.
14. Danesch U, Gloss B, Schmid W, et al. Glucocorticoid induction of the rat tryptophan oxygenase gene is mediated by two widely separated glucocorticoid responsive elements. EMBO J 1987; 6: 625–630.
15. Lancellotti S, Novarese L, De Cristofaro R. Biochemical propertis of indolamine 2,3-dioxygenase: from structure to optimized design of inhibitors. Curr Med Chem 2011; 18 : 2205–2214.
16. Takikawa O, Yoshida R, Kido R, Hayaishi O. Tryptophan degradation in mice initiated by indolamine 2,3.dioxygenase. J Biol Chem 1986; 261 : 3648–3653.
17. Orabona C, Grohman U. Indoleamine 2,3-dioxygenase and regulátory function: tyrptophan starvation and beyond. In Suppression and Regulation of Immune Responses. Methods in Molecular Biology. Chapter 19. Springrer Science+ Business Media. New York: Springer 2011; 269–280.
18. Marshall B, Keskin DB, Mellor AL. Regulation of prostaglandin synthesis and cell adhesion by a tryptophapha catabolizing enzyme. BCM Bioch 2001; 2 : 5–19.
19. Munn DH, Sharma MD, Zhou M, et al. Potential regulatory function of human dendritic cells expressing indolamine 2,3-dioxygenase. Science 1998; 119–1193.
20. Blaschitz A, Gauster M, Fuchs D, et al. Vascular endothelial expression of indoleamine 2,3-dioxygenase forms a positive gradient towards feto-maternal interface. PLoS One 2011; 6: e21774.
21. Platten M, Ho PP, Youseff S, et al. Treatment of autoimmune neuroinflammation with a synthetic neuroinflammation with a synthetic tryptophan metabolite. Science 2006; 310 : 850–855.
22. Opitz CA, Wick W, Steinmann L, Platten M. Tryptophan degradation in autoimmune diseases. Cell Mol Life Sci 2007; 64 : 2342–2362.
23. Curti A, Trabanelli, S, Salvestrini V, et al. The role of indoleamine 2.3 dioxygenase in the induction of immune tolerance: focus on hematology. Blood 2009; 113 : 2394–2401.
24. Jasperson LK, Bucher C, Pnoskaltsis-Mortari A, et al. Inducing the tryptophan catabolic pathway, indoleamine 2,3-dioxygenase (IDO) for suppression of graft-versus-host-disease (GVHD) lethality. Blood 2009; 114 : 5062–5070.
25. Trabanelli S, Očadlíková D, Evangelisti C, et al. Induction of regulátory T cells through indoleamine 2,3-dioxygenase: a potent mechanism of acquired peripheral tolerance. Curr Med Chem 2011; 18 : 2234–2239.
26. Pfefferkorn ER, Eckel M, Rehburn S. Interferon gamma blocks the growth of Toxoplasma gondii in human fibroblasts by inducing the cells to regrace tryptophan. Mol Biochem Parasitol 1986; 20 : 215–224.
27. Knubel CP, Martinez FF, Fretes RE, et al. Indoleamine 2,3-dioxygenase (IDO) is critical for host resistence against Trypanosoma crusi. Vet Immunol Immunother 2010; 24 : 2689–2701.
28. Müller A, Hesseler K, Schmidt SK, et al. The missing link between between indoleamine 2,3-dioxygenase mediated antibacterial and immunoregulatory effects. J Exp Med 2009; 13 : 1125–1135.
29. Takikawa O, Kuroiwa T, Yamazaki F, Kido R. Mechanism of interferon-gamma action. Characterization of indoleamine 2,3-dioxygenase in cultured human cells induced by interferon-gamma and evaluation of the enzyme-mediated tryptophan degradation in its anticancer activity. J Biol Chem 1988, 263 : 2401–2408.
30. Yoshida R, Park SW, Zasuj H, Takikawa O. Tryptophan degradation in transplanted tumor cells undergoing rejection. J Immunol 1988; 141 : 2819–2823.
31. Ozaki Y, Edelstein MP, Duch DS. Induction of indolamine 2,3-dioxygenase: a mechanism of the antitumor activity of interferon gamma. PNAS USA 1988; 85 : 1243–1246.
32. Sucher R, Kurz K, Weiss G, et al. IDO-mediated tryptophan degradation in the pathogenesis of malignant tumor disease. Int J Tryptophan Res 2010; 3 : 113–120.
33. Brandacher G, Perathoner A, Ladurner R, et al. Prognostic value of indoleamine 2,3-dioxygenase expression in colorectal cancer: effect on tumor-infiltrating T cells. Clin Cancer Res 2006; 15 : 1144–1151.
34. Lee JR, Dalton RR, Mesina JL, et al. Pattern of recruitment of immunoregulatory antigen-presenting cells in malignant melanoma. Lab Invest 2003; 83 : 1457–1466.
35. Weinlich G, Murr C, Richardson L. et al. Decreased serum tryptophan concentration predicts por prognosis in malignant melanoma patients. Dermatology 2007; 214 : 8–14.
36. Pan K, Wang H, Chen MS, et al. Expression and prognosis role of indoleamine 2,3-dioxygenase in hepatocellular carcinoma. J Cancer Res Clin Oncol 2008; 134 : 1247–1253.
37. de Jong RA, Nijman HW, Boezen HM, et al. Serum tryptophan and kynusenine concentration as parameters for indoleamine 2,3-dioxygenase activity in patients with endometrial, ovaria avulvar cancer. Int J Gynecol Cancer 2011; 21 : 1320–1327.
38. Feder-Mengus C, Wyler S, Hudolin T, et al. High expression of indoleamine 2,3-dioxygenase gene in prostate cancer. Europ J Cancer 2008; 44 : 2266–2275.
39. Suzuki Y, Suda S, Furuhashi K, et al. Increased serum kynurenine – tryptophan ratio correlates with disease progression in lung cancer. Lung Cancer 2010; 67 : 351–365.
40. Urakawa H, Nishida Y, Nakashima H, et al. Prognostic vaklue of indoleamine 2,3-dioxygenase expression in high grade osteosarcoma. Clin Exp Metastasis 2009; 26 : 1005–1012.
41. Curti A, Aluigi M, Pandolfi S, et al. Acute myeloid leukemia cells constitutively express the immunoregulatory enzyme indoleamine 2,3-dioxygenase. Leukemia 2007; 21 : 353–357.
42. Bonanno G, Mariotti A, Procoli A, et al. Indolamine 2,3 dioxygenase activity corelates with immune systém abnormalities in multiple myeloma. J Transl Med 2012; 10 : 247 (doi 10.1186/1479-5876-10-247).
43. YeJ, LiuH, HuY, et al. Tumoral indoleamine 2,3-dioxygenase expression predicts poor outcome in laryngeal squamous cell carcinoma. Virchows Arch 2013; 462 : 73–81.
44. Lindström V, Aittoniemi J, Jylhävä J, et al. Indoleamine 2,3-dioxygenase activity and expression in patients with chronic lymphocytic leukemia. Clin Lymphoma Myeloma Leuk 2012; 12 : 363–365.
45. Vonka V, Humlová Z, Klamová H, Kujovská-Krčmová L, Petráčková E,Hamšíková E, Krmenčíková-Fliegl M, Dušková M, Roth Z. Kynurenine and uric acid levels in chronic myeloid leukemia patients. Oncoimmunology 2015 (v tisku).
46. Fotopoulou C, Sehouli J, Pschowski R, et al. Systematic changes of tryptophan catabolites via indoleamine 2,3-dioxygenase pathway in primary cervical cancer. Anticancer Res 2011; 31 : 2629–2635.
47. Reisenberg R, Weiler C, Spring O, et al. Expression of indoleamine 2,3-dioxygenase in tumor endothelial cells correlates with long-term survival of patients with renal cell carcinoma. Clin Cancer Res 2007; 13 : 6993–7002.
48. Uyttenhove C, Pilotte L, Théate I, et al. Evidence for a tumoral immune resistence mechanism based on tryptophan degradation by indolamine 2,3-dioxygenase. Nat Med 2003; 9 : 1269–1274.
49. Cavia-Saiz M, Muniz P, De Santiago R, et al. Changes in the level of thioredoxin and indoleamine 2,3-dioxygenase in plasma of patients with colorectal cancer treated with chemotherapy. Bioch Cell Biol 2012; 90 : 173–178.
50. Mitsuka K, Kawataki T. Satoh E, et al. Expression of indoleamine 2,3-dioxygenase and correlation with pathological malignancy in gliomas. Neurosurgery 2013; 72 : 1031–1038.
51. Awad M, Pravica V, Persey C, et al. CA repeat allelel polymorphism in the first intron of the human interferon gamma gene is associated with lung allograft fibrosis. Hum Immunol 1999; 60 : 363–366.
52. Pravica V, Perrey C, Stevens A, et al. A single nukleotide polymorphism in the first intron of the human INF-gamma gene: absolute correlation with a polymorphic CA microsatellite marker. Hum Immunol 2000; 61 : 863–866.
53. Raitalla A, Petrovaara M, Karjalainen J, et al. Association of interferon-gamma +874 (T/A) single nukleotide polymorphism with the rate of tryptophan catabolism in healthy individuals. Scand J Immunol 2005; 61 : 387–390.
54. Sorensen RB, Hadrupm SR, Svane IM, et al. Indoleamine 2,3-dioxygenase specific, cytotoxic T cells as immune regulators. Blood 2011; 117 : 2200 –2210.
55. Munir S, Larsen SK, Iversen TZ, et al. Natural CD4+ T cell response against indoleamine 2,3-dioxygenase Plos One 2012; 7: e34568.
56. Onodera T, Jang MH, Guo Z, et al. Constitutive expression of IDO by dendritic cells of mesenteric lymph nodes: functional involvement of the CTLA-4/B7 and CCL22/CXCR4 interactions. J Immunol 2009; 183 : 5608–5614.
57. Fallarino F, Grohmann U, Hwang KW, et al. Modulation of tryptophan catabolism by regulatory T cells. Nat Immunol 2003; 4 : 1206–1212.
58. Mezrích JD, Fechner JH, Zhang X, et al. An interaction between kynurenine and the aryl hydrocarbon receptor can generace regulatory T cells.J Immunol 2010; 185 : 3190–3198.
59. Munn DH. Indoleamine 2,3-dioxygenase, Tregs and cancer. Curr Med Chem 2011; 18 : 2240–2246.
60. Prendergast GC. Immune escape as a fundamental trait of cancer: focus on IDO. Oncogene 2008; 27 : 3889–3900.
61. Baban B, Chander PR, Sharma MD, et al. IDO activates regulatoryT cells and blocks their conversion into Th17-like T cells. J Immunol 2009; 183 : 2475–2483.
62. Metz R, Rust S, Duhadaway JB, et al. IDO inhibits a tryptophan sufficiency signal that stimulates mTOR: A novel effector patway targeted by D-1-methyl-tryptphan. Oncoimmunology 2012; 1 : 1460–1468.
63. Fallarino F, Grohmann U, You S, et al. The combined effect of tryptophan starvation and tryptophan catabolism down-regulates T cell receptor zeta chain and induce a regulatory phenotype in naive T cells. J Immunol 2006; 176 : 752–761.
64. Boasso A, Herbeuval JP, Hardy AW, et al. HIV inhibits CD4+ T cell proliferation by inducing indoleaamine 2,3-dioxygenase in plasmocytoid dendritic cells. Blood 2007; 109 : 3351–3359.
65. Fallarino, F, Grohmann, U, Vacca, C, et al. T cell apoptosis by tryptophan catabolism. Cell Death Differ 2002; 9 : 1069–1077.
66. Song H, Park H, Kim YS, et al. L-kynurenine-induced apoptosis in human NK cell is mediated by reactive oxygen species. Int Immunopharmacol 2011; 11 : 932–938.
67. Song H, Park H, Kim J, et al. IDO metabolite produced by EBV – transformed B cells inhibits surface expression of NKG2D in NK cells via c-Jun N-terminal kinase (JNK) pathway. Immunol Letts 2011; 136 : 187–193.
68. Müller AJ, Du Hadaway JB, Donover PS, et al. Inhibition of indoleamine 2,3-dioxygenase, an immunoregulatory target of the cancer suppression gene Bin1, potentiates cancer chemotherapy. Nat Med 2005; 11 : 312–319.
69. Munn DH, Mellor AL. Indoleamine 2,3-dioxygenase and tumor-induced tolerance. J Clin Incest 2007; 117 : 1147–1154.
70. Löb S, Köningsreiner A, Rammensee HG, et al. Inhibitors of indoleamine-2,3-dioxygenase for cancer therapy: can we see the wood for the trees? Nat Rev Cancer 2009; 9 : 445–452.
71. Liu X, Shin N, Koblih HK, et al. Selective inhibition of IDO 1 effectively regulates mediators of antitumor imunity. Blood 2010; 115: 3520–3530.
72. Koblish HK, Hansbury MJ, Bowman KJ, et al. Hydroxyamidine inhibitorsof indoleamine 2,3-dioxygenase potently suppress systematic tryptophan catabolism and the growth of IDO-expressing tumors. Mol Cancer Ther 2010; 9 : 489–498.
73. Tourino MC, de Oliviera EM, Bellé LP, et al. Tryptamine and dimethyltryptamine inhibit indoleamine 2,3 dioxygenase and increase tumor-reactive effect of peripheral blood mononuclear cells. Cell Biochem Funct 2013; 31: 361–364.
74. He YW, Wang HS, Zeng J, et al. Sodiun butyrate inhibits interferon-gamma induced indoleamine 2,3-dioxygenase expression via STAT1 in nasopharyngeal carcinoma cells. Life Sci. 2013; 93 : 509–515.
75. Tanaka M, Li X, Hikawa H, et al. Sythesis and biological evaluation of novel tryptoline derivatives as indoleamine 2,3-dioxygenase (IDO) inhibitors. Bioorg Med Chem 2013; 21 : 1159–1165.
76. Flink HE, Lalonde JM, Malachowski WP, Muller AJ. The tumor-selective cytotoxic agent β-lapachone is a potent inhibitor of IDO1. Int J Tryptophan Res 2013; 6 : 35–45.
77. Yang S, Li X, Hu F, et al. Discovery of tryptanthrin derivatives as potent inhibitors of indoleamine 2,3 dioxygenase with therapeutic activity in Lewis lung cancer (LLC) tumor-bearing mice. J Med Chem 2013. 56(21): 8321–8331.
78. Blache CA, Manuale ER, Kaltcheva TI, et al. Systematic delivery of Salmonella typhimurium transformed with IDO shRNA enhanced intratumoral vector colonization and suppresses tumor growth. Cancer Res 2012; 7 : 6447–6456.
79. Manuel ER, Diamond DJ. A road less traveled paved by IDO silencing: Harnessing the antitumor acrtivity of neutrophils. Oncoimmunology 2013; 2: e2322.
80. Yen MC, Weng TY, Chen YL, Lin CC, Chen CY, et al. An HDC inhibitor enhances cancer therapeutic efficiency of RNA polymerase III promotor-driven IDO shRNA. Cancer Gene Therapy 2013; 20 : 361–357.
81. Najjar S, Pearlman DM, Alper K, Najjar A, Devinsky O. Neuro-inflammation and psychiatric illness. J Neuroinflammation 2013; 10 : 43 (doi:10.1186/1742-2094-10-43).
82. Miller AH, Haroon E, Raison CL, Felger JC. Cytokine targets in the brain: impact on neurotransmitters and neurocircuits. Depress Anxiety 2013; 30 : 297–306.
83. Horacek J, Flegr J, Tintera J, Verebova K, Spaniel F, Novak T, Brunovsky M, Bubenikova-Valesova V, Holub D, Palenicek T, Hoschl C. Latent toxoplasmosis reduces gray matter density in schizophrenia but not in controls: voxel-based-morphometry (VBM) study. World J Biol Psychiatry 2012, 13 : 501–509.
84. Myint AM. Kynurenines: from the perspective of major psychiatric disorders. FEBS J 2012; 279 : 1375–1385.
85. Muller N, Schwarz M. Schizophrenia as an inflammation-mediated dysbalance of glutamatergic neurotransmission. Neurotox Res 2006, 10 : 131–148.
86. Myint AM, Kim YK. Cytokine-serotonin interaction through IDO: a neurodegeneration hypothesis of depression. Med Hypotheses 2003; 61 : 519–525.
87. Muller N. The role of anti-inflammatory treatment in psychiatric disorders. Psychiatr Danub 2013; 25 : 292–298.
88. Muller N, Schwarz MJ. A psychoneuroimmunological perspective to Emil Kraepelins dichotomy: schizophrenia and major depression as inflammatory CNS disorders. Eur.Arch.Psychiatry Clin.Neurosci 2008; 258(Suppl 2): 97–106.
89. Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E. Inflammatory cytokine alterations in schizophrenia: a systematic quantitative review. Biol Psychiatry 2008; 63 : 801–808.
90. Muller N, Schwarz MJ. The immune-mediated alteration of serotonin and glutamate: towards an integrated view of depression. Mol Psychiatry 2007; 12 : 988–1000.
91. Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C, Brisch R, Bielau H, Meyer SL, Bogerts B, Myint AM. Severe depression is associated with increased microglial quinolinic acid in subregions of the anterior cingulate gyrus: evidence for an immune-modulated glutamatergic neurotransmission? J Neuroinflammation 2011, 8 : 94 (doi: 10.1186/1742-2094-8-94).
92. Lai CH. Gray matter volume in major depressive disorder: a meta-analysis of voxel-based morphometry studies. Psychiatry Res 2013, 211 : 37–46.
93. Myint AM, Kim YK. Network beyond IDO in psychiatric disorders: Revisiting neurodegeneration hypothesis. Prog.Neuropsychopharmacol. Biol Psychiatry 2013 (doi: 10.1016/j.pnpbp.2013.08.008).
94. Vrajova M, Stastny F, Horacek J, Lochman J, Sery O, Pekova S, Klaschka J, Hoschl C. Expression of the hippocampal NMDA receptor GluN1 subunit and its splicing isoforms in schizophrenia: postmortem study. Neurochem Res 2010; 35 : 994–1002.
95. Bubenikova-Valesova V, Horacek J, Vrajova M, Hoschl C. Models of schizophrenia in humans and animals based on inhibition of NMDA receptors. Neurosci Biobehav Rev 2008; 32 : 1014–1023.
96. Freedman R. Alpha7-Nicotinic Acetylcholine Receptor Agonists for Cognitive Enhancement in Schizophrenia. Annu Rev Med 2014; 65 : 245–261.
97. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R. The astrocyte-derived alpha7 nicotinic receptor antagonist kynurenic acid controls extracellular glutamate levels in the prefrontal cortex. J Mol Neurosci 2010; 40 : 204–210.
98. Yoshimi N, Futamura T, Hashimoto K. Prenatal immune activation and subsequent peripubertal stress as a new model of schizophrenia. Expert Rev Neurother 2013; 13 : 747–750.
99. Torrey EF, Bartko JJ, Lun ZR, Yolken RH. Antibodies to Toxoplasma gondii in patients with schizophrenia: a meta-analysis. Schizophr Bull 2007; 33 : 729–736.
100. Nagineni CN, Pardhasaradhi K, Martins MC, Detrick B, Hooks JJ. Mechanisms of interferon-induced inhibition of Toxoplasma gondii replication in human retinal pigment epithelial cells. Infect Immun 1996; 64 : 4188–4196.
101. Silva NM, Rodrigues CV, Santoro MM, Reis LF, Alvarez-Leite JI, Gazzinelli RT. Expression of indoleamine 2,3-dioxygenase, tryptophan degradation, and kynurenine formation during in vivo infection with Toxoplasma gondii: induction by endogenous gamma interferon and requirement of interferon regulatory factor 1. Infect Immun 2002; 70 : 859–868.
102. Suzuki Y. Immunopathogenesis of cerebral toxoplasmosis. J Infect Dis 2002; 186(Suppl 2): S234–S240.
103. Wilke I, Arolt V, Rothermundt M, Weitzsch C, Hornberg M, Kirchner H. Investigations of cytokine production in whole blood cultures of paranoid and residual schizophrenic patients. Eur Arch Psychiatry Clin Neurosci 1996; 246 : 279–284.
104. Schwarcz R, Bruno JP, Muchowski PJ, Wu HQ. Kynurenines in the mammalian brain: when physiology meets pathology. Nat Rev Neurosci, 2012; 13 : 465–477.
105. Berati-Giani D, Ricciardi-Castagnoli P, Kohler C, Cesura AM. Regulation of the kynurenine metabolic pathway by interferon-gamma in murine cloned macrophages and microglial cells. J Neurochem 1996; 66 : 996–1004.
106. Glahn DC, Laird AR, Ellison-Wright I, Thelen SM, Robinson JL, Lancaster JL, Bullmore E, Fox PT. Meta-analysis of gray matter anomalies in schizophrenia: application of anatomic likelihood estimation and network analysis. Biol Psychiatry 2008; 64 : 774–781.
107. Gaskell EA, Smith JE, Pinney JW, Westhead DR, McConkey GA. A unique dual activity amino acid hydroxylase in Toxoplasma gondii. PLoS One 2009; 4: e4801.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Střípky z lékařské brašnyČlánek Intenzivní medicínaČlánek Anální fisuraČlánek KardioonkologieČlánek S dětmi proti obezitěČlánek Člověk, život a smrt: definice termínů podle současných znalostí genetiky a lékařské embryologie
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Metamizol v kostce a v praxi – účinné neopioidní analgetikum pro celé věkové spektrum
-
Všetky články tohto čísla
- Too much medicine: mírná hypertenze při malém riziku
- Anální fisura
- Subkutánní rehydratace u pacientů s terminální fází demence
- Kardioonkologie
- S dětmi proti obezitě
- A přece se točí (a lidstvo se množí)
-
Člověk, život a smrt:
definice termínů podle současných znalostí genetiky a lékařské embryologie - Hodnocení neurologické prognózy dospělých pacientů po srdeční zástavě
-
Příspěvek k dějinám farmakologie
(období pozdní antiky) - Indolamin 2,3-dioxygenáza v onkologii a psychiatrii
- Dvojnásobné jubileum nedoceněného profesora J. D. Johna (1764–1814)
-
Mezinárodní konference AMEE
S podtitulem: Excelence ve vzdělávání – učitel pro 21. století -
Co nového ve výzkumu nikotinu a tabáku:
elektronické cigarety, psychiatrie, genetika a cytisin - Zirmův olomoucký diskuzní den
- Laureát Thomayerovy přednášky Spolku českých lékařů v Praze
- Noví čestní členové Odborné společnosti vojenských lékařů, farmaceutů a veterinárních lékařů ČLS JEP
- Spolek českých lékařů v Praze
- Poděkování prof. MUDr. Josefa Kouteckého, DrSc.
- Odešel prof. MUDr. Petr Zvolský, DrSc., emeritní přednosta Psychiatrické kliniky 1. LF UK a VFN v Praze
- Za doc. MUDr. Vlastislavem Hlavatým, CSc.
- Vzpomínka na MUDr. Vladimíra Brodana, CSc.
- Střípky z lékařské brašny
- Intenzivní medicína
- Anatomie od Vesalia po současnost 1514–2014
-
HAMILTON OTHANEL SMITH
(*1931)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Anální fisura
-
Co nového ve výzkumu nikotinu a tabáku:
elektronické cigarety, psychiatrie, genetika a cytisin - Subkutánní rehydratace u pacientů s terminální fází demence
- Indolamin 2,3-dioxygenáza v onkologii a psychiatrii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



