-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Promotorový polymorfismus (TTTTA)n genu CYP11A1 v patogenezi syndromu polycystických ovarií
(TTTTA)n polymorphism in the promoter of the CYP11A1 gene in the pathogenesis of polycystic ovary syndrome
Background.
Polycystic ovary syndrome (PCOS) is a common endocrinopathy which is characterized by ovarian androgen excess. PCOS has a strong genetic component but the pathogenetic mechanisms responsible for hyperandrogenemia are still unknown. The CYP11A1 encodes the cholesterol side-chain cleavage enzyme that catalyzes the first and rate-limiting step of steroidogenesis. A promoter polymorphism (TTTTA)n CYP11A1 has been reported to be related to the risk of PCOS but the results were controversial.Methods and Results.
We determined this polymorphism in a cohort of 256 PCOS and 109 healthy control women. Using two models (dominant model for allele with 4 repeats and dominant model for long alleles, i.e. 7 and more repeats) we did not find either the difference in allele and genotype distribution between PCOS and controls or the influence of polymorphism on serum testosterone and androstendione levels. However, the PCOS carriers of long alleles had lower FSH, total - and LDL-cholesterol compared to the carriers of short alleles (p = 0.007; p = 0.02; p = 0.02, ANOVA). In controls, the non-carriers of allele with 4 repeats had significantly higher DHEA-S (p = 0.02, ANOVA) levels than the carriers of allele with 4 repeats.Conclusions.
Despite of some associations found, it seems that the promoter variability of CYP11A1 does not play a key role in the pathogenesis of PCOS.Key words:
polycystic ovary syndrome, genetics, CYP11A1, promoter polymorphism
Autoři: Silvie Pražáková; Markéta Vaňková; Olga Bradnová; Petra Lukášová; Josef Včelák; Kateřina Dvořáková; Karel Vondra; Jana Vrbíková; Běla Bendlová
Působiště autorů: Endokrinologický ústav Praha
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 520-525
Kategorie: Původní práce
Souhrn
Východisko.
Syndrom polycystických ovarií (PCOS) je běžnou endokrinopatií, pro kterou je příznačný nadbytek ovariálních androgenů. PCOS je silně geneticky podmíněn, ale patogenetické mechanismy, které hyperandogenémii způsobují, zatím nejou známy. CYP11A1 kóduje enzym katalyzující odštěpení postranního řetězce cholesterolu, což je první a rychlost limitující krok v syntéze steroidů. Dle některých studií promotorový polymorfismus (TTTTA)n CYP11A1 asocioval se zvýšeným rizikem PCOS, ale výsledky jsou kontroverzní.Metody a výsledky.
Polymorfismus jsme stanovili u 256 pacientek s PCOS a 109 zdravých kontrolních žen. Hodnotili jsme dva modely (model dominance alel se čtyřmi opakováními a model dominance dlouhých alel, tj. s více než sedmi opakováními) a nenalezli jsme rozdíl ani v distribuci alel a genotypů mezi PCOS a kontrolami ani jsme neprokázali vliv polymorfismu na hladiny sérového testosteronu a androstendionu. Nicméně v souboru PCOS nositelky dlouhých alel měly nižší hladiny FSH, celkového a LDL--cholesterolu ve srovnání s nositelkami krátkých alel (p = 0,007; p = 0,02; p = 0,02, ANOVA). Kontrolní ženy, které nenesly alelu se čtyřmi opakováními, měly oproti nositelkám alely 4 vyšší hladiny DHEA-S (p = 0,02, ANOVA).Závěry.
I přes některé nalezené asociace se zdá, že promotorová variabilita genu CYP11A1 nehraje v patogenezi PCOS významnější roli.Klíčová slova:
syndrom polycystických ovarií, genetika, CYP11A1, promotorový polymorfismus.ÚVOD
Syndrom polycystických ovarií (PCOS) je jednou z nejběžnějších endokrinopatií, postihujících 4–10 % žen ve fertilním věku (1–3). Hlavními diagnostickými rysy jsou hyperandrogenémie nebo hyperandrogenismus a porucha menstruačního cyklu nebo morfologický, nejčastěji sonografický průkaz polycystických ovarií (4). Etiologie PCOS není dosud objasněná a je pravděpodobně multifaktoriální (5, 6). PCOS má zřetelný rodinný výskyt (7, 8), a proto se v jeho patogenezi uvažuje i o roli genetických faktorů (9).
Mezi kandidátními geny připadají v úvahu vzhledem k hyperandrogenémii také geny, které kódují enzymy účastnící se ve steroidogenezi. In vitro byla v ovariální tkáni mj. nalezena vyšší exprese mRNA CYP11A1 genu, který kóduje enzym odštěpující postranní řetězec cholesterolu (cholesterol side-chain cleavage enzyme, cytochrom P450scc) (10). Tento enzym katalyzuje první krok při syntéze steroidních hormonů (konverzi cholesterolu na pregnenolon), který je limitujícím krokem v jejich produkci, a gen, který ho kóduje, je proto jedním z možných kandidátních genů PCOS. Gen CYP11A1 je lokalizovaný na dlouhém raménku chromozomu 15 na pozici 15q24. Regulace syntézy steroidů se odehrává na úrovni transkripční regulace genu (11). Předpokládá se, že regulační element je umístěný v promotoru genu v 5’oblasti. Transkripční aktivitu nebo expresi genu CYP11A1 by mohl ovlivňovat mikrosatelitní (STR) polymorfismus tvořený pentanukleotidovou sekvencí (TTTTA)n, který se vyskytuje v pozici -528 bp od iniciačního místa transkripce. Jednotlivé alely se liší počtem opakování tohoto polymorfismu, který kolísá od 4 do 10. Předpokládá se, že tento délkový polymorfismus by mohl hrát roli v patogenezi PCOS.
Výsledky provedených studií týkajících se CYP11A1 u PCOS však nejsou jednoznačné. V populaci se nejčastěji vyskytují čtyři opakování této sekvence. Bylo prokázáno, že ženy s PCOS měly oproti kontrolám častěji zastoupený genotyp s více než čtyřmi opakováními pentanukleotidové sekvence (TTTTA)n, označovaný jako alela 216-, což bylo provázeno vyššími hladinami testosteronu (12, 13). Jiní autoři však neprokázali asociaci mezi výskytem počtu opakování alel v oblasti tohoto genového promotoru a PCOS a nepotvrdili ani asociaci s hladinami testosteronu (14).
Cílem naší studie bylo popsat výskyt promotorových variant CYP11A1 genu v české populaci žen s PCOS a studovat jejich asociaci s hladinami androgenů a s dalšími metabolickými a antropometrickými parametry.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Studované soubory a jejich charakterizace
Syndrom polycystických ovarií byl diagnostikován podle kritérií ESHRE (15), kdy diagnóza je splněna při přítomnosti dvou ze tří kritérií: 1. hyperandrogenismus (přítomnost hirsutismu, akné nebo androgenní alopecie) nebo hyperandrogenémie; 2. oligo-anovulace, 3. morfologický obraz polycystických ovarií. Do studie bylo zařazeno 256 pacientek s PCOS. Kontrolní soubor tvořilo 109 zdravých žen, s deklarovaným pravidelným menstruačním cyklem v rozmezí od 21 do 35 dní, bez klinických známek hyperandrogenismu a s negativní rodinnou anamnézou diabetu 2. typu. Antikoncepci neužívalo 65 žen z kontrolního souboru. Všechny ženy účastnící se studie byly podrobně informovány o studii, o průběhu vyšetření a o odběru krve ke genetickému vyšetření a podepsaly informovaný souhlas schválený etickou komisí Endokrinologického ústavu.
U zdravých kontrol a pacientek s PCOS bylo provedeno komplexní biochemické vyšetření a antropometrické měření. Ženy se podrobily tříhodinovému orálnímu glukózovému tolerančnímu testu (OGTT). Základní klinické vyšetření a funkční testy probíhaly v Endokrinologickém ústavu v Laboratoři funkčních testů.
Po nočním lačnění byly účastnicím studie odebrány vzorky periferní žilní krve a byly stanovovány následující parametry: glykémie (Backman Glucose Analyzer 2), C-peptid (IRMA, Immunotech), inzulín (IRMA, Immunotech), celkový cholesterol (metoda CHOD-PAP, Merckotest, Merck Vitalab Eclipse), HDL-cholesterol (metoda CHOD-PAP, Merck System Cholesterin, Merck Vitalab Eclipse), triacylglyceroly (TG; metoda CHOD-PAP, Merckotest, Merck Vitalab Eclipse), TSH (Elecsys 2010, Hitachi-Boehringer Mannheim, Germany), prolaktin (IRMA, Immunotech), kortizol, testosteron, androstendion (RIA, vlastní metody), SHBG (IRMA, Immunotech), DHEA-S, DHEA, LH, FSH, 17α-hydroxyprogesteron (RIA metody, Immonotech). Výpočtem byly stanoveny hladiny LDL-cholesterolu (LDL-cholesterol = celkový cholesterol – (triacylglyceroly/2,2) – HDL-cholesterol) a volného testosteronu (volný testosteron = (100*testosteron)/SHBG). U pacientek s PCOS byla tato vyšetření prováděna ve folikulární fázi menstruačního cyklu. Ženy kontrolního souboru byly vyšetřované nezávisle na fázi cyklu, proto hodnoty, jejichž hladiny jsou fází cyklu přímo ovlivněny (LH, FSH, 17α-hydroxyprogesteron) nebyly u těchto kontrol hodnoceny. U pacientek i kontrolních žen byl proveden OGTT, kdy v 0., 30., 60., 90., 120., 150. a 180. minutě OGTT byla stanovována hladina glykémie (G), inzulínu (I) a C-peptidu (Cp). Byly vypočítány indexy inzulínové sekrece a rezistence, resp. senzitivity k inzulínu – HOMA‑F: 20 × I/(G-3,5), HOMA-R: I0 × G/22,5, inzulinogenní index: (I30 - I)/(G30 - G), Matsudův index: 104V [(mean I × mean G) × G × I], Cederholmův index: [75000/120 × (G-G120) × 1,15 × 180 × 0,19 × (hmotnost v kg/120)] / [mean G × log mean I].
Účastnice studie absolvovaly podrobné antropometrické měření, které obnášelo měření hmotnosti, výškových, šířkových a obvodových rozměrů a měření kožních řas. Takto zjištěné hodnoty se poté používaly pro výpočty BMI, WHR a složení těla podle Matiegkových rovnic. Výsledky měření byly zpracovány pomocí programu ANTROPO (16). Součástí studie byl také dotazník týkající se osobní a rodinné anamnézy.
STR analýza polymorfismu (TTTTA)n CYP11A1 genu
Genotypováno bylo celkem 365 osob. Genomická DNA byla izolována z leukocytů nesrážlivé periferní krve pomocí komerčního kitu (NucleoSpin Blood kit, Macherey-Nagel, Německo).
K detekci jednotlivých variant délkového polymorfismu (TTTTA)n v genu CYP11A1 byla použita fragmentační analýza. Studovaný mikrosatelitní úsek byl nejprve naamplifikován pomocí PCR. Sekvence primerů (F: 5’-GGT GAA ACT GTG CCA TTG C-3’; R: 5’-GTT TGG GGG AAA TGA GGG GC-3’) byly zvoleny dle literárních dat (12) a byly nasyntetizovány firmou PharmaTech (Praha, Česká republika). Forward primer byl označen na 5’konci fluorescenční značkou Cy5. PCR amplifikace reverzního vlákna genu byla provedena v 12 μl reakci: 20 ng genomické DNA, 0,1 μM každého z obou primerů, 200 μM dNTPs (Fermentas), 1× PCR Buffer (10× PCR Buffer, Perkin Elmer), 0,15 U Taq DNA polymeráza (AmpliTaq Gold 5 U/μl, Perkin Elmer), 2,5 mM MgCl2 (Perkin Elmer). Podmínky PCR reakce po optimalizaci byly následující: úvodní denaturace při 95 °C, 10 min; následovalo 30 cyklů sestávajících z denaturace při 95 °C, 30 s; annealingu při teplotě 60,6 °C, 30 s; extenze při 72 °C, 1 min; konečná extenze při 72 °C, 10 min. Čistota PCR produktů byla ověřována elektroforeticky na 1,5% agarózovém gelu. PCR produkty byly obarveny ethidiumbromidem a analyzovány pomocí UV světla.
Poté byla připravena směs pro STR analýzu: k 40 μl SLS (sample loading solution, BeckmanCoulter, USA) bylo přidáno 0,25 μl velikostního standardu 60–400 bp nebo 60–600 bp (DNA Size Standart Kits – 400, -600, BeckmanCoulter, USA) a 0,1 μl PCR produktu. Analýza byla provedena na kapilárním analyzátoru CEQ 8000 (BeckmanCoulter, USA). Vstupní data byla analyzována pomocí softwaru dodávaného firmou, který přiřadí každému vrcholu křivky velikost a zároveň určí počet repetic v daném fragmentu. Bylo detekováno šest různě dlouhých fragmentů o velikosti 213, 223, 233, 228, 238, 243 bp, které odpovídají alelám se 4, 6, 7, 8, 9 a 10 repeticemi.
Pro kontrolu správnosti detekce polymorfismu pomocí STR analýzy jsme použili vzorek se známým počtem opakování. Počet repetic u tohoto vzorku (homozygot pro alelu 4) byl ověřen sekvenací.
Statistické metody
V tabulkách jsou hodnoty parametrů uvedeny jako průměry se směrodatnými odchylkami. Statisticky signifikantní významnost byla stanovena pro hladinu významnosti α < 0,05. Rozdíly ve frekvencích genotypů a alel STR polymorfismu byly hodnoceny pomocí χ2-testu, případně Fisherovým exaktním testem.
Asociace genotypů se sledovanými antropometrickými a biochemickými parametry byly hodnoceny Mann-Whitneyovým testem v případě netransformovaných dat, u transformovaných dat (pomocí mocninné transformace na nulovou šikmost; Excel) po ověření normality rozdělení dat (QC Expert) byla provedena analýza rozptylu (ANOVA) (NCSS 2004). Při analýze rozptylu byly parametry, které jsou závislé na BMI, na BMI adjustovány.
VÝSLEDKY
Antropometrické, biochemické a hormonální parametry a indexy inzulínové sekrece a senzitivity u souboru pacientek s PCOS a kontrolních žen, které neužívaly antikoncepci, jsou uvedeny v tabulkách 1 až 3. Ač se soubory nelišily ve věku, ženy s PCOS měly signifikantně vyšší BMI, WHR, obvodové míry, procento tukové hmoty a nižší procento svaloviny. Kromě hladin androgenů měly pacientky s PCOS signifikantně nižší hladinu FSH a signifikantně vyšší poměr LH/FSH, což patří též k obrazu PCOS. Změny byly patrné i v lipidovém spektru. PCOS provázely vyšší hladiny triacylglycerolů a celkového a LDL-cholesterolu, a to i po adjustaci na BMI. Soubory se nelišily v lačné glykémii, v průběhu OGTT byl však PCOS spojen s vyššími hladinami stimulované glykémie a se zvýšenou sekrecí C-peptidu a inzulínu, přičemž signifikance přetrvaly i po adjustaci na BMI. Tomu odpovídaly i indexy inzulínové sekrece a senzitivity. Pacientky s PCOS měly signifikantně vyšší index inzulínové sekrece (HOMA-F) a vykazovaly nižší senzitivitu k inzulínu (indexy HOMA-R, Matsudův index, Cederholmův index) oproti kontrolám.
Tab. 1. Antropometrické parametry u souboru pacientek s PCOS a kontrolního souboru bez antikoncepce 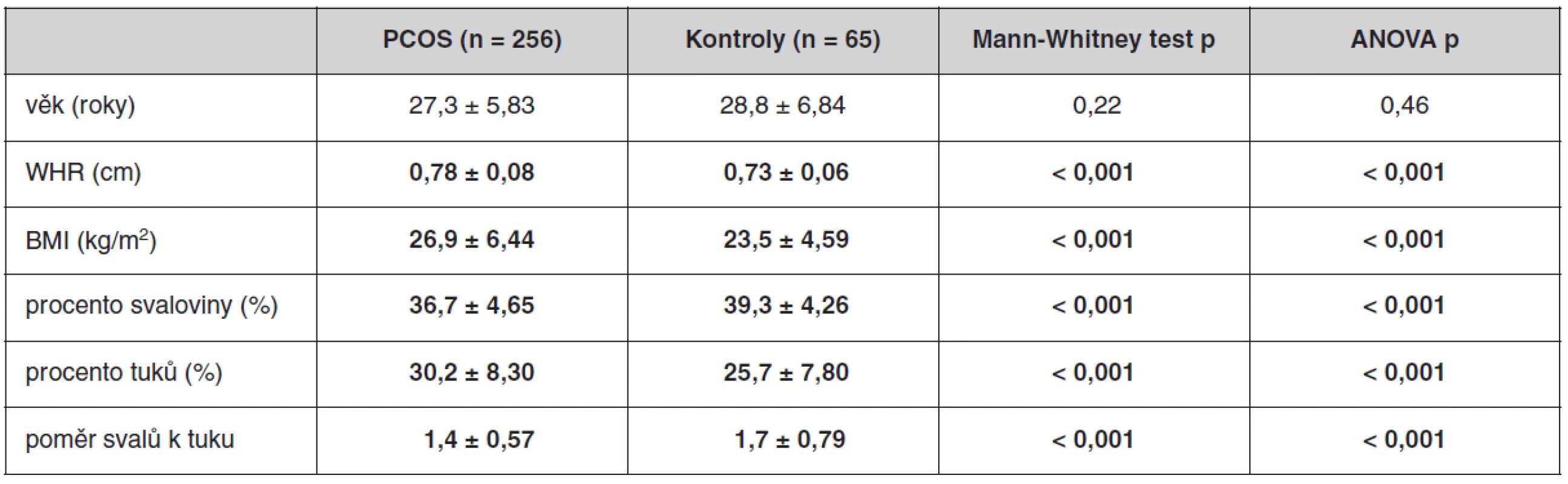
Tab. 2. Hormonální a biochemické parametry u souboru pacientek s PCOS a kontrolního souboru bez antikoncepce 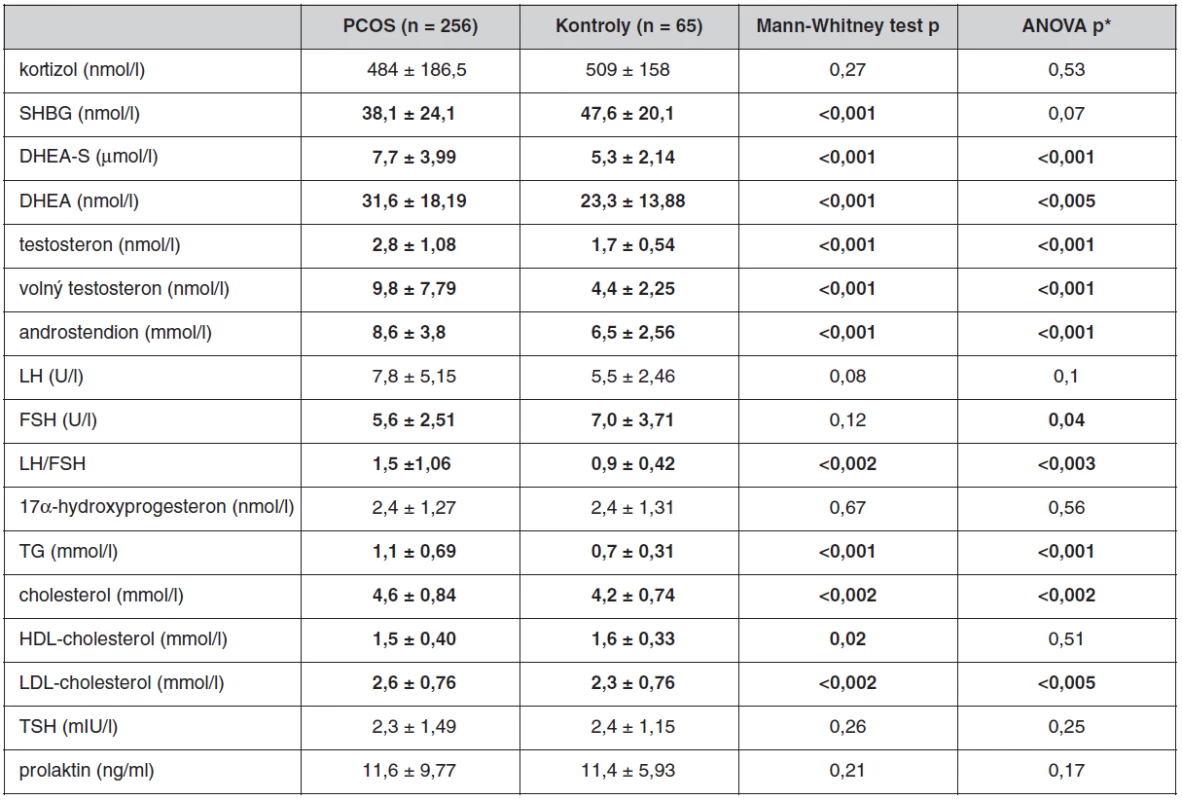
*adjustováno na BMI Tab. 3. Parametry OGTT u souboru pacientek s PCOS a kontrolního souboru bez antikoncepce 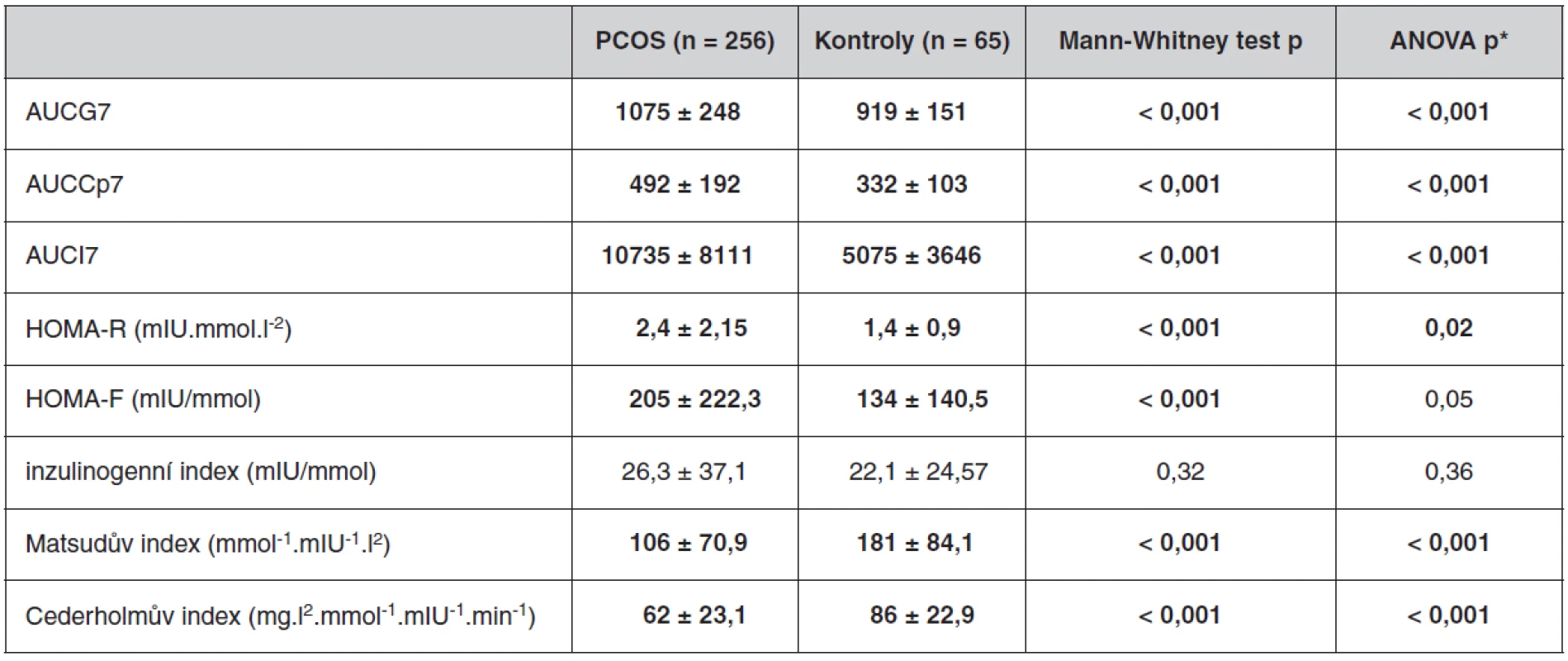
*adjustováno na BMI , AUC7 – vypočítaná plocha pod křivkou z prodlouženého sedmibodového OGTT (0, 30, 60, 90, 120, 150, 180 min) Co se týče promotorového polymorfismu genu CYP11A1, neprokázali jsme žádné rozdíly v distribuci alel se 4–10 opakováními mezi pacientkami s PCOS a kontrolami. Nejčastější byly alely se čtyřmi opakováními, které se vyskytovaly u 61,9 % PCOS a 57,8 % kontrol, dále se šesti opakováními (24 % PCOS a 25,7 % kontrol), osmi opakováními (7,4 % PCOS a 10,1 % kontrol), devíti opakováními (6,3 % PCOS a 5,9% kontrol). Alela s pěti opakováními nebyla v souborech detekována, alely se sedmi a s deseti opakováními se vyskytovaly jen vzácně. Frekvence alel a distribuce genotypů detekovaných u pacientek s PCOS a kontrol je uvedena v tabulce 4. Kontrolní soubor pro frekvenční analýzu zahrnoval i ženy, které užívaly antikoncepci.
Tab. 4. Frekvence alel a genotypů u polymorfismu (TTTTA)<sub>n</sub> v genu CYP11A1 u souboru pacientek s PCOS a kontrolních žen 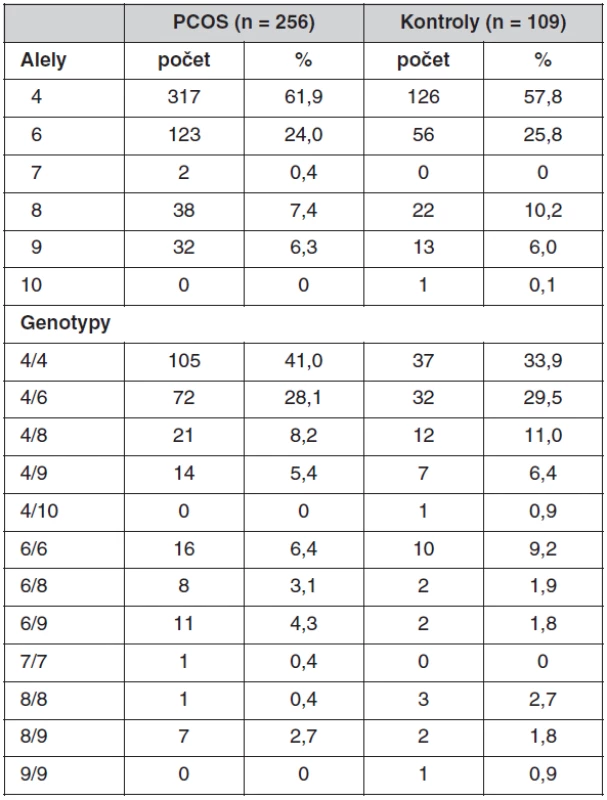
Velký počet genotypů komplikuje další statistické zpracování. Proto jsme vytvořili modely, kdy byly genotypy rozděleny na dvě skupiny (tab. 5). První, tzv. dominantní model pro alelu 4, který počítá s dominantním efektem alely se čtyřmi repeticemi, rozděluje genotypy na skupinu 4+ a 4-. 4+ skupina obsahuje genotypy, ve kterých se nachází alespoň jedna alela 4. Patří sem genotypy 4/4, 4/6, 4/8, 4/9, 4/10. Skupina 4 - zahrnuje zbývající genotypy 6/6, 6/8, 6/9, 7/7, 8/8, 8/9, 9/9.
Tab. 5. Frekvence genotypů polymorfismu (TTTTA)n v genu CYP11A1 po rozdělení do skupin dle dvou modelů 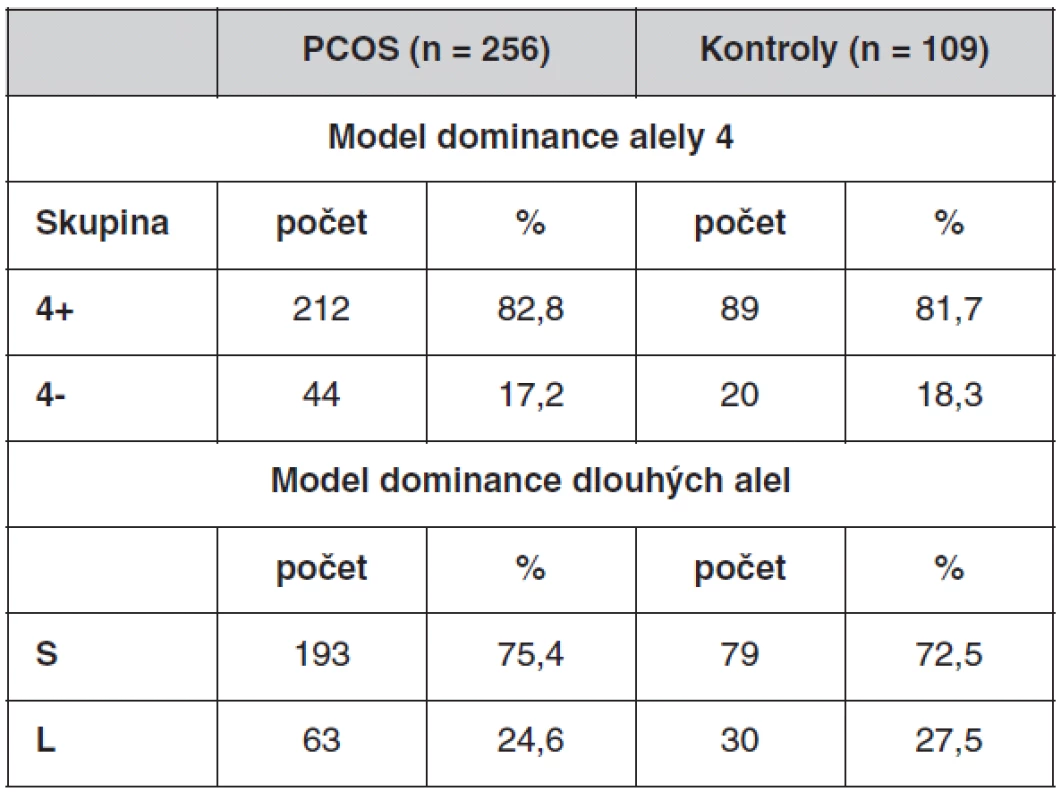
Skupina 4+ zahrnuje genotypy: 4/4, 4/6, 4/8, 4/9, 4/10; skupina 4-: 6/6, 6/8, 6/9, 7/7, 8/8, 8/9, 9/9. Skupina S zahrnuje genotypy: 4/4, 4/6, 6/6; skupina L: 4/8, 4/9, 4/10, 6/8, 6/9, 7/7, 8/8, 8/9, 9/9. Druhý model, tzv. dominantní model pro dlouhé alely, počítá s dominantním efektem alel s větším počtem repetic (sedm a více repetic). Rozděluje genotypy na skupinu S (short) a L (long). L skupina obsahuje genotypy, ve kterých se nachází alespoň jedna alela s počtem repetic 7, 8, 9 nebo 10. Jsou to genotypy 4/8, 4/9, 4/10, 6/8, 6/9, 7/7, 8/8, 8/9, 9/9. Skupina S zahrnuje zbývající genotypy 4/4, 4/6, 6/6.
U každého modelu jsme porovnávali χ2-testem četnost výskytu jednotlivých skupin mezi soubory. Frekvence genotypů u obou modelů se mezi souborem PCOS a souborem kontrol statisticky významně nelišil (první model: χ2 = 0,0713, p = 0,789, druhý model: χ2 = 0,342, p = 0,559).
Pro hodnocení vlivu polymorfismu na fenotyp byly genotypy rozděleny dle výše zmíněných modelů a podrobeny statistické analýze, která zahrnovala pacientky s PCOS a kontrolní ženy neužívající antikoncepci.
Pacientky s PCOS, které nebyly nositelkami alely 4, měly signifikantně vyšší sekreci inzulínu oproti nositelkám alely 4 (inzulínogenní index: 28,92 ± 19,85 vs. 25,22 ± 41,57 mIU/mmol, p = 0,04, ANOVA). U kontrolních žen rozdíl v sekreci inzulínu nebyl prokázán, ale ženy ze skupiny 4 - měly oproti nositelkám alely 4 signifikantně vyšší hladiny DHEA-S (6,79 ± 2,32 vs. 5,04 ± 2,01 μmol/l, p = 0,02, ANOVA).
V případě tzv. dominantního modelu pro dlouhé alely měly pacientky s dlouhými alelami oproti nositelkám krátkých alel signifikantně nižší hladiny FSH (5,06 ± 2,16 vs. 5,87 ± 2,65 U/l, p = 0,007, ANOVA), celkového cholesterolu (4,42 ± 0,81 vs. 4,65 ± 0,84 mmol/l, p = 0,02, ANOVA) a LDL-cholesterolu (2,5 ± 0,71 vs. 2,69 ± 0,76 mmol/l, p = 0,02, ANOVA).
Neprokázali jsme však žádnou asociaci mezi výskytem alely 4 nebo mezi výskytem dlouhých alel a hladinami testosteronu, volného testosteronu či androstendionu. Genotyp neměl vliv ani na antropometrické parametry.
DISKUZE
Pro PCOS je příznačná nadměrná sekrece androgenů, nicméně patofyzilogické mechanismy, které jsou její příčinou, stále nejsou známy.
CYP11A1 patří v tomto ohledu mezi klíčové kandidátní geny. Je zřejmé, že mutace tohoto důležitého enzymu, který katalyzuje limitující krok steroidogeneze, přeměnu cholesterolu na pregnenolon, by mohly ovlivnit hladiny androgenů v těle. V několika populacích byla studována možná asociace promotorového STR polymorfismu (TTTTA)n s PCOS a s hladinami androgenů, avšak s kontroverzními výsledky (12–14, 17–20). Původní studie prokázaly asociaci alel s větším počtem repetic s PCOS a s vyššími hladinami testosteronu (12, 13). Daneshmand et al. (20) sice prokázal vyšší výskyt alel s devíti opakováními u pacientek s PCOS, ale počet alel neovlivnil hladiny sérového testosteronu ani androstendionu ve folikulární tekutině. Jiní autoři (14, 19) nezjistili ani žádný rozdíl ve frekvenci alel mezi pacientkami a kontrolami, ani jejich vliv na hladiny testosteronu.
Je třeba upozornit na etnické rozdíly, které by mohly diskrepanci výsledků částečně vysvětlit. Nedávná studie Pirase et al. (21), která zjišťovala distribuci alelických a genotypových frekvencí polymorfismu (TTTTA)n u deseti evropských a severoafrických populací prokázala výrazný severo-jižní gradient distribuce alel. Frekvence výskytu alely se čtyřmi opakováními se zvyšovala směrem na sever, naproti tomu frekvence výskytu alely s osmi opakováními se zvyšovala směrem k jihu. Naše populace s nejhojnějším výskytem alely se čtyřmi opakováními tak odpovídá tomuto distribučnímu gradientu.
Rozdílné frekvenční zastoupení alel je popisované i u asijských populací. U čínských žen s PCOS v porovnání s kontrolní populací bylo častější zastoupení alely s šesti opakováními (17, 22). Pacientky, homozygotky pro alelu s šesti opakováními, měly signifikantně vyšší BMI (17), resp. WHR a nižší AUCG (22), než ty, které tuto alelu neměly zastoupenou. Recentně byl v indické populaci žen s PCOS prokázán vyšší testosteron u žen s šesti opakováními v porovnání s těmi, které měly čtyři opakování alely. Hladiny androstendionu se nelišily a v kontrolní skupině nebyl v hladinách androgenů nalezen rozdíl (18).
Naše studie hodnotící dva modely (dominantní model pro alelu 4 a dominantní model pro dlouhé alely) neprokázala asociaci polymorfismu (TTTTA)n genu CYP11A1 s PCOS ani s hladinami sérového testosteronu a androstendionu. V případě dominantního modelu pro alelu 4 však pacientky, které nebyly nositelkami alely 4, měly signifikantně vyšší sekreci inzulínu v první fázi OGTT (inzulínogenní index). U souboru kontrol jsme vliv na sekreci inzulínu neprokázali, ale zjistili jsme signifikantně vyšší hladiny slabého androgenu DHEA-S u skupiny s genotypy bez alely 4. Při použití dominantního modelu pro dlouhé alely jsme u souboru s PCOS nalezli signifikantní rozdíly v hladinách celkového a LDL-cholesterolu. Skupina s genotypy dlouhých alel měla hladiny obou cholesterolů nižší. To by mohla vysvětlit vyšší aktivita enzymu CYP11A1. I když byly u pacientek s PCOS v thékálních buňkách opakovaně prokázány vyšší hladiny mRNA CYP11A1 a zvýšená sekrece androgenů (20, 23–25), polymorfismus samotný zřejmě nemá vliv na expresi genu, ani na jeho aktivitu (20, 26). Zvýšená exprese CYP11A1, ale i dalších genů spojených se steroidogenezí je tedy důsledkem jiných regulačních mechanismů. Jedním z nich může být ovlivnění promotorové aktivity CYP11A1 transkripčním faktorem GATA-6. Je totiž známo, že jeho exprese je v thékálních buňkách pacientek s PCOS též zvýšena (24, 25).
Za zmínku stojí, že promotorový polymorfismus genu CYP11A1 byl studován i v souvislosti s některými nádorovými onemocněními. V čínské populaci byl u pacientek s karcinomem prsu častější výskyt alel s osmi opakováními a nositelství této alely v homozygotním stavu bylo spojeno téměř s trojnásobným zvýšením rizika karcinomu prsu ve srovnání s ženami, které tuto alelu nenesou (27). U karcinomu prostaty se sice pacienti nelišili ve frekvencích alel od zdravých kontrol a pacientů s benigní hyperplazií prostaty, ale pacienti s karcinomem prostaty, kteří nebyli nositeli alely se čtyřmi opakováními, měli mnohem agresivnější projevy onemocnění. Vliv polymorfismu na hladiny androgenů však prokázán nebyl (28). Ve studiích, které zkoumaly asociaci mezi endometriálním karcinomem, hladinami steroidních hormonů a genotypy, též nebyla nalezena asociace mezi genotypy CYP11A1 (TTTTA)n a hladinami androgenů, progesteronu a estrogenů (29).
Závěrem lze říci, že i když promotorový polymorfismus (TTTTA)n genu CYP11A1 pravděpodobně nehraje v patogenezi PCOS podstatnou roli, protože přímo neovlivňuje expresi a aktivitu enzymu, otázka role CYP11A1 jak u PCOS, tak u některých nádorových onemocnění, zůstává stále nedořešená. Je třeba studovat příčiny zvýšení exprese tohoto genu u PCOS v širších souvislostech, tzn. studovat další regulační mechanismy a modifikující faktory, možný vliv imprintingu apod.
Zkratky
AUC – plocha pod křivkou (area under the curve)
bp – pár/y bází (base pair/s)
BMI – index tělesné hmotnosti (body mass index)
Cp – C-peptid
CYP11A1 – cholesterol side-chain cleavage enzyme, cytochrome P450scc
DHEA(S) – dehydroepiandrosteron a jeho sulfát
ESHRE – European Society of Human Reproduction and Embryology
FSH – folikuly stimulující hormon
G – glykémie
HOMA-F – homeostatický model funkce beta-buněk pankreatu
HOMA-R – homeostatický model inzulinové rezistence
I – inzulín
LH – luteinizační hormon
OGTT – orální glukózový toleranční test
PCOS – syndrom polycystických ovarií
PCR – polymerázová řetězová reakce
RIA – radioimunoanalýza
SHBG – sexuální hormony vázající globulin
SLC – sample loading solution
STR – krátké tandemové úseky (short tandem repeats)
TG – triacylglyceroly
TSH – tyreotropin
WHR – poměr pas/boky (waist-hip ratio)
Práce byla podpořena grantem IGA MZ ČR NS/9839-4.
Děkujeme všem dobrovolnicím za účast ve studii. Poděkování patří i sestrám a laborantkám za jejich pomoc a pečlivou práci.
Adresa pro korespondenci:
RNDr. Běla Bendlová, CSc.
Endokrinologický ústav
Národní 8, 116 94 Praha 1
e-mail: bbendlova@endo.cz
Zdroje
1. Diamanti-Kandarakis E, Kouli C R, Bergiele AT, et al. A survey of the polycystic ovary syndrome in the Greek island of Lesbos: hormonal and metabolic profile. J Clin Endocrinol Metab 1999; 84 : 4006–4011.
2. Azziz R, Woods KS, Reyna R, et al. The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab 2004; 89 : 2745–2749.
3. Asuncion M, Calvo RM, San Millan JL, et al. A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain. J Clin Endocrinol Metab 2000; 85 : 2434–2438.
4. Azziz R, Carmina E, Dewailly D, et al. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. J Clin Endocrinol Metab 2006; 91 : 4237–4425.
5. Ehrmann DA. Polycystic ovary syndrome. N Engl J Med 2005; 352 : 1223–1236.
6. Vrbíková J, Bendlová B. Polycystic ovary syndrome in 2006. Čas Lék čes 2007; 146(3): 218–222.
7. Franks S. Polycystic ovary syndrome: a changing perspective. Clin Endocrinol (Oxf) 1989; 31 : 87–120.
8. Ferriman D, Purdie AW. The inheritance of polycystic ovarian disease and a possible relationship to premature balding. Clin Endocrinol (Oxf) 1979; 11 : 291–300.
9. Bendlová B, Vaňková M, Lukášová P, et al. Study of the genetic causes of polygeneticallv determined endocrinopathies-patience can bring success. Čas Lék čes 2007; 146 : 198–204.
10. Jakimiuk AJ, Weitsman SR, Navab A, Magoffin DA. Luteinizing hormone receptor, steroidogenesis acute regulatory protein, and steroidogenic enzyme messenger ribonucleic acids are overexpressed in thecal and granulosa cells from polycystic ovaries. J Clin Endocrinol Metab 2001; 86 : 1318–1323.
11. Moore CC, Brentano ST, Miller WL. Human P450scc gene transcription is induced by cyclic AMP and repressed by 12-O-tetradecanoylphorbol-13-acetate and A23187 through independent cis elements. Mol Cell Biol 1990; 10 : 6013–6023.
12. Diamanti-Kandarakis E, Bartzis MI, Bergiele AT, et al. Microsatellite polymorphism (tttta)(n) at -528 base pairs of gene CYP11alpha influences hyperandrogenemia in patients with polycystic ovary syndrome. Fertil Steril 2000; 73 : 735–741.
13. Gharani N, Waterworth DM, Batty S, et al. Association of the steroid synthesis gene CYP11a with polycystic ovary syndrome and hyperandrogenism. Hum Mol Genet 1997; 6 : 397–402.
14. Gaasenbeek M, Powell BL, Sovio U, et al. Large-scale analysis of the relationship between CYP11A promoter variation, polycystic ovarian syndrome, and serum testosterone. J Clin Endocrinol Metab 2004; 89 : 2408–2413.
15. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod 2004; 19 : 41–47.
16. Bláha, P. ANTROPO – ein Programm für automatische Beartbeitung anthropologischer Daten. Wiss. Zeitschrift der Humboldt-Universität zu Berlin 1991; 5 : 153-156.
17. Wang Y, Wu X, Cao Y, et al. A microsatellite polymorphism (tttta)n in the promoter of the CYP11a gene in Chinese women with polycystic ovary syndrome. Fertil Steril 2006; 86 : 223–226.
18. Pusalkar M, Meherji P, Gokral J, et al. CYP11A1 and CYP17 promoter polymorphisms associate with hyperandrogenemia in polycystic ovary syndrome. Fertil Steril 2009; 92 : 653-659.
19. San Millan JL, Sancho J, Calvo RM, Escobar-Morreale HF. Role of the pentanucleotide (tttta)n polymorphism in the promoter of the CYP11a gene in the pathogenesis of hirsutism. Fertil Steril 2001; 75 : 797–802.
20. Daneshmand S, Weitsman SR, Navab A, et al. Overexpression of theca-cell messenger RNA in polycystic ovary syndrome does not correlate with polymorphisms in the cholesterol side-chain cleavage and 17alpha-hydroxylase/C(17-20) lyase promoters. Fertil Steril 2002; 77 : 274–280.
21. Piras I, Falchi A, Moral P, et al.: Frequencies of promoter pentanucleotide (TTTTA)n of CYP11A gene in European and North African populations. Genet Test. 2008; 12(1): 93–96.
22. Hao CF, Bao HC, Zhang N, et al. Evaluation of association between the CYP11alpha promoter pentanucleotide (TTTTA)n polymorphism and polycystic ovary syndrome among Han Chinese women, Neuro Endocrinol Lett 2009; 30(1): 56–60.
23. Nelson VL, Legro RS, Strauss JF 3rd, McAllister JM. Augmented androgen production is a stable steroidogenic phenotype of propagated theca cells from polycystic ovaries. Mol Endocrinol 1999; 13 : 946–957.
24. Wood JR, Nelson VL, Ho C, et al. The molecular phenotype of polycystic ovary syndrome (PCOS) theca cells and new candidate PCOS genes defined by microarray analysis. J Biol Chem 2003; 278 : 26380–26390.
25. Wood JR, Ho CK, Nelson-Degrave, VL, et al. The molecular signature of polycystic ovary syndrome (PCOS) theca cells defined by gene expression profiling. J Reprod Immunol 2004; 63(1): 51–60.
26. Hum, DW, Staels B, Black SM, Miller WL. Basal transcriptional activity and cyclic adenosine 3’, 5’-monophosphate responsiveness of the human cytochrome P450scc promoter transfection into MA-10 Leydig cells. Endocrinology 1993; 132 : 546–552.
27. Zheng W, Gao YT, Shu XO, et al. Population-based case-control study of CYP11A gene polymorphism and breast cancer risk. ancer Epidemiol Biomarkers Prev 2004; 13(5): 709–714.
28. Kumazawa T, Tsuchiya N, Wang L, et al. Microsatellite polymorphism of steroid hormone synthesis gene CYP11A1 is associated with advanced prostate cancer. Int J Cancer 2004; 110(1): 140–144.
29. Olson SH, Bandera EV, Orlow I. Variants in estrogen biosynthesis genes, sex steroid hormone levels, and endometrial cancer: a HuGE review. Am J Epidemiol 2007; 165 : 235–245.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Současný stav stravování a pohybové aktivity ve vztahu k obezitě u sedmiletých dětí – studie WHOČlánek Pokroky v urogynekologiiČlánek 4. hematologický denČlánek Spolek lékařů českýchČlánek KnihaČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Prof. MUDr. RNDr. Luboslav Stárka, DrSc. osmdesátníkem
- Farmakoterapie obezity – současné možnosti a perspektivy
- Promotorový polymorfismus (TTTTA)n genu CYP11A1 v patogenezi syndromu polycystických ovarií
- Vztah sekrece a působení inzulínu – studium genetické determinace
- Současný stav stravování a pohybové aktivity ve vztahu k obezitě u sedmiletých dětí – studie WHO
- Redukce abdominální obezity a kardiometabolických rizik u obézních adolescentů krátkodobým lázeňským redukčním programem
- Změny plazmatických hladin obestatinu a ghrelinu po podání rozpustné vlákniny s glukózou a samotné vlákniny zdravým ženám a pacientkám s bulimia nervosa
- Primární hyperparatyreóza jako příčina hyperkalcémie u pacientky s karcinomem prsu
- 12. konference SRNT Europe (Evropská společnost pro léčbu závislosti na tabáku, Society for Research on Nicotine and Tobacco)
- Pokroky v urogynekologii
- 4. hematologický den
- Roční zkušenosti se stanovením PAI-1
- XIX. konference endoskopické sekce ČGPS ČLS JEP
- Setkání pediatrů, alergologů, dermatologů, urologů a dětských balneologů
- Spolek lékařů českých
- PLÁNOVANÉ AKCE ODBORNÝCH SLOŽEK ČLS JEP
- Kniha
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Farmakoterapie obezity – současné možnosti a perspektivy
- Primární hyperparatyreóza jako příčina hyperkalcémie u pacientky s karcinomem prsu
- Prof. MUDr. RNDr. Luboslav Stárka, DrSc. osmdesátníkem
- Vztah sekrece a působení inzulínu – studium genetické determinace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



