-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vplyv kyseliny tranexámovej na mortalitu, cievne okluzívne príhody a transfúzie krvi u pacientov s veľkým poúrazovým krvácaním (CRASH-2) – randomizovaná, placebom kontrolovaná štúdia*
Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo controlled trial
Background:
Tranexamic acid can reduce bleeding in patients undergoing elective surgery. We assessed the effects of early administration of a short course of tranexamic acid on death, vascular occlusive events, and the receipt of blood transfusion in trauma patients.Methods:
This randomised controlled trial was undertaken in 274 hospitals in 40 countries. 20,211 adult trauma patients with, or at risk of, significant bleeding were randomly assigned within 8 h of injury to either tranexamic acid (loading dose 1 g over 10 min then infusion of 1 g over 8 h) or matching placebo. Randomisation was balanced by centre, with an allocation sequence based on a block size of eight, generated with a computer random number generator. Both participants and study staff (site investigators and trial coordinating centre staff) were blinded to treatment allocation. The primary outcome was death in hospital within 4 weeks of injury, and was described with the following categories: bleeding, vascular occlusion (myocardial infarction, stroke and pulmonary embolism), multiorgan failure, head injury, and other. All analyses were by intention to treat.
This study is registered as ISRCTN86750102, Clinicaltrials.gov NCT00375258, and South African Clinical Trial Register DOH-27-0607-1919.Findings:
Total 10,096 patients were allocated to tranexamic acid and 10,115 to placebo, of whom 10,060 and 10,067, respectively, were analysed. All-cause mortality was significantly reduced with tranexamic acid (1,463 [14·5%] in the tranexamic acid group vs 1,613 [16·0%] in the placebo group; relative risk 0.91, 95% CI 0.85–0.97; p = 0.0035). The risk of death due to bleeding was significantly reduced (489 [4.9%] vs 5.74 [5.7%]; relative risk 0.85, 95% CI 0.76–0.96; p = 0.0077).Interpretation:
Tranexamic acid safely reduced the risk of death in bleeding trauma patients in this study. On the basis of these results, tranexamic acid should be considered for use in bleeding trauma patients.Funding:
UK NIHR Health Technology Assessment programme, Pfizer, BUPA Foundation, and J P Moulton Charitable Foundation.Keywords:
tranexamic acid – trauma – bleeding – RCT – CRASH-2
Autoři: Trenkler Štefan 1; Laincz Anton 2; Valky Jozef 3; Yaghi Ajtham 4; Svoboda Petr 5
Působiště autorů: Ďalší účastníci sú uvedení na konci článku. **; Klinika anestéziológie a intenzívnej medicíny, Univerzita P. J. Šafárika a Univerzitná nemocnica L. Pasteura Košice, Slovensko 1; Oddelenie anestéziológie a intenzívnej medicíny, Nemocnica Poprad, a. s., Slovensko 2; Oddelenie anestéziológie a intenzívnej medicíny, Fakultná nemocnica s Poliklinikou F. D. Roosevelta Banská Bystrica 3; Klinika anestéziológie a intenzívnej medicíny, Univerzitná nemocnica Bratislava, Nemocnica Ružinov 4; Úrazová nemocnice v Brně 5
Vyšlo v časopise: Anest. intenziv. Med., 22, 2011, č. 2, s. 103-114
Kategorie: Intenzivní medicína - Původní práce
(za spolupracovníky CRASH-2 studie**)
Souhrn
Východiská:
Kyselina tranexámová môže zmenšiť rozsah krvácania u pacientov s plánovaným chirurgickým výkonom. Hodnotili sme účinok včasného a krátkodobého podania kyseliny tranexámovej na mortalitu, cievne okluzívne príhody a potrebu transfúzií krvi u pacientov s veľkým poúrazovým krvácaním.Metódy:
Na tejto randomizovanej kontrolovanej štúdii sa zúčastnilo 274 nemocníc v 40 krajinách. Spolu 20 211 dospelých pacientov s úrazom a signifikantným krvácaním, alebo s vysokým rizikom krvácania, bolo náhodne zaradených do skupiny s kyselinou tranexámovou (úvodná dávka 1 g počas 10 minút a potom infúzia 1 g počas 8 hodín), alebo do skupiny s placebom. Randomizácia bola zabezpečená centrom štúdie s použitím počítačového generátora náhodných čísel, ktorý vytvoril sekvenčné bloky po osem pre študovanú látku. Pacienti i osoby, ktoré sa podieľali na štúdii (miestni výskumníci a koordinátori štúdie), nepoznali pridelenú liečbu. Primárnym výsledným ukazovateľom bolo úmrtie v nemocnici do 4 týždňov. Príčina úmrtia bola kategorizovaná ako krvácanie, cievna oklúzia (infarkt myokardu, mozgová cievna príhoda a pľúcna embólia), multiorgánové zlyhanie, poranenie mozgu, ostatné. Všetky analýzy boli vykonané podľa pridelenej liečby (intention-to-treat). Štúdia je registrovaná ako ISRCTN86750102, Clinicaltrials.gov NCT00375258 a South African Clinical Trial Register DOH-27-0607-1919.Výsledky:
Spolu 10 096 pacientov bolo zaradených do skupiny s kyselinou tranexámovou a 10 115 do skupiny s placebom. Do analýzy bolo zaradených 10 060 zo skupiny s kyselinou tranexámovou a 10 067 zo skupiny s placebom. Mortalita zo všetkých príčin bola signifikantne nižšia v skupine s kyselinou tranexámovou ako v skupine s placebom: 1463 (14,5 %) verzus 1613 (16,0 %), relatívne riziko 0,91, 95% CI 0,85–0,97, p = 0,0035. Aj riziko úmrtia pre krvácanie bolo signifikantne nižšie; 489 (4,9 %) verzus 574 (5,7 %), relatívne riziko 0,85, 95% CI 0,76–0,96, p = 0,0077.Diskusia a záver:
V tejto štúdii kyselina tranexámová bezpečne znížila riziko úmrtia u krvácajúcich pacientov po úraze. Preto by u pacientov s veľkým poúrazovým krvácaním malo byť zvážené podanie kyseliny tranexámovej.Klíčová slova:
kyselina tranexámová – úraz – krvácanie – RCT – CRASH-2*CRASH – 2 trial collaborators: Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo controlled trial).
Originální publikace Lancet, 2010 Jul 3; 376 (9734): 23–32. Epub 2010 Jun 14. Publikace překladu se souhlasem a autorizací vydavatele.Úvod
Úrazy sú celosvetovo jednou z hlavných príčin úmrtí [1, 2]. Každý rok zomrie vo svete v súvislosti s dopravným úrazom vyše milióna ľudí. Dopravné úrazy sú celosvetovo deviatou vedúcou príčinou úmrtia a odhaduje sa, že do roku 2020 sa dostanú na tretie vedúce miesto úmrtia a invalidity. Každý rok zomrie okolo 1,6 milióna ľudí v dôsledku vedomého násilného činu spáchaného jedincom, kolektívom alebo samotným postihnutým. K vyše 90 % úmrtí v súvislosti s úrazom dochádza v krajinách s nízkym alebo stredným príjmom [2]. Krvácanie je zodpovedné asi za tretinu úmrtí v nemocnici a môže prispievať aj k úmrtiu na multiorgánové zlyhanie [1].
Hemostatický systém pomáha udržiavať cirkuláciu po závažnom cievnom poranení, či už traumatickom alebo chirurgickom [4]. Veľké chirurgické operácie a úrazy spúšťajú podobnú hemodynamickú odpoveď a veľké straty krvi predstavujú v oboch prípadoch extrémnu výzvu pre koagulačný systém. Súčasťou odpovede na chirurgický výkon a úraz je stimulácia rozkladu koagula (fibrinolýza), ktorá sa v určitých prípadoch môže stať patologickou (hyperfibrinolýza) [4]. Antifibrinolytické látky znižujú straty krvi u pacientov s normálnou i vystupňovanou fibrinolytickou odpoveďou na operáciu, a to bez zjavného zvýšenia rizika pooperačných komplikácií [5].
Kyselina tranexámová je syntetický derivát aminokyseliny lyzínu, ktorý inhibuje fibrinolýzu blokovaním väzobných miest plazminogénu pre lyzín [6]. Systematické prehľady randomizovaných štúdií s kyselinou tranexámovou u elektívnych chirurgických pacientov identifikovali 53 štúdií, zahŕňajúcich 3 836 pacientov [5]. Kyselina tranexámová znížila potrebu krvných transfúzií o jednu tretinu (relatívne riziko [RR] 0,61, 95% CI 0,54–0,70), bez významného zníženia mortality (0,61, 0,32–1,12) [5]. Keďže hemostatická odpoveď na chirurgický výkon a úraz je podobná [4], kyselina tranexámová by mohla znižovať mortalitu pacientov s poúrazovým krvácaním. Ale doteraz nebola vykonaná žiadna randomizovaná štúdia s kyselinou tranexámovou u týchto pacientov [7]. V tejto štúdii sme hodnotili účinok včasného a krátkodobého podávania kyseliny tranexámovej na mortalitu, cievne okluzívne príhody a potrebu transfúzií krvi u pacientov s veľkým poúrazovým krvácaním, alebo s rizikom veľkého krvácania.
Metódy
Návrh štúdie a pacienti
CRASH-2 (Clinical Randomisation of an Antifibrinolytic in Significant Haemorrhage 2) je veľká, placebom kontrolovaná štúdia o účinku včasného a krátkodobého podania kyseliny tranexámovej na mortalitu, cievne okluzívne príhody a potrebu transfúzií krvi. Štúdia bola vykonávaná v 274 nemocniciach v 40 krajinách. Prvý pacient bol do štúdie zaradený v máji 2005. Cieľ štúdie, metódy a protokol boli publikované na inom mieste. Protokol štúdie bol recenzovaný a uverejnený na webovej stránke časopisu The Lancet v roku 2005.
Do štúdie boli zaradení dospelí pacienti po úraze s veľkým krvácaním (systolický tlak < 90 mmHg alebo frekvencia srdca > 110 za minútu alebo oba), alebo pacienti s rizikom veľkého krvácania, počas prvých 8 hodín od úrazu. Pacienti boli do štúdie zaradení vtedy, ak si ošetrujúci lekár nebol istý, či má alebo nemá použiť v liečbe kyselinu tranexámovú (t. j. zaradenie bolo riadené princípom neistoty) [8]. Pacienti, u ktorých ošetrujúci lekár rozhodol, že kyselina tranexámová je indikovaná, neboli zaradení do štúdie. Podobne neboli do štúdie zaradení pacienti, u ktorých bola kyselina tranexámová kontraindikovaná. Ale ak si zodpovedajúci lekár nebol istý, či podať kyselinu tranexámovú alebo nie, pacient bol náhodne zaradený do štúdie.
Miestne regulačné orgány alebo etické komisie posúdili otázky informovaného súhlasu. Informovaný súhlas bol získaný u pacientov, ktorým to umožnili ich fyzické a mentálne schopnosti. Ak pacient nebol schopný podpísať informovaný súhlas, tento bol podpísaný rodinným príslušníkom alebo zastupujúcou osobou. Ak nebola prítomná ani zastupujúca osoba, bol súhlas odložený, alebo sa od neho upustilo, pokiaľ s tým súhlasila etická komisia. Ak bol súhlas odložený, alebo podpísaný zastupujúcou osobou, pacient bol informovaný o štúdii hneď, ako to bolo možné a podľa okolností bol získaný súhlas.
Randomizácia a zaslepenie
Po splnení kritérií na zaradenie do štúdie a obdŕžaní informovaného súhlasu boli pacienti náhodne zaradení do jednej z dvoch skupín. Randomizácia bola zabezpečená centrom s použitím počítačového generátora náhodných čísel, ktorý vytvoril sekvenčné bloky po osem. V nemocniciach, v ktorých nebolo možné použitie telefonickej randomizácie, bol použitý miestny systém balení látky; v jednej škatuli bolo osem balení, z ktorých sa postupne vyberali balenia od najnižšieho čísla. Liečebné balenia boli – až na identifikačné číslo – identické. Číslo balenia bolo zaznamenané na vstupnom formulári, ktorý bol zaslaný do medzinárodného koordinačného centra štúdie v Londýne. Nemocnice vo Veľkej Británii využívali telefónnu randomizačnú službu Univerzity v Oxforde (CTSU). Randomizačná služba používala minimalizačný algoritmus vyvažujúci pohlavie, vek, čas od úrazu, typ poranenia (tupé alebo penetrujúce), Glasgow Come Score, systolický tlak krvi, dychovú frekvenciu, čas kapilárneho návratu a krajinu, berúc do úvahy, aké balenia boli dostupné v nemocnici. Po pridelení čísla balenia bol pacient zaradený do štúdie bez ohľadu na to, či balenie bolo, alebo nebolo otvorené, alebo či sa začalo s pridelenou liečbou. Tak pacienti, ako aj osoby, ktoré sa podieľali na štúdii (miestni výskumníci a koordinátori štúdie), nepoznali pridelenú liečbu.
Ampulky s kyselinou tranexámovou a placebom sa nedali od seba odlíšiť. Kyselina tranexámovú vyrobila Pharmacia (Pfizer, Sandwich, UK) a placebo St. Mary’s Pharmaceutical Unit, Cardiff, UK. Liečebné balenia boli pripravené nezávislou organizáciou (Bilcare, Crickhowell, UK). Správnosť zaslepenia a kódovania ampuliek bola overená náhodným testovaním každej šarže na obsah s použitím vysokoúčinnej kvapalnej chromatografie. V prípade urgentnej potreby bolo možné zistiť obsah balenia telefonicky v CTSU.
Postupy
Pacienti dostali náhodným spôsobom úvodný bolus 1 g kyseliny tranexámovej v infúzii počas 10 minút a následne 1 g počas 8 hodín, alebo placebo (0,9% roztok NaCl). Každému pacientovi bolo pridelené liečebné balenie s jedinečným číslom, ktoré obsahovalo 4 ampulky s 500 mg kyseliny tranexámovej alebo placebo, 100 ml 0,9% roztoku NaCl vo vaku (na podanie úvodného bolusu), striekačku a ihlu, nálepky s podrobnosťami štúdie a randomizačným číslom (na prilepenie na infúzny vak, formulár a pacientov zdravotný záznam) a pokyny. Každá škatuľa s 8 liečebnými baleniami obsahovala letáky s informáciami pre pacientov, príbuzných a zastupujúce osoby, informované súhlasy a formuláre na zber údajov. Nálepky, inštrukcie a letáky boli v miestom jazyku.
Výsledné ukazovatele a vopred stanovené analýzy podskupín
Primárnym výsledným ukazovateľom bolo úmrtie v nemocnici do štyroch týždňov od úrazu. Príčina smrti bola stanovená v týchto kategóriách: krvácanie, cievna oklúzia (infarkt myokardu, mozgová cievna príhoda alebo pľúcna embolizácia), multiorgánové zlyhanie, úraz mozgu a ostatné. Sekundárnymi výslednými ukazovateľmi boli cievne okluzívne príhody (infarkt myokardu, mozgová cievna príhoda, pľúcna embólia alebo hlboká žilová trombóza), chirurgické výkony (neurochirurgický, hrudníkový, brušný alebo panvy), podanie transfúzie krvi a počet transfundovaných krvných prípravkov. Invalidizácia/závislosť pacienta bola hodnotená pri prepustení z nemocnice alebo na 28. deň, pokiaľ bol pacient stále v nemocnici, s použitím Modified Oxford Handicap škály. Škála má kategórie mŕtvy alebo závislý (mŕtvy, plne odkázaný na pomoc vo dne aj v noci, bez potreby stálej pomoci) a nezávislý (mierne obmedzenie v živote, ale bez potreby pomoci, prípadne pacienti s miernymi alebo žiadnymi príznakmi) [9]. Ďalej bolo zaznamenané použitie rekombinantného faktora VIIa a výskyt gastrointestinálneho krvácania ako komplikácie. Všetky očakávané komplikácie boli zaznamenané na výsledkovom formulári. Nežiaduce príhody, ktoré boli závažné, neočakávané a predpokladalo sa, že majú vzťah k študovanej liečbe, boli evidované samostatne. Výsledky liečby boli zaznamenané vtedy, ak k nim došlo u hospitalizovaného pacienta do 28. dňa od podania študovanej látky. Údaje boli odoslané do koordinačného centra elektronicky (zašifrovanými elektronickými formulármi, ktoré mohli byť odoslané emailom, alebo priamo na bezpečný server) alebo faxom. Všetky získané údaje boli vložené do centrálnej databázy v koordinačnom centre v Londýne. Kvalita údajov v štúdii bola monitorovaná s použitím kombinácie centrálnej štatistickej kontroly údajov a návštevami zúčastnených nemocníc, kde boli porovnávané výstupné formuláre pacientov s chorobopisom [10].
Účinok liečby na primárny výsledný ukazovateľ je uvádzaný v štyroch základných kategóriách: 1. odhadovaný čas od úrazu (< 1, 1–3, 3–8 hod), 2. systolický tlak krvi (≤ 75, 76–89, ≥ 90 mmHg), 3. Glasgow Coma Score (závažné 3–8, stredné 9–12, mierne 13–15) a 4. typ poranenia (iba penetrujúce alebo tupé, ktoré zahŕňajú tupé aj penetrujúce).
Štatistické analýzy
Plán štatistických analýz bol odoslaný všetkým etickým komisiám a regulačným agentúram pred odslepením podaných látok. Keďže riziko úmrtia sa odhaduje na 20 % a aj 2% rozdiel v prežívaní (zodpovedajúci relatívnemu riziku úmrtia pri použití kyseliny tranexámovej 0,9) by bol významný, veľkosť súboru bola stanovená na 20 000 účastníkov, čo znamená 85% možnosť dosiahnuť obojstranné hodnoty p < 0,01 a 95% možnosť dosiahnuť hodnoty p < 0,05. Všetky analýzy boli vykonané podľa pridelenej liečby (intention-to-treat). Pri každom binárnom výsledku sme vypočítali RR (relatívne riziko) a 95% CI, ako aj obojstranné hodnoty p pre štatistickú významnosť. Relatívne riziko udáva, koľkokrát je vyššia (RR > 1) alebo nižšia (RR < 1) pravdepodobnosť príhody v skupine s kyselinou tranexámovou v porovnaní so skupinou s placebom. Pre analýzu vo vopred určených podskupinách (iba primárne výsledné ukazovatele) sme vypočítali RR s 99% CI s obojstrannými hodnotami p. Heterogenitu v liečebných účinkoch medzi podskupinami sme testovali s použitím χ2 testov. Vopred sme stanovili, že pokiaľ by nebol silný dôkaz (p < 0,001) proti homogenite účinkov, priemernú hodnotu RR je možné považovať za najlepšiu mieru odhadov RR vo všetkých podskupinách. Pre hodnoty s celými číslami sme vypočítali priemery a SD a obojstranné hodnoty p pre rozdiely priemerov logaritmov. Analýza bola vykonaná u všetkých účastníkov, ktorí mali k dispozícii relevantné údaje o výsledku. Neboli vykonané korekcie na chýbajúce údaje. V priebehu štúdie vykonával nezávislý štatistik nezaslepené priebežné analýzy pre monitorujúcu etickú komisiu.
Táto štúdia je registrovaná pod číslom ISRCTN86750102, Clinicaltrials.gov NCT00375258 a South African Clinical Trial Register DOH-27-0607-1919.
Financovanie štúdie
Sponzorujúce subjekty nemali žiadny vplyv na návrh štúdie, zber údajov a ich analýzu, interpretáciu, výslednú formu alebo napísanie štúdie. Komisia pre napísanie publikácie mala plný prístup ku všetkým údajom štúdie a konečnú zodpovednosť za rozhodnutie uverejniť štúdiu.
Výsledky
Na obrázku 1 je profil štúdie. Spolu 20 211 pacientov bolo náhodne zaradených do skupiny s kyselinou tranexámovou alebo placebom; z toho bolo 20 116 pacientov randomizovaných lokálnym systémom balení a 95 pacientov telefonicky. Zo štúdie boli vyradení 4 pacienti, ktorí po randomizácii stiahli súhlas. U 5 zaradených pacientov sa neskôr ukázalo, že ešte nemajú 16 rokov. Vek bol neznámy u 4 pacientov, 23 pacientov bolo zaradených do štúdie po 8 hodinách od prijatia. Čas poranenia nebol známy u 11 pacientov, 9 pacientov krvácalo pre inú ako poúrazovú príčinu, 3 pacienti dostali inú ako randomizáciou pridelenú látku. Plánovaný postup pri získavaní súhlasu nebol plne dodržaný u 34 pacientov. O tejto skutočnosti boli informované príslušné etické komisie, ktoré dali súhlas na použitie týchto údajov. Do analýzy výsledkov tak boli zahrnutí všetci pacienti okrem 4, ktorí stiahli svoj informovaný súhlas.
Obe skupiny liečených pacientov boli porovnateľné čo do východzích charakteristík (tab. 1, príloha P 1 na webe obsahuje východzie údaje pacientov s údajmi o ďalšom sledovaní). Výsledné údaje pre primárne výsledné ukazovatele boli dostupné u 20 127 pacientov (99,6 %), z ktorých 10 060 dostalo kyselinu tranexámovú a 10 067 placebo. U 19 944 pacientov bola podaná úvodná dávka (99,1 %) a u 18 965 pacientov udržiavacia dávka počas 8 hodín (94,2 %). Zomrelo 3076 pacientov (15,3 %), z toho 1086 (35,3 %) v deň randomizácie (obr. 2). Na krvácanie zomrelo 1063 pacientov, z toho 637 (59,9 %) v deň randomizácie.
Tab. 1. Východzie charakteristiky účastníkov 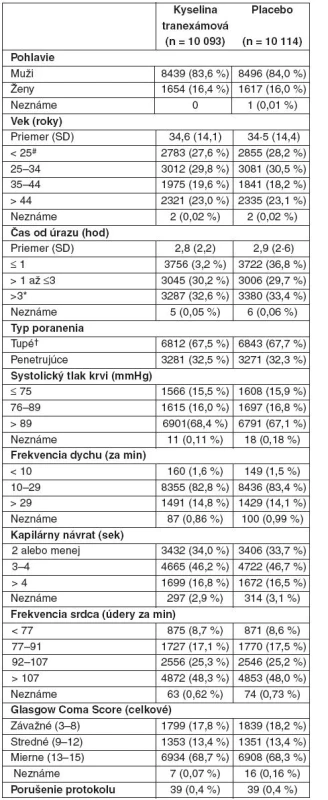
Údaje sú čísla (% v skupine), pokiaľ to nie je ináč uvedené. #Zahŕňa päť pacientov vo veku pod 16 rokov. *Zahŕňa 23 pacientov randomizovaných po 8 hod od poranenia. †Zahŕňa pacientov s tupým i penetrujúcim poranením a pacientov iba s tupým poranením. Obr. 2. Mortalita podľa dní od randomizácie 
Mortalita zo všetkých príčin bola signifikantne nižšia v skupine s kyselinou tranexámovou (tab. 2). Relatívne riziko úmrtia v skupine s kyselinou tranexámovou bolo 0,91 (95% CI 0,85–0,97, p = 0,035; pozri tab. 2). Riziko úmrtia pre krvácanie bolo výrazne znížené (pozri tab. 2). Tento účinok na mortalitu bol zjavný aj v deň randomizácie (282 v skupine s kyselinou tranexámovou [2,8 %] a 355 v skupine s placebom [3,5 %]; RR 0,80, 95% CI 0,68–0,93, p = 0,0036). Na cievnu oklúziu zomrelo 33 pacientov v skupine s kyselinou tranexámovou (0,3 %) a 48 v skupine s placebom (0,5 %) – tab. 2, vrátane 7 vz. 22 na infarkt mykardu, 8 vz. 5 na mozgovú cievnu príhodu a 18 vz. 21 na pľúcnu embóliu. Počet úmrtí na multiorgánové zlyhanie, poranenie mozgu alebo inú príčinu sa medzi skupinami výrazne nelíšil (pozri tab. 2).
Tab. 2. Úmrtie podľa príčin 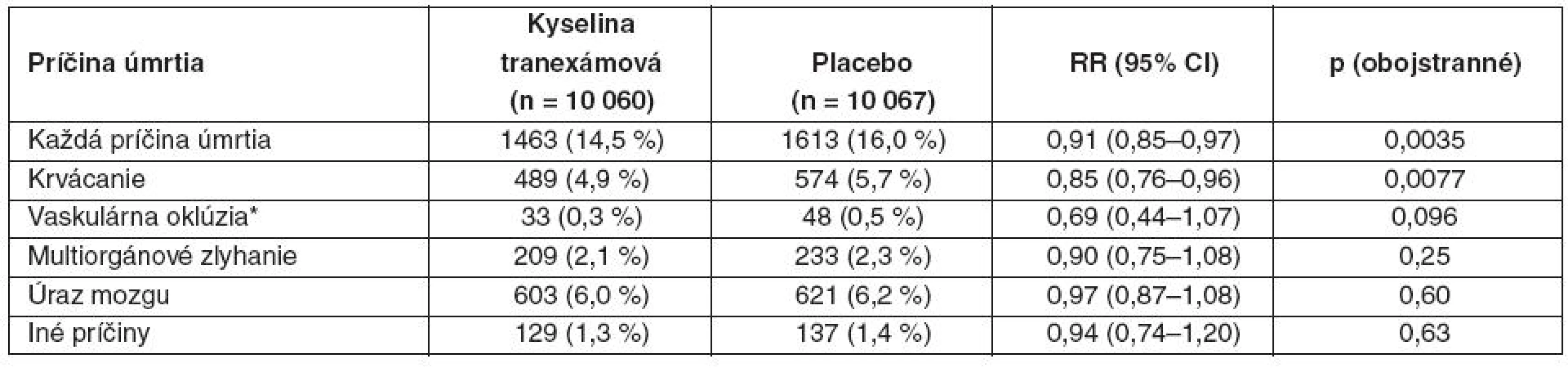
Údaje sú čísla ( %), pokiaľ to nie je ináč uvedené. RR – relatívne riziko. *Zahŕňa infarkt myokardu, mozgovú cievnu príhodu a pľúcnu embóliu. Počet cievnych okluzívnych príhod (fatálnych alebo nefatálnych) nebol signifikantne rozdielny – 168 pacientov s jednou alebo viacerými príhodami (infarkt myokardu, mozgová cievna príhoda, pľúcna embolizácia, hlboká žilová trombóza) v skupine s kyselinou tranexámovou (1,7 %) a 201 pacientov v skupine s placebom (2,0 %) – tab. 3.
Tab. 3. Príhody vaskulárnych oklúzií, potreba transfúzií a operácie a stupeň závislosti 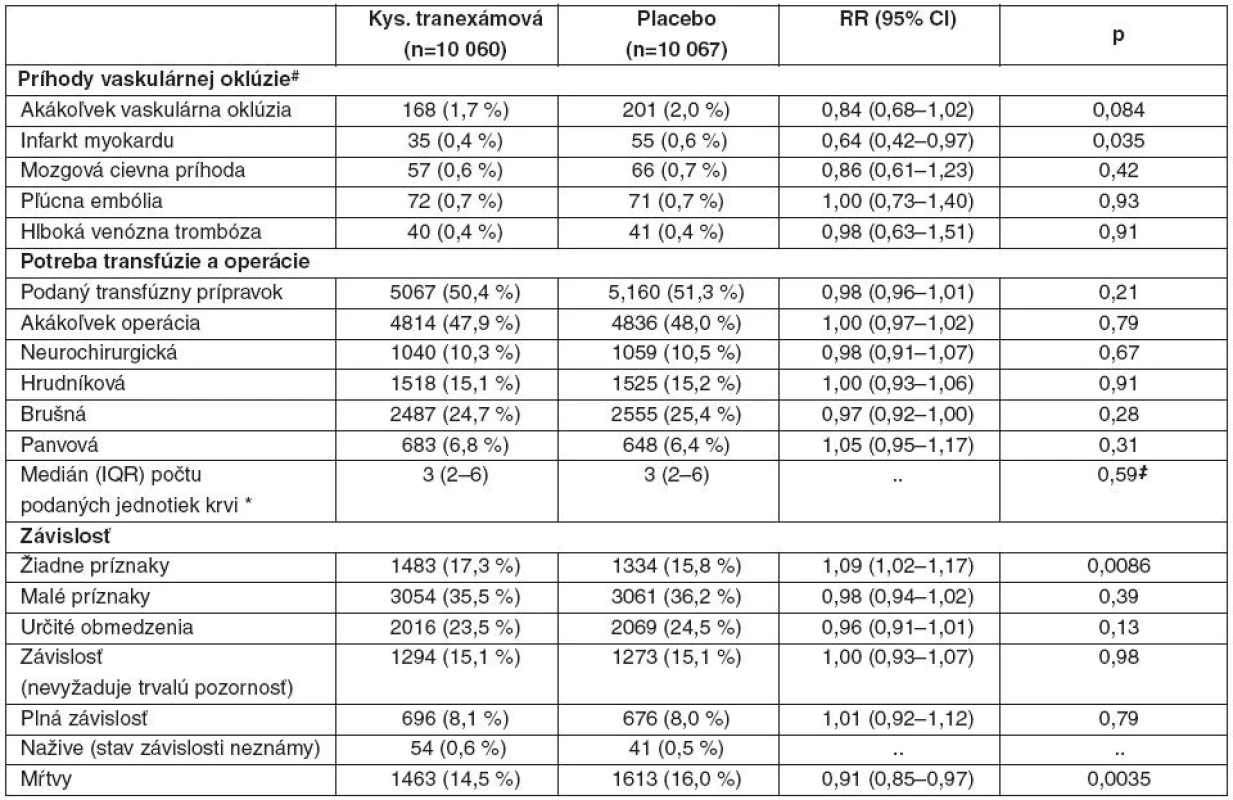
Údaje sú čísla (%), pokiaľ to nie je ináč uvedené. Sú uvedené počty pacientov s aspoň jednou príhodou. RR – relatívne riziko. #Zahŕňa fatálne i nefatálne príhody. *Iba pacienti s transfúziou. ‡Analýzy s použitím logaritmickej transformácie priemerného počtu podaných transfúznych prípravkov. Transfúzie krvných derivátov boli podané 5067 pacientom v skupine s kyselinou tranexámovou (50,4 %) a 5160 pacientom v skupine s placebom (51,3 %) – pozri tab. 3. Pacienti v skupine s kyselinou tranexámovou dostali v priemere 6,06 (SD 9,98) jednotky krvi v porovnaní s priemerne 6,29 (SD 10,31) v skupine s placebom. Čo sa týka intervencií, 4814 pacientov v skupine s kyselinou tranexámovou (47,9 %) vyžadovalo jeden alebo viac chirurgických zásahov (neurochirurgický, hrudný, brušný výkon alebo výkon v panve) v porovnaní s 4836 (48,0 %) v skupine s placebom (pozri tab. 3). Iba 17 pacientov bolo liečených rekombinantným faktorom VIIa (13 pacientov v skupine s kyselinou tranexámovou a 4 v skupine s placebom). U 132 pacientov v každej skupine bolo pozorované krvácanie z tráviaceho traktu (p = 0,99).
V skupine s kyselinou tranexámovou bolo 3453 pacientov klasifikovaných ako mŕtvych alebo závislých na pomoci pri prepustení alebo na 28. deň hospitalizácie (34,3 %) v porovnaní s 3562 pacientmi v skupine s placebom – 35,4 % (RR 0,97, 95% CI 0,93–1,00; p = 0,12). V čase prepustenia alebo na 28. deň nemalo žiadne príznaky 1483 pacientov v skupine s kyselinou tranexámovou (14,7 %) a 1334 v skupine s placebom (13,3 %) – pozri tab. 3. Na 28. deň bolo stále hospitalizovaných 1846 pacientov (9,2 %) – 958 vz. 888.
Vopred sme stanovili, že pokiaľ by nebol prítomný silný dôkaz (p < 0,001) proti homogenite účinkov, priemernú hodnotu RR bude možné považovať za najlepšiu mieru odhadov RR vo všetkých podskupinách. Nezaznamenali sme ale žiadny dôkaz heterogenity v žiadnej z vopred stanovených analýz podskupín: systolický tlak krvi (heterogenita p = 0,51), GCS pri podaní študovanej látky (p = 0,50), typ poranenia (p = 0,37) alebo čas od poranenia do podania (p = 0,11). V poslednej z týchto kategórii bol ale odhad nepresný, pretože počet pacientov zaradených do včasnej kategórie (< 1 hod) bol vzhľadom na zaokrúhľovanie číslic nízky. Preto sme dodatočne preklasifikovali včasnú kategóriu z < 1 hod na ≤ 1 hod (obr. 3).
Obr. 3. Mortalita zo všetkých príčin podľa podskupín GCS – Glasgow Coma Score, *95% CI. 
Nebolo potrebné žiadne predčasné odslepenie študovaných látok a nevyskytli sa žiadne také nežiaduce účinky, ktoré by sa dali považovať za vážne, neočakávané alebo s predpokladaným vzťahom k študovanej liečbe.
Diskusia
Výsledky ukázali, že včasné podanie kyseliny tranexámovej u traumatických pacientov s rizikom krvácania alebo s aktívnym krvácaním znižuje riziko úmrtia pre krvácanie bez viditeľného nárastu fatálnych alebo nefatálnych príhod cievnej oklúzie. Mortalita zo všetkých príčin bola signifikantne znížená v skupine s kyselinou tranexámovou.
Kritériá na zaradenie do štúdie boli len klinické a nezáviseli na výsledkoch laboratórnych testov. Pacienti boli zaradení do štúdie, ak mali podľa ošetrujúceho lekára pokračujúce signifikantné krvácanie s príznakmi tachykardie a hypotenzie, alebo ak sa predpokladalo, že majú vysoké riziko krvácania, napr. pacienti s kompenzovaným hemoragickým šokom a stabilnými vitálnymi funkciami, alebo tí, u ktorých sa krvácanie zastavilo, ale znova hrozilo po objemovej resuscitácii. Použitie klinických kritérií na zaradenie do štúdie je pri poúrazovom krvácaní vhodné, pretože na stanovenie alebo vylúčenie krvácania sa používa viacero klinických príznakov, pričom sa berú do úvahy aj protiopatrenia, ako je objemová resuscitácia. Klinické kritériá na zaradenie, veľký počet pacientov a rôzne systémy zdravotnej starostlivosti v zúčastnených nemocniciach umožňujú široké zovšeobecnenie týchto výsledkov.
Táto štúdia má silné i slabšie stránky. Použitá randomizačná technika zaistila, že lekári zapojení do štúdie vopred nevedeli o podávanej látke. Východzie prognostické faktory boli medzi skupinami dobre porovnateľné. Všetky analýzy boli vykonané systémom intention-to-treat, a keďže temer všetci randomizovaní pacienti mali k dispozícii výsledné údaje, nebolo potrebné použiť metódu na korekciu chýbajúcich údajov [11]. Primárnym výsledným ukazovateľom bola mortalita zo všetkých príčin, pričom jej zníženie v skupine s kyselinou tranexámovou bolo štatisticky i klinicky významné. Klinická diagnóza poúrazového krvácania môže byť náročná a je možné, že niektorí pacienti v čase randomizácie nekrvácali. Táto nesprávna diagnóza by znižovala silu štúdie na preukázanie účinku kyseliny tranexámovej na mortalitu z krvácania. My sme ale pozorovali signifikantné zníženie úmrtí na krvácanie.
Hoci sme v skupine s kyselinou tranexámovou nezaznamenali vyššie riziko nefatálnych cievnych okluzívnych príhod, presnosť odhadov bola nízka, a tak nie je možné vylúčiť možnosť určitého zvýšeného rizika. Pri hodnotení výsledkov klinických štúdií nemusia byť odhady relatívneho rizika skreslené ani pri nedokonalej senzitivite stanovenia diagnózy, pokiaľ sa nájde iba málo falošne pozitívnych výsledkov (vysoká špecificita) [12]. Preto sme sa snažili, aby diagnóza nefatálnych cievnych okluzívnych príhod mala vysokú špecificitu a stanovili, že okluzívne príhody budú zaznamenané iba vtedy, ak pre ne existujú jasné klinické dôkazy. Preto je možné, že frekvencia týchto príhod bola v skutočnosti vyššia. Ale naše odhady RR nefatálnych okluzívnych príhod by nemali byť skreslené [12].
Slabou stránkou tejto štúdie je to, že poskytuje iba málo informácií o mechanizme, ktorým kyselina tranexámová znižuje riziko úmrtia u pacientov s poúrazovým krvácaním. Včasné poruchy zrážanlivosti sú časté u pacientov s rozsiahlymi poraneniami, pričom sú spojené s vysokou mortalitou [13]. Novšie štúdie ukazujú, že hyperfibrinolýza je súčasťou týchto porúch, takže je možné, že antifibrinolytické látky, ako je kyselina tranexámová, by mohli pôsobiť týmto mechanizmom [13]. Navyše, intravenózne podanie kyseliny tranexámovej má včasný (do 4 hod) antifibrinolytický účinok [14]. Ale hoci tento mechanizmus je pravdepodobný, v našej štúdii sme nemerali fibrinolytickú aktivitu, takže nemôžeme vylúčiť aj iný mechanizmus účinku. Sú potrebné ďalšie štúdie, ktoré by objasnili mechanizmus účinku kyseliny tranexámovej u pacientov s poúrazovým krvácaním. Meranie krvných strát je u pacientov s traumou problematické. Najväčšie straty krvi sa pozorujú priamo na mieste nehody a krvácanie v nemocnici je často skryté, napr. krvácanie do hrudníka, brušnej dutiny, panvy alebo mäkkých tkanív. V štúdii sme nezistili žiadne výrazné zníženie potreby podania krvných preparátov, ani zníženie počtu podaných krvných transfúzií. Tento nález môže byť indikátorom problémov pri presnom odhade krvných strát u pacientov s úrazom za účelom indikácie podania transfúzie(í). Ďalšie možné vysvetlenie je, že po úvodnej dávke bola kyselina tranexámová podaná v udržiavacej dávke počas 8 hodín, pričom rozhodnutie o podaní transfúzie sa robí v krátkom čase po prijatí do nemocnice. Napokon, v skupine s kyselinou tranexámovou prežívalo viac pacientov ako v skupine s placebom a pacienti, ktorí prežili vďaka podaniu kyseliny tranexámovej, mali väčšiu šancu dostať transfúziu krvi (konkurujúce riziko).
Úvodná dávka kyseliny tranexámovej bola podaná do 8 hod od úrazu, po nej nasledovala udržiavacia infúzia počas 8 hodín. Rozhodli sme sa pre včasné a krátkodobé podanie kyseliny tranexámovej, pretože k väčšine úmrtí pre krvácanie dochádza v deň úrazu a my sme vychádzali z predpokladu, že mechanizmus účinku študovanej látky je zníženie krvácania. Vo všeobecnosti, po prvom dni sa riziko úmrtia pre krvácanie znižuje, ale riziko cievnych okluzívnych príhod môže ostať nezmenené. Preto sme vybrali taký režim, ktorý by umožnil kyseline tranexámovej znížiť včasné riziko krvácania bez pokračovania účinku v období, kedy by táto liečba mohla zvyšovať riziko cievnych okluzívnych príhod. Neprítomnosť zvýšenej incidencie cievnych okluzívnych príhod (či už fatálnych alebo nefatálnych) pri liečbe je dôkazom bezpečnosti podania kyseliny tranexámovej. Hoci vplyv tejto látky na mortalitu zo všetkých príčin nezávisel od času, ktorý uplynul medzi vznikom úrazu a jej podaním, je možné, že včasné podanie môže byť účinnejšie. Ale aj keby tomu tak nebolo, skutočnosť, že k úmrtiu dochádza najčastejšie v prvých hodinách od úrazu znamená, že treba vyvinúť maximálne úsilie, aby liečba bola podaná čo najskôr [15–17].
Zvolená dávka kyseliny tranexámovej vychádzala zo štúdií tejto látky u chirurgických pacientov, kde sa úvodná dávka pohybuje v rozsahu od 2,5 mg . kg-1 po 100 mg . kg-1 a udržiavacia dávka od 0,25 mg . kg-1 . hod-1 po 4 mg . kg-1 . hod-1, podaná počas 1–12 hodín [5]. Štúdie o účinku rôznych dávok kyseliny tranexámovej na krvné straty a krvné transfúzie nepreukázali signifikantné rozdiely medzi nižšími a vyššími dávkami. Štúdie v kardiochirurgii zistili, že pri úvodnej dávke kyseliny tranexámovej 10 mg . kg-1, s udržiavacou infúziou 1 mg . kg-1 . hod-1, sa dosiahli plazmatické koncentrácie, ktoré postačovali na inhibíciu fibrinolýzy, pričom vyššie dávky nemali žiadny ďalší hemostatický účinok [18, 19]. V urgentných situáciách je podanie fixných dávok praktické, pretože stanovenie hmotnosti pacienta s ťažkým úrazom môže byť problematické. Preto sme sa rozhodli pre fixnú dávku v rozsahu, ktorý zabezpečuje inhibíciu fibrinolýzy a zlepšuje hemostázu aj u pacientov s väčšou telesnou hmotnosťou (> 100 kg), ale je bezpečný aj u pacientov s menšou telesnou hmotnosťou (< 50 kg), pričom dávka na kg, ktorú dostali pacienti s menšou telesnou hmotnosťou, bola pri podávaní v štúdiách u chirurgických pacientov bez nežiaducich účinkov. Možnosť, že by vyššia dávka kyseliny tranexámovej mala väčší liečebný účinok ostáva otvorená na diskusiu a mala by byť predmetom ďalších štúdií.
Zistenie, že kyselina tranexámová znižuje riziko úmrtia u pacientov s poúrazovým krvácaním umožňuje usudzovať, že by mohla byť účinná aj v iných situáciách, kde krvácanie ohrozuje pacienta na živote, alebo môže byť spojené s invalidizáciou. Úrazové poškodenie mozgu je vo všeobecnosti sprevádzané intrakraniálnym krvácaním, ktoré môže vzniknúť, alebo progredovať po prijatí do nemocnice. Poúrazové intrakraniálne krvácanie je spojené so zvýšeným rizikom úmrtia a invalidizácie, pričom veľkosť ložiska, nezávisle od lokalizácie, silne koreluje s výsledkom [20–22]. Ak by kyselina tranexámová znížila rozsah intrakraniálneho krvácania po izolovanom úrazovom poškodení mozgu, mohlo by to viesť k zlepšeniu výsledku liečby. Sú potrebné ďalšie štúdie, ktoré by posúdili účinok kyseliny tranexámovej na rozsah intrakraniálneho krvácania.
Kyselina tranexámová by mohla byť užitočná aj pri krvácaní nesúvisiacom s úrazom. Krvácanie po pôrode je vedúcou príčinou materskej mortality, keď každý rok vedie k úmrtiu okolo 100 000 matiek [23]. Hoci niektoré výsledky naznačujú, že tento liek znižuje krvácanie po pôrode, kvalita existujúcich štúdií je nízka a žiadna z nich nebola dostatočne veľká na to, aby mohla zhodnotiť účinok kyseliny tranexámovej na výsledné ukazovatele, ktoré sú dôležité pre ženy [24]. V súčasnosti prebieha veľká štúdia zamerané na posúdenie účinku kyseliny tranexámovej na riziko úmrtia a hysterektómie u pacientiek s krvácaním po pôrode [25].
Záverom možno povedať, že kyselinu tranexámovú je možné podať v rôznych klinických situáciách, pričom v našej štúdii bezpečne znížila riziko úmrtia u pacientov s poúrazovým krvácaním. Všetci lekári, ktorí liečia pacientov s traumou kdekoľvek na svete, by mali mať možnosť podať kyselinu tranexámovú a táto látka by sa mala zaradiť do zoznamu nevyhnutných liekov Svetovej zdravotníckej organizácie. U pacientov s poúrazovým krvácaním treba zvážiť podanie kyseliny tranexámovej.
Koordiniátori štúdie CRASH-2
Komisia na napísanie článku – Haleema Shakur (predseda), Ian Roberts (UK), Raúl Bautista (Mexiko), José Caballero (Peru), Tim Coats (UK), Yashbir Dewan (India), Hesham El-Sayed (Egypt), Tamar Gogichaishvili (Georgia), Sanjay Gupta (India), Jorge Herrera (Kolumbia), Beverley Hunt (UK), Pius Iribhogbe (Nigéria), Mario Izurieta (Ekvádor), Hussein Khamis (Egypt), Edward Komolafe (Nigéria), María Acelia Marrero (Kuba), Jorge Mejía-Mantilla (Kolumbia), Jaime Miranda (Peru), Carlos Morales (Kolumbia), Oluwole Olaomi (Nigéria), Fatos Olldashi (Albánsko), Pablo Perel (UK), P V Ramana (India), R R Ravi (India), Surakrant Yutthakasemsunt (Thajsko). Národní koordinátori – Jonathan Dakubo (Ghana), Tamar Gogichaishvili (Gruzínsko), Nyoman Golden (Indonézia), Mario Izurieta (Ekvádor), Hussein Khamis (Egypt), Edward Komolafe (Nigéria), Jorge Loría - -Castellanos (Mexiko), Jorge Mejía-Mantilla (Kolumbia), Jaime Miranda (Peru), Ángeles Muñoz (Španielsko), Vincent Mutiso (Keňa), Patrick Okwen (Kamerun), Zulma Ortiz (Argentína), María Pascual, CENCEC (Kuba), R Ravi (India), April Roslani (Malajzia), Štefan Trenkler (Slovensko), Annalisa Volpi (Taliansko), Surakrant Yutthakasemsunt (Thajsko). Tím koordinačného centra štúdie – Ian Roberts (klinický koordinátor, hlavný výskumník), Haleema Shakur (manažér štúdie), Pablo Perel (regionálny koordinátor), Lin Barnetson (manažér údajov), Maria Ramos (administrátor štúdie), Lisa Cook (asistent manažéra štúdie, regionálny koordinátor od roku 2007), Taemi Kawahara (asistent manažéra štúdie, regionálny koordinátor od roku 2007), Eni Balogun (regionlny koordinátor od roku 2006), Matthew Berle (aistent štúdie od roku 2007), Collette Barrow (asistentka administrátora od roku 2008), Tony Brady (programátor do roku 2006), Chris Rubery (asistent pre spracovanie údajov od roku 2009), Jackie Wayte (UK koordinátor od roku 2008), Cynthia To (asistent pre spracovanie údajov 2007–2009). Riadiaci výbor – Ian Franklin (predseda), Brigitte Chaudhry, Tim Coats, Charles Deakin, Steve Goodacre, Beverley Hunt, David Meddings, Richard Peto, Ian Roberts, Peter Sandercock. Manažment štúdie – Ian Roberts (predseda), Haleema Shakur, Tim Coats, Phil Edwards, Beverley Hunt, Maria Ramos. Komisia pre etiku a monitorovanie štúdie – Rory Collins (predseda), Adrian Grant, John Myburgh, Alex Baxter (nezávislí štatistici).
Spolupracovníci štúdie CRASH-2 podľa krajín
Albánsko (115) – National Trauma Centre Hospital: Fatos Olldashi, Mihal Kerçi, Tefik Zhurda, Klotilda Ruçi; Spitali Civil Durres: Arben Banushi. Argentína (51) – Hospital Ángel Cruz Padilla: Mario Sardón Traverso, Juan Jiménez; Hospital Regional Rio Grande: Jorge Balbi; Hospital “4 de Junio” Dr Ramon Carrillo: Christian Dellera; Hospital Castro Rendón: Silvana Svampa; Hospital San Martín de La Plata: Gustavo Quintana; Hospital Municipal de Agudos “Dr Leonídas Lucero”: Gustavo Piñero; Hospital Interzonal General de Agudos “Dr Oscar Alende”: Jorge Teves. Austrália (17) – Nepean Hospital: Ian Seppelt; Sir Charles Gairdner Hospital: David Mountain; John Hunter Hospital: Zsolt Balogh. Bangladéš (12) – United Hospital Limited: Maniruz Zaman. Belgicko (51) – Sint-Vincentius Hospital: Patrick Druwé, Robert Rutsaert; Centre Hospitalier Regional de Namur: Guy Mazairac. Kamerun (124) – Tombel District Hospital: Fogang Pascal, Zognou Yvette, Djeuchon Chancellin; St Theresa’s Catholic Medical Centre: Patrick Okwen; Bamenda Provincial Hospital: Jules Djokam-Liapoe; Bali District Hospital: Ernest Jangwa; Bafut District Hospital: Lawrence Mbuagbaw; Fundong District Hospital: Ninying Fointama; St John of God Medical Centre: Nguemo Pascal. Kanada (2) – Hamilton General Hospital: Frank Baillie. Čína (51) – Renji Hospital: Ji-yao Jiang, Guo-yi Gao, Yin-hui Bao. Kolumbia (2940) – Hospital Universitário San Vicente de Paúl, Universidad de Antioquia: Carlos Morales, Juan Sierra, Santiago Naranjo, Camilo Correa, Carolina Gómez; Hospital Universitário San Jose de Popayan: Jorge Herrera, Liliana Caicedo, Alexei Rojas, Henry Pastas, Hugo Miranda; Hospital Pablo Tobon Uribe: Alfredo Constaín, Mayla Perdomo, Diego Muñoz, Álvaro Duarte, Edwin Vásquez; Hospital San Andrés de Tumaco: Camilo Ortiz, Bernardo Ayala, Hernán Delgado, Gloria Benavides, Lorena Rosero; Fundación Clínica Valle del Lili: Jorge Mejía-Mantilla, Ana Varela, Maríaisabel Calle, José Castillo, Alberto García; Clínica las Americas: Juan Ciro, Clara Villa, Roberto Panesso; Hospital General de Medellin: Luz Flórez, Argemiro Gallego; Hospital San Felix ESE: Fabián Puentes-Manosalva, Leonor Medina, Kelly Márquez; Hospital Universitário del Caribe: Adalgiza Reyes Romero, Ricardo Hernández, Julio Martínez; Hospital Universitário San Jorge: Wilson Gualteros; Hospital San Rafael Tunja: Zulma Urbina, Julio Velandia; Clínica La Estancia SA: Federico Benítez, Adolfo Trochez; Fundación Hospital San José de Buga: Andrés Villarreal, Pamela Pabón; Hospital Civil de Ipiales: Hernán Delgado; Hospital Universitário Departamental Nariño: Héctor López; Hospital Universitário del Valle: Laureano Quintero; Hospital Universitário de Neiva: Andrés Rubiano; Hospital Manuel Uribe Ángel: Juan Tamayo. Kuba (575) – Hospital Clínico-Quirúrgico Docente “Saturnino Lora”: Marjoris Piñera; Hospital General Universitário “Carlos Manuel de Céspedes”: Daimi Martínez, Heriberto Martínez; Hospital Provincial Docente “Manuel Ascunce Domenech”: Eugenio Casola; Hospital Universitário “Arnaldo Milián Castro”: Mario Domínguez, Carlos Herrera; Hospital Universitário “Dr Gustavo Aldereguía Lima”: Marcos Iraola, Omar Rojas; Hospital Abel Santamaría Cuadrado: Irene Pastrana, Daniel Rodríguez, Sergio Álvarez de la Campa; Hospital Miguel Enríquez: Thorvald Fortún; Hospital General Calixto García: Martha Larrea; Hospital Antonio Luaces Iraola: Lensky Aragón; Hospital Provincial Docente VI Lenin: Aida Madrazo. Česká republika (17) – Traumatologická nemocnice Brno: Petr Svoboda. Ekvádor (1198) – Hospital Luis Vernaza: Mario Izurieta, Alberto Daccach, Mónica Altamirano, Antonio Ortega, Bolívar Cárdenas, Luis González; Hospital José Carrasco Arteaga: Marcelo Ochoa, Fernando Ortega, Fausto Quichimbo, Jenny Guiñanzaca; Hospital de Niños Dr Roberto Gilbert Elizalde: Ines Zavala, Sayra Segura; Hospital Naval Guayaquil: Johnny Jerez; Hospital Alcivar: Daniel Acosta; Hospital “Dr Rafael Rodríguez Zambrano”: Fabián Yánez; Clínica De Especialidades Medicas “San Gregorio”: Rubén Camacho. Egypt (2234) – Mataria Teaching Hospital: Hussein Khamis, Hossam Shafei, Ali Kheidr, Hani Nasr, Moetaz Mosaad, Safwat Rizk; Suez Canal University: Hesham El Sayed, Taha Moati, Emad Hokkam; Aswan Teaching Hospital: Mamdouh Amin, Hany Lowis, Medhat Fawzy, Nabil Bedir, Mohamed Aldars. Salvador (84) – Hospital Nacional Rosales: Virginia Rodríguez, Juan Tobar, Jorge Alvarenga. Gruzínsko (1783) – Tbilisi State University Clinical Hospital ‘I Javakhishvili’: Budu Shalamberidze, Elza Demuria, Nikoloz Rtveliashvili, Gocha Chutkerashvili, David Dotiashvili; Tbilisi First Hospital, University Clinic, Neurosurgery Center: Tamar Gogichaishvili, George Ingorokva, David Kazaishvili, Besik Melikidze, Natia Iashvili; Tbilisi City Hospital: Gia Tomadze, Manana Chkhikvadze, Leri Khurtsidze, Zviad Lomidze, Diana Dzagania; Tbilisi State Medical University ER Department: Nikoloz Kvachadze, Giorgi Gotsadze, Vakhtang Kaloiani; Institute of Critical Care Medicine: Nino Kajaia. Ghana (136) – Korle Bu Teaching Hospital: Jonathan Dakubo, Simon Naaeder, Priscilla Sowah; Nyinahin Government Hospital: Adamu Yusuf, Alhaji Ishak; Sogakope District Hospital: Paul Selasi-Sefenu; Methodist Hospital Wenchi: Ballu Sibiri; Effia Nkwanta Regional Hospital: Sampson Sarpong--Peprah; Saint Theresa’s Hospital: Theodore Boro. India (4768) – Medical Trust Hospital Kochi: Kanjithanda Bopaiah, Kishore Shetty, Raja Subbiah, Lukman Mulla, Anand Doshi; Christian Medical College Ludhiana: Yashbir Dewan, Sarvpreet Grewal, Pradipta Tripathy, Jacob Mathew, Bharat Gupta; Aditya Neuroscience Centre: Anil Lal, Majulie Choudhury; Sri Sai Hospital: Sanjay Gupta, Smita Gupta, Arun Chug; Care Hospital: Venkataramana Pamidimukkala, Palaniappan Jagannath, Mohan Maharaj, Ramaraju Vommi, Naresh Gudipati; North Bengal Neuro Research Centre: W H Chhang; Sheth VS General Hospital and NHL Municipal College: Pankaj Patel, Nilay Suthar, Deepa Banker, Jyotish Patel; LTM Medical College and General Hospital: Satish Dharap, Ranjeet Kamble, Shraddha Patkar, Sushil Lohiya; Government Medical College and Associated Hospitals Jammu: Rakesh Saraf, Dinesh Kumar, Satish Parihar, Rahul Gupta; MKCG Medical College: Rasananda Mangual, Alagumuthu, Don Kooper, Chinmaya Mohapatra; Christian Medical College Hospital Vellore: Suresh David, Wesley Rajaleelan, Appas; KLE Hospital and Medical Research Centre: Ashok Pangi, Vivek Saraf, Santhosh Chikareddy; NKP Salve Institute of Medical Sciences and Lata Mangeshkar Hospital: Sushil Mankar, Anil Golhar, Rahul Sakhare, Nilesh Wagh; Sanjivani Diagnostics and Hospital: Anil Lal, Dhiman Hazarika; Parkar Hospital: Pratyush Chaudhuri; Jeevan Jyoti Hospital and Research Centre: Prakash Ketan; Mansarovar Hospital: Govindbhai Purohit, Yogesh Purohit, Mandakini Pandya; Postgraduate Institute of Medical Science Rohtak: Rakesh Gupta, Shashi Kiran, Saurab Walia; Goyal Hospital Jalna: Sonam Goyal, Sidhant Goyal, Satish Goyal; Government Medical College Chandigarh: Sanjay Gupta, Ashok Attri, Rajeev Sharma; Oberai Hospital: Ashok Oberai, Mahesh Oberai, Supriya Oberoi; Rajeev Gandhi Memorial Hospital and Research Centre: Gajendra Kant Tripathi; Calicut Medical College Hospital: Vijayan Peettakkandy, Premkumar Karuthillath, Pavithran Vadakammuriyil; Krishnamai Medical and Research Foundation’s NIKOP Hospital: Jalindar Pol, Sunita Pol, Manisha Saste; St Stephen’s Hospital: Subrat Raul, Shashi Tiwari, Neileino Nelly; Government Rajaji Hospital: M Chidambaram; Medical College Trivandrum: Viswanathan Kollengode, Sam Thampan; Sanjeevani Hospital: Sunder Rajan, Sushrut Rajan; Kamineni Hospital: Subodh Raju, Renuka Sharma; Sri Sakthi Hospital: Subbiah Venkatesh Babu, Chellappa Sumathi; Bhattacharya Orthopaedic and Related Research Centre: Protyush Chatterjee, Alok Agarwal; Sushrut Hospital: Hemant Magar, Meera Magar; All India Institute of Medical Sciences: Manmohan Singh, Deepak Gupta; GM Hospital (P): LTD: Anil Lal, Kamal Haloi; Government Medical College and Superspeciality Hospital Nagpur: Varsha Sagdeo, Pramod Giri; Government Medical College New Civil Hospital: Nimesh Verma, Ravi Jariwala, Ashish Goti; Chikitsa Hospital: Aman Prabhu-Gaonkar, Sagar Utagi; Apollo Health City: Mahesh Joshi, Ruchit Agrawal; Apex Neurotrauma and Superspeciality Hospital: Gopal Sharma, Gurvinder Saini; Neuro Center Gola Ghat: Vinod Tewari; NSCB Medical College: Yad Yadav, Vijay Parihar; BGS Global Hospital: Neelam Venkataramana, Shailesh Rao; Chettinad Hospital and Research Institute: Narayana Reddy; Sir Sayajirao General Hospital and Medical College Baroda: Virsing Hathila; Goyal Hospital and Research Centre Jodhpur: Vithal Das; Krishna Surgical Hospital and Trauma Care Centre: Kantibhai Agaja; Nizam’s Institute of Medical Sciences: Aniruddh Purohit; Niramay Hospital: Akilesh Lahari; Apex Hospital Bhopal: Rajesh Bhagchandani; Dr Jeyasekharan Medical Trust: Bala Vidyasagar; Himalayan Institute of Medical Sciences: P K Sachan; Apollo Gleneagles Hospitals: Tanmoy Das; Civil Hospital Gandhinagar: Sharad Vyas; Sukhdev Raj Soin Hospital: Sujoy Bhattacharjee; Sancheti Institute for Orthopaedics and Rehabilitation: Parag Sancheti; St James Hospital: T Manoj; Al Shifa Hospital: Mubarak Moideen; Anant Institute of Medical Sciences: Kailash Pansey; Vinayaka Mission Hospital: V P Chandrasekaran; Gauhati Medical College and Hospital: Kabul Saikia; Krishna Hospital and Medical Research Centre: Hoshedar Tata; Ruby Hall Clinic: Sanjay Vhora; Shreejee Hospital: Aniket Shah; Nazareth Hospital: Gordon Rangad; Ganga Hospital: S Rajasekaran; Vadamalayan Hospitals: S T Shankarlal; Devadoss Multispeciality Hospital: Sathish Devadoss; KIOT Hospital: M Saleem; Baby Memorial Hospital: Haroon Pillay; Bethany Hospital: Zulfiquer Hazarika; Suretech Hospital and Research Centre: Parikshit Deshmukh; Surya Hospital: S P Murugappan; Apollo Clinic Varanasi: Amit Jaiswal; Fortis Escorts Hospital: Deepak Vangani; Gokul Hospital and Trauma Centre: Prakash Modha; International Hospital Assam: Chawngrolien Chonzik; Lifeline Multispeciality Hospital: Megha Praveen; Meenakshi Mission Hospital and Research Centre: Vijaya Sethurayar; MOSC Medical College Hospital: Sojan Ipe; MS Ramaiah Memorial Hospital: Naresh Shetty; Saykhedkar Hospital and Research Centre: Aniket Shah; Shanti Mukand Hospital: R P Gupta; Shri KM Memorial Jain Heart and General Hospital: Vinod Jain; Usha Hospital: Ketan Shah. Indonézia (706) – Soebandi Hospital Jember: Moch Dwikoryanto; Sanglah General Hospital: Nyoman Golden, Kuning Atmadjaya, Ketut Wiargitha, Ketut Sudiasa, Gede Suwedagatha; Saiful Anwar General Hospital: Farhad Bal’afif; Dr Soetomo General Hospital: Vicky Budipramana, Tabrani, Agung Lemuel; Cipto Mangunkusumo Hospital: Susilo Chandra; Muhammadiyah Lamongan Hospital: Faisol Ama. Irán (134) – Nemazi Hospital: Ehsan Sherafatkazemzadeh, Ehsan Moradi, Alireza Sheikhi; Erfan Hospital: Ali Ziaee, Ahmad Fanaei; Loqman Medical Center: Esmaeil Hajinasrollah; Imam Hosain Hospital: Kamran Heidari. Irak (392) – Diwaniyah College of Medicine: Bassim Mohammad, Najah Hadi. Taliansko (57) – Spedali Civili di Brescia: Giovanna Perone, Elena de Peri; Azienda Ospedaliera Di Parma: Annalisa Volpi. Jamaika (11) – University Hospital of the West Indies: Jean Johnson. Japonsko (9) – Fukuoka University Hospital: Masayoshi Abe. Keňa (31) – Kenyatta National Hospital: Vincent Mutiso, Benjamin Okanga; Kapenguria District Hospital: Daniel Ojuka. Malajzia (216) – Hospital University Science Malaysia: Baharudin Abdullah, Hishamuddin Rahman, Yazid Noh; Sungai Buloh Hospital: Sabariah Jamaluddin, Hasnah Dawal; University of Malaya Medical Centre: April Roslani, Chee-Wei Law, P Devashanti; Hospital Tengku Ampuan Rahimah: Yusof Wahab, Shanta Velaiutham; Ampang Hospital: Ridzuan Dato. Mexiko (479) – Hospital General Regional 25: Jorge Loría, Erandy Montes, Eduardo Gómez, Víctor Cazales, Paúl Bautista; Hospital Gustavo Rovirosa: Raúl Bautista, David Ahumada, Edwin Hernández, Germahin Velásquez; Hospital General de Uruapan “Dr Pedro Daniel Martínez”: Patricia Ortega, Gabriel Lira, Francisco Estrada; Hospital General Ecatepec Las Américas: Jorge Martínez; Hospital General La Perla: Juan Martínez; Hospital General de Ecatepec “Dr José María Rodríguez”: Julio Casasola. Nigéria (2053) – National Hospital Abuja: Oluwole Olaomi, Yari Abubakar, Kanati Apollo, Olawale Badejo, Ogemdi Ihekire; University of Benin Teaching Hospital: Pius Iribhogbe, Olugbenga Oludiran, Emmanuel Obeta, Collins Okojie, Ernest Udefiagbon; Obafemi Awolowo University Teaching Hospitals: Edward Komolafe, Patrick Olaleye, Tochukwu Uzochukwu, Uvie Onakpoya; Irrua Specialist Teaching Hospital: Andrew Dongo; Olabisi Onabanjo University Teaching Hospital: Lateef Thanni; University College Hospital Ibadan: Adefemi Afolabi, Titilade Akinola, Adeyinka Ademola, Olusola Akute; Ahmadu Bello University Teaching Hospital: Lawal Khalid, Lawal Abubakar, Muhammad Aminu, Mike Ogirima; Baptist Medical Centre: Ambrose Attansey, Durodola Michael, Olaniran Aremu; University of Ilorin Teaching Hospital: Odebode Olugbenga, Udoffa Ukpong, Yusuf Salman; Enugu State University Teaching Hospital: Nene Obianyo, Chinenye Ani, Roderick Ezeadawi; LAUTECH Teaching Hospital: Oluwadiya Kehinde, Agodirin Olaide; Federal Medical Centre Makurdi: Andrea Jogo, Terna Bitto; Nnamdi Azikiwe University Teaching Hospital: Stanley Anyanwu, Okechukwu Mbonu; Lagos State University Teaching Hospital: Mobolaji Oludara, Michael Somoye; Usmanu Danfodiyo University Teaching Hospital: Bello Shehu, Nasir Ismail; National Orthopaedic Hospital Enugu: Amechi Katchy; University of Calabar Teaching Hospital: Rowland Ndoma-Egba, Ngim Grace-Inah; University of Abuja Teaching Hospital: Zumnan Songden, Abdulrahman Abdulraheem; University of Uyo Teaching Hospital: Akpan Otu, Timothy Nottidge; Federal Medical Centre, Yenagoa: Domingo Inyang, David Idiapho; Seventh Day Adventist Hospital: Herb Giebel; Federal Medical Centre Birnin-Kebbi: Ramatu Hassan; Abia State University Teaching Hospital: Adeyinka Adisa; Wesley Guild Hospital: Akinbolaji Akinkuolie; Federal Medical Centre, Umuahia: Kalu Okam; University of Maiduguri Teaching Hospital: Abubakar Musa; National Orthopaedic Hospital, Igbobi: Ignatius Falope; University of Nigeria Teaching Hospital Enugu: John Eze. Peru (452) – Hospital Regional Docente de Trujillo: José Caballero, Wenceslao Azabache, Oscar Salirrosas; Hospital Nacional Hipolito Unanue: Alonso Soto, Elfi Torres, Gloria Ramírez, Mónica Pérez; Clinica Santa Ana: Cesar Malca; Hospital La Caleta: Juan Velez; Hospital Nacional Sergio E Bernales: Raul Yepez; Hospital de Apoyo de Sullana: Hernan Yupanqui; Hospital IV Essalud Huancayo: Pedro Lagos; Hospital Nacional Arzobispo Loayza: Diana Rodriguez; Hospital Municipal Los Olivos: Jorge Flores; Hospital Jose Cayetano Heredia: Anselmo Moya; Hospital Nacional Carlos Alberto Seguin Escobedo: Alejandro Barrionuevo; Hospital Nacional Dos De Mayo: Marco Gonzales-Portillo; Hospital Nacional Cayetano Heredia: Edgar Nunez. Saudská Arábia (70) – King Khalid University Hospital: Abdelazeem Eldawlatly, Mohammed Al Naami, Bilal Delvi; King Khalid National Guard Hospital: Walid Alyafi. Srbsko (1) – Klinicki Centar Srbije: Branko Djurovic. Singapur (2) – National Neuroscience Institute: Ivan Ng. Slovensko (38) – FNsP Ružinov: Aktham Yaghi; NsP Poprad: Anton Laincz; NsP JA Reimana: Stefan Trenkler; FNsP F D Roosevelta: Jozef Valky. Južná Africa (76) – Dr George Mukhari Hospital: Mphako Modiba, Peter Legodi, Thomas Rangaka; George Provincial Hospital: Lee Wallis. Španielsko (23) – Hospital Universitário Virgen del Roció: Ángeles Muñoz; Hospital Ramón y Cajal de Madrid: Ana Serrano; Hospital Universitário Germans Trias i Pujol: Maite Misis; Hospital Torrecardenas: Martin Rubi; Hospital Universitário Virgen de la Victoria: Victoria de la Torre. Sri Lanka (103) – National Hospital of Sri Lanka: Ranjith Ellawala, Samitha Wijeratna, Lukshrini Gunaratna, Crishantha Wijayanayaka. Tanzánia (64) – Muhimbili Orthopaedic Institute: Kitugi Nungu, Billy Haonga, Grenda Mtapa. Thajsko (903) – Khon Kaen Regional Hospital: Surakrant Yutthakasemsunt, Warawut Kittiwattanagul, Parnumas Piyavechvirat, Tawatcahi Impool, Santipong Thummaraj; Pattani Hospital: Rusta Salaeh; Suratthani Hospital: Sakchai Tangchitvittaya; Bhumibol Adulyadej Hospital: Kamol Wattanakrai, Teerasak Jiravongbunrod, Chatchai Soonthornthum; Lampang Hospital: Surasak Meephant; Rayong Hospital: Pusit Subsompon; Roi-Et Hospital: Phaiboon Pensuwan; Phrae Hospital: Wicheanrat Chamnongwit. Tunisko (36) – Hospital Habib Thameur: Zouheir Jerbi, Abderraouef Cherif. UK (135) – University Hospital of North Staffordshire: Mark Nash; Royal London Hospital: Tim Harris; Leicester Royal Infirmary: Jay Banerjee; Nottingham University Hospitals NHS Trust: Ramzi Freij; Frenchay Hospital: Jason Kendall; Countess of Chester Hospital: Stephen Moore; Hull Royal Infirmary: William Townend; Royal Sussex County Hospital: Rowland Cottingham; Derby Hospitals NHS Trust: Dan Becker; Bedford Hospital NHS Trust: Stuart Lloyd; Royal Liverpool University Hospital: Peter Burdett-Smith; Colchester General Hospital: Kazim Mirza; Royal Lancaster Infirmary: Andrew Webster; Worthing Hospital: Suzanne Brady, Amanda Grocutt; Darent Valley Hospital: John Thurston; Hope Hospital: Fiona Lecky; Northern General Hospital: Steve Goodacre. Zambia (62) – University Teaching Hospital, Lusaka: Yakub Mulla, Dennis Sakala; Nchanga North General Hospital: Charles Chengo.
Sponzorované: UK NIHR Technology Assessment programme, Pfizer, BUPA Foundation a J P Moulton Charitable Foundation.
Poďakovania: Telefonický randomizačný systém, odslepovanie a hlásenie nežiaducich účinkov zabezpečovali CTSU, University of Oxford, Oxford, UK. Randomizačné kódy pripravil Alan Young z CTSU. The London School of Hygiene and Tropical Medicine podporovala koordinačný personál počas prvého roka štúdie. Finančné prostriedky na rozbehnutie štúdie pochádzali z J P Moulton Charitable Foundation a BUPA Foundation. Finančné prostriedky na zakúpenie kyseliny tranexámovej a placeba poskytla firma Pfizer. Hlavná fáza štúdie bola hradená z programu UK NIHR Health Technology Assessment a bude publikovaná v časopise Health Technology Assessment. V publikácii vyjadrené názory reprezentujú názory autorov a nemusia zodpovedať názorom ministerstva zdravotníctva.
Došlo dne 23. 12. 2010.
Přijato do tisku dne 3. 2. 2011.Adresa pro korespondenci:
MUDr. Štefan Trenkler, PhD.
Sabinovská 9
080 81 Prešov
Slovensko
e-mail: strenkler@gmail.com
Zdroje
1. Peden, M., McGee, K., Sharma, G. The injury chart book: a graphical overview of the global burden of njuries. Geneva: World Health Organization, 2002.
2. Gosselin, R. A., Spiegel, D. A., Coughlin, R., Zirkled, L. G. Injuries: the neglected burden in developing countries. Bull World Health Organ., 2009, 87, p. 246.
3. Sauaia, A., Moore, F. A., Moore, E. E. et al. Epidemiology of trauma deaths: a reassessment. J. Trauma, 1995, 38, p. 185–93.
4. Lawson, J. H., Murphy, M. P. Challenges for providing effective hemostasis in surgery and trauma. Sem. Hematol., 2004, 41, p. 55–64.
5. Henry, D. A., Carless, P. A., Moxey, A. J. et al. Anti-fibrinolytic use for minimising perioperative allogeneic blood ransfusion. Cochrane Database Syst. Rev., 2007, 4, p. CD001886.
6. Okamoto, S., Hijikata-Okunomiya, A., Wanaka, K., Okada, Y., Okamoto, U. Enzyme controlling medicines: introduction. Semin. Thromb. Hemost., 1997, 23, p. 493–501.
7. Coats, T., Roberts, I., Shakur, H. Antifibrinolytic drugs for acute traumatic injury. Cochrane Database Syst. Rev., 2004, 4, p. CD004896.
8. Baigent, C., Peto, R., Gray, R., Parish, S., Collins, R. Large-scale randomized evidence: trials and meta-analyses of trials. In Warrell, D. A., Cox, T. M., Firth, J. D., eds. Oxford Textbook of Medicine (5th edn). Oxford: Oxford University Press, 2010, p. 31–45.
9. Perel, P., Edwards, P., Shakur, H., Roberts, I. Use of the Oxford Handicap Scale at hospital discharge to predict Glasgow Outcome Scale at 6 months in patients with traumatic brain injury. BMC Med. Res. Methodol., 2008, 8, p. 72.
10. Duley, L., Antman, K., Arena, J. et al. Specific barriers to the conduct of randomized trials. Clin. Trials, 2008, 5, p. 40–48.
11. Sterne, J., White, I., Carlin, J. et al. Multiple imputation for missing data in epidemiological and clinical research: potential and pitfalls. BMJ, 2009, 338, p. b2393.
12. Rogers, A., MacMahon, S. Systematic underestimation of treatment effects as a result of diagnostic test naccuracy: implications for the interpretation and design of thromboprophylaxis trials. Thromb. Haemost., 1995, 73, p. 167–171.
13. Brohi, K., Cohen, M. J., Ganter, M. T. et al. Acute coagulopathy of trauma: hypo-perfusion induces systemic anticoagulation and hyper-fibrinolysis. J. Trauma, 2008, 64, p. 1211–1217.
14. Ekbäck, G., Axelsson, K., Ryttberg, L. et al. Tranexamic acid reduces blood loss in total hip replacement surgery. Anesth. Analg., 2000, 91, p. 1124–1130.
15. Kauvar, D. S., Lefering, R., Wade, C. E. Impact of hemorrhage on trauma outcome: an overview of epidemiology, clinical presentations, and therapeutic considerations. J. Trauma, 2006, 60, p. S3–11.
16. Mock, C. N., Jurkovich, G. J., Nii-Amon-Kotei, D., Arreola--Risa, C., Maier, R. V. Trauma mortality patterns in three nations at different economic levels: implications for global trauma system development. J. Trauma, 1998, 44, p. 804–812.
17. Wyatt, J., Beard, D., Gray, A., Busuttil, A., Robertson, C. The time of death after trauma. BMJ, 1995, 310, p. 1502.
18. Fiechtner, B. K., Nuttall, G. A., Johnson, M. E. et al. Plasma tranexamic acid concentrations during cardiopulmonary bypass. Anesth. Analg., 2001, 92, p. 1131–1136.
19. Horrow, J. C., Van Riper, D. F., Strong, M. D., Grunewald, K. E., Parmet, J. L. The dose-response relationship of tranexamic acid. Anesthesiology, 1995, 82, p. 383–392.
20. MRC CRASH Trial Collaborators Predicting outcome after traumatic brain injury: practical prognostic models based on large cohort of international patients. BMJ, 2008, 12, p. 12.
21. Maas, A. I., Steyerberg, E. W., Butcher, I. et al. Prognostic value of computerized tomography scan characteristics in traumatic brain injury: results from the IMPACT study. J. Neurotrauma, 2007, 24, p. 303–314.
22. Perel, P., Roberts, I., Bouamra, O., Woodford, M., Mooney, J., Lecky, F. Intracranial bleeding in patients with traumatic brain injury: a prognostic study. BMC Emerg. Med., 2009, 9, p. 15.
23. Hogan, M. C., Foreman, K. J., Naghavi, M. et al. Maternal mortality for 181 countries, 1980–2008: a systematic analysis of progress towards Millennium Development Goal 5. Lancet, 2010, 375, p. 1609–1623.
24. Ferrer, P., Roberts, I., Sydenham, E., Blackhall, K., Shakur, H. Anti-fibrinolytic agents in postpartum haemorrhage: a systematic review. BMC Pregnancy Childbirth, 2009, 9, p. 29.
25. Shakur, H., Elbourne, D., Gülmezoglu, M. et al. The WOMAN Trial (World Maternal Antifibrinolytic Trial): tranexamic acid for the treatment of postpartum haemorrhage: an international randomised, double blind placebo controlled trial. Trials, 2010, 11, p. 40.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2011 Číslo 2- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Vplyv kyseliny tranexámovej na mortalitu, cievne okluzívne príhody a transfúzie krvi u pacientov s veľkým poúrazovým krvácaním (CRASH-2) – randomizovaná, placebom kontrolovaná štúdia*
- Přehled nejvýznamnějších změn v Doporučených postupech pro neodkladnou resuscitaci
- Aký bude dopad súdnych žalôb na prácu lekárov?
-
Zápis ze schůze výboru ČSIM
Ostrava 25. 1. 2011 - Nový výbor ČSARIM pro období 2011–2014
- Programové prohlášení nového výboru ČSARIM
- Nová Guidelines 2010 pro kardiopulmonální resuscitaci (KPR)
- Svalová relaxace během celkové anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie
- Stanovisko Ústředí VZP ČR pro hodnocení umělé plicní ventilace
- Srovnání nákladů na doplňovanou anestezii vedenou s oxidem dusným a bez něj ve Fakultní nemocnici Olomouc
- Perioperační optimalizace hemodynamiky*
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Přehled nejvýznamnějších změn v Doporučených postupech pro neodkladnou resuscitaci
- Perioperační optimalizace hemodynamiky*
- Svalová relaxace během celkové anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie
- Aký bude dopad súdnych žalôb na prácu lekárov?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




