-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
Significance of urokinase and its inhibitors in the invasiveness and metastasing of malignant tumors
Fibrinolysis is process, which leads to the degradation of fibrin to fibrin monomers. Fibrinolysis helps to regulate hemostasis and prevents the creation of inappropriately large thrombus, which could reduce blood flow to the bloodstream. The main enzyme involved in fibrinolysis is plasmin. Tissue plasminogen activator (tPA) and urokinase (uPA) are agents converting plasminogen into active plasmin, together with urokinase receptor (uPAR) and urokinase inhibitors (PAI 1, PAI 2, PAI 3 and protease nexin) form plasminogen activator system (PAS) which is among others also part of the metastatic cascade and significantly contributes to invasive growth and angiogenesis of malignant tumours. In contrast to tPA that is fundamental in fibrinolysis, uPA plays an essential role in tissue degradation as part of physiological and pathological processes. uPAR is a GPI (glycosylphosphatidylinositol)-anchored protein. The binding of uPA to uPAR results in activation of protein tyrosine kinase, protein kinase C and MAP kinase. At the same time, direct signalling pathway via Jak/STAT cascade utilising signalling transduction of Scr-like protein tyrosine kinase have also been described. uPAR expression is regulated by many growth factors, e.g. EGF, FGF-2 and HGF. It seems that individual PAS factors are involved in the process of rendering malignant tumors invasive. To what degree this influence is essential to specific malignancies, should be answered by further research. In the article the authors present a summary of findings about the interaction of fibrinolysis and tumor process, especially on the effects of urokinase and other activators and their inhibitors in metastasis of malignant tumors. The text contains information on the factors theirs introduction into practice is still the subject of numerous discussions, but in the future, individual PAS factors could play an important role in planning treatment strategies and also could become targets of targeted therapy.
Key words:
plasminogen activator system – uPA – uPAR – PAI 1 – PAI 2
Autoři: J. Halámková 1; I. Kiss 1
; J. Tomášek 1
; Z. Pavlovský 2; Š. Tuček 1; M. Penka 3
Působiště autorů: Klinika komplexní onkologické péče Lékařské fakulty MU a MOÚ Brno, přednosta prof. MUDr. Rostislav Vyzula, CSc. 1; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc. 2; Oddělení klinické hematologie FN Brno, přednosta prof. MUDr. Miroslav Penka, CSc. 3
Vyšlo v časopise: Vnitř Lék 2012; 58(2): 129-134
Kategorie: Přehledné referáty
Souhrn
Fibrinolýza pomáhá regulovat hemostázu, a zabraňuje tak vytvoření neadekvátně velkého trombu, který by mohl omezit průtok krve cévním řečištěm. Hlavním enzymem podílejícím se na fibrinolýze je plazmin. Tkáňový aktivátor plazminogenu (tPA) a urokináza (uPA) jsou agens konvertující plazminogen na aktivní plazmin, tvoří společně s receptorem pro urokinázu (uPAR) a inhibitory urokinázy (PAI 1, PAI 2, PAI 3 a protease nexin) plazminogen aktivátor systém (PAS), který je mimo jiné součástí metastatické kaskády a významnou měrou se podílí na invazivním růstu a angiogenezi maligních nádorů. Pro samotnou fibrinolýzu má zásadní význam tPA, uPA se pak podílí na degradaci tkání jak při fyziologických, tak i patologických pochodech. Receptor pro uPA – uPAR je navázán na buněčnou membránu prostřednictvím glykosylfosfatidylinositolu. Navázáním uPA na uPAR dochází k aktivaci proteintyrosinkináz, proteinkinázy C a MAP-kinázy. Současně byla popsána i přímá signální cesta Jak/STAT kaskádou s využitím signální transdukce Scr-like proteintyrosinkinázy. Exprese uPAR je regulována řadou růstových faktorů, např. EGF, bFGF a HGF. Zdá se, že jednotlivé faktory PAS se podílí na procesu malignizace nádorových onemocnění. Na otázku, do jaké míry je jejich vliv zásadní u konkrétních malignit, by měl odpovědět další výzkum. V článku autoři předkládají souhrn poznatků o interakci fibrinolýzy a nádorového procesu, speciálně o vlivu urokinázy a dalších aktivátorů a jejich inhibitorů na metastazování maligních tumorů. Text obsahuje informace o faktorech, jejichž zavedení do praxe je zatím předmětem četných diskuzí, nicméně do budoucna by jednotlivé faktory PAS mohly hrát významnou úlohu při plánování strategie léčby a zároveň by se mohly stát i terčem cílené terapie.
Klíčová slova:
plazminogen aktivátor systém – uPA – uPAR – PAI 1 – PAI 2
Fibrinolýza pomáhá regulovat hemostázu, a zabraňuje tak vytvoření neadekvátně velkého trombu, který by mohl omezit průtok krve cévním řečištěm, dochází při ní k degradaci fibrinu na fibrinové monomery. Hlavním enzymem podílejícím se na fibrinolýze je plazmin, který je produkován v inaktivní formě jako plazminogen v játrech, jeho poločas rozpadu je kolem 2 dnů, ale v závislosti na aktivaci fibrinolytického systému může být i výrazně kratší. Tkáňový aktivátor plazminogenu (tPA) a urokináza (uPA) jsou agens konvertující plazminogen na aktivní plazmin (obr. 1).
Obr. 1. Zjednodušené schéma fibrinolýzy. 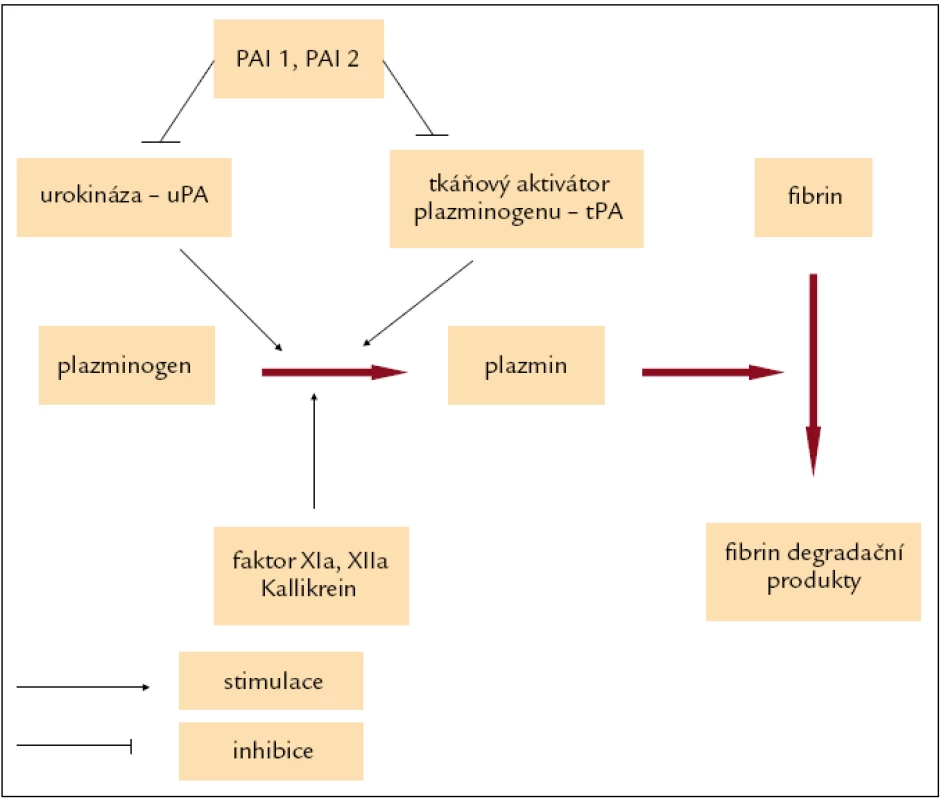
Tkáňový aktivátor plazminogenu (tPA) je serinovou proteinázou, která je přítomna v cévních endoteliích a v buňkách téměř všech parenchymatózních orgánů, zvláště plic, ledvin, prostaty a placenty, odkud se uvolňuje při poranění (např. operace). V plazmě cirkuluje společně v komplexu s inhibitorem urokinázy 1 (PAI 1), méně než 5 % je ho ve volné (aktivní) formě [1]. Urokináza (uPA) je serinová proteináza, která hraje zásadní roli v aktivaci plazminogenu na plazmin, který patří mezi serinové proteinázy, a současně se podílí na aktivaci matrixmetaloproteináz, latentních elastáz, růstových faktorů a cytokinů, které se účastní degradace elementů extracelulární matrix, jako jsou fibrin a laminin. Je syntetizována z proenzymu prourokinázy (pro-uPA nebo sc-uPA). Pro-uPA je aktivována prostřednictvím řady proteináz, zahrnující např. plazmin, katepsin B/L, kallikrein, trypsin-like enzymy, thermolysin, NGF-γ, na enzymaticky aktivní vysokomolekulární formu uPA (HMW). HMW-uPA je dále degradována na nízkomolekulární enzymaticky aktivní formu uPA (LMW) a enzymaticky inaktivní amino-terminální fragment (ATF). ATF epitop v sobě zahrnuje growth-factor-like doménu (GFD). GFD umožňuje vazbu uPA na uPAR [2]. Plazmin se podílí též na aktivaci neaktivních matrixmetaloproteináz. Společně se svým receptorem (uPAR), tkáňovým aktivátorem (tPA, který je syntetizován z proenzymu pro-tPA nebo sc-tPA) a inhibitory urokinázy (PAI 1, PAI 2, PAI 3 – identický s inhibitorem proteinu C a protease nexin) [1] tvoří plazminogen aktivátor systém (PAS), který je součástí metastatické kaskády a významnou měrou se podílí na invazivním růstu a angiogenezi maligních nádorů [2]. V nedávné době byla navržena nová nomenklatura, v níž byl PAI 1 označen jako serpin E1, PAI 2 serpin B2 a PAI 3 serpin A5 [3].
uPA hraje zásadní roli v degradaci tkání při fyziologických i patologických pochodech, na rozdíl od tPA, který má zásadní význam pro fibrinolýzu. PAI 1, který tvoří 60 % ze všech inhibitorů aktivátorů plazminogenu, inhibuje jak uPA, tak tPA. Zajímavostí je, že byla zjištěna nízká exprese uPA a vysoká tPA u normální tkáně střeva, na rozdíl od kolorektálních karcinomů, kde je aktivita tPA nízká oproti vysoké aktivitě uPA [4].
uPAR je membránový glykoprotein, receptor pro uPA, označovaný také jako CD 87. Navázáním uPA k uPAR dochází k aktivaci signální transdukce, jejímž výsledkem je stimulace buněčné proliferace, modulace adheze a zvýšení buněčné migrace (obr. 2) [5]. Nejvýznamnější specifické inhibitory jsou PAI 1 a PAI 2, které reagují s receptorem uPA, ale ne s pro-uPA, oba náleží do rodiny serpinů (serine protease inhibitor super-family) [6].
Obr. 2. Multifunkční potenciál uPA. Upraveno podle [16]. ![Multifunkční potenciál uPA. Upraveno podle [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bda07080681bf4adcda7b3f4b064d3f1.png)
PAI 1 je jednořetězcový glykoprotein sestávající z 379 aminokyselin, jeho gen je lokalizován na 7. chromozomu a je tvořen převážně v hladké svalovině cév, v megakaryocytech, endoteliích, granulocytech, monocytech, makrofázích a nádorových buňkách. Jedná se o serpin, přítomný v plazmě a v α-granulích trombocytů, má schopnost vazby na vitronectin [7–9]. Komplex vitronectin-PAI 1 má delší poločas rozpadu a inhibuje migraci hladkých svalových buněk blokádou αvβ3 integrinu k vitronectinu [10,11]. Kromě αvβ3 integrinu se váže i na další ze skupiny integrinů jako αvβ1, αvβ5, αIIbβ3 a α8β1 [12]. Interakcí PAI 1 s uPA/uPAR komplexem vede k internalizaci této trojice, která stimuluje buněčnou proliferaci, naproti tomu komplex PAI 2/uPA/uPAR není internalizován, ale zpracován na buněčném povrchu [13]. PAI 1 je nejúčinnějším inhibitorem uPA a tPA. Navázání PAI 1 na uPAR vázaného k uPA vede k internalizaci uPA komplexu prostřednictvím endocytických receptorů low density lipoprotein (LDL) receptorové rodiny, jako je protein příbuzný LDL receptoru (LDL receptor related protein – LRP). Navázání uPA k PAI 1 přeruší normální PAI 1-vitronectin interakci a zahájí konformační změny v PAI 1, které umožňují expozici skrytému vysoce afinnímu vazebnému místu na LRP [14]. Obvykle je plazmatická hladina PAI 1 nízká a jeho vysoká hladina je asociována s různými typy onemocnění, např. vaskulárními chorobami či maligními tumory.
PAI 2, známý také jako placentární plazminogen aktivátor inhibitor, existuje ve 2 formách: v intracelulární neglykosylované a extracelulární glykosylované formě. Gen pro PAI 2 se nachází na 18. chromozomu a inhibuje pouze uPA [15]. PAI 2 se vyskytuje v trofoblastickém epitelu a je syntetizován leukocyty. Donedávna mu bylo jako hlavní úloha, podle některých autorů, přisuzováno ovlivnění koagulace u těhotných. Při jeho hlubším zkoumání však vychází najevo jeho nemálo významná role v procesu růstu maligních tumorů (obr. 3).
Obr. 3. Imunohistochemické barvení tkáně kolorektálního karcinomu – nádorové buňky jsou pozitivní na PAI 2 (zvětšeno 200krát). 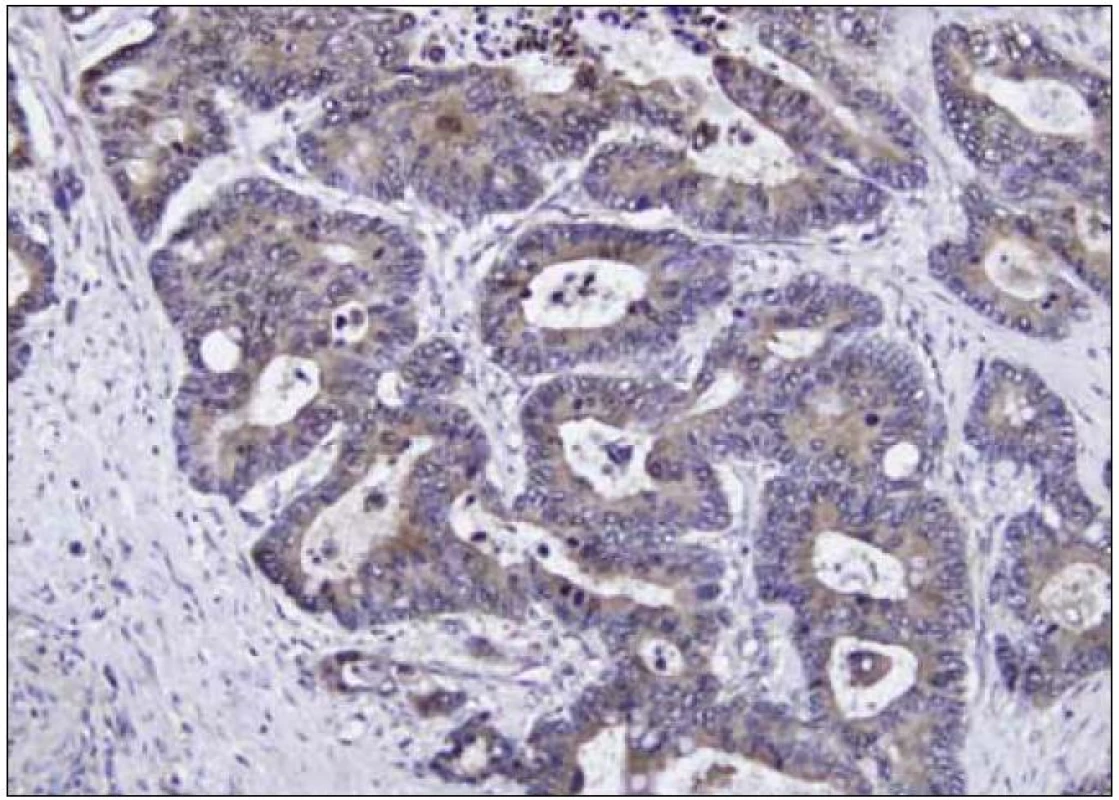
U nádorových buněk je tedy působení PAI 1 a PAI 2 odrazem jejich rozdílných fyziologických biologických funkcí. PAI 1 tedy navázáním komplexu uPA/uPAR vede k stimulaci růstu a současně k redistribuci uPAR na povrchu buněk zajišťující zpětně invazivitu tumorózní tkáně. Na druhé straně PAI 2 by měl být tím pravý inhibitorem PAS, nejen inhibicí aktivity urokinázy, ale i zabráněním migrace tumorózních buněk blokádou uPAR [16].
PAI 3 má nízkou afinitu k uPA i tPA, je označován také jako inhibitor proteinu C. Inhibuje trombin, faktor Xa, faktor XIa a komplex trombin-trombomodulin. Je exprimován v játrech, varlatech, ledvinách a pankreatu. Role PAI 3 a protease nexinu zatím není zcela objasněná [1]. Na experimentech s null PAI 3 myšmi bylo zjištěno, že u nich nejsou abnormality v koagulaci a v hemostáze, ale u myších samců byla zjištěna infertilita. Předpokládá se tedy, že by PAI 3 mohl mít význam ve spermatogenezi [17].
In vivo je to hlavně rovnováha aktivátorů a jejich inhibitorů, která určuje degradaci fibrinu a extracelulární matrix působenou plazminem [15].
Invazivita a metastazování maligních tumorů
V rámci metastatické kaskády dochází k uvolnění buňky z primárního ložiska, prostupu přes bazální membránu a extracelulární matrix do cévního systému, kterým se dostává na stanovené místo, kde opět prostoupí bazální membránou a extracelulární matrix a založí vzdálenou metastázu. Základním procesem je tedy buněčná adheze zprostředkovaná integriny, kadheriny, kateniny, selektiny, imunoglobuliny a dalšími adhezivními molekulami a extracelulárními proteolytickými enzymy, jako jsou např. matrixmetaloproteinázy, cysteinproteinázy (např. katepsin B, L a D) a serinproteinázy (např. urokináza). Kromě proteolytického efektu byla prokázána účast urokinázy i v procesu angiogeneze, jíž se účastní svou katalytickou funkcí, ale i parakrinně//autokrinním efektem na buněčnou migraci [18]. To bylo potvrzeno in vitro experimentálními modely [19]. I když přesný mechanizmus zatím není znám, je jisté, že uPAR neslouží pouze k ukotvení uPA, ale podílí se na signální kaskádě. Jakým způsobem však zatím není jasné, neboť uPAR je GPI (glykosylfosfatidyl inositol) kotveným proteinem a nemá cytoplazmatickou doménu, předpokládá se tedy využití transmembránových integrinů [20]. Potenciálními induktory angiogeneze jsou také fibrin, fibronektin a jejich degradační produkty, které mají chemotaktický efekt na endoteliální buňky.
Plazminogen aktivátor systém a jeho význam v invazi, metastazování a angiogenezi
Lze říci, že plazminogenem vázané molekuly hrají zásadní roli v invazi a metastazování tumoru. Aktivace uPA je regulována prostřednictvím urokinázového receptoru (uPAR). Navázání uPA na jeho receptor uPAR akceleruje aktivaci uPA z inaktivního proenzymu pro-uPA, jehož konverze je katalyzována plazminem, koagulačním faktorem XIIa a katepsinem B a L. Interakce uPAR s extracelulární matrix se děje prostřednictvím vitronectinu [21], tato interakce je zesílena navázáním uPA a snížena prostřednictvím PAI 1. Komplex uPA/uPAR má vysokou afinitu k vitronectinu, a to především k jeho doméně označované jako somatomedin B. PAI 1 je schopen vazbu uPAR k somatomedin B doméně inhibovat. Vitronectin je vázán s fibrinem, podílí se na migraci nádorových buněk ve fibrinové matrix, a tím na lokální invazi tumoru a vzdáleném metastazování. Základním procesem invazivního růstu nádoru je totiž degradace bazální membrány a proteinů extracelulární matrix, což umožňuje migraci nádorových buněk. uPAR je navázán na buněčnou membránu prostřednictvím glykosylfosfatidyl inositolu. Navázáním uPA na uPAR dochází k aktivaci proteintyrozinkináz [22], proteinkinázy C [23] a MAP kinázy [24]. Současně byla popsána i přímá signální cesta Jak/STAT kaskádou s využitím signální transdukce Scr-like proteintyrosinkinázy [25]. Exprese uPAR je regulována řadou růstových faktorů, např. EGF, bFGF a HGF. Extracelulární interakce mezi uPA, uPAR, α5β1 integrinem a fibronektinem iniciuje intracelulární signální kaskádu zprostředkovanou přes epidermální růstový faktor [26]. uPAR/uPA/PAI 1 systém se také podílí na angiogenezi indukované prostřednictvím VEGF [27].
Zajímavé je, že PAI 1 pozitivní buňky byly zachyceny spíše v centrálních částech tumorů, zatímco na periferii byla zjištěna vysoká exprese uPA společně se známkami tkáňové destrukce, což podporuje teorii, podle níž by inhibitor mohl chránit tkáň proti působení uPA [6]. Bylo zjištěno, že PAI 1 inhibuje uPA dependentní invazivitu buněčných linií karcinomu plic, ovariálního karcinomu, choriokarcinomu či fibrosarkomu [28–30]. Rostoucí exprese PAI 1 v nádorové tkáni je však u těchto pacientů spojena s horší prognózou. Tím je jeho role v celé šíři nádorového růstu zatím neobjasněná [31,32]. Proč je rostoucí hladina proteolytického inhibitoru spojena s horší prognózou, je tedy nejasné. Avšak užitím PAI 1 deficientních transgenních myší bylo zjištěno, že lokální invaze a s tumorem asociovaná angiogeneze jsou závislé na přítomnosti PAI 1 [33–35]. Jak se tedy PAI 1 podílí na tumorózní progresi? Vysvětlení může být následující: indukce uPAR vede k modifikaci integriny zprostředkované buněčné adheze prostřednictvím interakce s vitronectinem. Vazba uPA navázáním na uPAR vede k vzrůstu afinity k vitronectinu, je tedy pravděpodobné, že zvýšení PAI 1 sníží buněčnou adhezi k extracelulární matrix interferencí s uPAR navázaným na vitronectin, tímto pak zjednoduší buněčnou invazi a migraci [11,36–39].
PAI 1 se váže nejen na volný uPA, ale i na uPA vázaný k uPAR. Nemáme zatím vysvětlení například pro skutečnost, že u kolorektálních karcinomů je uPA exprimován hlavně na nádorových buňkách a PAI 1 nalézán převážně na endoteliích, na rozdíl třeba od karcinomu prsu, kde je uPA, uPAR a PAI 1 exprimován jak na nádorových, tak i na okolních buňkách stromatu [40]. Role PAS v metastatickém procesu není tedy závislá pouze na proliferačním a invazivním potenciálu vlastních nádorových buněk, ale vyžaduje existenci podpůrného vaskularizovaného nádorového stromatu, což představuje vzájemnou komunikaci mezi nádorovou linií a hostitelským prostředím a vytvoření nových cév v procesu angiogeneze. Angiogenezí je obecně označována novotvorba cév, proces podstatný pro růst tumoru. Jedná se o stav přísně regulovaný rovnováhou mezi aktivátory a inhibitory angiogeneze. Podkladem je rozpuštění bazální membrány, proliferace endotelií, jejich migrace a vytvoření nové cévy. Angiogeneze je stimulována hypoxií a právě hypoxie vede k zvýšení exprese uPAR a PAI 1 na endoteliálních buňkách [41]. Řada angiogenních faktorů jako např. VEGF, bFGF indukuje expresi uPA, tPA, uPAR a PAI 1, zatímco TGF β snižuje expresi uPA a posiluje PAI 1 produkci [42,43]. Důležitou roli v destrukci extracelulární matrix hrají kromě serinových proteináz (uPA, PAI 1) i katepsin B (CATB) a katepsin L (CATL), které jsou cysteinovými proteinázami [44,45]. Přesný mechanizmus, jakým se PAI 1 podílí na angiogenezi, však zatím nebyl objasněn. Zásadní je ale jeho význam při ochraně extracelulární matrix proti degradaci a vytvoření sítě pro migrující endoteliální buňky. PAI 1 prokázal u různých buněčných linií schopnost ochrany proti apoptóze, ať už spontánní, či léky indukované. Mechanizmus, kterým toho dosáhne, však zatím není znám [46].
Někteří autoři se domnívají, že PAI 1 nebo jeho nedostatek alteruje se signálními cestami jako např. PI3K/Akt a Jak/STAT a je zahrnut do procesů udržení integrity endoteliálních buněk, a tím i regulace buněčné smrti. PAI 1 ovlivňuje apoptózu snížením buněčné adheze a působením na intracelulární signální dráhy. Umožní to jeho schopnost inhibice generace plazminu, inhibice kaspázy 3 a schopnost inhibice buněčné adheze zprostředkované vitronectinem. Právě inhibice kaspázy 3 prostřednictvím PAI 1 může směrovat intracelulární buněčnou signalizaci od indukce apoptózy k indukci proliferace [47,48].
Plazminogen aktivátor systém jako cíl antitumorózní léčby
Jako první podali důkaz o antitumorózním efektu plazminu Cliffton a Grossi v roce 1956, kdy využili podání plazminu u pokusných králíků v návaznosti na intravenózní aplikaci nádorových buněk [49]. V současnosti se výzkum zaměřuje na několik cest, kterými by bylo možné ovlivnit PAS, a tím i procesy, kterých se v rámci nádorového růstu účastní:
- a) vytvoření nízkomolekulárních inhibitorů zaměřených přímo proti enzymaticky aktivnímu místu uPA,
- b) proteolyticky inaktivní uPA nebo jí podobné peptidy,
- c) monoklonální nebo polyklonální protilátky proti uPA či uPAR blokující uPA/uPAR interakci,
- d) rekombinantní, solubilní formy uPAR interferující s navázáním uPA na povrch nádorové buňky,
- e) inhibice syntézy PAS – využitím antisens oligodeoxynukleotidů nebo RNA zaměřená proti uPA nebo uPAR expresi,
- f) toxiny napojené na uPA,
- g) virové vektory přenášející jednotlivé genové komponenty pro PAS [16].
Zatím jsou však zkoušeny preparáty zaměřující se na PAS spíše u jiných onemocnění, jako např. Tiplaxtinin – inhibitor PAI 1(PAI-039), malá molekula, která oslabuje remodelaci cév, ke které dochází např. při aktivaci systému renin-angiotenzin u arteriální hypertenze. První výsledky jsou však publikovány s pozitivním efektem i na tumorózní angiogenezi u zvířecích modelů [50].
Závěr
Jak již bylo uvedeno, jednotlivé faktory PAS se jistě podílí na procesu malignizace nádorových onemocnění. Na otázky, do jaké míry je jejich vliv zásadní u konkrétních malignit a jak by mohl být terapeuticky nasměrován ve prospěch nemocného, by měl odpovědět další výzkum. V článku je souhrnně předložen přehled teoretických i klinických poznatků, které na své rutinní zavedení do praxe zatím čekají. Autoři článku však chtějí na podkladě publikovaných informací upozornit na vzájemnou provázanost koagulace, fibrinolýzy a procesu invaze a metastazování maligního onemocnění. Do budoucna by totiž jednotlivé faktory PAS mohly hrát významnou úlohu při plánování strategie léčby a zároveň by se mohly stát i terčem cílené terapie.
Tato práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005.
MUDr. Jana Halámková, Ph.D.
www.mou.cz
e-mail: jana.halamkova@mou.cz
Doručeno do redakce: 21. 6. 2011
Přijato po recenzi: 4. 8. 2011
Zdroje
1. Brummel-Ziedins K, Orfeo T, Swords JN et al. Blood coagulation and fibrinolysis. In: Greer JP, Foerster J, Rodgers JM et al (eds). Wintrobe’s Clinical Hematology. Baltimore: Lippincott Wiliams & Wilkins 2009 : 528–619.
2. Schmitt M, Harbeck M, Thomssen C et al. Clinical impact of the plasminogen activation system in tumor invasion and metastasis: Prognostic relevance and target therapy. Thromb Haemost 1997; 78 : 285–296.
3. Silverman GA, Bird PI, Carrell RW et al. The serpins are an expanding superfamily of structurally similar but functionally diverse proteins: evolution, mechanism of inhibition, novel functions, and a revised nomenclature. J Biol Chem 2001; 276 : 33293–33296.
4. De Bruin PA, Griffioen G, Verspaget HW et al. Plasminogen activators and tumor development in the human colon: activity levels in normal mucosa, adenomatous polyps, and adenocarcinomas. Cancer Res 1987; 47 : 4654–4657.
5. Duffy MJ. The urokinase plasminogen activator system: role in malignancy. Curr Pharm Des 2004; 10 : 39–49.
6. Pyke C, Kristensen P, Ralfkiaer E et al. The plasminogen activation system in human colon cancer: Messenger RNA for the inhibitor PAI-1 is located in endothelial cells in tumor stroma. Cancer Res 1991; 51 : 4067–4071.
7. Fya WP, Shapiro AD, Shih JL et al. Brief report: Complete deficiency of plasminogen-activator inhibitor type 1 due to a frame-shift mutation. N Engl J Med 1992; 327 : 1729–1733.
8. Carmeliet P, Stassen JM, Schoonjans L et al. Plasminogen activator inhibitor-1 gene-deficient mice. II. Effect on haemostasis, thrombosis and thrombolysis. J Clin Invest 1993; 92 : 2756–2760.
9. Hill SA, Shaughnessy SG, Joshua P et al. Differential mechanisms targeting type 1 plasminogen activator inhibitor and vitronectin into the storage granules of a human megakaryocytic cell line. Blood 1996; 87 : 5061–5073.
10. Stefansson S, Peticlerc E, Wong MK et al. Inhibition of angiogenesis in vivo by plasminogen activator inhibitor-1. J Biol Chem 2001; 276 : 8135–8141.
11. Stefansson S, Lawrence DA. The serpin PAI-1 inhibits cell migration by blocking integrin alpha V beta 3 binding to vitronectin. Nature 1996; 383 : 441–443.
12. Sugiura Y, Ma L, Sun B et al. The plasminogen-plasminogen activator (PA) system in neuroblastoma: role of PA inhibitor-1 in metastasis. Cancer Res 1999; 59 : 1327–1336.
13. Nykjaer A, Conese M, Christensen EI et al. Recycling of the urokinase receptor upon internalization of the uPA: serpin complexes. EMBO J 1997; 16 : 2610–2620.
14. Chazaud B, Ricoux R, Christov C et al. Promigratory effect of plasminogen activator inhibitor-1 on invasive breast cancer cell populations. Am J Pathol 2002; 160 : 237–246.
15. Baker EA, Bergin FG, Leaper DJ et al. Plasminogen activator system, vascular endothelial growth factor and colorectal cancer progression. Mol Pathol 2000; 53 : 307–312.
16. Schmitt M, Wilhelm O, Reuning U et al. The urokinase plasminogen activator system as a novel target for tumour therapy. Fibrinolysis Proteol 2000; 14 : 114–132.
17. Meijers JC, Marquart JA, Bertina MR et al. Protein C inhibitor (plasminogen activator inhibitor-3) and the risk of venous thrombosis. Br J Haematol 2002; 118 : 604–609.
18. Mignatti P, Rifkin DB. Plasminogen activators and matrix metalloproteinases in angiogenesis. Enzyme Prot 1996; 49 : 117–137.
19. Pepper MS, Sappino AP, Stöcklin R et al. Up-regulation of urokinase receptor expression on migrating endotelial cells. J Cell Biol 1993; 122 : 673–684.
20. Ploug M, Ronne E, Behrendt N et al. Cellular receptor for urokinase plasminogen activator. Carboxyl-terminal processing and membrane anchoring by glycosylphosphatidylinositol. J Biol Chem 1991; 266 : 1926–1933.
21. Waltz DA, Natkin LR, Fujita RM et al. Plasmin and plasminogen activator inhibitor type 1 promote cellular motility by regulating the interaction between the urokinase receptor and vitronectin. J Clin Invest 1997; 100 : 58–67.
22. Resnati M, Guttinger M, Valcamonica S et al. Proteolytic cleavage of the urokinase receptor substitutes for the agonist-induced chemotactic effect. EMBO J 1996; 15 : 1572–1582.
23. Busso N, Masur SK, Lazega D et al. Induction of cell migration by pro-urokinase binding to its receptor: possible mechanism for signal transduction in human epitelial cells. J Cell Biol 1994; 126 : 259–270.
24. Nguyen DH, Hussaini IM, Gonias SL. Binding of urokinase-type plasminogen activator to its receptor in MCF-7 cells activates extracellular signal regulated kinase 1 and 2 which is required for increased cellular motility. J Biol Chem 1998; 273 : 8502–8507.
25. Dumler I, Weis A, Mayboroda OA et al. The Jak/Stat pathway and urokinase receptor signaling in human aortic vascular smooth muscle cells. J Biol Chem 1998; 273 : 315–321.
26. Durand MK, Bødker JS, Christensen A et al. Plasminogen activator inhibitor 1 and tumour growth, invasion and metastasis. Tromb Haemost 2004; 91 : 439–449.
27. Prager GW, Breuss JM, Steurer S et al. Vascular endothelial growth factor receptor-2-induced initial endothelial cell migration depends on the presence of the urokinase receptor. Circ Res 2004; 94 : 1562–1570.
28. Brückner A, Filderman AE, Kirchheimer JC et al. Endogenous receptor-bound urokinase mediates tissue invasion of the human lung carcinoma cell lines A549 and Calu-1. Cancer Res 1992; 52 : 3043–3047.
29. Kobayashi H, Moniwan N, Gotoh J et al. Role of activated protein C in faciliting basement membrane invasion by tumor cells. Cancer Res 1994; 54 : 261–267.
30. Praus M, Collen D, Gerard RD. Both u-PA inhibition and vitronectin binding by plasminogen activator inhibitor 1 regulate HT1080 fibrosarcoma cell metastasis. Int J Cancer 2002; 102 : 584–591.
31. Harbeck N, Schmitt M, Kates RE et al. Clinical utility of urokinase-type plasminogen activator and plasminogen activator inhibitor-1 determination in primary breast cancer tissue for individualized therapy concepts. Clin Breast Cancer 2002; 3 : 196–200.
32. Taponeco F, Curcio C, Giuntini A et al. Expression and prognostic significance of urokinase and plasminogen activator inhibitor type-1 in endometrial hyperplazia and cancer. J Exp Clin Canc Res 2001; 20 : 239–246.
33. Bajou K, Noël A, Gerard RD et al. Absence of host plasminogen activator inhibitor 1 prevents cancer invasion and vascularization. Nat Med 1998; 4 : 923–928.
34. Rak J, Klement P, Yu J. Genetic determinats of cancer coagulopathy, angiogenesis an disease progression. Vnitř Lék 2006; 52 (Suppl 1): 135–138.
35. Penka M. Activation of blood coagulation in oncology patient. Vnitř Lék 1997; 43 : 337–339.
36. Deng C, Cirriden SA, Wang S et al. Is plasminogen activator inhibitor 1 the molecular switch that governs urokinase receptor-mediated cell adhesion and release? J Cell Biol 1996; 134 : 1563–1571.
37. Kanse SM, Kost C, Wilhelm OG et al. The urokinase receptor is a major vitronectin-binding protein on endothelial cells. Exp Cell Res 1996; 224 : 344–353.
38. Abe J, Urano T, Konno H et al. Larger and more invasive colorectal carcinoma contains larger amounts of plasminogen activator inhibitor type 1 and its relative ratio over urokinase receptor correlates well with tumor size. Cancer 1999; 86 : 2602–2611.
39. Malý J, Blažek M, Bláha M et al. Changes in hemostasis in malignant diseases. Vnitř Lék 2002; 48 : 614–618.
40. Rakic JM, Maillard C, Jost M et al. Role of plasminogen activator-plasmin system in tumor angiogenesis. Cell Mol Life Sci 2003; 60 : 463–473.
41. Uchiyama T, Kurabayashi M, Ohyama Y et al. Hypoxia induced transcription of the plasminogen activator inhibitor 1 gene through genistein-sensitive tyrosine kinase pathways in vascular endothelial cells. Arterioscl Throm Vas 2000; 20 : 1155–1161.
42. Premzl A, Turk V, Kos J. Intracellular proteolytic activity of cathepsin B is associated with capillary-like tube formation by endothelial cells in vitro. J Cell Biochem 2006; 97 : 1230–1240.
43. Smith OP. Thrombotic complications in children with cancer. Vnitř Lék 2009; 55 : 223–226.
44. Danø K, Behrendt N, Høyer-Hansen G et al. Plasminogen activations and cancer. Thromb Haemost 2005; 93 : 676–681.
45. Krueger S, Kalinski T, Wolf H et al. Interactions between human colon carcinoma cells, fibroblasts and monocytic cells in coculture-regulation of cathepsin B expression and invasiveness. Cancer Lett 2005; 223 : 313–322.
46. Kwaan HC, Wang J, Svoboda K et al. Plasminogen activator inhibitor 1 may promote tumour growth through inhibition of apoptosis. Br J Cancer 2000; 82 : 1702–1708.
47. Balsara RD, Ploplis VA. Plasminogen activator inhibitor-1: the double-edged sword in apoptosis. Thromb Haemost 2008; 100 : 1029–1036.
48. Schneider DJ, Chen Y, Sobel BE. The effect of plasminogen activator inhibitor type 1 on apoptosis. Thromb Haemost 2008; 100 : 1037–1040.
49. Clifton EE, Grossi CE. Effect of human plasmin on the toxic effects and growth of blood borne metastasis of the Brown-Pearce carcinoma and the V2 carcinoma of rabbit. Cancer 1956; 9 : 1147–1152.
50. Leik CE, Su EJ, Nambi P et al. Effect of pharmacologic plasminogen activator inhibitor-1 inhibition on cell motility and tumor angiogenesis. J Thromb Haemost 2006; 4 : 2710–2715.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací
- Je potřeba zavádět pojem bažení do klinické praxe? – editorial
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



