-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Genová terapie – nová naděje v léčbě erektilní dysfunkce?
GENE THERAPY - NEW HOPE FOR THE TREATMENT OF ERECTILE DYSFUNCTION?
Current available treatment options for erectile dysfunction (ED) are effective but not without failure and/or side effects. Although the development of phosphodiesterase type 5 (PDE5) inhibitors (i.e. sildenafil, tadalafil and vardenafil) has revolutionized the treatment of ED, these oral medications required on-demand are less efficacious in some hard-to-treat populations (diabetics, men after radical prostatectomy). Recent trials have demonstrated that gene therapy strategies may be applicable for such purposes. Improvement in the treatment of ED depends on the understanding of the regulation of human corporal smooth muscle tone and on the identification of relevant molecular targets. Tissue engineering and gene therapy are currently investigated in animal studies for reconstructing penile tissue or treating erectile dysfunction. Future ED therapies might consider the application of molecular technologies, such as gene therapy. As a potential therapeutic tool, gene therapy might provide an effective and specific means of altering intracavernous pressure "on demand" without affecting the other penile functions. Gene therapy is applicable to the penis because of its location and accessibility, low penile circulatory flow in flaccid state and the presence of endothelial lined lacunar spaces. Gene therapy approaches have focused on a number of signalling pathways that are crucial for penile erection (i.e. nitric oxide/cyclic guanosine monophosphate, RhoA/Rho-kinase, growth factors, ion channels, peptides). This review provides a brief insight of the current role of gene therapy in the management of ED.
Key words:
gene therapy, erectile dysfunction
Autoři: MUDr. Libor Zámečník; Febu
Působiště autorů: Urologická klinika 1. LF UK a VFN
Vyšlo v časopise: Urol List 2007; 5(3): 34-37
Souhrn
Současné terapeutické možnosti u poruch erekce – erektilní dysfunkce (ED) – jsou dostatečně efektivní, ale někdy selhávají a jsou spojeny s některými nežádoucími účinky. Jakkoli můžeme považovat léčbu inhibitory fosfodiesterázy 5 (iPDE5); (sildenafil, tadalafil a vardenafil) za revoluci v léčbě ED, je tato perorální terapie ne vždy „on demand“ dostatečně účinná, například u pacientů s komplikovanou ED (diabetici, pacienti po radikální prostatektomii). Jak se ukazuje na současných studiích, bylo by v těchto případech možno využít genové terapie. Zlepšení účinnosti terapie ED ale závisí na pochopení regulace tonu hladké svaloviny organizmu a na identifikaci odpovídajících molekulárních pochodů. Buněčné inženýrství a genová terapie, která se zabývá vývojem tkání podobných tkáním penisu a léčbou poruch erekce, dnes pracuje zatím na úrovni studií na zvířatech. Budoucnost terapie poruch erekce tedy patrně tkví v aplikaci molekulárních technologií, např. genové terapie. Genová terapie může být potencionální vysoce efektivní a specifický léčebný prostředek pro „on demand“ změny intrakavernózního tlaku beze změn ostatních funkcí penisu. Vhodnost aplikace genové léčby v této indikaci je dána zvláště uložením penisu a snadnou dosažitelností, nízkými průtoky cévami penisu ve flacidním stavu a přítomností endotelu v prostorách lakun topořivých těles. Genová terapie se zaměřuje na velké množství procesů a bodů, které jsou zásadní pro erekci (např. oxid dusnatý/cGMP, RhoA/Rho-kináza, růstové faktory, iontové kanály, peptidy). Sdělení podává přehled o současné roli genové terapie v léčbě poruch erekce.
Klíčová slova:
genová terapie, erektilní dysfunkceÚVOD
Genová terapie (GT) je jedním z velmi významných a vědecky náročných výstupů molekulární biologie a genového inženýrství a právem patří k nejvíce diskutovaným terapeutickým postupům. I přesto, že se patrně nebude jednat o měsíce, kdy se prosadí v rutinní praxi, je třeba mít o podstatě a možnostech této léčby základní informace.
U velkého množství geneticky podmíněných chorob známe příčinu (mutaci konkrétního genu), ale nejsme schopni tuto příčinu vyléčit (jedná se tedy jen o symptomatickou léčbu). A právě zde je zásadní místo pro léčbu kauzální pomocí GT. Do GT zařazujeme všechny postupy, které jsou schopny využít přenosu funkčního genetického materiálu k léčebným účelům (ještě jednodušeji: do nemocného organizmu se vpraví genetická informace, podle které si organizmus sám vyrobí „lék“ - tím může být chybějící enzym, bílkovina, prostředek pro boj s nádorem, či dokonce již DNA-vakcína, na základě které si pacient vytvoří cizí bílkovinu a připraví svůj organizmus na atak choroboplodných zárodků). Tyto metody zažívají tak prudký vývoj, že se v rámci GT nejedná již jen o opravu geneticky vadných buněk, nýbrž o docílení změny funkce orgánu či reaktivity organizmu nebo o potlačení nepříjemných symptomů nemoci, jako je třeba bolest [1].
Na počátku posledního desetiletí minulého století, kdy se GT zrodila, se uvažovalo o jejím využití při léčbě vrozených vad (převážně metabolických), později se většina úsilí přesměrovala k onemocněním získaným, mezi nimiž jednoznačně převažují zhoubné nádory - v urologii se diskutuje například léčba nádorů ledvin či prostaty [2].
Z výše uvedeného by se zdálo, že GT je u erektilní dysfunkce (ED) málo opodstatněná a vědecké úsilí by mělo sílit na poli onkourologie. Zvláš tehdy, máme-li tak účinné léky, jakými jsou inhibitory fosfodiesterázy 5 (iPDE5). Jakkoli můžeme považovat léčbu pomocí iPDE5 (sildenafil, tadalafil a vardenafil) za revoluci v léčbě ED, ne vždy je tato perorální terapie „on demand“ dostatečně účinná, například u pacientů s komplikovanou ED (diabetici, pacienti po radikální prostatektomii, míšních traumatech, dialýzovaní pacienti atd) [3]. Genová terapie se může stát potenciálním vysoce efektivním a specifickým léčebným prostředkem pro „on demand“ změny intrakavernózního tlaku bez změn ostatních funkcí penisu a tak i řešením hrozící fibrózy topořivých těles u ED [4].
Samotné provedení GT, obecně popsáno, zahrnuje:
- Vytvoření genetické informace (metodami rekombinantní DNA), ta je určená pro transport do buněk.
- Poté je třeba vybrat buňky, do kterých bude upravená genetická informace vnesena. Genová terapie se může provádět jak in vivo (kdy jsou cílové buňky po celou dobu součástí organizmu), tak in vitro (kdy jsou cílové buňky z těla organizmu nejprve odebrány a po provedení genové terapie opět vráceny na své místo v organizmu).
- Je nutné vybrat vhodný vektor (nosič), který bude použit pro vpravení genetické informace do cílových buněk. V současnosti se nejvíce využívá virových vektorů (jde zejména o adenoviry a retroviry, které mají schopnost přenést svou genetickou informaci do genomu hostitelské buňky). Do virových kapsid je zabudována terapeutická genetická informace (vlastní virová genetická informace je tedy odstraněna) a virové vektory jsou aplikovány.
Celý mechanizmus genové terapie shrnuje schéma.
Schéma. Průběh genové terapie. 
VEKTORY POUŽÍVANÉ PŘI GENETICKÉ TERAPII
Jak bylo uvedeno výše, pro přenos požadované genetické informace do cílových buněk jsou užívány tzv. vektory. Mezi virové vektory - ty jsou využívány s velmi dobrým efektem na přenos cílové informace patří zejména retroviry a adenoviry [5]. Genetický materiál v retrovirech je v podobě molekul RNA. Proces produkce DNA z molekuly RNA se nazývá reverzní transkripce. U adenovirů je genetická informace nesena v dvojšroubovici DNA. Většinou způsobují respirační, střevní a oční infekce. Genetický materiál není inkorporován do genetického materiálu hostitelské buňky [6]. Z rodiny parvovirů pocházejí viry sloužící jako virové vektory, které přenášejí genetickou informaci v jednošroubovici DNA, jsou to tzv. adeno-asociované viry. Tyto viry přenášejí u pacientů specificky genetickou informaci na chromozom 19 s menší imunitní a lepší terapeutickou odpovědí [7].
Zástupci nonvirových vektorů jsou nahá DNA (naked DNA) a lipozomální struktury. Nahá DNA je základní kyselina zbavená tzv. histonů (skupina bazických bílkovin v jádře eukaryotních buněk, kde vytvářejí reversibilní komplexy s DNA. Rozlišuje se 5 typů histonů: H1, H2A, H2B, H3 a H4, histony H2A, H2B, H3 a H4 tvoří vždy ve 2 kopiích oktamery, kolem nichž se obtáčí dvojšroubovicová DNA; tento útvar se nazývá nukleozom) [8]. DNA, která má být inkorporována do buněk musí být chráněna před poškozením a vstup do buňky by měl být jistým způsobem také usnadněn. To umožňují nové systémy, které se nazývají lipoplexy nebo polyplexy [9]. Jsou to struktury, které obsahují jak DNA, tak lipidy, které ji chrání. Tvoří komplexy podobné micelám nebo lipozomům.
Výhody a nevýhody jednotlivých vektorových druhů shrnuje tab.
Tab. 1. Výhody a nevýhody virových a nonvirových vektorů. 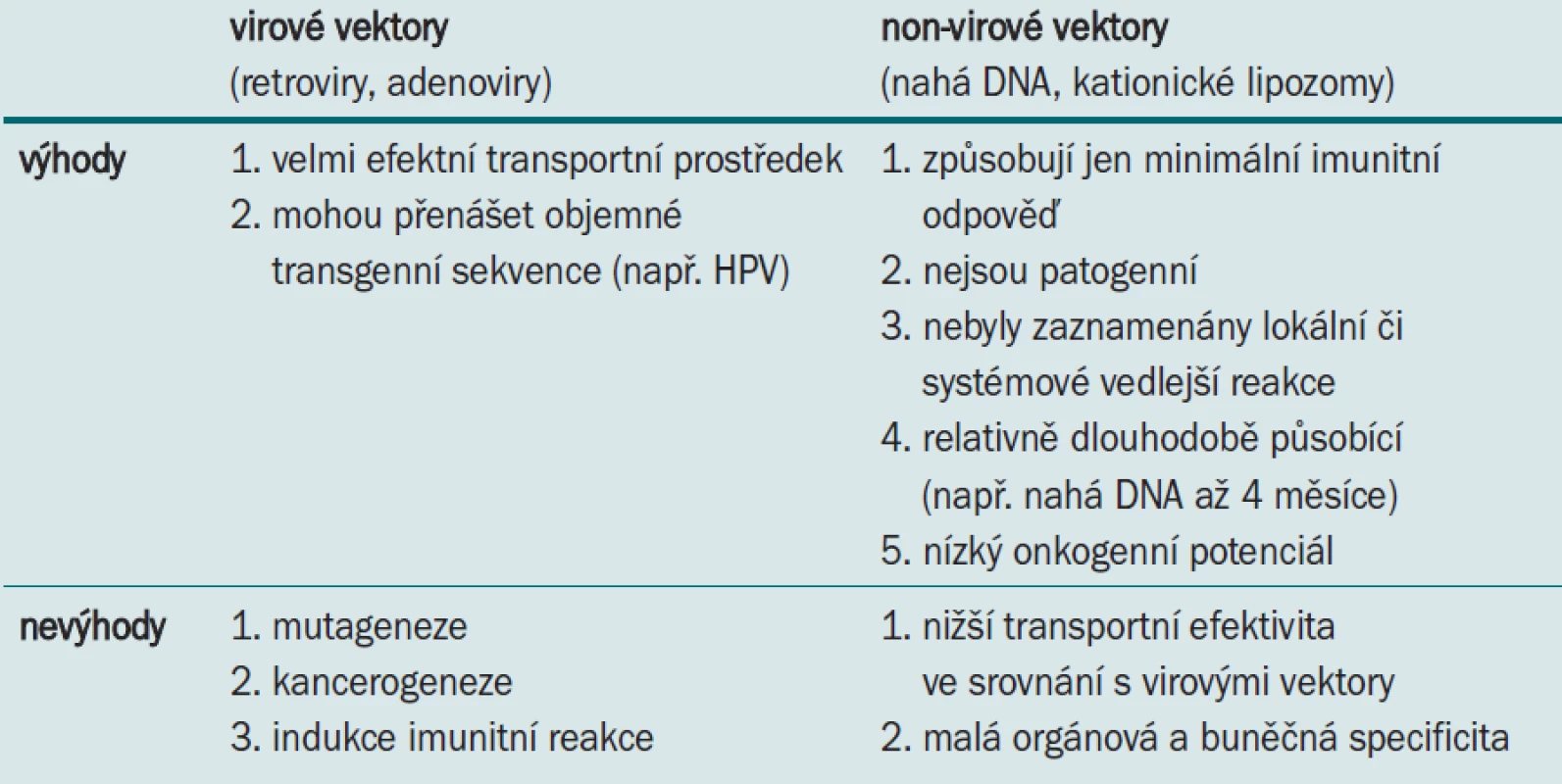
GENOVÁ TERAPIE A NOS
Modulace syntézy oxidu dusnatého (NO), hlavního mediátoru erekce, se jeví jako velmi nadějná metoda v rámci genové terapie ED (diagram). Syntéza NO je katalyzována enzymem NO-syntázou (nitric oxide synthase). Pomocí elevace hladin cGMP (cyklický guanosin monofosfát) a aktivace kinázy G dochází k redukci intracelulární hladiny vápníku a inhibici kavernózní kontrakce. V experimentech na zvířatech bylo prokázáno, že hladiny NOS jsou výrazně redukovány u diabetiků a pacientů vyššího věku. Zdá se tedy, že tímto směrem – zvyšováním hladin NOS – by se mohla ubírat genová terapie u ED [10].
Diagram. Shrnutí použité genové terapie při léčbě ED (NO - oxid dusnatý, NOS - NO syntáza, eNOS - endoteliální NOS). 
Existují 3 izoformy NOS. Ty jsou pojmenovány podle tkání, v nichž byl daný typ enzymu poprvé identifikován. Neuronová NOS (nNOS) byla nejdříve izolována z neuronů. Z endotelové výstelky cév se podařilo izolovat endotelovou izoformu (eNOS). Další izoforma NOS byla odhalena v širokém spektru buněk imunitního systému. Produkuje NO po stimulaci cílových buněk cytokiny a označuje se proto jako indukovatelná (iNOS). Indukovatelná izoforma je na rozdíl od zbývajících 2 izoforem NOS schopna produkovat značná množství NO a její exprese v buňkách imunitního systému z ní činila logicky hlavního podezřelého v případě nadprodukce NO při anafylaktickém šoku. Všechny 3 formy jsou v experimentu používány jako možné modulátory erektilní odpovědi, penis je totiž, ve své podstatě, modifikovanou vaskulární tkání. Proto nepřekvapí, že se po počátečních stadiích výzkumu genové terapie na ostatních vaskularizovaných tkáních pozornost zaměřila právě na penis. V případě eNOS se výzkum soustředil na ovlivnění kontrakce cév, a to zvláště in vitro. Pozitivní efekt eNOS genového transferu, nadějný pro možné využití v praxi, se prokázal v corpus cavernosum (kde byla částečně obnovena syntéza NO a erektilní funkce) u krys s streptozotocinem indukovaným diabetem [11]. Stejný efekt byl pozorován i u orgánů krys, kde byl simulován zvýšený věk. Obdobný efekt byl pozorován u starších krys, kde byla použita v konkomitantní terapii eNOS transfekce a aplikace iPDE5 [12]. Vždy byly použity adenovirové vektory. Garban et al byli první, kteří demonstrovali pozitivní vliv iNOS na léčbu ED průkazem zvýšení intrakavernózního tlaku - ICP (stimulací kavernózního nervu) po intrakorporální injekci iNOS cDNA (cDNA = deoxyribonukleová kyselina získaná umělým přepisem z mRNA, neobsahuje introny). Stejně tak bylo prokázáno, že iNOS cDNA by mohla mít pozitivní antifibrotický efekt na jizevnaté změny v plaku u M. Peyronie [13].
Varianta nNOS izoformy, která se jmenuje PnNOS (penilní NOS), se vyskytuje v penisu člověka a také v penilní tkáni potkanů. Jedná se o formu nNOS odlišnou od té, která se vyskytuje v centrálním nervovém systému [14]. Jak se ukázalo v mnoha pozorováních na potkanech, souvisí ED se sníženou aktivitou NOS. V rámci chronických onemocnění byla snížena tato aktivita na podkladě úbytku nNOS, narozdíl od eNOS, jejíž hladina zůstává konstantní [15]. Proto se nNOS jeví jako vhodný kandidát pro použití v rámci genové terapie u ED, a to zvláště PnNOS, pro svou tkáňovou specificitu. To ostatně potvrdili Magee et al, když genovou terapií (pomocí PnNOS a helper-dependentního adenoviru) zlepšili aging-related ED již po 18 dnech.
GENOVÁ TERAPIE A HUMÁNNÍ KALCIUM – SENZITIVNÍ SUBTYPY DRASLÍKOVÝCH KANÁLŮ
Draslíkové kanály jsou modulátory tonu lidské hladké svaloviny, a to díky schopnosti měnit membránový potenciál, transmembránový tok kalciových iontů a také koncentraci intracelulárních volných kalciových iontů. Kalcium senzitivní, maxi-K kanál je jedním z předních kanálů zastoupených v hladkosvalových buňkách. Draslíkový kanál je kódován hSlo cDNA genem [16]. Intrakavernózní aplikací injekce nahé hSlo cDNA u potkanů došlo k zachování erektilní funkce. Odpověï byla měřena pomocí změn intrakavernózního tlaku po elektrické stimulaci [17]. Obdobně byl tento vliv prokázán u diabetických potkanů. Genový transfer upravil jejich erektilní funkci in vivo [18]. V současnosti probíhá klinické zkoušení genové terapie s maxi-K kanály i u lidí. Jedná se o fázi 1, s intrakavernózním podáním, bez vedlejších účinků [19,20].
GENOVÁ TERAPIE A VASKULÁRNÍ ENDOTELIÁLNÍ RŮSTOVÝ FAKTOR (VEGF) A OSTATNÍ MOLEKULÁRNÍ OBJEKTY
ED je často spojena s poruchami průtoku krve penisem. V experimentu bylo prokázáno, že terapie pomocí VEGF u zvířat či lidí s periferním arteriálním postižením vedla ke zvýšení prokrvení tkání [21]. V korporální tkáni potkanů i lidí byly prokázány 4 izoformy VEGF [22]. Identifikace relevantní humánní izoformy VEGF umožňuje genovou manipulaci VEGF v penisu u pacientů s ED. Studie byly zaměřeny na intrakavernózní podání VEGF proteinu nebo VEGF genu jako terapie, která zachovává erektilní funkci u pacientů s hyperlipidemií [23].
Vazoaktivní intestinální polypeptid (VIP) a kalcitonin gene-related peptid (CGRP) jsou neurotransmitery, které se nacházejí v kavernózních tělesech. Dostupné práce dokazují, že se oba mediátory účastní relaxace kavernózních těles a jsou možnými nadějnými prostředky v genové léčbě ED [24,25]. Navíc, např. VIP cDNA je jednoduše aplikovatelná do kavernózních těles.
Dalším možným ovlivněním poruch erekce u diabetiků a erektilní dysfunkce spojené s věkem se jeví suprese eNOS pomocí RhoA/Rho kinázy [26,27].
ZÁVĚR
Přes všechno výše uvedené a relativně velké množství experimentálních prací je genová terapie ED stále v začátcích. Nejdůležitejším faktem zůstává, že intrakavernózní injekce a intracelulární vpravení nahé DNA vede k expresi funkčních proteinů [18]. Složitou otázkou bude i nadále řešení technických a etických otázek spojených s GT. Půjde o nalezení bezpečných, specifických a dostatečně dlouho trvajících léčebných „on demand“ postupů pro ovlivnění intrakavernózního tlaku a erektilní funkce.
MUDr. Libor Zámečník, FEBU
Urologická klinika 1. LF UK a VFN
Ke Karlovu 6, 128 00 Praha 2
e-mail: libor.zamecnik@lf1.cuni.cz
Zdroje
1. Vonka V. Genová terapie v onkologii. Sanquis 2004; 6 : 32.
2. Gaston KE, Ornstein DK. Pharmacotherapy for biochemical recurrences after therapy for localised prostate cancer. Expert Opin Pharmacother 2002; 3 : 657-669.
3. Kendirci M, Teloken PE, Champion HC et al. Gene therapy for erectile dysfunction: fact or fiction? Eur Urol 2006; 50 : 1208-1222.
4. Song LJ, Pan LJ, Xu YM. Reconstruction of penile function with tissue engineering techniques. Zhonghua Nan Ke Xue 2007; 13 : 352-355.
5. Kendirci M, Gur S, Sikka SC. Gene therapy for erectile dysfunction. Front Biosci 2005; 10 : 2758-2769.
6. Bivalacqua TJ, Champion HC, Mehta YS et al. Adenoviral gene transfer of endothelial nitric oxide synthase (eNOS) to the penis improves age-related erectile dysfunction in the rat. Int J Impot Res 2000; 12(suppl 3): S8-17.
7. Xing JP, Sun JH, Cui XF, Qiu SD. Expression and effect of hCGRP recombinant adeno-associated virus in primary cultured corporal cavernosum smooth muscle cells of the rat in vitro. Zhonghua Nan Ke Xue 2005; 11 : 918-921.
8. Melman A. Gene transfer for the therapy of erectile dysfunction: progress in the 21st century. Int J Impot Res 2006; 18 : 19-25.
9. Lee M, Ryu JK, Oh SM et al. Water-soluble lipopolymer as a gene carrier to corpus cavernosum. Int J Impot Res 2005; 17 : 326-334.
10. Yetik-Anacak G, Catravas JD. Nitric oxide and the endothelium: history and impact on cardiovascular disease. Vascul Pharmacol 2006; 45 : 268-276.
11. Bivalacqua TJ, Usta MF, Champion HC et al. Gene transfer of endothelial nitric oxide synthase partially restores nitric oxide synthesis and erectile function in streptozotocin diabetic rats. J Urol 2003; 169 : 1911-1917.
12. Bivalacqua TJ, Usta MF, Champion HC et al. Effect of combination endothelial nitric oxide synthase gene therapy and sildenafil on erectile function in diabetic rats. Int J Impot Res 2004; 16 : 21-29.
13. Davila HH, Magee TR, Vernet D et al. Gene transfer of inducible nitric oxide synthase complementary DNA regresses the fibrotic plaque in an animal model of Peyronie´s disease. Biol Reprod 2004; 71 : 146-151.
14. Gonzales-Cadavid NF, Burnstock G, Magee TR et al. Expression of penile neuronal nitric oxide synthase variants in the rat and mouse penile nerves. Biol Reprod 2000; 63 : 704-714.
15. Xie Y, Garbar C, Ng C et al. Effect of long-term passive smoking on erectile function and penile nitric oxide synthase in the rat. J Urol 1997; 157 : 1121-1126.
16. Christ GJ. K+ channels and gap junctions in the modulation of corporal smooth muscle tone. Drug News Perspect 2000; 13 : 28-36.
17. Christ GJ, Melman A. The application of gene therapy to the treatment of erectile dysfunction. Int J Impot Res 1998; 10 : 111-112.
18. Christ GJ, Day N, Santizo C et al. Intracorporal injection of hSlo cDNA restores erectile capacity in STZ-diabetic F-344 rats in vivo. Am J Physiol Heart Circ Physiol 2004; 287 : 1544-1553.
19. Melman A, Bar-Chama N, McCullough A et al. The first human trial for gene transfer therapy for the treatment of erectile dysfunction: preliminary results. Eur Urol 2005; 48 : 314-318.
20. Melman A, Bar-Chama N, McCullough A et al. hMaxi-K gene transfer in males with erectile dysfunction: results of the first human trial. Hum Gene Ther 2006; 17 : 1165-1176.
21. Gholami SS, Rogers R, Chang J et al. The effect of vascular endothelial growth factor and adeno-associated virus mediated brain derived neurotrophic factor on neurogenic and vasculogenic erectile dysfunction induced by hyperlipidemia. J Urol 2003; 169 : 1577-1581.
22. Rogers RS, Graziottin TM, Lin CS et al. Intracavernosal vascular endothelial growth factor (VEGF) injection and adeno-associated virus-mediated VEGF gene therapy prevent and reverse venogenic erectile dysfunction in rats. Int J Impot Res 2003; 15 : 26-37.
23. Seftel A. Intracavernosal vascular endothelial growth factor (VEGF) injection and adeno-associated virus-mediated VEGF gene therapy and reverse venogenic erectile dysfunction in rats. J Urol 2003; 170 : 681.
24. Cormio L, Gesualdo L, Maiorano E et al. Vasoactive intestinal polypeptide (VIP) is not an androgen-dependent neuromediator of penile erection. Int J Impot Res 2005; 17 : 23-26.
25. Champion HC, Wang R, Santiago JA et al. Comparison of responses to adrenomedullin and calcitonin gene-related peptide in the feline erection model. J Androl 1997; 18 : 513-521.
26. Moore CR, Wang R. Pathophysiology and treatment of diabetic erectile dysfunction. Asian J Androl 2006; 8 : 675-684.
27. Jin L, Liu T, Lagoda GA et al. Elevated RhoA/Rho-kinase activity in the aged rat penis: mechanism for age-associated erectile dysfunction. Faseb J 2006; 20 : 536-538.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2007 Číslo 3- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Ze zahraničních periodik
- Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
- Kvíz
- Výsledky vyšetření mikrodelecí oblasti AZF(Yq) u mužů s reprodukčními problémy
- Klinická anatomie sulcus nervi dorsalis penis/clitoridis
- Mužská antikoncepce
- Genová terapie – nová naděje v léčbě erektilní dysfunkce?
- Editorial
- Stárnoucí muž, hormonální a genetické změny
- Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
- Rehabilitace erektilní funkce po radikální prostatektomii
- Peyronieho choroba: kontroverzní přístup k terapii Modelace penisu s inflatabilní protézou se stala zlatým standardem léčby Peyronieho choroby
- Vliv endokrinních disruptorů na fertilitu savců
- Erektilní dysfunkce po radikální prostatektomii
- Změny spermiogramu v závislosti na stupni varikokély
- Pracovní výjezdní zasedání Andrologické sekce České urologické společnosti Jana Evangelisty Purkyně v New Yorku 13.–16. 9. 2007
- Druhý Český a mezinárodní andrologický kongres v České republice
-
Druhý Český a mezinárodní andrologický kongres v České republice
Abstrakta
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Erektilní dysfunkce po radikální prostatektomii
- Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
- Mužská antikoncepce
- Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



