-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Interfant 99 – léčebná studie zohledňující odlišnou biologii akutní lymfoblastické leukemie kojenců a její výsledky v České republice
Interfant 99 – treatment reflecting unique biology of the infant acute lymphoblastic leukemia. The results in the Czech Republic
Acute lymphoblastic leukemia (ALL) affecting infants is a rare malignancy with the biological behavior different from the leukemia of older children. About 80% infants have a rearrangement of the MLL gene at the chromosomal locus 11q23. The most frequent abnormality is the t(4;11)(q21;q23) translocation producing the MLL-AF4 fusion gene. The MLL+ ALL originates usually in the immature B-cell precursors with aberrant expression of myeloid antigens. It is characterized by hyperleukocytosis, poor initial treatment response and high risk of the early relapse. Treatment results are significantly worse than in older children. Current protocols usually combine elements used in the therapy of both lymphoid and myeloid acute leukemias. Between 1990 and 1999, twenty-one infants were diagnosed with ALL in the Czech Republic and only 6 of them were treated according to a protocol designed specifically for the infants. Five-years event-free survival (EFS) was 33 %, only one out of the ten children with MLL-AF4 fusion gene was cured. Between 2000 and 2005, fourteen infants were diagnosed with ALL and 13 of them were treated in the international randomized study Interfant 99. Ten children bear an MLL rearrangement, most frequently the t(4;11) in 6 of them. Flow cytometry showed pro-B ALL immunophenotype in nine patients, pre-B ALL in two cases and two children were diagnosed as T-ALL (unusual in the infant age) with complex karyotype. Ten children had WBC ≥ 50 000/μl, 7 infants were younger than 6 months at diagnosis. Twelve children achieved complete remission. Two children with a poor early treatment response were stratified into the high risk group, all others into the standard risk group. Seven children suffered from relapse and one child developed secondary malignancy. Altogether, 7 children are alive, four of them in the first remission. Five children underwent 7 stem cell transplantations from the unrelated (n = 6) or HLA identical donor (n = 1) (only one of them in the first remission). Five-years EFS of 482 patients enrolled in the international study Interfant 99 is 46% and overall survival 55% showing the improvement in comparison with majority of the previous studies.
Key words:
acute lymphoblastic leukemia, infants, Interfant 99 study, MLL rearrangement, t(4;11) translocation
Autoři: J. Starý 1; V. Vávra 1; J. Zuna 1; P. Sedláček 1; V. Mihál 2; J. Štěrba 3; K. Toušovská 4; D. Pospíšilová 2; D. Mendelová 3; J. Hak 4; P. Smíšek 1; O. Hrušák 1; E. Mejstříková 1; Z. Zemanová 5; K. Michalová 5; M. Jarošová 6; A. Oltová 7; P. Gajdoš 1; R. Formánková 1; P. Keslová 1; Y. Jabali 8; B. Blažek 9; Z. Černá 10; D. Procházková 11; K. Kramarzová 1; A. Vrzalová 1; J. Housková 12; J. Trka 1
Působiště autorů: Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha, 2Dětská klinika LF UP a FN Olomouc, 3Klinika dětské onkologie FN Brno, 4Dětská klinika FN Hradec Králové, 5Centrum nádorové cytogenetiky, Ústav klinické biochemie a laboratorní diagnostiky 1
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 2, p. 83-90.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Akutní lymfoblastická leukemie (ALL) postihující kojence je vzácné onemocnění s biologickým chováním odlišným od ALL dětí starších jednoho roku. Osmdesát procent kojenců má přestavbu genu MLL v oblasti 11q23, nejčastější abnormalitou je translokace t(4;11)(q21;q23) s fúzním genem MLL-AF4. MLL+ ALL vzniká většinou ve velmi nezralých prekurzorech B lymfatické řady (BCP), nese současně myeloidní znaky, má častěji hyperleukocytózu, horší iniciální odpověď na léčbu a vysoké riziko časného relapsu. Důsledkem jsou významně horší výsledky léčby než u starších dětí a snaha konstruovat léčebné protokoly kombinující léky účinné u lymfatických i myeloidních leukemií. V letech 1990–99 byla v ČR diagnostikována ALL u 21 kojenců, z nichž pouze 6 bylo léčeno protokoly zohledňujícími odlišnost kojenecké ALL. Pětiletý EFS celé skupiny byl 33 %, z deseti dětí s MLL-AF4+ ALL bylo vyléčeno jediné. V období 2000–2005 jsme diagnostikovali ALL u 14 kojenců a 13 z nich jsme léčili v mezinárodní randomizované studii INTERFANT 99. Deset dětí mělo přestavbu MLL genu, nejčastější translokací byla t(4;11) u 6 z nich. Dvě děti měly v kojeneckém věku neobvyklou T-ALL s komplexními změnami karyotypu, 9 dětí CD10 negativní pro-B ALL a dva pacienti pre-B ALL. Leukocyty nad 50 000/μl mělo 10 dětí, sedm dětí bylo při diagnóze mladších 6 měsíců. Kompletní remise byla dosažena u 12 dětí. Dvě děti měly špatnou iniciální odpověď na léčbu a byly zařazeny do vysokého rizika. Sedm dětí prodělalo relaps nemoci, v první remisi žijí čtyři pacienti a celkem žije 7 dětí. Pět dětí podstoupilo celkem sedm transplantací kostní dřeně od nepříbuzného dárce (N = 6) nebo HLA identického sourozence (N = 1) (pouze jedno v první remisi). Pětiletý EFS 482 pacientů zařazených do studie Interfant 99 je 46 % a přežití 55 %, což znamená zlepšení proti výsledkům většiny předchozích studií. Hledání optimálního léčebného přístupu k ALL kojenců není u konce, nová studie INTERFANT 06 navazuje na současný protokol s cílem výsledky léčby dále zlepšit.
Klíčová slova:
akutní lymfoblastická leukemie, kojenci, studie Interfant 99, MLL přestavba, t(4;11)Akutní lymfoblastická leukemie (ALL) má u kojenců mladších jednoho roku života odlišnou biologii než stejné onemocnění starších dětí a rovněž odlišné, významně horší, výsledky léčby. Kojenci mají při diagnóze velkou nádorovou masu v organismu, projevující se významnou leukocytózou a hepatosplenomegalií. Rovněž iniciální výskyt leukemické infiltrace mozku je častější než u dětí starších. Nejčastějším fenotypem (v 70 % případů) kojenecké ALL je pro-B ALL, leukemie z nezralých B prekurzorů, postrádajících CALLA (CD10) antigen, s častým výskytem myeloidních znaků CD15 a CDw65. S tímto fenotypem se sdružuje typický genotyp kojenecké ALL, charakterizovaný přestavbou genu MLL (mixed-lineage leukemia) na dlouhých ramenech chromozomu 11 (11q23) (80 % případů kojenecké ALL). Nejčastějším partnerem promiskuitního genu MLL je gen AF4. Tato fúze je produktem translokace t(4;11)(q21;q23), postihující 40–50 % kojenců s ALL. Následují translokace t(11;19)(q23;p13.1) (fúzní gen MLL-ENL) ve 20 % a t(9;11)(p22;q23) (MLL-AF9) u 10 % dětí. Výskyt MLL přestaveb je nejvyšší v prvních měsících života a klesá s věkem (roční děti mají výskyt MLL-AF4 v 10 %, děti mezi 1–15 lety ve 2 %) (1–4). Leukemie s MLL přestavbou má specifický genový expresní profil při vyšetření DNA microarray metodou (5).
Není pochyb o tom, že k přestavbě MLL genu, jejímž důsledkem jsou zmíněné fúze a jejich produkty-onko - proteiny, dochází in utero (6, 7). Zatímco „preleukemická“ perioda jiné leukemie charakterizované iniciálním poškozením prekurzoru lymfocytu v děloze, ALL s fúzí TEL-AML1, trvá několik let (průměrný věk při diagnóze 2–5 let), trvá období latence u kojeneckých MLL+ ALL pouze několik měsíců (8, 9, 10). Ve srovnání s TEL-AML1 pozitivní ALL dochází tedy u MLL+ kojeneckých ALL zřejmě k rychlejšímu výskytu dalšího poškození DNA, nutného k rozvoji leukemie. Na rozdíl od fúzního genu TEL-AML1 nebyl gen MLL-AF4 nalezen v pupečníkové krvi zdravých novorozenců (11). Za látky indukující in utero přestavbu MLL genu jsou považovány inhibitory topoizomerázy II. Jedná se nejčastěji o flavonoidy obsažené v ovoci, zelenině i dalších potravinách, pesticidy, insekticidy. Protože proliferující buňky obsahují vyšší hladinu topoizomerázy II ve srovnání s buňkami klidovými, může tak být plod (procházející obdobími rychlého buněčného obratu) citlivější vůči inhibitorům tohoto enzymu v okolním prostředí a v potravě než dospělý (12, 13, 14). Lékové inhibitory topoizomerázy II etoposid a antracykliny jsou původci sekundárních leukemií s přestavbou MLL genu, jejichž období latence je však ve srovnání s kojeneckou leukemií delší (zpravidla 1,5 až 2 roky).
Léčba kojenecké ALL dosahuje podstatně horších výsledků než u starších dětí. V druhé polovině 80. a první polovině 90. let dosáhly nejlepších výsledků protokoly bostonského pracoviště Dana Farber Cancer Institute (4letá pravděpodobnost přežití bez selhání (= event-free-survival, EFS) 54 %, n = 23 dětí) a německý protokol ALL-BFM 90 (6letý EFS 43 %, n = 105) (15, 16). Výsledky ostatních studií byly horší. Šance na vyléčení dětí s translokací t(4;11) dosahovala maximálně 30 %. V České republice dosáhla skupina 28 kojenců léčených v letech 1985–95 podle protokolů BFM 83 a 90 5letý EFS 25 % (17). Americký protokol POG 9407, vyvinutý cíleně pro léčbu kojenecké leukemie, byl v České republice aplikován v letech 1997–99. Z pěti dětí bylo vyléčeno jediné. Pětiletý EFS deseti dětí diagnostikovaných v devadesátých letech s translokací t(4;11) byl 10 % (18).
Mezinárodní studie Interfant 99 nabídla specifický „hybridní“ protokol, zohledňující biologii kojenecké leukemie (která zpravidla vzniká ve velmi nezralém progenitoru s částečně zachovanou schopností lymfoidní i myeloidní diferenciace) a kombinující proto nejúčinnější léčebné postupy protokolů léčby ALL i akutní myeloidní leukemie (AML). K mezinárodnímu konsorciu „Interfant 99“ tvořenému národními leukemickými skupinami z Holandska, Německa, Velké Británie, Itálie, skandinávských zemí, Belgie, Rakouska, Argentiny, Chile, Hong Kongu, Polska a dvou velkých amerických center (St Jude Research Hospital v Memphisu a Dana Farber Cancer Institute v Bostonu) se rozhodnutím Pracovní skupiny dětské hematologie přidala i Česká republika.
PACIENTI A METODY
Studie Interfant 99 proběhla v České republice v období 1. 1. 2000–31. 12. 2005, první pacient byl zařazen 23. 11. 2000, poslední 5. 8. 2005. Mezinárodní studie se uskutečnila od května 1999 do 31. 12. 2005. Centrální databáze pacientů se nacházela v italské Monze, randomizace se uskutečnila v Národním centru studie v Motole. Do studie byly zařazeny děti s ALL mladší jednoho roku při diagnóze.
Morfologické a cytogenetické vyšetření leukemického klonu při diagnóze bylo provedeno v jednotlivých centrech podle zaběhlých postupů. Imunofenotyp byl ověřen centrálně v laboratoři průtokové cytometrie UK 2. LF a FN Motol. Imunologické podskupiny byly definovány podle kritérií EGIL následovně: pro-B ALL: TdT+, CD19+, CD10, cyIgM-, sIg-; common (c) ALL: TdT+, CD19+, CD10+, cyIgM-, sIg-; pre-B ALL: TdT+, CD19+, CD10+/-, cyIgM+, sIg-; T-ALL: TdT+, cyCD3+, CD7+ (19). U všech pacientů bylo v cytogenetických laboratořích provedeno vyšetření přestavby MLL genu pomocí metody FISH (20). Molekulární screening fúzního genu MLL-AF4 byl uskutečněn v molekulární laboratoři Kliniky dětské hematologie a onkologie UK 2. LF a FN Motol. Zde byli rovněž pacienti s MLL přestavbou vyšetřeni multiplex PCR za účelem nalezení partnerského genu (21).
Schéma protokolu Interfant 99 se nachází v tabulce 1 a na obrázku 1. Pacienti byli rozděleni do rizikových skupin podle odpovědi na týden trvající prednizonovou předfázi (a jednu intratekální aplikaci MTX). Pokles blastů pod 1000/μl krve je řadil do standardního rizika (SR), 1000 blastů/μl do vysokého rizika (HR). V obou rizikových skupinách byla po 3 blocích chemoterapie (Indukce, MARAM, OCTADD) léčba randomizována. U standardního rizika byl léčebný blok VIMARAM (viz tab. 1) randomizován s udržovací léčbou 1B, která trvala 6 měsíců, obsahovala 6-MP + MTX per os a tři reindukce Dexametason + Vinkristin + MTX/AraC IT. U vysokého rizika byl blok VIMARAM randomizován s udržovací léčbou 1A, která trvala rovněž 6 měsíců a obsahovala 6-MP + MTX per os s třemi pulsy Dexametason + Vinkristin + MTX/AraC IT a třemi pulsy AraC 1 g/m2 + etoposid. Pro obě rizikové skupiny následovala udržovací chemoterapie 6-MP + MTX per os do celkového trvání léčby 2 roky. Pacienti vysokého rizika byli indikováni k alogenní transplantaci po třetím bloku chemoterapie (OCTADD), byl-li v rodině nalezen HLA identický sourozenec. Preventivní ozáření CNS v tomto protokolu nebylo prováděno. U dětí mladších 6 měsíců byly podány 2/3 dávky vypočtené na povrch těla, u dětí ve věku 6–12 měsíců 3/4 dávky a u starších 12 měsíců plná dávka cytostatika.
Tab. 1. Protokol Interfant 99 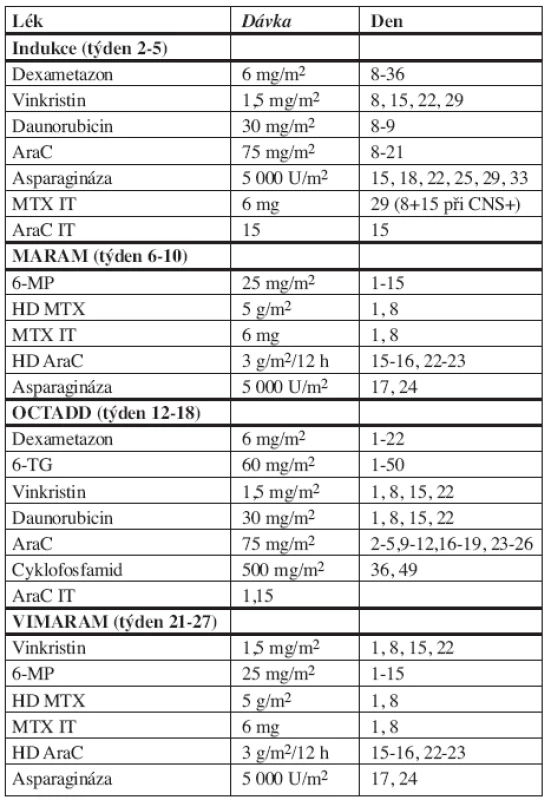
Vysvětlivky: AraC = cytosin arabinosid, IT = intratekální aplikace, MTX = metotrexát, 6-MP = merkaptopurin, HD MTX = vysokodávkovaný MTX, HD AraC = vysokodávkovaný AraC, 6-TG = thioguanin Obr. 1. Schéma protokolu Interfant 99. 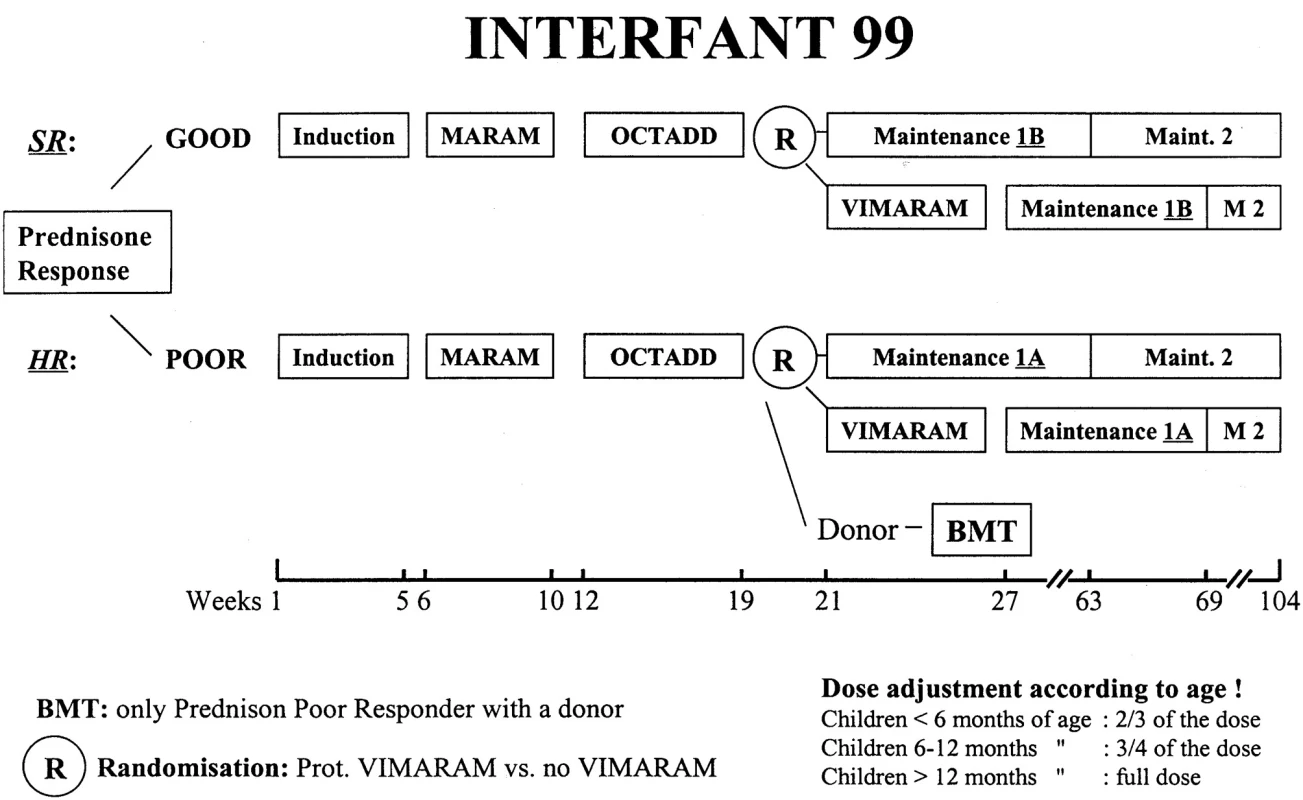
Statistická analýza: Křivky přežití byly konstruovány podle metody Kaplana-Meiera a rozdíly byly počítány pomocí testu log-rank (22, 23). Pro stanovení přežití do selhání (EFS) byly jako selhání hodnoceny smrt v indukci, nedosažení remise (non-responder), smrt v remisi, relaps nebo sekundární malignita.
Výsledky léčby byly vyhodnoceny k 30. 6. 2008 a minimální doba sledování byla 2,9 roku.
Výsledky
V období 6 let trvání studie Interfant 99 (2000–2005) bylo v České republice diagnostikováno 14 dětí mladších jednoho roku s ALL a 13 z nich bylo zařazeno do studie. Jedno dítě s vrozenou leukemií a velikou nádorovou masou zemřelo několik hodin po porodu za projevů leukostázy v plicích a CNS a léčba leukemie nebyla zahájena. Fenotyp leukemie byl pro-B, cytogenetické vyšetření prokázalo komplexní změny karyotypu s přestavbou 11q23. Ročně jsou tedy v České republice diagnostikováni dva až tři kojenci s ALL.
Charakteristika souboru 13 pacientů léčených ve studii Interfant 99 je v tabulce 2. Převahu měli chlapci, 7 dětí bylo při diagnóze mladších 6 měsíců (jedno dítě s leukemií diagnostikovanou ihned po narození, dvě diagnostikované ve 3. a 5. týdnu života, dvě ve 3 měsících, jedno ve 4. a jedno v pátém měsíci života). Sedmdesát procent dětí mělo pro-B leukemii a 77 % přestavbu genu MLL (všech 7 dětí mladších 6 měsíců a 3 ze 6 dětí starších 6 měsíců při diagnóze). Přestavbu genu MLL mělo všech 9 dětí s pro-B leukemií a jedno ze dvou dětí s pre-B leukemií. Nejčastější translokací byla t(4;11) u 46 % všech pacientů a 60 % dětí s přestavbou genu MLL. Jedno dítě mělo komplexní translokaci t(4;11;18), která produkovala atypickou variantu fúzního genu MLL-AF4 se zlomem v intronu 10 genu AF4. Obě děti s T-ALL měly komplexní cytogenetické změny bez přestavby genu MLL. Detailní popis jejich karyotypu je v tabulce 2. Pacient A měl 3 kopie genu MLL (nadpočetná kopie byla v rámci komplexních přestaveb insertována do chromozomu 22), pacientka B měla celý gen MLL translokován na chromozom 5.
Tab. 2. Charakteristika souboru. 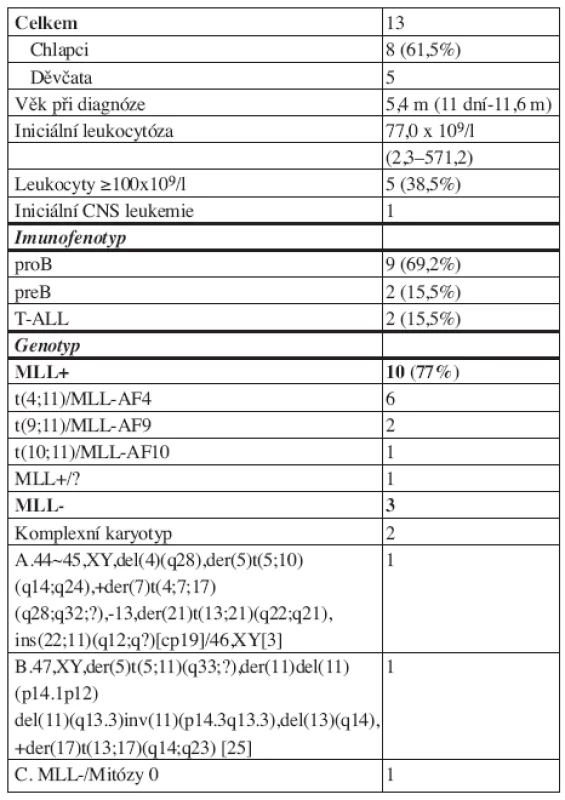
Děti byly léčeny ve čtyřech centrech. Deset z nich bylo zařazeno do standardního rizika (SR), protože měly dobrou odpověď na prednizonovou předfázi, dvě děti byly léčeny ve vysokém riziku (HR) pro špatnou odpověď na iniciální fázi léčby. Jedno dítě zemřelo čtvrtý den léčby na krvácení do mozku při progresi leukemie a kombinované sepsi E. coli a Candida albicans. Léčebná odpověď na prednizonovou předfázi tak u něj nemohla být hodnocena. Kompletní remisi dosáhlo 12 ze 13 dětí (92,3 %). Pět dětí s velkou nádorovou masou při diagnóze prodělalo v indukci urátovou nefropatii. Dvě děti s renálním selháním potřebovaly hemodialýzu, třem dětem byla podána urát-oxidáza a renální selhání nevyvinuly. Žádné dítě nezemřelo na toxicitu léčby v remisi. Relaps prodělalo 7 dětí (58 % pacientů, kteří dosáhli remise). Ve čtyřech případech se jednalo o izolovaný relaps v kostní dřeni, u dvou pacientů o kombinovaný relaps v kostní dřeni a CNS a u jednoho o izolovaný testikulární relaps. Medián vzniku relapsu od diagnózy byl 1,5 roku (7–32 měsíců). Jeden chlapec s T-ALL vyvinul 21 měsíců od diagnózy sekundární akutní monocytární leukemii M5 dle FAB klasifikace s cytogenetickým průkazem odlišného klonu. Této komplikaci podlehl. Celkem žije 7 dětí (v první remisi 4, ve druhé remisi 3). Výsledky léčby jsou shrnuty v tabulce 3.
Tab. 3. Výsledky léčby. 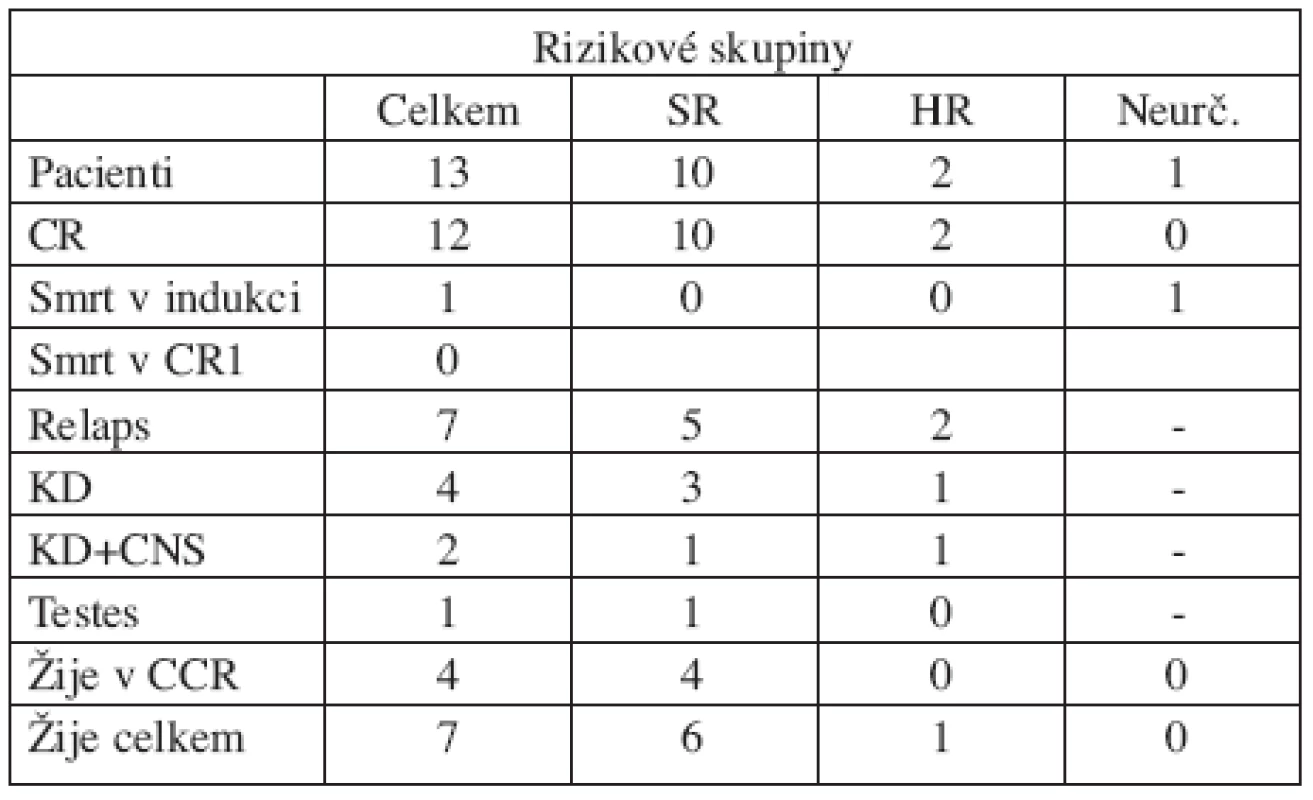
Vysvětlivky: CR=dosažení remise, CR1=první remise, KD=kostní dřeň, KD+CNS=kombinovaný relaps v kostní dřeni a centrálním nervovém systému, Testes=leukemická infiltrace testes, CCR=první kontinuální remise Pětiletý EFS celé skupiny 13 dětí je 30,8% (SE 13,1%) a pravděpodobnost celkového přežití (OS) 51,3% (SE 15,4%) (graf 1). Medián doby sledování souboru je 6,1 roku (2,9–7,6 roku). Hodnocení výsledků léčby jednorozměrnou analýzou v jednotlivých podskupinách souboru je v tabulce 4. V žádné z analyzovaných kategorií nebyl zaznamenán statisticky významný rozdíl ve výsledcích léčby. Malé počty pacientů jistě měly na tuto analýzu vliv. Z 6 dětí s t(4;11) žijí 3, z toho 2 v první remisi.
Tab. 4. Prognostické faktory a EFS/OS. 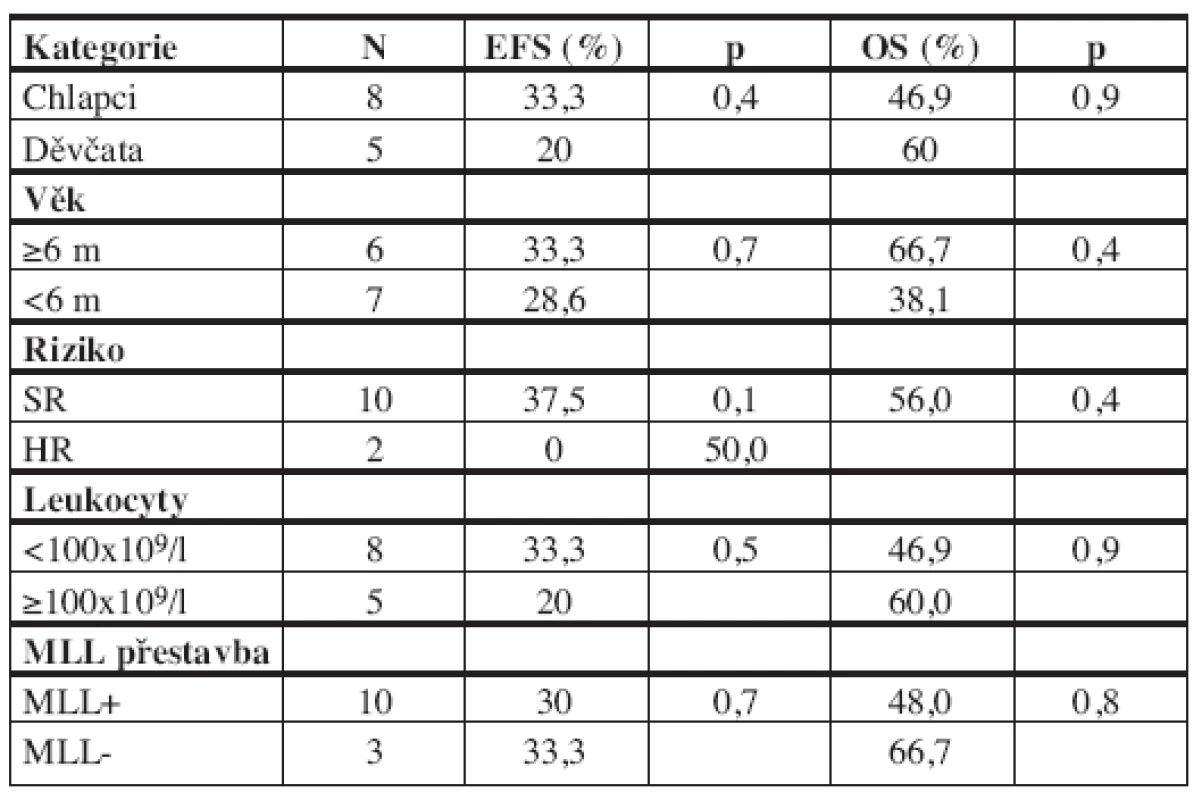
Graf 1. Přežití do selhání (EFS) a celkové přežití (OS) celé skupiny pacientů (N=13). 
V první remisi podstoupilo alogenní transplantaci kostní dřeně jediné dítě s T-ALL a iniciální pomalou odpovědí na léčbu (špatná odpověď na prednizonovou předfázi, non-responder v kostní dřeni po skončení indukce). Dárcem byl HLA identický nepříbuzný dárce, přípravným režimem kombinace busulfan + cyklofosfamid + vepesid. Pacientka prodělala 13 měsíců po transplantaci dřeňový relaps, absolvovala druhou transplantaci od stejného dárce v druhé remisi po přípravném režimu s celotělovým ozářením a žije v remisi 3,5 roku od transplantace. Ze 7 dětí s relapsem ALL (včetně výše uvedené pacientky) dosáhlo druhé remise 6 dětí (jeden non-responder zemřel). Jeden pacient prodělal další relaps ještě před plánovanou alogenní transplantací a zemřel. Pět dětí podstoupilo alogenní transplantaci v druhé remisi, dárcem byl v jednom případě HLA identický sourozenec a u 4 dětí nepříbuzný dárce z registru. Přípravným režimem byla ve třech případech kombinace busulfan+cyklofosfamid+melfalan, v jednom případě busulfan+cyklofosfamid+vepesid a celotělové ozáření v kombinaci s vepesidem. Jedno dítě zemřelo krátce po transplantaci na sepsi Pseudomonas aeriginosa, jedno (pacient s vrozenou leukemií diagnostikovanou ihned po porodu) prodělalo 12 měsíců po transplantaci relaps, absolvovalo druhou nepříbuznou transplantaci od jiného dárce v třetí remisi po přípravném režimu s celotělovým ozářením a vepesidem a osm měsíců po transplantaci prodělalo další relaps a zemřelo. Tři děti (43 %) žijí v remisi.
Diskuse
Cílem studie Interfant 99 bylo zlepšit nepříznivé výsledky léčby kojenecké ALL při zohlednění její specifické biologie. Leukemické blasty kojenců s MLL přestavbou jsou ve studiích lékové rezistence in vitro významně rezistentnější vůči prednizonu a asparagináze, ale signifikantně citlivější vůči AraC než blasty starších dětí (24). Zatímco u dětí starších jednoho roku tvoří v BFM protokolech špatní respondeři na prednizonovou předfázi 10 % pacientů, u kojeneckých leukemií je to 30 % a jejich prognóza je významně horší než u kojenců na prednizonovou předfázi dobře odpovídajících (16). Nejúspěšnější protokoly léčby kojenecké leukemie devadesátých let obsahovaly v případě BFM protokolů vysokodávkovaný MTX 5 g/m2 a kombinaci vysokodávkovaného AraC a MTX v případě protokolů Dana Farber (15, 16). Interfant 99 je hybridním protokolem kombinujícím prvky léčby protokolů ALL i AML. Klasická indukce ALL studií složená ze 4 léků (dexametazon, vinkristin, daunorubicin a asparagináza) byla doplněna o AraC podávaný nejen IV, ale i IT (spolu s MTX). Konsolidace MARAM obsahovala kombinaci dvou dávek vysokodávkovaného MTX a AraC. Reindukce OCTADD byla modifikovanou konsolidací AML-BFM protokolů. Pozdní intenzifikace VIMARAM (vinkristinem doplněný MARAM) neprokázala v randomizované studii výhodu proti udržovací léčbě posílené o pulsy dexametazonu a vinkristinu, event. pro HR skupinu v kombinaci se střední dávkou AraC a etoposidem.
Výsledky mezinárodní studie Interfant 99 byly publikovány (25). Do studie bylo zařazeno 482 dětí, z nichž 31 % bylo klasifikováno do vysokého rizika, 62 % mělo pro-B leukemii a 80 % přestavbu genu MLL. Remisi dosáhlo 94 % pacientů, 5 % zemřelo v remisi a 40 % prodělalo relaps s mediánem vzniku 8 měsíců od diagnózy. Pětiletý EFS celé skupiny byl 46 %, OS 55,2 %. Děti standardního rizika dosáhly EFS 54,4 %, děti vysokého rizika 30,5 %. Dalšími nepříznivými faktory byly věk při diagnóze pod 3 měsíce (EFS 28 %), 3–6 měsíců (EFS 38 %), leukocytóza ≥ 300x109/l (EFS 25 %), pro-B fenotyp (EFS 38 %), přestavba genu MLL (EFS 35 %), přičemž nebyl rozdíl ve výsledcích léčby dětí s t(4;11) a jinými translokacemi postihujícími gen MLL. Naopak nejlepších výsledků bylo dosaženo u dětí ve věku 9–12 měsíců (EFS 64 %), BCP ALL CD10 pozitivní (EFS 59,4 %) a MLL negativní (EFS 75 %). Starší věk, CALLA pozitivní fenotyp a nepřítomnost MLL přestavby se většinou spojovaly u konkrétního pacienta. Ze skupiny vysokého rizika podstoupilo 41 dětí alogenní transplantaci kostní dřeně v první remisi. EFS 50,2 % transplantovaných pacientů nebyl po zohlednění čekací doby na zákrok významně lepší než dětí léčených pouze chemoterapií (EFS 37,4 %; p = 0,19) (R. Pieters, ústní sdělení). Ze 76 dětí s relapsem leukemie, které obdržely kurativní léčbu, dosáhlo remise 87 % s pravděpodobností přežití 36,5 % jeden rok od diagnózy relapsu. Po transplantaci žilo jeden rok 60 % dětí, po chemoterapii 15 %.
Výsledky léčby našich pacientů jsou v souladu s výsledky celkovými při zohlednění rizika analýzy malého počtu pacientů. Úspěšnost v dosažení remise byla stejná jako v mezinárodní studii, žádný náš pacient nezemřel v remisi. Úspěšné provedení pacientů časnou fází léčby není při jejich často vysoké nádorové mase v organismu snadné, jak ukazuje potřeba hemodialýzy u dvou dětí. Zásadní zlepšení průběhu urátové neuropatie přineslo použití rekombinantní urát-oxidázy zavedené do klinického použití v průběhu studie. Jediné dítě s CALLA pozitivní leukemií z B prekurzorů bez MLL přestavby žije v první remisi. Dvě děti s T-ALL v našem souboru je velmi neobvykle vysoké zastoupení fenotypu, který se vyskytuje u kojenců výjimečně (mezinárodní studie 4 % dětí). Jejich věk při diagnóze (7 a 11 měsíců) je v souladu s pozorováním, že pokud se tento fenotyp v kojeneckém věku vyskytne, pak u starších dětí. Obě děti měly komplexní změny karyotypu bez MLL přestavby. Jedno z nich vyvinulo sekundární AML – jedinou sekundární malignitu v celém souboru 482 dětí mezinárodní studie! Druhá pacientka žije v druhé remisi po dvou alogenních transplantacích kostní dřeně. Ze 7 dětí mladších 6 měsíců při diagnóze žijí 3, z 10 dětí s MLL přestavbou žije 5, z toho 4 v první remisi. V devadesátých letech v ČR na předchozích protokolech léčby z deseti pacientů s prokázanou MLL přestavbou přežil jediný. Ze sedmi dětí s relapsem tři žijí (43 %), všichni po transplantaci kostní dřeně. V devadesátých letech nepřežil v ČR žádný pacient s relapsem. Léčba relapsu kojenecké leukemie transplantací kostní dřeně dává části pacientů šanci na vyléčení.
Studie Interfant 99 dosáhla srovnatelných, nikoliv však lepších výsledků než německá ALL-BFM 90 a americká Dana Farber Cancer Institute Consortium uskutečněné v první polovině devadesátých let. Pro většinu účastníků se jednalo o zlepšení výsledků léčby ve srovnání se studiemi minulými. V druhé polovině devadesátých let byly realizovány a publikovány dvě velké národní studie – americká a japonská. V americké studii COG 1953 bylo léčeno 115 kojenců, z nichž 79 mělo MLL přestavbu. Léčba obsahovala vysokodávkovaný MTX i AraC, úspěšnost v dosažení remise byla pouze 82,5 %, EFS byl 41,7 % a OS 44,8 %. Pětiletý EFS dětí s MLL přestavbou byl 33,6 % (26). V japonské studii byli všichni pacienti s MLL přestavbou indikováni k alogenní transplantaci krvetvorných buněk (často pupečníkové krve) v první remisi po přípravném režimu s celotělovým ozářením. Tříletý EFS/OS 44 dětí s MLL přestavbou byl 43,5 %/58,2 %, 11 dětí prodělalo před transplantací relaps, nejhorších výsledků bylo dosaženo u dětí mladších 6 měsíců s leukocytózou ≥ 100,0 x 109/l (EFS 9,4 %) (27). Delší doba sledování prokázala vysoký výskyt pozdních následků léčby dětí podstoupivších v kojeneckém věku transplantaci po celotělovém ozáření (porucha růstu, kognitivní deficity, pohlavní vývoj ještě hodnocen být nemohl) (28). Děti bez přestavby genu MLL byly léčeny pouze chemoterapií s velmi dobrými výsledky (EFS 95 %; n = 22) (29).
Interfant 99 ani další protokoly používané ve druhé polovině devadesátých let tedy nepřinesly zásadní zlepšení prognózy kojenců s ALL. Jaké jsou perspektivy léčby tohoto vzácného onemocnění, tvořícího 5 % všech ALL v dětském věku, na počátku 21. století? Interfant 99 poskytl kojencům léčbu s relativně nízkými kumulativními dávkami tří léků účinných v terapii ALL, které však mají u dětí zvýšené riziko pozdních následků. Kumulativní dávka antracyklinů byla pro děti standardního i vysokého rizika 120–165 mg/m2, cyklofosfamidu 600–1000 mg/m2 a etoposidu pro vysoké riziko 480–720 mg/m2. Pozdní následky chemoterapie nejsou při dlouhodobém sledování u kojenců častější než u starších dětí. Je otázkou, zdali v situaci neuspokojivých výsledků léčby pro 80 % dětí s kojeneckou leukemií není na místě kumulativní dávku těchto účinných léků zvýšit. Většina současných protokolů léčby kojenecké leukemie redukuje jednotlivé dávky cytostatik ve srovnání se staršími dětmi. Interfant dává dětem mladším 6 měsíců 2/3 dávky, dětem ve věku 6–12 měsíců 3/4 vypočtené dávky chemoterapie. Farmakokinetické studie odůvodňující tuto redukci dávky kojencům chybí. V průběhu studie Interfant proběhly dvě farmakokinetické studie, kterých jsme se rovněž zúčastnili. Clearence MTX stoupá s věkem. Redukce dávky kojencům tak vede k výši hladin srovnatelné se staršími dětmi a toto doporučení není pravděpodobně nutné měnit. Za ověření stojí úvaha o individualizaci léčby – zvýšení dávky dětem, které po první dávce MTX dosáhnou podprůměrných hladin léku (30). Naopak u daunorubicinu odlišná farmakokinetika u kojenců ve srovnání se staršími dětmi prokázána nebyla a redukce dávek tak odůvodněna není (31). Farmakokinetické studie pokračují i v současné studii Interfant 06. Blasty MLL+ALL mají u kojenců vysokou expresi receptoru tyrosin kinázy Flt3,aniž by její gen byl mutován. Jedná se o nepříznivý prognostický faktor. V souboru 32 kojenců s přestavbou MLL měli pacienti s nízkou expresí EFS 71% a ti s vysokou expresí EFS 36 % (32). Lákavá možnost kombinovat v léčbě kojenců s přestavbou genu MLL chemoterapii s inhibitory Flt3 kinázy, jako je PKC412 nebo CEP-701, již vstoupila v USA do klinických studií 2. etapy (33).
Medián relapsu od diagnózy byl ve studii Interfant 99 osm měsíců. Pozdní intenzifikace VIMARAM zahájená 6 měsíců od diagnózy prognózu pacientů nezlepšila. V japonské studii MLL98 ze 42 dětí, které dosáhly remise, prodělalo 11 (26 %) relaps před transplantací kostní dřeně, ke které byly všechny indikovány. MLL přestavba se vyskytuje i u kojenců s AML, i když je méně častá, než je tomu u ALL. Nejčastějším podtypem MLL+ AML je t(9;11), která tvoří 10 % dětských AML, vyskytuje se typicky u dětí mladších 2 let a spojuje se s monocytární leukemií. Výsledky její léčby jsou v protokolech terapie AML lepší, než je tomu u MLL+ALL. Pravděpodobnost přežití přesahuje 50 % (34). Nová studie Interfant 06, zahájená i v České republice, zohledňuje většinu výše uvedených skutečností. Děti bez přestavby MLL genu (20 % pacientů) měly ve studii Interfant 99 EFS 75 %. V nové studii tvoří skupinu nízkého rizika a jejich léčba zůstává nezměněna s výjimkou posílení o BFM protokol Ib (velmi účinná měsíc trvající postindukční léčba kombinující vysokou dávku merkaptopurinu 60 mg/m2/den x 4 týdny se 4 čtyřdenními pulsy AraC v dávce 75 mg/m2/den a dvěma dávkami cyklofosfamidu (1000 mg/m2) a intratekálně podaného MTX i AraC). Pacienti vysokého rizika (25 % dětí) měli ve studii Interfant 99 EFS 20 %. Jedná se o děti s přestavbou MLL, mladší 6 měsíců s leukocytózou > 300,0 x 109/l a/nebo špatnou odpovědí na prednizonovou předfázi. V randomizované studii je u pacientů vysokého rizika srovnáván předchozí léčebný přístup posílený o protokol Ib s léčbou kombinující bloky léčby ALL (indukce, MARMA, OCTADD, udržovací léčba z Interfant 99) s léčbou AML – bloky ADE (AraC 100 mg/m2 x 20 + daunorubicin 50 mg/m2 x 3 + etoposid 100 mg/m2 x 5) a MAE (AraC 100 mg/m2 x 20 + mitoxantron 12 mg/m2 x 3 + etoposid 100 mg/m2 x 5). Kumulativní dávka antracyklinů, etoposidu i cyklofosfamidu je tak ve srovnání s protokolem Interfant 99 významně zvýšena. Všechny děti vysokého rizika jsou indikovány k transplantaci kostní dřeně v první remisi. Všichni ostatní pacienti (55 % dětí) jsou řazeni do skupiny středního rizika (ve studii Interfant 99 EFS 45 %), ve které probíhá randomizace do stejných ramen léčby jako u vysokého rizika s výjimkou indikace k transplantaci. Postindukční intenzifikace léčby má za cíl redukci výskytu časných relapsů a úspěšné dovedení pacientů nejvyššího rizika k transplantaci. Ve studii Interfant 99 bylo v první remisi transplantováno 16 dětí vysoce rizikové ALL a 9 z nich (56 %) žije v remisi s mediánem sledování 41 měsíců. Přípravný režim neobsahuje celotělové ozáření ve snaze snížit riziko pozdních následků. Mezinárodní studie Interfant 06 byla zahájena ve stejných zemích jako Interfant 99 v průběhu roku 2006.
Poděkování
Děkujeme pracovníkům laboratoří morfologie, průtokové cytometrie a cytogenetickým laboratořím jednotlivých nemocnic za provedení vstupních vyšetření při diagnóze a v relapsu. Rovněž děkujeme lékařům a sestrám jednotlivých center za péči o dětské pacienty a spolupráci při získávání klinických a laboratorních dat. Aleši Lukšovi děkujeme za technickou spolupráci na přípravě rukopisu. Studie byla částečně podpořena výzkumnými záměry MSM 0021620813, MSM 6198959216, MZO 00064203/6719, MZO VFN2005, MSM 6198959205.
Prof. MUDr. Jan Starý, DrSc.
Klinika dětské hematologie a onkologie UK 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: jan.stary@lfmotol.cuni.cz
Doručeno do redakce: 23. 2. 2009
Přijato: 27. 3. 2009
Zdroje
1. Jansen MWJC, Corral L, van der Velden VHJ, et al. Immunobiological diversity in infant acute lymphoblastic leukemia is related to the occurrence and type of MLL gene rearrangement. Leukemia 2007; 21 : 633–641.
2. Pui CH, Gaynon PS, Boyett JM, et al. Outcome of treatment in childhood acute lymphoblastic leukaemia with rearrangements of the 11q23 chromosomal region. Lancet 2002; 359 : 1909–1915.
3. Pui CH, Chessells JM, Camitta B, et al. Clinical heterogeneity in childhood acute lymphoblastic leukemia with 11q23 rearrangements. Leukemia 2003; 17 : 700–706.
4. Mann G, Cazzaniga G, van der Velden VHJ, et al. Acute lymphoblastic leukemia with t(4;11) in children 1 year and older: The „big sister“ of the infant disease? Leukemia 2007; 21 : 642–646.
5. Yeoh EJ, Ross ME, Shurtleff SA, et al. Classification, subtype discovery, and prediction of outcome in pediatric acute lymphoblastic leukemia by gene expression profilig. Cancer Cell 2002; 1 : 133–143.
6. Ford AM, Ridge SA, Cabrera ME, et al. In utero rearrangements in the trithorax-related oncogene in infant leukaemias. Nature 1993; 363 : 358–360.
7. Gale KB, Ford AM, Repp R, et al. Backtracking leukemia to birth: identification of clonotypic gene fusion sequences in neonatal blood spots. Proc Natl Acad Sci USA. 1997; 94 : 13950–13954.
8. Ford AM, Bennett CA, Price CM, et al. Fetal origins of the TEL-AM1 fusion gene in identical twins with leukemia. Proc Natl Acad Sci USA. 1998; 95 : 4584–4588.
9. Wiemels JL, Ford AM, van Wering ER, et al. Protracted and variable latency of acute lymphoblastic leukemia after TEL-AML1 gene fusion in utero. Blood 1999; 94 : 1057–1062.
10. Wiemels JL, Cazzaniga G, Daniotti M, et al. Prenatal origin of acute lymphoblastic leukaemia in children. Lancet 1999; 354 : 1499–1503.
11. Trka J, Zuna J, Hrušák O, et al. No evidence for MLL/AF4 expression in normal cord blood samples. Blood 1999; 93 : 1106–1110.
12. Eguchi M, Eguchi-Ishimae M, Knight D, et al. MLL chimeric protein activation renders cells vulnerable to chromosomal damage: an explanation for the very short latency of infant leukemia. Genes Chromosomes Cancer 2006; 45 : 754–760.
13. Alexander FE, Patheal SL, Biondi A, et al. Transplacental chemical exposure and risk of infant leukemia with MLL gene fusion. Cancer Res 2001; 61 : 2542–2546.
14. Ross JA. Dietary flavonoids and the MLL gene: a pathway to infant leukemia? PNAS 2000; 97 : 4411–4413.
15. Silvermann LB, McLean TW, Gerber RD, et al. Intensified therapy for infants with acute lymphoblastic leukema. Cancer 1997; 80 : 2285–2295.
16. Dördelmann M, Reiter A, Borkhardt A, et al. Prednisone response is the strongest predictor of treatment outcome in infant acute lymphoblastic leukemia. Blood 1999; 94 : 1209 – 1217.
17. Jabali Y, Starý J, Hak J, et al. Acute lymphoblastic leukemia in infants: a decade of experience in the Czech Republic. Med Pediatr Oncol 2000; 34 : 493–495.
18. Starý J, Gajdoš P, Trka J, et al. Akutní lymfoblastická leukemie u kojenců. Transfuze Hematol dnes 2002; 8 : 47–54.
19. European group for the immunological characterisation of leukaemias (EGIL), Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukaemias. Leukemia 1995; 9 : 1783–1786.
20. van der Burg M, Beverloo HB, Langera AW, et al. Rapid and sensitive detection of all types of MLL gene translocations with single FISH probe set. Leukemia 1999; 13 : 2107–2113.
21. Andersson A, Höglund M, Johansson B, et al. Paired multiplex reverse-transcriptase polymerase chain reaction (PMRT-PCR) analysis as a rapid and accurate diagnostic tool for the detection of MLL fusion genes in hematologic malignancies. Leukemia 2001; 15 : 1293–1300.
22. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
23. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50 : 163–170.
24. Pieters R, den Boer ML, Durian M, et al. Relation between age, immunophenotype and in vitro drug resistance in 395 children with acute lymphoblastic leukemia – implications for treatment of infants. Leukemia 1998; 12 : 1344–1348.
25. Pieters R, Schrappe M, De Lorenzo P, et al. A treatment protocol for infants younger than 1 year with acute lymphoblastic leukaemia (Interfant-99): an observational study and a multicentre randomized trial. Lancet 2007; 370 : 240–250.
26. Hilden JM, Dinndorf PA, Meerbaum SO, et al. Analysis of prognostic factors of acute lymphoblastic leukemia in infants: report on CCG 1953 from the Childrenęs Oncology Group. Blood 2006; 108 : 441–451.
27. Kosaka Y, Koh K, Kinukawa N, et al. Infant acute lymphoblastic leukemia with MLL gene rearrangements: outcome following intensive chemotherapy and hematopoietic stem cell transplantation. Blood 2004; 104 : 3527–3534.
28. Tomizawa D, Koh K, Sato T, et al. Outcome of risk-based therapy for infant acute lymphoblastic leukemia with or without an MLL gene rearrangement, with emphasis on late effects: a final report of two consecutive studies, MLL96 and MLL98, of the Japan Infant Leukemia Study Group. Leukemia 2007; 21 : 2258–2263.
29. Nagayama J, Tomizawa D, Koh K, et al. Infants with acute lymphoblastic leukemia and a germline MLL gene are highly curable with use of chemotherapy alone: results from the Japan Infant Leukemia Study Group. Blood 2006; 107 : 4663–4665.
30. Lonnerholm G, Valsecchi MG, de Lorenzo P, et al. Pharmacokinetics of high dose methotrexate in infants treated for acute lymphoblastic leukemia. Ped Blood Cancer 2009; 52 : 596–601.
31. Hempel G, Relling MV, de Rossi G, et al. Pharmacokinetics of daunorubicin and daunorubicinol in infants with leukemia treated in the Interfant 99 protocol. Ped Blood Cancer, submitted.
32. Stam RW, Schneider P, de Lorenzo P, et al. Prognostic significance of high-level Flt3 expression in MLL-rearranged infant acute lymphoblastic leukemia. Blood 2007; 110 : 2774–2775.
33. Stam RW, den Boer ML, Pieters R. Towards targeted therapy for infant acute lymphoblastic leukemia. Br J Haematol 2006; 132 : 539–551.
34. Rubnitz JE, Raimondi SC, Xin Tong, et al. Favorable impact of the t(9;11) in childhood acute myeloid leukemia. J Clin Oncol 2002; 20 : 2302–2309.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2009 Číslo 2- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Když se ve střevech děje něco nepatřičného...
- Jak naučit dítě s hemofilií aplikovat injekci? V Motole pomáhají sestrám i umělé ruce
-
Všetky články tohto čísla
- Oznámení
- Klonální evoluce u chronické lymfocytární leukemie
- Adaptorové molekuly PAG, NTAL a LAT ve fyziologických lymfocytárních prekurzorech a u dětských leukemií
- Novinky v terapii nízce rizikových nemocných s myelodysplastickým syndromem
- K životnímu jubileu prim. MUDr. Dagmar Radochové, CSc.
- Za prim. Jindřiškou Maškovou
- Recenze
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2009_05 ze dne 15. 5. 2009
- Leukémie u dojčiat
- Interfant 99 – léčebná studie zohledňující odlišnou biologii akutní lymfoblastické leukemie kojenců a její výsledky v České republice
- Rizikové faktory u chronické lymfocytární leukemie, validace flow-cytometrické detekce ZAP-70 pomocí RT-PCR a imunohistochemie
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2009_05 ze dne 15. 5. 2009
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- K životnímu jubileu prim. MUDr. Dagmar Radochové, CSc.
- Klonální evoluce u chronické lymfocytární leukemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



