-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
MikroRNA a jejich potenciál v diagnostice karcinomu ovaria: současný stav a možná budoucnost
MicroRNA and their potential in ovarian cancer diagnostics: Current state and possible future
Epithelial ovarian cancer is the most fatal gynecologic cancer. Recent studies suggest an extraovarian origin for this disease. However, there is lack of information on exact etiology of ovarian cancer, and screening markers are also lacking. Non-coding RNA, particularly microRNAs are currently intensively investigated. They may be implicated in various cellular processes and regulate the gene expression at post-transcriptional level. In carcinogenesis, they may be involved as well, e.g. as tumor suppressors, or oncogenes. There have been identified expression profiles of microRNAs for various types of samples in ovarian cancer, however no expression profile is currently available for use in clinical diagnosis of ovarian cancer. Analyses of non-invasively collected material (e.g. urine, saliva) and further analyses of serum, or blood may provide basis for establishment of better diagnostic tools. We reviewed the studies on microRNAs shown to be deregulated in ovarian cancer, and coming from tumor tissues, plasma exosomes, serum, whole blood, and differing also between recurrent vs. primary ovarian cancer tissues. Function of particular microRNA is known partially only in several cases; however, for many microRNAs an elucidation of their functional role remains the goal for future investigations. MicroRNAs thus may stand at the beginning of novel diagnostic and therapeutic tools for ovarian cancer and other malignancies.
Key words:
ovarian cancer – diagnostics of ovarian cancer – microRNA – markers of adenocarcinoma – adeno - carcinoma
Autoři: Luděk Záveský 1; Eva Jandáková 2; Milada Kohoutová 1
Působiště autorů: Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha 1; Ústav patologie LF MU a Fakultní nemocnice Brno 2
Vyšlo v časopise: Prakt Gyn 2012; 16(2-4): 59-65
Kategorie: Onkogynekologie: Přehledový článek
Souhrn
Karcinom ovaria je nejzhoubnějším gynekologickým nádorem. Nejnovější výzkumy ukazují, že v ovariální karcinogenezi hrají významnou roli extraovariální tkáně. Přesto není přesná etiologie karcinomu ovaria známa a dosud neexistuje screeningový marker pro záchyt nemoci v časném stadiu. Velká pozornost současného výzkumu je věnována nekódujícím RNA, především mikroRNA. Tyto molekuly mohou regulovat expresi genů na posttranskripční úrovni a uplatňují se v řadě buněčných procesů. V karcinogenezi se mohou uplatňovat také jako regulační faktory, např. v roli tumor-supresorů i onkogenů. U karcinomu ovaria byly identifikovány profily exprese různých mikroRNA pro různé typy vzorků. V současnosti však neexistuje konsenzuální profil exprese mikroRNA, použitelný pro klinickou diagnostiku karcinomu ovaria. Diagnostický význam exprese mikroRNA v budoucnosti vzroste s rozvojem analýz neinvazivně odebíraného materiálu (např. moči, slin) a dalších analýz séra a krve. V tomto článku uvádíme přehled deregulovaných mikroRNA, identifikovaných v recentních výzkumech karcinomu ovaria, zahrnujících tkáně, exozomy, sérum a plnou krev, a také nalezených jako deregulované u recidivujících karcinomů ovaria. U některých mikroRNA jsou určité funkce částečně známy, ale u mnohých je objasnění jejich funkce v ovariální karcinogenezi otázkou pro budoucí výzkumy. MikroRNA tak mají velký potenciál stát na počátku nových diagnostických a terapeutických postupů u karcinomu ovaria i jiných nádorových onemocnění.
Klíčová slova:
karcinom ovaria – diagnostika karcinomu ovaria – mikroRNA – markery adenokarcinomu – adeno-karcinomCharakteristika karcinomu ovaria
Mezi gynekologickými nádory představuje karcinom ovaria specifickou skupinu heterogenních nádorů.
Hlavními histologickými typy karcinomu ovaria jsou
- karcinom serózní (> 50 % případů)
- endometrioidní (cca 25 %)
- mucinózní (cca 10 %)
- světlobuněčný (cca 4–12 %)
Jednotlivé typy se patrně liší svým původem. Předpokládá se, že high-grade serózní karcinomy mají původ ve fimbriích vejcovodu a některé mohou být odvozeny od cyst vzniklých z implantovaného fimbriálního epitelu. Rovněž existují doklady pro odvozený původ low-grade serózních karcinomů, také z epitelu vejcovodu, případně povrchového mezotelu ovaria (ovarian surface epithelium – OSE). Low-grade endometrioidní a světlobuněčné karcinomy jsou patrně odvozeny od endometriózy a vyvíjejí se z endometriálních cyst. Mucinózní tumory mají nejméně jasný původ, přisuzují se přechodnému epitelu lokalizovanému na tubo-peritoneální junkci.
Molekulární charakteristiky rozdělují karcinomy ovaria do 2 skupin.
Typ I zahrnuje low-grade serózní, low-grade endometrioidní, mucinózní adenokarcinomy a část světlobuněčných adenokarcinomů. Vyvíjejí se z prekurzorových lézí, jsou omezeny na jedno ovarium a mohou mít příznivější prognózu.
Typ II tvoří high-grade serózní adenokarcinomy, high-grade endometriodní adenokarcinomy a část světlobuněčných adenokarcinomů – druhá skupina představuje rychle rostoucí a vysoce agresivní typ, vyskytující se u pokročilých stadií s nepříznivou prognózou [1].
Přes uvedené koncepty původu není dosud známa přesná etiologie karcinomu ovaria, přestože vrozené mutace (genů BRCA1/2 a HNPCC DNA mismatch repair genes) a různé rizikové faktory jsou známou příčinou zvýšeného rizika vzniku karcinomu ovaria. Mutacím uvedených genů lze přičíst pouze cca 10 % případů. Více ovulačních let, užívání estrogenů, pozdější menopauza nebo obezita riziko vzniku karcinomu ovaria zvyšují. Naopak pozdější nástup menarché, kojení, užívání perorální antikoncepce nebo tubální ligace mohou riziko vzniku karcinomu ovaria snižovat. Rizikové faktory se mohou lišit u histologických typů z hlediska zvýšení rizika [2,3,4]. Např. kouření zvyšuje riziko vzniku mucinózního typu [4], stejně jako byla pro tento typ nalezena nejsilnější obrácená asociace u délky kojení [2].
Z hlediska výskytu je karcinom ovaria druhým nejběžnějším gynekologickým nádorem (po karcinomu endometria), z hlediska mortality se jedná o nejzhoubnější gynekologický nádor, který je 5. nejzhoubnějším nádorem u žen. Karcinom ovaria je příčinou více než 50 % úmrtí ve skupině gynekologických nádorů [5]. Asymptomatický průběh onemocnění v časných stadiích vede k tomu, že většina případů je diagnostikována v pozdních stadiích. Tato stadia se vyznačují vysokou mortalitou (pravděpodobnost 5letého přežití 20–33 %) a velmi častou recidivou (60–80 % pacientek, mezi 6 měsíci až 2 lety), vyplývající z rezistence k chemoterapii [6,7].
Diagnostika karcinomu ovaria
Pro příznivější prognózu přežití je nezbytné zachytit onemocnění v časném stadiu. Dosud neexistuje spolehlivý marker či typ vyšetření, který by umožnil plošný screening při relativně nízké incidenci, aby byla senzitivita a specificita vyšetření dostatečná. Rutinně používané diagnostické metody pro detekci karcinomu ovaria jsou vyšetření pánevní oblasti (vaginální a rektovaginální vyšetření), transvaginální ultrasonografické vyšetření a stanovení hladiny tumor-markeru CA125 v séru.
CA125 je stále nepřekonaným diagnostickým markerem pro odhalení karcinomu ovaria [8], s patrně významnou rolí v ovariální karcinogenezi [9]. Stanovení jeho koncentrace v séru je základním postupem i při monitoringu vývoje nemoci, přestože je takový monitoring nejnovějšími rozsáhlými klinickými studiemi zpochybňován z hlediska jeho významu pro přežití pacientek [10]. Nedostatečná senzitivita a specificita však znemožňuje použití CA125 jako screeningového markeru. Existuje řada markerů, které samostatně nebo v kombinaci s CA125 vykazovaly přijatelné hodnoty senzitivity a specificity pro diagnostiku karcinomu ovaria. Jedním v současnosti velmi intenzivně zkoumaným markerem v klinických výzkumech je např. HE-4 [11].
MikroRNA v regulaci buněčných procesů a jako diagnostický nástroj
Relativně nedávno byly objeveny malé, proteiny nekódující RNA, zahrnující především tzv. mikroRNA (microRNA, miRNA) [12]. Tyto molekuly mají jednořetězcovou strukturu délky cca 22 nukleotidů. Jejich význam spočívající v posttranskripční regulaci exprese proteinů (štěpením mRNA nebo blokádou translace) vedl k natolik intenzivnímu výzkumu, že od dob objevů prvních mikroRNA (lin4, roku 1993; let-7, roku 2000) je již známo v lidském genomu přes 2 000 druhů mikroRNA.
MikroRNA fungují jako velmi efektivní regulační síť s mnoha zpětnými vazbami (pozitivními i negativními) v buněčných procesech od buněčného dělení až po buněčnou smrt (apoptózu). Každá mikroRNA může regulovat více mRNA, současně se ukazuje, že více mikroRNA může regulovat expresi jediného genu. V procesech karcinogeneze mohou hrát roli v obou zmíněných procesech, mohou se ale také účastnit procesů dediferenciace v rámci epiteliálně mezenchymální tranzice (EMT) a její obrácené verze (mezenchymálně epiteliální tranzice – MET). Dále mohou vystupovat jako onkogeny či tumor-supresory, ale uplatňují se i v celé řadě dalších buněčných procesů [13].
Procesy EMT mají mimořádný význam pro normální průběh embryonálního vývoje, především při vzniku mezodermu. Jsou nezbytné např. pro správnou tvorbu neurální lišty, srdce, svalové soustavy, kraniofaciálních struktur a periferní nervové soustavy. Epiteliální buňky jsou těsně spojeny a mají bazo-apikální polarizaci, vhodnou pro procesy endocytózy, exocytózy a vezikulární transport. Pro tvorbu mezodermu je nezbytné narušení mezibuněčných spojů, změna tvaru a polarizace buněk a získání schopnosti migrace. Tato radikální transformace (dediferenciace) epiteliálních buněk na buňky mezenchymální je spojena se snížením exprese epiteliálních markerů (např. E-kadherinu, plakoglobinu) a zvýšením exprese mezenchymálních markerů (např. N-kadherinu, vimentinu).
Přestože u mnoha typů karcinomů je E-kadherin považován za tumor-supresor, právě karcinom ovaria, zánětlivý typ karcinomu prsu a gliom jsou výjimkami s vysokou expresí E-kadherinu. Role E-kadherinu v karcinogenezi u těchto typů nádorů se může lišit, a díky své kontroverznosti je předmětem dalších výzkumů. Mezenchymální charakter buněk je spojen se schopností invazivity a tvorby metastáz. Možný dynamický model ovariální karcinogeneze zahrnující MET, při němž se buňky s mezenchymálním charakterem mění na buňky epiteliální, a EMT je uveden dále.
Deregulace mikroRNA (tedy rozdílná exprese vůči referenční tkáni, up-regulace, tj. zvýšená exprese, down-regulace, tj. snížená exprese) jsou typickým projevem různých onemocnění, včetně nádorových. Příčiny deregulace lze najít na úrovni DNA (chromozomální abnormality, mutace), jako důsledek defektů v jejich biogenezi či v souvislosti s epigenetickými změnami. Tyto změny reprezentují změny v metylaci DNA a histonové deacetylaci, při nichž zvýšená, nebo naopak snížená metylace, či deacetylace může vést k up-regulaci některých mikroRNA [12,14].
V karcinogenezi mohou fungovat mikroRNA následovně. Pokud je cílem působení určité mikroRNA tumor-supresorový gen (mRNA), jedná se o onkogenní mikroRNA (oncomiRNA), např. miR-21. Při její zvýšené aktivitě (up-regulaci) je výsledkem snížení exprese tumor-supresoru (např. PTEN) a dochází naopak ke zvýšení produkce onkogenního proteinu. Naopak při snížení exprese tumor-supresorové mikroRNA (např. let-7), jejímž cílem je mRNA onkogenu (např. K-Ras), dochází opět k nadprodukci onkogenního proteinu [13].
Deregulace mikroRNA, které mohou vést k rozdílné expresi cílových mRNA, se projeví nejen funkčními změnami v dané oblasti (např. tumoru), ale mohou působit i v oblastech jiných. Nejnovější objevy totiž ukazují, že mikroRNA mohou být transportovány pomocí exozomů (40–100 nm velké vezikuly) do jiných buněk, než ve kterých byly syntetizovány. Exozomy takto mohou transportovat RNA, proteiny a patrně i DNA (prokázáno u mitochondriální DNA). Ukazuje se, že extracelulární RNA se může vyskytovat v různých tělesných tekutinách [15]. V krvi se nadto k exozomům z buněk imunitního systému mohou připojit exozomy z nádorových buněk, uvolněných do systémové cirkulace [16].
Diferenciální exprese mikroRNA jako důsledek jejich deregulace tak může být detekovatelná na různých úrovních od nádorových buněk až po různé tělesné tekutiny (viz výše). Přesný biologický význam takto změněné exprese zatím není téměř znám (u tělesných tekutin takřka vůbec), ale pro diagnostické, prognostické a terapeutické možnosti současné medicíny se v mikroRNA skrývá patrně jeden z nejmocnějších nástrojů.
Role mikroRNA v patogenezi karcinomu ovaria
Vzhledem k heterogennímu charakteru karcinomu ovaria zahrnujícímu různé histologické typy, stadia a diferenciační stupně, lze předpokládat rozdílné projevy v expresi regulačních molekul mikroRNA s touto variabilitou související. Tato variabilita může souviset s různým histologickým původem karcinomu (viz výše), rozdílnou imunitní odezvou organizmu, interakcemi nádorových buněk a tumor infiltrujících buněk (např. lymfocytů či makrofágů) v prostředí nádoru, případně s rolí rakovinných kmenových buněk.
Protože ovariální karcinogeneze zřejmě zahrnuje také různé formy dediferenciace v procesech epiteliálně mezenchymální tranzice (EMT) a mezenchymálně epiteliální tranzice (MET), viz výše, dochází ke změnám v expresi mikroRNA asociovaným s těmito procesy. Nejznámějšími mikroRNA asociovanými s EMT jsou rodiny mikroRNA miR-200 a let-7. Většina členů rodiny let-7 (má dosud 13 známých členů) funguje jako tumor-supresory snižující translaci onkogenů (např. K-Ras, Myc, HMGA-2 [17] nebo regulátorů buněčného cyklu (CDC25, CDK6, cyklin D2). Některé miRNA z této rodiny se však mohou chovat jako onkogeny (např. let-7a-3 u karcinomu plic [18]). Let-7 mohou negativně regulovat EMT, tj. podporují epiteliální fenotyp. Role rodiny miR-200 v EMT je sporná, mikroRNA z této rodiny mají u karcinomu ovaria zvýšenou expresi. Zvýšená exprese vede k potlačení exprese ZEB1/2, vysokým hladinám E-kadherinu a epiteliálnímu fenotypu [19].
Byl navržen model, který předpokládá, že v ovariální karcinogenezi nejprve dochází k mezotelově-epiteliální tranzici (MET) v povrchové oblasti ovaria mezotelového původu, buňky získávají epiteliální charakteristiky, a současně se zvyšuje exprese epiteliálních markerů. Exprese ZEB1/2 jako transkripčních represorů E-kadherinu klesá. Další vývoj pravděpodobně může zahrnovat EMT, při níž naopak exprese ZEB1/2 roste a buňky získávají mezenchymální charakter, vhodný pro migraci a tvorbu metastáz [19]. Následovat však může další „re-epitelizace“ u distálních metastáz. Nejnovější výzkumy ukázaly, že u CD133/1+ kmenových buněk ovariálního karcinomu, u kterých byla uměle zvýšena exprese miR-200, došlo ke zvýšení exprese E-kadherinu, snížení exprese ZEB2 a snížení schopnosti migrace a invazivity [20]. Vliv exprese miR-200 na prognózu je sporný, neboť byly publikovány práce ukazující opačné efekty. Obtížná interpretace právě u zhoršené prognózy a vyšší exprese miR-200 je patrně důsledkem nesourodosti použitých metod.
Existuje několik mikroRNA, jejichž exprese může mít prognostický význam pro přežití pacientek a další mikroRNA byly identifikovány v souvislosti s potenciálními rolemi v chemorezistenci. V obou případech jejich biologický význam související s karcinogenezí není dosud uspokojivě vysvětlen, proto je zde neuvádíme. Vzhledem k množství dosud identifikovaných mikroRNA v lidském genomu a jejich složité roli v buněčných regulacích je dosud známo o jejich funkcích příliš málo. Na příkladu miR-200 bylo demonstrováno, jak složitá může být interpretace nalezených výsledků.
Diferenciální exprese mikroRNA u karcinomu ovaria jako diagnostický nástroj pro rozpoznání karcinomu ovaria
Několik recentních studií identifikovalo expresní profily mikroRNA u různých typů vzorků, zahrnujících tkáně (tab. 1), sérum (tab. 2), exozomy (tab. 2) a plnou krev (tab. 3). Rovněž byly zjištěny rozdíly v expresi mikroRNA mezi primárními a recidivujícími nádory (tab. 4). Přestože řada mikroRNA byla nalezena podobně deregulována napříč studiemi, pro mnohé mikroRNA existuje jen slabý překryv a kompatibilita výsledků.
Tab. 1. Diferenciální exprese mikroRNA ve vzorcích primárního karcinomu ovaria (nádorová tkáň) 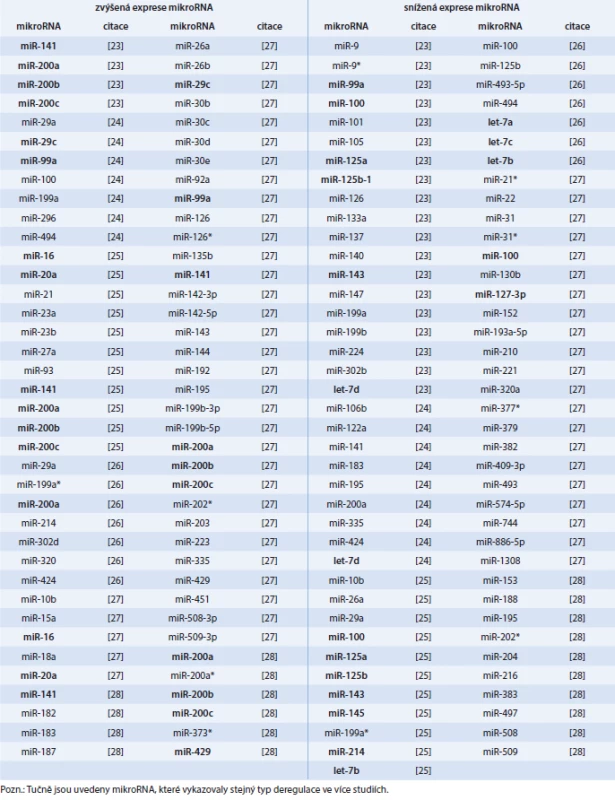
Tab. 2. Diferenciální exprese mikroRNA v séru pacientek s karcinomem ovaria [21] a exozomů izolovaných z periferní krve [16] ![Diferenciální exprese mikroRNA v séru pacientek s karcinomem ovaria [21] a exozomů izolovaných z periferní krve [16]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c6aee4f77316157d7478e289be65a91c.png)
Tab. 3. Diferenciální exprese mikroRNA z plné krve pacientek s karcinomem ovaria [22] ![Diferenciální exprese mikroRNA z plné krve pacientek s karcinomem ovaria [22]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4edcd435580cccec801b556193c68932.png)
Tab. 4. Diferenciální exprese mikroRNA u recidivujícího vs. primárního karcinomu ovaria [29] ![Diferenciální exprese mikroRNA u recidivujícího vs. primárního karcinomu ovaria [29]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/aff712f08fb8c70126ba1c70961d13f5.png)
Rozdílná exprese mikroRNA u karcinomu ovaria (snížená v některých studiích a zvýšená v jiných) byla nalezena např. u těchto mikroRNA: miR-10b, miR-26a, miR-29a, miR-99a, miR-100, miR-126, miR-141, miR-143, miR-183, miR-195, miR-199a*, miR-199b, miR-200a, miR-214, miR-494, miR-508 a miR-509 (tab. 1).
Rozdíly v nalezené expresi u různých studií mohou mít různé důvody. Především jsou to rozdílné metody pro stanovení exprese mikroRNA, odlišné formy normalizace vůči endogenním kontrolám a jiný typ použitých referenčních vzorků. Roli může hrát i variabilita vlastní tumorové tkáně a její histopatologická klasifikace, neboť studovaný vzorek může představovat určitou vývojovou fázi karcinogeneze, kterých v odebraném materiálu může existovat více.
V různých tkáních a v různých buněčných typech mohou mít mikroRNA různé funkce. O funkcích mikroRNA je známo velmi málo, ačkoli byly identifikovány mnohé pravděpodobné cíle jejich působení, tj. příslušné mRNA. Protože jedna mikroRNA může mít za cíl desítky až stovky mRNA, není zřejmé, jak přesně je jejich exprese regulována v daném okamžiku působení. Nejnovější výzkumy navíc ukazují, že v regulacích mohou hrát roli vazby kompetujících endogenních RNA (tzv. ceRNAs) [12].
Pro diagnostické účely tak má stanovení exprese miRNA v nádorové tkáni jen omezený význam, neboť pro zlepšení prognózy vývoje nemoci je nezbytné zachytit nemoc v časných fázích, často asymptomatických. Diferenciální exprese mikroRNA z nádorových tkání dosud nebyla validována na rozsáhlých souborech pacientek s jednoznačnou interpretací a využitím v klinické praxi z diagnostického a prognostického hlediska.
Budoucnost výzkumu mikroRNA a význam pro klinickou praxi
Identifikace obecněji platných expresních profilů z neinvazivně odebíraných vzorků s vysokou senzitivitou a specificitou bude pro diagnostiku na základě exprese mikroRNA nezbytná. Studie zaměřené na mikroRNA v séru [21] a plné krvi [22] přinesly první výsledky na tomto poli. Z hlediska diagnostiky karcinomů nabízí koncept analýz mikroRNA z krve potenciálně využitelný a efektivní nástroj. U plné krve a serózního typu karcinomu ovaria dosáhl tento typ analýz relativně vysoké specificity a senzitivity (u obou > 85 %) [22]. Je nepochybné, že stanovení exprese miRNA v plné krvi a séru je obrazem složitého komplexu extracelulárních mikroRNA, pocházejících z exozomů buněčných složek krve a také exozomů pocházejících z tumoru. Nelze tak přesněji odlišit příspěvek jednotlivých složek, i vzhledem k jejich odlišné biologické/fyziologické roli. Alternativu nabídl výzkum exozomů z krve odvozených z tumoru [16]. U použitého postupu je však nevýhodou problematická kalibrace a normalizace dat (absence referenčních exozomů) a náročnost použité metody.
Většina výzkumů exprese mikroRNA však byla dosud provedena na vzorcích tkání nebo buněčných linií [30]. Vzhledem k nutnosti diagnostiky pomocí neinvazivních postupů v časných fázích nemoci, je nezbytné další výzkumy zaměřit na identifikaci diagnostických markerů z minimálně invazivně odebíraných vzorků, především krve (plazmy, séra), moči nebo slin. Analýzy exprese mikroRNA z nádorů nabízí prognostický nástroj, který bez nalezení efektivnější léčby patrně nemůže mít zásadní dopad na přežití pacientek. Klinický monitoring CA125 a jeho sporný vliv na mortalitu pacientek je varováním před přílišným optimizmem. MikroRNA však mohou skýtat také velké možnosti v terapeutickém využití (umělé zvýšení nebo snížení exprese) a patrně se stanou jedním z budoucích nástrojů cílené terapie nádorových onemocnění. Je pravděpodobné, že se efektivní diagnostika společně s léčbou neobejde bez detailních znalostí biologických funkcí jakéhokoli markeru (diagnostického či prognostického), u mikroRNA však zvláště.
Poděkování
Tato práce byla podpořena projektem PRVOUK-P27/LF1/1.
Doručeno do redakce dne 1. 6. 2012
Přijato po recenzi dne 23. 7. 2012
RNDr. Luděk Záveský, Ph.D.
ludek.zavesky@vfn.cz
Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha
www.biol.lf1.cuni.cz
MUDr. Eva Jandáková
doc. MUDr. Milada Kohoutová, CSc.
Zdroje
1. Kurman RJ, Shih IM. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer-Shifting the paradigm. Hum Pathol 2011; 42(7): 918–931.
2. Gates MA, Rosner BA, Hecht JL et al. Risk Factors for Epithelial Ovarian Cancer by Histologic Subtype. Am J Epidemiol 2010; 171(1): 45–53.
3. Cramer DW. The Epidemiology of Endometrial and Ovarian Cancer. Hematology-Oncology Clinics of North America 2012; 26(1): 1–12.
4. Gram IT, Lukanova A, Brill I et al. Cigarette smoking and risk of histological subtypes of epithelial ovarian cancer in the EPIC cohort study. Int J Cancer 2012; 130(9): 2204–2210.
5. Jemal A, Siegel R, Xu JQ et al. Cancer Statistics 2010. CA Cancer J Clin 2010; 60(5): 277–300.
6. Jaarsveld MTM van, Helleman J, Berns EMJJ et al. MicroRNAs in ovarian cancer biology and therapy resistance. Int J Biochem Cell Biol 2010; 42(8): 1282–1290.
7. Salani R, Backes FJ, Fung MFK et al: Posttreatment surveillance and diagnosis of recurrence in women with gynecologic malignancies: Society of Gynecologic Oncologists recommendations. Am J Obstet Gynecol 2011; 204(6): 466–478.
8. Skates SJ, Mai P, Horick NK et al. Large Prospective Study of Ovarian Cancer Screening in High-Risk Women: CA125 Cut-Point Defined by Menopausal Status. Cancer Prev Res 2011; 4(9): 1401–1408.
9. Záveský L. CA125/MUC16 jako diagnostický a prognostický marker pro karcinom ovaria. Onkologie (Solen) 2012; 6(2): 65–67.
10. Buys SS, Partridge E, Black A et al. Effect of Screening on Ovarian Cancer Mortality The Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial. JAMA 2011; 305(22): 2295–2303.
11. Jacob F, Meier M, Caduff R et al. No benefit from combining HE4 and CA125 as ovarian tumor markers in a clinical setting. Gynecol Oncol 2011; 121(3): 487–491.
12. Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med 2012; 4(3): 143–159.
13. Di Leva G, Croce CM. Roles of small RNAs in tumor formation. Trends Mol Med 2010; 16 (6): 257–267.
14. Scott GK, Mattie ND, Berger CE et al. Rapid alteration of microRNA levels by histone deacetylase inhibition. Cancer Res 2006; 66(3): 1277–1281.
15. Weber JA, Baxter DH, Zhang SL et al. The MicroRNA Spectrum in 12 Body Fluids Clin Chem 2010; 56(11): 1733–1741.
16. Taylor DD, Gercel-Taylor C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer. Gynecol Oncol 2008; 110(1): 13–21.
17. Bussing I, Slack FJ, Grosshans H. let-7 microRNAs in development, stem cells and cancer. Trends Mol Med 2008; 14(9): 400–409.
18. Brueckner B, Stresemann C, Kuner R et al. The human let-7a-3 locus contains an epigenetically regulated microRNA gene with oncogenic function. Cancer Res 2007; 67(4): 1419–1423.
19. Bendoraite A, Knouf EC, Garg KS et al. Regulation of miR-200 family microRNAs and ZEB transcription factors in ovarian cancer: Evidence supporting a mesothelial-to-epithelial transition. Gynecol Oncol 2010; 116 (1): 117–125.
20. Wu QH, Guo RJ, Lin M, et al. MicroRNA-200a inhibits CD133/1+ ovarian cancer stem cells migration and invasion by targeting E-cadherin repressor ZEB2. Gynecol Oncol 2011; 122(1): 149–154.
21. Resnick KE, Alder H, Hagan JP et al. The detection of differentially expressed microRNAs from the serum of ovarian cancer patients using a novel real-time PCR platform. Gynecol Oncol 2009; 112(1): 55–59.
22. Häusler SFM, Keller A, Chandran PA et al. Whole blood-derived miRNA profiles as potential new tools for ovarian cancer screening. Br J Cancer 2010; 103(5): 693–700.
23. Iorio MV, Visone R, Di Leva G et al. MicroRNA signatures in human ovarian cancer. Cancer Res 2007; 67(18): 8699–8707.
24. Dahiya N, Sherman-Baust CA, Wang TL, et al. MicroRNA Expression and Identification of Putative miRNA Targets in Ovarian Cancer. Plos One 2008; 3(6): e2436.
25. Nam EJ, Yoon HJ, Kim SW et al. MicroRNA expression profiles in serous ovarian carcinoma. Clin Cancer Res 2008; 14(9): 2690–2695.
26. Yang H, Kong W, He L et al. MicroRNA expression profiling in human ovarian cancer: miR-214 induces cell survival and cisplatin resistance by targeting PTEN. Cancer Res 2008; 68(2): 425–433.
27. Wyman SK, Parkin RK, Mitchell PS, et al. Repertoire of microRNAs in Epithelial Ovarian Cancer as Determined by Next Generation Sequencing of Small RNA cDNA Libraries. Plos One 2009; 4(4): e5311.
28. Gallagher MF, Flavin RJ, Elbaruni SA, et al. Regulation of microRNA biosynthesis and expression in 2102Ep embryonal carcinoma stem cells is mirrored in ovarian serous adenocarcinoma patients. J Ovarian Res 2009; 2 : 19.
29. Laios A, O‘Tooles, Flavin R, et al. Potential role of miR-9 and miR-223 in recurrent ovarian cancer. Mol Cancer 2008; 7 : 35.
30. Záveský L, Jančárková N, Kohoutová M. Ovarian cancer: Origin and factors involved in carcinogenesis with potential use in diagnosis, treatment and prognosis of the disease. Neoplasma 2011; 58(6): 457–468.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek EditorialČlánek Anorgazmie a frigidita
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2012 Číslo 2-4- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Terapeutické použití IUS – Mirena®: kazuistika
- Poskytování zdravotních služeb: nový právní rámec
- Jak jednat při ošetřování a léčbě cizinců: úskalí, zjištění a doporučení
- Kubánské zdravotnictví: dojmy z autopsie
- Zpráva ze studijního pobytu na Gynekologicko-porodnické klinice University Lund
-
Nejčastější gynekologické malignity: průvodce onemocněním
Nový edukativní film připravený společností Dialog Jessenius -
Obecně prospěšná společnost Dialog Jessenius:
naděje pro pacienty a pomoc pro zdravotníky - 20. PRAKTICKÁ UROGYNEKOLOGIE, Praha 2011
- Editorial
- Významný pokrok v léčbě ovariálního karcinomu po 20 letech
- MikroRNA a jejich potenciál v diagnostice karcinomu ovaria: současný stav a možná budoucnost
- Výskyt HPV-infekcie krčka maternice po liečbe prekanceróz konizáciou
-
Karcinom prsu: průvodce onemocněním
Edukační DVD - Využití kvasinkového lyofilizátu CANDIVAC cps. u žen s rekurentní vulvovaginální kandidózou: výsledky klinické studie
- Ulipristal acetát: nový přípravek v léčbě děložních myomů
- Tromboprofylaxe u císařského řezu
- Diagnostika a terapie vybraných forem extragenitální endometriózy
- Anorgazmie a frigidita
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diagnostika a terapie vybraných forem extragenitální endometriózy
- Anorgazmie a frigidita
- Jak jednat při ošetřování a léčbě cizinců: úskalí, zjištění a doporučení
- Ulipristal acetát: nový přípravek v léčbě děložních myomů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



