-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Gastrointestinální toxicita imunoterapie
Gastrointestinal Toxicity of Immunotherapy
Immunotherapy is a standard modern therapeutic modality of clinical oncology. Due to the specific nature of affecting the immune system of the oncology patient, modern immunotherapy brings new and sometimes difficult to recognise autoimmune adverse reactions. One of the organ systems most commonly affected by autoimmune inflammation is the gastrointestinal system. The incidence of autoimmune enterocolitis in patients undergoing immunotherapy ranges from 1 to 25% depending on the type of drug administered (checkpoint inhibitor) and whether the patient is being treated with monotherapy or combination immunotherapy. The clinical signs (diarrhoea) and severity of gastrointestinal toxicity of immunotherapy are stratified on a four-step scale. The intensity of pharmacotherapy for these adverse events is determined by the degree of severity. Most side effects are reversible and well-managed with corticosteroid therapy. If symptoms are not relieved within 3–5 days with high doses of corticosteroids, immunosuppressive therapy with the anti-TNF inhibitor infliximab at 5 mg/kg should be given every 2 weeks until the signs of toxicity have disappeared. Early initiation of adequate corticotherapy for these auto-immune conditions induced by immunotherapy is essential to the success of this supportive therapy. Therefore, general awareness of the potential pitfalls of checkpoint inhibitor therapy should be well understood and anticipated. Just as we are looking for biomarkers to predict the effect of immunotherapy, we should also focus on research into predicting the toxicity of immunotherapy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
corticosteroids – immunotherapy – checkpoint inhibitors – autoimmune inflammation – enterocolitis
Autori: J. Špaček
Pôsobisko autorov: Onkologická klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Klin Onkol 2020; 33(1): 23-28
Kategória: Přehled
doi: https://doi.org/10.14735/amko202023Súhrn
Imunoterapie je standardní moderní léčebnou modalitou klinické onkologie. Vzhledem k specifickému charakteru ovlivnění imunitního systému onkologického pacienta přináší moderní imunoterapie nové a někdy velmi obtížně rozpoznatelné autoimunitní nežádoucí účinky. Jednou z orgánových soustav nejčastěji postiženou autoimunitním zánětem je gastrointestinální systém. Incidence autoimunitní enterokolitidy u pacientů podstupujících moderní imunoterapii se pohybuje v rozmezí 1–25 % podle druhu aplikovaného léčiva (checkpoint inhibitoru) a podle toho, zda je pacient léčen monoterapií, či kombinovanou imunoterapií. Klinické příznaky (průjem) a závažnost gastrointestinální toxicity imunoterapie se stratifikují do čtyřstupňové škály. Intenzita farmakoterapie těchto nežádoucích účinků je určena stupněm jejich závažnosti. Většina nežádoucích účinků je reverzibilní a dobře zvládnutelná terapií kortikosteroidy. Pokud nedojde ke zmírnění symptomů během 3–5 dnů při aplikaci vysokých dávek kortikosteroidů, zahájí se imunosupresivní léčba anti-TNF inhibitorem infliximabem v dávce 5 mg/kg každé 2 týdny, dokud příznaky toxicity imunoterapie nezmizí. Brzké zahájení adekvátní kortikoterapie těchto autoimunitních stavů indukovaných imunoterapií je zásadní pro úspěšnost této podpůrné terapie. Proto by obecné povědomí o možných úskalích terapie checkpoint inhibitory mělo být co nejširší. Stejně jako hledáme biomarkery predikce efektu imunoterapie, měli bychom se také zaměřit na výzkum v oblasti predikce toxicity imunoterapie.
Klíčová slova:
imunoterapie – checkpoint inhibitory – autoimunitní zánět – enterokolitida – kortikosteroidy
Úvod
Imunoterapie je standardní moderní léčebnou modalitou klinické onkologie. Vzhledem k specifickému charakteru modifikace imunitního systému onkologického pacienta přináší moderní imunoterapie nové a někdy velmi obtížně rozpoznatelné autoimunitní nežádoucí účinky. Jednou z orgánových soustav nejčastěji postiženou autoimunitním zánětem je gastrointestinální systém.
Epidemiologie
Imunitně podmíněné nežádoucí účinky (immune related adverse effect – irAE) ovlivňující gastrointestinální systém (GIT) jsou během léčby moderní imunoterapií poměrně frekventované. Do gastrointestinálních obtíží při imunoterapii se řadí zejména průjmy doprovázející autoimunitní zánět střevní sliznice. Incidence autoimunitní enterokolitidy u pacientů podstupujících moderní imunoterapii se pohybuje v rozmezí 1–25 % podle druhu aplikovaného léčiva (check-point inhibitoru) a podle toho, zda je pacient léčen monoterapií, či kombinovanou imunoterapií. Endoskopický a histologický obraz autoimunitních střevních zánětů a idiopatických střevních zánětů je do jisté míry totožný. Rozdíl je zejména v bohatších infiltracích polymorfonukleárních granulocytů ve sliznici střeva postiženého autoimunitním zánětem oproti většímu zastoupení lymfocytů ve střevě postiženém chronickým idiopatickým střevním zánětem. U více než dvou třetin pacientů, kteří absolvovali terapii anti-CTLA-4 protilátkou, se vyskytne nějaký druh irAE. Jedna třetina pacientů, kteří jsou takto léčeni, manifestuje irAE právě v oblasti gastrointestinálního traktu, jako jsou aftózní vředy, ezofagitida, gastritida a enterokolitida, která se obvykle projevuje jako průjem [1,2]. Incidence průjmu stupně 3–4 je vyšší u pacientů, kteří podstupují terapii anti-CTLA-4 protilátkou (jako je ipilimumab), ve srovnání s pacienty, kteří mají léčbu anti-PD-1/anti-PD-L1 (programmed cell death-1 / programmed cell death-1 ligand) protilátkou (jako je nivolumab nebo pembrolizumab) [3,4]. Vyskytovala se u 21 % pacientů s maligním melanomem léčených ipilimumabem. Bylo také prokázáno, že incidence kolitidy stupně 3–4 se zvýšila z 13 na 16 % u pacientů s karcinomem prostaty navýšením dávky ipilimumabu z 5 na 10 mg/kg [5]. Bez zajímavosti není ani fakt, že profil toxicity se nezvýšil, pokud se dávka nivolumabu nebo pembrolizumabu zvýšila z FDA (Úřad pro kontrolu potravin a léčiv) doporučené dávky 2 mg/kg každé 3 týdny na vyšší dávky 10 mg/kg každé 2 nebo 3 týdny. Lze proto tvrdit, že gastrointestinální toxicita způsobená terapií checkpoint inhibitory závisí v případě anti-CTLA-4 protilátek na dávce, zatímco v případě anti-PD-1/anti-PD-L1 protilátek tomu tak není [6].
Rizikové faktory
Střevní mikrobiom
Základní složení mikrobioty může predikovat riziko vzniku enterokolitidy indukované ipilimumabem. V prospektivní studii s 34 pacienty, u nichž bylo analyzováno složení střevního mikrobiomu před zahájením imunoterapie, byla zjištěna zvýšená přítomnost bakterií kmene Bacteroides u pacientů, u kterých se při léčbě ipilimumabem neobjevila autoimunitní enterokolitida [7]. Další studie s 26 pacienty léčenými ipilimumabem pro metastatický maligní melanom ukázala, že u pacientů s větším zastoupením bakterií druhu Bacteroides ve stolici se nerozvinula autoimunitní enterokolitida a většina druhů bakterií souvisejících s autoimunitní enterokolitidou byla z kmene Firmicutes [8]. Ve srovnání s pacienty, jejichž mikrobiom byl před léčbou složen zejména z bakterií kmene Bacteroides, vykazovali pacienti s mikrobiotou obohacenou o Faecalibacterium a Firmicutes delší přežití bez progrese a delší celkové přežití.
Autoimunitní choroby
Pacienti s anamnézou autoimunitních onemocnění jsou po dobu terapie check-point inhibitory ohroženi zhoršením svého autoimunitního onemocnění. Toxicita terapie je však často mírná a zvládnutelná bez přerušení imunoterapie [9]. U pacientů, kteří již zažili irAE při předchozí terapii checkpoint inhibitorem, existuje větší riziko rozvoje irAE po léčbě jiným typem checkpoint inhibitoru. Riziko irAE se také zvyšuje při kombinované terapii [9,10].
Další rizikové faktory
Nedávná data prokázala, že užívání nesteroidních antirevmatik je spojeno se zvýšeným rizikem enterokolitidy vyvolané ipilimumabem [11]. U pacientů s Crohnovou chorobou a ulcerativní kolitidou je k dispozici jen málo údajů o riziku vzniku autoimunitní enterokolitidy indukované protinádorovou imunoterapií.
Klinický obraz
Nejčastějším klinickým korelátem GIT toxicity imunoterapie je průjem, který je definován jako zvýšená frekvence řídké stolice. Jeho patologickoanatomickým podkladem je autoimunitní enterokolitida projevující se bolestmi břicha, krvácením z konečníku nebo přítomností hlenu ve stolici [12]. Přítomnost enterokolitidy zvyšuje riziko dalších komplikací, vč. vzniku ileu, střevní distenze, toxického megakolon, perforace střeva až klinické smrti pacienta. Klinická závažnost průjmu i kolitidy je odstupňována podle společných terminologických kritérií pro nežádoucí účinky [13]. Mírný průjem (stupeň 1) je definován jako < 4 stolice denně nad standardní počet stolic daného pacienta. Průjem stupně 2 je definován jako 4–6 stolic denně nad standardní počet stolic pacienta, zatímco enterokolitida stupně 2 je charakterizována bolestmi břicha nebo krví nebo hlenem ve stolici. Těžký průjem (stupeň 3) je definován jako ≥ 7 stolic denně nad standardní počet stolic pacienta a enterokolitida stupně 3 je navíc definována přítomností peritoneálních příznaků – horečkou, ileem a hrozící perforací střeva. Označení stupně 4 se liší od enterokolitidy stupně 3 zvýšenou závažností klinických příznaků a život ohrožující povahou těchto symptomů.
Diagnostika
Při prvním průjmu nebo bolestech břicha by měly být u pacientů léčených terapií checkpoint inhibitory nejprve vyloučeny infekční příčiny průjmu. Stolice by měla být zaslána na standardní mikrobiologická vyšetření, vč. vyšetření parazitologického a testování na Clostridium difficile [14]. Infekční kolitida a enterokolitida indukovaná imunoterapií mohou koexistovat, jak ukazují dvě kazuistiky koinfekce cytomegaloviru (CMV) a Salmonelly u pacientů podstupujících imunoterapii [15,16]. Přestože infekční etiologie průjmů je v rámci diferenciální diagnostiky pravděpodobnější příčinou obtíží, je třeba vyloučit i GIT metastázy jako potenciální důvod trávicích obtíží. Pacienti s klinickými příznaky peritonitidy, jako je peritoneální dráždění, horečka, distenze střeva či rigidita břišní stěny, by měli podstoupit vyšetření břicha výpočetní tomografií (computed tomography – CT). Toto vyšetření by mělo vyloučit perforace tlustého střeva, což je vzácná, ale dobře zdokumentovaná nežádoucí příhoda, která může být fatální [17–19]. Kolonoskopie s vyšetřením terminálního ilea a biopsií tlustého střeva je u pacientů s přetrvávajícím průjmem stupně ≥ 2 zlatým standardním diagnostickým testem. Pacienti s příznaky horního GIT, jako je nevolnost nebo zvracení, by měli podstoupit gastrofibroskopii s biopsií. Normální vzhled sliznice při endoskopickém vyšetření nevylučuje přítomnost autoimunitního zánětu, a proto musí být vždy provedena slizniční biopsie. Někteří pacienti s imunitně zprostředkovaným průjmem nebo enterokolitidou mohou vykazovat slizniční ulcerace, eroze, erytém nebo ztrátu cévní kresby. Možný je však také fyziologický nález na mukóze [20]. Enterokolitida vyvolaná ipilimumabem velmi často způsobuje léze v oblasti konečníku a sigmoidea, proto pro diagnostiku obvykle postačuje flexibilní sigmoidoskopie či rektoskopie. Mezi závažností autoimunitního zánětu, resp. jeho stupněm a endoskopickým nálezem nebyla prokázána žádná korelace.
Léčba gastrointestinálních toxických účinků imunoterapie
Optimální léčba imunitně indukované enterokolitidy vyžaduje zejména včasné rozpoznání a následné rychlé podání imunosupresivních medikamentů, jejichž dávkování je přizpůsobeno vážnosti klinických projevů. U mírného průjmu stupně 1 mohou pacienti pokračovat v terapii checkpoint inhibitory při symptomatické terapii (podávání loperamidu a substituce elektrolytů) [21]. Pro průjem nebo enterokolitidu stupně 2, definované jako 4–6 stolic denně nad standardní denní počet stolic pacienta + klinické symptomy (bolesti břicha, krev nebo hlen ve stolici), musí být před zahájením kortikoterapie vyloučeny infekční příčiny. Imunoterapie by v těchto případech měla být zastavena a podávání perorálních kortikosteroidů by mělo být zahájeno dávkou 0,5–1 mg/kg za den prednisonu, pokud příznaky přetrvávají > 1 týden.
Pro závažnou GIT toxicitu stupně 3–4, definovanou jako ≥ 7 stolic nad běžný počet stolic pacienta za 1 den nebo přítomnost peritoneálních příznaků, ileu, horečky či perforací střeva by měla být terapie checkpoint inhibitory přerušena trvale. Pacienti s toxicitou stupně 3–4 jsou obvykle hospitalizováni vzhledem k nutnosti rehydratační infuzní terapie a kortikoterapie. Terapie systémovými kortikosteroidy se zahajuje v dávce 1–2 mg/kg za den (prednison nebo ekvivalent), jakmile je vyloučena perforace střeva a infekce Clostridium difficile.
Jedna až dvě třetiny pacientů nereagují na vysoké dávky intravenózních kortikosteroidů nebo mají relaps enterokolitidy vyžadující zvýšení dávky kortikoterapie [21]. Ve studii s 92 pacienty, u nichž se při imunoterapii maligního melanomu nebo bronchogenního karcinomu vyvinul imunitně indukovaný průjem či enterokolitida, byla u 54 (56 %) z nich tato příhoda rezistentní na kortikoterapii [22]. Recentní studie rovněž naznačují, že přítomnost ulcerací tlustého střeva při endoskopickém vyšetření u pacientů s autoimunitní enterokolitidou tuto rezistenci na kortikoterapii predikuje [22–24]. Další studie s 92 pacienty s autoimunitní enterokolitidou vyžadující terapii kortikosteroidy potvrdila, že přítomnost ulcerace, pankolitidy a vysokého Mayo skóre nebo vysoké skóre van der Heijde, které posuzují závažnost kolitidy na základě endoskopického nálezu, predikují rezistenci na kortikoterapii a určují pacienty s potenciálním benefitem z terapie infliximabem [22,25,26]. Pokud nedojde ke zmírnění symptomů během 3–5 dnů při aplikaci vysokých dávek kortikosteroidů, zahájí se imunosupresivní léčba anti-TNF inhibitorem infliximabem v dávce 5 mg/kg každé 2 týdny, dokud nezmizí příznaky [26]. Pacienti, kteří vyžadují terapii infliximabem, mají obvykle vynikající odpověď.
Podle všech klinických doporučení se trvale ukončuje imunoterapie při enterokolitidě stupně 4. Při kolitidě stupně 3 se doporučení liší. Society for Immunotherapy of Cancer (SITC) doporučuje pokračovat v imunoterapii, jakmile je kortikosteroid snížen na dávku ≤ 10 mg/den a pacient zůstává bez příznaků. American Society of Clinical Oncology (ASCO) doporučuje zvážit trvalé přerušení léčby anti-CTLA-4 protilátkami, zatímco PD-1 nebo PD-L1 inhibitory mohou být znovu podávány, pokud se autoimunitní příznaky drží na stupni 1. European Society for Medical Oncology (ESMO) neposkytuje žádná jasná doporučení ohledně pokračování v imunoterapii u průjmu či enterokolitidy stupně 3. Všechny odborné společnosti souhlasí, že pokračování v imunoterapii je možné při autoimunitní enterokolitidě či průjmu stupně 2, jakmile je zaznamenáno zlepšení klinického stavu pacienta. U pacientů, u nichž se objeví perforace tlustého střeva, je indikována urgentní subtotální kolektomie. Někdy může být doporučena i totální kolektomie, protože léze tlustého střeva jsou obecně často rozsáhlé a po segmentální resekci tlustého střeva zánět recidivuje do zbývajícího tlustého střeva [20].
Závěr
Imunoterapie představuje naději pro určitou skupinu pacientů napříč širokým spektrem nádorových onemocnění. Efektivita terapie je vypozorována u zhruba třetiny pacientů. Stejně jako hledáme biomarkery predikce efektu imunoterapie, měli bychom se také zaměřit na výzkum v oblasti predikce toxicity imunoterapie. Tento typ toxicity je zcela specifický a souvisí s vlastním mechanizmem účinku moderní imunoterapie. Může mít projevy v různé intenzitě od lehkých až po život ohrožující stavy. Brzké zahájení adekvátní kortikoterapie těchto autoimunitních stavů indukovaných imunoterapií je zásadní pro její úspěšnost. Proto by obecné povědomí o možných úskalích terapie checkpoint inhibitory mělo být co nejširší.
Kazuistika
Projevy a terapii GIT toxicity imunoterapie budeme demonstrovat na případu pacientky s generalizovaným spinocelulárním karcinomem mediastina, léčené v 6. linii paliativní terapie nivolumabem. Pacientka se narodila v roce 1945. Byla silnou kuřačkou, kouřila od 18 do 56 let přibližně 20 cigaret denně a po 8leté pauze kouřila už jen příležitostně. V roce 2001 byla léčena pro invazivní duktální karcinom levého prsu, který byl resekován a pacientka následně podstoupila adjuvantní radioterapii a hormonální léčbu. Jiné závažné interní komorbidity nebyly u pacientky přítomny. V době diagnózy karcinomu mediastina byla pacientka léčena na plicním oddělení pro chronickou obstrukční chorobu plic. Od ledna 2013 trpěla zhoršující se dušností, a proto byla odeslána praktickým lékařem na CT vyšetření. Na CT byl v květnu roku 2013 pacientce diagnostikován tumor horního mediastina s infiltrací do levé pleury a perikardu. Tumor byl verifikován cestou mediastinoskopie, jednalo se o spinocelulární karcinom. Bronchoskopické vyšetření, otorinolaryngologické vyšetření a PET/CT neobjasnily primární původ nádorového bujení a vyloučily jiná vzdálená ložiska. Bylo tedy jasné pouze to, že se jedná o spinocelulární karcinom, v diferenciální diagnóze velmi pravděpodobně bronchogenní, avšak byla zvažována i možnost skvamózního karcinomu thymu. Rozsah primárního tumoru byl poměrně velký (obr. 1) a zcela jistě se jednalo o inoperabilní nález. Vzhledem k lokalizaci nádoru v předním mediastinu bez postižení plicního parenchymu a zjevným klinickým obtížím pacientky se přistoupilo k zahájení chemoterapie PAC (cisplatina, doxorubicin, cyklofosfamid) s primární profylaxí G-CSF a následně 35 frakcím radioterapie. Efekt této léčby byl znatelný a došlo k významné parciální regresi (obr. 2). Dle kontrolní CT hrudníku, provedeného v květnu 2014, však byla popsána mírná progrese ložiska v mediastinu a nové ložisko na pleuře. Kvůli progresi a elevaci nádorových markerů specifických pro karcinom prsu zahájila pacientka vzhledem k onkologické anamnéze perorální chemoterapii kapecitabinem v monoterapii, a to až do října roku 2014. Vzhledem k další progresi nádorového onemocnění byla změněna terapie na další linii léčby paklitaxelem, jehož užívání ale musela pacientka ukončit po druhém cyklu pro alergickou reakci. Pro alergii byl dále až do května 2015 podáván nab-paklitaxel. Kvůli dalšímu zvětšení nádoru o 1 cm byla terapie změněna na perorální, metronomické podávání navelbinu. Tuto léčbu však pacientka extrémně špatně tolerovala. Dostavilo se nechutenství, zvracení, začala hubnout a progredovala i dušnost. Pro masivní pneumonii byla v červenci roku 2015 ukončena specifická onkologická terapie a pacientka byla převedena do režimu nejlepší možné symptomatické terapie.
Obr. 1. Primární tumor před zahájením onkologické terapie (16. 5. 2013). 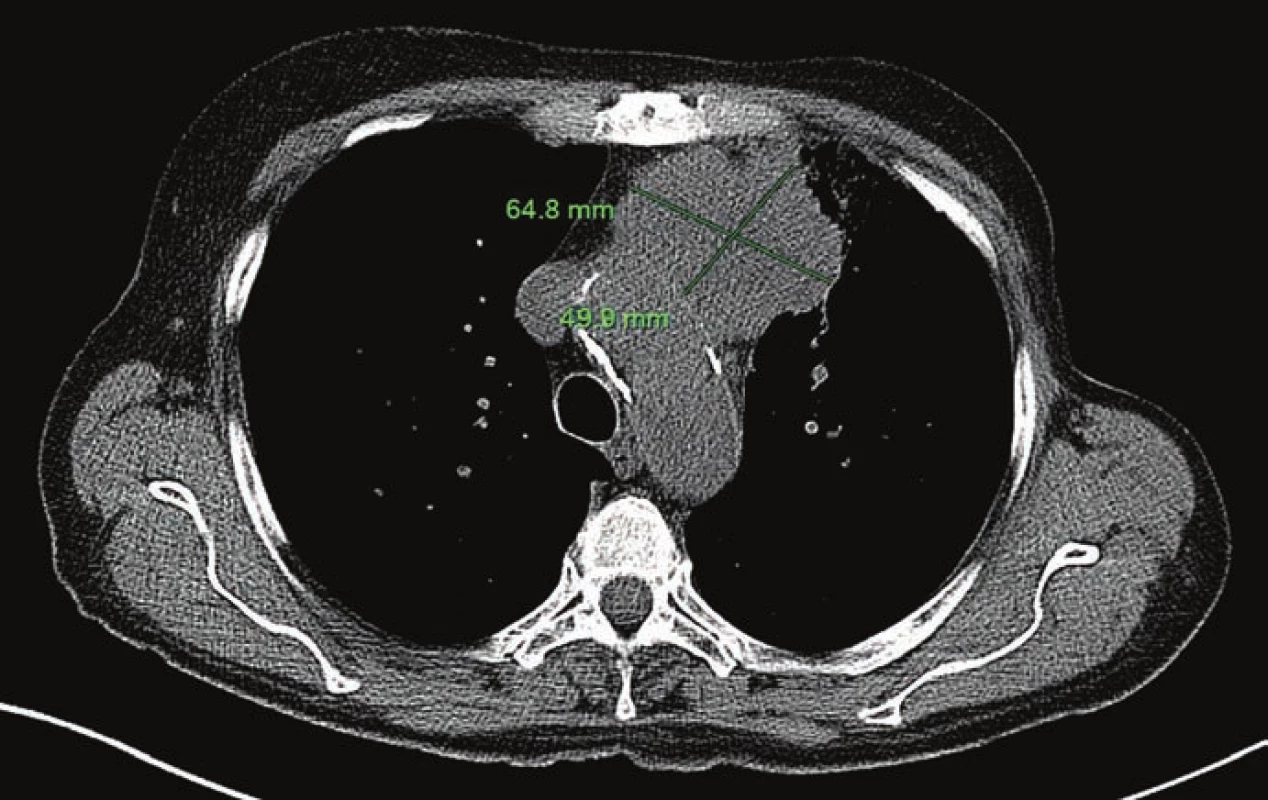
Obr. 2. Téměř kompletní zobrazovací remise po konkomitantní chemoradioterapii (12. 2. 2014). 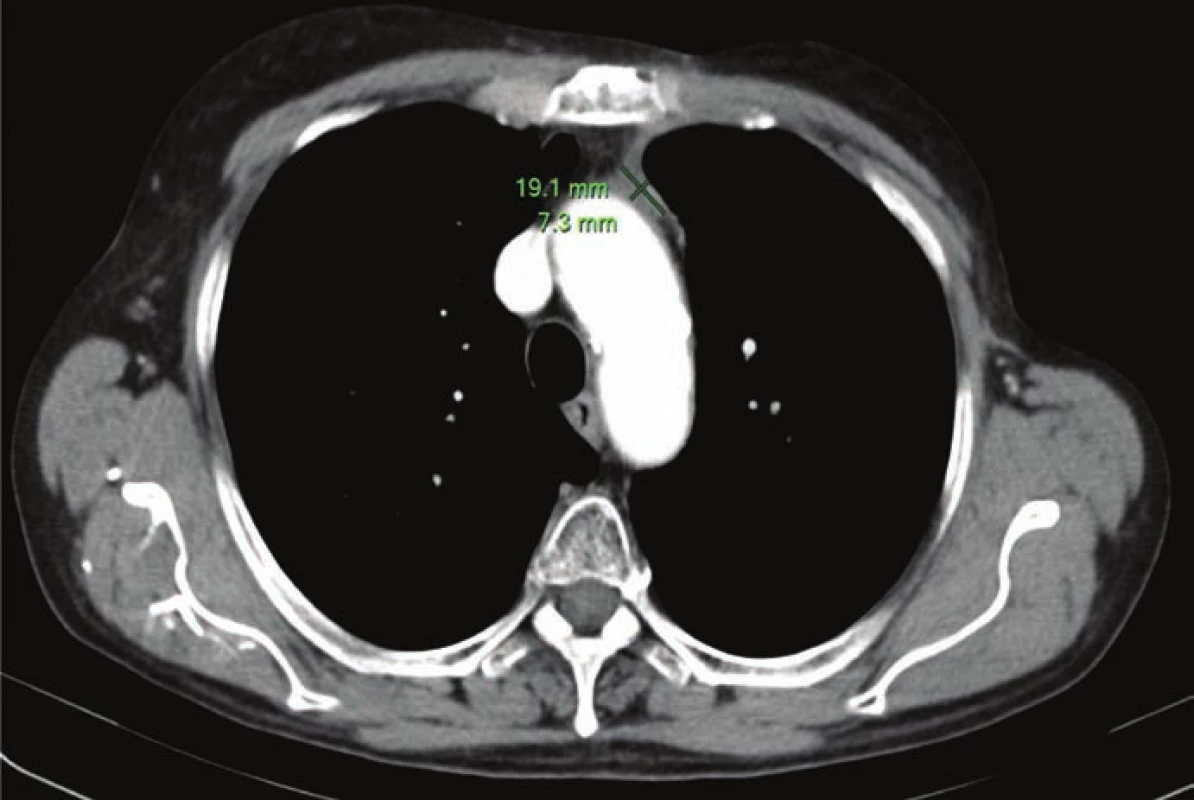
Po ukončení onkologické léčby nevolnosti zcela odezněly, klidově a při malé námaze byla pacientka na nižší dávce transdermálního opiátu (fentanyl 25 mcg/h) prakticky bez dušnosti. Výkonnostní stav se výrazně zlepšil a začala přibírat na váze. Vzhledem k možnému plicnímu původu tumoru a značné předléčenosti pacientky byla od listopadu 2015 indikována terapie nivolumabem v rámci specifického léčebného programu. Před zahájením imunoterapie podstoupila pacientka kontrolní CT trupu, která ukázala progresi do zhruba dvou třetin původní velikosti (obr. 3). První aplikaci v standardním dávkování 3 mg/kg absolvovala pacientka dne 12. 11. 2015. Po čtvrtém cyklu se objevila první epizoda průjmovitého onemocnění. Pacientka měla až 7 stolic denně a situace si vyžádala podpůrnou a rehydratační infuzní terapii za hospitalizace. Vzhledem k podezření na rozvoj autoimunitní enterokolitidy byla indikována perorální kortikoterapie v dávce 60 mg prednisonu denně. Klinický stav se poměrně rychle upravil a pacientka absolvovala další cyklus imunoterapie při snížené dávce prednisonu 40 mg denně. Šestý cyklus nebyl dne 25. 2. 2016 podán pro zánět průdušek. Během těchto komplikací byla provedena restagingová CT, která prokázala i u takto předléčené pacientky pozoruhodnou efektivitu nivolumabu (obr. 4). Následně byla ovšem opět nutná hospitalizace z důvodu febrilních stavů a trombocytopenie při rozsáhlé pravostranné pneumonii. Pneumokoková pravostranná pneumonie byla léčena antibiotiky a pacientka mohla být dimitována ve stabilizovaném stavu do domácího prostředí. Přes chronickou kortikoterapii se dostavila druhá epizoda průjmů autoimunitní etiologie G3 vyžadující intenzifikaci kortikoterapie. Pacientka byla převedena na 2 mg/kg/den metylprednisolonu podávaného intravenózně. Při selhání této terapie (průjem pokračoval více než 5 dní) byl indikován infliximab, který vyžadoval schválení revizního lékaře. Teprve po třech aplikacích infliximabu průjmy ustaly a klinický stav se stabilizoval. Dle kontrolní CT v září 2016 bylo onemocnění stabilizováno. Vzhledem k rizikovosti recidivy autoimunitních GIT komplikací byla imunoterapie ukončena a pacientka byla nadále léčena pouze symptomaticky. V prosinci 2016 byla na centrálním interním příjmu vyšetřena s příznaky rozvíjejícího se septického stavu. V průběhu následné hospitalizace v lednu 2017 došlo k postupnému zhoršení stavu vedoucímu k úmrtí.
Obr. 3. Poslední CT před zahájením terapie nivolumabem (14. 10. 2015). 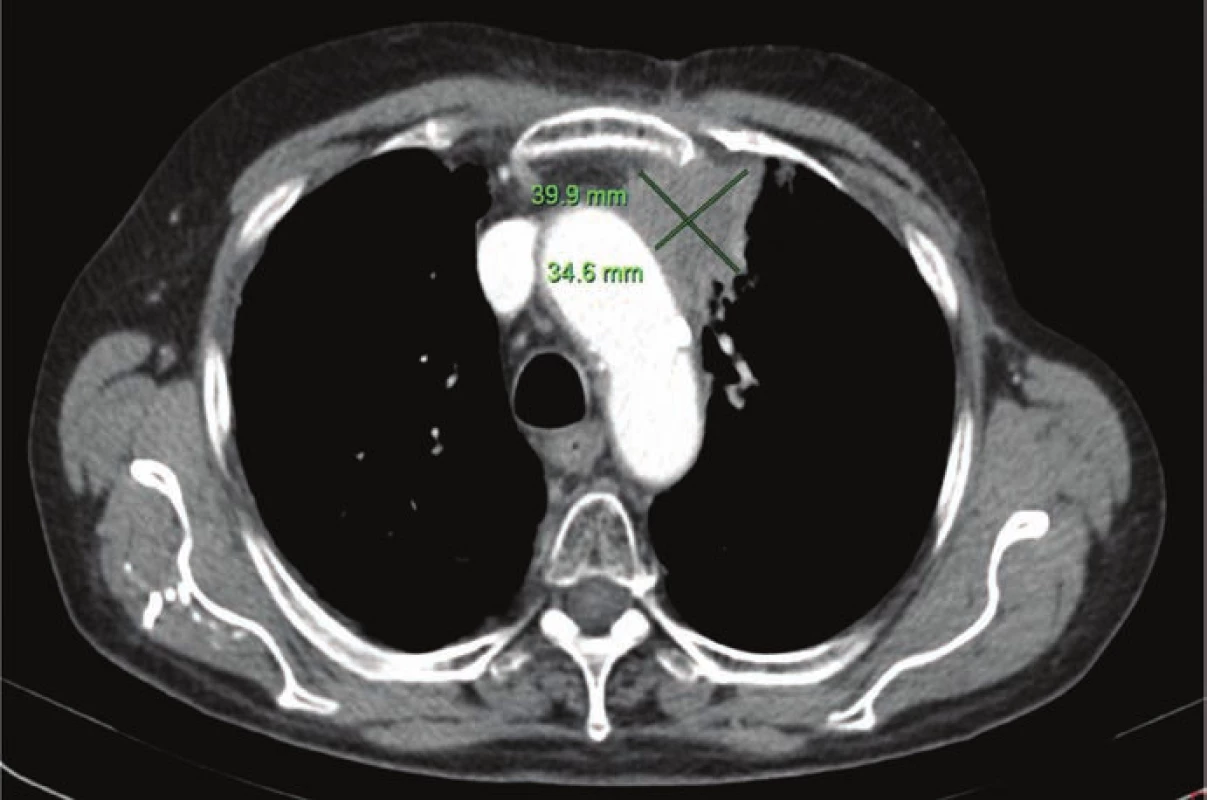
Obr. 4. CT hrudníku a břicha z 10. 2. 2016 po čtyřech aplikacích nivolumabu – regrese patologického ložiska v hrudníku. 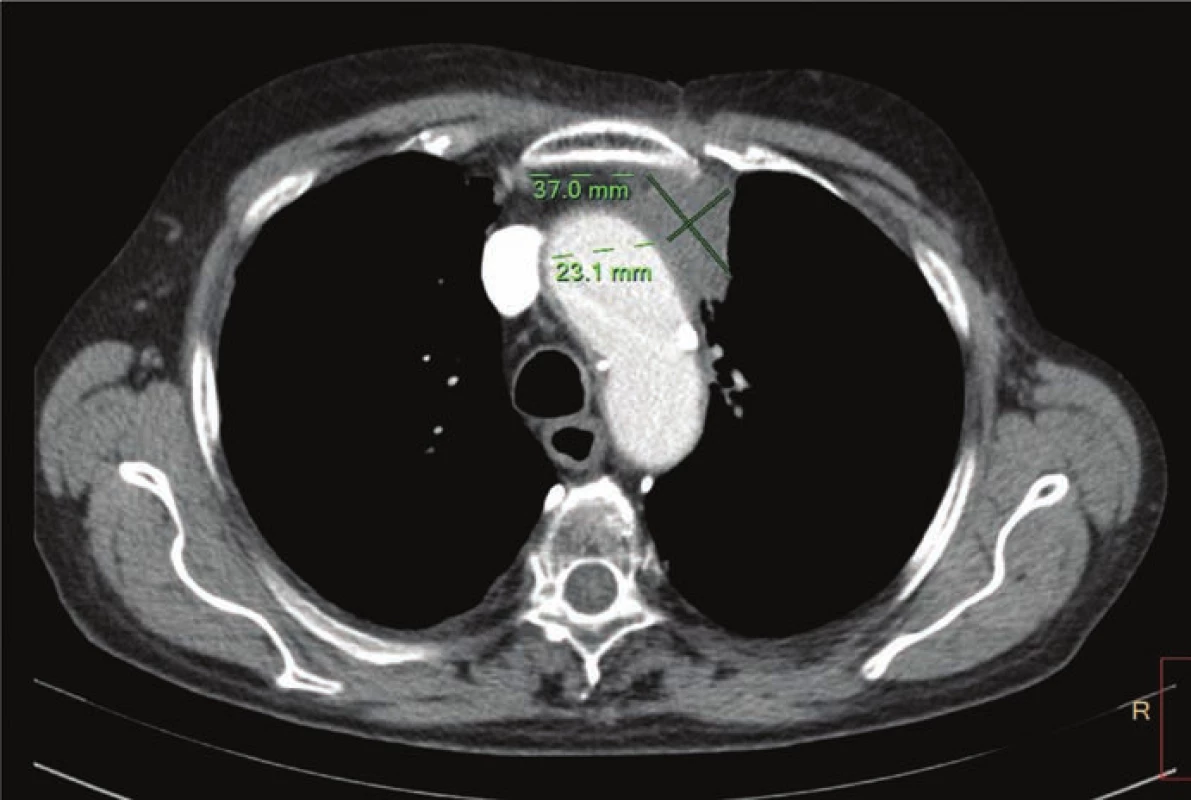
Shrnutí kauzistiky
I u takto komplikované pacientky s rozsáhlým primárním nádorovým postižením, kde selhala řada onkologických léčebných postupů, byla imunoterapie efektivní a výrazně prodloužila život. GIT toxicita byla úspěšně zaléčena i přes primární rezistenci na kortikoterapii. Autoimunitní enterokolitida může být život ohrožující komplikací imunoterapie, ale včasná aplikace kortikosteroidů a při jejich selhání infliximabu může předejít jejím fatálním důsledkům.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jan Špaček
Onkologická klinika
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha
e-mail: jan.spacek@vfn.cz
Obdrženo: 29. 10. 2019
Přijato: 11. 1. 2020
Zdroje
1. Graziani G, Tentori L, Navarra P. Ipilimumab: a novel immunostimulatory monoclonal antibody for the treatment of cancer. Pharmacol Res 2012; 65 (1): 9–22. doi: 10.1016/ j.phrs.2011.09.002.
2. Gupta A, De Felice KM, Loftus EV jr et al. Systematic review: colitis associated with anti-CTLA-4 therapy. Aliment Pharmacol Ther 2015; 42 (4): 406–417. doi: 10.1111/apt.13 281.
3. Hofmann L, Forschner A, Loquai C et al. Cutaneous, gastrointestinal, hepatic, endocrine, and renal side-effects of anti-PD-1 therapy. Eur J Cancer 2016; 60 : 190–209. doi: 10.1016/j.ejca.2016.02.025.
4. Beck KE, Blansfield JA, Tran KQ et al. Enterocolitis in patients with cancer after antibody blockade of cytotoxic T-lymphocyte-associated antigen 4. J Clin Oncol 2006; 24 (15): 2283–2289. doi: 10.1200/JCO.2005.04.5716.
5. Slovin SF, Higano CS, Hamid O et al. Ipilimumab alone or in combination with radiotherapy in metastatic castration-resistant prostate cancer: results from an open-label, multicenter phase I/II study. Ann Oncol 2013; 24 (7): 1813–1821. doi: 10.1093/annonc/mdt107.
6. Kumar V, Chaudhary N, Garg M et al. Corrigendum: current diagnosis and management of immune related adverse events (irAEs) induced by immune checkpoint inhibitor therapy. Front Pharmacol 2017; 8 : 49. doi: 10.3389/fphar.2017.00049.
7. Dubin K, Callahan MK, Ren B et al. Intestinal microbiome analyses identify melanoma patients at risk for checkpoint-blockade-induced colitis. Nat Commun 2016; 7 : 10391. doi: 10.1038/ncomms10391.
8. Chaput N, Lepage P, Coutzac C et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab. Ann Oncol 2017; 28 (6): 1368–1379. doi: 10.1093/annonc/mdx 108.
9. Menzies AM, Johnson DB, Ramanujam S et al. Anti-PD-1 therapy in patients with advanced melanoma and preexisting autoimmune disorders or major toxicity with ipilimumab. Ann Oncol 2017; 28 (2): 368–376. doi: 10.1093/annonc/mdw443.
10. Bowyer S, Prithviraj P, Lorigan P et al. Efficacy and toxicity of treatment with the anti-CTLA-4 antibody ipilimumab in patients with metastatic melanoma after prior anti-PD-1 therapy. Br J Cancer 2016; 114 (10): 1084–1089. doi: 10.1038/bjc.2016.107.
11. Marthey L, Mateus C, Mussini C et al. Cancer immunotherapy with anti-CTLA-4 monoclonal antibodies induces an inflammatory bowel disease. J Crohns Colitis 2016; 10 (4): 395–401. doi: 10.1093/ecco-jcc/jjv227.
12. Postow MA. Managing immune checkpoint-blocking antibody side effects. Am Soc Clin Oncol Educ Book 2015; 35 : 76–83. doi: 10.14694/EdBook_AM.2015.35.76.
13.Marin-Acevedo JA, Harris DM, Burton MC. Immunotherapy-induced colitis: an emerging problem for the hospitalist. J Hosp Med 2018; 13 (6): 413–418. doi: 10.12788/jhm.2925.
14. Rawa T, Reguła J. Management of gastrointestinal toxicity from nivolumab therapy. Oncol Clin Pract 2017; 13 (5): 225–229. doi: 10.5603/OCP.2017.0026.
15. McCutcheon JL, McClain CM, Puzanov I et al. Infectious colitis associated with ipilimumab therapy. Gastroenterology Res 2014; 7 (1): 28–31. doi: 10.14740/gr594e.
16. Lankes K, Hundorfean G, Harrer T et al. Anti-TNF-refractory colitis after checkpoint inhibitor therapy: possible role of CMV-mediated immunopathogenesis. Oncoimmunology 2016; 5 (6): e1128611. doi: 10.1080/21 62402X.2015.1128611.
17. Dilling P, Walczak J, Pikiel P et al. Multiple colon perforation as a fatal complication during treatment of metastatic melanoma with ipilimumab – case report. Pol Przegl Chir 2014; 86 (2): 94–96. doi: 10.2478/pjs-2014-0017.
18. Burdine L, Lai K, Laryea JA. Ipilimumab-induced colonic perforation. J Surg Case Rep 2014; 86 (2): 94–96. doi: 10.1093/jscr/rju010.
19. Shah R, Witt D, Asif T et al. Ipilimumab as a cause of severe pan-colitis and colonic perforation. Cureus 2017; 9 (4): e1182. doi: 10.7759/cureus.1182.
20. Verschuren EC, van den Eertwegh AJ, Wonders J et al. Clinical, endoscopic, and histologic characteristics of ipilimumab-associated colitis. Clin Gastroenterol Hepatol 2016; 14 (6): 836–842. doi: 10.1016/j.cgh.2015.12. 028.
21. Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab. J Clin Oncol 2012; 30 (21): 2691–2697. doi: 10.1200/JCO.2012.41.6750.
22. Geukes Foppen MH, Rozeman EA, van Wilpe S et al. Immune checkpoint inhibition-related colitis: symptoms, endoscopic features, histology and response to management. ESMO Open 2018; 3 (1): e000278. doi: 10.1136/esmoopen-2017-000278.
23. Jain A, Lipson EJ, Sharfman WH et al. Colonic ulcerations may predict steroid-refractory course in patients with ipilimumab-mediated enterocolitis. World J Gastroenterol 2017; 23 (11): 2023–2028. doi: 10.3748/wjg.v23.i11.2023.
24. Wang Y, Abu-Sbeih H, Mao E et al. Endoscopic and histologic features of immune checkpoint inhibitor-related colitis. Inflamm Bowel Dis 2018; 24 (8): 1695–1705. doi: 10.1093/ibd/izy104.
25. Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med 1987; 317 (26): 1625–1629. doi: 10.1056/NEJM198712243172603.
26. van der Heide H, van den Brandt-Gradel V, Tytgat GN et al. Comparison of beclomethasone dipropionate and prednisolone 21phosphate enemas in the treatment of ulcerative proctitis. J Clin Gastroenterol 1988; 10 (2): 169–172. doi: 10.1097/00004836-198804000-00013.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2020 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- Management imunitně podmíněné endokrinopatie při protinádorové léčbě checkpoint inhibitory
- Toxicita imunoonkologické léčby – myokarditida
- Gastrointestinální toxicita imunoterapie
- Renální toxicita imunoonkologické léčby
- The Important Role of STAT3 in Chronic Lymphocytic Leukaemia Biology
- Význam fibroblastů asociovaných s nádorem při patogenezi karcinomů v oblasti hlavy a krku
- Dlouhodobé klinické výsledky IGRT karcinomu prostaty
- Expresia ligandu receptora programovanej bunkovej smrti 1 v bio psii nemalobunkového karcinómu pľúc a jej asociácia s tumor infi ltrujúcimi lymfocytmi a stupňom dezmoplázie
- Novinky z genetiky, molekulární biologie a klinické onkologie sarkomů
- Vzpomínka na prof. MUDr. Vítězslava Kolka, DrSc.
- Prof. MUDr. Stanislav Špánik, CSc. – 60-ročný
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- The Important Role of STAT3 in Chronic Lymphocytic Leukaemia Biology
- Toxicita imunoonkologické léčby – myokarditida
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



