-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Gastrointestinální stromální tumory
Gastrointestinal Stromal Tumors
Gastrointestinal stromal tumours (GISTs) are the most common group of mesenchymal tumours affecting the gastrointestinal tract. Despite this, GISTs are relatively rare, since all mesenchymal tumours constitute just 1 percent of all primary GI cancers. Most often, GISTs affect the stomach and proximal small intestine but can be found in any section of the alimentary tract, including, occasionally, the omentum, mesentery and peritoneum. Virtually all GISTs (especially those larger than 1 cm) have malignant potential. Malignant potential of a tumour increases with its size and its mitotic rate, and it also depends on its anatomic location: intestinal GISTs are more aggressive than gastric tumours. Treatment of GISTs was revolutionized when it was discovered that mutational activation of KIT or PDGFRA stimulates the growth of these cancer cells. Mutational activation of KIT or PDGFRA led to abnormal activation of receptor tyrosine kinase and uncontrolled oncogenic signalling. This uncontrolled oncogenic signalling can be specifically targeted therapeutically with small molecule inhibitors of the receptor tyrosine kinase (imatinib, sunitinib). All GISTs ≥ 2 cm in size should be resected. To reduce disease recurrence, adjuvant imatinib therapy is recommended for all high-risk patients after resection. Neoadjuvant therapy is recommended for primarily unresectable tumours or a limited amount of potentially resectable metastatic disease. The goal of treatment is to reduce tumour size, thus facilitating complete surgical resection and increasing the likelihood of organ preservation.
Key words:
GIST – KIT – diagnosis – surgical procedures – imatinib
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: J. Žabka
Působiště autorů: Chirurgické oddělení, Klatovská nemocnice, a. s., Klatovy
Vyšlo v časopise: Klin Onkol 2011; 24(3): 187-194
Kategorie: Přehledy
Souhrn
Gastrointestinální stromální tumory (GIST) tvoří největší část mezenchymálních nádorů trávicího traktu. Přesto jsou velmi vzácné, protože všechny mezenchymální tumory GIT dohromady tvoří jen 1 % všech primárních nádorů gastrointestinálního traktu. GIST nejčastěji postihují žaludek a proximální část tenkého střeva, ale mohou se vyskytnout kdekoli v GIT včetně omenta, mezenteria a peritonea. Každý GIST (zejména pokud je větší než 1 cm) je třeba považovat za potenciálně maligní. Maligní potenciál GIST vzrůstá s velikostí tumoru a jeho mitotickou aktivitou. Závisí také na jeho lokalizaci: nejmenší je při lokalizaci tumoru v žaludku. Vznik těchto tumorů souvisí s aktivační mutací KIT nebo PDGFRA genů. To vede k abnormální aktivaci receptoru tyrozinkinázy, což zprostředkuje soustavný přenos onkogenních signálů do nitra buňky. Blokáda této patologické systematické aktivace receptoru tyrozinkinázy pomocí jejích nízkomolekulárních inhibitorů (imatinib, sunitinib) vede k výraznému zlepšení prognózy onemocnění. Obecně platí, že každý GIST větší než 2 cm má být chirurgicky odstraněn. Po jeho resekci je všem rizikovým nemocným doporučeno podávat adjuvantní léčbu imatinibem, která výrazně snižuje pravděpodobnost recidivy. V případě rozsáhlých tumorů se doporučuje neoadjuvantní léčba imatinibem. Ta vede k předoperačnímu zmenšení nádorové masy GIST, takže operace je potom technicky jednodušší a umožní lépe zachovat funkčnost orgánů.
Klíčová slova:
GIST – KIT – diagnóza – chirurgická léčba – imatinibÚvod
Mezenchymální (stromální) tumory tvořené vřetenovitými či epiteloidními buňkami představují cca jen 1 % primárních nádorů gastrointestinálního traktu (GIT). Na rozdíl od obvyklých a mnohem častějších epiteliálních nádorů GIT se vyskytují subepiteliálně a lze je rozdělit do dvou skupin:
První, běžnější skupinu mezenchymálních nádorů GIT nyní nazýváme gastrointestinální stromální tumory (GIST).
Druhou, vzácnější skupinu mezenchymálních nádorů GIT tvoří celé spektrum tumorů, které mohou vznikat z měkkých tkání i kdekoliv jinde v těle (lipomy, liposarkomy, leiomyomy, leiomyosarkomy, desmoidní tumory, schwannomy atd.).
Následující text bude zaměřen jen na problematiku GIST, které sice nejčastěji postihují žaludek a proximální část tenkého střeva, ale mohou se vyskytnout kdekoli v alimentárním traktu od jícnu po anus a např. i na omentu, mezenteriu a peritoneu.
Souhrnné studie udávají největší výskyt GIST v žaludku (60–70 %), tenkém střevě (20–25 %), tlustém střevě (5 %), jícnu (cca 1–5 %) [1].
Multifokální tumory bývají považovány za pokročilé stadium choroby, avšak při hereditárním familiárním výskytu může jít o mnohočetné primární tumory s odlišnou prognózou. Vyžadují zejména jiný chirurgický přístup.
Vzácné jsou extra-gastrointestinální stromální tumory (EGIST), které se krom omenta a mezenteria mohou vyskytnout i v retroperitoneu, pankreatu, žlučníku, seróze močového měchýře, prostatě a byly popsány i ve vagině. V části případů jde pravděpodobně o subserózní GIST žaludku či střeva, který se vyklene mimo stěnu trávicí trubice a ztratí s ní kontakt.
Makroskopicky bývají GIST uloženy pod gastrointestinální sliznicí a vycházejí z některé vrstvy gastrointestinální stěny (nejčastěji z muscularis propria), vyklenují se intraluminálně či na serózní povrch žaludku nebo střeva. Může dojít k ulceraci přilehlé sliznice.
Tumory bývají dobře ohraničené, občas s tenkou pseudokapsulou, ze které někdy vybíhají septa rozdělující nádor na pseudolobuly. Konzistence tumoru bývá elastická, pokud není změněna regresivními změnami (jako je pseudocystická přeměna, prokrvácení, kalcifikace nebo nekróza). Na řezu bývají bílé, homogenní, někdy s vláknitou strukturou [2].
Histologicky je dělíme na dva typy: vřetenobuněčný (70 %) a epiteloidní (20 %), případně třetí smíšený typ mixoidní (10 %) [3]. Konvenční světelná mikroskopie umožňuje s vysokou mírou pravděpodobnosti vyslovit suspekci na GIST, a to ještě před konfirmačním imunohistochemickým vyšetřením (obr. 1). Imunohistochemická charakteristika mezenchymálních tumorů je uvedena v tab. 1.
Obr. 1. A – barvení HE – vřetenobuněčný GIST s cytonukleárními atypiemi, B – CD117 (c-Kit) – silná difuzní plazmatická a membránová pozitivita. 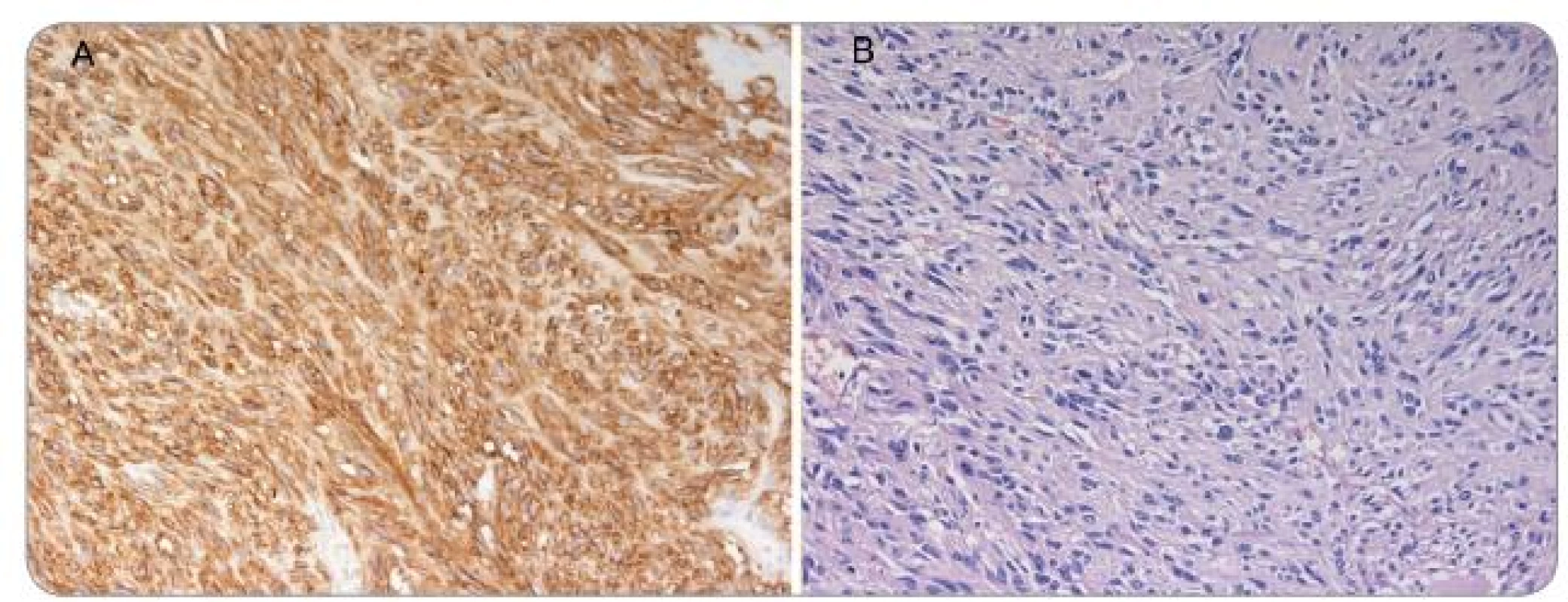
Tab. 1. Imunohistochemické schéma pro diferenciální diagnózu vřetenobuněčných tumorů GIT [5]. ![Imunohistochemické schéma pro diferenciální diagnózu vřetenobuněčných tumorů GIT [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/35cbd86020c1f0feef517ea6a528a62f.jpeg)
Etiopatogeneze a molekulární podstata patologie GIST a její klinický význam
V roce 1998 bylo zjištěno, že pro nádorové buňky GIST (krom již předtím popsaných histomorfologických znaků) je typická téměř univerzální exprese antigenu CD117 (u 95 % GIST) [4].
Tím je možno spolehlivě odlišit GIST od vzácnější skupiny mezenchymálních nádorů GIT (leiomyomy, liposarkomy atd…, viz výše uvedený text), které jsou CD117 negativní (tab. 1).
Molekula CD117 je součástí tzv. KIT transmembránového receptoru tyrozinkinázy, který je produktem KIT protoonkogenu. Ten je uložen na dlouhém raménku 4. chromozomu.
U více než 80 % GIST vede mutace v KIT genu ke strukturálním změnám v KIT transmembránovém proteinu a k jeho soustavné patologické konformaci vedoucí k následné abnormální aktivaci („gain of function“) receptoru tyrozinkinázy, což zprostředkuje soustavný přenos onkogenních signálů do nitra buňky. Výsledkem je proliferace nádorových buněk.
Naproti tomu ve zdravých buňkách je aktivita KIT tyrozinkinázového receptoru kontrolována navázáním endogenního ligandu – tzv. KIT ligandu, někdy označovaného jako SCF (stem cell faktor).
U nevelké části (cca do 10 %) GIST se nedaří prokázat mutaci v KIT genu i přes pozitivní imunohistochemický průkaz exprese patologického KIT proteinu – jedná se o tzv. KIT „wild type“ GIST. Mechanizmus jeho vzniku není spolehlivě objasněn [6].
U malé části (cca 5–10 %) GIST je exprese KIT neprokazatelná a vznik těchto tumorů souvisí s aktivační mutací příbuzného genu, který kóduje tzv. „platelet-derived growth faktor receptor alfa“ (PDGFRA) a je uložen v těsné blízkosti KIT genu na dlouhém raménku 4. chromozomu [7]. Tato mutovaná izoforma genu má velmi podobnou strukturu jako KIT proonkogen. PDGFRA pozitivní tumory mají většinou epiteloidní strukturu a jsou obvykle lokalizovány na omentu a mezenteriu.
V současné době se předpokládá histogeneze GIST z progenitorových mezenchymálních buněk schopných diferenciace ve fenotyp fibroblastický, leiomuskulární, neurální i diferenciace k tzv. intersticiálním (pacemakerovým) Cajalovým buňkám, které zajišťují peristaltiku – tvoří jakýsi převod („interface“) mezi autonomní inervací střevní stěny a buňkami hladké svaloviny střeva. Na rozdíl od buněk GIST Cajalovy buňky exprimují KIT protein nezávisle na mutaci KIT genu – tato vlastnost původně vedla (zřejmě nesprávně) část autorů k úvahám o možné histogenezi GIST z Cajalových buněk [8].
Na základě výše uvedených faktů je možno prokázat, že převážná většina mezenchymálních nádorů GIT patří do skupiny GIST.
Klinicky významné je, že popsaný soustavný nekontrolovaný přenos onkogenních signálů do nitra buněk je dnes možno specificky blokovat perorálně podávanými inhibitory tyrozinkinázy, jako je imatinib (Glivec) nebo sunitinib (Sutent), výsledkem je blokáda proliferace nádorových buněk. Léčba těmito preparáty významným způsobem zlepšila prognózu nemocných.
Maligní potenciál GIST a jejich senzitivita k inhibitorům tyrozinkinázy bude zjevně závislá na tom, který konkrétní exon genu („KIT - proonkogenu“) je postižen mutací. Nejběžnější je mutace exonu 11, který kóduje juxstamembránovou část KIT proteinu, citlivost na imatinib bývá dobrá. Byly popsány i mutace exonů 9, 13, 17. Nejagresivnější maligní potenciál má pravděpodobně mutace na exonu 9 [9,10]. Jde však o informace, které se stále vyvíjejí a nejsou dostatečně konzistentní. V současné době není pro zahájení terapie imatinibem genová analýza nutná.
Výskyt
Nejvěrohodnější epidemiologická data pocházejí z populačních studií, které byly provedeny ve Švédsku, Nizozemsku a na Islandu – byla zjištěna roční incidence 11–14,5 případu GIST na 1 milion obyvatel [11–13].
Recentně bylo v japonské studii konsekutivně vyšetřeno (v řezech po 5 mm) 100 celých žaludků (resekovaných pro žaludeční nádor). S pomocí optické mikroskopie a imunohistochemie bylo nalezeno 50 mikroskopických GIST u 35 pacientů. Většina mikroskopických GIST (90 %) byla lokalizována v horní polovině žaludku. (Krom toho byly ve 28 žaludcích nalezeny mikroskopické leiomyomy [14].)
Jiné studie odhadují výskyt incidentálních GIST (menších než 1 cm) v žaludku až u jedné třetiny dospělé populace. Tyto incidentální nepatrné tumory jsou téměř vždy benigní.
Je zřejmé, že pouze velmi malá část mikroskopických GIST doroste do klinicky relevantní velikosti s možným maligním potenciálem, který se předpokládá již u tumorů větších než 2 cm bez ohledu na jejich histologický obraz.
Vzácně se u mladých mužů i žen vyskytuje familiární syndrom spočívající v mnohočetných, multifokálních GIST v žaludku a tenkém střevě provázený multicentrickými paragangliomy, dysfagií a hyperpigmentací kůže s autozomálně dominantním typem dědičnosti (Carney-Stratakisův syndrom), který je třeba odlišit od vzácně se vyskytující Carneyovy triády (GIST – zejména žaludku, paragangliomy a plicní chondrom) u mladých žen. S Carneyovou triádou související GIST mají i v případě metastáz relativně indolentní průběh, zejména v mladém věku (12–18 let) [15,16].
Maligní potenciál GIST
Na základě provedených studií lze obecně konstatovat, že maligní potenciál GIST je nejmenší při lokalizaci tumoru v žaludku. Nádory tenkého střeva bývají výrazně agresivnější (tab. 2).
Tab. 2. Procentuální vyjádření přežití bez progrese u GIST žaludku, tenkého střeva a konečníku rozdělené podle velikosti tumoru a mitotického indexu [17]. ![Procentuální vyjádření přežití bez progrese u GIST žaludku, tenkého střeva a konečníku rozdělené podle velikosti tumoru a mitotického indexu [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c25e33a36b86867356180c607b094b7d.jpeg)
Incidentální GIST menší než jeden centimetr bývají benigní. Maligní potenciál GIST vzrůstá s velikostí tumoru a jeho mitotickou aktivitou [18,19] (tab. 2, 3).
Tab. 3. Navrhovaná úprava klasifi kace rizika malignizace GIST dohodnuté na konferenci NIH [18,19]. ![Navrhovaná úprava klasifi kace rizika malignizace GIST dohodnuté na konferenci NIH [18,19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a56ac8e0cbf1ead7f975437af43e2c2b.jpeg)
Principiálně je však maligní potenciál přítomen v každém GIST a dělení na benigní a maligní se nedoporučuje.
V tab. 2 jsou shrnuty výsledky rozsáhlých dlouhodobých studií M. Miettinena, prováděných u 1 055 pacientů s nádory žaludku, 629 pacientů s nádory tenkého střeva, 144 pacientů s nádory duodena a 111 pacientů s nádory konečníku.
Klinická manifestace GIST
GIST je nezřídka asymptomatický a bývá objeven náhodně při endoskopickém, CT či sonografickém vyšetření, které je indikováno z jiných důvodů. Někdy se projevuje nespecifickými příznaky, jako je pocit neadekvátně rychlého nasycení či meteorizmus.
Větší tumory způsobují abdominální bolest nebo i střevní obstrukci (tumor nezřídka poslouží jako struktura vedoucí k rozvoji intususcepce). Často dochází k ulceraci sliznice nad tumorem, která může být provázena okultním či masivním krvácením do GIT, střevní perforace je výjimečná.
Občasnou manifestací může být protrahovaná hypoglykemie při paraneoplastické sekreci „insulin like růstového faktoru II“ [20].
GIST metastázují do peritonea, jater, výjimečně do plic a raritně do lymfatických uzlin.
Diagnostické možnosti
CT
Nejpřínosnější pro diagnózu GIST je CT vyšetření s obojím kontrastem (tj. perorálně i intravenózně) k jasnému zobrazení střevního okraje. CT určí rozsah tumoru a přítomnost metastáz.
Podezření na potenciálně maligní tumor lze z CT zobrazení vyslovit, je-li tumor větší než 5 cm v průměru, lobulární, heterogenně enhancující (příčinou bývají nekrózy, hemoragie a dystrofické změny masy tumoru), s exofytickým růstem, infiltrací mezenteriálního tuku, s ulcerací či regionální lymfadenopatií [3].
GIST s nízkým metastatickým potenciálem rostou endoluminálně, mají hladký, ostře konturovaný okraj a po i.v. kontrastní látce enhancují homogenně, riziko rekurence je malé.
Endoskopie
Typickým nálezem je submukózní elastická masa s hladkými okraji vyklenující se do lumina, většinou krytá normální sliznicí, která však může v některých případech exulcerovat. Běžná endoskopická biopsie bývá příliš mělká a nezachytí nádorovou tkáň. Odběr polypektomickou kličkou je zatížen rizikem možné perforace a je třeba ho pečlivě uvážit. Nejpřínosnější bývá aspirace tenkou jehlou při endoskopické ultrasonografii.
Endoskopická ultrasonografie (EUS)
EUS dokáže s vysokou pravděpodobností rozlišit submukózní léze, jako jsou varixy, cysty, polypy, lipomy, leiomyomy, leiomyosarkomy, lymfomy, karcinoidy aj. od GIST – neurčí však s jistotou stupeň malignity. Někdy je užitečné opakované vyšetření k posouzení dynamiky procesu.
V průběhu EUS s výhodou provádíme cílenou aspiraci nádorové tkáně tenkou jehlou s následnou cytologickou a imunohistochemickou analýzou. Materiál vždy zašleme na RT-PCR k vyšetření KIT-mutace nezbytné pro diagnózu GIST, kterou však definitivně potvrdíme až po získání vzorku tkáně tumoru po jeho resekci.
Provedení předoperační biopsie se nedoporučuje, protože souhrn nálezů předchozích diagnostických postupů umožní určit s vysokou pravděpodobností diagnózu GIST, a nejde-li o metastazující tumor, je jeho resekce stejně jednoznačně indikovaná.
Biopsii však provádíme (a to i perkutánní) u rozsáhlých metastazujících nádorů. Je potřeba s jistotou potvrdit diagnózu GIST, plánujeme-li nasazení imatinibu s cílem zmenšit rozsah tumoru, a tím usnadnit jeho budoucí resekci. Biopsii provádíme též u tumorů, které jsou nepochybně neresekovatelné – zde k definitivnímu potvrzení diagnózy [3].
Jako komplikace biopsie hrozí nebezpečí ruptury kapsuly tumoru a implantačních metastáz na peritoneu, proto dáváme přednost cílené biopsii pod EUS kontrolou.
PET scan s fluorodeoxyglukózou (FDG-PET)
Toto vyšetření je velmi senzitivní u tumorů s vysokým metabolickým obratem glukózy. Pro stanovení primární diagnózy GIST se pro nízkou specificitu nehodí a nedosahuje výsledků získaných při kvalitně provedeném CT. Své místo má jen v případech, kdy výsledky předchozích vyšetření nejsou konzistentní [3].
FDG-PET se hodí spíše k monitoraci terapie imatinibem.
Chirurgická léčba GIST
Přístup chirurga je ovlivněn rozsahem (případně stupněm rozsevu) tumoru, jeho lokalizací a velikostí, důvěryhodností předoperační diagnózy a okolnostmi prezentace tumoru, jako je např. obstrukce nebo perforace střeva či masivní nekontrolovatelné krvácení.
Obecné principy chirurgické léčby GIST
Obecně platí, že každý GIST > 2 cm má být resekován, a to s jistotou zachování negativních operačních okrajů resektátu (obr. 2). Požadována je resekce segmentální se zachováním intaktní pseudokapsuly tumoru (je-li to možné). S tumorem je nutno zacházet opatrně, protože jeho ruptura může být zdrojem mnohočetných implantačních metastáz na peritoneu. Během operace je nutno provést pečlivou revizi břišní dutiny a povrchu jater k vyloučení možného metastatického postižení [22].
Obr. 2. Stromální nádor – odběr materiálu na histologické vyšetření [21]. ![Stromální nádor – odběr materiálu na histologické vyšetření [21].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ed4e6ad14e81655823dcbc1e7317288a.jpeg)
Laparoskopická resekce GIST žaludku (dokonce i tenkého střeva) je považována za bezpečnou, provádí-li ji zkušený, onkologicky zaměřený chirurg a dokáže-li zajistit negativní resekční okraje [23].
V případě zjištění pozitivních resekčních okrajů je lokální recidiva tumoru velmi pravděpodobná a je třeba indikovat zajišťovací léčbu imatinibem. Tuto léčbu též indikujeme u všech pacientů po resekci GIST > 3 cm, i tehdy, jsou-li okraje negativní – snížíme tak pravděpodobnost recidivy, která jinak přichází u cca poloviny pacientů do 5 let po operaci.
V případě rozsáhlých, obtížně resekovatelných tumorů s možností poškození důležitých orgánů během operace se doporučuje předoperační léčba imatinibem k retrakci masy tumoru a s cílem usnadnit plánovanou resekci.
GIST většinou nerostou invazivně do okolních orgánů, pouze je odtlačují, přesto je někdy nutné provést blokovou resekci pro rozsáhlé meziorgánové srůsty.
Rutinní lymfadektomie není nutná, protože metastázy do lymfatických uzlin jsou vzácné.
V současné době není jednoznačný názor na význam resekce malých incidentálních tumorů menších než 1 cm, které se vyskytují mnohem častěji, než se předpokládalo (viz výše) a jejichž maligní potenciál je nejistý. Někteří doporučují pravidelné endoskopické sledování těchto tumorů a k jejich resekci přistoupit, jen v případě, že začnou růst nebo jsou symptomatické.
Rozdíly v chirurgickém přístupu v jednotlivých částech GIT
Jícen
V jícnu se z mezenchymálních tumorů vyskytují zejména leiomyony, a to převážně v jeho dolní třetině. GIST jsou v jícnu vzácné, jde jen asi o 1 % ze všech GIST [22].
Při endoskopii jícnu obvykle nalézáme do lumina se vyklenující subslizniční elastickou a ohraničenou masu krytou normální sliznicí. Na základě endoskopie (bez přispění dalších vyšetření) nelze rozlišit, zda jde o GIST, nebo v této lokalizaci mnohem běžnější leiomyom.
K objasnění podstaty procesu je nutno provést endosonograficky zacílenou biopsii tenkou jehlou nebo FDG-PET vyšetření, které na rozdíl od leiomyomu prokáže u GIST vysoký metabolický obrat glukózy projevující se jasným a sytým zobrazením.
Při průkazu GIST je v jícnu chirurgické ošetření obtížnější než v dalších částech GIT uložených intraabdominálně, protože v jícnu není tumor fixován vrstvou serózy a navíc je segmentální resekce jícnu relativně kontraindikovaná kvůli jeho krevnímu zásobení při přirozených cévních anatomických poměrech. Jen v distální části jícnu lze někdy provést adekvátní lokální resekci s dostatečně negativními okraji. U GIST, které jsou lokalizovány v gastroezofageální junkci, a u všech GIST jícnu > 2 cm je doporučována totální („en bloc“) ezofagektomie [24].
Endoskopické excize kličkou elektrokauteru s koagulační elektrodou jsou v jícnu vyhrazeny zejména pro léčbu leiomyomů a jejich využití k léčbě GIST je rizikové až kontraindikované.
Žaludek
GIST se nejčastěji vyskytují v žaludku, jde o 1–3 % ze všech tumorů žaludku a o 60–70 % ze všech GIST. Vyskytují se v každém věku a u obou pohlaví, typicky však postihují převážně muže po 50. roce věku [22].
GIST nejčastěji rostou v žaludečním fundu, mohou však postihnout jakékoli místo v žaludku. Expandují často extraluminálně, ale mohou mít i tvar přesýpacích hodin při extragastrickém i intraluminálním růstu.
Malé stromální tumory bývají asymptomatické, zatímco rozsáhlejší se až v 60 % případů prezentují ulcerací a krvácením [25]. GIST se může manifestovat i anorexií, nauzeou, zvracením, hubnutím a/nebo abdominální bolestí. Perforace žaludku není běžná.
Diagnostický postup odpovídá obecným principům (viz výše).
Chirurgickým řešením je segmentální resekce GIST, a to preferenčně laparoskopickým přístupem. Tento postup je metodou volby – zejména proto, že i u malých tumorů můžeme prokázat mutaci KIT a maligní chování tumoru nelze vyloučit. Přesto bývá prognóza GIST žaludku obvykle výrazně lepší než při lokalizaci nádoru jinde v GIT [25].
Endoskopické odstranění GIST kličkou je možné, pro nebezpečí perforace žaludeční stěny je však prováděno jen po pečlivém zvážení všech pro a proti (nutnost zachování negativních okrajů) a indikovat a provést je může jen zkušený endoskopista.
Tenké střevo
Po žaludku je druhý nejčastější výskyt GIST v tenkém střevě (20–25 % ze všech GIST). Nejvíce je nacházíme v jejunu, poté v ileu a nejméně v duodenu. Ze všech mezenchymálních nádorů tenkého střeva tvoří GIST asi 85 % případů.
Nemocní si mohou stěžovat na abdominální bolest a hubnutí. Při vyšetření můžeme palpovat tumorózní masu a nezřídka zjišťujeme symptomy perforace střeva. GIST většinou roste extraluminálně, takže obstrukce střeva je vzácná a naopak bývá spíše typická pro leiomyom.
Metodou volby je pro chirurga segmentální resekce tumoru s dostatečnými negativními okraji, peritumorální resekce je zcela nevhodná a je zatížena vysokou pravděpodobností lokální rekurence tumoru. Do regionálních lymfatických uzlin GIST metastazují vzácně, proto není nutná (ani prospěšná) mezenterická lymfadektomie [22].
Prognóza závisí na adekvátnosti resekce, velikosti tumoru a jeho mitotické aktivitě. Po 5 letech přežívají cca dvě třetiny nemocných bez rekurence tumoru a celkové pětileté přežití nemocných se udává kolem 85 % [26].
Tlusté střevo a rektum
V této oblasti nacházíme pouze cca 5 % ze všech GIST a jen zcela raritně byl popsán GIST v oblasti apendixu, přesto v této lokalitě mezi mezenchymálními nádory GIST zcela převažují, a to zejména v oblasti rekta [27].
Při palpačním vyšetření rekta můžeme nalézt GIST jako tvrdý uzlík často menší než 1 cm. Větší GIST mohou být příčinou ulcerace sliznice rekta, krvácení, abdominálního diskomfortu a zácpy [22].
V kolon nacházíme GIST většinou jako transmurálně rostoucí tumory s extra i intraluminální komponentou.
Chirurgický přístup spočívá ve standardní kolektomii, podobné jako u výrazně četnějších adenokarcinomů.
Adjuvantní a neoadjuvantní léčba imatinibem
Chirurgická segmentální resekce GIST byla až do roku 2001 jedinou dostupnou léčbou. Pro pokročilost procesu nebyla kompletní resekce možná asi u poloviny pacientů a doba přežívání nemocných po stanovení diagnózy kolísala mezi 10 a 23 měsíci.
Dramatické zlepšení prognózy těchto nemocných souvisí s objevem prokazujícím, že vznik a růst nádorových buněk GIST je závislý na aktivační mutaci KIT nebo PDGFRA genů. To vedlo k vývoji efektivní systémové léčby, která spočívá v blokádě patologické systematické aktivace receptoru tyrozinkinázy pomocí jejích nízkomolekulárních inhibitorů (TKI), jako je imatinib (Glivec) nebo sunitinib (Sutent) (obr. 3).
Obr. 3. Dosažení CT kompletní remise při terapii imatinibem: A – před zahájením léčby: rozsáhlá tumorózní infi ltrace mezenteriálního tuku, střevních kliček, peritonea a omenta; B – po 14 týdnech léčby: regrese patologického infi ltrátu mezenteria, omenta a tenkých kliček ad integrum [29]. ![Dosažení CT kompletní remise při terapii imatinibem: A – před zahájením léčby: rozsáhlá tumorózní infi ltrace mezenteriálního tuku, střevních kliček, peritonea a omenta; B – po 14 týdnech léčby: regrese patologického infi ltrátu mezenteria, omenta a tenkých kliček ad integrum [29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8510020c5217a889ab0adac9b12e54df.jpeg)
Po zavedení této léčby do praxe se u pokročilých GIST zlepšilo přežívání nemocných z 10–23 měsíců na 60 měsíců (po stanovení diagnózy) a předpokládá se další zlepšení s nárůstem zatím limitované délky doby sledování.
Adjuvantní léčba
Pozitivní výsledky studií v současné době vedly k obecnému doporučení podávat adjuvantní léčbu imatinibem (400 mg/d, p. o.) všem rizikovým nemocným k prevenci rekurence GIST po úspěšné kompletní resekci tumoru. Např. v USA je léčba imatinibem schválena pro všechny nemocné po resekci GIST > 3 cm [28]. Není však zatím vyřešeno, jaká má být optimální délka adjuvantní léčby a jaký bude její dlouhodobý dopad.
Neoadjuvantní léčba
Úspěch léčby imatinibem rozšířil terapeutické možnosti a umožnil jeho použití v pokročilých stadiích choroby k předoperačnímu zmenšení nádorové masy GIST. Poté je možný menší rozsah chirurgické resekce, která je technicky jednodušší a umožní lépe zachovat funkčnost orgánů [28].
Ačkoli se jednotliví autoři zatím neshodli na přesných indikacích této neoadjuvantní léčby imatinibem, ta je využívána u neresekovatelných či hraničně resekovatelných tumorů nebo v těch případech, kdy by resekce byla možná jen za cenu extenzivní ablace orgánů.
V těchto případech je imatinib podáván obvykle 3–9 měsíců (poté je regresivní efekt na tumoru již minimální) a nemocný je v pravidelných cca tříměsíčních intervalech sledován zobrazovacími metodami (CT, případně FDG-PET); pokaždé jsou znovu přehodnoceny možnosti chirurgické resekce. Příznivý efekt se na CT projeví regresivními změnami v tumoru, úbytkem vaskularizace a klesající denzitou GIST. Nejde prvořadě o změnu velikosti tumoru (obr. 4) [28].
Obr. 4. Dosažení parciální remise při terapii imatinibem: A – před zahájením léčby: objemný, nehomogenní tumor vyplňuje celou levou polovinu dutiny břišní – 20 × 15 × 30 cm, od subfrenia až do pánve, přesahuje střední čáru; B – po 8 týdnech léčby: regrese tumoru o 50–60 %, převaha nekrotické tkáně [30]. ![Dosažení parciální remise při terapii imatinibem: A – před zahájením léčby: objemný, nehomogenní tumor vyplňuje celou levou polovinu dutiny břišní – 20 × 15 × 30 cm, od subfrenia až do pánve, přesahuje střední čáru; B – po 8 týdnech léčby: regrese tumoru o 50–60 %, převaha nekrotické tkáně [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7e57bbbe39432e29656e9283cd0b069c.jpeg)
Zatím nedošlo ke shodě, zda je výhodnější operovat v prvním okamžiku, kdy je resekce možná, či zda je lepší vyčkat maximálního efektu léčby imatinibem (v této chvíli je nejsprávnější individualizovaný přístup ke každému nemocnému, nejlépe v rámci činnosti vysoce specializovaného multidisciplinárního týmu).
Chirurgický přístup k pacientům s metastazujícím GIST
V případě metastazujícího GIST dnes léčíme v prvé řadě imatinibem, avšak chirurgická resekce primárního tumoru či ojedinělých metastáz může zlepšit osud nemocných a je prováděna z následujících důvodů:
- Léčba imatinibem omezí růst GIST ve více než 80 % případů, avšak kompletní remise/zmizení tumoru je velmi vzácné. Bylo prokázáno, že nekrotické části tumoru, které jsou i dle vysoce senzitivního metabolického zobrazení FDG-PET neživotné, stále obsahují živé nádorové buňky GIST, schopné rozsevu (obr. 5) [28].
- Většina pacientů, kteří jsou zpočátku na léčbu imatinibem senzitivní, v průměru po 2 letech léčby získají k imatinibu rezistenci a pouze malá část z nich profituje z navýšení dávky imatinibu (tj. ze 400 mg/d na 800 mg/d, p. o.) nebo z převedení na sunitinib (50 mg/d). Další možnosti léčby jsou limitované [28].
Obr. 5. Dosažení PET kompletní remise při terapii imatinibem: dolní řada obrázků – před zahájením léčby: ložiska ve zvětšených játrech, levém mezogastriu a malé pánvi retrovezikálně, ložiska vykazují kumulovanou aktivitu odpovídající metabolismu maligních buněk; horní řada obrázků – po 5 týdnech léčby: kontrolní scan nedetekuje žádná ložiska hypermetabolizmu glukózy svědčící pro přítomnost viabilní nádorové tkáně [31]. ![Dosažení PET kompletní remise při terapii imatinibem: dolní řada obrázků – před zahájením léčby: ložiska ve zvětšených játrech, levém mezogastriu a malé pánvi retrovezikálně, ložiska vykazují kumulovanou aktivitu odpovídající metabolismu maligních buněk; horní řada obrázků – po 5 týdnech léčby: kontrolní scan nedetekuje žádná ložiska hypermetabolizmu glukózy svědčící pro přítomnost viabilní nádorové tkáně [31].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d98f2606fb8e8ea9bc2ea38bfb0e142b.jpeg)
Včasná resekce reziduálního tumoru (včetně resektabilních metastáz v játrech a na peritoneu) může zabránit vzniku rezistentních klonů nádorových buněk a může předejít progresi GIST nebo ji zpozdit.
Časté i vícečetné metastázy GIST v játrech jsou ve specializovaných centrech úspěšně ošetřovány kombinovaným přístupem včetně embolizace a chemoembolizace (cisplatinou) do větví hepatální arterie, embolizací části porty či radiofrekvenční ablací neresektovatelných metastáz.
Kontinuální podávání imatinibu před operací i po ní je nezbytné.
Předoperační podávání imatinibu je pro pacienta výhodné též v případě plánování rozsáhlých resekcí – absence odpovědi na léčbu znamená „negativní biologickou selekci“ k jakékoli další léčbě. Nemáme co nabídnout těm pacientům, jejichž tumor progreduje i přes vysoce dávkovaný imatinib, či dokonce sunitinib. Chirurgická resekce jejich nepříznivou prognózu nezmění.
Je zřejmé, že správný čas k chirurgické resekci nastává v situaci, kdy léčbou imatinibem byly vytvořeny příznivé podmínky. Předoperační léčba imatinibem musí vždy kontinuálně pokračovat i po resekci.
Po operaci nemocné pravidelně sledujeme po 3–6 měsíců většinou s pomocí CT nebo případně i FDG-PET. V případě příznivého průběhu je třeba v této dispenzarizaci pokračovat minimálně po dobu 3–5 let [32].
Závěr
Na počátku současného desetiletí bylo zjištěno, že vznik a proliferace nádorových buněk GIST souvisí s patologickou systematickou aktivací receptoru tyrozinkinázy (RTK), která je nejčastěji důsledkem mutací genů na dlouhém raménku 4. chromozomu.
Následně byly do léčby GIST zavedeny nízkomolekulární inhibitory receptoru tyrozinkinázy (TKI), které blokují patologickou systematickou aktivaci RTK a dokážou zastavit proliferaci nádorových buněk GIST.
Efektivita nově zavedené léčby vedla ke změně chirurgického přístupu při léčbě GIST a umožnila výrazně radikálnější postupy vedoucí k pokud možno úplnému odstranění tumoru.
Poděkování
Chtěl bych poděkovat vážené paní MUDr. Iloně Kocákové, Ph.D., za laskavé zapůjčení obrázků.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.MUDr. Jiří Žabka
Klatovská nemocnice, a. s.
Plzeňská 569/II
339 01 Klatovy
e-mail: jirizabka@seznam.cz
Zdroje
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors – definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438(1): 1–12.
2. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29(1): 52–68.
3. Demetri G, Morgan J, Raut C. Epidemiology, classification, clinical presentation, and diagnostic work-up of gastrointestinal mesenchymal neoplasms including GIST. UpToDate [on line]. Vystaveno17.11.2009. Available from: <http://www.uptodate.com/online/content/topic.do?topicKey=stb_tumr/8100&selectedTitle=1~51&source=search_result>.
4. Sarlomo-Rikala M, Kovatich AJ, Barusevicius A et al. CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. Mod Pathol 1998; 11(8): 728–734.
5. Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical spectrum of GISTs at different sites and their differential diagnosis with a reference to CD117 (KIT). Mod Pathol 2000; 13(10): 1134–1156.
6. Janeway KA, Liegl B, Harlow A et al. Pediatric KIT wild-type and platelet-derived growth factor receptor alpha-wild-type gastrointestinal stromal tumors share KIT activation but not mechanisms of genetic progression with adult gastrointestinal stromal tumors. Cancer Res 2007; 67(19): 9084–9088.
7. Daum O, Vaněček T, Šíma R et al. Gastrointestinální stromální tumor: Současný pohled. Klin Onkol 2006; 19(4): 201–211.
8. Daum O, Linke Z, Vaněček T et al. Gastrointestinální strumální tumor. [online]. Vystaveno 16.4.2008. Dostupné z: <http://www.gist.nadory.cz/>.
9. Ernst SI, Hubbs AE, Przygodzki RM et al. KIT mutation portends poor prognosis in gastrointestinal stromal/smooth muscle tumors. Lab Invest 1998; 78(12): 1633–1636.
10. Lasota J, Jasinski M, Sarlomo-Rikala M et al. Mutations in exon 11 of c-Kit occur preferentially in malignant versus benign gastrointestinal stromal tumors and do not occur in leiomyomas or leiomyosarcomas. Am J Pathol 1999; 154(1): 53–60.
11. Nilsson B, Bümming P, Meis-Kindblom JM et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era-a population-based study in western Sweden. Cancer 2005; 103(4): 821–829.
12. Tryggvason G, Gíslason HG, Magnússon MK et al. Gastrointestinal stromal tumors in Iceland, 1990–2003: the icelandic GIST study, a population-based incidence and pathologic risk stratification study. Int J Cancer 2005; 117(2): 289–293.
13. Goettsch WG, Bos SD, Breekveldt-Postma N et al. Incidence of gastrointestinal stromal tumours is underestimated: results of a nation-wide study. Eur J Cancer 2005; 41(18): 2868–2872.
14. Kawanowa K, Sakuma Y, Sakurai S et al. High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol 2006; 37(12): 1527–1535.
15. Maeyama H, Hidaka E, Ota H et al. Familial gastrointestinal stromal tumor with hyperpigmentation: association with a germline mutation of the c-kit gene. Gastroenterology 2001; 120(1): 210–215.
16. Graadt van Roggen JF, van Velthuysen ML, Hogendoorn PC. The histopathological differential diagnosis of gastrointestinal stromal tumours. J Clin Pathol 2001; 54(2): 96–102.
17. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23(3): 70–83.
18. Fletcher CD, Berman JJ, Corless C et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol 2002; 33(5): 459–465.
19. Huang HY, Li CF, Huang WW et al. A modification of NIH consensus criteria to better distinguish the highly lethal subset of primary localized gastrointestinal stromal tumors: a subdivision of the original high-risk group on the basis of outcome. Surgery 2007; 141(6): 748–756.
20. Pink D, Schoeler D, Lindner T et al. Severe hypoglycemia caused by paraneoplastic production of IGF-II in patients with advanced gastrointestinal stromal tumors: a report of two cases. J Clin Oncol 2005; 23(27): 6809–6811.
21. Kocáková I, Špelda S, Vetchá H et al. Imatinib mesylate – the first effective molecularly targeted drug therapy for GIST. 6th Int. Congress: Perspective in colorectal cancer. Barcelona 2004, Proceeding book: 302.
22. Demetri G, Morgan J, Raut C. Local treatment for gastrointestinal stromal tumors, leiomyomas, and leiomyosarcomas of the gastrointestinal tract. UpToDate [online]. Vystaveno 11.1.2010. Available from: <http://www.uptodate.com/online/content/topic.do?topicKey=stb_tumr/13782&selectedTitle=2~51&source=search_result>.
23. Huguet KL, Rush RM Jr, Tessier DJ et al. Laparoscopic gastric gastrointestinal stromal tumor resection: the mayo clinic experience. Arch Surg 2008; 143(6): 587–590.
24. Miettinen M, Sarlomo-Rikala M, Sobin LH et al. Esophageal stromal tumors: a clinicopathologic, immunohistochemical, and molecular genetic study of 17 cases and comparison with esophageal leiomyomas and leiomyosarcomas. Am J Surg Pathol 2000; 24(2): 211–222.
25. Igwilo OC, Byrne MP, Nguyen KD et al. Malignant gastric stromal tumor: unusual metastatic patterns. South Med J 2003; 96(5): 512–515.
26. Huang CC, Yang CY, Lai IR et al. Gastrointestinal stromal tumor of the small intestine: a clinicopathologic study of 70 cases in the postimatinib era. World J Surg 2009; 33(4): 828–834.
27. Miettinen M, Furlong M, Sarlomo-Rikala M et al. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases. Am J Surg Pathol 2001; 25(9): 1121–1133.
28. Demetri G, Morgan J, Raut C. Adjuvant and neoadjuvant imatinib for gastrointestinal stromal tumors. UpToDate [on line]. Vystaveno 9.6.2009. Available from: <http://www.uptodate.com/online/content/topic.do?topicKey=stb_tumr/15134&selectedTitle=4~51&source=search_result>.
29. Kocáková I, Verchovski D, Špelda S et al. Therapy of GIST by Imatinib Mesylate (Glivec) – a Specific Inhibitor of the c-Kit Receptor Tyrosine Kinase. 16th Int. Congress on Anti-cancer Treatment. Paris 2005, Proceeding book: 251.
30. Kocáková I, Špelda S, Kocák I. Imatinib mesylate and sunitinib malate in the treatment of metastatic gastrointestinal stromal tumor, 19th Int. Congress on Anti-cancer Treatment. Paris 2008, Proceeding book: 218–219.
31. Kocáková I, Kocák I, Špelda S et al. Staging and prediction of response to imatinib mesylate (IM) therapy of metastatic or locally andvanced gastrointestinal stromal tumors (GIST) according to F-FDG PET and CT scan, one centre study. 19th Int. Congress on Anti-cancer Treatment. Paris 2008, Proceeding book: 219–220.
32. DeMatteo RP, Lewis JJ, Leung D et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 2000; 231(1): 51–58.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Selén a rakovina: od prevencie k liečbe
- High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů
- Gastrointestinální stromální tumory
- In vitro hodnocení prostupnosti cytotoxických léčiv přes rekonstruovanou lidskou epidermis a ústní epitel
- Dynamika vývoja psychosociálnej záťaže prežívajúcich pacientok s karcinómom prsníka: klinický úspech s psychosociálnymi dôsledkami
- Radiofrekvenční ablace neuroendokrinního nádoru pankreatu
- Regrese osteolytického ložiska u pacienta s mnohočetným myelomem léčeného klodronátem po úspěšné terapii režimem s bortezomibem
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
- Paliativní péče v České republice v roce 2011 – několik poznámek
- Avastin v léčbě karcinomu prsu
- Zápis ze schůze výboru České onkologické společnosti dne 5. 4. 2011 v Praze
- Zápis ze schůze výboru České onkologické společnosti dne 27. 5. 2011 v MOÚ v Brně
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Gastrointestinální stromální tumory
- Selén a rakovina: od prevencie k liečbe
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



