-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ischemická choroba srdca a hypertenzia ako neskoré následky liečby nádorov testis – prehľad
Coronary Heart Disease and Hypertension as Late Effects of Testicular Cancer Treatment – a Minireview
The modern treatment of testicular cancer has led to notable improvement in the prognosis of these patients. A significant number of testicular cancer survivors suffer from late effects of their treatment that can occur several years after the treatment. Cardiovascular late effects represent one of the most serious effects with respect to their life-threatening potential. Considering the higher risk of coronary heart disease, numerous studies have investigated the prevalence of cardiovascular risk factors in patients treated for testicular cancer. Higher prevalence of hypertension in patients after treatment for testicular cancer may be one of the reasons for their serious cardiovascular morbidity and mortality. The aim of this is to summarize the current knowledge on the impact of review treatment modalities used in testicular cancer therapy on prevalence of hypertension and its pathogenetic context. Both chemotherapy and radiotherapy are associated with increased prevalence of hypertension several years after completing the treatment. In patients treated with chemotherapy, hypertension is associated with administration of cisplatin. Regular and long-term monitoring of cardiovascular risk should be introduced to ensure better quality of life in these patients.
Key words:
testicular cancer – late effects – cardiotoxicity – coronary heart disease – hypertension – endothelial dysfunction
Autoři: M. Valentová 1,2; B. Mladosievičová 1
Působiště autorů: Oddelenie klinickej patofyziológie LF UK v Bratislave, Slovenská republika 1; I. interná klinika LF UK v Bratislave, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2011; 24(1): 18-22
Kategorie: Přehledy
Souhrn
Pokroky v liečbe nádorov testis viedli k výraznému zlepšeniu prognózy pacientov. U významnej časti vyliečených pacientov dochádza s odstupom niekoľkých rokov k rozvoju neskorých následkov liečby. Kardiovaskulárne neskoré následky patria z hľadiska možného ohrozenia života k najzávažnejším. Vzhľadom na zvýšené riziko vzniku ischemickej choroby srdca sa mnohé štúdie venovali objasneniu výskytu kardiovaskulárnych rizikových faktorov u pacientov po liečbe nádorov testis. Zvýšený výskyt hypertenzie po absolvovaní liečby môže byť jednou z príčin závažnej kardiovaskulárnej morbidity a mortality tejto skupiny pacientov. Cieľom práce je zhrnutie súčasných poznatkov o vplyve jednotlivých liečebných modalít nádorov testis na výskyt hypertenzie a objasnenie patogenetických súvislostí. Chemoterapia aj rádioterapia súvisia so zvýšeným výskytom hypertenzie pozorovaným niekoľko rokov po ukončení liečby nádorov testis. U pacientov liečených chemoterapiou sa zistila súvislosť hypertenzie s podaním cisplatiny. Z hľadiska zlepšenia dlhodobej úspešnosti liečby a kvality života pacientov bude potrebné pravidelné a dlhodobé monitorovanie kardiovaskulárneho rizika týchto pacientov.
Kľúčové slová:
nádory testis – neskoré následky liečby – kardiotoxicita – ischemická choroba srdca – hypertenzia – endoteliálna dysfunkciaÚvod
Nádory testis predstavujú solídne nádory s najpriaznivejšou prognózou s 10-ročným prežívaním pacientov viac ako 95 % [1,2]. Ich incidencia vykazuje dlhodobo rastúci trend, pričom za uplynulé desaťročia vzrástla v európskych krajinách 3 - až 4-násobne [3–5]. Najčastejší výskyt tohto nádorového ochorenia je zaznamený u mužov vo veku 15–44 rokov [6]. Na rozdiel od incidencie mortalita pacientov s nádormi testis od polovice 70. rokov postupne klesá, čo sa dáva do súvislosti s celkovou optimalizáciou liečebnej stratégie a predovšetkým so zavedením cisplatiny do chemoterapeutických protokolov [7].
Napriek výraznému zlepšeniu prognózy ochorenia sú terapeutické postupy používané v súčasnosti sprevádzané viacerými nežiaducimi účinkami (tab. 1), ktoré sa prejavujú v mnohých prípadoch až s odstupom niekoľkých rokov po ukončení liečby. Klinické štúdie skúmajúce neskoré následky jednotlivých liečebných modalít, predovšetkým chemoterapie s obsahom cisplatiny a rádioterapie, neustále pribúdajú [8–11]. Pre zlepšenie dlhodobej úspešnosti liečby je preto potrebné hľadať nové východiská pre stratifikáciu rizika možných neskorých následkov a možnosti ich prevencie a včasnej liečby. Dôležitú bázu v tomto procese tvorí pochopenie patogenézy nežiaducich účinkov.
K potenciálne najzávažnejším neskorým následkom antineoplastickej liečby u pacientov s nádormi testis, ktoré môžu viesť k predčasnej smrti, patria kardiovaskulárne ochorenia [12]. Ischemická choroba srdca (ICHS) predstavuje časté ochorenie pacientov po liečbe nádoru testis [13–15]. Autori Meinardi et al zistili v súbore 87 pacientov po chemoterapeutickej liečbe metastazujúceho nádoru testis v kompletnej remisii > 10 rokov 7-krát vyššie riziko vzniku ICHS v porovnaní s bežnou populáciou (95% konfidenčný interval [CI] 1,9–18,3), medián veku pacientov v čase sledovania bol 41 rokov [13]. Signifikantne vyšší výskyt ICHS ≥ 5 rokov po stanovení diagnózy nádoru testis v porovnaní s bežnou populáciou (štandardizovaný index incidencie – standardized incidence ratio – SIR – 1,2; 95% CI 1,0–1,3) dokázali aj autori holandskej štúdie van den Belt-Dusebout et al na početnom súbore pacientov (n = 2 512), pričom riziko ICHS bolo najvyššie 10–19 rokov po stanovení diagnózy základného ochorenia a u pacientov < 55 rokov [14]. Z výsledkov štúdie vyplýva, že po antineoplastickej liečbe sú pacienti ohrození rozvojom ICHS v pomerne mladom veku, pričom ICHS býva diagnostikovaná najčastejšie až s odstupom viac ako 10 rokov po stanovení diagnózy nádorového ochorenia. Z hľadiska aplikovaných liečebných modalít ohrozuje ICHS predovšetkým pacientov liečených kombináciou chemoterapie a rádioterapie [14,16].
Zvýšené kardiovaskulárne riziko pacientov po prekonaní nádoru testis je závažným zistením, napriek tomu sa mu v rámci dispenzarizácie pacientov po ukončení liečby v ambulanciách onkológov a neskôr všeobecných lekárov často nevenuje náležitá pozornosť. Európska urologická spoločnosť odporúča aktívný skríning kardiovaskulárnych ochorení a metabolického syndrómu u pacientov s nádormi testis po ukončení liečby [17]; forma, frekvencia a dĺžka sledovania však nie sú bližšie špecifikované. Výsledky štúdií skúmajúcich výskyt kardiovaskulárnych rizikových faktorov – hypertenzie, dyslipidémie, obezity a metabolického syndrómu u pacientov s nádormi testis po ukončení liečby [9,13,18–22] naznačujú, že kľúčovú úlohu pri rozvoji ICHS zohráva nepriaznivý kardiovaskulárny rizikový profil. Výskyt hypertenzie je spomedzi všetkých kardiovaskulárnych rizikových faktorov najlepšie preskúmaný a výsledky jednotlivých štúdií sú pomerne jednotné.
Hypertenzia predstavuje nezávislý kardiovaskulárny rizikový faktor [23]. V bežnej populácii rastie kardiovaskulárne riziko lineárne už od hodnôt krvného tlaku 115/75 mmHg [24].
V nedávno uverejnenej štúdii zistil autorský kolektív Haugnes et al v súbore 990 pacientov po liečbe nádoru testis (medián času sledovania 19 rokov) vyššiu prevalenciu antihypertenzívnej liečby v porovnaní so zdravými mužmi rovnakého veku (22 % νs 13 %); výnimkou bola skupina pacientov, ktorí boli liečení iba orchiektómiou [16]. Zvýšený výskyt hypertenzie po chemoterapeutickej liečbe s obsahom cisplatiny a/alebo po ožiarení potvrdila aj ďalšia štúdia [18].
Hypertenzia a cisplatina
Výskyt vysokého krvného tlaku u pacientov po chemoterapeutickej liečbe obsahujúcej cisplatinu je udávaný v rozmedzí 13% až 53% [9,13,16,25–29]. Podľa výsledkov vyššie spomenutej štúdie je pravdepodobnosť výskytu hypertenzie (vyjadrená ako pomer pravdepodobnosti, odds ratio – OR) u pacientov, ktorí boli liečení chemoterapiou, až 3-násobne vyššia v porovnaní so zdravými mužmi rovnakého veku (OR 3,3; 95% CI 2,4–4,5) [16].
Doteraz najväčšou publikovanou štúdiou skúmajúcou tlak krvi u pacientov po liečbe nádorov testis a prvou, ktorá porovnávala výsledky s kontrolnou skupinou zdravých mužov, bola nórska štúdia autorského kolektívu Sagstuen et al. Štúdie sa zúčastnilo 1 289 pacientov s mediánom veku v čase sledovania 44 rokov a mediánom dĺžky sledovania 11 rokov. Z výsledkov štúdie vyplýva, že výskyt hypertenzie je u pacientov niekoľko rokov po liečbe signifikantne vyšší v porovnaní so zdravými mužmi (OR = 1,4; 95% CI 1,2–1,7). Chirurgická liečba pritom riziko hypertenzie nezvyšuje, na rozdiel od chemoterapie a rádioterapie. V porovnaní s pacientami liečenými iba chirurgicky je riziko vysokého krvného tlaku najvyššie u pacientov, ktorým bola podaná vysoká kumulatívna dávka cisplatiny (> 850 mg/m²) – tab. 2 [18].
Súvislosť podávania cisplatiny s výskytom hypertenzie bola potvrdená aj ďalšími štúdiami [13,29]. V holandskej štúdii bol v skupine 87 pacientov 2 až 17 rokov po chemoterapeutickej liečbe s obsahom cisplatiny systolický a diastolický tlak krvi signifikantne vyšší a hypertenzia bola diagnostikovaná častejšie v porovnaní s pacientami liečenými iba orchiektómiou (13 % νs 39 %; p = 0,003) [13]. Echokardiograficky vykazujú pacienti s hypertenziou väčšiu hrúbku steny ľavej komory v porovnaní s normotenznými pacientami (9,5 mm νs 8,7 mm; p = 0,02) [13], čo demonštruje následky zvýšenia krvného tlaku v podobe remodelácie steny ľavej komory.
Platinové deriváty predstavujú významný benefit v liečbe nádorov testis. Okrem nádorových buniek však účinkujú toxicky aj na bunky nenádorové, čím sa vysvetľuje ich pomerne dobre preskúmaná nefrotoxicita [30–32], neurotoxicita [33–35], ototoxicita [36] a sekundárna tumorigenéza [37]. Patomechanizmus vedúci k zvyšovaniu krvného tlaku v súvislosti s týmito derivátmi nebol zatiaľ kompletne objasnený. Platinové komplexy viazané na DNA pretrvávajú v tkanivách niekoľko rokov po ukončení podávania platiny [38,39]. V plazme je cisplatina detekovateľná dokonca 20 rokov po skončení terapie [40]. Koncentrácia platiny v moči a v plazme pacientov je niekoľko rokov po ukončení liečby až 1 000-násobne vyššia v porovnaní s neexponovanými jedincami [41], pričom platina ostáva naďalej čiastočne reaktívna [42]. K zvyšovaniu krvného tlaku môžu viesť platinové deriváty dlhodobým poškodzovaním obličiek alebo chronickou aktiváciou endotelu (obr. 1), detailnejšie pochopenie patomechanizmu si vyžaduje ďalší výskum.
Obr. 1. Možný patomechanizmus podieľajúci sa na zvýšenom výskyte ICHS u pacientov po liečbe nádorov testis. ICHS – ischemická choroba srdca. 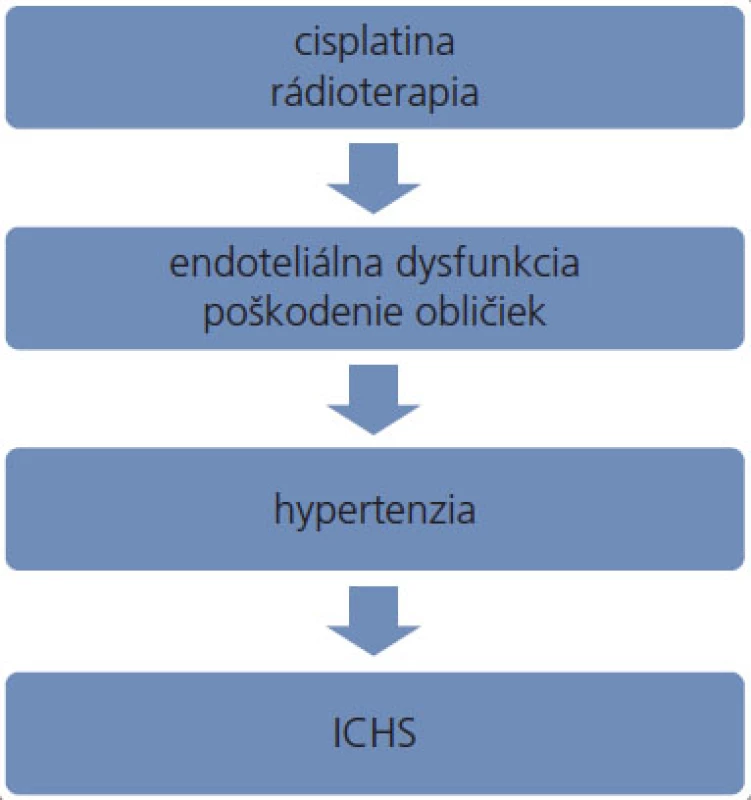
Autori Fossa et al zistili u 13 zo 44 (29,5 %) pacientov liečených cisplatinou 13 až 17 rokov po stanovení diagnózy pretrvávajúce zníženie renálnych funkcií pod 70 %, pričom závažnosť nefrotoxicity súvisela s kumulatívnou dávkou cisplatiny [31]. Hypomagnezémia, ktorá zvyšuje vazospastickú odpoveď cievnej steny [43,44], sa pravidelne zisťuje u pacientov počas podávania cisplatiny a bezprostredne po liečbe [31]. Pozorovaná normalizácia koncentrácie sérového magnézia niekoľko mesiacov po liečbe môže byť sprevádzaná jeho intracelulárnym deficitom [45].
Aktivácia endotelu cisplatinou
In vitro štúdie potvrdili schopnosť cisplatiny stimulovať endotel a viesť k jeho poškodeniu [46–48]. Priama vaskulárna toxicita cisplatiny tak môže stimulovať produkciu proinflamačných a vazokonstrikčných mediátorov ešte niekoľko rokov po ukončení jej podávania a viesť k zvyšovaniu periférnej cievnej rezistencie. Autori Nuver et al zistili prítomnosť mikroalbuminúrie (marker endoteliálnej dysfunkcie) u 10 z 90 (12 %) pacientov liečených chemoterapiou, nezistila sa však u žiadneho z pacientov po orchiektómii a ani v skupine zdravých mužov [49]. Po liečbe nádorov testis sa u pacientov pravidelne zisťujú abnormálne zvýšené koncentrácie ďalších markerov endoteliálnej dysfunkcie (vysokosenzitívny C-reaktívny proteín, von Willebrandov faktor, inhibítor plazminogénového aktivátora a tkanivový plazminogénový aktivátor) [49–51], ako aj markery včasnej aterosklerózy (intimomediálny index karotickej tepny a prietokom podmienená dilatácia arteria brachialis) [50,52]. V štúdii autorov Vaughn et al boli zistené signifikantne zvýšené hladiny cirkulujúcich endotelových buniek (vznikajú odlučovaním poškodených endotelových buniek) v skupine pacientov liečených chemoterapiou v porovnaní s pacientami, ktorým chemoterapia podaná nebola [52].
Hypertenzia a rádioterapia
Súvislosť hypertenzie a rádioterapie nebola u pacientov s nádormi testis jednoznačne dokázaná. Autorský kolektív Sagstuen et al zistil v tejto skupine pacientov signifikantne vyššie riziko hypertenzie v porovnaní s kontrolnou skupinou (OR = 1,3) v skupine pacientov liečených kombináciou rádioterapie a chemoterapie sa však riziko hypertenzie signifikantne nelíšilo v porovnaní s pacientami liečenými iba chemoterapiou [18]. V inej štúdii sa zistil najvyšší vzostup prevalencie hypertenzie počas dispenzarizácie v skupine pacientov liečených rádioterapiou (z 25,0 % na 41,7 % počas priemernej doby sledovania 7 rokov) [20], autori však pri interpretácii výsledkov nezohľadnili vek pacientov, pričom treba uvážiť, že pacienti liečení rádioterapiou bývajú v priemere starší než pacienti liečení chemoterapiou.
Rádioterapia môže viesť k zvyšovaniu krvného tlaku ovplyvnením renálnych funkcií. Vplyv infradiafragmatickej rádioterapie používanej v liečbe pacientov s nádormi testis na funkciu obličiek nebol doposiaľ preskúmaný vo väčšej prospektívnej štúdii. Autori Fossa et al vyšetrovali renálne funkcie u 18 pacientov liečených rádioterapiou počas 13 rokov po stanovení diagnózy a dospeli k záveru, že už dávky žiarenia < 20 Gy spôsobujú subklinické poškodenie obličiek [31]. Na rozdiel od poklesu renálnych funkcií po podaní cisplatiny, ktorý vzniká bezprostredne, poškodenie renálnych funkcií po ožiarení sa vyvíja postupne a manifestuje sa s odstupom 3–5 rokov po liečbe [31,53].
Pri kombinovaní chemoterapie s rádioterapiou je výsledná nefrotoxicita závažnejšia než po použití samotnej chemoterapie [31,45]. Histologicky je u pacientov so zníženou renálnou funkciou po infradiafragmatickej rádioterapii dokázateľná postupne progredujúca skleróza malých ciev [31].
Súhrn a perspektívy
Špecifické epidemiologické charakteristiky nádorov testis – nárast incidencie, pomerne mladý vek pacientov v čase diagnózy a pokles mortality – nastoľujú nové výzvy pre klinickú prax a výskum, ktorých cieľom je zlepšenie kvality a dĺžky života vyliečených a dlhodobo prežívajúcich pacientov minimalizáciou neskorých následkov liečby. Základným predpokladom kontroly neskorých následkov je poznanie ich rizika na strane pacientov, ale aj lekárov, v ktorých starostlivosti sú pacienti po ukončení liečby. Výsledky štúdií dokazujú zvýšený výskyt hypertenzie u pacientov po liečbe nádorov testis v porovnaní s bežnou populáciou rovnakého veku, predovšetkým po podaní vysokej kumulatívnej dávky cisplatiny a kombinácii chemoterapie s rádioterapiou [16,18]. Hypertenzia môže sekundárne viesť k závažnej kardiovaskulárnej morbidite a mortalite pozorovanej u týchto pacientov [13–15].
Patomechanizmus vysvetľujúci zvyšovanie krvného tlaku nebol doposiaľ jednoznačne objasnený. Kľúčová by podľa výsledkov preklinických a klinických štúdií mohla byť úloha endotelu, ktorý reaguje na poškodenie cisplatinou tvorbou metabolitov oxidačného stresu a prozápalových cytokínov [46–48]. Vzhľadom na dlhodobé pretrvávanie cisplatiny v tkanivách, plazme a moči pacientov [39–42] môže byť chronická stimulácia endotelu touto látkou príčinou zvyšovania periférnej cievnej rezistencie.
Meranie tlaku krvi, ktoré by bolo pravidelne vykonávané spolu so zisťovaním čo najširšieho spektra ďalších kardiovaskulárnych rizikových faktorov, by mohlo výraznou mierou prispieť k včasnej diagnostike a liečbe kardiovaskulárnych ochorení. Vzhľadom na to, že neskoré kardiovaskulárne následky sa manifestujú často až s odstupom ≥ 10 rokov po diagnóze základného ochorenia [14], sú pacienti v ambulanciách onkológov sledovaní pomerne krátko (5–10 rokov). Z týchto dôvodov by bolo potrebné rozšíriť povedomie a zodpovednosť za screening kardiovaskulárnych ochorení u všeobecných lekárov, ktorí pacientov zo starostlivosti onkológov preberajú, resp. predĺžiť onkologickú dispenzárnu starostlivosť. Optimalizáciu dispenzárnej starostlivosti by mohli priniesť modely stratifikácie kardiovaskulárneho rizika pacientov [11]. Pri určovaní rizika by bolo vhodné zohľadniť okrem kardiovaskulárnych rizikových faktorov bežnej populácie aj aplikovanú liečebnú modalitu a dávku. Do budúcnosti sa pre presný odhad rizika neskorých kardiovaskulárnych následkov javí perspektívne využitie metód molekulárnej genetiky. Popri určovaní genetických markerov predikujúcich kardiovaskulárne riziko, ktoré boli identifikované pre bežnú populáciu [54–57], napreduje aj výskum genetických determinantov toxicity liečby. Toxicita podanej dávky liečiva vykazuje interindividuálnu variabilitu determinovanú polymorfizmami génov kódujúcich biotransformačné enzýmy a enzýmy potrebné pre metabolizmus chemoterapeutík [58]. U pacientov s nádormi testis boli genetické prediktory rizika neskorých následkov liečby (predovšetkým ototoxicity) už čiastočne preskúmané [59–62]. Genetické markery kardiotoxicity cisplatiny v tejto skupine pacientov vyžadujú ďalší výskum.
Navrhnuté riešenia by mohli dopomôcť optimalizovať a individualizovať prevenciu neskorých kardiovaskulárnych následkov liečby nádorov testis, a mohli by tak zlepšiť dlhodobú efektivitu protinádorovej liečby.
Poďakovanie
Za odborné usmernenia vyjadrujeme poďakovanie MUDr. Michalovi Megovi, PhD., z Národného onkologického ústavu v Bratislave.
Práca bola čiastočne podporená grantom Ministerstva zdravotníctva SR 2007/42-UK-18.
This work was partly supported by a grant from the Ministry of Health of Slovak Republic SR 2007/42-UK-18.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. MUDr. Beata Mladosievičová, CSc.
Oddelenie klinickej patofyziológie
Lekárska fakulta Univerzita Komenského
Sasinkova 4
811 08 Bratislava
Slovenská republika
e-mail: beata.mladosievicova@fmed.uniba.sk
Obdrženo/Submitted: 30. 7. 2010
Přijato/Accepted: 19. 8. 2010
Zdroje
1. Horner MJ, Ries LAG, Krapcho M et al. SEER Cancer Statistics Review, 1975–2006, National Cancer Institute. Bethesda, MD. http://seer.cancer.gov/csr/1975_2006/, based on November 2008 SEER data submission, posted to the SEER web site, 2009.
2. Verdecchia A, Francisci S, Brenner H et al. Recent cancer survival in Europe: a 2000–02 period analysis of EUROCARE-4 data. Lancet Oncol 2007; 8(9): 784–796.
3. Huyghe E, Matsuda T, Thonneau P. Increasing incidence of testicular cancer worldwide: a review. J Urol 2003; 170(1): 5–11.
4. Moger TA, Aalen OO, Heimdal K et al. Analysis of testicular cancer data using a frailty model with familial dependence. Stat Med 2004; 23(4): 617–632.
5. Safaei Diba Ch, Pleško I. Cancer incidence in the Slovak Republic 2004. National Cancer Registry of the Slovak Republic. Bratislava: National Health Information Center 2008 : 168.
6. Ondrusova M, Ondrus D. Epidemiological features of testicular cancer in the Slovak Republic – retrospective study. Klin Onkol 2009; 22(2): 52–57.
7. Ondrušová M, Ondruš D. Nádory testis: Epidemiológia, etiológia, patológia a diagnostika. Urol List 2006; 4(3): 17–21.
8. Ondrusova M, Ondrus D, Dusek L et al. Damage of hormonal function and bone metabolism in long-term survivors of testicular cancer. Neoplasma 2009; 56(6): 473–479.
9. Strumberg D, Brugge S, Korn MW et al. Evaluation of long-term toxicity in patients after cisplatin-based chemotherapy for nonseminomatous testicular cancer. Ann Oncol 2002; 13(2): 229–236.
10. Kollmannsberger C, Kuzcyk M, Mayer F et al. Late toxicity following curative treatment of testicular cancer. Semin Surg Oncol 1999; 17(4): 275–281.
11. Travis LB, Beard C, Allan J M et al. Testicular Cancer Survivorship: Research Strategies and Recommendations. J Natl Cancer Inst 2010; 102(15): 1–17.
12. van den Belt-Dusebout AW, de Wit R, Gietema JA et al. Treatment-specific risks of second malignancies and cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol 2007; 25(28): 4370–4378.
13. Meinardi MT, Gietema JA, van der Graaf WT et al. Cardiovascular morbidity in long-term survivors of metastatic testicular cancer. J Clin Oncol 2000; 18(8): 1725–1732.
14. van den Belt-Dusebout AW, Nuver J, de Wit R et al. Long-term risk of cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol 2006; 24(3): 467–475.
15. Huddart RA, Norman A, Shahidi M et al. Cardiovascular disease as a long-term complication of treatment for testicular cancer. J Clin Oncol 2003; 21(8): 1513–1523.
16. Haugnes HS, Wethal T, Aass N et al. Cardiovascular risk in long-term testicular cancer survivors. J Clin Oncol 2010; 28 (Suppl): abstr. 4533.
17. Krege S, Beyer J, Souchon R et al. European consensus conference on diagnosis and treatment of germ cell cancer: a report of the second meeting of the European Germ Cell Cancer Consensus Group (EGCCCG): part II. Eur Urol 2008; 53(3): 497–513.
18. Sagstuen H, Aass N, Fosså SD et al. Blood pressure and body mass index in long-term survivors of testicular cancer. J Clin Oncol 2005; 23(22): 4980–4990.
19. Boyer M, Raghavan D, Harris PJ et al. Lack of late toxicity in patients treated with cisplatin-containing combination chemotherapy for metastatic testicular cancer. J Clin Oncol 1990; 8(1): 21–26.
20. Oh JH, Baum DD, Pham S et al. Long-term complications of platinum-based chemotherapy in testicular cancer survivors. Med Oncol 2007; 24(2): 175–181.
21. Haugnes HS, Aass N, Fosså SD et al. Components of the metabolic syndrome in long-term survivors of testicular cancer. Ann Oncol 2007; 18(2): 241–248.
22. Nord C, Fosså SD, Egeland T. Excessive annual BMI increase after chemotherapy among young survivors of testicular cancer. Br J Cancer 2003; 88(1): 36–41.
23. Wilson PW, D’Agnostino RB, Levy D et al. Prediction of coronary heart disease using risk factor categories. Circulation 1998; 97(18): 1837–1847.
24. Lewington S, Clarke R, Qizilbash N et al. Age-specific relevance of usual blood pressure to vascular mortality: A meta-analysis of individual data for one million adults in 61 prospective studies. Prospective Studies Collaboration. Lancet 2002; 360(9349): 1903–1913.
25. Gietema JA, Sleijfer DT, Willemse PH et al. Long-term follow-up of cardiovascular risk factors in patients given chemotherapy for disseminated nonseminomatous testicular cancer. Ann Intern Med 1992; 16(9): 709–715.
26. Hansen SW, Groth S, Daugaard G et al. Long-term effects on renal function and blood pressure of treatment with cisplatin, vinblastine, and bleomycin in patients with germ cell cancer. J Clin Oncol 1988; 6(11): 1728–1731.
27. Bissett D, Kunkeler L, Zwanenburg L et al. Long-term sequelae of treatment for testicular germ cell tumours. Br J Cancer 1990; 62(4): 655–659.
28. Stoter G, Koopman A, Vendrik CP et al. Ten-year survival and late sequelae in testicular cancer patients treated with cisplatin, vinblastine, and bleomycin. J Clin Oncol 1989; 7(8): 1099–1104.
29. Bokemeyer C, Berger CC, Kuczyk MA et al. Evaluation of long-term toxicity after chemotherapy for testicular cancer. J Clin Oncol 1996; 14(11): 2923–2932.
30. Petersen PM, Hansen SW. The course of long-term toxicity in patients treated with cisplatin-based chemotherapy for non-seminomatous germ-cell cancer. Ann Oncol 1999; 10(12): 1475–1483.
31. Fosså SD, Aass N, Winderen M et al. Long-term renal function after treatment for malignant germ-cell tumours. Ann Oncol 2002; 13(2): 222–228.
32. Daugaard G, Rossing N, Rørth M. Effects of cisplatin on different measures of glomerular function in the human kidney with special emphasis on high-dose. Cancer Chemother Pharmacol 1988; 21(2): 163–167.
33. Thompson SW, Davis LE, Kornfeld M et al. Cisplatin neuropathy. Clinical, electrophysiologic, morphologic and toxicologic studies. Cancer 1984; 54(7): 1269–1275.
34. Hansen SW, Helweg-Larsen S, Trojaborg W. Long-term neurotoxicity in patients treated with cisplatin, vinblastin, and bleomycin for metastatic germ cell cancer. J Clin Oncol 1989; 7(10): 1457–1461.
35. Higa GM, Wise TC, Crowell EB. Severe, disabling neurologic toxicity following cisplatin retreatment. Ann Pharmacother 1995; 29(2): 134–137.
36. Bokemeyer C, Berger CC, Hartmann JT et al. Analysis of risk factors for cisplatin-induced ototoxicity in patients with testicular cancer. Br J Cancer 1998; 77(8): 1355–1362.
37. Travis LB, Fosså SD, Schonfeld SJ et al. Second cancers among 40,576 testicular cancer patients: focus on long-term survivors. J Natl Cancer Inst 2005; 97(18): 1354–1365.
38. Poirier MC, Reed E, Litterst CL et al. Persistence of platinum-ammine-DNA adducts in gonads and kidneys of rats and multiple tissues from cancer patients. Cancer Re 1992; 52(1): 149–153.
39. Tothill P, Klys HS, Matheson LM et al. The long-term retention of platinum in human tissues following the administration of cisplatin or carboplatin for cancer chemotherapy. Eur J Cancer 1992; 28A(8–9): 1358–1361.
40. Gietema JA, Meinardi MT, Messerschmidt J et al. Circulating plasma platinum more than 10 years after cisplatin treatment for testicular cancer. Lancet 2000; 355(9209): 1075–1076.
41. Gerl A, Schierl R. Urinary excretion of platinum in chemotherapy-treated long-term survivors of testicular cancer. Acta Oncol 2000; 39(4): 519–522.
42. Brouwers EE, Huitema AD, Beijnen JH et al. Long-term platinum retention after treatment with cisplatin and oxaliplatin. BMC Clin Pharmacol 2008; 8 : 7.
43. Turlapaty PD, Altura BM. Magnesium deficiency produces spasms of coronary arteries: relationship to etiology of sudden death ischemic heart disease. Science 1980; 208(4440): 198–200.
44. Vogelzang NJ, Torkelson JL, Kennedy BJ. Hypomagnesemia, renal dysfunction, and Raynaud’s phenomenon in patients treated with cisplatin, vinblastine, and bleomycin. Cancer 1985; 56(12): 2765–2770.
45. Barbagallo M, Dominguez LJ, Galioto A et al. Role of magnesium in insulin action, diabetes and cardio-metabolic syndrome X. Mol Aspects Med 2003; 24(1-3): 39–52.
46. Shi Y, Inoue S, Shinozaki R et al. Release of cytokines from human umbilical vein endothelial cells treated with platinum compounds in vitro. Jpn J Cancer Res 1998; 89(7): 757–767.
47. Ramesh G, Reeves WB. TNF-alpha mediates chemokine and cytokine expression and renal injury in cisplatin nephrotoxicity. J Clin Invest 2002; 110(6): 835–842.
48. Davis CA, Nick HS, Agarwal A. Manganese superoxide dismutase attenuates cisplatin-induced renal injury: importance of superoxide. J Am Soc Nephrol 2001; 12(12): 2683–2690.
49. Nuver J, Smit AJ, Sleijfer DT et al. Microalbuminuria, decreased fibrinolysis, and inflammation as early signs of atherosclerosis in long-term survivors of disseminated testicular cancer. Eur J Cancer 2004; 40(5): 701–706.
50. Nuver J, Smit AJ, van der Meer J et al. Acute chemotherapy-induced cardiovascular changes in patients with testicular cancer. J Clin Oncol 2005; 23(36): 9130–9137.
51. Wethal T, Kjekshus J, Røislien J et al. Treatment-related differences in cardiovascular risk factors in long-term survivors of testicular cancer. J Cancer Surviv 2007; 1(1): 8–16.
52. Vaughn DJ, Palmer SC, Carver JR et al. Cardiovascular risk in long-term survivors of testicular cancer. Cancer 2008; 112(9): 1949–1953.
53. Dewit L, Anninga JK, Hoefnagel CA et al. Radiation injury in the human kidney: a prospective analysis using specific scintigraphic and biochemical endpoints. Int J Radiat Oncol Biol Phys 1990; 19(4): 977–983.
54. Helgadottir A, Thorleifsson G, Magnusson KP et al. The same sequence variant on 9p21 associates with myocardial infarction, abdominal aortic aneurysm and intracranial aneurysm. Nat Genet 2008; 40(2): 217–224.
55. McPherson R, Pertsemlidis A, Kavaslar N et al. A common allele on chromosome 9 associated with coronary heart disease. Science 2007; 316(5830): 1488–1491.
56. Wellcome Trust Case Control Consortium. Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature 2007; 447(7145): 661–678.
57. Samani NJ, Erdmann J, Hall AS et al. WTCCC and the Cardiogenics Consortium. Genomewide association analysis of coronary artery disease. N Engl J Med 2007; 357(5): 443–453.
58. Mladosievičová B, Foltinová A. Genetické polymorfizmy – perspektívy predikcie toxicity cytostatík. In: Mladosievičová B, Kaiserová E, Foltinová A (eds). Možné neskoré následky protinádorovej liečby v detstve. 1. vyd. Bratislava: SAP 2007 : 157–158.
59. Oldenburg J, Kraggerud SM, Brydøy M et al. Association between long-term neuro-toxicities in testicular cancer survivors and polymorphisms in glutathione-s-transferase-P1 and -M1, a retrospective cross sectional study. J Transl Med 2007; 5(70): 70.
60. Oldenburg J, Kraggerud SM, Cvancarova M et al. Cisplatin-induced long-term hearing impairment is associated with specific glutathione s-transferase genotypes in testicular cancer survivors. J Clin Oncol 2007; 25(6): 708–714.
61. Nuver J, Lutke Holzik MF, van Zweeden M et al. Genetic variation in the bleomycin hydrolase gene and bleomycin-induced pulmonary toxicity in germ cell cancer patients. Pharmacogenet Genomics 2005; 15(6): 399–405.
62. Riedemann L, Lanvers C, Deuster D et al. Megalin genetic polymorphisms and individual sensitivity to the ototoxic effect of cisplatin. Pharmacogenomics J 2008; 8(1): 23–28.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Když se ve střevech děje něco nepatřičného...
- Nejasný stín na plicích – kazuistika
-
Všetky články tohto čísla
- Ischemická choroba srdca a hypertenzia ako neskoré následky liečby nádorov testis – prehľad
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Editorial
- Algoritmus separace plazmatických buněk ze vzorků kostní dřeně
- Antineoplastické účinky simvastatínu u experimentálnej rakoviny prsníka
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
- Vulvárna intraepiteliálna neoplázia
- Vývoj nových léčiv u solidních nádorů – změna pohledu na optimální design klinických studií
- Postavení Avastinu v léčbě karcinomu prsu v Evropě a v USA
- V Brně vzniká špičkové centrum pro výzkum nádorových onemocnění díky podpoře z evropských fondů
- XVIII. Fórum onkologů – zpráva z jednání v Brně dne 5. 11. 2010
- Best of ASCO® Czech Republic 2011
- Zápis ze schůze výboru České onkologické společnosti dne 21. 12. 2010 ve VFN Praha
- Zápis ze schůze výboru České onkologické společnosti dne 18. 1. 2011 ve FNB Praha
- Tematický seznam publikací vydaných v Klinické onkologii v roce 2009 a 2010
- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vulvárna intraepiteliálna neoplázia
- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





